Terug naar het richtlijnenoverzicht
Het folliculair lymfoom (FL) is na het diffuus grootcellig B cel lymfoom (DLBCL) het meest voorkomende non Hodgkin lymfoom (NHL) in West-Europa. De incidentie is over de afgelopen decaden toegenomen, en FL wordt in Nederland nu jaarlijks bij circa 600 personen vastgesteld (IKNL). Nauwkeuriger classificatie en toegenomen behandelingsmogelijkheden hebben ertoe bijgedragen dat de overleving in de afgelopen jaren sterk is verbeterd. Vooral de introductie van de anti-CD20 antistof rituximab heeft hierin een belangrijke rol gespeeld. De mediane overleving bedraagt momenteel meer dan 10 jaar (Tan et al., Blood 2013)
Het FL vindt zijn oorsprong in B lymfocyten in het kiemcentrum, en wordt biologisch gekenmerkt door de t(14;18)(q32;q21) translocatie. Deze translocatie leidt tot constitutieve over -xpressie van het anti-apoptotische eiwit BCL-2, waardoor de cel relatief ongevoelig wordt voor celdood (en daarmee voor behandeling met chemotherapie). Bij nagenoeg alle patiënten worden additionele cytogenetische en/of moleculaire afwijkingen gevonden (bijv. in MLL2, EPHA7, TNFRSF14, BCL6 en EZH2), maar de de rol van deze afwijkingen in de pathogenese van FL is nog grotendeels onbekend (Kridel et al., J Clin Invest 2012). Daarnaast is het in de afgelopen jaren steeds duidelijker geworden dat de tumorcellen samen met een heterogene populatie van omliggende cellen (macrofagen, folliculair dendritische cellen, endotheliale cellen en T lymfocyten) een specifiek micromilieu vormen waarin bidirectionele interacties plaatsvinden (Stevenson et al., Blood 2012).
Het FL presenteert zich voornamelijk met gegeneraliseerde lymfadenopathie. Bij bijna de helft van de patiënten is het beenmerg ook aangedaan. Bij slechts een kleine minderheid van de patiënten is er sprake van lokaal beperkte ziekte. Een initieel asymptomatisch beloop is niet ongewoon. De ziekte wordt dan ook vaak bij toeval ontdekt. Andere patiënten presenteren zich met uitgesproken progressieve lymfadenopathieen/ of B symptomen.
Bij het grootste deel van de patiënten wordt bij pathologisch onderzoek het typerende folliculaire groeipatroon gezien, maar er bestaat een sterk wisselende groeiwijze, waarbij sommige lymfomen slechts enkele follikels laten zien en in zeldzame gevallen het beeld volledig diffuus is (diffuus folliculair lymfoom). Ongeveer 30-40% van de FL toont in de loop van de tijd transformatie naar een agressiever lymfoom, meestal naar een DLBCL of hooggradig B-cel lymfoom met of zonder additionele MYC translocatie. Omdat een dergelijke transformatie focaal optreedt, kan er sprake zijn vaneen zogenaamd discordant lymfoom, waarbij in het beenmerg of op andere lymfoomlokalisaties nog de indolente component van het lymfoom kan worden aangetroffen.
Het FL reageert doorgaans goed op behandeling, maar recidiveert in de regel vroeg of laat altijd. De responsduur op opeenvolgende lijnen is over het algemeen steeds korter en een groot deel van de patiënten overlijdt uiteindelijk toch aan de ziekte. Nieuwe behandelstrategieën zijn dan ook onverkort nodig.
Nieuwe inzichten in de pathobiologie van de ziekte, en vooral in de rol van het micromilieu hierin, hebbengeresulteerd in een heel arsenaal aan nieuwe middelen welke zich in verschillende stadia van ontwikkeling bevinden. Voorbeelden hiervan zijn nieuwe antistoffen, immuunconjugaten en immuunmodulerende middelen (zoals proteasoomremmers, remmers van de B celreceptor-signalering en immuuncheckpoint remmers). Totdat er voldoende gegevens zijn over de effectiviteit, en veiligheid, zijn deze middelen nog maar beperkt inzetbaar bij het FL. Daarnaast zijn de kosten van deze nieuwe middelen, voor zover geregistreerd en beschikbaar, hoog. Dit maakt dat de plaats van deze middelen in de behandeling van FL zorgvuldig moet worden bepaald.
Een veelbelovende ontwikkeling in de behandeling van B cel maligniteiten is de toepassing van ‘chimeric antigen receptor’ (CAR) T cellen. Ook de plaats van deze therapievorm zal in de komende jaren vastgesteld moeten worden.
Referenties
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van het FL bij volwassenen. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een FL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, en tracht een betere uniformiteit van behandeling en daarmee een betere kwaliteit van zorg en uiteindelijk betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij, het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een FL, zoals internist-hematologen, internist-oncologen, radiotherapeuten en algemeen internisten, maar ook pathologen, radiologen, maag-darm-leverartsen, chirurgen oncologieverpleegkundigen, IKNL-consulenten etc.
Voor de herziening van de richtlijn is in 2023 een werkgroep ingesteld. De werkgroep leden zijn door HOVON of de betrokken wetenschappelijke verenigingen gemandateerd voor deelname. De werkgroep werkte gedurende zes maanden aan de herziening van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn en bestond uit:
De werkgroepleden (en overige betrokkenen) hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. De belangenverklaringen kunt u bij het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
Methode ontwikkeling:
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht door de werkgroepleden.In een aantal gevallen is afgezien van een systematische search met als mogelijke redenen: het ontbreken van voldoende gepubliceerde studies, de beschikbaarheid van recente internationale evidence-based richtlijnen of systematische reviews. Voor deze revisie zijn voor de uitgangsvragen uit de vorige versie van de richtlijn (2019) alle gepubliceerde data beoordeeld en zijn de aanbevelingen aangepast indien relevant (zie ook verantwoording versie 2017 en 2019).
De uitgangsvragen 5 (lenalidomide), 7 (ibrutinib), 8 (bispecifieke antistoffen) en 9 (CAR-T cellen) zijn nieuw in deze richtlijn. Voor de formulering van de aanbevelingen zijn de richtlijnen van de ESMO en NCCN geraadpleegd, en is alle gepubliceerde literatuur beoordeeld. Vanwege het beperkte aantal publicaties is voor deze vragen geen systematische review verricht.
Werkwijze:
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline en Cochrane.Aanvullend werd gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs.
Kwaliteitsindicatoren
1. Kwaliteitsindicator diagnostisch proces
Bij stadiëring van het FL wordt beeldonderzoek middels een (diagnostische) CT-scan, eventueel in combinatie met een FDG-PET-scan, verricht.
2. Kwaliteitsindicator behandeling
De systemische behandeling van FL in de eerste lijn bevat tenminste een CD20 antistof.
De conceptrichtlijn is op 27 juli 2023 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Eén respondent maakte van deze mogelijkheid gebruik. Alle commentaren werden vervolgens beoordeeld en eventueel verwerkt door de werkgroep.
Patiënten hebben de mogelijkheid gehad commentaar te geven op de concept richtlijn. In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon: Dhr. S. Hartjes (Commissie Belangenbehartiging)
Voorafgaande aan de ontwikkeling (en ook bij revisie van) van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals. Patiënten (vertegenwoordigers) hebben de conceptversie van de richtlijn gelezen en commentaar kunnen aanleveren. De meest relevante knelpunten worden uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een folliculair lymfoom. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. De richtlijn beoogt derhalve niet een volledig leerboek te zijn.
Hieronder vindt u een samenvatting van de aanbevelingen (n.a.v. de vooraf vastgestelde uitgangsvragen) per hoofdstuk. Verdere adviezen t.a.v. diagnostiek, prognosticering, behandeling, respons evaluatie en follow-up zijn weergegeven in de betreffende hoofdstukken en paragrafen.
Diagnostiek
Aanbeveling(en):
Voor het stellen van de diagnose FL is een histologisch biopt noodzakelijk, ook voor juiste subtypering; bijvoorkeur een volledige lymfklier of extranodale afwijking óf een ruim incisie biopt van een lymfklier of extranodale lokalisatie.
Wanneer lymfklieren of extranodale afwijkingen niet bereikbaar zijn voor excisie- of incisiebiopten, wordenmeerdere echo- of CT-geleide dikke naald biopten, laparoscopische of endoscopische biopten geadviseerd.
Bij twijfel, of discrepantie tussen kliniek en histologische diagnose, verdient het de aanbeveling om een nieuw biopt te nemen of een lymfklier/ extranodale afwijking te extirperen, eventueel op geleide van een FDG-PET scan (meest FDG-avide laesies benaderen).
Aanbeveling(en):
Voor de stadiëring van het FL is minimaal diagnostische CT scan vereist (met i.v. contrast), met uitzondering van de volgende situaties:
Behandeling
Aanbeveling(en):
Vawege het ontbreken van curatieve behandelopties en de kans op spontane remissie, hoeft behandeling pas te worden gestart bij het ontstaan van symptomatische ziekte, zoals: B symptomen, snelle progressie (hoog LDH), hinderlijke (bulky) lymfadenopathie, klinisch relevante oorgaanbetrokkenheid of (dreigende) orgaancompressie, beenmergverdringing en ascites/ pleuravocht.
In afwezigheid van bovenstaande bevindingen wordt een afwachtend beleid aanbevolen.
Aanbeveling(en):
Voor symptomatisch FL is behandeling met R-CVP (8x) de eerste keuze.
Voor patiënten met een hoog risicoprofiel (bijv. FLIPI 3-5) of als snelle respons gewenst is, kunnen bendamustine i.c.m. rituximab (6x) en R-CHOP (6x) overwogen worden, waarbij het toxiciteitsprofiel van beide schema’s een belangrijke factor in de keuze is.
R-lenalidomide (+ R onderhoud) is, mits vergoed, een alternatief voor R-chemotherapie.
De keuze voor een van deze behandelschema’s dient het resultaat te zijn van ‘shared decision making’.
Aanbeveling(en):
R-lenalidomide kan toegepast worden in tweedelijns behandeling en verder, vooral bij recidief na eerdere Immunochemotherapie, of indien immunochemotherapie te toxisch wordt geacht.
Aanbeveling(en):
Idelalisib is geregistreerd voor en kan worden ingezet bij FL refractair op (meer dan) 2 eerdere therapielijnen.
Vanwege de toxiciteit en beschikbare alternatieven (binnen en buiten studie) hebben PI3-kinase slechts bescheiden plaats in de behandeling van FL.
Aanbeveling(en):
Ibrutinib kan worden ingezet vanaf de tweede lijn voor patiënten die te unfit/ frail zijn voor intensievere therapieën gezien het relatief gunstige bijwerkingsprofiel, of in patiënten die recidiveren op meerdere andere behandellijnen (bijv. als brug naar T cel gemedieerde immuuntherapie als CAR T cellen of alloSCT), mits vergoed.
Aanbeveling(en):
Bispecifieke antistoffen zijn geïndiceerd als behandeling van R/R FL in de derde lijn en verder, vooral voor patiënten met ‘hoog risico’ factoren zoals eerdere POD24 en dubbelrefractoriteit (anti-CD20 antistof en alkylerende therapie), mits vergoed.
Aanbeveling(en):
CAR T cel therapie is geïndiceerd als behandeling van R/R FL in de derde lijn en verder, vooral voor patiënten met ‘hoog risico’ factoren zoals eerdere POD24 en dubbelrefractoriteit (anti-CD20 antistof en alkylerende therapie), mits vergoed.
Aanbeveling(en):
11. Wat zijn de indicaties voor autologe stamceltransplantatie in FL?
Aanbeveling(en):
Het indicatiegebied van autologe stamceltransplantatie binnen de behandeling van FL is beperkt.
Hoge dosis chemotherapie + autologe stamceltransplantatie dient overwogen te worden bij gerecidiveerd FL, vooral na reïnductie behandeling van een recidief dat binnen 2 jaar na immunochemotherapie (minimaal R-CVP) is opgetreden.
De optimale timing van autologe stamceltransplantatie is na/ ter consolidatie van het eerste of tweede recidief, omdat het voordeel, vooral m.b.t. PFS, afneemt na 3 of meer eerdere behandelingen.
Verdere argumenten voor autologe stamceltransplantatie:
12. Wat zijn de indicaties voor allogene stamceltransplantatie in FL?
Aanbeveling(en):
Het indicatiegebied van allogene stamceltransplantatie binnen de behandeling van FL is beperkt.
Allogene stamceltransplantatie kan in de behandeling van FL worden toegepast na meerdere (2x of meer) recidieven, vooral deze zich voor doen binnen 2 jaar na immunochemotherapie.
Argumenten voor allogene stamceltransplantatie:
Aanbeveling(en):
In eerstelijns behandelschema’s is het vervangen van rituximab door obinutuzumab niet standaard aanbevolen.
Voor rituximab refractaire patiënten is obinutuzumab i.c.m. bendamustine gevolgd door obinutuzumab onderhoudsbehandeling geïndiceerd, vooral wanneer rituximab gegeven werd in combinatie met chemotherapie.
Aanbeveling(en):
Autologe stamceltransplantatie dient te worden toegepast na succesvolle inductie bij alle patiënten met tFL die in het verleden al voorbehandeling hebben gehad voor het FL.
Autologe stamceltransplantatie kan bij patiënten zonder eerdere voorbehandeling voor het FL ook overwogen worden; vooral als geen rituximab kan worden gegeven, of bij patiënten die refractair zijn op inductie therapie voor tFL (maar wel gerespondeerd hebben op salvage behandeling).
Autologe stamceltransplantatie kan in de tweede lijn van de behandeling van tFL worden toegepast als de patiënt recidiveert en eerder geen autologe stamceltransplantatie heeft ondergaan.
Aanbeveling(en):
Er is geen rol voor allogene stamceltransplantatie als consolidatie na inductie in eerste lijn.
Allogene stamceltransplantatie kan worden toegepast bij tFL dat recidiveert na eerdere autologe stamceltransplantatie.
Respons evaluatie
Aanbeveling(en):
Een FDG-PET-CT is aanbevolen voor respons evaluatie mits er consequenties aan worden verbonden voor het beleid (er dient in dat geval bij voorkeur een uitgangs FDG-PET scan beschikbaar te zijn).
Er is geen plaats voor de FDG-PET scan in de interim respons-evaluatie.
De behoefte aan uniform beleid in Nederland, de snelle ontwikkelingen in diagnostiek en behandelingsmogelijkheden, de stijgende kosten van de behandeling (vooral van de ‘nieuwe middelen’) en de betrokkenheid van diverse disciplines bij de behandeling, maken een breed gedragen richtlijn noodzakelijk.
Bovengenoemde overwegingen waren voor de lymfoomwerkgroep aanleiding een ‘evidence based’ richtlijn te ontwikkelen voor het beleid bij het folliculaire lymfoom.
In 2019 en 2023 zijn, naar aanleiding van nieuwe inzichten en het beschikbaar komen van nieuwe middelen, een aantal items toegevoegd, en zijn enkele aanbevelingen aangepast.
De diagnostiek bij FL bestaat uit het pathologisch onderzoek dat benodigd is om de diagnose te stellen, en uit onderzoek om de uitgebreidheid van de ziekte in kaart te brengen (stadiëring, tabel 1).
Tabel 1. Aanbevolen onderzoek diagnose en stadiëring
|
Anamnese |
B-symptomen* |
|
Lichamelijk onderzoek |
Algemeen lichamelijk onderzoek Performance status, lymfeklieren, lever, milt, en extranodale ziektelokalisaties |
|
Primaire diagnostiek |
Histologisch (excisie) biopt lymfklier voor morfologie en immuunhistochemie (op indicatie: moleculaire diagnostiek)
|
|
Laboratorium |
Bloedbeeld en differentiatie, evt. immunofenotypering Kreatinine, leverenzymen, urinezuur, LDH; evt. IgA, IgG, IgM, M-proteine, ß2M Op indicatie: zwangerschapstest Serologie: Hepatitis B,C; op indicatie HIV |
|
Stadiëring |
Beeldvorming
Beenmergonderzoek (indien therapeutische consequenties)
|
|
Toxiciteit |
ECG, echocardiografie/ejectiefractie (voorafgaand aan anthracyclines, stamceltransplantatie) Op indicatie: counseling fertiliteit** |
* B symptomen: onverklaarde koorts > 38oC, gewichtsverlies >10% in 6 maanden, nachtzweten
** zie ook: https://www.oncoline.nl/fertiliteitsbehoud-bij-vrouwen-met-kanker
De primaire diagnostiek omvat het onderzoek dat nodig is om de diagnose FL te stellen en andere lymfoomtypen uit te sluiten. Dit onderzoek omvat, volgens de systematiek van de WHO classificatie, histologisch onderzoek, immuunfenotypering/ immuunhistochemie en, waar relevant, moleculair/ cytogenetisch onderzoek.
Recent is er een nieuwe editie van de WHO classificatie uitgegeven (WHO Classification of Tumours, Haematolymphoid tumours., IARC 2022). met veranderingen in de classificatie van het FL. De zeer specifieke klinisch-pathologische varianten (paediatric-type FL, in situ Folliculair B cel neoplasm, duodenal-type FL) zijn vrijwel ongewijzigd. De rest van de FL wordt vanaf heden onderverdeeld in vier subcategorieën.
Histologie (uitgangsvraag 1)
Uitgangsvraag:
Is voor het stellen van de diagnose FL een histologisch biopt noodzakelijk?
Aanbeveling(en):
Voor het stellen van de diagnose FL is een histologisch biopt noodzakelijk, ook voor juiste subtypering; bij voorkeur een volledige lymfklier of extranodale afwijking óf een ruim incisie biopt van een lymfklier of extranodale lokalisatie.
Wanneer lymfklieren of extranodale afwijkingen niet bereikbaar zijn voor excisie- of incisiebiopten, worden meerdere echo- of CT-geleide dikke naald biopten, laparoscopische of endoscopische biopten geadviseerd.
Bij twijfel, of discrepantie tussen kliniek en histologische diagnose, verdient het de aanbeveling om een nieuw biopt te nemen of een lymfklier/ extranodale afwijking te extirperen, eventueel op geleide van een FDG-PET scan (meest FDG-avide laesies benaderen).
Inleiding:
Hoewel lymfoomcellen kunnen worden aangetoond in cytologische puncties, en bepaalde eigenschappen m.b.v. flowcytometrie bevestigd kunnen worden, is histologie van essentiëel belang voor het stellen van een classificerende diagnose. Vanwege de logistieke implicaties en kans op per- en postoperatieve complicaties, bestaat er vaak terughoudendheid bij de betrokkenen (hematoloog, chirurg en patiënt), en rijst de vraag of puncties of naaldbiopten niet volstaan.
Conclusie(s):
|
SORT grade |
Conclusie |
|
C |
Voor het stellen van de diagnose FL is een histologisch biopt noodzakelijk (expert opinion/ consensus) |
|
C |
Dikke naald biopten zijn een redelijk alternatief als lymfklierextirpatie of incisiebiopten niet mogelijk zijn (expert opinion/ consensus) |
Samenvatting literatuur:
Resultaten
Recente richtlijnen van de ‘European Society of Medical Oncology’ (ESMO) en de ‘National Comprehensive Cancer Network’ (NCCN) (Dreyling et al., Ann Oncol 2021; NCCN 2021) als ook de WHO 2022 onderschrijven het belang van een histologisch biopt voor de diagnose FL.
Uit retrospectieve analyses is gebleken dat cytologische puncties (maar ook naaldbiopten) bij een derde tot drie kwart van de patiënten gevolgd moeten worden door een excisiebiopt om een lymfoom te kunnen diagnosticeren en classificeren (Hehn et al., J Clin Oncol 2004; Frederiksen et al., Arch Pathol Lab Med 2015).
De WHO classificatie 2022 geeft expliciet aanwijzingen hoe om te gaan met naaldbiopten. Als hierin een klassiek FL zonder folliculaire structuren aanwezig is wordt geadviseerd om dit ‘FL, waarschijnlijk klassiek’ te noemen. ‘FL met voornamelijk diffuse groeiwijze’ mag alleen op een lymfklierincisie of -excisiebiopt gesteld worden. Dat geldt in principe ook voor ‘folliculair grootcellig B cel lymfoom’, alhoewel deze diagnose op een naaldbiopt voldoende reden is om het proces als een diffuus grootcellig B cel lymfoom te behandelen.
Gezien de mogelijkheid van onvoldoende representativiteit adviseert de WHO 2022 om in dergelijke situaties in multidisciplinair overleg te bespreken, met name om een goede correlatie met beeldvorming/FDG-PET scan te realiseren. Elk klassiek FL met agressieve klinische kenmerken en klassiek FL op naaldbiopt waarbij er buiten follikels veel blasten zijn vallen hieronder. Ook ‘FL met ongebruikelijke cytologische kenmerken’ verdient aandacht in een multidisciplinaire bespreking.
Indien er getwijfeld wordt of er sprake zou kunnen zijn van een lymfoom of een (gemetastaseerde) solide tumor, kan een cytologische punctie gebruikt worden om richting te geven aan de verdere diagnostiek, vooral in het hoofd-halsgebied (Saika et al., Diagn Cytopathol 2002; Florentine et al., Cancer 2006). Als o.b.v. de cytologie een lymfoom waarschijnlijk is dient alsnog histologie verkregen te worden.
Referenties
Bewijskracht van de literatuur Level 3; consistent
Overwegingen:
De diagnostiek en classificatie van maligne lymfomen, waaronder FL, vereisen een ruim histologisch biopt. Cytologische puncties of naaldbiopten zijn in nagenoeg alle gevallen onvoldoende representatief en informatief om een diagnose te kunnen stellen; dit geldt a fortiori voor de diagnose FL ten opzichte van andere klassen van indolente B cel lymfomen en reactieve lymfklierproliferaties. Vanwege onvoldoende representativiteit kan concordante transformatie naar een agressieve fase vaak onvoldoende uitgesloten worden. Een initieel naaldbiopt in een poging om tot een diagnose te komen, leidt heel vaak alsnog tot de noodzaak een excisiebiopt te verrichten en dus tot onnodige vertraging in de diagnostiek.
Pathologen ontvangen in toenemende mate dikke naaldbiopten (14, 16G) van lymfklieren en extranodale afwijkingen in plaats van hele excisies voor primaire diagnostiek. Dit blijkt ook heel duidelijk uit gegevens van opeenvolgende HOVON trials (HO75, HO84, HO110, HO130) en betreft zeker niet alleen biopten bij diep gelegen lokalisaties of oudere patiënten. Deze geleidelijke wijziging van beleid lijkt veeleer ingegeven door logistieke problemen (en toenemende terughoudendheid bij de betrokkenen) binnen ziekenhuizen. Daarnaast wordt het bij inclusie in trials steeds meer verplicht gesteld om zeer ruim materiaal beschikbaar te stellen voor onderzoek door de sponsor.
De werkgroep is, conform de aanbevelingen in internationale richtlijnen, van mening dat aangezien dikke naaldbiopten dikwijls tot onnodige vertraging in het diagnostisch proces (en tot extra ingrepen) leiden, de stap van het naaldbiopt waar mogelijk moet worden overgeslagen en in alle gevallen gestreefd moet worden naar een lymfklierexcisie of ruim incisiebiopt. In gevallen waarin differentiaal diagnostisch hoge verdenking bestaat op een niet-hematologische maligniteit (metastase carcinoom, melanoom) is een initiële cytologische punctie te verdedigen.
Morfologie en immuunfenotypering
De diagnose FL wordt gesteld volgens de criteria van de geldende WHO classificatie op basis van karakteristieken van architectuur, celtype en immunofenotype, zie hiervoor de ‘WHO classification of tumours of haematopoietic and lymphoid tissues’ (WHO Classification of Tumours, Haematolymphoid tumours., IARC 2022).
Voor het stellen van een primaire diagnose FL, en het uitsluiten van andere lymfoomtypen, moet volledig immunohistochemisch onderzoek verricht worden met ten minste de volgende markers: CD20, CD10 en/of BCL6, BCL2 en CD3. Het verdient aanbeveling een gestandaardiseerd panel van markers te gebruiken, zodat hiermee ruime ervaring opgebouwd kan worden. Afhankelijk van de specifieke differentiaal diagnose (bv. nodaal marginale zone lymfoom en grootcellig B cel lymfoom met IRF4 rearrangement) moet een uitgebreider panel van markers gebruikt worden.
Het minimale flowcytometrie panel dat geadviseerd is bij verdenking B-NHL/FL is: CD45, CD19. CD20, CD23, CD38, CD10, CD5, CD103, sIgkappa en sIglambda; en als additionele markers: FMC7, CD22, CD79ben CD43 (zie richtlijnen op www.cytometrie.nl, minimale panels).
In geval van een FL zullen de volgende makers meestal positief zijn: CD45, CD19 (vaak zwak), CD20, CD10, CD38, sIgkappa of lambda restrictie, FMC7, CD22 en CD79b.
Referenties
WHO Classification of Tumours Editorial Board. Haematolymphoid tumours. Lyon (France): International Agency for Research on Cancer; forthcoming. (WHO classification of tumours series, 5th ed.; vol. 11). https://publications.iarc.fr.
Moleculaire diagnostiek
Translocatie onderzoek m.b.v. FISH en moleculaire diagnostiek naar BCL-2 translocaties wordt op indicatie verricht in differentiaal diagnostisch moeilijke situaties.
Bij 90% van het klassieke FL wordt een t(14;18)(q32;q21) translocatie gevonden, waardoor het BCL-2 oncogen gekoppeld is aan het locus van de immuunglobuline zware keten, hetgeen leidt tot overexpressie van het anti-apoptotische eiwit BCL-2. Veel zeldzamer, maar biologisch equivalent, zijn translocaties tussen 18q21 en de loci van de immuunglobuline lichte ketens (t(2;18)(p11;q21) en t(18;22)(q21;q21)) (Bloomfield et al., Cancer Res 1983). Specifieke subtypes en varianten van FL kunnen een andere genetische context hebben, waarin BCL-2 translocaties geen rol spelen (bijv. de novo FLBL, voorheen FL graad 3B (Bosga-Brouwer et al., Blood 2003). Ook in het ‘FL met voornamelijk diffuus groeipatroon’ wordt geen BCL-2 translocatie gevonden.
BCL-2 translocaties zijn niet specifiek voor FL. De translocatie kan ook worden gevonden in circa 30% van de DLBCLs (Ngan et al., N Eng J Med 1988).
Met meer geavanceerde moleculaire onderzoekstechnieken zoals ‘next generation sequencing sequencing’ (NGS) zijn er aantal terugkerende mutaties in FL gevonden. Sommige van deze mutaties zijn zeer frequent (bijv. CREBBP, KMTD2), terwijl andere minder frequent voorkomen en mogelijk gerelateerd zijn aan progressie (Green et al. Blood 2013; Okosun et al., Nature genetics 2014; Pasquaucci et al., Cell reports 2014). Van deze mutaties is de rol in de pathobiologie van FL en de prognostische betekenis nog grotendeels onbekend en bepaling hiervan heeft dan dan ook nog geen standaard plaats in de praktijk.
Referenties
Met transformatie van FL wordt de ontwikkeling van een agressief non Hodgkin lymfoom (meestal DLBCL) bij een patiënt met een (al eerder) vastgesteld FL aangegeven.
Bij het ontwikkelen van één of meer van de volgende symptomen moet aan transformatie van het FL worden gedacht:
De diagnose moet gesteld worden op basis van een histologisch biopt. Omdat niet alle lymfoomlokalisaties getransformeerd hoeven te zijn, is er kans op sampling error. De FDG-PET-scan kan hierbij behulpzaam zijn; het biopteren van de lymflier/ lokalisatie met hoogste FDG opname geeft de meeste kans op het aantonen van transformatie (expert opinion, Bodet-Millin et al., Haematologica 2008; Noy et al., Ann Oncol 2009; Wondergem et al., EJNMMI Research 2014). In een behoorlijk deel van de gevallen (25-40%) kan er met FISH een MYC translocatie gevonden worden.
Net als bij de primaire diagnose heeft het verwijderen van een gehele lymfklier/ extranodale lokalisatie of een ruim incisiebiopt de voorkeur. Indien de lokalisatie die de meeste FDG opname laat zien slecht bereikbaar is, kan eventueel getracht worden met (liefst meerdere) dikke naaldbiopten tot een diagnose te komen.
Referenties
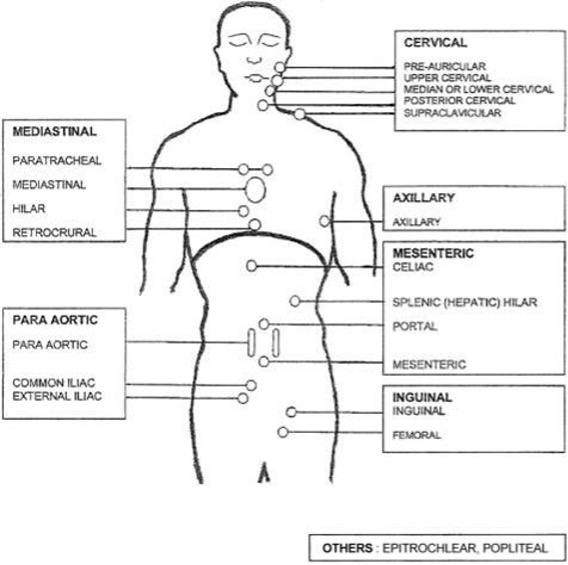
Het FL wordt gestadieerd volgens de Ann–Arbor classificatie (tabel 2 en figuur 1; Cheson et al., J Clin Oncol 2007).
Het beeldvormend onderzoek heeft tot doel de uitgebreidheid van de lymfadenopathie en eventuele orgaaninfiltratie vast te stellen. Om die reden is dan ook CT-onderzoek (diagnostische CT met i.v. en oraal contrast) aanbevolen (i.p.v. echografie of conventioneel röntgenonderzoek). Voor het vaststellen van de FLIPI risicoscore is ook het aantal aangedane lymfklierstations van belang (zie figuur 1). De overwegingen m.b.t. de FDG-PET scan zijn in de volgende paragraaf uitgewerkt. Beeldvormend onderzoek dient bij diagnose, maar zeker vóór en na afronding van de behandeling plaats te vinden.
Vóór behandeling dient ook beenmergonderzoek verricht te worden. Indien de CT scan al minimaal een stadium III laat zien, de patiënt asymptomatisch is en (nog) geen behandeling behoeft (en het perifere bloedbeeld geen beenmerg-verdringing suggereert), kan van beenmerg diagnostiek worden afgezien, aangezien de uitkomst ervan in die situatie geen consequenties heeft. In alle andere gevallen dient de CT scan aangevuld te worden met een beenmergbiopt en aspiraat met immunofenotypering d.m.v. immuno-histochemie (en/ of flowcytometrie). Aangezien FL vaak als wijd verspreid gelegen haardjes in het beenmerg aanwezig is, wordt 2 cm als optimale lengte van het beenmergbiopt aanbevolen. In deze gevallen kan het aspiraat vals-negatief zijn doordat de lymfoomcellen in de fibrotische haardjes achterblijven.
Indien sprake lijkt te zijn van stadium I of II ziekte, dan is een aanvullende FDG-PET-scan noodzakelijk om het stadium definitief te bepalen en de uitgebreidheid van de radiotherapie velden te bepalen.
Tabel 2. Ann Arbor stadiëring
|
Stadium |
Definitie |
|
I (IE) |
Eén lymfeklier of één extranodale lokalisatie |
|
II (IIE) |
Twee of meer lymfeklierstations aan dezelfde zijde van het diafragma met eventueel een gelokaliseerde extralymfatische lokalisatie of ingroei in omliggende weefsel vanuit deze lymfklierstations |
|
III (IIIS) |
Twee of meer lymfklieren aan beide zijden van het diafragma met eventueel een gelokaliseerde extralymfatische lokalisatie of ingroei in omliggende weefsel vanuit deze lymfeklierstations, miltaantasting of beide |
|
IV |
Diffuse aantasting van een orgaan of meerdere extralymfatische lokalisaties met of zonder lymfeklierlokalisaties |
|
Voor alle stadia |
|
Figuur 1. Lymfklierstations t.b.v. Ann Arbor stadiëring en FLIPI score
Referentie
Indicaties FDG-PET (uitgangsvraag 2)
Uitgangsvraag:
Is voor de stadiëring van FL een FDG-PET scan noodzakelijk?
Aanbeveling(en):
Voor de stadiëring van het FL is minimaal diagnostische CT scan vereist (met i.v. contrast), met uitzondering van de volgende situaties:
Inleiding:
Met behulp van een FDG-PET-CT scan kan de uitgebreidheid van de ziekte nauwkeuriger worden vastgelegd. De vraag is echter of het grotere onderscheidend vermogen van de FDG-PET-scan, in vergelijking met conventioneel CT onderzoek, klinisch van significant toegevoegde waarde is.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
FDG-PET data bij diagnose zijn voorspellend voor zowel PFS als OS (Meignan et al., J Clin Oncol 2016; Batlevi et al., Eur J Cancer 2020) |
|
B |
FDG-PET is sensitiever dan CT alleen bij vaststellen van stadium I-II ziekte; en leidt to betere uitkomst van curatieve radiotherapie (Metser et al., Cancer 2017; Brady et al., Blood 2019) |
|
B |
FDG-PET bij vermoeden op transformatie (Bodet-Millin et al., Haematologica 2008; Noy et al., Ann Oncol 2009; Wondergem et al., EJNMMI Research 2014) |
Samenvatting literatuur:
Resultaten
In de richtlijn van de ESMO wordt routinematig gebruik van de FDG-PET-CT scan voor start van de behandeling aanbevolen (ook bij de hogere stadia) omdat deze de nauwkeurigheid van stadiëring verbetert. Er is echter weinig onderbouwing voor deze aanbeveling en de graad van de aanbeveling is zwak (Dreyling et al., Ann Oncol 2021). In de Lugano classificatie 2014 wordt voorkeur gegeven aan een FDG-PET-CT scan voor de stadiëring van alle FDG-avide lymfomen (waaronder FL). Ook hier wordt beredeneerd dat een FDG-PET-CT scan de nauwkeurigheid van de stadiëring verbetert. Het betreft hier een aanbeveling gebaseerd op consensus (Cheson et al., J Clin Oncol 2014). Recente literatuur toont dat FDG PET-CT scans bij initiële stadiering van patiënten met FL verband houdt met een betere PFS en OS. Dit betreft echter voornamelijk retrospectieve data.
Een studie met 185 patiënten, uit 3 studies (PRIMA (n=38), PET-FOL (n=106) en FOLL05 (n=41)) samengenomen, laat zien dat het ‘baseline metabolic tumor volume’ een voorspeller is voor progressie vrije overleving en overall survival. In deze studies zijn de patiënten echter met verschillende regimes behandeld (R-CHOP (n=1184) R-CVP (n=450) R-FM (n=178) of R-FCM (n=45)), en is maar van 10% van alle geincludeerde patiënten een baseline FDG-PET-scan beschikbaar. De reden voor de FDG-PET-scan bij deze 185 patienten is niet bekend (Meignan et al., J Clin Oncol 2016).
Ook liet een retrospectieve cohort studie een overlevigsvoordeel zien bij patiënten met snelle ziekteprogressie (POD24) die initieel gestadieerd waren met FDG-PET versus alleen met CT, waarschijnlijk grotendeels bepaald doordat met de FDG-PET eventuele transformatie al vóórstart van de behandeling werd vastgesteld (Batlevi et al., Eur J Cancer 2020).
De waarde van de FDG-PET scan bij patiënten met stadium I-II ziekte die in aanmerking komen voor curatieve radiotherapie, is evident. In een recente prospectieve studie in 197 patiënten met een indolent lymfoom, werd bij 47 patiënten die op grond van een CT scan stadium I-II ziekte hadden, op grond van de FDG-PET-CT toch meer uitgebreide stadium III-IV ziekte vastgesteld. Daarentegen bleek bij 4 patiënten bij wie aanvankelijk stadium III-IV ziekte was vastgesteld, uiteindelijk sprake van stadium I-II ziekte (Metser et al., Cancer 2017; Brady et al, Blood 2019). Een retrospectieve analyse uitgevoerd door de ILROG toonde dat de PFS na in opzet curatieve radiotherapie in FDG-PET gestadieerde patiënten hoger was dan eerder geraporteerde percentages (Brady et al., Blood 2019).
Bij vermoeden op transformatie geeft het biopteren van de lymflier/ lokalisatie met hoogste FDG opname de meeste kans op het aantonen van transformatie (expert opinion, Bodet-Millin et al., Haematologica 2008; Noy et al., Ann Oncol 2009; Wondergem et al., EJNMMI Research 2014).
Referenties
Bewijskracht van de literatuur level 2, consistentie n.v.t.
Overwegingen:
In de literatuur worden wisselende aanbevelingen gegeven over de plaats van de FDG-PET-CT scan in de stadiëring van het FL. Het betreft hier in alle gevallen aanbevelingen o.b.v. consensus met een beperkte bewijskracht. De werkgroep is van mening dat er momenteel te weinig bewijs is voor het routinematig toepassen van een FDG-PET scan bij diagnose, of voor start van een behandeling wanneer therapeutische consequenties ontbreken. In de afwezigheid van directe implicaties (m.b.t. beleidskeuzes) wegen de ‘kosten’ (m.b.t. de belasting voor de patiënt, hogere kosten en beslag op de planning) niet op tegen de ‘baten’.
Er bestaat daarom geen twijfel over de toegevoegde waarde van de FDG-PET scan bij het bevestigen van beperkte stadium I/II ziekte, en bij het vermoeden van transformatie om de plaats van het biopt te bepalen.
Voor iedere patiënt dient de initiële diagnostiek inclusief de beeldvorming besproken te worden, en het therapie plan geformuleerd te worden in een multidisciplinair overleg (MDO), waarbij minimaal aanwezig: hematoloog/oncoloog, patholoog met hematologische expertise, radioloog (met nucleair geneeskundige expertise indien van toepassing) of nucleair geneeskundige met radiologie expertise, en een radiotherapeut (indien van toepassing). De werkgroep is van mening dat de patiënt steeds opnieuw ingebracht moet worden in het MDO op het moment dat er een (nieuwe) behandelindicatie ontstaat.
Om een inschatting te maken van de prognose van FL wordt de FLIPI score gebruikt (Follicular Lymphoma International Prognostic Index, tabel 3; Solal-Celigny et al,Blood 2004). Hoewel deze index werd ontwikkeld op een cohort patiënten dat niet met rituximab werd behandeld, is inmiddels duidelijk geworden dat deze ook in het ‘rituximab tijdperk’ nog onderscheidend is (Buske et al., Blood 2006; Marcus et al., J Clin Oncol 2008).
Tabel 3. FLIPI
|
Prognostische factor |
Aantal punten |
|
Leeftijd > 60 jaar |
1 |
|
Stadium III/IV |
1 |
|
Aantal klierstations > 4* |
1 |
|
LDH > ULN |
1 |
|
Hb < 7.5 mmol/l |
1 |
* De volgende klierstations worden onderscheiden: cervicaal, axillair, mediastinaal/hilair/retrocruraal; paraaortaal/parailiacaal; coeliacus/mesenteriaal; inguinaal/femoraal; epitrochleair; popliteaal (zie ook figuur 1, stadiëring).
|
Risico groep |
Aantal factoren |
% patiënten |
|
Laag |
0-1 |
36 |
|
Intermediair |
2 |
37 |
|
Hoog |
3-5 |
27 |
Nieuwere risicoscores zoals de gereviseerde index (FLIPI2, gebaseerd op β2 microglobuline, de diameter van de grootste lymfeklier, beenmerginfiltratie en het hemoglobinegehalte), de PRIMA-PI (gebaseerd op β2 microglobuline en beenmerginfiltratie), en de recent gepubliceerde (Follicular Lymphoma Evaluation Index (FLEX; gebaseerd op geslacht, SPD, histologie gradatie, extra nodale betrokkenheid, ECOG, Hb, β2 microglobuline, natural killer cell count (NKCC) en LDH) hebben in de dagelijkse praktijk de ‘oude’ FLIPI score nog niet vervangen (Federico et al., J Clin Oncol 2009; Bachy et al., Blood 2018; Mir et al., Am J Hematol 2020).
Ook de gepubliceerde klinisch-genetische risico score die gebruik maakt van de mutatiestatus van zeven genen (M7-FLIPI; gebaseerd op FLIPI, ECOG, mutaties in EZH2, ARID1A, MEF2B, EP300, FOXO1, CREBBP and CARD11) of van een op RNA gebaseerd expressie profiel van 23 genen worden in de dagelijks praktijk niet gebruikt. (Pastore et al., Lancet oncol 2015; Huet et al. Lancet Oncol 2018), zeker omdat beide scores in andere cohorten niet gevalideerd konden worden. (Jurinovic et al., Blood 2019; Lockmer et al., Br J Haematol 2020; Bolen et al., Blood 2021)
POD24 en CR30
Naast de prognostische scores voor start van de behandeling, wordt de prognose ook bepaald door de duur van de initiële respons zoals early progression of disease (POD) binnen 24 maanden na start van chemo-immunotherapie (POD24; Casulo et al., Ann Oncol 2015, Sortais C et al. Ann Haematol 2020) of het bereiken en behouden van complete remissie met therapie na 30 maanden (CR30; Chi et al., JCO 2017). Deze eindpunten zijn sterk geassocieerd met progressie vrije overleving, en POD24 ook met inferieure overall survival. Patiënten met een POD24 hebben ook een hoog risico op transformatie (circa 50%; Yoon et al., J Cancer 2021). Er moet daarom bij een snel recidief (bv < 24 maanden) altijd een biopt overwogen en in een MDO besproken worden vanwege de therapeutische consequentie.
Referenties
Onderstaande aanbevelingen betreffen klassiek FL (graad 1-3A). Voor de behandeling van FLBL (voorheen graad 3B) wordt verwezen naar de DLBCL richtlijn, aangezien deze patiënten op dezelfde manier behandeld worden. Aan de behandeling van het getransformeerde FL is een aparte paragraaf gewijd.
Op het moment van inzetten van een behandeling zijn veel patiënten niet in staat om de mogelijke gevolgen hiervan te overzien. Men accepteert dat bestrijding van de ziekte nodig is en heeft het ‘noodzakelijk kwaad’ van de bijwerkingen te accepteren. Bijwerkingen op de langere termijn hebben grote invloed op de kwaliteit van leven. Het verdient daarom de aanbeveling de patiënt bij de start van iedere behandeling standaard te informeren over de meest voorkomende bijwerkingen en de mogelijkheid te bespreken om bepaalde middelen niet of in mindere mate in te zetten. Daarbij spelen onder andere de levensfase van de patiënt, de aard van het eventuele werk (handarbeider of hoofdarbeider) en de belangrijkste hobby’s (fysiek of mentaal georiënteerd) een rol.
Een minderheid van de patiënten (15-25%) presenteert zich met lokaal beperkte ziekte (stadium I en II gelokaliseerd en zonder grote tumormassa). Mogelijk is er in nagenoeg alle gevallen sprake is van, al dan niet klinisch waarneembare, gedissemineerde ziekte. Dit onderstreept de noodzaak van zeer nauwkeurige stadiering (inclusief FDG-PET-CT en beenmergonderzoek) bij vermoeden op stadium I-II ziekte.
De behandelingsopties voor het FL in de vroege stadia I-II en het in de hogere stadia III-IV worden separaat behandeld. Dit omdat het FL met beperkte ziektelast en -uitbreiding curatief behandeld kan worden. Indien er bij FL stadium II sprake is van meer dan twee aangrenzende lymfklier-regio’s of twee niet aangrenzende lymfklier-regio’s (of bijv. lokalisaties in beide oksels), is de kans op uitgebreidere ziekte groot en dient er behandeld te worden volgens de aanbevelingen voor de hogere stadia.
Stadium I-II
Tabel 4. Eerstelijns behandeling FL stadium I-II
|
Curatieve intentie |
|
|
Radiotherapie |
24 Gy (12×2 Gy) |
|
Geen curatieve intentie – asymptomatisch |
|
|
Watch & wait |
|
|
Geen curatieve intentie – symptomatisch |
|
|
Radiotherapie |
4 Gy (2×2 Gy of 1×4 Gy) |
|
Rituximab monotherapie |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1,8,15,22, evt gevolgd door onderhoudsbehandeling |
Vanwege de afwezigheid van solide data m.b.t. de optimale behandeling van het FL in vroege stadia verdient het de voorkeur patiënten in klinische studies te behandelen. In afwezigheid van studies is de huidige standaardbehandeling, conform internationale richtlijnen (NCCN 2021; Dreyling et al., Ann Oncol 2021), radiotherapie in curatieve opzet.
Deze aanbeveling geldt voor patiënten met stadium I ziekte, en patiënten met stadium II ziekte met maximaal 2 aangrenzende aangedane lymfklierregio’s. Nauwkeurige stadiëring inclusief FDG-PET-CT en beenmergonderzoek is dan ook noodzakelijk. Indien deze definitie van stadium II gehanteerd wordt is er een 5-jaars ziekte-vrije overleving bij stadium I van circa 75 % en bij stadium II van circa 50% (Brady et al., Hematol Oncol 2017 en Blood 2019). Voor patiënten met meer uitgebreide ziekte is systemische behandeling (als aanbevolen voor stadium III-IV) aangewezen. In deze situatie kan aanvullende radiotherapie overwogen worden bij residuale ziekte (Friedberg et al., J Clin Oncol 2012).
Veel van de beschikbare data over de behandeling van het FL in vroege stadia zijn verkregen uit retrospectieve en niet vergelijkende studies. Uit een gerandomiseerde studie is gebleken dat een dosis van 24 Gy even effectief is (m.b.t. respons, progressievrije overleving en algehele overleving) als hogere doses (40-45 Gy) (Lowry et al., Radiother Oncol 2011). Vierentwintig Gy was wel duidelijk effectiever (m.b.t. progressievrije overleving) dan een lagere dosis van 4 Gy (Hoskin et al., Lancet Oncol 2021). Een curatieve dosis bij FL van 24 Gy (12 x 2 Gy) is dan ook alom geaccepteerd. Deze lage dosis en de moderne bestralingstechnieken (IMRT/VMAT) maken de kans op blijvende nadelige effecten van de behandeling (sicca syndroom, hypothyreoidie of myelosupressie) erg klein. Er zijn doorgaans dan ook geen redenen om deze behandeling niet aan te bieden (afgezien van co-morbiditeit die de levensverwachting sterk nadelig beïnvloedt. Recent heeft een gerandomiseerde studie aangetoond dat ‘combined modality treatment’ (CMT) de uitkomst van patiënten met stadium I-II FL kan verbetern. Patienten die na IFRT met (R-) CVP behandeld werden hadden een langere PFS dan patiënten die alleen IFRT kregen (MacManus et al., J Clin Oncol 2018). Er was geen overlevingsvoordeel en het is niet bekend of CMT voordeel biedt boven radiotherapie alleen gevolgd door immunochemotherapie bij een eventueel recidief. Ook werden niet alle patiënten in deze studie gestadiëerd m.b.v. een FDG-PET-scan. CMT is daarom vooralsnog niet routinematig aanbevolen.
Als om bepaalde redenen van radiotherapie in curatieve opzet wordt afgezien, zijn rituximab monotherapie of ‘watch and wait’ (W&W) mogelijke alternatieven. Ook is palliatieve radiotherapie (IF-RT 2 x 2 Gy) te overwegen (Solal-Céligny et al., J Clin Oncol 2012; Friedberg et al., J Clin Oncol 2012; Hoskin et al., Lancet Oncol 2021).
Voor radiotherapie velden en technieken wordt verwezen naar richtlijnen van de beroepsgroep radiotherapie.
Referenties
Stadium III-IV
Tabel 5. Eerstelijns behandeling FL stadium III-IV
|
Asymptomatisch |
|
|
Watch & wait |
|
|
Symptomatisch |
|
|
R-CVP (8x, à 3 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1*, vincristine 1.4 mg/m2 i.v. (max 2 mg) d1, prednison 40 mg/m2 p.o. d1-5 |
|
R-CHOP (6x, à 3 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1, , doxorubicine 50 mg/m2 i.v. d1, vincristine 1.4 mg/m2 (max 2 mg) i.v. d1, prednison 100 mg d1-5 |
|
R- bendamustine (6 x, à 4 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, bendamustine 90 mg/m2 i.v. d1, 2 |
|
R-chloorambucil (6-12 x, à 4 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, chloorambucil 10 mg p.o. d1-14 óf 10 mg/m2 p.o. d1-7 |
|
Rituximab monotherapie |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1,8,15,22, evt gevolgd door onderhoudsbehandeling |
|
R-lenalidomide (18 x, à 4 weken; gevolgd door RM)** |
Lenalidomide 1 dd 20 mg p.o. d2-22 (10 mg bij kreatinineklaring 30-59 mL/min) c1-6; bij (u)CR 1 dd 10 mg p.o. d2-22 c7-18, bij PR 1 dd 20 mg p.o. d2-22 c7-9/12 (tot (u)CR, daarna 1 dd 10 mg. rituximab 375 mg/m2 kuur 1 d1,8,15,22 en kuur 2-6 d1 (gevolgd door RM à 8 weken). |
|
Radiotherapie |
4 Gy (2×2 Gy) |
* alteratief: cyclofosfamide 300 mg/m2 p.o. d1-5
** mits vergoed
Voor patiënten met FL stadium III-IV (en stadium II niet in aanmerking komend voor curatieve radiotherapie), biedt conventionele therapie geen uitzicht op curatie. Bovendien heeft de ziekte vaak een fluctuerend beloop en wordt bij 10 tot 20% van de patiënten spontane regressie gezien.
Dit maakt dat het moment van starten van de behandeling zorgvuldig overwogen moet worden. Ook zijn bij de keuze voor een behandeling de (progressievrije) overleving en kwaliteit van leven minstens zo belangrijk als het bereiken van een complete respons. Tabel 5 geeft een overzicht van de meest gebruikte immunochemotherapie schema’s (in de eerste lijn).
Omdat de ziekte bij vrijwel alle patiënten vroeg of laat zal recidiveren, en de recidieven zich na een steeds korter interval zullen voordoen, is verdere verbetering van de behandeling onverminderd nodig. Alle patiënten moeten dan ook zoveel mogelijk in studieverband behandeld worden.
W&W versus direct behandelen (uitgangsvraag 3)
Uitgangsvraag:
Op welk moment moet behandeling worden gestart en tot welk moment is ‘watch and wait’ (W&W) gerechtvaardigd?
Aanbeveling(en):
Vawege het ontbreken van curatieve behandelopties en de kans op spontane remissie, hoeft behandeling pas te worden gestart bij het ontstaan van symptomatische ziekte, zoals: B symptomen, snelle progressie (hoog LDH), hinderlijke (bulky) lymfadenopathie, klinisch relevante oorgaanbetrokkenheid of (dreigende) orgaancompressie, beenmergverdringing en ascites/ pleuravocht.
In afwezigheid van bovenstaande bevindingen wordt een afwachtend beleid aanbevolen.
Inleiding:
Omdat er voor de hogere stadia FL geen curatieve behandeling bestaat, en de ziekte na initiële behandeling op termijn vrijwel zeker zal recidiveren, moet de timing van de start van de behandeling goed overwogen worden. Naast factoren als de biologie en het klinisch beloop van de ziekte, verwachtingen t.a.v. effectiviteit en toxiciteit van de behandeling, dienen hierin ook patiëntgebonden factoren als comorbiditeit, maar ook kwaliteit van leven en psychische gevolgen meegenomen te worden.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
Behandeling hoeft pas geworden bij symptomtische ziekte (Young et al., Semin Hematol 1988; Brice et al., J Clin Oncol 1997; Ardeshna et al., Lancet 2003; Ardeshna et al., Lancet Oncol 2014; Kahl et al., J Clin Oncol 2014) |
Samenvatting literatuur:
Resultaten
Drie gerandomiseerde trials, uitgevoerd vóór de introductie van rituximab, hebben aangetoond dat starten van de behandeling vroeg in de ziekte (in plaats van bij het ontstaan van symptomen) niet leidt tot verbetering van de (ziekte–specifieke) overleving (Young et al., Semin Hematol 1988; Brice et al., J Clin Oncol 1997; Ardeshna et al., Lancet 2003).
In een recentere studie werden 379 patiënten met asymptomatisch FL met lage tumorlast gerandomiseerd tussen W&W, rituximab inductie (4 giften) en rituximab inductie gevolgd door rituximab onderhoud (gedurende 2 jaar) (Ardeshna et al., Lancet Oncol 2014). Hoewel patiënten die direct behandeld werden met rituximab een significant langere tijd tot nieuwe behandeling (TTNT) en progressievrije overleving (PFS) hadden (HR 0.35 (0.22–0.56; p<0.0001) resp. HR 0.55 (0.37–0.83; p=0.0034)), was er geen verschil in algehele overleving. Rituximab inductie gevolgd door rituximab onderhoudsbehandeling gaf overigens geen voordeel boven alleen rituximab inductie m.b.t. TTNT; wel leidde dit tot een lagere PFS (HR 0.54 (0.32–0.87; p=0.011).
Een andere studie, waarin 289 patiënten ná rituximab inductiebehandeling werden gerandomiseerd tussen rituximab onderhoud en W&W met herstart van rituximab als nodig, toonde geen verschil in tijd tot volgende behandellijn (Kahl et al., J Clin Oncol 2014).
Referenties
Bewijskracht van de literatuur Level 1, consistent
Overwegingen:
Hoewel er vooralsnog geen overlevingsvoordeel is aangetoond van vroege start met behandeling, zijn de studies waarin rituximab monotherapie vroeg in het ziektebeloop werd toegediend nog van recente datum en is de follow-up waarschijnlijk te kort om definitieve conclusies t.a.v. de algehele overleving te trekken. Ook is nog onvoldoende bekend over de invloed van vroege behandeling met rituximab op de respons op latere behandeling met immunochemotherapie.
Er zijn gevallen denkbaar waarin W&W onaantrekkelijk is. In dergelijke gevallen kan rituximab monotherapie (4 wekelijkse toedieningen van 375 mg/m2) overwogen worden. Een verbetering van de kwaliteit van leven door vroege start van behandeling met rituximab werd overigens alleen gezien bij patiënten die na inductie ook onderhoudsbehandeling met rituximab kregen (Ardeshna et al., Lancet Oncol 2014).
Uit onderzoek onder patiënten uitgevoerd door Hematon blijkt dat personen die in de ‘watch and wait’ fase zitten met meer dan gemiddelde bezorgheid naar controlebezoeken gaan. Dit kan worden verklaard door het feit dat men zich zorgen maakt dat er een vorm van kanker is geconstateerd maar dat er ‘niets aan wordt gedaan’.
Andersom is de zorg op welk moment in de controlefase het bericht zal komen dat nu behandeling nodig is.
In deze fase moet dus extra aandacht worden besteed aan de informatie naar de patiënt waarom er voor wordt gekozen om nog niet actief te behandelen en wat criteria zijn om daartoe later wel over te gaan.
Referentie
Fitte patiënt (uitgangsvraag 4)
Uitgangsvraag:
Wat is de eerstelijns behandeling van het FL stadium III-IV (en stadium II met grote tumorlast)?
Aanbeveling(en):
Voor symptomatisch FL is behandeling met R-CVP (8x) de eerste keuze.
Voor patiënten met een hoog risicoprofiel (bijv. FLIPI 3-5) of als snelle respons gewenst is, kunnen bendamustine i.c.m. rituximab (6x) en R-CHOP (6x) overwogen worden, waarbij het toxiciteitsprofiel van beide schema’s een belangrijke factor in de keuze is.
R-lenalidomide (+ R onderhoud) is, mits vergoed, een alternatief voor R-chemotherapie.
De keuze voor een van deze behandelschema’s dient het resultaat te zijn van ‘shared decision making’.
Inleiding:
Toevoegen van rituximab aan chemotherapie heeft de uitkomst van de behandeling van het FL verbeterd; zowel wat betreft respons, als progressievrije overleving en algehele overleving (Schulz et al., Cochrane Database Syst Rev 2007; Marcus et al., J Clin Oncol 2008). Zowel R-CHOP als R-CVP worden in Nederland veel gebruikt. In de afgelopen jaren wordt daarnaast R-bendamustine steeds meer toegepast. Het is echter niet goed bekend welk chemotherapie schema in welke situaties de voorkeur heeft.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
R-CVP, R-benda en R-CHOP zijn effectieve eerstelijnsbehandelingen voor FL, met een duidelijk verschillend toxiciteitsprofiel (Hiddeman et al., Blood 2005; Federico et al., J Clin Oncol 2013; Rummel et al., Lancet 2013; Walewski et al., Br J Haematol) |
|
C |
R-CVP is te prefereren vanwege een gunstiger toxiciteitsprofiel, zonder negatieve invloed op overleving (expert opinion) |
|
A |
R-bendamustine is een effectieve behandeling met mogelijk lagere toxiciteit dan R-CHOP (Rummel et al, Lancet 2013; Flinn et al., Blood 2014) |
|
A |
R-lenalidomide + onderhoud) is even effectief als R-chemotherapie met een ander toxiciteit profiel (Morschhauser et al., N Engl J Med). |
Samenvatting literatuur:
Resultaten
De resultaten van de systematische search zijn samengevat in tabel S1.
Een systematische review heeft aangetoond dat toevoegen van rituximab aan chemotherapie de overleving van patiënten met FL heeft verbeterd (HR 0.63; 95% CI 0.51-0.79; Schulz et al., Cochrane Database Syst Rev 2007).
Op grond van effectiviteit (en toxiciteitsprofiel) worden R-CVP, R-CHOP en R-bendamustine als opties aangemerkt in recente richtlijnen van de NCCN en ESMO (NCCN 2021; Dreyling et al., Ann Oncol 2021). R-CVP en R-CHOP zijn in Nederland de meest gebruikte schema’s. Recent is ook het gebruik van R-bendamustine toegenomen. R-CVP heeft een gunstiger bijwerkingenprofiel, vooral wat betreft hematologische toxiciteit en cardiotoxiciteit.
De effectiviteit van R-CVP en R-CHOP ontloopt elkaar niet veel. Vergelijk van verschillende studies suggereert een voordeel van R-CHOP boven R-CVP met betrekking tot kans op CR en PFS, maar dit leidt niet tot een toename van de OS (tabel S1). Een post-hoc analyse van de studie van Federico et al, toonde een (licht voordeel) van R-CHOP boven R-CVP m.b.t. tijd tot volgende behandeling voor grote maximale tumordiameter en beenmerglokalisatie, en m.b.t. PFS voor verhoogd ß2M en beenmerglokalisatie, maar niet voor grote kliermassa’s. In deze studie was een hoge FLIPI géén voorspeller voor een meerwaarde van een van beide schema’s. Er is in deze studie geen verschil in incidentie van secundaire maligniteiten gevonden (Federico et al., J Clin Oncol 2013).
In een gerandomiseerde studie in 250 patiënten met indolent NHL (w.o. 42% FL), waarin patiënten werden gerandomiseerd tussen R-CHOP en R-CVP gevolgd door rituximab onderhoudsbehandeling was er geen significant verschil in ORR en CR, en na een mediane follow-up van meer dan 5 jaar, ook geen verschil in EFS, PFS en OS. Wel was er significant meer toxiciteit in de R-CHOP arm (Walewski et al., Br J Haematol 2019).
Ook een Cochrane systematische review toonde geen voordeel m.b.t. overleving van toevoeging anthracyclines aan de behandeling. Van belang is dat deze review grotendeels studies heeft geïncludeerd van vóór de introductie van rituximab en dat de controle armen vaak ook uit relatief intensieve schema’s bestonden (Itchaki et al., Cochrane Database Syst Rev, 2013).
R-bendamustine is in twee vergelijkende studies minstens net zo effectief of beter gebleken als R-CHOP. Belangrijk is wel dat de respons op R-CHOP in deze studies wat lager was dan in andere studies gevonden werd (Rummel et al., Lancet 2013; Flinn et al, Blood 2014). Ook werd FL graad 3a in deze studies niet meegenomen. R-Bendamustine leidde ook tot een significant langere progressievrije overleving in één van deze studies (Rummel et al., Lancet 2013) en heeft mogelijk een gunstiger toxiciteitsprofiel (minder hematologische toxiciteit, alopecia, cardiotoxiciteit en infecties). Er was geen verschil in het aantal secundaire maligniteiten (Rummel et al., Lancet 2013). Wel is er zorg vanwege mogelijk toegenomen toxiciteit van R-bendamustine gevolgd door rituximab onderhoud (zie sectie ‘onderhoudsbehandeling rituximab’). In een exploratieve analyse van deze laatste studie leek R-bendamustine een voordeel te hebben over R-CHOP vooral bij lage FLIPI en normaal LDH.
Vanwege de relatieve schaarste aan gerandomisserde studies is een ‘random-effects’ Bayesiaanse netwerk-meta-analyse van meerdere gerandomiseerde fase III-studies uitgevoerd; FOLL05, PRIMA, Stil NHL 1, BRIGHT, Stil NHL 7, GALLIUM en RELEVANCE’gezamenlijk 4.557 deelnemers.
Bendamustine bleek in deze analyse een betere chemotherapeutische basis (‘backbone’) m.b.t. PFS dan CHOP (en CVP), zowel met als zonder onderhoudsbehandeling (met onderhoudsbehandeling: R-benda-R vs. R-CHOP-R: HR = 0,62; O-benda-O vs. O-CHOP-O: HR = 0,55; zonder onderhoudsbehandeling: R-benda vs. R-CHOP: HR = 0,68). (Wang et al., Bl Cancer J 2021). CHOP was superieur boven CVP (R-CVP-R vs. R-CHOP-R: HR = 1.56). Het is van belang te realiseren dat in deze analyse niet naar individuele patiënt data is gekeken (zo is de chemo-backbone in de Gallium en PRIMA studieS (de grootste studies) niet gerandomiseerd toegewezen) en zijn toxiciteitsverschillen niet meegenomen.
Lenalidomide wordt al langer toegepast in de recidief setting. In de eerste lijn werd o.a. in de fase III-RELEVANCE-studie gevonden dat de combinatie van rituximab en lenalidomide (18 cycli met rituximab onderhoud gedurende 1 jaar) leidt tot een vergelijkbare 3-jaars PFS en CR rate als met rituximab-chemotherapie gevolgd door rituximab onderhoud (3 jaar PFS 77% versus 78%; CR in 48% versus 53%). (Morschhauser et al., N Engl J Med 2018).
Referenties
Bewijskracht van de literatuur Level 1, redelijk consistent
Overwegingen:
Op grond van de beschikbare literatuur is niet goed aan te geven welke groepen patiënten baat van intensievere behandeling dan R-CVP. R-CHOP liet weliswaar is sommige studies/ cohorten een hogere kans op (complete) respons en langere progressievrije overleving zien maar deze uitkomsten zijn niet consistent, er is geen verbeterde overleving, en R-CHOP gaat gepaard met meer toxiciteit. De werkgroep is dan ook van mening dat R-CVP i.p. de behandeling van voorkeur is en R-CHOP gereserveerd moet worden voor lymfomen met een hoog risico, zoals bijvoorbeeld een FLIPI > 3 of een klinisch agressief beloop, omdat de winst in PFS t.o.v. R-CVP in die gevallen opweegt tegen de de extra toxiciteit van de anthracycline. Dit heeft ook als voordeel dat anthracyclines bij deze patiënten eventueel alsnog kunnen worden ingezet als het lymfoom transformeert.
R-bendamustine is een effectieve behandeling met mogelijk gunstig bijwerkingenprofiel in vergelijking met R-CHOP, en wordt in een deel van de wereld als standaardbehandeling in de eerste lijn wordt gebruikt. Er zijn nog relatief weinig data gepubliceerd over de toxiciteit op lange termijn (secundaire maligniteiten) of de mogelijkheid stamcellen te mobiliseren bij een recidief, hoewel er aanwijzingen zijn dat de mogelijkheid hiertoe niet is aangetast. Ook is er toenemend ervaring dat recente behandeling met bendamustine behandeling met CAr-T cellen of bispecifieke antistoffen negatief beinvloedt.
Als laatse is er zorg over de veiligheid en waarde van anti-CD20 onderhoudsbehandeling na inductie met bendamustine. De data van de GALLIUM studie geven enige zorg vanwege mogelijke oversterfte in patiënten behandeld met bendamustine i.c.m. een anti-CD20 antistof (Hiddemann et al., J Clin Oncol 2018). Hoewel dit niet de primaire vraagstelling van deze studie was, is enige voorzichtigheid geboden. Voor patiënten die in aanmerking komen voor behandeling met R-CHOP, maar een (relatieve) contra-indicatie hebben voor anthracyclines, is R-bendamustine een goed alternatief.
Hoewel R-lenalidomide vooralsnog vooral in de recidief setting wordt toegepast, lijkt de activiteit van R-lenalidomide gevolgd door R onderhoud gelijk aan die van R-chemotherapie + R onderhoud. R-lenalidomide geeft minder ernstige neutropenie en minder infecties, maar wel meer (ernstige) huidreacties. Ook is de follow-up van de vergelijkende studies nog te kort om te kunnen oorelen over lange termijn effectenn als secundaire tumoren. Een potentieel nadeel is dat de lenalidomide in get geraporteerde schema lan geslikt moet worden (18 maanden). Ht middel wordt nog niet vergoed in de eerste lijn.
Referenties
Niet-fitte patiënt
Tabel 6. Eerstelijns behandeling FL stadium III-IV bij niet fitte patiënt
|
Asymptomatisch |
|
|
Watch & wait |
|
|
Symptomatisch |
|
|
R-CVP (8x, à 3 weken) |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1*, vincristine 1.4 mg/m2 i.v. (max 2 mg) d1, prednison 40 mg/m2 p.o. d1-5 |
|
R-chloorambucil (6-12 x, à 4 weken) |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, chloorambucil 10 mg p.o. d1-14 óf 10 mg/m2 p.o. d1-7 |
|
Rituximab monotherapie |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1,8,15,22, evt gevolgd door onderhoudsbehandeling |
|
R-lenalidomide (18 x, à 4 weken; gevolgd door RM)** |
Lenalidomide 1 dd 20 mg p.o. d2-22 (10 mg bij kreatinineklaring 30-59 mL/min) c1-6; bij (u)CR 1 dd 10 mg p.o. d2-22 c7-18, bij PR 1 dd 20 mg p.o. d2-22 c7-9/12 (tot (u)CR, daarna 1 dd 10 mg. rituximab 375 mg/m2 kuur 1 d1,8,15,22 en kuur 2-6 d1 (gevolgd door RM à 8 weken). |
|
Radiotherapie |
4 Gy (2×2 Gy) |
* alteratief: cyclofosfamide 300 mg/m2 p.o. d1-5
** mits vergoed
1. Chemo-immunotherapie met R-CVP wordt vaak ook op hogere leeftijd goed verdragen en dit is, indien mogelijk, dan ook de voorkeursbehandeling. Bij twijfel over de kwetsbaarheid en belastbaarheid kan het zinvol zijn een geriater of internist ouderengeneeskunde de patiënt te laten beoordelen.
Een verkort chemotherapie schema met het volledige aantal giften rituximab is effectief en haalbaar gebleken bij ouderen (Vitolo et al., J Clin Oncol 2013), maar dit is niet onderzocht met het in Nederland meest toegepaste schema R-CVP.
2. Indien R-CVP niet haalbaar of onwenselijk is, is zeker bij geringe ziektelast, rituximab monotherapie een goed alternatief. Het meest gebruikte schema is 4 giften van 375 mg/m2 á 1 week (inductie), al dan niet gevolgd door onderhoudsbehandeling (tweemaandelijkse giften, gedurende 8 maanden tot 2 jaar) (Ghielmini et al., Blood 2004; Martinelli et al., J Clin Oncol 2010; Ardeshna et al., Lancet Oncol 2014; Kahl et al., J Clin Oncol 2014)
In een internationale fase 3 studie, waarin rituximab inductie gevolgd door onderhoudsbehandeling gedurende twee jaar werd vergeleken met W&W in 379 patienten met niet eerder behandeld folliculair lymfoom, was het responspercentage 88% (complete respons 51%). Er was geen verschil in overleving (94% resp 97% na 3 jaar) (Ardeshna et al., Lancet Oncol 2014). Een vergelijkbaar responspercentage (73%) werd gevonden in een tweede multicenter studie in 408 onbehandelde patiënten. In deze studie werd vervolgens gerandomiseerd tussen onderhoudsbehandeling of herhalen van inductiebehandeling bij ziekteprogressie. Ook in deze studie was de (geschatte) 5 jaars overleving goed en niet verschillend in beide armen (circa 94%) (Kahl et al., J Clin Oncol 2014). Behandeling met rituximab ging niet gepaard met een verhoogde kans op transformatie in beide studies.
De waarde van onderhoudsbehandeling na een korte inductiebehandeling met rituximab is overigens niet vastgesteld. Er zijn situaties denkbaar waarin onderhoudsbehandeling toch wenselijk is i.v.m. de langere remissieduur. Het herhalen van de korte inductiekuur bij ziekteprogressie is ook een goede mogelijkheid. Langduriger onderhoudsbehandeling (tot 5 jaar) is invergelijking met een kortere onderhoudsbehandeling niet zinvol gebleken (m.b.t. EFS en OS) (Taverna et al., J Clin Oncol 2016).
Bij hogere tumorlast is toevoegen van clorambucil (bijv 6 mg/m2 continu ged 6 weken of 1 dd 10 mg ged 14 dagen, elke 4 weken) aan rituximab een overweging (Martinelli et al., Hematol Oncol 2015).
3. R-lenalidomide (+ R onderhoud) is even effectief gebleken als R-chemotherapie met een ander toxiciteitsprofiel (minder diepe neutropenie en ernstige infecties); zie uitgangsvraag 4 (fitte patiënt). Daarmee is dit schema een goed alternatief voor R-chemotherapie bij de minder fitte patiënt. Lenalidomide wordt momenteel nog niet vergoed in de eerste lijn.
4. FL is zeer gevoelig voor radiotherapie. Een zeer lage bestralingsdosis van 4 Gy leidt nagenoeg nooit tot acute bijwerkingen of late effecten, en kan dus laagdrempelig worden aangeboden. De kans op respons is erg hoog. Verder kan een lokale behandeling met 4 Gy probleemloos worden herhaald, met opnieuw een hoge kans op respons (Ganem et al., Int J Radiat Oncol Biol Phys. 2010; Haas et al., J Clin Oncol 2003). Naast lokale klachten/ problemen (zoals druk, pijn of obstructie) kunnen ook cosmetische redenen een indicatie zijn om te bestralen.
Referenties
Tabel 7. Behandelopties recidief/ refractair FL
|
Asymptomatisch |
|
||
|
Watch & wait |
|
||
|
Symptomatisch |
|||
|
Schema |
Referentie |
Aantal kuren (dosering) |
ORR |
|
R-bendamustine (6x, à 4 weken) |
Rummel et al., J Clin Oncol 2005 Robinson et al., J Clin Oncol 2008
|
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, bendamustine 90 mg/m2 i.v. d1,2 |
90% |
|
R-CHOP (6x, à 3 weken) |
Van Oers et al., Blood 2006 |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1, doxorubicine 50 mg/m2 i.v. d1, vincristine 1,4 mg/m2 (max 2 mg) i.v. d1, prednison 100 mg d 1-5 p.o. |
85% |
|
R-FC (6x, à 4 weken) |
Czuczman et al., J Clin Oncol 2005 Tobinai et al., Cancer Sci 2009 |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, Fludarabine 40 mg/m2 p.o. d1-3, cyclosfosfamide 250 mg/m2 p.o. d1-3 |
80-90% |
|
R-CVP (8x, à 3 weken) |
|
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1*, vincristine 1,4 mg/m2 (max 2 mg) i.v. d1, prednison 100 mg d 1-5 p.o. |
|
|
Radiotherapie |
Haas et al., JCO 2003 Hoskin et al., Lancet Oncol 2014 Gastaud et al., Radiother 2016 |
4 Gy |
> 80% |
|
R-chloorambucil |
Martinelli et al., Br J Haematol 2003 |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1 (en d8,15 en 22 gedurende cyclus 1), chloorambucil 10 mg p.o. d1-14 óf 10 mg/m2 d1-7 |
>80% |
|
Rituximab monotherapie |
Tobinai et al., Cancer Sci 2011 |
Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, 8,15,22 óf Rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1 (8 cycli à 4 weken) |
60-70% |
|
R-lenalidomide (12x, a 4 weken) |
Leonard et al., J Clin Oncol 2019 |
Lenalidomide 1 dd 20 mg p.o. d1-21 (10 mg bij kreatinineklaring 30-59 mL/min) Rituximab 375 mg/m2 kuur 1 d1,8,15,22 en kuur 2-5 d1 |
78% |
|
Rituximab refractair |
|
||
|
Obinutuzumab-bendamustine (6x, à 4 weken) |
Sehn et al., Lancet Oncol 2016 |
Obinutuzumab 1000 mg i.v. d1,8,15 van kuur 1; d1 van kuren 2-6, bendamustine 90 mg/m2 i.v. d1,2, alle kuren |
65-70% |
|
Bendamustine (6x, à 4 weken) |
Sehn et al., Lancet Oncol 2016 |
Bendamustine 90 of 120 mg/m2 i.v. d1,2 |
60-70% |
|
Idelalisib (tot aan progressie, of tot allo-SCT) |
Gopal et al., N Engl J Med 2014 |
Idelalisib 2 d.d. 150 mg p.o. |
50-55% |
|
Nieuwe middelen (in afwachting van registratie/ vergoeding) |
|||
|
Ibrutinib (tot aan progressie, of tot aan allo-SCT) |
Gopal et al., JCO 2018 Bartlett et al., Blood 2018 |
Ibrutinib 1 d.d. 560 mg p.o. |
21-38% |
|
Mosenutuzumab (8x (tot 17x indien geen CR), à 3 weken) |
Budde et al., Lancet Oncol 2022 |
Mosenutuzumab: 1 mg dag 1, 2 mg dag 8, 60 mg dag 15 van kuur 1 en dag 1 van kuur 2; 30 mg dag 1 kuur 3 e.v. |
80% |
|
CAR-T cellen – Axicel – Tisacel |
Jacobsen et al., Lancet Oncol 2022 Fowler et al., Nat Med 2022 |
Axicel 2 × 106 CAR T cells per kg Tisacel 0.6-6×108 cells |
94% 86,2% |
NB let bij beoordeling responspercentages: betreft verschillende studie populaties (PFS om die reden niet weergegeven)
* alteratief: cyclofosfamide 300 mg/m2 p.o. d1-5
** Radioimmunotherapie (Zevalin), tenzij meer dan 25% beenmerginfiltratie met non-Hodgkin lymfoom
# Let op: check vergoedingsstatus (vooralsnog vergoed via add-on)
Bij een recidief is hernieuwde biopsie (eventueel FDG-PET gestuurd) aangewezen om transformatie uit te sluiten; zeker als het recidief snel optreedt na eerstelijns chemo-immunotherapie (POD24). Ook is nieuw stadiëringsonderzoek aanbevolen om de respons op behandeling goed te kunnen bepalen (zie Stadiëring).
Er is geen uniform behandeladvies te geven voor het recidief/ refractair FL, omdat er vele patiënt- en ziekte-specifieke factoren meespelen bij het bepalen van de optimale behandeling. Ook ontbreken goede vergelijkende studies. Indien een behandelindicatie ontstaat, is er een de sterke voorkeur te behandelen in studieverband.
De behandelingskeuze hangt af van de eerder gegeven behandelingen en de responsduur. Onderstaande overwegingen kunnen als leidraad genomen worden. Tabel 7 geeft een samenvatting van de mogelijkheden, waarbij onderscheid is gemaakt o.b.v. rituximab-refractoriteit.
Aanwijzingen voor het maken van een keuze
Tweede lijn
1. Bij lange responsduur (> 12-24 maanden) na immunochemotherapie kan het eerdere regime opnieuw gegeven worden (met uitzondering van anthracycline-bevattende schema’s).
2. Bij een kortere responsduur (< 12-24 maanden), moet voor een ‘niet kruis resistent’ schema gekozen worden: bijvoorbeeld CHOP na bendamustine of vice versa. Deze patiënten komen in aanmerking voor consolidatie met hoge dosis chemotherapie (BEAM) en autologe stamceltransplantatie (zie verder).
Ook R-lenalidomide (zie onder) of FC-R kan in deze setting overwogen worden. Fludarabine kan beter vermeden worden als autologe SCT of CAR-T cel therapie nog worden overwogen, vanwege het risico op mobilisatie falen of verminderde kwaliteit van de T cellen. Hoewel er minder ervaring is met stamcel mobilisatie na bendamustine, lijkt dit niet een groot probleem te zijn (Poenisch et al., J Cancer Res Clin Oncol 2015; Santoro et al., J Clin Oncol 2016; Martin et al., Br J Haematol. 2017).
3. Rituximab refractaire ziekte: indien patiënten geen PR of CR hebben bereikt op een rituximab bevattend schema van tenminste 4 kuren, of een recidief/progressie krijgen tijdens of binnen 6 maanden na rituximab-bevattende inductie- of onderhoudsbehandeling worden zij beschouwd als rituximab-refractair. Het iswaarschijnlijk niet zinvol om een volgend chemotherapie regime te combineren met rituximab. Deze patiënten komen in aanmerking voor behandeling met obinutuzumab + bendamustine (zie verder).
Derde lijn en verder
4. Bij lange responsduur (> 12-24 maanden) na immunochemotherapie kan het tot dan toe meest succesvolle immunochemotherapie regime opnieuw gegeven worden (met uitzondering van anthracycline-bevattende schema’s).
5. Patiënten die nog niet eerder autologe SCT hebben ondergaan, komen hier in de derde lijn alsnog voor in aanmerking (zie verder). Voor de reïnductie behandeling kan ook gekozen worden voor schema’s die gebruikt worden in DLBCL zoals (R)-DHAP en (R-)GDP (zie DLBCL richtlijn).
6. Voor patiënten met ‘high risk’ factoren zoals POD24 of refractoriteit voor zowel rituximab als alkylerende middelen, kan in de derde lijn en verder behandeling met T celgemedieerde immuuntherapie overwogen worden (zie verder).
7. Behandeling met ‘targeted’ middelen zoals ibrutinib of idelalisib kan overwogen worden ter overbrugging naar bv allogene stamceltransplantatie gebruikt worden, als er geen andere opties meer voorhanden zijn.
8. Ook minder fitte patiënten komen voor behandeling met ‘ targeted middelen’ in aanmerking, maar hierbij dient het risico op toxiciteit goed in overweging te worden genomen.
9. FL is zeer gevoelig voor radiotherapie. Een zeer lage bestralingsdosis van 4 Gy leidt nagenoeg nooit tot acute of late effecten, en kan dus laagdrempelig worden aangeboden.De kans op respons is erg hoog.Verder kan een lokale behandeling met 4 Gy goed worden herhaald, met opnieuw een hoge kans op respons (Ganem et al., Int J Radiat Oncol Biol Phys. 2010; Haas et al., J Clin Oncol 2003). Naast lokale klachten/problemen (zoals druk, pijn of obstructie) kunnen ook cosmetische redenen een indicatie om te bestralen.
Referenties
‘Targeted’ orale medicatie
Lenalidomide (uitgangsvraag 5)
Uitgangsvraag:
Wat is de plaats van lenalidomide in de behandeling van R/R FL?
Aanbeveling(en):
R-lenalidomide kan toegepast worden in tweedelijns behandeling en verder, vooral bij recidief na eerdere Immunochemotherapie, of indien immunochemotherapie te toxisch wordt geacht.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
R-lenalidomide is actief in patiënten met R/R FL (Leonard et al., J Clin Oncol 2019) |
Samenvatting literatuur:
Resultaten
Er is één fase III onderzoek (de AUGMENT studie) verricht naar de activiteit van lenalidomide in R/R FL. In dit onderzoek werden 358 patiënten met FL (82%) of MZL (18%) die tenminste 1 eerdere behandeling had gehad (NB ook rituximab monotherapie; range 1-12) gerandomiseerd tussen lenalidomide + rituximab (R2) of placebo + ritximab (R). Na een mediane follow-up van 28,3 maanden, was de PFS (primaire eindpunt) 39,4 maanden (95% CI, 22.9 mnd-NR) in de R2 arm versus 14.1 maanden (95% CI, 11.4 – 16.7 mnd), met een HR van 0.46 (95% CI, 0.34 – 0.62; P < .001). Er was wel duidelijk meer toxiciteit in de R2 arm: infecties (63% vs 49%), neutropenie (58% vs 23%), en huidreacties (32% vs 12%). Graad 3 en 4 neutropenie (50% vs 13%) en leukopenie (7% vs 2%) werden ook meer gezien (Leonard et al., J Clin Oncol 2019).
Referenties
Bewijskracht van de literatuur
Overwegingen:
Hoewel de behandeling met R2 in tweede lijn (en verder) effectief lijkt, is het vergelijk met rituximab monotherapie in de Nederlandse situatie weinig relevant. Studies waarin R2 met standaardbehandeling met immunochemotherapie vergeleken wordt ontbreken vooralsnog.
Een dergelijke vergelijkende studie is wel verricht in onbehandelde FL patiënten (de RELEVANCE studie). In deze studie werden 1030 patiënten gerandomiseerd tussen behandeling met R2 en R-chemotherapie (vnl R-CHOP) gevolgd door rituximab onderhoudsbehandeling. Er was geen verschil in CR rate en PFS na 3 jaar. Wel was het toxiciteitsprofiel verschillend, met vooral meer graad 3-4 neutropenie (32 versus 50%) in de R-chemo arm en meer graad 3-4 huidreacties (7 versus 1%) in de R2 arm (Morschhauser et al., N Engl J Med 2018).Hoewel deze resultaten niet direct vertaald kunnen worden naar de R/R setting, is de werkgroep van mening dat R2 ook daar een goed alternatief is voor immunochemotherapie.
Referenties
Idelalisib (uitgangsvraag 6)
Uitgangsvraag:
Wat is de plaats van idelalisib in de behandeling van FL?
Aanbeveling(en):
Idelalisib is geregistreerd voor (en kan worden ingezet bij) FL refractair op (meer dan) 2 eerdere therapielijnen.
Vanwege de toxiciteit en beschikbare alternatieven (binnen en buiten studie) hebben PI3-kinase slechts bescheiden plaats in de behandeling van FL.
Inleiding:
Patiënten met een rituximab-refractair FL hebben beperkte behandelmogelijkheden en een slechte prognose. Voor deze patiëntengroep zijn nieuwe behandelingen nodig. Idelalisib is geregistreerd voor FL refractair op (meer dan) 2 eerdere therapielijnen (sinds 2014).
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Idelalisib is geregistreerd voor FL refractair op 2 eerdere therapielijnen (Gopal et al., N Engl J Med 2014). |
Samenvatting literatuur:
Resultaten
In fase 2 studie bij 125 patiënten met een indolent non-Hodgkin lymfoom, waaronder 72 met FL (Gopal et al., N Engl J Med 2014), voorbehandeld met gemiddeld 4 behandellijnen (spreiding 2-12), en refractair voor rituximab en een alkylerend middel, was het respons percentage (CR/PR) 56% en de mediane PFS en OS 11 resp. 20 maanden. Een post-hoc analyse van deze studie toonde geen verschil in activiteit in patiënten die snelle progressie (< 12 maanden) na eerstelijns behandeling met CIT hadden gehad in vergelijking met patiënten die een langere respons na eerstelijnsbehandeling hadden laten zien (Gopal et al., Blood 2017). De meest frequente bijwerkingen (> graad 3) waren diarree (13.9%), pneumonie (6.9%) en koorts (4.2%); de meest voorkomende laboratoriumafwijkingen (> graad 3) neutropenie (22.2%) en leverenzymstoornissen (13.9%) (Salles et al., Haematologica 2017).
Referenties
Bewijskracht van de literatuur Level 2, consistent
Overwegingen:
Vervolg studies, en studies in CLL, hebben tot zorgen geleid m.b.t. de toxiciteit, inclusief fatale gevallen, van idelalisib, hetgeen zelfs tot een voortijdige stop van een aantal studies heeft geleid. Dit betreft voornamelijk infecties, PJP- en CMV, als ook een toegenomen frequentie van ernstige immuungemedieerde toxiciteit bij toepassing van idelalisib ‘vroeg’ in het ziektebeloop (bijv. in de eerste lijn bij CLL patiënten). Dit laatste heeft geleid tot een zogenaamde ‘black box’ waarschuwing van de FDA m.b.t. ernstige (zelfs fatale) diarree en colitis, pneumonitis, hepatotoxiciteit en intestinale perforatie. Ook is de registratie voor FL en SLL bij de FDA (niet bij de EMA) teruggetrokken.
De activiteit van de ‘nieuwere’ middelen copanlisib en duvelisib, is waarschijnlijk niet duidelijk verschillend dan die van idelalisib, hoewel de middelen niet onderling zijn vergeleken en ook de studiepopulaties waarin ze getest zijn verschillen (bv op het gebied van het aantal voorbehandelingen). Ook van deze middelen is het bijwerkingen patroon aanzienlijk. Copanlisib en duvelisib zijn vooralsnog niet vergoed in Nederland (Flinn et al., J Clin Oncol 2019; Dreyling et al., Ann Oncol 2017).
Behandeling met idelalisib kan worden gebruikt ter overbrugging, bijvoorbeeld naar allogene stamceltransplantatie. Het is de verwachting dat het gebruik van idelalisib in de nabije toekomst wel steeds meer op de achtergrond zal raken gezien de toename van alternatieve opties, zoals bispecifieke antistoffen en CAR T cellen.
Gezien de waargenomen toxiciteit dienen extra maatregelen genomen te worden, o.a.:
1: PJP profylaxe (bijv. cotrimoxazol 1 dd 480 mg) en VZV/ HSV profylaxe (valaciclovir 2 dd 500 mg) en 2: Klinische en laboratorium controle op verschijnselen van CMV-infectie (indien CMV serologie positief); controle neutrofielen en leverenzymen.
Zie voor volledige advies de geneesmiddelentekst in het farmacotherapeutisch kompas (waarschuwingen en voorzorgen) Ook heeft een expert panel adviezen geformuleerd t.a.v. immuungemedieerde toxiciteit (Coutré et al., Leuk Lymphoma 2015).
Referenties
Ibrutinib (uitgangsvraag 7)
Uitgangsvraag:
Wat is de plaats van ibrutinib in de behandeling van FL?
Aanbeveling(en):
Ibrutinib kan worden ingezet vanaf de tweede lijn voor patiënten die te unfit/frail zijn voor intensievere therapieën gezien het relatief gunstige bijwerkingsprofiel, of in patiënten die recidiveren op meerdere andere behandellijnen (bijv. als brug naar T cel gemedieerde immuuntherapie als CAR T cellen of alloSCT), mits vergoed.
Inleiding:
De laatste jaren is er een toename aan behandelopties voor R/R FL, maar deze zijn met name gericht op vitale patiënten en hebben aanzienlijke kans op toxiciteit. Ibrutinib heeft een wat gunstiger bijwerkingsprofiel dan de PI3-kinase remmer idelalisib welke eerder is geregistreerd, wat de toepassing ook bij oudere patiënten met comorbiditeit mogelijk maakt.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Ibrutinib heeft een bescheiden effectiviteit bij FL met relatief milde toxiciteit (Gopal et al., JCO 2018). |
Samenvatting literatuur:
Resultaten
Er is een fase 2 studie verricht bij 110 patiënten met R/R FL (Gopal et al., JCO 2018). De patiënten in deze studie waren uitgebreid voorbehandeld, met gemiddeld 3 behandellijnen (spreiding 2-13), 94% refractair op rituximab en 63% refractair op een alkylerend middel. Ibrutinib werd gecontinueerd tot progressie. Het respons percentage (CR/PR) was beperkt (20.9%) in deze uitgebreid voorbehandelde groep. De mediane tijd tot respons was 5.7 maanden met een mediane duur van respons van 19.4 maanden. Dit vertaalde zich in eenmediane PFS van 4.6 maanden. Een post-hoc analyse van deze studie toonde dat er geen verschil was in activiteit van ibrutunib in patiënten die snelle progressie (< 6 maanden) na eerdere behandeling met CIT hadden gehad of refractair hierop waren in vergelijking met patiënten die een langere respons hadden laten zien. De toxiciteit van deze behandeling was beperkt. De meest frequente bijwerkingen (> graad 3) waren neutropenie (13.6%), anemie (9.1%) en pneumonie (6.4%).
Er is één andere fase 2 studie beschikbaar waarin slechts 40 patienten met recidief FL werden behandeld met ibrutinib (Bartlett et al., Blood 2018). Zij hadden mediaan 3 eerdere behandellijnen (range 1-11), maar slechts in 45% van de patiënten refractair op rituximab. Deze studie laat een veel betere overall response rate zien van 37.5%. Dit vertaalde zich in een mediane PFS van 14 maanden. De beste respons werd gezien bij patiënten die niet rituximab-refractair waren (52.6% vs. 16.7%).
Referenties
Bewijskracht van de literatuur Level 2, consistent
Overwegingen:
Ibrutinib wordt over het algemeen goed verdragen en veel toegepast bij CLL. De laatste jaren is echter steeds duidelijker geworden dat ibrutinib de kans op hartritmestoornissen (o.a. atriumfibrilleren maar ook sudden cardiac death) vergroot (Lampson et al., Blood 2017). Daarom moeten de potentiële voordelen worden afgewogen tegen de risico’s, met name bij patiënten met een verhoogde kans op of een voorgeschiedenis van hartritmestoornissen. Verder is de responskans bij R/R FL patiënten ook duidelijk lager, mn bij rituximab refractaire patiënten.
Recent zijn ook de eerste resultaten gepubliceerd van de ‘next generation’ BTK remmer zanubrutinib, als monotherapie (Phillips et al., Blood Adv 2022) of in combinatie met obinutuzumab (Tam et al., Blood Adv 2020).
De werkgroep is van mening dat ibrutinib van beperkte waarde is in de behandeling van patiënten met R/R FL. Afhankelijk van de vergoedingsstatus, kan het middel worden toegepast bij unfit/frail patiënten die niet in aanmerking komen voor 2e lijns chemo-immunotherapie of bij patiënten recidiverend na meerdere behandelingen. Het zou ook kunnen dienen als therapie ter overbrugging naar CAR-T of allogene SCT.
Referenties
T cel gemedieerde immuuntherapie
De ontwikkelingen op het gebied van T celgemedieerde immuuntherapie voor lymfomen hebben een grote vlucht genomen. Er zijn vele bispecifieke antistoffen en CAR-T cel producten in verschillende fasen van klinische ontwikkeling. Resultaten van fase II studies met de CD3xCD20 specifieke antistof mosenutuzumab en de CAR-T celproducten tisagenlecleucel en axicabtagene ciloleucel zijn recent gepubliceerd; de resultaten van deze studies worden hieronder besproken.
Voor beide modaliteiten is veelbelovende effectiviteit aangetoond (hoge ORR en PFS), maar het vermogen daadwerkelijk curatie te bewerkstelligen (i.e. een plateau in de PFS curves) is nog niet vastgesteld. Langere follow-up van deze en lopende studies zal daar duidelijkheid over geven.
De werkgroep acht deze middelen vooral geïndiceerd voor patiënten met ‘hoog risco’ziekte, zoals POD24 of dubbelrefractoriteit (anti-CD20 antistof en alkylerende therapie). Voor deze middelen wordt nu vergoeding aangevraagd voor behandeling van FL in de derde lijn en verder. Indien mogelijk verdient het de voorkeur patiënten in studieverband te behandelen. Bij het ontbreken van studies, kan geïnformeerd worden naar de mogelijkheid op compassionate use basis toegang te krijgen tot deze middelen.
Vooralsnog is het niet mogelijk om op grond van effectiviteit (groter voor CAR-T cel therapie dan mosenutuzumab) en toxiciteit (milder bij behandeling met bispecifieke antistoffen dan van CAR-T celtherapie) een prioritering aan de te geven. Initiële studies (NB vooral bij myeloom patiënten verricht) suggereren verminderde werkzaamheid van CAR T celtherapie NA bispecifieke antistoffen (t.g.v. uitputting van het T celcompatiment).
Op dit moment vindt CAR-T behandeling alleen plaats in de academische centra. Wellicht zal deze behandeling in de nabije toekomst ook in echelon B ziekenhuizen toegepast kunnen worden.
Op dit moment vindt CAR-T behandeling alleen plaats in de academische centra. Op termijn is de verwachting dat deze behandeling ook in echelon B ziekenhuizen toegepast zal kunnen worden.
Toediening van bispecifieke antistoffen gaat gepaard met minder toxiciteit (ICANS, CRS) dan CAR-T behandeling. De werkgroep is daarom van mening is dat deze behandeling gegeven kan worden (binnen studieprotocollen danwel in geval van goedkeuring en vergoeding) in ziekenhuizen waar 24 uur per dag toezicht door een hematoloog en neuroloog gewaarborgd is, onafhankelijk van de echelonnering.
Bispecifieke anistoffen (uitgangsvraag 8)
Uitgangsvraag:
Wat is de plaats van bispecifieke antistoffen in de behandeling van FL?
Aanbeveling(en):
Bispecifieke antistoffen zijn geïndiceerd als behandeling van R/R FL in de derde lijn en verder, vooral voor patiënten met ‘hoog risico’ factoren zoals eerdere POD24 en dubbelrefractoriteit (anti-CD20 antistof en alkylerende therapie), mits vergoed.
Inleiding:
Patiënten met een rituximab-refractair FL hebben beperkte behandelmogelijkheden en een slechte prognose. Idelalisib is geregistreerd voor FL refractair op (meer dan) 2 eerdere therapielijnen (sinds 2014).
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Mosenutuzumab is effectief in R/R FL in de derde lijn en verder, ook bij hoog risicofactoren zoals POD24 en dubbelrefractoriteit (Budde et al., Lancet Oncol 2022) |
|
c |
Vanwege het ontbreken van vergelijkende studies en de nog korte follow-up, lijkt behandeling vooralsnog voorbehouden aan patiënten met hoog risico FL (expert concensus) |
Samenvatting literatuur:
Resultaten
In een fase II studie is de CD3xCD20 bispecifieke antistof mosunetuzumab onderzocht in 90 patiënten met R/R FL die tenminste 2 eerder behandelingen hadden ondergaan (inclusief een anti-CD20 antistof en alkylerende therapie); het mediane aantal voorbehandelingen was 3. De ORR was 80% (95% CI 70·3–87·7) en de CR rate 60% (95% CI 49·1–70·2). De mediane tijd tot respons was 1,4 mnd (1,1-8,9) en tot CR 3,0 maanden (1,1-18,9). In deze studie had een groot aantal patiënten ‘high risk’ factoren zoals dubbelrefractoriteit (53%) en POD24 (52%); de ORR en CR rate was in deze patiënten niet significant verschillend. Na een mediane follow-up van 18,3 maanden van de mediane PFS 17,9 maanden, en een mediane duur van respons van 22,8 maanden (9·7–NR) en in patiënten met een complete respons 22·8 maanden (18·7–NR).
Cytokine release syndrome (CRS) was met 44% de meest frequente bijwerking (vnl. graad 1-2 (26% resp 17%) , en werd vooral gezien in cyclus 1. De meest voorkomende graad 3-4 bijwerkingen waren neutropenie (27%), hypofosfatemie (17%), hyperglycemie en anemie (ieder 8%). Vijf patienten (6%) hadden ‘immune-effector cell’ gerelateerde bijwerking; allen graad 1-2. Een ‘serious adverse event’ (SAE) kwam bij 47% van de patienten voor; er trad geen fatale toxiciteit op (Budde et al., Lancet Oncol 2022).
Referenties
Bewijskracht van de literatuur Level 2, beperkt
Overwegingen:
De effectiviteit van bispecifieke antistoffen is veelbelovend, zeker bij patiënten met hoog risico factoren zoals een snel recidief na eerdere imuunochemotherapie. Hoewel er geen directe vergelijking gemaakt is met standaard behandeling, is de effectiviteit in deze patiëntcategorie zeer waarschijnlijk beter dan de andere therapie opties die voorhanden zijn (zoals chemo-immunotherapie en ‘targeted drugs’ als idelalisib). Vanwege de relatief korte follow-up van deze studie is er nog onvoldoende zekerheid over de duurzaamheid van de respons. Ook over de kosten-baten balans van deze kostbare behandeling is nog onvoldoende bekend om de optimale plek in de behandelsequentie te kunnen duiden.
Vooralsnog acht de werkgroep behandeling met bispecifieke antistoffen dan ook vooral geïndiceerd voor patiënten met hoog risicofactoren zoals refractaire ziekte of eerder snelle progressie na immuno chemotherapie (POD24).
CAR T cel therapie (uitgangsvraag 9)
Uitgangsvraag:
Wat is de plaats van behandeling met CAR T cellen in de behandeling van FL?
Aanbeveling(en):
CAR T cel therapie is geïndiceerd als behandeling van R/R FL in de derde lijn en verder, vooral voor patiënten met ‘hoog risico’ factoren zoals eerdere POD24 en dubbelrefractoriteit (anti-CD20 antistof en alkylerende therapie), mits vergoed.
Inleiding:
De introductie van CAR T- cel therapie heeft de vooruitzichten voor patiënten met B cel maligniteiten, voor hen die al vele lijnen behandeling hebben ondergaan, enorm verbeterd. Recent zijn de eerste resultaten gepubliceerd over de effectiviteit van CAR-T cel behandeling in FL.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
|
B |
CAR-T cel therapie is effectief in R/R FL in de derde lijn en verder, ook bij hoog risicofactoren zoals POD24 en dubbelrefractoriteit (Fowler et al., Nat Med 2022; Jacobsen et al., Lancet Oncol 2022). |
|
|
c |
Vanwege het ontbreken van vergelijkende studies en de nog korte follow-up, lijkt behandeling vooralsnog voorbehouden aan patiënten met hoog risico FL (expert concensus) |
|
Samenvatting literatuur:
Resultaten
De resultaten van twee fase II studies zijn gepubliceerd: de ZUMA-5 studie (met Axicabtagene ciloleucel, Axicel) en de ELARA studie (Tisagenlecleucel, Tisacel).
In de ZUMA-5 studie werden 153 patiënten geïncludeerd met R/R FL en MZL die tenminste 2 eerder behandelingen hadden ondergaan (inclusief een anti-CD20 antistof en alkylerende therapie). Na leukaferese ondergingen patiënten conditionerings behandeling met cyclofosfamide/ fludarabine gevolgd door een eenmalige infusie met CAR-T cellen (2 × 106 per kg).
Ten tijde van de interim analyse, was de ORR (primaire eindpunt) in 86 FL patiënten 94% (CR 79%). Bij een mediane follow-up van 17,5 maanden, was de mediane PFS 39.6 maanden (25.7–NR), met een geschatte PFS2jr van 73 maanden (51,1-86,2) in patienten zonder POD24en 57,3 maanden (41,2-70,4) met POD24.
De meest voorkomende > graad 3 bijwerkingen waren cytopenieën (70%), en infecties (18%). CRS > graad 3 werd gezien bij 7%; neurotoxiciteit > graad 3 bij 19%. SAEs kwamen voor bij 50%. Er overleden 4 patiënten (3%), waarbij bij één patiënt het overlijden toegeschreven werd aan de behandeling (multisystem organ failure) (Jacobsen et al., Lancet Oncol 2022).
In de ELARA studie werden 98 patiënten geïncludeerd met R/R FL die tenminste 2 eerder behandelingen hadden ondergaan (inclusief een anti-CD20 antistof en alkylerende therapie. Na leukaferese ondergingen patiënten conditionerings behandeling met cyclofosfamide/ fludarabine of bendamustine, gevolgd door een eenmalige infusie met CAR-T cellen (n=97; 0,6-6 × 108).
Ten tijde van de interim analyse, was de ORR 86,2% (95% confidence interval, 77.5-92.4) en de CR rate (primaire eindpunt) in 94 FL patiënten 69.1% (95% CI 58.8–78.3%). Bij een mediane follow-up van 16,6 maanden is de geschatte PFS1jr 67% (95% CI, 56–76%).
Binnen 8 weken na infusie was de incidentie van CRS 48.5% (graad ≥3, 0%), neurologische toxiciteit 37.1% (graad ≥3, 3%; de neurologische toxiciteit was voornamelijk hoofdpijn) en ICANS 4.1% (graad ≥3, 1%). Graad > 3 neutropenie kwam voor bij 32% en graad > 3 infecties bij 5,2%. Er waren geen overlijdens t.g.v. de behandeling (Fowler et al., Nature Medicine 2022).
Referenties
Bewijskracht van de literatuur Level 2, consistent
Overwegingen:
De effectiviteit van CAR T cel behandeling is veelbelovend, zeker bij patiënten met hoog risico factoren zoals een snel recidief na eerdere imuunochemotherapie. Hoewel er geen direct vergelijkende studie is, is de effectiviteit van CAR T celtherapie in deze patiëntcategorie zeer waarschijnlijk beter dan de andere therapie opties die voorhanden zijn (zoals chemo-immunotherapie en ‘targeted drugs’ als idelalisib). Om beter zicht te krijgen op deze vraag zijn de uitkomsten van de ELARA studie uitgezet tegen de uitkomsten in een gematcht retrospectief cohort FL patiënten (ReCORD-FL). Deze vergelijking tussen behandeling met tisacel versus standaardbehandeling toonde inderdaad een significante risicoreductie m.b.t. PFS na 1 jaar (HR 0.60 (0.34-0.86)) en zelfs OS (HR=0.2 (0.02-0.38)) (Salles et al., Blood Adv 2022). Hoewel deze data de potentie van CAR T- cel therapie ondersteunen, moet de daadwerkelijke waarde verder onderzocht worden in vergelijke studies en m.b.t. populatie-gebaseerde behandeluitkomsten.
Vanwege de relatief korte follow-up van deze studie is er nog onvoldoende zekerheid over de duurzaamheid van de respons. Ook over de kosten-baten balans van deze kostbare behandeling is nog onvoldoende bekend om de optimale plek in de behandelsequentie te kunnen duiden.
Vooralsnog acht de werkgroep behandeling met CAR T cel therapie dan ook vooral geïndiceerd voor patiënten met hoog risicofactoren zoals refractaire ziekte of eerder snelle progressie na immuno chemotherapie (POD24).
Referenties
Onderhoudsbehandeling rituximab (uitgangsvraag 10)
Uitgangsvraag:
Is onderhoudsbehandeling met rituximab geïndiceerd na inductie behandeling met immunochemotherapie?
Aanbeveling(en):
Inleiding:
Toevoegen van immunotherapie (rituximab) aan chemotherapie heeft de progressievrije overleving na behandeling van het FL en andere laaggradige lymfomen verbeterd. Na verloop van tijd zal zich echter bij nagenoeg alle patiënten een recidief voor doen. Optimalisatie van de behandeling moet dan ook gericht zijn op het verduurzamen van het resultaat van de behandeling. De plaats van onderhoudsbehandeling met rituximab is nog niet definitief vastgesteld.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
Rituximab onderhoud verlengt de PFS na eerstelijnsbehandeling (Vidal et al., Eur J Cancer 2017; Dreyling et al., Ann Oncol 2021; NCCN guidelines 2021) |
|
A |
Rituximab verlengt de PFS en OS na tweedelijnsbehandeling(Vidal et al., Eur J Cancer 2017; Dreyling et al., Ann Oncol 2021; NCCN guidelines 2021) |
|
C |
Er zijn onvoldoende data over onderhoudsbehandeling met rituximab in tweede lijn na eerdere onderhoudsbehandeling met rituximab (expert opinion) |
Samenvatting literatuur:
Resultaten
De PRIMA studie heeft aangetoond dat onderhoudsbehandeling met rituximab gedurende 2 jaar (na een respons op inductie behandeling met immunochemotherapie) resulteert in een aanzienlijk en significant voordeel in progressievrije overleving (na 6 jaar: 42.7% versus 59.2% (p < 0.0001; HR 0.58); na een follow-up van 9 jaar was de mediane PFS 4,1 versus 10,5 jaar (p< 0.001; HR 0.61)). Er kon geen verschil worden aangetoond in algehele overleving; met een geschatte 10-jaars overleving van 80% in beide armen. In deze studie werd rituximab 375 mg/m2 gedurende 2 jaar elke 8 weken gegeven. (Salles et al; Lancet 2011; Bachy et al., J Clin Oncol 2019).
In patienten met recidief/ refractaire ziekte verbeterde rituximab onderhoudsbehandeling, in vergelijking met observatie, de progressievrije overleving (mediaan 3.7 jaar versus 1.3 jaar; HR 0.55; p < .001), zowel na inductiebehandeling met CHOP (HR 0.37; p < .001) als met R-CHOP (HR 0.69; p = .003). De 5-jaars overleving was 74% in de rituximab onderhoudsarm versus 64% in de observatie arm (p = .07) (van Oers et al; J Clin Oncol 2010). In deze studie werd rituximab 375 mg/m2 gedurende 2 jaar elke 12 weken gegeven.
Uit een ‘individual patient data’ (IPD) meta-analyse (2017), waarin naast van twee bovengenoemde studies data van 7 andere studies bij 2315 patiënten met FL werden meegnomen, bleek een progressievrij overlevingsvoordeel en algeheel overlevingsvoordeel voor patiënten die behandeld waren met rituximab onderhoudsbehandeling (HR PFS 0.57, 95% CI 0.51-0.64, HR dood 0.79, 95% CI 0.66-0.96). Het overlevingsvoordeel werd gevonden voor alle groepen (met verschillende ziekte- en patiëntkarakteristieken), maar was twijfelachtig voor patiënten die een respons hadden bereikt op een eerstelijns inductiebehandeling waaraan rituximab was toegevoegd (Vidal et al., Eur J Cancer 2017). Onderhoudsbehandeling gaat overigens wel gepaard met meer graad 3 en 4 toxiciteit (HR 1.31, 95% CI 1.08-1.58) en een verhoogd risico op infecties (HR 1.41, 95% CI1.20-1.66), met ook een duidelijke toename in graad 3 en 4 infectieuze complicaties (HR 1.548, 95% CI1.04-2.11).
In een recente studie waarin patiënten na eerstelijnsbehandeling met immunchemotherapie gerandomiseerd werden tussen standaard onderhoudsbehandeling gedurende 2 jaar en versus een respons-gestuurde onderhoudsbehandeling (o.b.v. FDG-PET respons en MRD bepaling) liet een betere PFS3jr zien voor standaard onderhoudsbehandeling in vergelijking met een responsgestuurde benadering (86% v 72%; P < .001) (Luminari et al., J Clin Oncol 2022).
Naast de bovengenoemde schema’s werden in de studies die meegenomen zijn in deze analyse ook drieandere rituximab onderhoudsschema’s toegepast; nl. wekelijkse rituximab giften gedurende 4 weken, op 3 en 9 maanden na afronden van de inductiebehandeling, ofwel elke 6 maanden gedurende 2 jaar; en 4 tweemaandelijkse giften. Er zijn geen vergelijkende studies tussen deze onderhoudsschema’s verricht.
Referenties
Bewijskracht van de literatuur Level 1, consistent
Overwegingen:
Hoewel onderhoudsbehandeling met rituximab de progressievrije overleving na behandeling met immunochemotherapie zowel in de eerste lijn als in latere lijnen in belangrijke mate verbetert, is voor onderhoudsbehandeling in de eerste lijn nog geen onomstoten overlevingsvoordeel aangetoond. Mogelijk is progressie van ziekte na een eerdere remissie niet altijd van direct klinisch belang en is tweedelijns behandeling effectief genoeg, maar het kan ook zijn dat de follow-up in de gepubliceerde studies nog te kort is (meestal enkele jaren) in verhouding tot de goede overleving van deze patientengroep (in tegenstelling tot de overleving na behandeling in tweede of latere lijn).
M.b.t. kosteneffectiviteit heeft ’the National Instutute for health and Clinical Excellende’ (NICE) in Groot-Brittanië rituximab onderhoudsbehandeling na eerstelijns inductiebehandeling op grond van de data van de PRIMA studie aanbevolen, met als aantekening dat een degelijke beoordeling vooralsnog niet helemaal goed mogelijk is i.v.m. onrijpheid van de data (Greenhalgh et al., Pharmacoeconomics 2013).
Het voordeel van onderhoudsbehandeling met rituximab is vastgesteld na inductiebehandeling met rituximab monotherapie en chemotherapie (FC(M), CVP en CHOP), al dan niet in combinatie met rituximab. Er zijn nog geen prospectieve en gerandomiseerde data gepubliceerd over de voor- en nadelen van rituximab onderhoudsbehandeling na bendamustine i c.m. rituximab. Preliminaire data van de GALLIUM studie geven enige zorg vanwege mogelijke oversterfte in patiënten behandeld met bendamustine i.c.m. een anti-CD20 antistof (Hiddeman et al., J Clin Oncol 2018). Voorlopig is dan ook voorzichtigheid geboden.
De werkgroep is dan ook van mening dat onderhoudsbehandeling na eerstelijns inductie behandeling op individuele basis overwogen moet worden. De patiënt voorkeuren m.b.t. tot de voor- en nadelen spelen hierin een belangrijke rol. Indien in de eerste lijn is afgezien van onderhoudsbehandeling, beveelt de werkgroep onderhoudsbehandeling in de tweede lijn, vanwege het aangetoonde overlevingsvoordeel, sterk aan.
Er zijn geen vergelijkende studies verricht tussen de verschillende onderhoudsschema’s. Een recente studie heeft wel aangetoond dat een langdurig onderhoudsschema (tot maximaal 5 jaar), geen voordeel biedt in vergelijking met een kortere behandeling (8 maanden) m.b.t. ‘event free survival’ en overleving (Taverna et al.. J Clin Oncol 2016; Moccia et al., Blood Adv 2020). Ook de eerste uitkomsten van gerandomiseerde studie in patiënten met iNHL in PR/CR na eerstelijnsbehandeling met CIT tonen geen verschil in PFS tussen rituximab onderhoud (s.c.) gedurende 2 jaar versus onderhoud tot aan progressie (MABCUTE trial, Rule et al., EHA 2019). De werkgroep adviseert de tot op heden in studies meest toegepaste schema’s te gebruiken; d.w.z twee- of driemaandelijkse giften (375 mg/m2) gedurende 2 jaar (Salles et al., Lancet 2011 en ASH 2013; van Oers et al., J Clin Oncol 2010). Hoewel in de studies in de eerste lijn voornamelijk gebruik is gemaakt van het tweemaandelijkse schema, is het voordeel dat behaald is met het driemaandelijks schema na tweedelijnsbehandeling vergelijkbaar. Het is daarom aannemelijk dat de effectiviteit van deze schema’s elkaar niet veel ontloopt.
Andere openstaande vragen waarop in toekomstige studies een antwoord moet worden gevonden zijn: kan de keuze voor onderhoudsbehandeling gestuurd worden door bekende klinische risicofactoren en kan de onderhoudsbehandeling aangepast worden aan de hand van ‘minimal residual disase’ (MRD) gegevens tijdens/na de behandeling?
Referenties
Autologe stamceltransplantatie (uitgangsvraag 11)
Uitgangsvraag:
Wat zijn de indicaties voor autologe stamceltransplantatie in FL?
Aanbeveling(en):
Het indicatiegebied van autologe stamceltransplantatie binnen de behandeling van FL is beperkt.
Hoge dosis chemotherapie + autologe stamceltransplantatie dient overwogen te worden bij gerecidiveerd FL, vooral na reïnductiebehandeling van een recidief dat binnen 2 jaar na immunochemotherapie (minimaal R-CVP) is opgetreden.
De optimale timing van autologe stamceltransplantatie is na/ ter consolidatie van het eerste of tweede recidief, omdat het voordeel, vooral m.b.t. PFS, afneemt na 3 of meer eerdere behandelingen.
Verdere argumenten voor autologe stamceltransplantatie:
Inleiding:
Er zijn voor het FL verschillende behandelmogelijkheden voorhanden, ook voor een recidief. De verwachting is bovendien dat meerdere nieuwe middelen binnenkort een plaats in de behandeling zullen krijgen. Dat maakt dat de toepassing van stamceltransplantatie (autoloog of allogeen) nauwkeurig overwogen moet worden. Beschikbare biologische en genetische risicofactoren zijn onvoldoende om de keuze richting autoloog of allogeen te sturen; de keuze hangt af van patiëntkarakteristieken en klinisch beloop, en moet op individuele basis gemaakt worden.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Autologe stamceltransplantatie is zinvol bij recidief FL vooral binnen 2 jaar na R-chemo (Jimenez et al., Hematol Oncol 2018 ; Jurinovic et al., Biol Blood Marrow Transplant 2018; Manna et al., Leuk Lymphoma 2019; Montoto et al., Haematologica 2013; Dreyling et al., Ann Oncol 2016) |
Samenvatting literatuur:
Resultaten
De meeste literatuur over consolidatie met hoge dosis chemotherapie en autologe stamceltransplantatie stamt uit het pre-rituximab tijdperk. Indertijd werd een duidelijk voordeel met betrekking tot progressievrije en algehele overleving gezien bij consolidatie en autologe stamceltransplantatie van het eerste recidief (Schouten et al., J Clin Oncol 2003). Tegenwoordig zijn echter alle patiënten die in aanmerking komen voor autologe SCT voorbehandeld met rituximab. De studie van Alig et al toonde ook nu nog geen survivalvoordeel aan van autologe SCT in eerste lijn, zelfs bij hoog risico groepen. (Alig S. et al., Blood Adv 2020)
Jurinovic et al rapporteren een duidelijk toegenomen 5 jaars tweede progressie vrije overleving van 51% mét, en 19% zonder autologe SCT, en een 5 jaars overall survival van respectievelijk 77 en 59% bij patiënten met een progressie van het folliculaire lymfoom binnen twee jaar na eerstelijns behandeling (Jurinovic et al., Biol Blood Marrow Transplant 2018). Manna vindt bij analyse van de Canadese registry data eenzelfde voordeel (Manna et al., Leuk Lymphoma 2019). Jimenez rapporteert zelfs een plateau op 50% in de zeven jaars progressievrije overlevingscurve na autologe SCT in deze groep wanneer in complete remissie na re-inductie, in een analyse van de Spaanse lymfoom registratie (Jimenez-Ubieto A et al., Hematol Oncol 2018)
Deze voordelen zijn alleen gezien bij autologe SCT na progressie binnen twee jaar na eerste lijns behandeling. Meerdere groepen rapporteren minder voordeel van autologe SCT indien er al (meer dan) 3 voorbehandelingen zijn gegeven (afname PFS met 20%; Evens et al., Cancer 2013; Vose et al., Biol Blood marrow Transplant 2008). Bij minder dan 3 voorbehandelingen kan een 5 jrs PFS tot 70% worden bereikt. Casulo ziet bij analyse van de LymphoCare Study en CIBMTR met name overlevings winst als de autologe SCT wordt toegepast binnen een jaar na de snelle progressie (binnen twee jaar na chemo immunotherapie) (Casulo et al., Biol Blood Marrow transplant 2018).
De ESMO richtlijn geeft de aanbeveling om autologe SCT toe te passen bij recidief na kortdurende remissie of resistente ziekte na een rituximab-bevattend schema (Dreyling et al. Ann Oncol 2021).
In het EBMT consensus project, opgezet om de lacune t.g.v. het ontbreken van relevante literatuur te vullen, is de consensus dat autologe consolidatie in eerste lijn bij FL geen plaats heeft buiten studieverband. Zij adviseren hoge dosis chemotherapie en autologe SCT als consolidatie na re-inductie behandeling van een eerste of later recidief, vooral bij hoge FLIPI of korte eerdere remissieduur na een R-chemotherapie bevattend schema (Montoto et al., Haematologica 2013).
De beste studie m.b.t. de vergelijking tussen allogene en autologe SCT voor patiënten met een relaps binnen twee jaar na chemo-immunotherapie is van Smith et al, een CIBMTR analyse (Smith et al., Cancer 2018). Zij vonden een significant betere vijf jaars overleving voor de autoloog getransplanteerde patiënten en allogene getransplanteerde patiënten met een sibling donor, dan voor de allogeen getransplanteerde patiënten met een matched unrelated donor (resp 70, 73 en 49%), hetgeen veroorzaakt door een hogere NRM in de laatste groep. De autoloog getransplanteerden tonen een lagere NRM maar hogere relapse dan de allogeen getransplanteerden met sibling donor. In het EBMT consensus project is de consensus dat er bij FL, in tegenstelling tot bv bij AML, geen biologische of genetische factoren zijn die de beslissing tot type SCT kunnen leiden, en dat deze nog steeds op individuele basis genomen moet worden (Montoto et al., Haematologica 2013; Casulo et al., Blood 2019).
Referenties
Bewijskracht literatuur Level 2, redelijk consistent
Overwegingen:
Consolidatie met hoge dosis chemotherapie gevolgd door autologe SCT blijft een optie voor de patiënt met korte remissie na behandeling met R-chemotherapie. Hierbij moet het risico op secundaire maligniteiten (2 tot 5% bij niet TBI bevattende schema’s) worden meegewogen. Welke plaats autologe SCT de komende jaren krijgt t.o.v. alle nieuwe therapeutische mogelijkheden is nog onduidelijk. Wat betreft kosten zal autologe SCT in vele gevallen niet duurder zijn dan een alternatieve therapie met een nieuw middel.
Indien men een keuze wil maken tussen autologe en allogene consolidatie is met name het aantal voorbehandelingen van belang: vanaf 3 eerdere behandellijnen lijkt autologe consolidatie minder effectief. Heeft iemand snel weer een tweede behandeling nodig dan kan met autologe consolidatie een 5 jrs PFS tot respectievelijk 87% en 70% worden bereikt, waarbij de overlevingscurves van meerdere series na verloop van tijd een plateau laten zien, hetgeen betekent dat een deel van de patiënten mogelijk gecureerd kan worden.
Allogene stamceltransplantatie (uitgangsvraag 12)
Uitgangsvraag:
Wat zijn de indicaties voor allogene stamceltransplantatie in FL?
Aanbeveling(en):
Het indicatiegebied van allogene stamceltransplantatie binnen de behandeling van FL is beperkt.
Allogene stamceltransplantatie kan in de behandeling van FL worden toegepast na meerdere (2x of meer) recidieven, vooral deze zich voor doen binnen 2 jaar na immunochemotherapie.
Argumenten voor allogene stamceltransplantatie:
Inleiding:
Er zijn voor het FL verschillende behandelmogelijkheden voorhanden, ook voor een recidief. De verwachting is bovendien dat meerdere nieuwe middelen binnenkort een plaats in de behandeling zullen krijgen. Dat maakt dat de toepassing van stamceltransplantatie (autoloog of allogeen) nauwkeurig overwogen moet worden. Beschikbare biologische en genetische risicofactoren zijn onvoldoende om de keuze richting autoloog of allogeen te sturen; de keuze hangt af van patiëntkarakteristieken en klinisch beloop, en moet op individuele basis gemaakt worden.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Allogene stamceltransplantatie moet worden overwogen voor FL bij meerdere (2x of meer) recidieven, vooral binnen 2 jaar na immunochemotherapie en als autologe stamceltransplantatie geen of een minder goede optie is door uitgebreide voorbehandeling of resistente ziekte (Montoto et al, Haematologica 2013; Bhatt et al., Exp Opinion Biol Ther 2016; Dreyling et al., Ann Oncol 2016) |
Samenvatting literatuur:
Resultaten
Meerdere publicaties rapporteren het effect van allogene consolidatie in sterk voorbehandelde FL patiënten of patiënten met een zeer korte remissieduur na immunochemotherapie bevattende schema’s. Dit effect wordt zelfs gezien bij resistente ziekte vóór allogene SCT. Er is geen voordeel van myelo-ablatieve conditionering boven reduced intensitiy conditionering; vanwege de kleinere kans op toxiciteit heeft de laatste de voorkeur, óók omdat deze toepasbaar is bij de oudere patient (EBMT consensus; Montoto et al., Haematologica 2013, Bhatt et al., Exp Opinion Biol Ther 2016).
Desalniettemin worden in verschillende series sterk uiteenlopende resultaten gemeld. Na reduced intensity conditionering kan een 3-jaars overleving van 32 tot 66% gezien worden (Vigoroux et al.,Haematologica 2007), maar een 5-jaars overleving tot 85% is ook beschreven (Khouri et al., Blood 2008). De uitkomsten zijn sterk afhankelijk van het aantal voorbehandelingen, chemotherapie-resistentie en de conditie van de patiënt.
De plaats van allogene SCT blijft een punt van discussie. In het EBMT consensus project werd overeenstemming bereikt over de plaats van allogene consolidatie bij recidief FL na autologe SCT maar niet over de rol van allogene SCT als geen eerdere autologe SCT had plaatsgevonden. De ESMO guideline beveelt allogene SCT aan voor FL patiënten met een zeer hoog risico, of recidief na autologe SCT, met name bij korte remissieduur en zeer resistente ziekte (beiden niet duidelijk gedefinieerd) (Dreyling et al., Ann Oncol 2016).
Er zijn geen studies gepubliceerd waarin autologe en allogene SCT in FL direct zijn vergeleken. De enige poging daartoe werd voortijdig afgebroken i.v.m. onvoldoende accrual (Tomblynn et al., Biol blood Marrow Transplant 2011). De beste studie m.b.t. de vergelijking tussen allogene en autologe SCT voor patiënten met een relaps binnen twee jaar na chemo-immunotherapie is van Smith et al, een CIBMTR analyse (Smith et al., Cancer 2018). Zij vonden een significant betere vijf jaars overleving voor de autoloog getransplanteerde patiënten en allogene getransplanteerde patiënten met een sibling donor, dan voor de allogeen getransplanteerde patiënten met een matched unrelated donor (resp 70, 73 en 49%), hetgeen veroorzaakt door een hogere NRM in de laatste groep. De autoloog getransplanteerden tonen een lagere NRM maar hogere relapse dan de allogeen getransplanteerden met sibling donor.
Referenties
Bewijskracht literatuur Level 2, consistent
Overwegingen:
Allogene consolidatie kan, ondanks aanzienlijke ‘non-relapse mortality’ (NRM) en morbiditeit, toch leiden tot langdurige ziektevrije overleving bij FL met zeer slechte ziekte-eigenschappen zoals resistente ziekte, korte remissieduur of meerdere voorbehandelingen. De beste resultaten worden wel behaald bij jongere patiënten met weinig bijkomende risicofactoren en chemosensitieve ziekte, maar dankzij een duidelijk ‘graft versus lymfoom’ effect kan allogene SCT ook bij resistente ziekte nog uitkomst bieden. Indien in de toekomst strategieën ontwikkeld kunnen worden die tot minder ‘graft versus host’ ziekte leiden met behoud van het ‘graft versus lymfoom’ effect kan het voordeel van allogene SCT hoger uit gaan vallen. Bovendien kan allogene SCT tot curatie leiden, terwijl dit na autologe SCT nog niet overtuigend is aangetoond.
‘Reduced intensity conditionering’ (RIST) heeft de voorkeur; voor myeloablatieve conditionering is geen plaats meer. Dit laatste leidt wel tot minder recidieven, maar geeft geen voordeel wat betreft de overleving, waarschijnlijk door de lagere ’treatment related mortality’ (TRM) van RIST (10-15%). Dit terwijl de RIST in het algemeen ook nog bij fysiek minder fitte patienten wordt toegepast.
De plaats van allogene SCT blijft een punt van discussie. In het EBMT consensus project werdovereenstemming bereikt over de plaats van allogene consolidatie bij recidief FL na autologe SCT maar nietover de rol van allogene SCT als geen eerdere autologe SCT had plaatsgevonden. De ESMO guideline beveelt allogene SCT aan voor FL patiënten met een zeer hoog risico, of recidief na autologe SCT, met name bij korte remissieduur en zeer resistente ziekte (beiden niet duidelijk gedefinieerd) (Dreyling et al., Ann Oncol 2016).
In het EBMT consensus project is de consensus dat er bij FL, in tegenstelling tot bv bij AML, geen biologische of genetische factoren zijn die de beslissing tot type SCT kunnen leiden, en dat deze nog steeds op individuele basis genomen moet worden (Montoto et al., Haematologica 2013; Casulo et al., Blood 2019).
Indien men een keuze wil maken tussen autologe en allogene consolidatie is met name het aantal voorbehandelingen van belang: vanaf 3 eerdere behandelingen lijkt autologe consolidatie minder effectief. Ook bij resistente ziekte voor SCT lijkt de keuze voor allogene SCT gezien het te verwachten ‘graft versus lymfoom’effect meer voor de hand liggend. Bij recidief na eerdere autologe SCT is allogene SCT nog een optie die langere ziektevrije overleving kan geven.
Recent zijn de eerste resultaten gepubliceerd van studies met bispecifieke antistoffen en CD19 CAR T cellen bij patienten met recidief/refractair FL (zie ook boven). Deze behandelingen kennen soms ernstiger acute toxiciteit, maar hebben veel minder toxiciteit op de langere termijn en hebben als voordeel dat de patiënt niet in remissie hoeft te zijn voor succesvolle behandeling (bij CAR T celtherapie). Bij beide modaliteiten is er nog geen plateau in de progressievrije overlevingscurves gezien (er is geen curatief potentieel aangetoond); dientengevolge kunnen zij de plaats van allogene SCT niet zeker innemen.
Referenties
Obinutuzumab (uitgangsvraag 13)
Uitgangsvraag:
Wat is de plaats van obinutuzumab in de behandeling van FL?
Aanbeveling(en):
In eerstelijns behandelschema’s is het vervangen van rituximab door obinutuzumab niet standaard aanbevolen.
Voor rituximab refractaire patiënten is obinutuzumab i.c.m. bendamustine gevolgd door obinutuzumab onderhoudsbehandeling geïndiceerd, vooral wanneer rituximab gegeven werd in combinatie met chemotherapie.
Inleiding:
Er is onderzocht of nieuwe anti-CD20 antistoffen zoals obinutuzumab de uitkomsten voor FL patiënten kunnen verbeteren, zowel in de eerste lijn als bij refractaire ziekte.
De vooruitzichten voor patiënten met een rituximab refractair FL zijn beperkt. Voor de behandeling in deze setting zijn bendamustine en idelalisib geregistreerd. Beiden middelen hebben een redelijk responspercentage (50-70%), met een beperkte PFS van 9-12 maanden. Vooral voor deze patiëntengroep is er dus duidelijk ruimte voor verbetering van de behandeling.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
Obinutuzumab is in eerstelijns immunochemotherapie schema’s effectiever m.b.t. PFS, maar leidt tot meer toxiciteit (Marcus et al. N Engl J Med 2017) |
|
A |
Obinituzumab + bendamustine is effectief voor rituximab refractaire patiënten (Sehn et al., Lancet Oncol 2016, update Cheson et al., Abstract 615 ASH 2016). |
Samenvatting literatuur:
Resultaten
In de GALLIUM studie is onderzocht of het toevoegen van obinutuzumab aan standaard chemotherapie in vergelijking met rituximab tot een langere progressievrije overleving leidt zonder toename van toxiciteit (Marcus et al., N Eng J med 2017). In deze studie werden 1202 patienten met een eerste behandelindicatie voor FL gerandomiseerd tussen obinutuzumab-chemotherapie en rituximab-chemotherapie gevolgd door 2 jaar onderhoudstherapie met obinutuzumab of rituximab. Chemotherapie bestond uit CVP, CHOP of bendamustine, vastgesteld per site, waarbij meer dan de helft van de patiënten bendamustine kreeg.
Obinutuzumab-chemotherapie resulteerde in vergelijking met rituximab-chemotherapie weliswaar in een gelijke ORR (88,5 % versus 86,9%), maar wel in een betere PFS3jr (80 versus 73%). Bij de relatief nog korte follow-up duur (ca 4,5 jaar) was er geen verschil in OS.
In de obinutuzumab-chemotherapie werd wel meer toxiciteit zien (AE gr 3-5: 74.6% versus 67.8%; SAE: 46.1 versus 39.9% en dood t.g.v. toxiciteit 4 versus 3.4%). Graad 3-5 AEs die meer werden gezien in de obinituzumab arm waren: neutropenie (45.9 versus 39.5%), infecties (20 versus 15.6%), IRR (12.4 versus 6.7%) en secundaire maligniteiten 4.7 versus 2.7%).
De GADOLIN studie heeft de waarde van obinutuzumab toegevoegd aan bendamustine (GB) gevolgd door obinutuzumab onderhoudsbehandeling, versus bendamustine (B) monotherapie, onderzocht bij rituximab refractaire patiënten met een indolent NHL. De responspercentages (CR en PR) na inductiebehandeling waren vergelijkbaar; GB 69% versus B 63%. De progressievrije overleving was echter significant langer na combinatie behandeling (GB; 25 maanden) dan na monotherapie (B; 14 maanden) (Sehn et al., Lancet Oncol 2016). Een update van de resultaten van de GADOLIN studie bleek naast het voordeel in PFS ook een significant overlevingsvoordeel voor GB t.o.v. B zien (Cheson et al., J Clin Oncol). Er was licht toegenomen toxiciteit in de experimentele arm in vergelijking met bendamustine monotherapie (68% versus 62%); deze additionele toxiciteit bestond vooral uit cytopenieën en infusie gerelateerde reacties.
Referenties
Bewijskracht van de literatuur Level 2, consistent
Overwegingen:
Obinutuzumab-chemotherapie in de eerste lijn lijkt t.o.v. rituximab chemotherapie voordeel te geven m.b.t. PFS, maar wel tegen een prijs van meer toxiciteit (waaronder meer secundaire maligniteiten en overlijden t.g.v. toxiciteit). Post-hoc analyses van deze studies hebben aangetoond, dat dit voordeel van obinutuzumab boven ritxumab geldt voor alle chemotherapieschema’s, maar vooral voor de grootste groep patiënten in deze studie die met bendamustine werden behandeld. De groepen die met de in Nederland gebruikte schema’s CHOP en R-CVP waren (aanzienlijk) kleiner (Hiddenman et al., J Clin Oncol 2018). Andere secundaire analyses hebben aangetoond dat het percentage MRD-negatieve patienten aan het einde van de inductie behandeling hoger is in de obinutumab arm (92.6 versus 85.2%; Pott et al., Blood 2018) en er minder patiënten vroege ziekteprogressie (POD24) tonen (10.1 versus 17.4%; Seymour et al., Haematologica 2019). M.b.t. de veiligheid, is een opvallende bevinding in deze studie dat graad 3-5 infecties en fatale toxiciteit meer gezien werden bij patiënten die met bendamustine behandeld waren, en dan vooral tijdens de onderhoudsfase (en meer i.c.m. obinutuzumab dan met rituximab). Een andere kwestie is of het verschil in effectiviteit niet toegeschreven kan worden aan de cumulatieve dosering van de antistof die patiënten kregen toegediend; zowel de dosering als het aantal giften van obinutuzumab was hoger dan die van rituximab.
Omdat het vooralsnog onvoldoende duidelijk is welk voordeel obinutuzumab biedt i.c.m. de in Nederland gebruikte schema’s CVP en CHOP, omdat er vooralsnog geen voordeel m.b.t. OS is, de grotere toxiciteit (waaronder ook ernstige toxiciteit) en hogere kosten, is de werkgroep van mening dat er onvoldoende grond is toevoeging van obinutuzumab aan chemotherapie als standaardbehandeling aan te bevelen.
In de studie in refractaire FL patiënten is geen direkte vergelijking gemaakt tussen obinutuzumab en rituximab; ook ontbrak in de controle arm onderhoudsbehandeling. Het is niet uitgesloten dat in deze, weliswaar formeel rituximab-refractaire, groep rituximab toch enigzins effectief is. Vanwege de slechte vooruitzichten voor patiënten met rituximab refractaire ziekte is de werkgroep van mening dat obinutuzumab i.c.m. bendamustine geïndiceerd is voor deze specifieke groep. Geadviseerd wordt wel de voorbehandeling mee te wegen in de besluitvorming, omdat het voordeel van obinutuzumab mogelijk minder duidelijk is indien de patiënt alleen refractair is gebleken op op ritxumab monotherapie.
Referenties
Biosimilars rituximab
Conform het standpunt van de FMS (https://www.demedischspecialist.nl/onderwerp/biosimilars), en voor wat betreft studies onder de voorwaarden van de HOVON lymfoomwerkgroep, kunnen biosimilars van rituximab gebruikt worden in de behandeling van FL. Waar in deze richtlijn dus in behandelschema’s rituximab wordt genoemd, kan er ook gebruik gemaakt worden van geregistreerde biosimilars.
Rituximab subcutaan
Subcutane toediening van rituximab (1400 mg flat dose) leidt niet tot afname van effectiviteit of toename van toxiciteit (Salar et al., J Clin Oncol 2014; Davies et al., Lancet 2014 en ASH 2016). Ondanks iets meer lokale bijwerkingen zoals lokaal erytheem, pijn t.p.v. de injectieplaats, en rash, is patiënt-tevredenheid groter over de subcutane toediening en heeft deze wijze van toediening de voorkeur van de meeste patiënten (Rummel et al., Ann Oncol 2017).
Voor het ziekenhuis zijn er de voordelen van kortere behandeltijd en geringer gebruik van personeel (de Cock et al., PLoS One 2016); hetgeen ook tot lagere kosten zal leiden (Ponzetti et al., Clinicoecon Outcomes Res 2016). Met het verlopen van het patent op rituximab zijn biosimilars van rituximab ter beschikking gekomen. Vanwege de lagere prijs van deze biosimilars is het niet uitgesloten dat het kostenvoordeel van het subcutane preparaat van rituximab geen stand zal houden. Er zijn geen biosimilars die subcutaan kunnen worden toegediend.
Referenties
Er zijn geen gerandomiseerde studies gedaan naar de beste behandeling voor het getransformeerde FL (tFL). De beschikbare gegevens zijn verkregen uit retrospectieve studies en prospectieve cohortstudies.
De overwegingen en aanbevelingen m.b.t. de behandeling van het tFL zijn hieronder nader uitgewerkt.
Behandeling tFL
Situatie 1: de patiënt is niet eerder behandeld voor het FL
Inductie met rituximab-CHOP-21, 6x gevolgd door 2 x rituximab, hierbij de richtlijn voor de eerstelijns behandeling van DLBCL volgend.
Hier geldt dat autologe stamceltransplantatie als consolidatie geen overlevingsvoordeel geeft, alleen een langere progressie-vrije overleving. Indien een goede remissie wordt bereikt na R-CHOP hoeft deze dus niet gevolgd te worden door een consolidatie met autologe stamceltransplantatie (Da Villa et al., J Clin Oncol 2013; Chin et al., Br J Haematol 2020).
Argumenten om eventueel wel te consolideren met hoge dosis chemotherapie en autologe stamceltransplantatie zijn: als rituximab niet gegeven kan worden in verband met toxiciteit of allergie (gezien het voordeel van autologe SCT in het pre-rituximab tijdperk).
Er is geen onderzoek gedaan naar de rol van rituximab onderhoudsbehandeling in deze setting. Dit wordt, conform de richtlijnen voor de behandeling van het DLBCL, niet aanbevolen in de eerste lijn.
Situatie 2: de patiënt is eerder behandeld voor het FL
Inductie met R-CHOP-21 6x (of R-DHAP/R-VIM/R-DHAP indien patiënt al R-CHOP heeft gekregen), gevolgd door consolidatie met een autologe stamceltransplantatie.
Indien er geen stamcellen gemobiliseerd kunnen worden, of er contraïndicaties zijn voor autologe stamceltransplantatie (leeftijd, orgaandysfunctie), kan een expectatief beleid worden gevoerd na bereiken van een complete remissie. Overweeg in deze situatie een allogene stamceltransplantatie indien voorbehandeling al zeer uitgebreid was (Ida et al., Hematol Oncol 2021).
Situatie 3: de patiënt is refractair op inductie met R-CHOP of R-DHAP.
Autologe stamceltransplantatie is voor deze patiënten de enige kans op langduriger overleving. Wel dient dan eerst salvage therapie te worden gegeven om een remissie te bereiken. Hier moet inclusie in lopende studies overwogen worden, bijvoorbeeld met CAR-T cellen. Met CD19 CAR T cellen zijn CR rates van 54% bereikt, met een overall survival op 18 maanden van 52% (Neelapu et al., NEJM 2017).
Referenties
Autologe stamceltransplantatie tFL (uitgangsvraag 14)
Uitgangsvraag:
Wat is de rol van autologe stamceltransplantatie bij de behandeling van getransformeerd FL (tFL)?
Aanbeveling(en):
Autologe stamceltransplantatie dient te worden toegepast na succesvolle inductie bij alle patiënten met tFL die in het verleden al voorbehandeling hebben gehad voor het FL.
Autologe stamceltransplantatie kan bij patiënten zonder eerdere voorbehandeling voor het FL ook overwogen worden; vooral als geen rituximab kan worden gegeven, of bij patiënten die refractair zijn op inductie therapie voor tFL (maar wel gerespondeerd hebben op salvage behandeling).
Autologe stamceltransplantatie kan in de tweede lijn van de behandeling van tFL worden toegepast als de patiënt recidiveert en eerder geen autologe stamceltransplantatie heeft ondergaan.
Inleiding:
Er zijn geen gerandomiseerde studies gedaan naar de beste behandeling voor tFL, slechts retrospectieve studies en prospectieve cohortstudies. In het verleden zochten velen hun toevlucht tot consolidatie met hoge dosis chemotherapie en autologe stamceltransplantatie om de zeer matige overleving na chemotherapie alleen te verbeteren. Sinds het toevoegen van rituximab aan de inductiebehandeling van tFL is de prognose verbeterd. De plaats van autologe SCT in de behandeling van tFL moet daarom zorgvuldig bepaald worden.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Autologe stamceltransplantatie verbetert de uitkomst na succesvolle inductie bij alle patiënten met tFL met een eerdere behandeling voor FL (Ban Hoeffen et al., Br J Haematol 2013; Sarkozy et al.; J Clin Oncol 2016) |
|
B |
Autologe stamceltransplantatie verbetert de uitkomst van patiënten met tFL zonder eerdere behandeling voor FL, vooral in geval rituximab niet kan worden geven (expert opinion (Casulo); daVilla et al., J Clin Oncol 2013; Ban Hoeffen et al., Br J haematol 2013; Eide et al., Br J Haematol 2011) |
|
C |
Autologe stamceltransplantatie verbetert de uitkomst van patiënten die refractair zijn op inductie therapie maar in remissie na salvage (R-) chemotherapie (expert opinion) |
|
C |
Autologe stamceltransplantatie verbetert de uitkomst bij recidief tFL na re–inductie als eerder geen autologe stamceltransplantatie is gegeven (expert opinion) |
Samenvatting literatuur:
Resultaten
tFL patiënten die eerder voor het FL zijn hebben een slechtere uitkomst dan therapie-naïeve patienten (Lerch et al., Ann Hematol 2015). Up-front autologe stamceltransplantatie na inductiebehandeling van het tFL, kan de negatieve prognostische invloed van de eerdere behandeling doen verdwijnen; een 2 jaars OS van 83%, onafhankelijk van voorbehandeling, is in deze patieëntengroep beschreven (Ban Hoeffen et al., Br J Haematol 2013; Sarkozy et al.; J Clin Oncol 2016).
Hoewel er geen studies zijn die immunochemotherapie wél of niet gevolgd door ‘upfront’ autologe SCT met elkaar vergelijken bij patiënten die niet eerder behandeld werden voor het FL, kan autologe SCT in deze situatie wel overwogen worden (expert opinion, Casulo et al., Blood 2015; daVilla et al., J Clin Oncol 2013). Da Villa et al. hebben een beperkt voordeel m.b.t. progressievrije overleving (5 jaars PFS 55% na autoloog en 40% na immunochemotherapie alleen) gerapporteerd, maar het voordeel voor algehele overleving is, hoewel significant, niet indrukwekkend (5 jaars OS 65% na autoloog en 61% na immunochemotherapie alleen). Ook Chin et al. konden niet duidelijk genoeg voordeel op de overleving aantonen (Chin et al., Br J Haematol 2020).
Vooral als rituximab niet gegeven kan worden in de inductie behandeling moet up-front transplantatie overwogen worden, aangezien autologe SCT wel een duidelijk overlevings voordeel gaf in het pre-rituximab tijdperk (Eide et al., Br J Haematol 2011).
Er is nog geen bewijs dat toevoeging van radio-immunotherapie aan de conditionering voor autologe stamceltransplantatie de overleving verhoogt.
Referenties
Bewijskracht literatuur 2, consistent
Overwegingen:
Vanwege het beperkte voordeel bij patiënten die nooit eerder behandeld zijn voor het FL, is de werkgroep van mening dat er in principe geen plaats is voor autologe SCT in deze populatie. Het kan wel overwogen worden als rituximab niet kan worden gegeven in de inductie behandeling wegens toxiciteit. Omdat up-front autologe SCT het negatieve effect van eerdere behandeling van het FL op de overleving lijkt op te heffen, is autologe SCT voor deze patiëntengroep wel aangewezen. Hierbij dient het risico van transplantatie (co-morbiditeit etc) wel in overweging te worden meegenomen.
De adviezen voor patiënten die niet in remissie komen door de inductie therapie voor het tFL, of die recidiveren na eerdere immunochemotherapie, zijn geëxtrapoleerd uit behandelrichtlijnen voor het DLBCL.
Allogene stamceltransplantatie tFL (uitgangsvraag 15)
Uitgangsvraag:
Wat is de rol van allogene stamceltransplantatie bij de behandeling van getransformeerd FL (tFL)?
Aanbeveling(en):
Er is geen rol voor allogene stamceltransplantatie als consolidatie na inductie in eerste lijn.
Allogene stamceltransplantatie kan worden toegepast bij tFL dat recidiveert na eerdere autologe stamceltransplantatie.
Inleiding:
De toxiciteit van allogene stamceltransplantatie is hoog. Er moet dan ook een zorgvuldige afweging gemaakt worden, tussen transplantatie gerelateerde morbiditeit (en mortaliteit) enerzijds en verwacht voordeel anderzijds.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Er is geen rol voor allogene stamceltransplantatie als consolidatie na inductie in eerste lijn (Casulo et al., Blood 2015; Da Villa et al., J Clin Oncol 2013) |
|
B |
Allogene stamceltransplantatie kan worden toegepast bij getransformeerd FL dat recidiveert na eerdere autologe stamceltransplantatie (Doocey et al., Br J Haematol 2005; Wirk et al., Biol Blood marrow Transplant 2014; Wondergem et al., Bone Marrow Transplant 2014; Ida H et al., Hematol Oncol 2021) |
Samenvatting literatuur:
Resultaten
Allogene SCT heeft in meerdere studies in tFL geen voordeel boven consolidatie met hoge dosis chemotherapie en autologe SCT of chemo-immunotherapie alleen laten zien. Ban hoeffen et al. vonden een TRM van 44% en (mede daardoor) een 2 jaars overleving van 65%; lager dan de 74% na autologe SCT (TRM 7%) (Ban-Hoeffen et al., Br J Haematol 2013). Wirk et al. rapporteren ook een TRM van 41% met 5 jaars OS van 22% na allogene SCT en een TRM van 8% met een 5 jaars OS van 50% na autologe SCT (Wirk et al., Biol Blood Marrow Transplant 2014). Da Villa et al. rapporteerden een 5 jaars OS van 46% (tegenover 65% na autologe SCT) en meldt een TRM van 23% (Da Villa et al., Blood 2015). Dit zijn geen gerandomiseerde studies, maar de uitkomsten laten wel een consistent beeld zien.
Allogene SCT kan, indien toegepast bij tFL dat recidiveert (indolent en agressief) na eerdere autologe SCT en als er een goede remissie kan worden bereikt met re-inductie therapie, leiden tot een5 jaars overleving van 50-70%(Da Villa et al., J Clin Oncol 2013; Doocey et al., Br J Haematol 2005;Wondergem et al., Bone Marrow Transplant 2014; Ida H et al., Hematol Oncol 2021). In deze situatie is er eveneens een indicatie voor behandeling met CAR-T cellen.
Referenties
Bewijskracht van de literatuur Level 2, consistent
Overwegingen:
De werkgroep volgt de ‘expert opinion’ welke is gebaseerd is op retrospectieve analyses en prospectieve cohortstudies; nl dat er geen rol is voor allogene stamceltransplantatie als consolidatie na inductie in eerste lijn. Door de hoge morbiditeit en mortaliteit wordt elk voordeel betreffende minder recidieven tenietgedaan. Wel ziet de werkgroep een plaats voor allogene SCT bij recidief tFL, vooral na eerdere autologe SCT, omdat het in die situatie de enige kans is op lange termijn overleving.
Deze behandeling zal in de toekomst in toenemende mate moeten worden afgewogen tegen CAR T cel therapie. Afhankelijk van beschikbaarheid is behandeling met CD19 CAR T cellen een optie, mits de patient voldoet aan de gestelde voorwaarden voor deze behandeling, welke in handen is van gekwalificeerde CAR T cel behandelcentra.
In onderstaande paragrafen vindt u adviezen t.a.v.:
Hepatitis B en C
Opvlamming of reactivatie van hepatitis B virus (HBV) infectie is een potentieel ernstige complicatie bij hematologische patiënten. De kans op reactivatie bij een bestaande HBV infectie, of doorgemaakte HBV, is bij gebruik van Rituximab groot zonder gebruik van preventieve maatregelen. Voor start van de behandeling met rituximab dient HBV en HCV serologie verricht te worden. Adviezen t.a.v. hepatitis B vindt u hieronder.
Bij aanwijzingen voor een Hepatitis C infectie is het advies om patiënt te verwijzen naar een MDL arts/ hepatoloog voor verdere begeleiding tijdens de behandeling met chemo–immunotherapie.
Hepatitis B virus
Onderstaand vindt u mogelijke uitslagen van het serologisch onderzoek en de adviezen die daaruit voortvloeien. Het is sterk aanbevolen bij aanwijzingen voor actieve of doorgemaakte HBV infectie een MDL arts/ hepatoloog te consulteren.
Tabel 8. Overzicht van de interpretatie van veel voorkomende HBV test profielen
|
HBsAg |
anti-HBs |
anti HB-core |
HBV-DNA |
|
|
– |
– |
– |
– |
HBV naïeve patiënt |
|
– |
+ of – |
+ |
– |
doorgemaakte HBV infectie |
|
– |
+ |
– |
– |
status na vaccinatie |
|
+ |
– (soms +) |
+ |
+ |
HBV infectie |
1. Actieve HBV infectie (HBsAg positief)
2. Doorgemaakte HBV infectie
A. HBsAg negatief en anti-HBs-antistoffen en anti-HBc-antistoffen positief
Anti-HBs-antistoffen vervolgen. Tevens uitgangs HBV DNA bepalen.
Men kan overwegen, wanneer het anti-HBs negatief geworden is, profylactisch te starten met lamivudine, mits het HBV DNA niet aantoonbaar is of het beleid te volgen als onder b.
Wanneer HBV-DNA aantoonbaar is (bv HBV DNA < 20 IU/mL), dan altijd starten met antivirale therapie in samenspraak met MDL arts/ hepatoloog.
B. HBsAg en anti-HBs-antistoffen negatief en anti-HBc-antistoffen positief (de z.g. “core positives”)
Waarschijnlijk verlies van anti-HBs na doorgemaakte HBV infectie.
Regelmatigecontrole op reactivatie van HBV is daarom aangewezen: HBV-DNA, HBsAg en transaminasen moeten bepaald worden met een frequentie van ten minste 1 maal per 3 weken.
Men moet laagdrempelig overwegen om profylactisch te starten met tenofovir of entecavir, mits het HBV DNA negatief is (dus ook niet POS < 12 IU/mL).
Onderzoek heeft laten zien dat HBV-DNA gemiddeld 2-3 weken vóór stijging van transaminasen detecteerbaar wordt.
Zodra HBV-DNA en/of HBsAg aantoonbaar is moet antivirale altijd therapie gestart worden (in samenspraak met MDL-arts/ hepatoloog).
Behandeling kan bestaan uit:
Monitoring dient (volgens de meest recente richtlijn van de EASL) voortgezet te worden tot 18 maanden na de laatste gift chemo- en of immunotherapie.
Referenties
Vitamine D
Bij (behandelindicatie voor) FL, en gemeten laag vitamine D, is vitamine D suppletie te overwegen.
Recent is in meerdere cohorten vastgesteld dat een laag vitamine D geassocieerd is met een ongunstiger uitkomst in FL patiënten.
Analyse van twee studiecohorten van onbehandelde FL patiënten (uit SWOG en LYSA/ PRIMA studies), liet een associatie zien tussen een laag vitamine D (resp < 20 ng/mL en < 10 ng/mL) en ongunstiger (progressievrije) overleving. Dit verschil was significant in de cohorten van de SWOG studies, maar net niet in het LYSA/ PRIMA cohort (Kelly et al., J Clin Oncol 2015).
In een ander cohort van 642 FL patiënten die werden behandeld met immunochemotherapie was een laag vitamine D (25(OH)D < 20 ng/mL) geassocieerd met een lagere ‘event’ vrije overleving (EFS), algehele overleving en lymfoom specifieke overleving. In patiënten die andere behandelingen ondergingen (dan immunochemotherapie) of bij wie een afwachtend beleid werd gevoerd, was een vitamine D deficiëntie geassocieerd met een slechtere overleving (Tracy et al., Blood Cancer J 2017).
Er zijn nog geen data uit interventiestudies die aangeven dat dit negatieve effect overkomen kan worden d.m.v. suppletie. Totdat dergelijke gegevens beschikbaar zijn, is suppletie (bij een behandelindicatie) te overwegen als er een verlaagde waarde wordt gemeten. Patiënten uit de door de Gezondheidsraad geformuleerde risicogroepen, te weten 70-plussers, vrouwen 50-70 jaar, personen met een donkere huid en personen die weinig buitenkomen, dient sowieso vitamine D suppletie aangeboden te worden.
Referenties
Halverwege en aan het einde van de inductiebehandeling moet beeldvormend onderzoek worden verricht.
Interim evaluatie:
CT-hals-thorax-abdomen
Eind evaluatie:
Patiënten met een partiële respons op de CT scan na inductiebehandeling kunnen in de onderhoudsfase alsnog een CR bereiken.
Bij patiënten met onvoldoende respons (minder dan PR op CT scan), moet salvage behandeling overwogen worden.
Referenties
Uitgangsvraag:
Is er een rol voor de FDG-PET scan in de respons evaluatie tijdens en na behandeling?
Aanbeveling(en):
Een FDG-PET-CT is aanbevolen voor respons evaluatie mits er consequenties aan worden verbonden voor het beleid (er dient in dat geval bij voorkeur een uitgangs FDG-PET scan beschikbaar te zijn).
Er is geen plaats voor de FDG-PET scan in de interim respons-evaluatie.
Inleiding:
De FDG-PET-CT scan is gevoeliger dan CT scan of conventioneel onderzoek in het vastleggen van de uitgebreidheid van de ziekte. Deze is dus ook sensitiever t.a.v. het vaststellen van residuale ziekte na afronden van de behandeling. Omdat de additionele bevindingen meestal geen implicaties hebben voor het beleid, is het de vraag of een FDG-PET-CT in alle gevallen zinvoller is dan conventioneel onderzoek.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
FDG-PET-scan bij responsevaluatie aan einde behandeling is een belangrijke voorspeller voor progressie vrije overleveling (Kostakoglu et al., Leuk Lymphoma 2017; Trotman et al., Lancet Oncol 2018; Wong-Sefidan et al., Leuk Lymphoma 2017) |
|
B |
Waarde FDG-PET-scan bij interim respons evaluatie niet evident (Dreyling et al., Ann Oncol 2021; Adams et al., Ann Hematol 2016). |
Samenvatting literatuur:
Resultaten
Er zijn enkele studies waarin de waarde van de ‘end-of treatment’ FDG-PET scan prospectief onderzocht is m.b.t. klinisch relevante eindpunten als progressievrije overleving of algehele overleving (Kostakoglu et al., Leuk Lymphoma 2017; Trotman et al., Lancet Oncol 2018; Wong-Sefidan et al., Leuk Lymphoma 2017; review Dixon et al., Br J Haematol 2022). Andere publicaties betreffen retrospectieve analyses (review Adams et al., Ann Hematol 2016).
Uit de recente studies blijkt dat de ‘end of treatment’ FDG-PET scan voorspellend is voor progressievrije en algehele overleving. Dit bevestigt de uitkomsten van de eerder verschenen retrospectieve studies waaruit deze conclusie vanwege de matige kwaliteit van de beschikbare data nog niet definitief getrokken kon worden. Deze eerdere studies waren methodologisch niet ontworpen om de rol van de ‘end-of treatment’ FDG-PET scan te analyseren; er werden verschillende beoordelingscriteria voor de FDG-PET scans gebruikt, er is in veel gevallen niet gecorrigeerd voor FLIPI score, en er zijn geen duidelijke en reproduceerbare ‘progressievrije overleving’ criteria beschreven. Interventiestudies waarin de ‘end of treatment’ FDG-PET scan wordt gebruikt om het beleid op te bepalen zijn er echter tot op heden nog nauwelijks. Een recente studie van Luminari toonde dat een FDG-PET/ MRD gestuurde onderhoudsbehandeling leidde tot een slechtere PFS in vergelijking met standaard rituximab onderhoudsbehandeling (Luminari et al., J Clin Oncol 2022).
In deze analyses werd ook gekeken naar de voorspellende waarde van interim FDG-PET scans voor progressievrije en algehele overleving, maar daarvoor werden onvoldoende aanwijzingen gevonden (Adams et al., Ann Hematol 2016).
Indien een FDG-PET scan wordt verricht ter evaluatie van de respons, dan heeft een diagnostische CT met contrast weinig toegevoegde waarde. Van 50 patiënten met FL met een complete response op CT was de EFS 75% versus 53% in patienten zonder complete respons. Een complete response op een FDG-PET voorspelde een EFS in 75% van de patienten versus 35% bij patienten zonder een complete response (Paone et al., Sci Rep. 2021).
Referenties
Bewijskracht van de literatuur Level 2, redelijk consistent
Overwegingen:
De werkgroep is van mening dat, hoewel de beschikbare literatuur aantoont dat een FDG-PET scan aan het eind van de behandeling een betere voorspellende waarde heeft voor (progressievrije) overleving dan conventioneel CT onderzoek, de FDG-PET scan alleen aanbevolen wordt als er therapeutische consequenties aan verbonden worden. Een uitgangs FDG-PET scan is dan noodzakelijk. Bij een getransfomeerd folliculair lymfoom heeft een FDG-PET-scan aan het eind van de behandeling wel meerwaarde boven de CT-scan, omdat er in die situatie, zoals bij DLBCL, wel therapeutische consequenties aan de uitkomst verbonden zijn.
De follow-up bij een FL is er op gericht om progressie van het FL en/ of een behandelindicatie vast te stellen. Beeldvormend onderzoek wordt niet routinematig verricht en moet alleen verricht moet worden als er klinisch verdenking op progressie is en er mogelijke behandelconsequenties zijn. Afhankelijk van de dynamiek van het FL dienen de controles elke 3-6 maanden plaats te vinden.
Tabel 9 geeft een overzicht van de aanbevolen controles (en frequentie) voor de follow-up van het FL.
Tabel 9. Follow-up FL
|
onderzoek |
details |
jaar 1–2 |
jaar >3 |
|
Anamnese |
B-symptomen* |
a 3 maanden |
minimaal a 6 maanden |
|
Lichamelijk onderzoek |
Perifere klieren, milt en lever |
a 3 maanden |
minimaal a 6 maanden |
|
Laboratorium onderzoek |
Hb, leuko (evt differentiatie), trombo, LDH, kreat |
a 3 maanden |
minimaal a 6 maanden |
|
|
TSH (bij patiënt bestraald op de hals) |
jaarlijks |
jaarlijks |
|
Beeldvorming |
Echo abdomen bij abdo-minale lokalisatie |
a 6 maanden optioneel |
jaarlijks optioneel
|
|
|
CT hals-thorax-abdomen |
alleen bij vermoeden op pro- gressie |
alleen bij vermoeden op progressie |
|
|
FDG-PET-scan |
bij verdenking op transformatie |
bij verdenking op transfor- matie |
|
Aanvullend onderzoek |
MRD meting |
alleen in studie |
alleen in studie |
*onverklaarde koorts, gewichtsverlies >10% in 6 maanden, nachtzweten
|
AE |
‘adverse event’ |
|
bijv. |
bijvoorbeeld |
|
B symptomen |
onverklaarde koorts (>38oC), gewichtsverlies (>10% binnen 6 maanden) en nachtzweten |
|
CAR T cellen |
‘chimeric antigen receptor’ T cellen |
|
CR |
complete respons |
|
DLBCL |
diffuus grootcellig B cellymfoom |
|
ECG |
electrocardiogram |
|
ESMO |
European Society for mediacl Oncology |
|
evt. |
eventueel |
|
FDG-PET |
fluorine-18 (F-18) fluorodeoxyglucose positron emission tomography |
|
FISH |
‘fluorescent in situ hybridization’ |
|
FL |
folliculair lymfoom |
|
FLIPI |
Follicular Lymphoma International Prognostic Index |
|
IR-RT |
‘involved field radiotherapy’ |
|
IMRT |
intensiteitsgemoduleerde radiotherapie |
|
i.c.m. |
in combinatie met |
|
i.v. |
intraveneus |
|
ORR |
‘overall response rate’ |
|
OS |
‘overall survival’ |
|
PFS |
‘progression free survival’ |
|
PR |
partiële respons |
|
(R-)CVP |
(rituximab), cyclofosfamide, vincristine, prednison |
|
(R-)CHOP |
(rituximab), cyclofosfamide, doxorubicine, vincristine, prednison |
|
MRD |
‘minimal residual disease’ |
|
NCCN |
National Comprehensive Cancer Network |
|
|
|
|
NRM |
‘non-relapse mortality’ |
|
RIST |
‘reduced intensity conditioning stem cell transplantation’ |
|
s.c. |
subcutaan |
|
SCT |
stamcel transplantatie |
|
TRM |
’treatment related mortality’ |
|
TTF |
’time to treatment failure’ |
|
TTNT |
’time to next treatment’ |
|
VMAT |
volumetrische intensiteisgemoduleerde radiotherapie |
|
WHO |
World health organisation |
|
W&W |
watch & wait/ watchful waiting |
© 2022. Alle rechten voorbehouden
Autorisatie: Nederlandse Vereniging voor Hematologie
Autorisatiedatum: 13 september 2017
Autorisatiedatum revisie: 04 februari 2020
Autorisatiedatum revisie: 22 december 2023
Uiterlijk in 2025 bepaalt het bestuur van de HOVON werkgroep en van de NVvH of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De HOVON is als houder van deze richtlijn de eerst verantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerst-verantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.