Acute lymfatische leukemie (ALL) is een zeer heterogene ziekte die wordt gekenmerkt door klonale maligne hematopoëse met een differentiatieblok en daardoor toename van blastaire cellen in het beenmerg. De ziekte komt relatief frequent voor bij kinderen, maar 20% van alle ALL patiënten zijn volwassenen. Ongeveer 150 volwassen patiënten presenteren zich met een ALL in Nederland per jaar. Het is belangrijk dat diagnostiek en behandeling van ALL patiënten in de dagelijkse praktijk zorgvuldig en gestructureerd wordt uitgevoerd. Hieronder bespreken we de richtlijnen voor diagnostiek en behandeling zoals de HOVON leukemie ALL werkgroep denkt dat die zou moeten plaatsvinden.
Organisatie HOVON leukemie werkgroep
Namen werkgroep leden richtlijn
A.W. Rijneveld, M. Bellido, Y. Jauw, M. van Gelder, B.J. Biemond, A. van de Loosdrecht, C. Halkes, L.E. van der Wagen, G. van Sluis, M. Corsten, S. van Dorp, D. van Lammeren
| A.W. Rijneveld |
Pfizer, Servier
|
| M. Bellido | Amgen |
| D. van Lammeren | geen |
| Y. Jauw | geen |
| M. van Gelder | geen |
| B.J. Biemond |
Celgene, BMS, Novartis, CLS Behring, Novo Nordisk, GBT/Pfizer, Sanofi, Sanquin
|
| A. van de Loosdrecht | Novartis, Celgene, Pfizer, Helsinn, Takeda |
| C. Halkes | geen |
| L. van der Wagen | Novartis, Servier, Kite-Gilead, Amgen |
| G.L. van Sluis | geen |
| M. Corsten | geen |
| S. van Dorp | Kite-Gilead |
|
SORT Grade |
Meaning |
|
A |
Consistent, good-quality patient-oriented evidence* |
|
B |
Inconsistent or limited-quality patient-oriented evidence* |
|
C |
Consensus, disease-oriented evidence**, usual practice, expert opinion, or case series for studies of diagnosis, treatment, prevention, or screening |
|
* Patient-oriented evidence measures outcomes that matter to patients: morbidity, mortality, symptom improvement, cost reduction, and quality of life. **Disease-oriented evidence measures immediate, physiologic, or surrogate end points that may or may not reflect improvements in patient outcomes (e.g. blood pressure, blood chemistry, physiologic function, pathologic findings) |
|
Aanbeveling(en):
Anamnese
Speciale aandacht voor:
Lichamelijk onderzoek
Speciale aandacht voor:
Laboratorium onderzoek
Urineonderzoek
Virologie
Microbiologie
Liquorpunctie
Beenmergonderzoek
Overig
Onderbouwing:
Niet van toepassing
|
SORT Grade |
Conclusie |
|
C |
Anamnese, lichamelijk onderzoek en aanvullend onderzoek bij diagnose zijn uitgebreid. De bovenstaande aanbevelingen geven hier een overzicht van. |
Aanbeveling(en):
Onderbouwing:
Voor bovenstaande MRD advies zijn met uitzondering van de noodzakelijke beenmergonderzoeken geen evidence-based richtlijnen voorhanden. Voor alle genoemde vragen en of onderzoeken zijn goede argumenten waarom de informatie voor het vervolg-/ behandeltraject van belang zijn. De ALL-werkgroep is daarom van mening, dat bovenstaande tot de in Nederland geldende standaard behoort (SORT C).
|
SORT Grade |
Conclusie |
|
C |
Bij follow-up wordt geadviseerd beenmergonderzoek, beeldvorming en MRD bepalingen te doen zoals hierboven beschreven wordt. |
Aanbeveling(en):
Diagnose wordt gesteld op basis van beenmerg cytologie in combinatie met perifere bloeduitstrijk, immunofenotypering en genetisch onderzoek.
Voor subtypering van ALL worden de ICC2022 en de WHO2022 classificatie gebruikt, zie tabel 1 en 3. Mixed phenotype acute leukaemia (MPAL) is een aparte entiteit en ook hier wordt aanbevolen beide classificaties te gebruikende (zie tabel 2 en 4). De immunologische classificaties voor ALL staan in tabel 5 en 6.
Tabel 1 ICC 2022 classificatie precursor B/T-ALL/lymfoblastic lymphoma
|
B-cell lymphoblastic leukaemias/lymphoma |
|
B-lymphoblastic leukaemia/lymphoma, NOS |
|
B-ALL, hyperdiploid |
|
B-ALL, low hypodiploid |
|
B-ALL with iAMP21 |
|
B-ALL with t(9;22)(q34;q11.2) BCR::ABL1 |
|
B-ALL, BCR::ABL-like, ABL-1 class rearranged |
|
B-ALL, BCR::ABL-like, JAK-STAT activated |
|
B-ALL, BCR::ABL-like, NOS |
|
B-ALL with t(v;11q23.3)/KMT2A rearranged |
|
B-ALL with t(12;21)(p13.2;q22.1)/ETV6::RUNX1 |
|
Provisional entity: B-ALL, ETV6::RUNX1-like |
|
B-ALL with t(1;19)(q23.3;p13.3)/TCF::PBX1 |
|
B-ALL with t(5;14)(q31.1;q32.3)/IL3::IGH |
|
B-ALL with HLF rearrangement |
|
B-ALL with recurrent genetic abnormalities |
|
B-ALL, near haploid |
|
B-ALL with MYC rearrangement |
|
B-ALL with DUX4 rearrangement |
|
B-ALL with MEF2D rearrangement |
|
B-ALL with ZNF384(362) rearrangement |
|
B-ALL with NUTM1 rearrangement |
|
B-ALL with UBTF::ATXN7L3/PAN3.CDX2 (“CDX2/UBTF”) |
|
B-ALL with mutated IKZF1 N159Y |
|
B-ALL with mutated PAX5 P80R |
|
Provisional entity: B-ALL with PAX5 alteration |
|
Provisional entity: B-ALL with mutated ZEB2(p.H1038R)/GH::CEBPE |
|
Provisional entity: B-ALL, ZNF384 rearranged-like |
|
Provisional entity: B-ALL, KMT2A rearranged-like |
|
B-ALL, NOS |
|
T-lymphoblastic leukaemia/lymphoma |
|
T-ALL, NOS |
|
Early T-cell precursor ALL with BCL11B rearrangement |
|
Early T-cell precursor ALL, NOS |
|
Provisional entities (zie extra tabel) |
|
Provisional entity: natural killer cell ALL |
Tabel 2 ICC 2022 classificatie MPAL
|
Acute leukemia of ambiguous lineage |
|
Acute undifferentiated leukemia |
|
Mixed phenotype acute leukemia (MPAL) with t(9;22)(q34.1;q11.2); BCR::ABL1 |
|
MPAL, with t(v;11q23.3); KMT2A rearranged |
|
MPAL, B/myeloid, NOS |
|
MPAL, T/myeloid, NOS |
Tabel 3 WHO classificatie (revised 5th edition) 2022 precursor B/T-ALL/lymphoblastic lymphoma
|
B-cell lymphoblastic leukaemias/lymphomas |
|
B-lymphoblastic leukaemia/lymphoma, NOS |
|
B-lymphoblastic leukaemia/lymphoma with high hyperdiploidy |
|
B-lymphoblastic leukaemia/lymphoma with hypodiploidy |
|
B-lymphoblastic leukaemia/lymphoma with iAMP21 |
|
B-lymphoblastic leukaemia/lymphoma with BCR::ABL1 fusion |
|
B-lymphoblastic leukaemia/lymphoma with BCR::ABL1-like features |
|
B-lymphoblastic leukaemia/lymphoma with KMT2A rearrangement |
|
B-lymphoblastic leukaemia/lymphoma with ETV6::RUNX1 fusion |
|
B-lymphoblastic leukaemia/lymphoma with ETV6::RUNX1-like features |
|
B-lymphoblastic leukaemia/lymphoma with TCF3::PBX1 fusion |
|
B-lymphoblastic leukaemia/lymphoma with IGH::IL3 fusion |
|
B-lymphoblastic leukaemia/lymphoma with TCF3::HLF fusion |
|
B-lymphoblastic leukaemia/lymphoma with other defined genetic abnormalities |
|
T-lymphoblastic leukaemia/lymphoma |
|
T-lymphoblastic leukaemia / lymphoma, NOS |
|
Early T-precursor lymphoblastic leukaemia / lymphoma |
Tabel 4 WHO classification (revised 5th edition) 2022 MPAL
Acute leukemieën, zoals AML met myelodysplasia related changes (AML-MRC), therapie gerelateerde AML, blastencrise uit een CML of AML met gebalanceerde translokaties zoals core-binding factor leukemie (t(8;21, inv (16) en PML-RARA t(15;17)) worden niet als MPAL aangeduid.
|
Acute leukaemia of ambiguous lineage with defining genetic abnormalities |
|
Mixed-phenotype acute leukaemia with BCR::ABL1 fusion |
|
Mixed-phenotype acute leukaemia with KMT2A rearrangement |
|
Acute leukaemia of ambiguous lineage with other defined genetic alterations |
|
Acute leukaemia of ambiguous lineage, immunophenotypically defined |
|
Mixed-phenotype acute leukaemia, B/myeloid |
|
Mixed-phenotype acute leukaemia, T/myeloid |
|
Mixed-phenotype acute leukaemia, rare types |
|
Acute leukaemia of ambiguous lineage, not otherwise specified |
|
Acute undifferentiated leukaemia |
Tabel 5 Immunologische classificering
|
Markers |
pro-B-ALL |
common ALL |
pre-B-ALL |
transitional pre-B-ALL* |
|
TdT |
++** |
++ |
++ |
++ |
|
CD10 |
– |
++ |
++ |
++ |
|
CD19 |
++ |
++ |
++ |
++ |
|
CD20 |
– |
+ |
+ |
+ |
|
CD22 |
++ |
++ |
++ |
++ |
|
CyCD79 |
++ |
++ |
++ |
++ |
|
CyIgμ |
– |
– |
++*** |
++*** |
|
SmVpre-B/λ5 |
– |
– |
– |
++ |
|
SmIg-CD79 |
– |
– |
– |
++ |
|
CD34 |
+ |
+ |
+ |
+ |
|
HLA-DR |
++ |
++ |
++ |
++ |
|
* ∼5% van de pre-B-ALL patiënten hebben een transitional pre-B-ALL, gedefinieerd door zowel CyIgμ als membraanexpressie van het pre-B-celcomplex (SmIgμ-CD79) zonder expressie van κ of λ-Ig lichte ketens. |
||||
|
|
Onrijpe T-ALL |
Common thymocytaire T-ALL |
Rijpe T-ALL (EGIL T-IV) |
||
|
Markers |
prothymocytaire (pro-T-ALL, EGIL T-I) |
immature thymocytaire |
SmCD3‾ |
SmCD3+ |
|
|
TdT |
++ |
++ |
++ |
++ |
++ |
|
HLA-DR |
+ |
– |
– |
– |
– |
|
CD34 |
+ |
– |
– |
– |
– |
|
CD1 |
– |
– |
++ |
++ |
– |
|
CD2 |
+ |
++ |
++ |
++ |
++ |
|
CyCD3 |
++ |
++ |
++ |
++ |
++ |
|
CD5 |
– |
++ |
++ |
++ |
++ |
|
CD7 |
++ |
++ |
++ |
++ |
++ |
|
CD4‾/CD8‾ |
++ |
+ |
– |
– |
– |
|
CD4+/CD8‾ |
– |
± |
± |
± |
+ |
|
CD4‾/CD8+ |
– |
± |
± |
± |
± |
|
CD4+/CD8+ |
– |
– |
+ |
+ |
± |
|
SmCD3 |
– |
– |
– |
++ |
++ |
|
TCRαβ |
– |
– |
– |
+ a |
+ a |
|
TCRγδ |
– |
– |
– |
+ a |
+ a |
|
– = < 10% van de maligniteiten is positief; ± = 10-25% van de maligniteiten is positief; + = 25-75% van de maligniteiten is positief; ++ = > 75% van de maligniteiten is positief |
|||||
Tabel 6 Immunologische criteria voor mixed phenotype acute leukemie (MPAL)
|
Myeloid |
Myeloperoxidase (MPO) (Flowcytometrie, Immunohistochemie of Cytochemie) |
|
|
Monocytaire differentiatie (≥2): Nonspecific Esterase Cytochemistry, CD11c, CD14, CD64, or Lysozyme) |
||
|
B-cel |
Sterke expressie CD19 + ≥1 sterke: CD79a, cytoCD22, of CD10 |
|
|
Zwak CD19 + ≥2 sterk: CD79a, cCD22, of CD10 |
||
|
T-cel |
Sterke cCD3 OF |
|
|
Surface CD3 |
||
Onderbouwing:
Bovenstaande onderbouwing komt voort uit diverse bronnen en mogen derhalve geclassificeerd worden als SORT A. (1-4)
|
SORT Grade |
Conclusie |
|
A
|
Diagnose wordt gesteld op basis van beenmerg cytologie in combinatie met perifere bloeduitstrijk, immunofenotypering en genetisch onderzoek. Voor subtypering van ALL wordt de ICC2022 en de WHO2022 classificatie gebruikt. Mixed phenotype acute leukemia (MPAL) is een aparte entiteit met eigen immunologische criteria zoals boven beschreven. |
Referenties:
Aanbevelingen en onderbouwing:
Voor patiënten die in klinische studies worden behandeld wordt de risico classificatie van de betreffende studie aangehouden. Voor patiënten die buiten een klinische studie worden behandeld, wordt de prognostische score gebruikt zoals hieronder weergegeven.
Goed risico (GR-GEN) betreft:
Slecht risico (HR-GEN) betreft:
Een cutoff van 2,5 toonde twee klinisch toepasbare en onderscheidende risicogroepen. De score is als volgt opgebouwd en een website kan gebruikt worden om deze score per patiënt te berekenen. MRD wordt bepaald aan het einde van de remissie inductie kuur 1.
PI= t(MRD) x -0,218 + t(WBC) x 0,138 + GR-GEN x -0,440 + HR-GEN x 1,066.
Berekening kan via: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10910126/pdf/main.pdf
EWALL Prognostic Index (PI) werkblad
In de goed risicogroep heeft allogene stamceltransplantatie in eerste lijn geen meerwaarde ten aanzien van relapse rate of survival. In de slecht risicogroep heeft allogene stamceltransplantatie in eerste lijn wel meerwaarde ten aanzien van relapse risico, maar niet voor survival. De score wordt gebruikt om bij patiënten jonger dan of gelijk aan 40 jaar te beoordelen of zij classificeren als goed of slecht risicogroep. Voor patiënten ouder dan 40 jaar is er onvoldoende bewijs dat deze prognostische score voldoende onderscheidend is om de indicatie voor allogene stamceltransplantatie te bepalen, mede gezien de recente goede resultaten bij allogene stamceltransplantatie in Nederland (6).
|
SORT Grade |
Conclusie |
|
B |
Voor patiënten die in klinische studies worden behandeld wordt de risico classificatie van de betreffende studie aangehouden. Voor patiënten die buiten een klinische studie worden behandeld, wordt de prognostische score gebruikt zoals hieronder weergegeven. De UKALL-PI score wordt gebruikt om bij patiënten met Philadelphia negatieve ALL jonger dan of gelijk aan 40 jaar te beoordelen of zij classificeren als goed of slecht risicogroep. Philadelphia negatieve ALL wordt bij patiënten ouder dan 40 jaar gezien als hoog risico ziekte waarvoor indien er een geschikte donor is en de conditie van patiënt dat toe laat, een allogene stamcel transplantatie wordt geadviseerd in eerste CR. Bij patiënten met Philadelphia positieve ALL wordt een allogene stamceltransplantatie geadviseerd. Wanneer een patiënt met imatinib binnen 90 dagen een CMR bereikt kan in overleg met patiënt besloten worden van een allogene stamceltransplantatie af te zien, tenzij er sprake is van een IKZF1 plus genotype (zie paragraaf 21)(7). |
Referenties:
Aanbevelingen en onderbouwing:
Het advies is behandeling volgens inductieschema met reguliere, intensieve combinatie-chemotherapie, zoals het HOVON 100 schema voor patiënten ≤40 jaar, gevolgd door, indien minimaal partiele response (PR), consolidatie-, intensificatie- en interfase-chemokuren. Bij iedere precursor B-ALL waar bij diagnose CD20 tot expressie wordt gebracht op de BCP-ALL cellen (zoals vastgesteld met lokale flowcytometrische analyse) wordt rituximab toegevoegd aan de behandeling(8). Dit is onafhankelijk van de mate van expressie van CD20.
Tot welke leeftijd intensieve behandeling aangeboden kan worden is niet geheel duidelijk uit de internationale literatuur. Aanvankelijk werd gedacht dat intensificatie van de behandeling alleen haalbaar was bij adolescenten. Verschillende studies hebben inmiddels aangetoond dat dit ook haalbaar lijkt voor patiënten tot en met 55 jaar, daarboven is er veel toxiciteit van deze intensieve aanpak (9-11). Zie tabel 7 voor een volledig overzicht en tevens de timing van de rituximab giften.
Tabel 7 Eerstelijnsbehandeling precursor B-/T-ALL 18-40 jaar
|
Chemotherapie |
Doses |
Dagen |
|
Prefase |
||
|
Prednison (PO) |
30 mg/m2 tweemaal daags |
1-7 |
|
Methotrexaat (IT) + steroid |
15 mg |
1 |
|
Inductie |
||
|
Prednison (PO) |
20 mg/m2 tweemaal daags |
8-28 |
|
Vincristine (IV) |
1.5 mg/m2 max. 2 mg |
8, 15, 22, 29 |
|
Daunorubicine (IV) |
40 mg/m2 |
15, 22 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
13, 27 |
|
PEG-Asparaginase (IV) |
1000 IU/m2 |
8, 21 |
|
Methotrexaat (IT) + steroid |
15 mg |
8, 15 |
|
Consolidatie A |
||
|
6-Thioguanine (PO) |
60 mg/m2 |
1-21 |
|
Etoposide |
150 mg/m2
|
1, 8, 15 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1, 15 |
|
Cytarabine (SC) |
60 mg/m2 |
1, 2, 8, 9, 15, 16 |
|
Methotrexaat (IT) + steroid |
15 mg |
1, 15 |
|
Consolidatie B |
||
|
Prednison (PO) |
40 mg/m2 |
29-35 |
|
Vincristine (IV) |
1.5 mg/m2 |
29, 43 |
|
6-mercaptopurine (PO) |
50 mg/m2 |
29-49 |
|
Methotrexaat (IV) |
5000 mg/m2 |
29, 43 |
|
Methotrexaat (IT) + steroid |
15 mg |
29, 43 |
|
Na consolidatie 1b MRD bepalen voor risicogroep indeling |
||
|
Intensificatie IA |
||
|
Dexamethason (PO) |
10 mg/m2 |
1-14, taper in 1 week |
|
Vindesine (IV) |
3 mg/m2 max. 4 mg |
1, 8, 15 |
|
Adriamycine (IV) |
25 mg/m2 |
1, 8, 15 |
|
PEG-Asparaginase (IV) |
1000 IU/m2 |
4, 18 |
|
Methotrexate (IT) + steroid |
15 mg |
1 |
|
Intensificatie IB |
||
|
6-Thioguanine (PO) |
60 mg/m2 |
29-49 |
|
Etoposide (IV) |
150 mg/m2 |
29, 36, 43 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
29, 36 |
|
Cytarabine (SC) |
30 mg/m2 tweemaal daags |
29, 30, 36, 37, 43, 44 |
|
Methotrexaat (IT) + steroid |
15 mg |
29 |
|
Interfase A |
||
|
Prednison (PO) |
40 mg/m2 |
1-7 |
|
Vincristine (IV) |
1.5 mg/m2 max. 2 mg |
1, 15 |
|
6-mercaptopurine (PO) |
50 mg/m2 |
1-22 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
4, 18 |
|
Methotrexaat (IV) |
5000 mg/m2 |
1, 15 |
|
Methotrexaat (IT) + steroid |
15 mg |
1, 15 |
|
Schedelbestraling (als CZS betrokkenheid) |
24 Gy |
Tussen dag 29 en 43 |
|
Intensificatie IIA |
||
|
Prednison (PO) |
40 mg/m2 |
1-14 taper in 1 week |
|
Vincristine (IV) |
1.5 mg/m2 max. 2 mg |
1, 8, 15 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1, 8 |
|
Daunorubicine (IV) |
30 mg/m2 |
1, 8, 15 |
|
PEG-Asparaginase (IV) |
1000 IU/m2 |
4, 18 |
|
Methotrexaat (IT) + steroid |
15 mg |
1 |
|
Onderhoud |
||
|
6-mercaptopurine (PO) |
75 mg/m2 |
1-28 |
|
Methotrexaat (PO) |
15 mg/m2 |
8, 15, 22 |
|
Reinductie kuren (x12) |
||
|
Prednison (PO) |
1 mg/kg |
1-7 |
|
Vincristine (IV) |
1.5 mg/m2 max. 2 mg |
1 |
|
Methotrexaat (IT) + steroid |
15 mg |
1 (tot max 15 LP’s) |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1: 1x/2mnd, 6x in totaal tijdens 1st jaar |
Indien patiënt na behandeling met 3 kuren chemotherapie (i.e. na consolidatie 1b) nog MRD >0,1% of >10-3 heeft, is blinatumomab behandeling geïndiceerd. Er worden 1 of 2 kuren gedurende elk 4 weken gegeven, alvorens te consolideren met allogene stamceltransplantatie als er een geschikte donor is en het allogene stamceltransplantatie traject haalbaar is (12-14). Op het moment van diagnose zijn de meeste patiënten niet in staat om de mogelijke gevolgen van een behandeling te overzien. Men accepteert dat bestrijding van de ziekte nodig is en heeft de bijwerkingen te accepteren. Bijwerkingen op de langere termijn hebben grote invloed op de kwaliteit van leven. Het verdient daarom aanbeveling de patiënt bij de start van iedere onderdeel van de behandeling te informeren over de meest voorkomende bijwerkingen en andere opties ook te bespreken. Daarbij spelen onder andere de levensfase van de patiënt, de aard van het eventuele werk (handarbeider of hoofdarbeider) en de belangrijkste hobby’s (fysiek of mentaal georiënteerd) een rol. Indien er geen allogene stamceltransplantatie kan volgen, worden maximaal 4 cycli blinatumomab geadviseerd zonder aansluitend onderhoudsbehandeling zoals ook in de BLAST studie werd gedaan. Er zijn aanwijzingen dat er een niet nader gespecificeerde subgroep zou kunnen bestaan die een lange overleving kent zonder consolidatie met allogene stamceltransplantatie. Dit is vooralsnog onvoldoende om niet te consolideren met allogene stamceltransplantatie bij patiënten jonger dan 40 jaar oud.
Blinatumomab kuur: 15 ug/m2 gedurende 4 weken middels continue infusie waarna 2 weken rust. Dit kan in de thuissituatie gegeven worden.
|
SORT Grade |
Conclusie |
|
A |
Het advies is behandeling volgens inductieschema met reguliere, intensieve combinatie-chemotherapie, zoals het HOVON 100 schema voor patiënten ≤40 jaar, gevolgd door, indien minimaal partiele response (PR), consolidatie-, intensificatie- en interfase-chemokuren. Bij iedere precursor B-ALL waar bij diagnose CD20 tot expressie wordt gebracht, wordt rituximab toegevoegd aan de behandeling onafhankelijk van de mate van CD20 expressie. Indien patiënt na behandeling met 3 chemotherapie kuren (i.e na consolidatie 1b) nog MRD >0,1% of >10-3 heeft, is blinatumomab behandeling geïndiceerd in totaal 4 cycli. |
Referenties:
Aanbevelingen en onderbouwing:
Behandeling volgens inductieschema met reguliere, intensieve combinatie-chemotherapie, zoals bv het huidige HOVON 100 schema voor patiënten >40 jaar, gevolgd door, indien minimaal PR, consolidatie, en re-inductie chemokuren. Bij iedere precursor B-ALL waar bij diagnose CD20 tot expressie wordt gebracht op de blasten, wordt rituximab toegevoegd aan de behandeling. Zie tabel 8 voor een volledig overzicht en timing van de rituximab giften. Dit leidde in 2 fase 2 studies en een fase 3 studie tot een significante verbetering in overleving (15-17).
Tabel 8 Eerstelijns behandeling precursor B- en T-ALL >40 jaar
|
Chemotherapie |
Dosis |
Dagen |
|
Prefase |
||
|
Prednison (PO) |
30 mg/m2 tweemaal daags |
1-7 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4 mg) |
15 mg |
1 (afh. blasten in PB) |
|
Remissie Inductie |
||
|
Prednison (PO) |
20 mg/ m2 tweemaal daags |
8-28 taper in 1 week |
|
Rituximab (CD20 positief) |
375 mg/m2 |
8, 15 |
|
Vincristine (IV) |
1 mg |
8, 15, 22 |
|
Doxorubicine |
40 mg/m2 |
15, 22 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4 mg) |
15 mg |
8, 15, 22 |
|
Consolidatie 1 |
||
|
Cytarabine (IV) |
200 mg/m2 |
1 en 8 |
|
Etoposide (IV) |
120 mg/m2 |
1 en 8 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1, 8 |
|
Methotrexaat (IV) |
500 mg/m2 |
4 en 11 |
|
Remissie Inductie 2 |
||
|
Prednison (PO) |
40 mg/ m2 |
1-21 |
|
Vincristine (IV) |
1 mg |
1, 8, 15 |
|
Doxorubicine |
40 mg/ m2 |
1,8, 15 (1 extra toc RI 1) |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1, 8 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4mg) |
15 mg |
15 |
|
Na Remissie Inductie 2 Risicogroep vaststellen voor consolidatie |
||
|
Consolidatie 2 |
||
|
Cytarabine (IV) |
1000 mg/m2 tweemaal daags |
1, 2 |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1, 8 |
|
PEG-Asparaginase (IV) |
1000 IU/m2 |
3, 18 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4mg) |
15 mg |
15 |
|
|
|
|
|
Schedelbestraling (als CZS betrokkenheid) |
24 Gy |
|
|
Onderhoud (iedere maand gedurende 2de jaar) |
||
|
6-mercaptopurine (PO) |
75 mg/m2 |
1-28 |
|
Methotrexate (PO) |
15 mg/m2 |
8, 15, 22 |
|
Reinductie kuur 1x/maand (x12, gedurende het 1ste jaar) |
||
|
Prednison (PO) |
1 mg/kg |
1-7 |
|
Vincristine |
1,4 mg/m2 |
1 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4mg) |
15 mg |
1 (tot max 10 LP’s) |
|
Rituximab (CD20 positief) |
375 mg/m2 |
1: 1x/2mnd, 6x in totaal tijdens 1st jaar |
Indien patiënt na behandeling met 3 kuren chemotherapie (dus na remissie inductie kuur 2 nog MRD > 0,1% of > 10-3heeft, is blinatumomab behandeling geïndiceerd. Er worden 1 of 2 kuren gedurende elk 4 weken gegeven, alvorens te consolideren met allogene stamceltransplantatie als er een geschikte donor is en het allogene stamceltransplantatie traject haalbaar is(12, 13, 18). Indien er geen allogene stamceltransplantatie kan volgen, worden maximaal 4 cycli blinatumomab geadviseerd zonder aansluitend onderhoudsbehandeling zoals ook in de BLAST studie werd gedaan. Intrathecale profylaxe wordt geadviseerd voor cyclus 1, 2 en 4. Er zijn aanwijzingen dat er een nog niet nader gespecificeerde subgroep bestaat die een lange overleving kent zonder consolidatie met allogene stamceltransplantatie. Vooralsnog zijn deze onvoldoende gedefinieerd
Blinatumomab kuur: 15 ug/m2 gedurende 4 weken middels continue infusie waarna 2 weken rust.
|
SORT Grade |
Conclusie |
|
A |
Behandeling volgens inductieschema met reguliere, intensieve combinatie-chemotherapie, zoals het huidige HOVON 100 schema voor patiënten >40 jaar, gevolgd door, indien minimaal PR, consolidatie, en re-inductie chemokuren. Bij iedere precursor B-ALL waar bij diagnose CD20 tot expressie wordt gebracht op de blasten, wordt rituximab toegevoegd aan de behandeling. Indien patiënt na behandeling met 3 chemotherapie kuren nog MRD ≥ 0,1 % of > 10-3 heeft, is blinatumomab behandeling geïndiceerd. |
Referenties:
Aanbevelingen en onderbouwing:
Patiënten die niet in aanmerking komen voor intensieve chemotherapie worden met een milder regime behandeld. Er bestaan geen vergelijkende studies van een haalbaar behandelprotocol in niet-fitte of oudere patiënten.
De prospectieve data die er zijn, zijn vooral subklasse analyses van grotere studies, waarbij het aantal patiënten van ouder dan 65 klein is. De grootste studie is van Gökbuget et al. met totaal 268 patiënten waarvan 136 in de leeftijdscategorie van 66-75 jaar en 27 in de leeftijdscategorie van boven de 75 jaar. In deze studie worden complete remissie percentages bereikt van 74% (66-75 jaar) en 52% (> 75 jaar). De 5-jaars overall survival voor het hele cohort inclusief de patiënten tussen 55-65 jaar bedroeg 23%. De data hiervan zijn echter alleen in abstract vorm gepubliceerd waarbij expliciet wordt gemeld dat het schema eigenlijk niet haalbaar is voor patiënten > 75 jaar.
Het schema waarvoor in Nederland gekozen is, is de arm voor ‘ non-fit patients ‘ van de HOVON 117 studie (zie tabel 9).
De remissie inductie kuur wordt 2x herhaald (totaal 3 kuren) alvorens de onderhoud gedurende twee jaar te starten. Bij iedere precursor B-ALL waar bij diagnose CD20 tot expressie wordt gebracht op de blasten, wordt rituximab toegevoegd aan de behandeling. Zie tabel 9 voor een volledig overzicht en timing van de rituximab giften (12-14).
Tabel 9 Eerstelijns behandeling van niet fitte patiënt met Ph negatieve precursor B- of T-ALL
|
Chemotherapie |
Dosis |
Dagen |
|
Remissie Inductie 1 (RI1) |
||
|
Dexamethason (po) |
3 mg/m2 |
1-3 |
|
Rituximab (iv) (CD20 positief) |
375 mg/m2 |
8, 15 |
|
Vincristine (iv) |
1 mg/m2 |
1 |
|
Idarubicine (iv) |
10 mg/m2 |
1 |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4mg) |
12,5 mg |
Eenmalig in RI1 |
|
Methotrexaat (po) |
5 mg/m2 |
1, 8, 15, 22 |
|
6-mercaptopurine (po) |
25 mg/m2 |
1-28 |
|
Herhaal 2 keer deze kuur als perifere bloed hersteld is met neutrofielen > 0,75 x109/L en trombocyten > 75 x 109/L |
||
|
Na de 3e kuur en bij herstel perifere bloed wordt gestart met de onderhoudsbehandeling |
||
|
Onderhoud (24 maanden) |
||
|
6-mercaptopurine (po) |
25 – 75 mg/m2 afhankelijk labwaarden |
1-28 |
|
(streef naar neutrofielen 0,75-1,5 en trombocyten 75-150) * |
||
|
Methotrexaat (po) |
5 mg/m2 |
1x /week |
|
Rituximab (iv) (CD20 positief) |
375 mg/m2 |
1x/ 3 maanden |
|
Vincristine (iv) |
1,4 mg/m2 (max. 2 mg) |
1x / 3 maanden |
|
Prednison |
60 mg/m2 |
5 dagen/ 3 maanden |
|
Methotrexaat (IT) + steroid (bijv. dexamethason 4mg) |
12,5 mg |
1x /3 maanden |
|
* 6-MP starten met 25 mg/m2 en dan ophogen op geleide tolerantie iedere 4 weken tot maximaal 75 mg/m2
|
||
|
SORT Grade |
Conclusie |
|
B |
Patiënten die niet in aanmerking komen voor intensieve chemotherapie worden met een milder regime behandeld. Er bestaan geen vergelijkende studies van een haalbaar behandelprotocol in niet-fitte of oudere patiënten. |
Referenties
Aanbevelingen en onderbouwing:
Ongeveer 0,5 tot 2,5% van de leukemieën vertonen zowel myeloide als lymfatische kenmerken en kunnen niet als AML of ALL beschouwd worden. Deze leukemieën worden mixed phenotype acute leukemie genoemd (MPAL). Over het algemeen wordt gestart met een ALL behandeling (maar onderbouwing hiervoor is gering) tenzij er evidente MPO positiviteit wordt aangetoond (cytochemisch of flowcytometrisch) of AML gerelateerde moleculaire afwijkingen worden gevonden. Dan kan beter gekozen worden voor een AML gerichte behandeling. Consolidatie met allogene stamceltransplantatie verdient de voorkeur gezien de prognose met een gemiddelde overall survival van 30-40%. Het toevoegen van imatinib als BCR-ABL1 aanwezig is, wordt daarnaast ook geadviseerd. Bij onvoldoende response dient te worden overwogen over te schakelen naar een AML behandeling of vice versa als in de eerste lijn voor een AML regime is gekozen. Dit altijd na evaluatie van het beenmerg waarbij flowcytometrische analyse altijd volledig dient te worden meegenomen. Een lineage switch kan voorkomen en kan alleen op deze wijze vastgesteld worden(19-21).
|
SORT Grade |
Conclusie |
|
C |
Over het algemeen wordt gestart met een ALL behandeling (maar onderbouwing hiervoor is gering) tenzij er evidente MPO positiviteit wordt aangetoond (cytochemisch of flowcytometrisch) of AML gerelateerde moleculaire afwijkingen worden gevonden. Dan kan beter gekozen worden voor een AML gerichte behandeling. Consolidatie met allogene stamceltransplantatie verdient de voorkeur gezien de slechte overleving van patiënten met een MPAL. |
Referenties:
Aanbevelingen en onderbouwing:
Profylaxe van het centraal zenuwstelsel is aangewezen bij alle ALL patiënten zonder liquorlokalisatie met intrathecaal (i.t.) methotrexaat 15 mg (> 60 jaar 12,5 mg) in combinatie met i.t. corticosteroïden (dexamethason 4 mg of prednison 25 mg). Schema: de eerste viermaal wekelijks, daarna viermaal iedere 2 weken (<40jr) en nadien maandelijks (zie behandelschema). Het maximum totaal aantal LP’s is 17 voor patiënten ≤ 40 jaar en 12 voor patiënten > 40 jaar. Na allogene stamceltransplantatie met TBI-conditionering wordt CZS profylaxe niet meer gegeven. Via een Ommaya reservoir wordt 12,5 mg MTX intrathecaal geadviseerd. Deze aanbevelingen zijn gebaseerd op expert opinion en kunnen geclassificeerd worden als SORT C.
Toelichting: CZS betrokkenheid wordt bij diagnose bij 5-10% van volwassen gezien, vooral bij hyperleukocytose en T-cel fenotype. Bij recidieven ligt dit getal hoger, mogelijk verklaard door de beperkte CZS distributie van verschillende chemotherapeutica (22). Waar historische behandelschema’s CZS recidiefpercentages van >30% kenden, wordt dit percentage bijna gehalveerd door het gebruik van hoge doses chemotherapie met CZS penetratie (MTX, cytarabine) en verder verlaagd tot <10% bij gebruik van i.t. profylaxe (23). De meest gebruikte middelen voor i.t. profylaxe zijn MTX (15 mg) of cytarabine (70mg) doorgaans in combinatie met corticosteroïden als adjuvans en ter preventie van arachnoïditis (24). De dosis bij ouderen wordt gereduceerd in verband met het afgenomen liquorvolume en grotere kwetsbaarheid voor neurotoxiciteit. Schedelbestraling biedt ook effectieve profylaxe maar heeft nog slechts een beperkte plaats wegens de neurocognitieve en endocriene lange termijn gevolgen en het intrathecale alternatief (25).
Er zijn geen vergelijkende prospectieve studies om de precieze timing en het aantal IT giften op te baseren. De meeste studiegroepen, waaronder HOVON, plannen meerdere i.t. giften gedurende de eerste 1-2 jaar van behandeling met de grootste dichtheid tijdens inductie en consolidatiekuren(26) (22). De meerwaarde van profylaxe na allogene SCT met totale lichaamsbestraling (TBI) kon door meerdere groepen niet worden aangetoond (26) (27); een Japanse studie rapporteerde zelfs een hogere kans op CNS recidief na posttransplantatie i.t. giften (28). Dit wordt daarom niet aanbevolen (29).
|
SORT Grade |
Conclusie |
|
B |
Intrathecale.profylaxe met methotrexaat of cytarabine in combinatie met corticosteroïden tijdens ALL behandeling is een effectieve manier om CZS recidieven te verminderen. |
|
B |
Intrathecale profylaxe na allogene stamceltransplantatie met totale lichaamsbestraling vermindert de kans op CNS recidief niet. |
|
C |
Bij patiënten >60 jaar oud en bij toediening via een Ommaya reservoir moet de dosis van intrathecale chemotherapie gereduceerd worden. |
Referenties:
Aanbevelingen en onderbouwing:
Centraal zenuwstelsel betrokkenheid wordt bepaald op basis van het aantal leukocyten, erytrocyten en blasten in de liquor. MRI beeldvorming alleen op indicatie (parenchymlokalisaties zijn zeldzaam). Voor blastdetectie zijn zowel cytomorfologie als flowcytometrie bruikbaar; flowcytometrie is sensitiever(30). Voor gradering zie onderstaande tabel.
Tabel 10: CNS gradering
|
Gradering CZS ziekte bij diagnose |
Definitie |
|
CNS-1 |
Geen blasten in de liquor |
|
CNS-2 a b c |
<5 WBC /µL + blasten + <10 ery’s /µL (atraumatisch) <5 WBC /µL + blasten + ≥10 ery’s /µL ≥5 WBC /µL + blasten + ≥10 ery’s /µL; liquor WBC <2x bloed WBC |
|
CNS-3 a b c |
≥5 WBC /µL + blasten + <10 ery’s /µL ≥5 WBC /µL + blasten + ≥10 ery’s /µL; liquor WBC >2x bloed WBC Klinische tekenen van CZS ziekte |
Bron: Winick et al, JCO 2017
Bij CNS-2 wordt het normale behandelschema met profylactische LP’s aangehouden. Als er sprake is van CNS-3 wordt een therapeutisch intrathecaal behandelschema aangeraden: 2x per week i.t. behandeling gegeven met MTX 15 mg (> 60 jaar of via Ommaya reservoir 12,5 mg) of afwisselend MTX/cytarabine IT tot de liquor tweemaal schoon is, waarna 1x per week een LP gedurende 2 weken wordt gegeven en dan 2 LP’s om de 2 weken en dan 1x per maand. Het maximum aantal injecties is (conform het advies bij profylaxe) 17 LP’s voor patiënten ≤ 40 jaar en maximaal 12 LPs voor > 40 jaar oud. Dit wordt zo mogelijk gevolgd door radiotherapie, bij voorkeur als onderdeel van conditionering van allogene SCT. Indien geen respons optreedt na 4 IT toedieningen MTX/dexamethason, dan is het advies te switchen naar cytarabine 70 mg met dexamethason 4 mg i.t. volgens hetzelfde schema en is schedelbestraling 18-24Gy een optie.
Toelichting: CZS betrokkenheid wordt behandeld met standaard chemotherapie in combinatie met geïntensiveerde intrathecale therapie middels MTX tweemaal per week tot de liquor 2x negatief is. Sommige behandelaren wisselen in deze fase MTX i.t. en cytarabine i.t. af bij 2 giften per week om MTX stapeling te voorkomen. Schedelbestraling (in geval van geen allogene SCT) wordt wisselend toegepast bij responsieve ziekte; spinale bestraling wordt weinig toegepast wegens de geassocieerde myelosuppressie (22). Schema’s zijn veelal gebaseerd op ervaringen uit studieprotocollen, prospectieve vergelijkende studies zijn niet beschikbaar. De overleving blijft desondanks slechter dan zonder CNS betrokkenheid , variërend van 29% 5-jaars overleving in oude cohorten (31) tot >30% in recentere studies (22, 32). De liquor wordt in de meerderheid van gevallen negatief met deze benadering. Als lumbaal punctie moeizaam verloopt, is het mogelijk om een Ommaya reservoir te plaatsen voor toedieningen intraventriculair. Een aandachtpunt hierbij is dat voor diagnostiek niet gevaren kan worden op liquor verkregen uit de Ommaya omdat blasten zelden voorkomen in ventriculaire liquor (22). In geval van een Ph positieve ALL met CZS betrokkenheid gaat de voorkeur uit naar TKI behandeling met dasatinib in plaats van imatinib wegens de goede CZS penetratie in vergelijking met imatinib (33).
|
SORT Grade |
Conclusie |
|
B |
Behandeling van patiënten met CZS lokalisatie middels geïntensiveerde intrathecale giften van MTX of cytarabine leidt tot klaring van de liquor; overleving en recidiefkans blijven echter inferieur aan patiënten zonder CZS lokalisatie. |
|
B |
Gradering CNS lokalisatie in CNS 1-2-3. CNS-3 wordt beschouwd als liquorlokalisatie. Schedelbestraling moet sterk worden overwogen bij CNS-3. |
|
C |
Bij Ph+ ALL met CZS betrokkenheid verdient toevoeging van dasatinib de voorkeur in verband met optimale CZS penetratie. |
Referenties:
22. Larson RA. Managing CNS disease in adults with acute lymphoblastic leukemia. Leuk Lymphoma. 2018;59(1):3-13.
30. Del Principe MI, Gatti A, Johansson U, Buccisano F, Brando B. ESCCA/ISCCA protocol for the analysis of cerebrospinal fluid by multiparametric flow-cytometry in hematological malignancies. Cytometry B Clin Cytom. 2021;100(3):269-81.
31. Lazarus HM, Richards SM, Chopra R, Litzow MR, Burnett AK, Wiernik PH, et al. Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis: results from the international ALL trial MRC UKALL XII/ECOG E2993. Blood. 2006;108(2):465-72.
32. Shigematsu A, Kako S, Mitsuhashi K, Iwato K, Uchida N, Kanda Y, et al. Allogeneic stem cell transplantation for adult patients with acute lymphoblastic leukemia who had central nervous system involvement: a study from the Adult ALL Working Group of the Japan Society for Hematopoietic Cell Transplantation. Int J Hematol. 2017;105(6):805-11.
33. Porkka K, Koskenvesa P, Lundan T, Rimpilainen J, Mustjoki S, Smykla R, et al. Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia. Blood. 2008;112(4):1005-12.
Aanbevelingen en onderbouwing:
Hyperleukocytose, gedefinieerd als een totaal leukocyten aantal > 100 x 10E9/L wordt gezien bij 10-30% van de patiënten met nieuw gediagnostiseerde ALL . De incidentie is het hoogst bij jonge patiënten, tussen 10 en 20 jaar, bij mannelijk geslacht, aanwezigheid van t(4;11) of t(9;22) en bij een T cel fenotype. Leukostase is een klinische diagnose bij patiënten met hyperleukocytose en pulmonale of neurologische symptomen. Leukostase komt weinig voor bij ALL, en het vroege overlijdensrisico is < 5% bij kinderen met ALL. Om andere oorzaken van pulmonale of neurologische symptomen uit te sluiten wordt beeldvorming geadviseerd.
80% van de patiënten met leukostase heeft koorts, ten gevolge van inflammatie of bijkomende infectie. Empirische behandeling met antibiotica is geïndiceerd. De behandeling van hyperleukocytose is snelle cytoreductie, bij voorkeur met prednison 1 mg/kg of een equivalent hiervan, gevolgd door inductie chemotherapie. Indien een erytrocyten transfusie noodzakelijk is, probeer dit uit te stellen ivm hyperviscositeit en anders met langere inlooptijd toedienen.
Er lijkt geen rol te zijn voor leukaferese, hoewel er geen prospectieve trials of grote observationele studies zijn gedaan die inductie chemotherapie en leukaferese bij hyperleukocytose vergelijken, en alle data die er zijn AML patiënten betreffen (34). Patiënten met hyperleukocytose bij ALL hebben een hoger risico op het ontwikkelen van tumorlysis bij inductie behandeling, ter preventie zijn hyperhydratie en rasburicase geïndiceerd. Het risico op relapse is hoger bij ALL met hyperleukocytose(35-38).
|
SORT Grade |
Conclusie |
|
C |
Omdat leukostase met pulmonale of neurologische symptomen een klinische diagnose per exclusionem is, wordt geadviseerd andere oorzaken uit te sluiten middels beeldvorming. |
|
C |
Indien sprake is van leukostase met koorts, dient empirische behandeling met antibiotica gestart te worden. |
|
B |
Indien sprake is van hyperleukocytose wordt geadviseerd direct te starten met prednison 1 mg/kg of een equivalent hiervan, gevolgd door inductie chemotherapie. |
|
C |
Er lijkt geen plaats te zijn voor leukaferese. |
Referenties:
34. Korkmaz S. The management of hyperleukocytosis in 2017: Do we still need leukapheresis? Transfus Apher Sci. 2018;57(1):4-7.
Aanbevelingen en onderbouwing:
PEG-L-asparaginase is gepegyleerd L-asparaginase. Erwinase is Erwinia asparaginase. Voor PEG-asparaginase is geen testdosis geïndiceerd. Dosisaanpassingen met betrekking tot asparaginase staan vermeld in tabel 11 (39).
Er kan bij infusie van asparaginase een systemische reactie optreden, hypersensitiviteit genoemd. Dit gaat gepaard met een antistofresponse en inactivatie van asparaginase (40-42). Een switch naar Erwinase wordt dan geadviseerd als een complete inactivatie van asparaginase is bevestigd met een asparaginase activiteitsbepaling (Prinses Máxima Centrum voor Kinderoncologie, Utrecht). Dit kan via de volgende link, incl. aanvraagformulier en procedure: Asparaginase spiegel SOP Shared Care/Externe aanvragen (versie 1) (iprova.nl)
Soms is sprake van normale activiteit ondanks een reactie, deze wordt allergic-like reactie genoemd en manifesteert zich vaak wat later na toediening dan een werkelijke allergische reactie. Echter symptomen en gradering van de reactie verschillen niet tussen werkelijke allergie en allergic-like reactie. Stille inactivatie komt bij volwassenen met een ALL zeer weinig voor en standaard activiteitsbepaling wordt om die reden niet geadviseerd.
Verschillende studies suggereren een relatie tussen body mass index (BMI ≥30 kg/m2) en levertoxiciteit en ook tussen leversteatose en levertoxiciteit. Op basis van deze inzichten kan overwogen worden patiënten met een verhoogd risico op ernstige levertoxiciteit ten gevolge van PEG-asparaginase wat leidt tot vertraging in de chemotherapie, te switchen naar E.coli L-asparaginase 3x per week 6.000 U/m2 gedurende 3 weken(43, 44).
Tabel 11 dosisaanpassingen asparaginase
|
Pancreatitis |
Stop PEG-asparaginase tot herstel bij een mild beloop. Als sprake is van een ernstige pancreatitis, definitief staken. |
|
Hyperglycemie |
Geen dosisaanpassing, behandel hyperglycemie |
|
Amylase +/- lipase > 2x ULN |
Alleen asparaginase stoppen als sprake is van een pancreatitis. Verder zie boven bij pancreatitis |
|
Lever toxiciteit (bilirubine +/- ASAT en ALAT ≥ 5 x ULN) |
Stop tot herstel, geen dosisaanpassingen |
|
Hypertriglyceridemie |
Dieet en eventueel statines. Geen reden voor dosisreductie |
|
Klinische allergie, anafylaxie of anaphylactic like reactie |
Switch naar Erwinia asparaginase als activiteit bepaling 0 is. 1 gift PEG-asparaginase -> 6 giften Erwinia asparaginase 15.000 IU/m2 in 1 uur, 3x per week gedurende 2 weken. |
|
Trombose |
In principe geen reden tot het staken van de asparaginase. Advies ttv eerste remissie-inductie kuur hoog risico tromboseprofylaxe te geven tot 2 weken na de laatste gift peg-asparaginase |
|
Afwijkend stollingslab (i.e fibrinogeen, AT3) |
Geen bloedingsneiging, dan geen suppletie |
|
SORT Grade |
Conclusie |
|
C |
CR wordt gedefinieerd als < 5% blasten in beenmerguitstrijk of botbiopt, geen blasten in perifeer bloed zichtbaar (of < 1 % indien morfologisch 5-10% blasten worden gezien), geen extramedullaire leukemie |
Referenties:
Aanbevelingen en onderbouwing:
In geval van MTX geïnduceerde nefro-toxiciteit kan dialyse en toediening van glucarpidase overwogen worden(45). Deze twee behandelmodaliteiten zijn niet met elkaar vergeleken.
De indicaties voor toedienen van glucarpidase (voraxaze®) zijn weergegeven in de figuur. Indien op 24 uur na de toediening de MTX spiegel sterk verhoogd is (zie figuur), wordt geadviseerd de MTX spiegel na 12 uur (+ 36 uur na start) te herhalen. Bij volwassen wordt een dosering van 50 IE/kg geadviseerd, mogelijk zijn lagere doseringen even effectief, echter hier is vooralsnog onvoldoende bewijs voor.(46, 47). Let op: gedurende 2 uur voor en 2 uur na de glucarpidase geen folinezuur (Leucovorine®) geven.
|
SORT Grade |
Conclusie |
|
A |
In geval van MTX geïnduceerde nefro-toxiciteit kan dialyse en toediening van glucarpidase overwogen worden. Deze twee behandelmodaliteiten zijn niet met elkaar vergeleken. |
Referenties:
Aanbevelingen en onderbouwing:
Complete hematologische remissie (CR)
OF
Partiële response (PR)
OF
Falen van behandeling
Patiënten die geen CR of PR bereiken na inductie worden geclassificeerd aan de hand van onderstaande criteria:
Niet voldaan aan criteria voor CR, PR of recidief
Recidief na complete remissie is gedefinieerd als:
Opmerking:
Na recente chemotherapie en geen blasten in het perifere bloed EN wanneer het beenmerg 5-15% blasten bevat, moet beenmergonderzoek herhaald worden na een interval van tenminste 1 week om de mogelijkheid van een toename van blasten door vroege myeloïde regeneratie uit te sluiten. De herhaling van het onderzoek moet informatie opleveren om onderscheid te maken tussen persisterende leukemie of regeneratie.
Bovenstaande is van toepassing op evaluatie van de remissie-inductie behandeling, en eventueel de consolidatie behandeling wanneer er voorheen nog geen CR is vastgesteld.
|
SORT Grade |
Conclusie |
|
C |
CR wordt gedefinieerd als < 5% blasten in beenmerguitstrijk of botbiopt, geen blasten in perifeer bloed zichtbaar (of < 1 % indien morfologisch 5-10% blasten worden gezien), geen extramedullaire leukemie. |
Aanbevelingen en onderbouwing:
In het algemeen is het bepalen van MRD met behulp van flowcytometrie (volgens de EuroFlow SOPs of een andere gevalideerde equivalente test) het eenvoudigst en meest voor de hand liggend. Indien < 10-4 of <0,01% aberrante blasten worden gevonden in het beenmerg noemen we patiënt MRD negatief. Minimale restziekte kan ook bepaald worden door moleculaire analyse van immuunglobuline of T-cel receptor (IG/TR) genherschikkingen. Deze methode dient in ieder geval toegepast te worden na gebruik van blinatumomab in verband met therapie gericht tegen CD19 en mogelijk minder betrouwbare flowcytometrische analyse. Het gebruik van moleculaire MRD bepaling met behulp van IG/TR genherschikkingen wordt sterk aanbevolen indien sprake is van Philadelphia chromosoom positieve ALL. Deze combinatie kan een onderscheid maken tussen MRD negativiteit en CML-like disease. Namelijk als de BCR::ABL1 PCR nog zeer laag positief is en IG/TR negatief kan er sprake zijn van CML-like ziekte die eigenlijk geclassificeerd kan worden als MRD negatief(48, 49).
Moleculaire MRD analyse middels IG/TR (en eventuele fusiegenen) dient plaats te vinden in EuroMRD laboratoria (afdeling Immunologie, Erasmus MC; Sanquin, Amsterdam). Let wel: voor een moleculaire MRD analyse is de beschikbaarheid van diagnose (of eventueel recidief) materiaal (cellen of DNA) een vereiste. Voor BCR::ABL1 positieve patiënten kan MRD ook worden bepaald door kwantitatieve PCR analyse van het BCR::ABL1 fusiegentranscript door laboratoria die deelnemen aan de rondzendingen van de MODHEM of EuroMRD. Data dienen te worden uitgedrukt ten opzichte van diagnose materiaal en gerapporteerd te worden als ratio ten opzichte van diagnose(49).
|
Response bepaling op basis van MRD (3) |
|
|
Complete remissie (CR), complete hematologische remissie |
Morfologisch <5% blasten in beenmerguitstrijk of botbiopt zonder blasten in perifeer bloed en geen extramedullaire lokalisatie OF morfologisch 5-10% blasten in beenmerguitstrijk of botbiopt EN < 1% aberrante cellen bij immunofenotypering en zelfde voorwaarden tav perifeer bloed en extramedullaire lokalisatie |
|
Moleculaire CR (MRD negatief) |
CR en MRD negatief met gevoelige meting (flow dan wel PCR met gevoeligheid ≤10-4 |
|
Moleculaire/MRD response (MOLR) voor Ph POS en Ph NEG BCP-ALL |
CR en geen moleculaire CR, lage MRD positiviteit met flow of IG/TR PCR <10-4 |
|
Moleculair falen (MRD positief) |
CR zonder moleculaire CR/moleculaire response en MRD ≥10-4 |
|
Moleculair recidief (MolRel) |
CR met eerder moleculaire CR/moleculaire response en verlies hiervan met nu MRD ≥10-4 |
|
Recidief |
Geen CR meer met hematologisch recidief of extramedullair recidief (bijv. CZS) |
**NB indien MRD >0,1% of >10-3 is, is er een indicatie voor blinatumomab in de eerste lijnsbehandeling, zie pagina 19 van deze richtlijn.
|
SORT Grade |
Conclusie |
|
A |
Bepalen van MRD wordt geadviseerd te doen met behulp van flowcytometrie (volgens EuroFlow SOPs of andere gevalideerde equivalente test). Indien < 0,01% of < 10-4 ALL cellen worden gevonden wordt patiënt MRD negatief beschouwd. |
|
B |
MRD bij Ph positieve ALL kan worden bepaald middels flowcytometrie, BCR::ABL1 PCR en bij voorkeur ook met IG/TR genherschikkingen. Als een van deze positief is, i.e voor flowcytometrie ≥10-4 , voor BCR::ABL1 PCR positief en kwantificeerbaar en voor IG/TR ≥10-4 , wordt patiënt als positief beschouwd en is er een harde indicatie voor alloSCT. Indien BCR-ABL laag positief en IG/TR negatief is, dient gedacht te worden aan CML-like disease en patiënt kan als MRD negatief worden beschouwd. |
Indien sprake is van Ph positieve ALL wordt zowel MRD bepaald met flowcytometrie als met moleculaire analyse met behulp van RQ-PCR BCR::ABL1 en IG/TR genherschikkingen. Twee studies hebben laten zien dat deze bepalingen complementair zijn. Voor flowcytometrische MRD wordt een grens van 10-4 of 0,01% aangehouden en voor moleculaire MRD op basis van BCR::ABL1 ook 10-4 (3, 50-54).
Indien sprake is van meer dan 4 log reductie (<0,01% if 10-4) van BCR::ABL1 ten opzichte van baseline, en IG/TR genherschikkingen zijn negatief geworden, zou er sprake kunnen zijn van CML-like disease. Dit is de reden dat geadviseerd wordt ook IG/TR MRD bepaling te monitoren in patiënten met Ph positieve ALL.
Referenties:
3. Hoelzer D, Bassan R, Dombret H, Fielding A, Ribera JM, Buske C, et al. Acute lymphoblastic leukaemia in adult patients: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v69-v82.
48. Jabbour E, Haddad FG, Short NJ, Kantarjian H. Treatment of Adults With Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia-From Intensive Chemotherapy Combinations to Chemotherapy-Free Regimens: A Review. JAMA Oncol. 2022;8(9):1340-8.
49. Pfeifer H, Cazzaniga G, van der Velden VHJ, Cayuela JM, Schafer B, Spinelli O, et al. Standardisation and consensus guidelines for minimal residual disease assessment in Philadelphia-positive acute lymphoblastic leukemia (Ph + ALL) by real-time quantitative reverse transcriptase PCR of e1a2 BCR-ABL1. Leukemia. 2019;33(8):1910-22.
50. Campana D. Minimal residual disease in acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program. 2010;2010:7-12.
51. Bruggemann M, Raff T, Flohr T, Gokbuget N, Nakao M, Droese J, et al. Clinical significance of minimal residual disease quantification in adult patients with standard-risk acute lymphoblastic leukemia. Blood. 2006;107(3):1116-23.
52. van der Velden VH, Panzer-Grumayer ER, Cazzaniga G, Flohr T, Sutton R, Schrauder A, et al. Optimization of PCR-based minimal residual disease diagnostics for childhood acute lymphoblastic leukemia in a multi-center setting. Leukemia. 2007;21(4):706-13.
53. Zhao X, Zhao X, Chen H, Qin Y, Xu L, Zhang X, et al. Comparative Analysis of Flow Cytometry and RQ-PCR for the Detection of Minimal Residual Disease in Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia after Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant. 2018;24(9):1936-43.
54. Hrabovsky S, Folber F, Horacek JM, Stehlikova O, Jelinkova H, Salek C, et al. Comparison of Real-time Quantitative Polymerase Chain Reaction and Eight-color Flow Cytometry in Assessment of Minimal Residual Disease in Adult Acute Lymphoblastic Leukemia. Clin Lymphoma Myeloma Leuk. 2018;18(11):743-8.
Aanbevelingen en onderbouwing:
Refractair, gedefinieerd als geen CR op standaard remissie-inductie/consolidatiebehandeling.
Indien een patiënt refractair is op eerstelijnsbehandeling en/of een vroeg recidief heeft, wordt geadviseerd via de cytogenetica afdeling ABL-class fusies te bepalen via FISH onderzoek op diagnose materiaal (zowel B- als T-ALL). Indien een ABL-class fusie aanwezig is, kan overwogen worden dasatinib toe te voegen aan de behandeling(55-58). Indien sprake is van een JAK-STAT fusie zijn er enkele casus beschreven waarbij een JAK inhibitor op individuele basis zou kunnen worden overwogen(55, 57, 59-62).
Advies: blinatumomab of inotuzumab ozogamicine (IO) kunnen beide gegeven worden voor CD19 en/of CD22 positieve precursor B-ALL(63, 64). Er zijn situaties te definiëren waarbij er een voorkeur voor het ene boven het andere middel is. Zie in onderstaande tabel, deze gebaseerd op factoren die de kans op VOD verhogen bij het gebruik van IO(61, 65):
Tabel 12 leidraad voor behandeling blinatumomab of inotuzumab ozogamicine (IO)
|
|
Voorkeur blinatumomab |
Voorkeur IO |
|
CD19 of CD22 + |
CD19+/CD22- |
CD19-/CD22+ |
|
Hoog leucocytenaantal bij diagnose en/of bulky disease |
Voorzichtigheid met blinatumomab. overweeg debulking milde chemotherapie vooraf |
Ja |
|
Symptomatische CZS+ |
Nee (blinatumomab nietuitgesloten na MTX i.t. en schone liquor) |
Ja |
|
VG CVA/epilepsie |
Nee |
Ja |
|
Kandidaat 2de alloSCT |
Ja |
Nee |
|
Ouder dan 55 jaar |
Ja |
Nee |
|
Niet-verwante donor |
Ja |
Nee |
|
Pre-existente leverziekte (hyperbilirubinemie, ASAT/ALAT 3xULN, actieve hepatitis) |
Ja |
Nee |
|
Kandidaat CART-cellen |
Nee |
Ja |
Debulking
Bij > 50% blasten in het beenmerg voorafgaand aan de eerste blinatumomab infusie, is het advies corticosteroiden met of zonder lage dosis cyclofosfamide te geven als debulking therapie (maximaal gedurende een week)om het risico op cytokine release syndroom te beperken en respons te verhogen. Er zijn geen schema’s die een duidelijke voorkeur hebben. Wel lijkt combinatie chemotherapie (zoals cyclofosfamide en vincristine met of zonder steroïden effectiever dan steroïden alleen) (66)
Blinatumomab
Doseringsschema: 9 ug/dag de eerste week gevolgd door 28 ug/dag daarna middels continue infusie gedurende 4 weken in totaal waarna 2 weken rust. Tweede kuur 28 ug/dag continu gedurende 4 weken.
Inotuzumab ozogamicine
Doseringsschema in de eerste cyclus wordt dag 1 wordt inotuzumab ozogamicine in een cyclus van 3 weken gegeven. Op dag 1 wordt 0,8 mg gegeven en op dag 8 en 15 van iedere cyclus 0,5 mg onafhankelijk van de remissiestatus. De eerste cyclus duurt 3 weken (maar kan verlengd worden tot 4 weken indien sprake is van incompleet herstel of toxiciteit) en de daarop volgende cycli worden a 4 weken gegeven. Er worden maximaal 6 cycli gegeven. Indien een patiënt wordt doorgeleid naar allogene stamceltransplantatie, worden maximaal 2 cycli inotuzumab ozogamicine geadviseerd in verband met het toegenomen risico op VOD bij meer cycli.
Chemotherapie
Een alternatief is re-inductie met chemotherapie (zoals 1. Hoge dosis ARA-C; OF 2. Hoge dosis MTX), indien recent geen expositie aan deze middelen, gevolgd, na herstel van slijmvliezen en gastro-intestinale toxiciteit (herstel perifere bloedwaarden is niet vereist) door 1 of 2 kuren blinatumomab, ook als brug naar alloSCT.
Doseringsschema: 1500 mg/m2 a 12 uur op dag 1, 3, 5, 7 en indien cumulatieve dosis anthracyclines nog niet bereikt is, in combinatie met daunorubicine 90 mg/m2 op dag 1 t/m 3
Clofarabine
Doseringsschema: Cyclofosfamide dag 0-1 300 mg/m2, clofarabine dag 1 -4 10 mg/m2 en cyclofosfamide 600 mg/m2 op dag 2 – 4(67)
gevolgd door 1 of 2 kuren blinatumomab, na herstel van slijmvliezen en gastro-intestinale toxiciteit (herstel perifere bloedwaarden is niet vereist)als brug naar alloSCT.
Na het bereiken van CR (op beenmergniveau), consolideren met alloSCT met sib/MUD (9/10 of 10/10)/cord- of haplo-donor. Indien geen donor beschikbaar is of de patient niet geschikt is voor allogene stamceltransplantatie, dan starten met reguliere onderhoud (MTX/prednison/vincristine/6-mercaptopurine (MP)).
Inductiebehandeling met blinatumumab of inotuzumab ozogamicine bij patiënten met refractaire B-ALL of recidief B-ALL binnen 12 maanden wordt met name aangeraden als brug naar alloSCT of CART-celtherapie. Zonder mogelijkheid tot consolidatie behandeling leiden deze behandelingen slechts tot een zeer beperkte levensverlenging. . (68, 69).
Voor klinische studies buiten HOVON studieverband zie voor een actueel overzicht: https://hovon.nl/en/trials/associated-studies.
|
SORT Grade |
Conclusie |
|
B
|
Indien een patiënt refractair is op eerstelijnsbehandeling en/of een vroeg recidief heeft, wordt bepaling van ABL-class fusies geadviseerd op diagnose materiaal (zowel B- als T-ALL). Indien een ABL-class fusie aanwezig is, kan overwogen worden dasatinib toe te voegen aan de behandeling. |
|
A |
Indien sprake is van een JAK-STAT fusie zijn er onvoldoende data die een JAK inhibitor rechtvaardigen. Blinatumomab of inotuzumab ozogamicine (IO) kunnen beide gegeven worden voor refractair of vroeg recidief CD19 en/of CD22 positieve precursor B-ALL. |
Referenties:
Re-inductie met reguliere, intensieve combinatie-chemotherapie zie tabel 1 of 3, gevolgd, indien minimaal partiele response is bereikt na consolidatie kuur 1, door 1 of 2 kuren blinatumomab en na herstel van slijmvliezen en gastro-intestinale toxiciteit (herstel perifere bloedwaarden is niet vereist).
Indien refractair op re-inductie kan blinatumomab of inotuzumab ozogamicine (IO) gegeven worden. Zie ook paragraaf 16.
|
SORT Grade |
Conclusie |
|
C |
Re-inductie met reguliere, intensieve combinatie-chemotherapie zie tabel 1 of 3, gevolgd, indien minimaal partiele respons is bereikt na consolidatie kuur 1, door 1 of 2 kuren blinatumomab en na herstel van slijmvliezen en gastro-intestinale toxiciteit. |
Aanbevelingen en onderbouwing:
Indien een patiënt refractair is op eerstelijnsbehandeling en/of een vroeg recidief heeft, wordt geadviseerd via de cytogenetica afdeling ABL-class fusies te bepalen via FISH onderzoek op diagnose materiaal (zowel B- als T-ALL) . Indien een ABL-class fusie aanwezig is, kan overwogen worden dasatinib toe te voegen aan de behandeling. Indien sprake is van een JAK-STAT fusie zijn er onvoldoende data die een JAK inhibitor rechtvaardigen (55-57, 59, 60).
Hoewel meer dan 90% van patiënten met een precursor T-ALL met intensieve chemotherapie een complete remissie bereikt, is de 5-jaars overleving <50%. De belangrijkste oorzaak voor de slechte uitkomst is een recidief percentage van meer dan 40% en een slechte overleving na een recidief (52).
De GRAALL analyseerde de uitkomsten van de behandeling van 229 patiënten met recidief ALL zonder translocatie (9;22) na eerdere intensieve chemotherapie (waarvan 78 met T-ALL). Van de patiënten die met intensieve chemotherapie werden behandeld, behaalde 53% een CR2. Patiënten bij wie de eerste CR 18 maanden of meer had geduurd hadden een grotere kans op het bereiken van CR2. Het ondergaan van een allogene SCT na het bereiken van CR2 was geassocieerd met een betere ziekte vrije en overall overleving.53
Nelarabine is geregistreerd voor de behandeling van recidief T-ALL zonder CNS-lokalisatie. Behandeling met 1 of 2 kuren (1,5 gram/m2/dag op dag 1,3 en 5) bij recidief T-ALL leverde bij 39 volwassen patiënten (16-66 jaar) een CR en PR op van 31% en 10%. Na 1 jaar was de OS 28% .54 Een eenarmige studie in Duitsland naar nelarabine bij recidief T-ALL toonde bij 126 volwassen patiënten (18-81 jaar) bij 36% van de patiënten een CR en 12% een PR. Indien na het bereiken van een CR een consolidatie met een alloSCT werd uitgevoerd, was de OS in deze studie na 3 jaar 36%. Indien na bereiken van CR geen alloSCT werd uitgevoerd, was de OS na 3 jaar 0%.55 Belangrijk is te melden dat nelarabine kan leiden tot beenmergsuppressie en neurotoxiciteit waaronder polyneuropathie, verwardheid en insulten.
Op basis van deze literatuur lijkt het behalen van een tweede CR gevolgd door een alloSCT de beste kans te geven op langdurige overleving bij patiënten met een recidief T-ALL.
Chemotherapie
Er is geen onderzoek bekend naar de beste behandeling van patiënten met T-ALL die refractair zijn op eerstelijns intensieve chemotherapie. De werkgroep adviseert daarom bij deze patiëntengroep dezelfde behandelstrategie te hanteren als bij de patiënten met een recidief na intensieve chemotherapie, met uitzondering van het advies om intensieve chemotherapie te herhalen.
Nelarabine
Doseringsschema: 1.5 g/m2 in 2 uur op dag 1, 3 en 5 in een cyclus van 21 dagen. Als na 2 cycli geen response is, dan als refractair op nelarabine beschouwen.
Hoge dosis methotrexaat
Een alternatief voor nelarabine is hoge dosis methotrexaat indien dit nog niet is gegeven.
Na bereiken CR, doorgaan met allogene SCT met sib/MUD/ cord- of haplo-donor. Indien er geen donor beschikbaar is, dan starten reguliere onderhoud (MTX/prednison/vincristine/6-mercaptopurine).
Voor klinische studies buiten HOVON studieverband zie voor een actueel overzicht: https://hovon.nl/en/trials/associated-studies.
|
SORT Grade |
Conclusie |
|
C
C |
Indien een patiënt refractair is op eerste lijns behandeling en/of een vroeg recidief heeft, wordt geadviseerd ABL-class fusies te bepalen op diagnose materiaal (zowel B- als T-ALL) . Indien een ABL-class fusie aanwezig is, kan overwogen worden dasatinib toe te voegen aan de behandeling. Indien sprake is van een JAK-STAT fusie zijn er onvoldoende data die een JAK inhibitor rechtvaardigen. Er is geen onderzoek bekend naar de beste behandeling van patiënten met T-ALL die refractair zijn op eerstelijns intensieve chemotherapie. De werkgroep adviseert daarom bij deze patiëntengroep dezelfde behandelstrategie te hanteren als bij de patiënten met een recidief na intensieve chemotherapie, met uitzondering van het advies om intensieve chemotherapie te herhalen. |
Referenties:
Aangezien in de GRAALL-analyse het herhalen van de standaard intensieve chemotherapie bij 50% van de patiënten met recidief ALL tot een CR2 leidt, is het advies om indien de eerste complete remissie (CR1) >12 maanden en zeker wanneer CR1>18 maanden duurde, opnieuw standaard intensieve chemotherapie te geven. Indien refractair op re-inductie chemotherapie, kan nelarabine worden overwogen of hoge dosis methotrexaat.
Na het bereiken van CR doorgaan met allogene SCT met sib/MUD/cord- of haplo-donor. Indien er geen donor beschikbaar is, dan starten reguliere onderhoud (MTX/prednison/vincristine/6-mercaptopurine).
|
SORT Grade |
Conclusie |
|
B |
Bij recidief ALL leidt herhalen van intensieve chemotherapie tot een tweede CR bij meer dan 50% van de patiënten. Indien de eerste CR langer dan 18 maanden duurde is de kans op het bereiken van een tweede CR met herhalen van intensieve chemotherapie groter dan wanneer de eerste CR korter duurde dan 18 maanden. |
|
B |
Het ondergaan van een allogene SCT na het bereiken van een tweede CR geeft de grootste kans op langdurige kans op overleving na recidief T-ALL. |
|
B |
Bij recidief T-ALL leidt behandeling met nelarabine tot een CR bij 31-36% van de patiënten. Indien volwassen patiënten met een relaps T-ALL met een CR na nelarabine een allogene SCT ondergaan, is de 3 jaar OS 36% vanaf het bereiken van een CR |
Aanbevelingen met onderbouwing:
Blinatumomab kan gegeven worden aan patiënten die refractair zijn na chemotherapie en tevens aan patiënten die na eerstelijns behandeling in CR zijn, maar MRD positief na consolidatie kuur 1. Belangrijke unieke toxiciteit wordt beschreven bij het gebruik van blinatumomab waaronder cytokine release syndroom (CRS) en immune effector cell-associated neurotoxicity syndrome (ICANS).
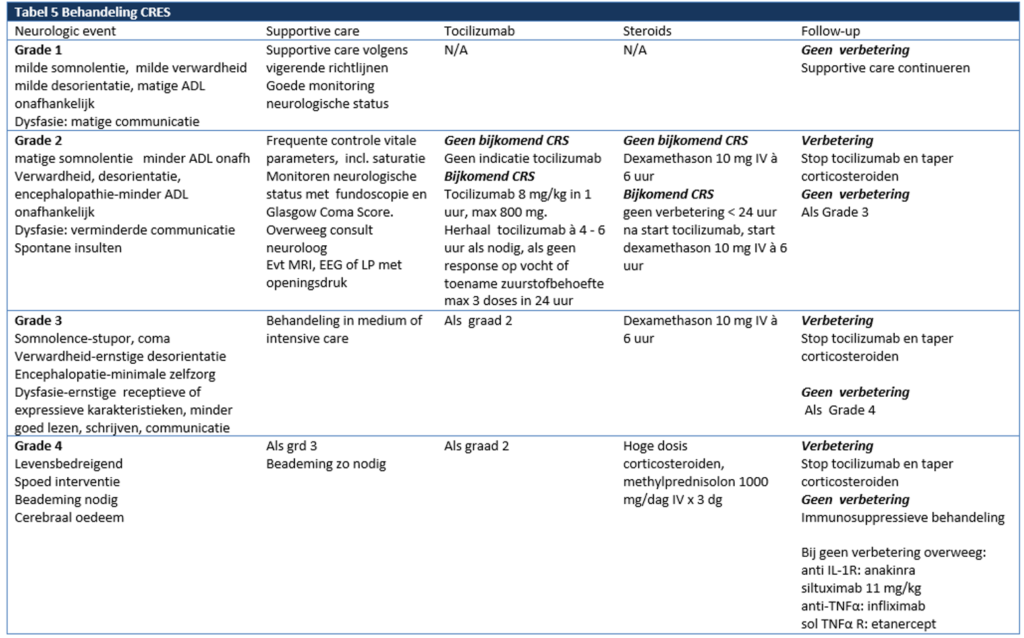
CRS ontstaat door activatie van cytotoxische T-cellen door de monoclonale antistof en gaat gepaard met de release van cytokines die leiden tot koorts en malaise, maar kan in ernstigere gevallen gepaard gaan met hypotensie, hypoxie, nierfalen, capillary leak syndroom, DIS of HLH. Het beleid ten aanzien van CRS is afhankelijk van de ernst van het CRS. Tabel 13 beschrijft de gradering die wordt toegepast voor het CRS. Indien zich neurologische toxiciteit of andere toxiciteit (inclusief CRS) voordoet ten tijde van het gebruik van blinatumomab, zie tabel 14 voor behandeling en tabel 16 voor dosisaanpassingen van blinatumomab.
ICANS is een beeld van neurotoxiciteit dat waarschijnlijk veroorzaakt wordt door verstoring van de bloed-hersen barrière door geactiveerde T-cellen met vervolgens cytokine release en binding aan CD19 positieve B-cellen in het CZS. Het klinisch beeld kan variëren van hoofdpijn, malaise, verwardheid, slaperigheid of desoriëntatie naar meer ernstigere vormen bestaande uit ataxie, epilepsie, afasie en coma. Ten aanzien van de behandeling ICANS, zie tabel 15.(70)
|
SORT Grade |
Conclusie |
|
A |
Belangrijke unieke toxiciteit wordt beschreven bij het gebruik van blinatumomab waaronder cytokine release syndroom (CRS) en immune effector cell-associated neurotoxicity syndrome (ICANS). Tabel 10 en 11 beschrijven een aanpak indien dit optreedt. |
Referenties:
Aanbevelingen met onderbouwing:
Voor deze patiënten wordt een niet-curatief beleid geadviseerd met steroïden gecombineerd met chemotherapie: vincristine, 6-mercaptopurine, methotrexaat oraal (maintenance-like schema). Zowel de dosis als de frequentie van deze chemokuren, zijn een afweging die door de behandelend arts, op geleide van de conditie en de wens van de patiënt wordt gemaakt.
In principe komen deze patiënten ook in aanmerking voor CNS-profylaxe/behandeling maar het is aan de behandelaar te overwegen het starten of niet met de intrathecale therapie.
Patiënten met een B-ALL Philadelphia chromosoom positief, komen ook in aanmerking voor een niet-curatief beleid gericht op palliatie met steroïden gecombineerd met een TKI-remmer. Indien er sprake is van CNS-betrokkenheid is er een voorkeur voor dasatinib. Bij resistentie of contra-indicatie voor alle TKI-remmers (imatinib, dasatinib, nilotinib, bosutinib en ponatinib), kan een ABL1 remmer (asciminib) worden overwogen, dit is echter nog niet geregistreerd voor deze indicatie.
|
SORT Grade |
Conclusie |
|
B |
Een niet curatief beleid (milde conventionele chemotherapie) wordt geadviseerd bij patiënten die niet in aanmerking komen voor allogene stamceltransplantatie. Indien sprake is van Philadelphia positiviteit kunnen steroïden gecombineerd worden met een TKI. |
Tabel 13 en 14. Gradering en behandeling van CRS
Tabel 16. dosis aanpassingen blinatumomab
|
Toxiciteit |
Gradering |
Advies |
|
Cytokine release syndrome (CRS) (voor gradering zie tabel 9) |
Grade 3 |
Stop blinatumomab tot herstel en hervat met 9 µg/dag. Na 7 dagen ophogen naar 28 µg/dag (bij hernieuwde toxiciteit, staken). Evt. tocilizumab 8 mg/kg in 1 uur is een optie en kan elke 4 tot 6 uur herhaald worden bij effect. |
|
Grade 4 |
Permanent staken van blinatumomab. Tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
|
|
Neurologische toxiciteit |
Convulsies |
Permanent staken van blinatumomab. |
|
Grade 3 |
Stop blinatumomab tot herstel en hervat met 9 µg/dag. Na 7 dagen ophogen naar 28 µg/dag (bij hernieuwde toxiciteit, staken). Herhaal altijd dexamethasone 20 mg voor herstart. Evt. tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. Stop blinatumomab definitief als deze recidiveert onder 9 µg/dag of als toxiciteit langer dan 7 dgn duurt. |
|
|
Grade 4 |
Permanent staken van blinatumomab. Tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
|
|
Leverenzymstoornissen |
Grade 3 |
Als klinisch relevant, dan evt. Staken tot graad 1 en hervat met 9 µg/dag. Na 7 dagen ophogen naar 28 µg/dag (bij hernieuwde toxiciteit, staken). Evt. tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
|
Grade 4 |
Permanent staken van blinatumomab. Tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
|
|
Overige klinisch relevante bijwerkingen |
Grade 3 |
Als klinisch relevant, dan evt. Staken tot graad 1 en hervat met 9 µg/dag. Na 7 dagen ophogen naar 28 µg/dag (bij hernieuwde toxiciteit, staken). Evt. tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
|
Grade 4 |
Permanent staken van blinatumomab. Tocilizumab 8 mg/kg in 1 uur geven en dit kan elke 4 tot 6 uur herhaald worden bij effect. |
Aanbevelingen met onderbouwing:
Patiënten met een hoog risico ALL (zie uitgangsvraag 4) komen in aanmerking voor een allogene stamceltransplantatie met stamcellen van een HLA-identieke broer of zus of van een onverwante donor met een 10/10 match of een 9/10 match in de Host versus Graft richting. Indien er geen geschikte donor is kan overwogen worden een alternatieve donor te zoeken (niet gematchte onverwante donor, cord blood of haplo-identieke donor)
Bij patiënten onder de 40 jaar wordt een myeloablatieve conditionering geadviseerd. Het toevoegen van totale lichaamsbestraling leidt bij ALL tot een lagere recidief kans en wordt daarom geprefereerd boven alleen chemotherapie, mits de co-morbiditeit dit toelaat. Bij patiënten boven de 55 tot 60 jaar wordt een niet-myeloablatieve conditionering geadviseerd. Voor patiënten tussen 40-55 jaar, wordt een beleid gevolgd op basis van de conditie van de patiënt, bewerken transplantaat en intensiteit conditionering.
Een intensieve, myeloablatieve conditionering voor een allogene stamceltransplantatie gaat gepaard met een lagere kans op een relaps maar leidt ook tot een hogere kans op non-relaps mortaliteit (NRM). De kans op NRM neemt toe met de leeftijd. Er kan bij patiënten met co-morbiditeit of bij oudere patiënten gekozen worden voor een niet-myeloablatieve conditionering. Hierbij is er een grotere relapse kans maar de NRM ligt lager dan na een myeloablatieve conditionering. Bovendien is er een kleine groep patiënten die ondanks hoog risico kenmerken ook zonder consolidatie met allogene stamceltransplantatie een langdurige overleving kent. Helaas is het met de huidige classificatiesystemen nog niet mogelijk om deze patiënten adequaat te identificeren.
Bij patiënten die volgens het chemotherapie schema van > 40 jaar worden behandeld, werd in de HOVON 100 studie geadviseerd de stamceltransplantatie aansluitend aan consolidatie II in te plannen. Aangezien deze kuur in de praktijk nog wel eens gepaard gaat met levertoxiciteit die kan interfereren met de conditionering voor de transplantatie, kan overwogen worden om in dit schema na Consolidatie I eerst consolidatie II te geven gevolgd door inductie II.
In een recente CIBMTR analyse naar de uitkomsten van 1118 volwassen patiënten (leeftijd 18 tot 60, gemiddeld 37 jaar) met ALL in eerste of tweede complete remissie die een allogene stamcel transplantatie ondergingen na myeloablatieve conditionering, was na drie jaar het relaps percentage 28-37% en de overall survival 53-57%. In de subgroep van 209 patiënten met een leeftijd tussen 50 en 60 was op 3 jaar de NRM 29-34% en de overall survival 40-49% (72).
Een CIBMTR analyse naar de uitkomsten van allogene stam cel transplantatie na niet-myeloablatieve conditionering bij 273 ALL patiënten van 55 jaar en ouder (gemiddeld 61, range 55-72 jaar) toonde op 3 jaar een NRM van 25% en een OS van 38%. In de subgroep van patiënten in eerste complete remissie was de OS op drie jaar 45%(73).
Bij patiënten met ALL leidt het niet-myeloablatieve schema zoals dat in Seattle ontwikkeld is tot een 3 jaar OS van 34% (NRM 28% en relapse percentage 40%) in een groep van 51 patiënten met een gemiddelde leeftijd van 56 jaar (range 8-69) (74).
|
SORT Grade |
Conclusie |
|
C |
Bij patiënten onder de 40 jaar wordt een myeloablatieve conditionering geadviseerd. Voor patiënten tussen 40-55 jaar, wordt een beleid gevolgd op basis van de conditie van de patiënt, bewerken transplantaat en intensiteit conditionering. Bij patiënten boven de 55 tot 60 jaar wordt een niet-myeloablatieve conditionering geadviseerd. |
Referenties:
Aanbevelingen met onderbouwing:
Indien bij de patiënt een translocatie 9;22 dan wel BCR-ABL aantoonbaar is (Ph positief), dient direct imatinib 600 mg aan de behandeling te worden toegevoegd. Als patiënten 600 mg niet verdragen volstaat een verlaging van de dosering naar 400 mg. Ph+ ALL wordt geclassificeerd als hoog risico ziekte en dus komen deze patiënten in aanmerking voor een allogene stamceltransplantatie.
Er zijn echter aanwijzingen dat mensen met Ph + ALL die snel MRD negatief (Complete moleculaire respons < 3 maanden, met een gevoeligheid van 0,01%) een goede lange termijn overleving hebben zonder allogene stamceltransplantatie. Daarom wordt geadviseerd indien er een contra-indicaties is voor transplantatie of andere voorkeuren van de patiënt, tot progressie een onderhoudsbehandeling met een TKI te overwegen.(75, 76)
Deze nuancering geldt uitdrukkelijk niet voor patiënten met IKZF1 Plus in Ph+: IKZF1 + CDKN2A/B , PAX5 of PAR1 deletie, en afwezige ERG deletie. Deze patiënten hebben in alle studies een slechtere uitkomst dan overige Ph+ ALL.(7, 77, 78)
Imatinib, of een andere tyrosine kinase remmer (TKI) wordt gecontinueerd tot er een recidief optreedt, tot het einde van de onderhoudsbehandeling of tot 12 maanden na allogene stamceltransplantatie afhankelijk van welke eerst komt. Als BCR-ABL positief blijft na de eerste consolidatie kuur 1B of weer positief wordt na eerder negatief te zijn geweest, wordt een 2de generatie TKI geadviseerd na BCR-ABL mutatieanalyse. Er bestaat een voorkeur voor dasatinib in de tweede lijn gezien de ruime ervaring met dit middel in combinatie met chemotherapie. Indien er een T315I mutatie wordt aangetoond, wordt ponatinib geadviseerd. Indien CZS betrokkenheid wordt aangetoond bij een Philadelphia positieve ALL, is er een voorkeur voor dasatinib in plaats van imatinib in de eerste lijn. Dit is gebaseerd op dierexperimentele en enkel humane data(33).
Ponatinib bij ALL+
Hoewel ponatinib in een aantal studies zeer goede effectiviteit laat zien qua respons, disease free survival en overall survival zijn er onvoldoende data over de toxiciteit en heeft het middel in de regel forse toxiciteit met name pancytopenie en dyslipidemie en de daaraan gerelateerde complicaties. Derhalve vinden wij dat er onvoldoende onderbouwing is om ponatinib in de 1e lijn te adviseren. Bij resistente of recidief zou ponatinib wel een rol kunnen spelen. De meest gebruikte dosering is 30mg 1dd, eventueel met een begin dosissering gedurende 2 weken 45mg 1dd, maar ook dosisreductie op basis van toxiciteit tot 15mg 1dd. (77, 79, 80)
|
SORT Grade |
Conclusie |
|
A |
Ph+-ALL: imatinib 600 mg dient aan de behandeling te worden toegevoegd. Ph+ ALL wordt geclassificeerd als hoog risico ziekte en dus komen deze patiënten in aanmerking voor een allogene stamceltransplantatie. Nuancering; indien snel MRD negatief (dwz complete moleculaire respons < 3 maanden, met gevoeligheid van 0,01%) kan hiervan worden afgeweken, bijv indien er contra-indicaties voor transplantatie zijn of andere voorkeuren van de patiënt, dan wordt het continueren van de TKI geadviseerd. Deze nuancering geldt niet voor patiënten met IKZF1 Plus in Ph+: IKZF1 + CDKN2A/B , PAX5 of PAR1 deletie, en afwezige ERG deletie. Deze patiënten classificeren voor allogene stamceltransplantatie indien haalbaar. |
|
B |
Er is onvoldoende onderbouwing om ponatinib in de 1e lijn op dit moment te adviseren, bij resistente of recidief zou dit wel een rol kunnen spelen. |
Referenties:
7. Stanulla M, Dagdan E, Zaliova M, Moricke A, Palmi C, Cazzaniga G, et al. IKZF1(plus) Defines a New Minimal Residual Disease-Dependent Very-Poor Prognostic Profile in Pediatric B-Cell Precursor Acute Lymphoblastic Leukemia. J Clin Oncol. 2018;36(12):1240-9.
33. Porkka K, Koskenvesa P, Lundan T, Rimpilainen J, Mustjoki S, Smykla R, et al. Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia. Blood. 2008;112(4):1005-12.
75. Giebel S, Czyz A, Ottmann O, Baron F, Brissot E, Ciceri F, et al. Use of tyrosine kinase inhibitors to prevent relapse after allogeneic hematopoietic stem cell transplantation for patients with Philadelphia chromosome-positive acute lymphoblastic leukemia: A position statement of the Acute Leukemia Working Party of the European Society for Blood and Marrow Transplantation. Cancer. 2016;122(19):2941-51.
76. Chalandon Y, Thomas X, Hayette S, Cayuela JM, Abbal C, Huguet F, et al. Randomized study of reduced-intensity chemotherapy combined with imatinib in adults with Ph-positive acute lymphoblastic leukemia. Blood. 2015;125(24):3711-9.
77. Sasaki K, Kantarjian HM, Short NJ, Samra B, Khoury JD, Kanagal Shamanna R, et al. Prognostic factors for progression in patients with Philadelphia chromosome-positive acute lymphoblastic leukemia in complete molecular response within 3 months of therapy with tyrosine kinase inhibitors. Cancer. 2021;127(15):2648-56.
78. Short NJ, Jabbour E, Sasaki K, Patel K, O’Brien SM, Cortes JE, et al. Impact of complete molecular response on survival in patients with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood. 2016;128(4):504-7.
79. Jabbour E, DerSarkissian M, Duh MS, McCormick N, Cheng WY, McGarry LJ, et al. Efficacy of Ponatinib Versus Earlier Generation Tyrosine Kinase Inhibitors for Front-line Treatment of Newly Diagnosed Philadelphia-positive Acute Lymphoblastic Leukemia. Clin Lymphoma Myeloma Leuk. 2018;18(4):257-65.
80. Ribera JM, Garcia-Calduch O, Ribera J, Montesinos P, Cano-Ferri I, Martinez P, et al. Ponatinib, chemotherapy, and transplant in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood Adv. 2022;6(18):5395-402.
Aanbevelingen en onderbouwing:
Voor de Ph + patiënten zijn er iets meer (9) prospectieve studies bij oudere patiënten. Enkele waarbij ook allogene stamceltransplantatie een onderdeel is van de behandeling. Zowel de combinatie van imatinib met chemotherapie, als nilotinib met chemotherapie als dasatinib met chemotherapie is onderzocht. CR percentages bereikt met combinatie dasatinib/chemotherapie en nilotinib/chemotherapie zijn rond de 96 en 97% met een 5-jaars overleving van 36 en 22%. Voor de imatinib-chemotherapie combinatie zijn de CR percentages 87-88% met een 5-jaars overleving van 22% (1 studie). Dit betreft overigens onderzoeken met weinig patiënten, waarbij niet beschreven is hoeveel patiënten 70 jaar of ouder zijn. Gezien het feit dat er geen verschillen zijn gemeten in overall survival ondanks betere CR percentages gaat de voorkeur uit naar het toevoegen van imatinib 600 mg aan de chemotherapie. (81-83) (84-89)
Tabel 17 Eerstelijns behandeling niet fitte oudere patiënten met Ph negatieve ALL
|
Remissie Inductie 1 (RI1) |
||
|
Dexamethason (po) |
3 mg/m2 |
1-3 |
|
Rituximab (iv, CD20 positief) |
375 mg/m2 |
8, 15 |
|
Vincristine (iv) |
1 mg/m2 (max. 2 mg) |
1 |
|
Idarubicine (iv) |
10 mg/m2 |
1 |
|
Methotrexaat (it) |
12,5 mg |
1, 8, 15, 22 (kuur 3 alleen dag 2) |
|
Dexamethason (it) |
4 mg |
1, 8, 15, 22 (kuur 3 alleen dag 2) |
|
Imatinib (po) |
400 mg/dag, ophogen tot 600 mg/dag na 2 weken |
8-25 |
|
Herhaal 2 keer deze zelfde kuur als perifere bloed hersteld met neutrofielen > 0,75 x109/L en trombocyten > 75 x 109/L |
||
|
NB in de 3e kuur, slechts 1 LP met MTX en dexamethason i.t. op dag 2 bij voorkeur |
||
|
Na de 3e kuur en bij herstel perifere bloed wordt gestart met de onderhoudsbehandeling. |
||
|
Onderhoud (24 maanden) |
||
|
6-mercaptopurine * (po) |
25 mg/m2 – 75 mg/m2 (streef neutrofielen 0,75 – 1,5 en trombocyten |
1-3 |
|
75 – 150) * |
||
|
Imatinib (po) |
400 of 600 mg |
1-28 |
|
Prednisolon (po) |
60 mg/m2 |
5 dagen/3 maanden |
|
Methotrexaat (it) |
12,5 mg |
1x /3 maanden |
|
Dexamethason (it) |
4 mg |
1x /3 maanden |
|
Vincristine (iv) |
1,4 mg/m2 (max 2 mg) |
1x /3 maanden |
|
* 6-MP starten met 25 mg/m2 en dan ophogen op geleide tolerantie iedere 4 weken tot maximaal 75 mg/m2 |
||
|
SORT Grade |
Conclusie |
|
B |
Milde chemotherapie in combinatie met een TKI, bij voorkeur imatinib. |
Referenties:
Aanbevelingen en onderbouwing:
Sinds 1 januari 2019 is tisagenlecleucel (merknaam Kymriah, het CAR-T cel product van Novartis) geregistreerd in Nederland voor de behandeling van kinderen en jong volwassen patiënten tot en met de leeftijd van 25 jaar met:
Deze registratie is gebaseerd op de klinische data van meerdere studies waarvan de grootste en meest recente staan weergegeven in Tabel 18.
Tabel 18 Overzicht studies registratie tisagenlecleucel
|
Studie |
Type CAR |
Aantal ptn |
Leeftijd |
CR |
Blasten % |
Allo SCT |
1 jrs OS |
|
Hay et al. 2019(90) |
Autoloog Activatie domein CD3zeta, costimulatory domain 4-1BBB |
53 ptn geinfundeerd (10,1% geëxcludeerd voor infusie) |
20-76 jaar |
85% (allen MRD-) |
64% had >5% blasten in BM, 32% was MRD+, 2 ptn hadden enkel extramedullaire ziekte |
43% voorafgaande allo SCT 18/45 ptn in MRD- CR hebben post CART alloSCT ondergaan (geassocieerd met betere DFS en OS) |
Mediane OS 20 m in MRD- CR vs 5m in non responders |
|
Maude et al. 2018(91) |
Autoloog Activatie domein CD3zeta, costimulatory domain 4-1BBB |
75 ptn geinfundeerd (18,5% geëxludeerd voor infusie) |
3-23 jaar |
81% (allen MRD-) |
Mediaan 74% (range 5-99%) |
61% post allOSCT 8 ptn hebben in CR post CART alloSCT ondergaan |
76% |
|
Park et al. 2018(92) |
Autoloog Activatie domein CD3zeta, costimulatory domain CD28 |
53 ptn (36% geëxludeerd voor infusie) |
23-74 jaar |
83% |
Mediaan 63% (range 5-97%) |
36% post alloSCT 17 ptn hebben post CART alloSCT ondergaan |
Mediane OS was 12.9 m voor alle ptn, in MRD- ptn dit was 20.7 maanden |
|
Turtle et al. 2016(93) |
|
32 ptn (6% geëxludeerd voor infusie) |
20-73 jaar |
93% |
Mediaan 21% (range 0-97%) |
11 ptn post alloSCT |
Niet genoemd |
|
Lee et al. 2015(94) |
Autoloog, costimulatory domain CD28 |
20 |
1-30 jaar |
70% (60% MRD-) |
Mediaan 26% |
8/20 ptn post alloSCT 10 ptn hebben post CART alloSCT ondergaan (allen MRD-) |
OS na 10 maanden was 51,7%, |
De plaatsbepaling van tisagenlecleucel ten opzichte van de nieuwe middelen blinatumomab en inotuzumab ozogamicine of een (tweede) allogene stamceltransplantatie is nog niet duidelijk. De beschikbare data hierover conflicteren van geen voordeel in de studie van Park et al. (92) tot wel voordeel in de studie van Hay et al.(90) Het standpunt van o.a. de EBMT en ASH werkgroepen is hierin dan ook nog onbeslist(95). Allogene stamceltransplantatie moet in ieder geval overwogen worden bij patiënten die nog niet eerder een allogene SCT hebben ondergaan. Andere factoren die hierin kunnen worden betrokken zijn comorbiditeit, beschikbare donor, MRD status, B-cel aplasie en persistentie van CAR-T cellen. Tisagenlecleucel dient te worden overwogen bij patiënten tot en met 25 jaar met een refractaire of recidief B-ALL. De timing van tisagenlecleucel ten opzichte van blinatumomab, inotuzumab ozogamicine en allogene stamceltransplantatie is nog onvoldoende duidelijk en derhalve zal dit per patiënt moeten worden bekeken waarbij het bereiken van MRD negativiteit een belangrijke overweging is.
Voor R/R B-ALL patiënten ≥26 jaar is de verwachting dat er in2024 het medicijn Tecartus (Brexucabtagene autoleucel) wordt vergoed in Nederland. Dit is reeds in 2022 goedgekeurd door de EMA.
Er is een expert panel samengesteld (bestaande uit hematologen en een kinderoncoloog) die maandelijks patiënten bespreken die mogelijk voor tweede of derdelijns therapie met hoge dosis chemotherapie, blinatumomab, inotuzumab ozogamicine of CAR-T cel therapie in aanmerking komen. U kunt patiënten aanmelden via bovengenoemde werkgroepleden. Tevens worden er meerdere CAR-T cel studies binnenkort geopend, zie voor het actuele overzicht: https://hovon.nl/en/trials/associated-studies
|
SORT Grade |
Conclusie |
|
A |
Overweeg Tisagenlecleucel bij patiënten tot en met 25 jaar met refractaire of recidief B-ALL. De timing van tisagenlecleucel ten opzichte van blinatumomab, inotuzumab ozogamicine en een allogene stamceltransplantatie is nog onvoldoende duidelijk en zal per patiënt moeten worden bekeken waarbij het bereiken van MRD negativiteit een belangrijke overweging is. |
Referenties:
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie