Acute myeloïde leukemie (AML) is een heterogene ziekte, die wordt gekenmerkt door klonale expansie van immature hematopoëtische cellen van de myeloïde reeks als gevolg van een blokkade in de normale uitrijping, leidend tot een excessieve toename van leukemische blasten. Als gevolg van verstoring van de normale hematopoëse kunnen anemie, trombocytopenie en leukopenie of leukocytose ontstaan, met daaruit voortkomende klinische symptomen.
In Nederland ontwikkelen circa 800 patiënten per jaar een AML. Bijna 50% van deze patiënten is ouder dan 70 jaar (IKNL-data: in 2024).
De laatste jaren is de diagnostiek en behandeling van AML snel aan het veranderen; met name door inzichten in de moleculaire pathofysiologie, de heterogeniteit van de ziekte, de rol van minimale restziekte detectie/ measurable residual disease (MRD) en de beschikbaarheid van nieuwe middelen. Sinds de jaren 70 van de vorige eeuw is behandeling met een anthracycline gecombineerd met cytarabine (“3+7”) de standaardbehandeling voor fitte patiënten.
Met name ontwikkelingen op het gebied van allogene hematopoëtische stamceltransplantatie en ontwikkelingen op het gebied van ondersteunende behandelingen hebben ervoor gezorgd dat, vooral bij jongere patiënten met AML, de overlevingskansen steeds beter zijn geworden. De prognose voor oudere patiënten is nog steeds matig, maar ook hier is door de ruimere toepassing van intensieve chemotherapie bij fitte ouderen, toevoeging van doelgerichte therapie (zoals venetoclax en ivosidenib) aan hypomethyleerders en toepassing van hematopoëtische stamceltransplantatie, vooruitgang geboekt.
In 2022 zijn nieuwe ICC- en WHO-criteria voor AML gepubliceerd en de ELN heeft nieuwe aanbevelingen gedaan voor diagnostiek, behandeling en risicoclassificatie.
In de periode van 2017-2024 zijn maar liefst 11 nieuwe middelen door de FDA goedgekeurd voor de behandeling van AML, en deel daarvan is ook door de EMA goedgekeurd. De registratie van deze nieuwe middelen met specifieke toepassingen illustreert de complexiteit van de behandeling van AML.
Mede gezien de snelle ontwikkelingen en steeds verder gepersonaliseerde behandelingen, is het belangrijk datdiagnostiek en behandeling van AML-patiënten in de dagelijkse praktijk zorgvuldig en gestructureerdgeschiedt. Hieronder bespreken we de richtlijnen voor diagnostiek en behandeling zoals de HOVON-leukemie-werkgroep denkt dat die zouden moeten plaatsvinden.
Organisatie: HOVON – Acute leukemie-werkgroep
Leden van de werkgroep die hebben bijgedragen aan het ontstaan van de richtlijn:
|
Lid |
Functie |
Instelling |
|
S.K. Klein |
Eerste auteur richtlijn, schrijfcomité |
UMCG, Groningen |
|
G.A. Huls |
Voorzitter LWG Schrijfcomité |
UMCG, Groningen |
|
E. Ammatuna |
Beoordelaar |
UMCG, Groningen |
|
A.B. Mulder |
Vertegenwoordiging MODHEM Beoordelaar (arts klinische chemie) |
UMCG, Groningen |
|
C. M. Woolthuis |
Beoordelaar |
UMCG, Groningen |
|
K. Meijer |
Beoordelaar (klinisch chemicus) |
UMCG, Groningen |
|
M. Raaijmakers |
Vicevoorzitter LWG Schrijfcomité |
ErasmusMC, Rotterdam |
|
M. Jongen- Lavrencic |
Beoordelaar |
ErasmusMC, Rotterdam |
|
B. Wouters |
Beoordelaar |
ErasmusMC, Rotterdam |
|
P. Valk |
Vertegenwoordiging MODHEM Beoordelaar (moleculair bioloog) |
ErasmusMC, Rotterdam |
|
A.A. van de Loosdrecht |
Secretaris LWG, schrijfcomité |
Amsterdam UMC, Amsterdam |
|
D.C. de Leeuw |
Beoordelaar |
Amsterdam UMC, Amsterdam |
|
C.E. Rutten |
Beoordelaar |
Amsterdam UMC, Amsterdam |
|
J. Cloos |
Beoordelaar (bioloog) |
Amsterdam UMC, Amsterdam |
|
B. Biemond |
Beoordelaar |
Amsterdam UMC, Amsterdam |
|
A. van Rhenen |
Beoordelaar |
UMCU, Utrecht |
|
J.J.W.M Janssen |
Beoordelaar |
Radboudumc, Nijmegen |
|
W.J.F.M van der Velden |
Beoordelaar |
Radboudumc, Nijmegen |
|
C.H.M.J. van Elssen |
Beoordelaar |
Maastricht UMC+, Maastricht |
|
J.H. Veelken |
Beoordelaar |
LUMC, Leiden |
|
P.A. von dem Borne |
Beoordelaar |
LUMC, Leiden |
|
G. van Sluis |
Beoordelaar |
Isala kliniek, Zwolle |
|
D. van Lammeren |
Beoordelaar |
Haga Ziekenhuis, Den Haag |
|
T. Snijders |
Beoordelaar |
Medisch Spectrum Twente, Enschede |
|
R. Fiets |
Beoordelaar |
Amphia ziekenhuis, Breda |
|
E. de Jongh |
Beoordelaar |
Albert Schweitzer Ziekenhuis, Doordrecht |
|
M.F. Corsten |
Beoordelaar |
Meander Medisch Centrum, Amersfoort |
|
M.L.H. Cuijpers |
Beoordelaar |
Rijnstate, Arnhem |
|
M. Cruijsen |
Beoordelaar |
Catharina Ziekenhuis, Eindhoven |
|
M. Söhne |
Beoordelaar |
Antonius Ziekenhuis, Nieuwegein |
|
M. Eefting |
Beoordelaar |
Ikazia Ziekenhuis, Rotterdam |
|
D. Ettema |
Vertegenwoordiging HEMATON Beoordelaar (vanuit patiëntenvertegenwoordiging) |
|
Alle boven genoemde personen zijn hematologen tenzij anders vermeld.
Alle werkgroepleden hebben aangegeven onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben in onderstaande tabel eventuele belangenverstrengeling ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
|
Lid |
Belangenverstrengeling |
|
G.A. Huls |
Geen |
|
S.K. Klein |
Geen |
|
E. Ammatuna |
Geen |
|
A.B. Mulder |
Geen |
|
C. M. Woolthuis |
Geen |
|
K. Meijer |
Geen |
|
M. Raaijmakers |
Research ondersteuning: Daichi Sankyo Advisory board: Daichi Sankyo |
|
M. Jongen- Lavrencic |
Honorarium: Sanofi, Molecular Parners, AvenCell, Kura Oncology |
|
B. Wouters |
Honorarium: Servier, Gesponsorde presentaties: Servier, BMS/Celgene, Roche |
|
P.J.M. Valk |
Geen |
|
A.A. van de Loosdrecht |
Geen |
|
D.C. de Leeuw |
Gesponsorde presentaties: Roche Pharma, Abbvie, Servier, Daiichi Sankyo Advisory board: Takeda, Servier, Immedica Pharma Reiskostenvergoeding: Abbvie |
|
C.E. Rutten |
Geen |
|
J. Cloos |
Research ondersteuning: Genenteck, Novartis. Gesponsorde presentaties: Astellas Andere ondersteuning (licentie royalties): BD Biosciences, Navigate |
|
B. Biemond |
Geen |
|
A. van Rhenen |
Research ondersteuning: Janssen |
|
J.J.W.M Janssen |
Research ondersteuning: Novartis, BMS, aan instituut. Andere ondersteuning als aoorzitter, St. Apps for Care and Science, nonprofit, deze heeft unrestricted educational grants ontvangen van Abbvie, Alexion, Amgen, Astellas, AstraZeneca, BMS, Daiichi-Sankyo, Janssen, Kite-Gilead, Incyte, Sanofi Genzyme, Servier, Jazz, Pfizer, Recordati, Serb, Novartis, Takeda. |
|
W.J.F.M van der Velden |
Geen |
|
C.H.M.J. van Elssen |
Honorarium: Servier, Astellas, J&J, Amgen, Sanofi, Pfizer |
|
J.H. Veelken |
Geen |
|
P.A. von dem Borne |
Geen |
|
G.L. van Sluis |
Geen |
|
D. van Lammeren |
Geen |
|
T. Snijders |
Geen |
|
R. Fiets |
Reiskostenvergoeding: Abbvie |
|
E. de Jongh |
Geen |
|
M.F. Corsten |
Geen |
|
M.L.H. Cuijpers |
Honorarium: Amgen |
|
M. Cruijsen |
Geen |
|
M. Söhne |
Geen |
|
M. Eefting |
Geen |
|
D. Ettema |
Geen |
Kwaliteitsindicatoren
De Hovon werkgroep acute leukemie heeft ervoor gekozen om de volgende kwaliteitsindicatoren te stellen:
Een aantal leden van de Hovon werkgroep voor acute leukemie hebben de richtlijn in concept voorbereid en vervolgens aan alle werkgroepleden ter beoordeling aangeboden. Het commentaar is getoetst en waar relevant bevonden verwerkt en vervolgens voor een laatste beoordeling aan iedereen verstuurd. Op 15-04-2025 is de conceptrichtlijn voor commentaar aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH) en aan de patiëntenvereniging “Hematon” aangeboden om de kwaliteit te optimaliseren, de uitvoerbaarheid te waarborgen en draagvalk te creëren.
Een respondent maakten van deze uitnodiging gebruik. Alle commentaren werden vervolgens beoordeeld en verwerkt door de werkgroep.
Ten slotte is de richtlijn ter autorisatie gestuurd naar de Nederlandse Vereniging voor Hematologie.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn als volgt verspreid:
|
ICC-definitie: De diagnose AML met terugkerende genetische afwijkingen (met uitzondering van AML met t(9;22)(q34.1;q11.2)/BCR::ABL1) kan gesteld worden met een percentage blasten > 10% in beenmerg en/ of bloed. Voor alle andere vormen van AML geldt een minimaal percentage blasten van > 20%. Daarnaast is een nieuwe categorie gedefinieerd: MDS/ AML met afwijkingen in het genoom waarbij 10-20% blasten in beenmerg of bloed geteld worden. |
SORT nvt ICC-definitie |
|
WHO-definitie: Bij AML-definiërende genetische afwijkingen (met uitzondering van BCR::ABL1 en CEBPA) wordt de diagnose AML gesteld ongeacht het percentage myeloïde blasten in bloed ofbeenmerg (maar wel met in achtneming van het klinisch-morfologisch oordeel). Bij de overige vormen van AML (gedefinieerd door cytomorfologische en flowcytometrische differentiatie) wordt de diagnose gesteld bij > 20% myeloïde blasten in bloed ofbeenmerg. |
SORT nvt WHO-definitie |
|
De subgroep-definitie volgt de laatste ICC- resp. WHO -classificatie (2022). |
SORT nvt ICC-classificatie en WHO-classificatie |
|
De werkgroep heeft een voorkeur voor het gebruik van de ICC-classificatie. |
SORT nvt
|
|
Anamnese en lichamelijk onderzoek dienen zo compleet mogelijk met specifieke aandacht voor AML-gerelateerde problemen en familiaire (hematologische) ziekten plaats te vinden. |
SORT nvt Gebaseerd op ELN richtlijn |
|
Het aanvullende onderzoek kent een aantal basisonderzoeken, die bij intensieve therapie of bijzondere omstandigheden dienen te worden aangevuld. |
SORT nvt Gebaseerd op ELN richtlijn |
|
Het beenmergonderzoek dient te bestaan uit cytomorfologie, immuunfenotypering, cytogenetica en moleculaire diagnostiek. Histopathologie is noodzakelijk bij een dry tap of bij de verdenking op een secundaire AML uit een MDS of MPN. |
SORT nvt Gebaseerd op WHO- en ICC-aanbevelingen en ELN richtlijn |
|
Bij recidief ziekte dient de diagnostiek naar moleculaire afwijkingen, die potentieel behandelconsequenties hebben (bijvoorbeeld FLT3 mutaties), herhaald te worden. |
SORT nvt Gebaseerd ELN richtlijn |
|
Het risicoprofiel wordt bepaald aan de hand van de risico-classificatie van het Europees Leukemie Netwerk (ELN), hiervoor zijn klassieke karyotypering en moleculaire analyses essentieel. |
SORT nvt ELN-richtlijnen |
|
De prognose is sterk afhankelijk van het risicoprofiel, leeftijd en comorbiditeit |
SORT A |
|
Behandeling van AML vindt zoveel mogelijk in studieverband plaats |
SORT nvt |
|
De basisbehandeling voor een patiënt met een nieuw gediagnosticeerde AML die fit is voor intensieve chemotherapie bestaat in principe uit twee inductiekuren gevolgd door een risico gestuurde consolidatiebehandeling. |
SORT A |
|
De behandeling voor een patiënt met een nieuw gediagnosticeerde AML met een FLT3 mutatie die fit is voor intensieve chemotherapie bestaat uit de basisbehandeling gecombineerd met midostaurine (ITD en TKD) of quizartinib (ITD)(zie onderbouwing voor specifiek advies). |
SORT A |
|
De behandeling voor een patiënt met een nieuw gediagnosticeerde APL met een laag of intermediair risico bestaat uit all-transretinoïnezuur (ATRA) en arseentrioxide (ATO) |
SORT A |
|
De voorkeursbehandeling voor een patiënt met een nieuw gediagnosticeerde APL met een hoog risico bestaat uit all-transretinoïnezuur (ATRA) gecombineerd met arseentrioxide (ATO). Deze combinatie leidt tot een significant betere event-free survival, dan de behandeling met ATRA gecombineerd met chemotherapie. Er loopt een add on aanvraag voor de combinatie ATRA/ ATO. Tot deze combinatie vergoed wordt bestaat de behandeling uit ATRA gecombineerd met chemotherapie |
SORT A |
|
Onderhoudsbehandeling met azacitidine (oraal of subcutaan) kan overwogen worden voor patiënten die in remissie zijn gebracht met intensieve chemotherapie maar die niet in aanmerking komen voor een allogene hematopoiëtische stamcel transplantatie |
SORT A |
|
De standaardbehandeling voor een patiënt (zonder IDH1 of TP53mutatie) met een nieuw gediagnosticeerde AML die niet fit is voor intensieve chemotherapie, maar wel (maximaal) behandeld wil worden, bestaat uit een hypomethylerend middel (azacitidine of decitabine) in combinatie met venetoclax. |
SORT A
|
|
Bij patiënten met een nieuw gediagnosticeerde AML met een IDH1mutatie die niet fit zijn voor intensieve chemotherapie geeft toevoeging van ivosidenib aan azacitidine een significant betere PFS en OS (vergeleken met monotherapie azacitidine) met een acceptabel bijwerkingenprofiel. |
SORT A
|
|
Bij patiënten met een nieuw gediagnosticeerde AML met een IDH1mutatie die niet fit zijn voor intensieve chemotherapie lijkt (hoewel niet “head tot head” vergeleken) azacitidine met ivosidenib een betere OS te geven dan azacitidine met venetoclax (mediaan >29 vs 15 maanden). |
SORT B
|
|
Patiënten die minder intensief behandeld willen worden kunnen kiezen uit monotherapie azacitidine s.c., decitabine i.v., decitabine/cedazuridine p.o., lage dosis cytarabine of enkel ondersteunende behandeling. |
SORT A |
|
De keuze voor een autologe dan wel allogene HCT vindt risico-gestuurd plaats op basis van de ELN 2022-genetische risico classificatie, CRe, hyperleukocytose bij diagnose, MRD na de 2einductiekuur en leeftijd. |
SORT B |
|
De Hematopoiëtische Cel Transplantie Co-morbiditeits Index (HCT-CI) score geeft richting bij de risico-inschatting van transplantatie gerelateerde mortaliteit voor een allogene HCT. |
SORT A |
|
Autologe stamcellen worden geoogst met behulp van G-CSF na de 2e inductiekuur. Er wordt gestreefd naar minimaal 2 x 106 CD34+ cellen/kg. |
SORT C
|
|
Het standaard conditioneringsschema voor een autologe hematopoëtische celtransplantatie bestaat uit busulfan in combinatie met cyclofosfamide, waarbij profylaxe tegen epileptische insulten gegeven dient te worden. |
SORT A |
|
Er bestaat geen algemeen als optimaal aanvaard conditioneringsschema voor een allogene hematopoëtische celtransplantatie bij een patiënt met AML. Veel verschillende factoren spelen bij de keuze voor een conditioneringsschema een rol (bijvoorbeeld remissie status, leeftijd, lokale ervaring met een bepaalde conditionering en donorkeuze). |
SORT nvt. |
|
De prognose van een patiënt met recidief AML is afhankelijk van de duur van de eerste remissie, de leeftijd ten tijde van het recidief, genetische afwijkingen (karyotype en moleculair) bij diagnose en recidief en het al dan niet hebben ondergaan van een eerdere allogene HCT. |
SORT A |
|
Een tweede allogene hematopoëtische stamceltransplantatie of donor lymfocyteninfusie kan een langdurige overleving geven bij patiënten met een recidief na een eerste allogene HCT. |
SORT A |
|
Er is geen algemeen aanvaarde standaard re-inductie intensieve chemotherapie van primair refractaire AML of recidief AML, wel wordt in vrijwel alle schema’s hoge dosis cytarabine gegeven. |
SORT C |
|
Hypomethylerende middelen (azacitidine en decitabine) zijn een beduidend minder toxisch alternatief dan hoge dosis chemotherapie, met name bij patiënten waarbij het recidief < 6 maanden na intensieve chemotherapie (inclusief allogene of autologe hematopoiëtische stamcel transplantatie) optreedt en/ of bij aanwezigheid van een TP53 mutatie. |
SORT C |
|
Toevoeging van venetoclax aan hypomethylerende middelen (azacitidine en decitabine) bij behandeling van een patiënt met een recidief/ refractaire AML leidt tot een significant hoger CR/CRi percentage en een betere overleving (add-on is aangevraagd). |
SORT B |
|
Ook in de recidiefsetting leidt behandeling gericht tegen een specifieke moleculaire afwijking (al dan niet in combinatie met chemotherapie of hypomethylerende therapie) in sommige gevallen tot betere overleving dan alleen chemotherapie of hypomethylerende therapie. |
SORT A |
|
Het is zinvol om bij een vermeend recidief te zoeken naar mutaties waarvoor gerichte behandeling mogelijk is (bijvoorbeeld FLT3), omdat:
|
SORT A |
|
Een patiënt met een recidief/ refractaire AML met een FLT3mutatie heeft met gilteritinib een significant langere OS (dan met standaardtherapie), de remissies zijn diep en de bijwerkingen minder vergeleken met andere therapieën. De werkgroep adviseert bij deze groep patiënten gilteritinib te gebruiken ter overbrugging naar een potentieel curatieve allogene hematopoiëtische cel transplantatie of potentieel curatieve DLI. |
SORT A |
|
Responsbeoordeling vindt plaats volgens de laatste ELN-criteria. |
SORT nvt. ELN-richtlijn |
|
Het gebruik van MRD-bepalingen wordt geadviseerd volgens het ELN-consensusdocument. |
SORT nvt. ELN-richtlijn |
|
Patiënten met hyperleukocytose hebben een slechtere korte- en langetermijnoverleving. |
SORT A |
|
Bij hyperleukocytose dienen leukostase en DIC direct behandeld te worden met cytoreductieve therapie met aandacht voor tumorlyse. |
SORT A |
|
Geadviseerd wordt om bij focale neurologische klachten, extramedullaire ziekte, leukocytose (> 40 x 109/L) en blastaire dendritische cel neoplasie een diagnostische LP (met achterlaten van MTX of cytarabine) te verrichten (indien de blasten uit het perifere bloed geklaard zijn). |
SORT nvt ELN-richtlijn |
|
Het APL-differentiatie syndroom (door ATRA en/of ATO) is een potentieel fatale complicatie waarvoor profylaxe met prednisolon (0,5 mg/kg tot tenminste dag 21) of dexamethason (2 dd 5 mg tot tenminste dag 15) gegeven dient te worden. Bij verdenking op het APL-differentiatie syndroom dient direct met dexamethason 2 dd 10 mg gestart te worden. |
SORT A |
|
De diagnose differentiatiesyndroom wordt “per exclusionem” gesteld en is een potentieel fatale complicatie. Het kan ook optreden bij behandeling met IDH-en FLT3-remmers. De behandeling bestaat uit het starten van steroïden en bij onvoldoende respons eventueel staken van de specifieke remmer. Overige maatregelen zijn afhankelijk van de presentatie en zijn gericht op het uitsluiten en behandelen van mogelijk onderliggende alternatieve oorzaken (zoals infecties). |
SORT A |
|
Het risico op tumorlyse wordt bepaald door de mate van leukocytose, de nierfunctie (kreatinine > 124 μmol/l), het uitgangsurinezuurgehalte (> 450 μmol/l), LDH (> 4x ULN) en de cytotoxiciteit van de behandeling. |
SORT A |
|
Tumorlyse dient gemonitord te worden en op basis van het risico met hyperhydratie, allopurinol en/ of rasburicase voorkomen dan wel behandeld te worden. |
SORT A |
|
De incidentie van neurotoxiciteit door cytarabine neemt toe met de leeftijd en de cumulatieve dosering en wordt mede bepaald door de nier- en leverfuncties en bijkomende middelen. |
SORT B |
|
Bij verdenking op neurotoxiciteit door cytarabine dient dit middel direct gestaakt te worden. |
SORT C |
|
In zeldzame gevallen wordt bij het gebruik van hypomethylerende therapie en cytarabine een pneumonitis gezien. Direct staken van de behandeling en hoge dosis steroïden worden geadviseerd. |
SORT C |
|
Onderzoek naar genetische predispositie voor het ontwikkelen van AML wordt aangeraden bij een verdachte (familie)anamnese, specifieke klinische bevindingen bij lichamelijk onderzoek en/of bij een mutatie met een VAF > 40% in specifieke genen (zoals DDX41, CEBPA, GATA2 of RUNX1). |
SORT A |
|
Door het gebruik van infectieprofylaxe (antibiotisch en antifungaal) is de overleving van patiënten met AML die intensief behandeld worden significant verbeterd. |
SORT A |
|
Ten aanzien van trombocytentransfusies en erytrocytentransfusies wordt het landelijke transfusiebeleid gevolgd. |
SORT A |
|
G-CSF als toevoeging aan de behandeling van AML met intensieve chemotherapie wordt niet standaard geadviseerd omdat het geen overlevingsvoordeel oplevert en niet kosteneffectief is gebleken. |
SORT A |
|
G-CSF verkort de neutropenieduur bij de behandeling met azacitidine/ decitabine in combinatie met venetoclax. En kan na klaring van blasten worden toegevoegd om langdurige neutropenie te voorkomen. |
SORT A |
|
AML veroorzaakt een grote psychosociale belasting voor de patiënt en naasten. |
SORT A |
|
Gestructureerde, professionele begeleiding van patiënt en naasten wordt met klem geadviseerd. |
SORT C |
|
De noodzakelijke diagnostiek en de mogelijke behandeling voor patiënten met AML wordt steeds complexer. |
SORT A |
|
Behandelingsuitkomsten zijn afhankelijk van de expertise van het team. Dit wordt mede bepaald door ervaringsuren (op het specifieke gebied) en het aantal behandelde patiënten (met een ziekte/ bepaalde behandeling). |
SORT A |
|
De leukemiewerkgroep is van mening dat alle patiënten met een AML voor start van de behandeling met een consulterend centrum besproken moeten worden om tot een wel overwogen therapieplan te komen. Regioafspraken zijn leidend voor “waar wat kan”. |
SORT C |
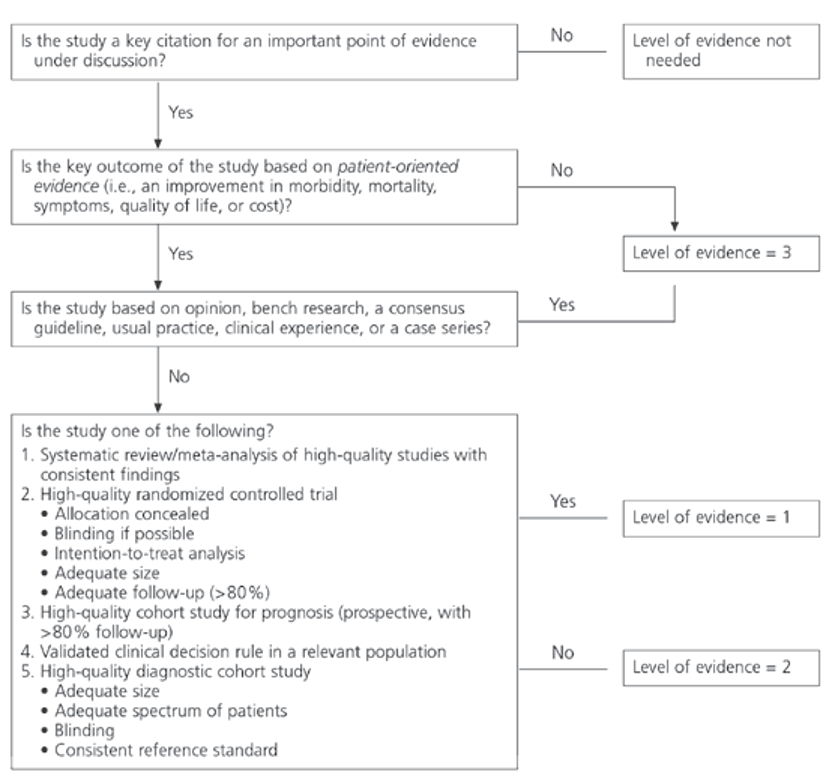
Hoe wordt de diagnose AML gesteld?
Aanbevelingen
|
ICC-definitie: De diagnose AML met terugkerende genetische afwijkingen (met uitzondering van AML met t(9;22)(q34.1;q11.2)/BCR::ABL1) kan gesteld worden met een percentage blasten > 10% in beenmerg en/ of bloed. Voor alle andere vormen van AML geldt een minimaal percentage blasten van > 20%. Daarnaast is een nieuwe categorie gedefinieerd: MDS/ AML met afwijkingen in het genoom waarbij 10-20% blasten in beenmerg of bloed geteld worden. |
SORT nvt ICC-definitie |
|
WHO-definitie: Bij AML-definiërende genetische afwijkingen (met uitzondering van BCR::ABL1 en CEBPA) wordt de diagnose AML gesteld ongeacht het percentage myeloïde blasten in bloed ofbeenmerg (maar wel met in achtneming van het klinisch-morfologisch oordeel). Bij de overige vormen van AML (gedefinieerd door cytomorfologische en flowcytometrische differentiatie) wordt de diagnose gesteld bij > 20% myeloïde blasten in bloed ofbeenmerg. |
SORT nvt WHO-definitie |
|
De subgroep-definitie volgt de laatste ICC- resp. WHO -classificatie (2022). |
SORT nvt ICC-classificatie en WHO-classificatie |
|
De werkgroep heeft een voorkeur voor het gebruik van de ICC-classificatie. |
SORT nvt
|
Onderbouwing
In 2022 zijn twee verschillende classificaties gepubliceerd voor het stellen van de diagnose AML – één door de WHO (World Health Organisation)1 en één opgesteld door een ander internationaal expert-panel met onder ander leden van de ELN (European Leukemia Net)2,3. De classificaties lijken in grote lijn op elkaar, maar verschillen op onderdelen (zie paragraaf 3 van deze module).
Bij alle nieuwe patiënten met een verdenking op een acute leukemie dient de diagnose te worden gesteld op basis van de ICC-classificatie 20222,3 (International Consensus Classification) mede opgesteld door het ELN en/ of de 5e editie van de WHO-classificatie 20221.
De leukemiewerkgroep heeft de voorkeur voor classificatie volgens de ICC-classificatie, tenzij in verband met een studie (ook) om de WHO-classificatie gevraagd wordt, omdat de ICC-classificatie:
De diagnose wordt gesteld op basis van het bloedbeeld, beenmergonderzoek bestaande uit cytomorfologie, immunofenotypering, genetisch en moleculair onderzoek en waar nodig een histologisch botbiopt (bv. bij dry tap).
1.1.1 Definitie AML
De diagnose AML met terugkerende genetische afwijkingen (met uitzondering van AML met t(9;22)(q34.1;q11.2)/BCR::ABL1) kan gesteld worden met een percentage blasten > 10% in beenmerg (BM) en of perifeer bloed (PB).
Voor alle andere vormen van AML geldt een minimaal percentage blasten van > 20%.
Daarnaast is een nieuwe categorie gedefinieerd: MDS/ AML met afwijkingen in het genoom waarbij 10-19% blasten in beenmerg of bloed geteld worden.
De werkgroep benadrukt, dat de nieuwe categorie MDS/ AML (vergelijkbaar met de WHO-diagnose MDS-IB2) een andere entiteit is dan een “echte” AML.
1.1.2 ICC-2022 classificatie subgroep AML
AML en gerelateerde neoplasieën en acute leukemie van ambigue afstamming volgens de ELN
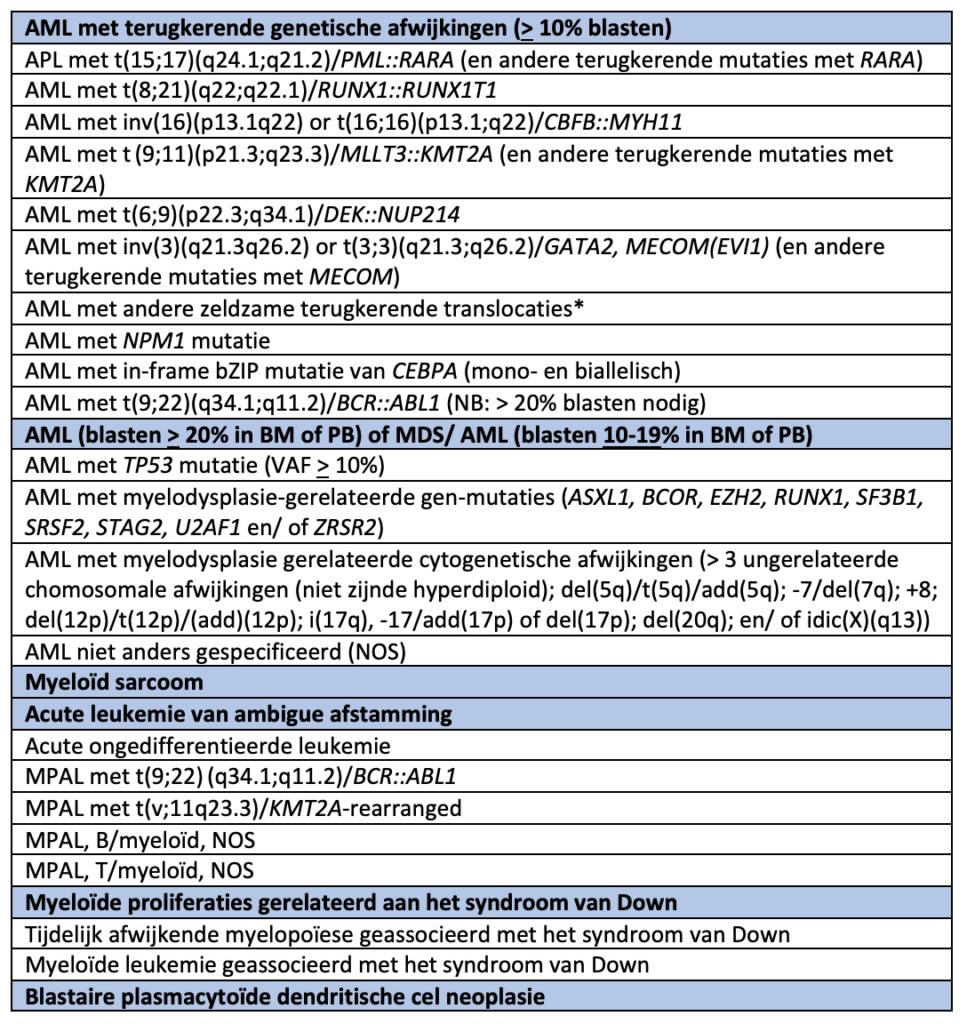
* Andere zeldzame terugkerende translocaties: t(1;3)(p36.3;q21.3)/PRDM16::RPN1; t(1;22)(p13.3;q13.1)/RBM15::MRTFA (megakaryoblastair); t(3;5)(q25.3;q35.1)/NPM1::MLF1; t(5;11)(q35.2;p15.4)/NUP98::NSD1; t(7;12)(q36.3;p13.2)/ETV6::MNX1; t(8;16)(p11.2;p13.3)/KAT6A::CREBBP; t(10;11)(p12.3;q14.2)/PICALM::MLLT10; t(11;12)(p15.4;p13.3)/NUP98::KMD5A; NUP98 en andere partners; t(16;21)(p11.2;q22.2)/FUS::ERG; t(16;21)(q24.3;q22.1)/RUNX1::CBFA2T3; inv(16)(p13.3q24.3)/CBFA2T3::GLIS2
Naast bovenstaande bestaan nog 4 diagnostische toevoegingen

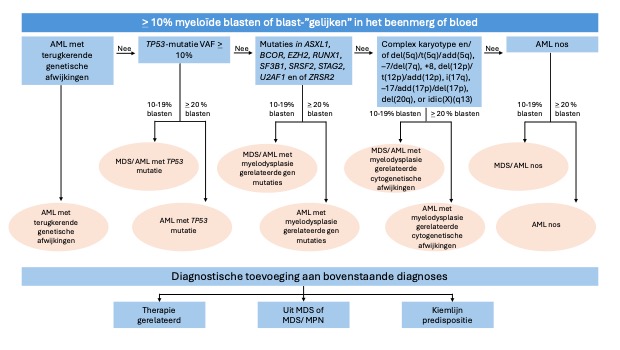
1.1.3. Hiërarchie in de ICC-classificatie
Bovenstaande classificatie kent een hiërarchie in hoe een AML te benoemen is
1.1.4. Immunofenotypische criteria
AML:
MPAL:
1.2.1. Definitie AML
De diagnose AML wordt ingedeeld in twee groepen: AML met AML-definiërende genetische afwijkingen en AML gedefinieerd op basis van differentiatie (cytomorfologisch en flowcytometrisch).
Bij AML-definiërende genetische afwijkingen (met uitzondering van BCR::ABL1 en CEBPA) wordt de diagnose AML gesteld ongeacht het percentage myeloïde blasten in bloed of beenmerg (maar wel met in achtneming van het klinisch-morfologische oordeel).
Bij de overige vormen van AML (gedefinieerd door differentiatie) wordt de diagnose gesteld bij > 20% myeloïde blasten in bloed of beenmerg.
Bijzonderheden in de telling:
1.2.2. WHO-2022 classificatie subgroepen AML
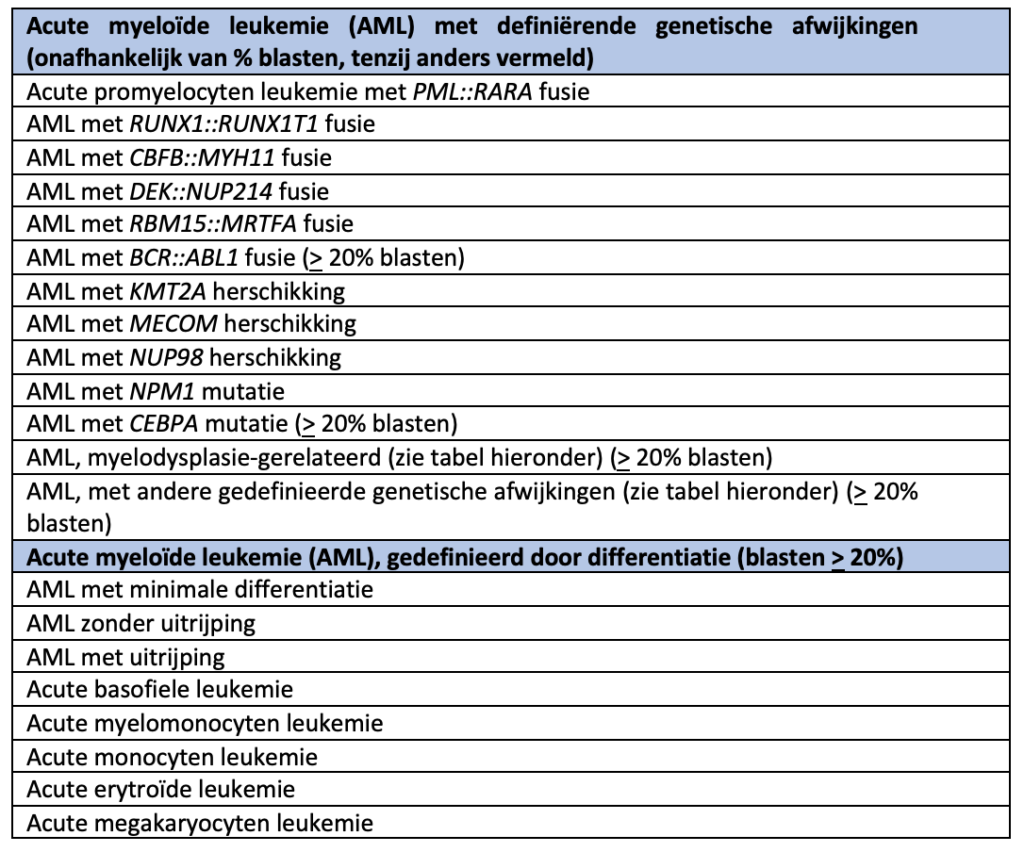
AML, myelodysplasie-gerelateerd
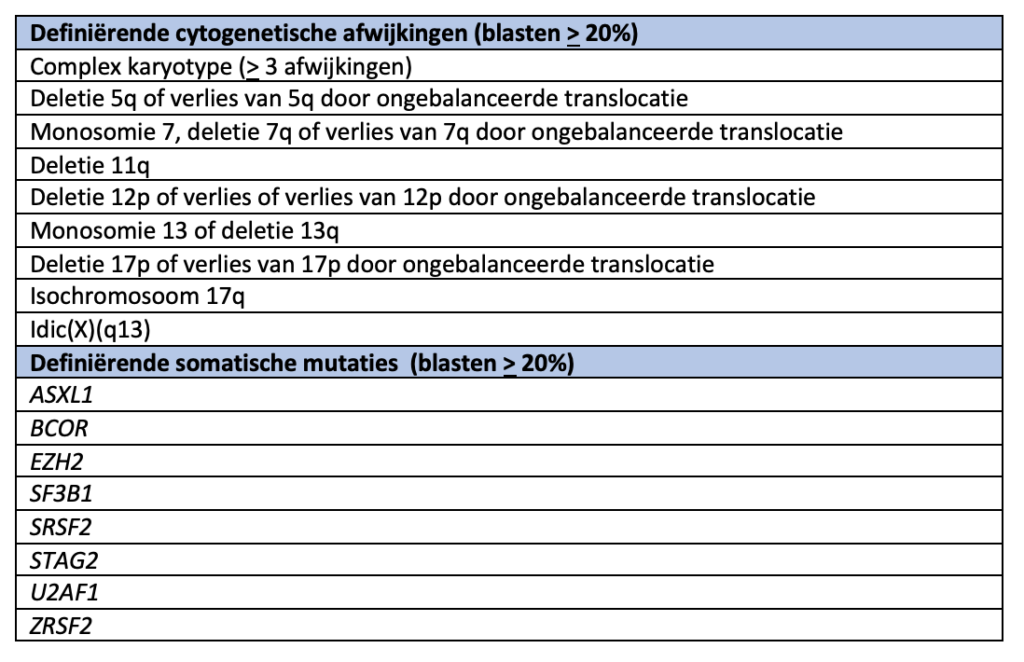
AML, met andere gedefinieerde genetische afwijkingen (blasten > 20%)

Acute leukemie met ambigue lijn (ALAL; blasten > 20%))

Naast boven genoemde vormen van AML bestaat nog het myeloïd sarcoom.
Een weefselmanifestatie van AML, getransformeerde MDS, MDS/ MPN overlap of MPN buiten het beenmerg.
De classificaties lijken in hoofdlijnen sterk op elkaar. Waar de ICC-classificatie zowel het genetisch afwijkende locus benoemt (bijvoorbeeld t(8;21)(q22;q22.1)) met erachter de bijbehorende genen beperkt de WHO zich tot de aangedane genen (bijvoorbeeld RUNX1::RUNX1T1).
Bij de WHO-classificatie is voor een deel van de AML-subtypes het blastenpercentage niet benoemd, omdat iedere afkapgrens als arbitrair wordt gezien. Dit geldt voor de groep met AML-definiërende genetische afwijkingen (met uitzondering van BCR::ABL1 en CEBPA).
Bij de ICC-classificatie is een nieuwe entiteit geïntroduceerd, MDS/AML. Deze groep heeft een blastenpercentage van 10-19% (niet zijnde AML met terugkerende cytogenetische afwijkingen). De rationale om deze subgroep MDS/AML te noemen is om aan te geven dat het om een continuüm gaat en om helderheid te scheppen ten aanzien van inclusie in trials en gebruik van behandelingen. Bij de WHO-classificatie wordt deze groep nog steeds MDS-IB2 genoemd.
Verder houdt de WHO-classificatie vast aan “AML met CEBPA-mutatie” en wordt bij de ICC-classificatie enkel de prognostisch belangrijke “AML met in-frame bZIP-mutatie van CEBPA (mono- en biallelisch)” als aparte entiteit benoemd.
In de ICC-classificatie is ruimte gegeven aan AML met TP53 mutatie, niet bestaand in de WHO-classificatie.
AML met myelodysplasie gerelateerde afwijkingen (WHO) is door de ICC-classificatie opgesplitst in de twee grote groepen “AML met myelodysplasie gerelateerde gen-mutaties” en “AML met myelodysplasie gerelateerde cytogenetische afwijkingen”.
In de ICC-classificatie zijn “Diagnostic classifiers” – “Diagnostische toevoegingen” gedefinieerd, die deels (oude) WHO-classificaties vervangen (bv AML therapie-gerelateerd).
Verder heeft de ICC-classificatie een duidelijke hiërarchie aangegeven in hoe een AML geclassificeerd dient te worden bij meerdere classificerende afwijkingen.
Welke diagnostiek moet voor start van de behandeling verricht worden?
Aanbevelingen
|
Anamnese en lichamelijk onderzoek dienen zo compleet mogelijk met specifieke aandacht voor AML-gerelateerde problemen en familiaire (hematologische) ziekten plaats te vinden. |
SORT nvt Gebaseerd op ELN richtlijn |
|
Het aanvullende onderzoek kent een aantal basisonderzoeken, die bij intensieve therapie of bijzondere omstandigheden dienen te worden aangevuld. |
SORT nvt Gebaseerd op ELN richtlijn |
|
Het beenmergonderzoek dient te bestaan uit cytomorfologie, immuunfenotypering, cytogenetica en moleculaire diagnostiek. Histopathologie is noodzakelijk bij een dry tap of bij de verdenking op een secundaire AML uit een MDS of MPN. |
SORT nvt Gebaseerd op WHO- en ICC-aanbevelingen en ELN richtlijn |
|
Bij recidief ziekte dient de diagnostiek naar moleculaire afwijkingen, die potentieel behandelconsequenties hebben (bijvoorbeeld FLT3 mutaties), herhaald te worden. |
SORT nvt Gebaseerd ELN richtlijn |
Onderbouwing
Bij alle patiënten met een verdenking op een acute leukemie dient de diagnose te worden bevestigd, en moet het subtype van de leukemie conform de ICC classificatie en/ of WHO 2022-classificatie in kaart worden gebracht. Daarnaast wordt het risicoprofiel, op basis van cytogenetica en moleculaire diagnostiek conform de ELN2022 bepaald.
2.1.1: Anamnese en lichamelijk onderzoek
Een volledige anamnese met:
Een volledig lichamelijk onderzoek met:
2.1.2. Laboratoriumonderzoek
Bloed
Serologie:
Microbiologie:
Urine:
2.1.3: Overig onderzoek
Met name als intensieve therapie wordt overwogen:
Bij alle patiënten waarbij behandeling (anders dan ondersteunende zorg en hydroxycarbamide) wordt overwogen zijn alle onderstaande onderzoeken wenselijk.
2.2.1: Cytomorfologie
Betrouwbare cytomorfologie is mogelijk bij een telling van minimaal 500 kernhoudende cellen in het beenmergaspiraat en 200 leukocyten in het bloeduitstrijkje.
Voor de criteria wordt verwezen naar module 1.
2.2.2: Immunofenotypering inclusief LAIP bepaling
Flowcytometrie wordt gebruikt om AML, ALL en ALAL te onderscheiden en om het leukemie geassocieerde immunofenotype (LAIP) vast te stellen. Het LAIP kan worden gebruikt om later meetbare residuale ziekte (MRD) te vervolgen. Het is daarom belangrijk om een monster bij diagnose naar het centrum, dat een eventuele allogene HCT zal uitvoeren, te sturen.
Er worden in de verschillende classificaties, richtlijnen en expertise groepen grotendeels overlappende, maar ook deels verschillende markers gebruikt, die evenwel hetzelfde doel dienen. Binnen de Nederlandse diagnostische laboratoria worden markers gebruikt conform de Minimale Panels van de Nederlandse Vereniging voor Cytometrie (NVC):
AML:
MPAL:
2.2.3: Cytogenetica
Cytogenetisch onderzoek wordt op de klassieke wijze verricht volgens de banderingspatronen van chromosomen in de metafase van de celdeling of eventueel middels FISH of SNP-array.
De in te zetten onderzoeken worden bepaald door de WHO- / ICC-classificatie zoals beschreven in module 1.
2.2.4: Moleculaire diagnostiek
Moleculaire diagnostiek vindt plaats door middel van PCR en/ of “next generation sequencing” (NGS) om specifieke genmutaties en genfusies te identificeren. De minimaal in te zetten onderzoeken worden bepaald door de diagnostische classificaties van de ICC- en WHO (module 1), de risicoclassificatie van de ELN, mutaties met opties voor gerichte therapie (module 4) en mutaties met mogelijkheid tot deelname aan mutatie-specifieke studies. De uitslagen van mutaties waarvoor specifieke geneesmiddelen beschikbaar zijn moeten binnen een korte termijn na diagnose/ recidief beschikbaar zijn. Bij de verdenking op een AML-predispositiesyndroom dient kiembaanonderzoek te worden uitgevoerd, bijvoorbeeld op wangslijmvlies, speeksel of fibroblasten van de patiënt of door het herhalen van de mutatieanalyse in een remissiebeenmerg, voor het bepalen van specifieke mutaties in de kiembaan.
2.2.5: Pathologie
Bij voorkeur wordt bij diagnose een botbiopt (crista iliaca posterior superior) verricht ter beoordeling van cellulariteit, mate van fibrosering en dysplasie, dit geldt vooral voor een AML uit een MDS of MPN. Bij een dry tap dient altijd een botbiopt verricht te worden. Hierbij dient ook een rolpreparaat voor cytomorfologie gemaakt te worden.
2.2.6: Biobank
Waar mogelijk dient (na goedkeuring door de patiënt (informed consent)) perifeer bloed en beenmerg voor studie gerelateerd onderzoek en/ of de biobank verzameld te worden.
Ten aanzien van het beenmergonderzoek geldt, dat bij de eerste intensieve behandeling tussen dag 15 -28 morfologische (eventueel in combinatie met immuunfenotypische) evaluatie plaats dient te vinden om te beoordelen of de blasten geklaard zijn, om te kunnen beslissen over een eventuele doorstart met een tweede intensieve chemotherapiekuur. Hierbij dient niet blind gevaren te worden op het percentage blasten in het beenmerg, maar moet ook de cellulariteit van het beenmerg bij de beoordeling worden meegenomen.
Bij persisterende ziekte is het uitdrukkelijke advies om direct met de tweede inductiekuur te starten, tenzij er sprake is van:
Bij behandeling met hypomethylerende therapie in combinatie met venetoclax is afgesproken om in cyclus 1 op dag 21 beenmergonderzoek te verrichten om de duur van de behandeling met venetoclax te kunnen bepalen (als het aantal blasten < 5% of het beenmerg hypocellulair (< 10%) is, wordt venetoclax gestaakt, bij > 5% blasten en zonder hypocellulariteit wordt gecontinueerd tot maximaal 28 dagen). Bij persisterende ziekte wordt het beenmerg op dag 28 herhaald.
In het geval van behandeling met hypomethylerende (mono) therapie (met name bij 10 dagen decitabine) is het advies om het eerste beenmergonderzoek op dag 28 (+/- 3 dagen) te verrichten. Bij azacitidine monotherapie is de behandeling pragmatisch en wordt vooral gevaren op het perifere bloedbeeld.
Het beenmergonderzoek voor responsevaluatie vindt plaats na repopulatie (in de praktijk vaak rond dag 28) of bij uitblijven van re-populatie uiterlijk op dag 35 (na 1e inductie kuur: morfologie; na 2e inductiekuur: morfologie, bij persisterende aplasie ook beenmergbiopt, immuunfenotypering ter bepaling van MRD, moleculair onderzoek ter bepaling van MRD (bv. NPM1 mutatie), eventueel bij eerdere afwijkingen cytogenetica en/ of moleculaire diagnostiek).
Bij recidief ziekte kan er sprake zijn van:
Derhalve dient bij recidief ziekte de diagnostiek naar moleculaire afwijkingen, die potentiële behandelconsequenties hebben (bijvoorbeeld FLT3 en IDH1 mutaties), herhaald te worden.
In welke risicogroepen worden patiënten ingedeeld en wat is de bijbehorende prognose?
Aanbevelingen
|
Het risicoprofiel wordt bepaald aan de hand van de risico-classificatie van het Europees Leukemie Netwerk (ELN), hiervoor zijn klassieke karyotypering en moleculaire analyses essentieel. |
SORT nvt ELN-richtlijnen |
|
De prognose is sterk afhankelijk van het risicoprofiel, leeftijd en comorbiditeit |
SORT A |
Onderbouwing
Bij alle patiënten met een AML dient de risicogroep bepaald te worden.
Voor patiënten die in klinische studies worden behandeld, wordt de risicoclassificatie van de betreffende studie aangehouden. Buiten studieverband geldt de ELN 2022 risicoclassificatie1 voor patiënten die met intensieve chemo(-immuno) therapie behandeld worden en de ELN 2024 risicoclassificatie2 voor patiënten die met minder intensieve therapie behandeld worden.
3.1.1: Risicoclassificatie volgens ELN 2022 (voor patiënten die met intensieve chemo(-immuno) therapie behandeld worden)
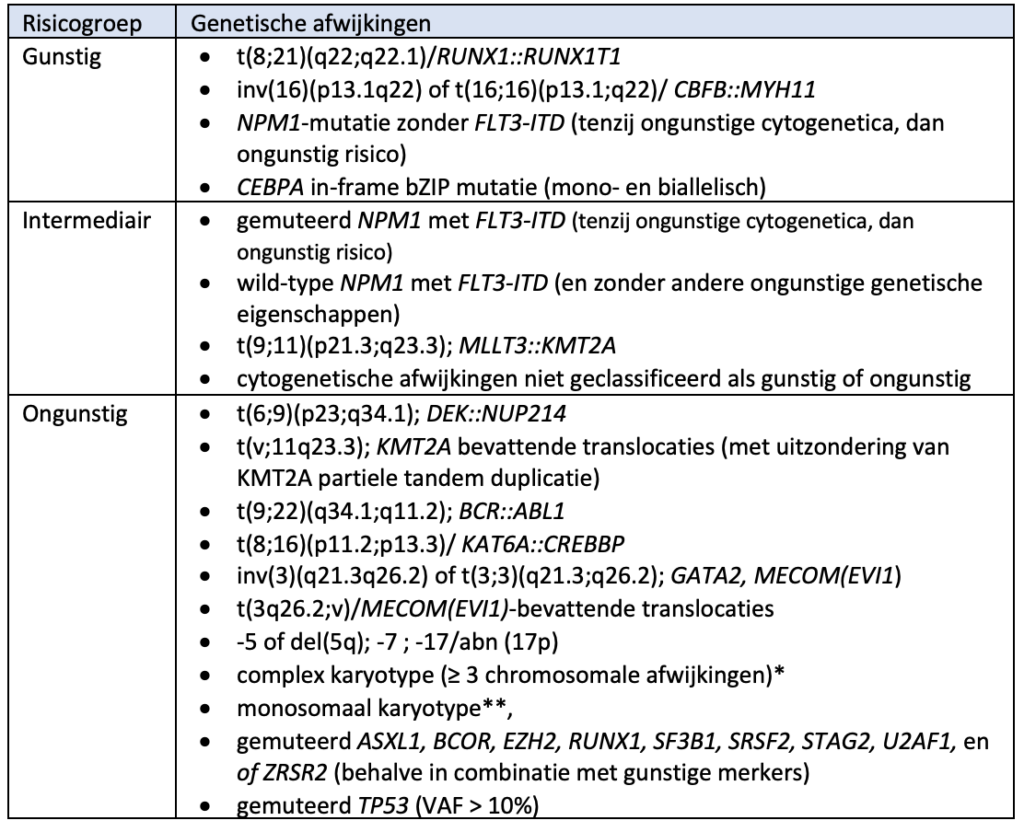
* in afwezigheid van andere classificerende terugkerende genetische afwijkingen, geëxcludeerd worden: hyperdiploïde karyotypes met > 3 trisomieën (of polysomien) zonder structurele afwijkingen
** aanwezigheid van > 2 afzonderlijke monosomieën (zonder verlies van X of Y), of een enkele autosomale monosomie in combinatie met > 1 structurele chromosomale afwijkingen (met uitzondering van core-binding factor AML)
3.1.2: ELN 2024 risicoclassificatie voor patiënten die met minder intensieve therapie behandeld worden

NB: deze risicoclassificatie geldt niet bij patiënten die eerder met azacitidine of decitabine zijn behandeld.
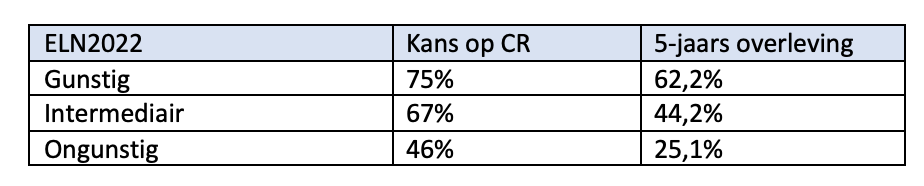
Onderstaande tabellen geven een grove inschatting van de prognose op basis van leeftijd en de risicogroep geclassificeerd volgens de ELN-2022 criteria3 mits behandeld met intensieve therapie.
Patiënten tot 60 jaar
Patiënten vanaf 60 jaar
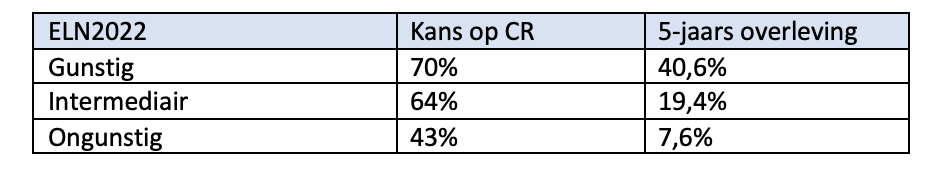
Recent is een nieuwe prognostische score ontwikkeld voor patiënten ouder dan 60 jaar met een AML4, die met een intensief schema (zoals gebruikt door Hovon) worden behandeld. Deze 60+ score discrimineert in deze populatie beter dan de ELN risico-classificatie.
Op basis van onderstaande variabelen met een weging worden patiënten in vier prognostische groepen verdeeld.
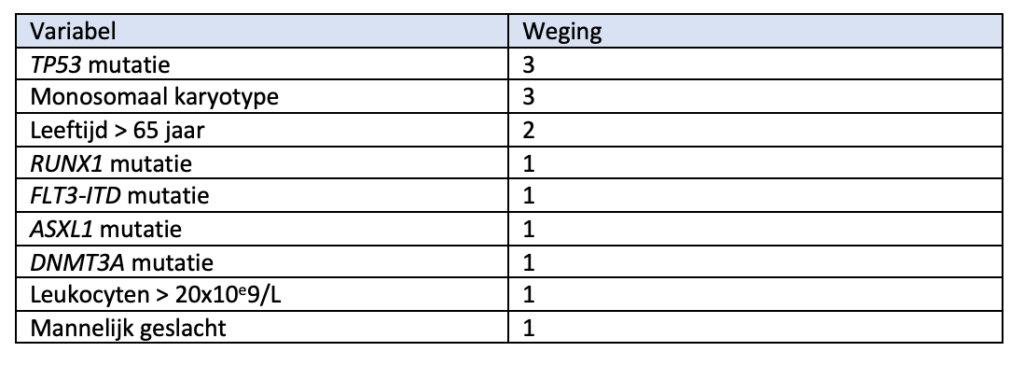
AML60+ classificatie

Aanbevelingen
|
Behandeling van AML vindt zoveel mogelijk in studieverband plaats |
SORT nvt |
|
De basisbehandeling voor een patiënt met een nieuw gediagnosticeerde AML die fit is voor intensieve chemotherapie bestaat in principe uit twee inductiekuren gevolgd door een risico gestuurde consolidatiebehandeling. |
SORT A |
|
De behandeling voor een patiënt met een nieuw gediagnosticeerde AML met een FLT3 mutatie die fit is voor intensieve chemotherapie bestaat uit de basisbehandeling gecombineerd met midostaurine (ITD en TKD) of quizartinib (ITD)(zie onderbouwing voor specifiek advies). |
SORT A |
|
De behandeling voor een patiënt met een nieuw gediagnosticeerde APL met een laag of intermediair risico bestaat uit all-transretinoïnezuur (ATRA) en arseentrioxide (ATO) |
SORT A |
|
De voorkeursbehandeling voor een patiënt met een nieuw gediagnosticeerde APL met een hoog risico bestaat uit all-transretinoïnezuur (ATRA) gecombineerd met arseentrioxide (ATO). Deze combinatie leidt tot een significant betere event-free survival, dan de behandeling met ATRA gecombineerd met chemotherapie. Er loopt een add on aanvraag voor de combinatie ATRA/ ATO. Tot deze combinatie vergoed wordt bestaat de behandeling uit ATRA gecombineerd met chemotherapie |
SORT A |
|
Onderhoudsbehandeling met azacitidine (oraal of subcutaan) kan overwogen worden voor patiënten die in remissie zijn gebracht met intensieve chemotherapie maar die niet in aanmerking komen voor een allogene hematopoiëtische stamceltransplantatie. |
SORT A |
Onderbouwing
Volgens vigerende richtlijnen (zie ook ELN 2022 aanbevelingen en richtlijnen van de ESMO en NCCN)1, 2, 3,4is voor fitte patiënten met een nieuw gediagnosticeerde AML intensieve chemotherapie al dan niet gecombineerd met doelgerichte therapie5 de voorkeursbehandeling, omdat hiermee het hoogste percentage complete remissies en ook de beste overlevingskansen bereikt werden.
Door resultaten van de EORTC-AML-21 studie6 verdient bovenstaande enige nuancering. In deze prospectieve, fase 3 studie was het doel patiënten ouder dan 60 jaar die fit worden geacht voor intensieve chemotherapie naar een allogene hematopoetische cel transplantatie te loodsen. Behandeling met 10 dagen decitabine werd gerandomiseerd vergeleken met intensieve chemotherapie volgens het 3+7 schema. Deze studie laat zien dat de overleving in beide groepen vergelijkbaar is (HR 1.04 (95% CI 0.86-1.26). Tevens is in deze studie gebleken dat, ook als geen complete remissie met hypomethylerende behandeling wordt bereikt, met een allogene HCT curatief geconsolideerd kan worden. Uit geplande subgroep analyses blijt dat, patiënten tussen 60-65 jaar, patiënten met een NPM1 mutatie en patiënten met een volgens de ELN 2017 gunstig risico, voordeel hebben van intensieve behandeling. Daarentegen lijken patiënten > 70 jaar en patiënten met een volgens de ELN 2017 ongunstig risico meer te profiteren van behandeling met decitabine.
Patiënten met een nieuw gediagnosticeerde AML dienen zo veel mogelijk behandeld te worden in studieverband. Buiten trialverband geldt dat de controle-arm van de H150 als standaardbehandeling wordt beschouwd.
De HOVON 501 heeft (in verband met de internationale samenwerking) een aangepaste controle arm. Vergeleken met internationaal frequent voorgeschreven inductiekuren, kan de dosering van de chemotherapie beschouwd worden als intensief, maar de dosis is lager dan de “standaard HOVON-inductie”.
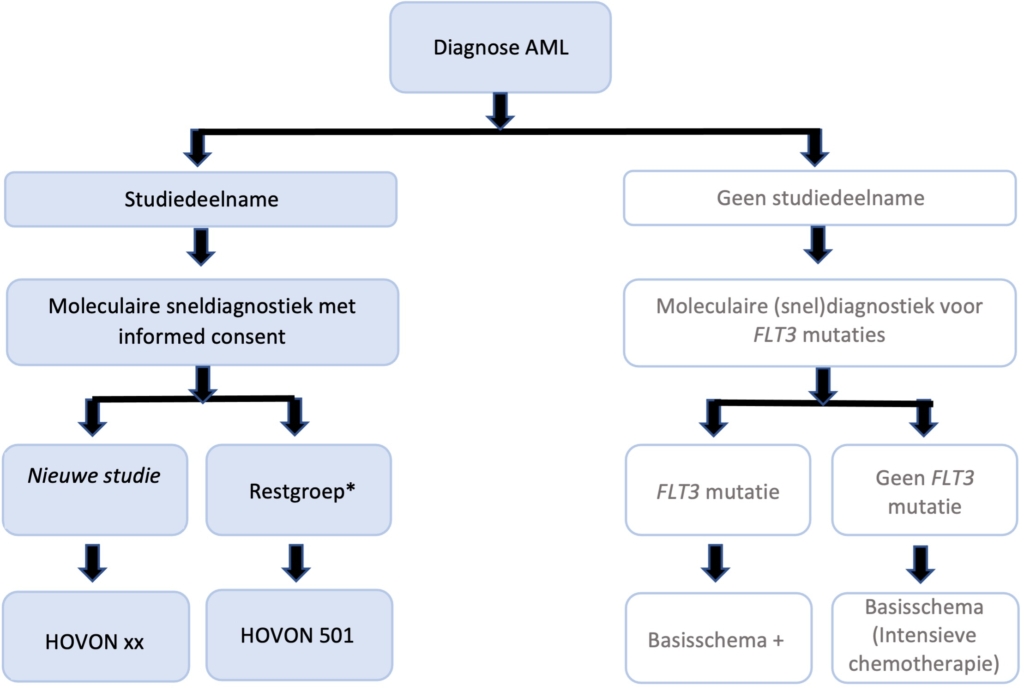
* Zonder FLT3 mutatie
** < 60 jaar (met FLT3-ITD variant) kan quizartinib overwogen worden
4.1.1. Basisschema (intensieve chemotherapie)
Het basisschema bestaat uit twee remissie-inductiekuren en een consolidatiebehandeling.
De eerste remissie-inductiekuur bestaat uit een continue i.v. infusie van cytarabine 200 mg/m2 (24 uur infusie) gedurende 7 dagen en daunorubicine 60 mg/m2 i.v. op dag 1-3 (1 uur infusie).
De tweede remissie-inductiekuur bestaat uit twee giften cytarabine 1000 mg/m2 i.v. (3 uur infusie) per 24 uur, gedurende 6 dagen. Bij patiënten tot en met 60 jaar wordt daunorubicine 60 mg/m2 i.v. op dag 1 t/m 3 (1 uur infusie) toegevoegd. Bij patiënten vanaf 61 jaar wordt geen daunorubicine gegeven (en bestaat de kuur enkel uit de cytarabine). Doses cytarabine hoger dan 1000 mg/m2 zijn niet effectiever7).
Indien daunorubicine niet beschikbaar is, dan kan deze vervangen worden door amsacrine (120 mg/m2; 1 uur i.v. infusie; dag 4-6 (of dag 5-7)) of idarubicine (12 mg/m2; 1 uur i.v. infusie; dag 4-6 (of dag 5-7)).
Indien patiënten na een eerste inductiekuur hun blasten niet hebben geklaard (geen: CR/ CRi/ MLFS) is het uitdrukkelijk advies om zo snel mogelijk (na herstel van niet-hematologische toxiciteit; met name mucositis) een doorstart te maken met de tweede inductiekuur. Met deze aanpak worden goede resultaten bereikt met hoge CR/ CRi kans en lage vroege sterfte. Ook de ELN benadrukt het belang van twee inductiekuren. Ongeveer 20% van de remissies wordt pas na 2 intensieve chemokuren bereikt. Voor patiënten met een TP53 mutatie wordt verwezen naar paragraaf 4.1.4.
De consolidatiebehandeling is afhankelijk van het risicoprofiel van de patiënt (zie module 5.1).
Gemtuzumab ozogamicine
Een meta-analyse8 toonde een gunstig effect van gemtuzumab ozogamicine (GO) aan bij patiënten met een AML met een ELN gunstig risicoprofiel (5 jaars overleving 76% vs 55%). Het advies van de werkgroep is echter om ook deze patiënten in lopende HOVON-studies te behandelen. Indien deelname niet mogelijk is kan buiten studieverband op basis van deze data gebruik van GO (alléén in de eerste kuur gedurende 3 dagen 3 mg/m2(max 5 mg), dag 1, 4 en 7) in de behandeling van core-binding-factor (CBF) AML overwogen worden, waarbij aangetekend dient te worden dat: 1) de meerwaarde in de setting van autologe SCT als consolidatie bij AML niet is aangetoond; 2) gebruik van GO geassocieerd is met SOS/ VOD wat de geschiktheid voor/ het beloop van autologe SCT zou kunnen compliceren; 3) GO de kans op succesvolle stamcelverzameling wat lijkt te verminderen9.
AML met myelodysplasie-gerelateerde veranderingen of therapie gerelateerde AML.
Gerandomiseerde studies suggereren dat patiënten met AML met myelodysplasie gerelateerde veranderingen of therapie-gerelateerde AML een betere overleving hebben als zij worden behandeld met een liposomale formulering daunorubicine/cytarabine (CPX-351, Vyxeos®). De controle arm van de gerandomiseerde registratiestudie10 wijkt echter af van de standaard intensieve chemotherapie behandeling zoals gegeven binnen HOVON.
Een (nog niet gepubliceerde) analyse van de HOVON, waarbij de data van de fase 2 en 3 studies met CPX-351 vergeleken zijn met een gematcht cohort dat behandeld is met het in Nederland gehanteerde inductieschema (HOVON 102, 103 en 132) laat geen significante verschillen zien in uitkomst (OS). Wel worden in het HOVON-cohort meer complete remissies (CR en CRi) bereikt. Gezien deze uitkomst, tezamen met een langere neutropenie duur en duidelijk hogere kosten bij het gebruik van CPX-351, heeft de werkgroep besloten dat, er in afwachting van direct vergelijkende data, in Nederland geen plaats is voor het gebruik van CPX-351. Patiënten met een AML met myelodysplasie-gerelateerde veranderingen (AML-MRC) en therapie- gerelateerde AML worden daarom volgens bovenstaand stroomdiagram en schema behandeld.
4.1.2: FLT3 mutaties
FLT3 mutaties komen bij ongeveer 30% van de AML-patiënten voor (FLT3-ITD (Internal Tandem Duplicatie) ongeveer 25% en FLT3-TKD (Tyrosine Kinase Domein) mutatie in ongeveer 5%).
In een grote internationale, gerandomiseerde, placebo-gecontroleerde fase III studie (RATIFY-trial)11 is aangetoond, dat patiënten met FLT3-ITD of FLT3-TKD mutaties een significant betere overleving (8% toename ten opzichte van placebo-arm) hebben als de tyrosinekinaseremmer midostaurine wordt toegevoegd aan intensieve chemotherapie (HR 0.78). Dit voordeel was consistent in vrijwel alle subgroepen (behalve vrouwen met een FLT3-ITD < 0.7 en ongunstig risico met FLT3-TKD) en onafhankelijk van consolidatie met een allogene hematopoëtische stamceltransplantatie. Het aantal bijwerkingen (SAE) was niet significant verschillend ten opzichte van de controle-arm.
Ook voor quizartinib is middels een grote gerandomiseerde studie (QuANTUM-First trial) aangetoond dat het overlevingsvoordeel biedt als het wordt gecombineerd met intensieve chemotherapie bij patiënten met AML met een FLT3-ITD (quizartinib heeft geen werkzaamheid tegen een FLT3-TKD mutatie) 12.
Omdat er geen directe vergelijking bestaat tussen deze twee middelen is getracht in een “matching adjusted indirect treatment comparison” de werking van deze beide middelen in combinatie met intensieve chemotherapie te vergelijken. Voor deze analyse zijn alleen patiënten met een FLT3-ITD mutatie van de RATIFY-trial gebruikt. In deze analyse blijkt quizartinib bij jonge patiënten niet inferieur te zijn ten aanzien van overleving en superieur ten aanzien van het verminderen van de kans op relapse na bereiken van een complete remissie. Quizartinib is evenwel meer myelosuppressief dan midostaurine wat kan leiden tot toename van de toxiciteit, met name infecties.
Op basis van deze analyse is het advies van de werkgroep om patiënten met een FLT3-TKD mutatie en patiënten ouder dan 60 jaar met een FLT3-ITD mutatie met intensieve chemotrherapie in combinatie met midostaurine te behandelen. Bij (fitte) patiënten < 60 jaar kan ook combinatie met quizartinib overwogen worden – bijvoorbeeld bij intolerantie voor midostaurine.
Midostaurine is geregistreerd voor onderhoudsbehandeling gedurende een jaar na autologe hematopoëtische stamceltransplantatie en na consolidatie met intensieve chemotherapie. Quizartinib kan volgens label gebruikt worden als onderhoudsbehandeling na consolidatie met zowel chemotherapie, autologe stamceltransplanatie als ook allogene stamceltransplantatie, waarbij de werkgroep het advies geeft de duur van onderhoudsbehandeling te beperken tot 1 jaar (in overeenstemming met midostaurine), omdat de meeste recidieven in het eerste jaar optreden en er onvoldoende wetenschappelijke ondersteuning is voor de meerwaarde van langere onderhoudsbehandeling.
Onderhoudsbehandeling na allogene stamceltransplantatie met een tweede-generatie FLT3 inhibitor (gilteritinib) leidde in de MORPHO-trial13 tot verbeterde overleving in patiënten die FLT3-ITD MRD positief waren voor of na transplantatie.
4.1.3: Restgroep in studieverband
Patiënten zonder FLT3 mutatie worden bij voorkeur behandeld in de HOVON 501 studie. Bij deze studie wordt de BCL2-remmer venetoclax of een placebo toegevoegd aan een licht gemodificeerd basisschema (met een intensiteit, die vergelijkbaar is met internationale standaarden, maar minder intensief is dan het standaard HOVON-schema).
4.1.4: Myeloïde neoplasie met TP53 mutatie
Mutaties in TP53 zijn vaak geassocieerd met complexe cytogenetische afwijkingen en komen bij ongeveer 10% van de AML-patiënten voor (maar tot 20-30% bij oudere AML-patiënten). Deze mutaties zijn geassocieerd met een zeer sombere prognose (3-jaars overleving inclusief allogene hematopoëtische stamceltransplantatie 0-15%). Bij MDS-patiënten is aangetoond dat de prognose vooral heel slecht is bij patiënten die geen wildtype TP53 allel meer hebben. Uit onderzoek binnen de HOVON leukemiegroep14 blijkt ook dat de prognose voor AML-patiënten met een TP53 mutatie heel slecht is (N = 230, 2-jaarsoverleving 12.8%), vooral binnen de zogenoemde genetisch instabiele TP53subgroep met een complex karyotype. Deze uitkomst is onafhankelijk van de VAF. Een subgroep, genetisch stabiele patiënten (zonder complex of monosomaal karyotype), heeft een significant lagere kans op recidief ziekte en derhalve een betere overleving.
Om nog onbegrepen redenen zijn patiënten met een TP53-mutatie relatief gevoelig voor behandeling met decitabine. Het percentage remissies bij decitabine behandeling is relatief hoog maar van korte duur15, 16 .
Bij persisterende ziekte na een intensieve inductiekuur en aanwezigheid van een TP53 mutatie kan overwogen worden 10 dagen decitabine te geven, te switchen naar een behandeling in studieverband of over te gaan op supportive care.
4.1.5: Onderhouds-/ overbruggingsbehandeling
Bij patiënten die in remissie zijn gekomen na intensieve chemotherapie, maar niet (direct) in aanmerking komen voor een allogene SCT, verlengt onderhoudsbehandeling met azacitidine 50 mg/m2 s.c. gedurende 5 dagen per 4 weken de ziektevrije overleving (DFS 64% vs 42% bij 12 maanden; uitkomst van de HOVON 97 studie)17. Deze studie was niet gepowerd op overleving.
De prospectief gerandomiseerde QUAZAR studie18 heeft een significant overlevingsvoordeel laten zien van onderhoudsbehandeling met een orale formulering van azacitidine (CC-486, Onureg®, 1 dd 300 mg dag 1-14 in cycli van 28 dagen) bij patiënten die na intensieve chemotherapie (inductie +/- consolidatie) niet in aanmerking kwamen voor een allogene SCT (mediane overleving 24.7 versus 14.8 maanden).
Op grond van deze data, waarbij formeel alleen voor orale azacitidine een overlevingsvoordeel is aangetoond, ondersteunt de werkgroep het gebruik van orale azacitidine in deze setting. Subcutane toediening wordt evenwel als een redelijk tot goed alternatief beschouwd (indien orale azacitidine niet beschikbaar is in een ziekenhuis). De behandeling wordt im principe voortgezet tot aan progressie, allogene HCT of inaceptabele toxiciteit.
4.1.6: Acute Promyelocytenleukemie (APL)
* ATO wordt op dit moment niet vergoed voor hoog risico APL, een add-on aanvraag is ingediend
Acute promyelocyten leukemie (APL) verdient extra aandacht gezien de karakteristieke klinische presentatie (met stollingscomplicaties, zowel trombose als ook bloedingen, als DIS) en een uitzonderlijke therapiegevoeligheid voor transretinoïden (all-transretinoïnezuur = ATRA) en arseentrioxide (ATO).
Het ziektebeeld varieert in prevalentie. In de Noord-Europese landen komt het slechts in een gering percentage (5-8%) van de AML voor terwijl de incidentie in de Zuid-Europese en Latijns-Amerikaanse landen significant hoger (15-30%) ligt.
Bij de geringste verdenking op een APL (op basis van morfologie: blasten met “takkenbossen” (cave variant: agranulair of fijne, stofachtige rode granula, sterk gelobde kern); kliniek met bloedingen en of DIS) dient zonder enig uitstel ATRA (45 mg/m2 per dag verdeeld over 2 giften) gegeven te worden en dient de patiënt te worden overgeplaatst naar een APL-behandelcentrum (echelon A en B)19, 20.
Bij de behandeling van een APL is speciale aandacht nodig voor:
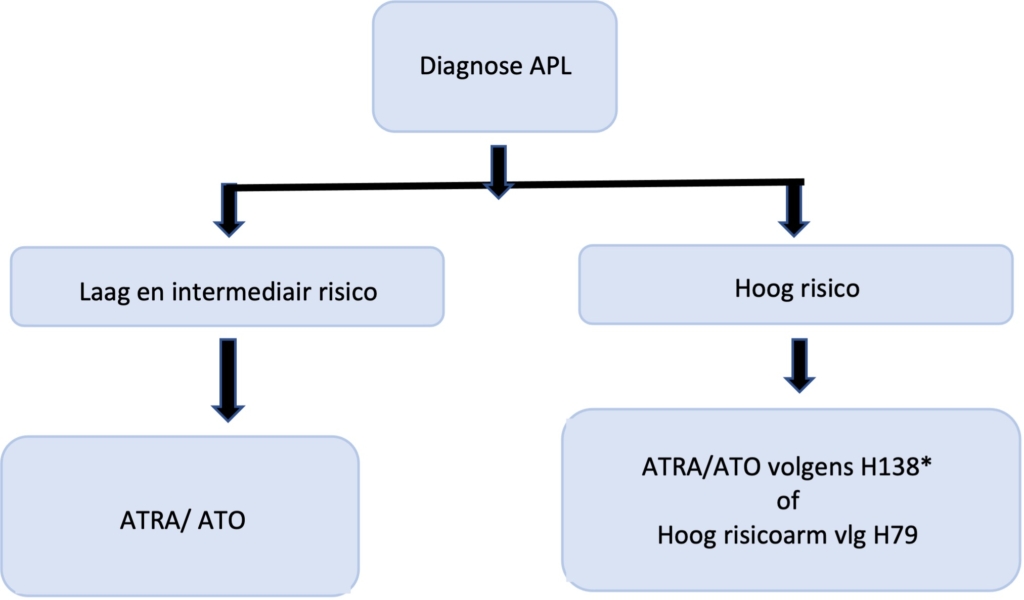
APL wordt onderverdeeld in drie groepen (Sanz score):
De behandeling is afhankelijk van deze risico-indeling.
De eerste- en tweedelijnsbehandeling voor patiënten met laag en intermediair risico APL bestaat uit ATO en ATRA21-23.
Tijdens de inductiebehandeling wordt ATO 0,15 mg/kg per dag gecombineerd met ATRA 45 mg/m2 verdeeld over twee giften per dag. Bij een leukocytose van 10-50 x 109/L wordt hydroxycarbamide 2000 mg per dag (verdeeld over 2 of 4 doses) toegevoegd, bij leukocyten >50 x 109/L dient de dosering hydroxycarbamide 4 dd 1000 mg te zijn. De hydroxycarbamide wordt gestaakt als de leukocyten zijn gedaald naar <10 X109/L.
Ter voorkoming van het APL-differentiatie-syndroom moeten dexamethason of prednisolon worden gegeven (zie module 8.3).
De inductiebehandeling met ATO en ATRA wordt gecontinueerd tot aan het behalen van een complete morfologische remissie (CR: < 5% myeloblasten en geen abnormale promyelocyten), maar minimaal 28 dagen. Indien nog geen CR is bereikt wordt de behandeling telkens met een week verlengd tot maximaal 60 dagen. Bij het behalen van een CR worden beide middelen gestaakt en wordt de remissie bevestigd na hematologisch herstel (neutrofielen > 1×109/L en trombocyten > 100×109/L).
Consolidatiebehandeling (laat en intermediair risico APL)
Na het behalen van een complete remissie en herstel van het bloedbeeld begint de consolidatiebehandeling. Deze behandeling bestaat uit vier gelijke blokken waarbij ATO 0,15 mg/kg per dag gedurende 5 dagen per week, gedurende 4 weken gegeven wordt, gevolgd door 4 weken rust. De ATRA wordt in 7 gelijke blokken van 45 mg/m2 verdeeld over twee giften per dag gegeven, gedurende 2 weken, gevolgd door 2 weken rust (zie module 12 voor schematische weergave).
Patiënten met een hoog risico APL worden volgens de hoog-risicoarm van de HOVON 79 studie behandeld, waarbij een inductiekuur wordt gevolgd door drie consolidatiekuren en twee jaar onderhoudsbehandeling.Echter is recent gebleken24 dat de behandeling met ATO en ATRA ook bij patiënten met een hoog risico APL tot een significant betere “event-free survival” leidt. Op basis van deze data stelt de werkgroep voor dat de experimentele arm van de HOVON138 de standaardbehandeling voor patiënten met een hoog risico APL wordt. De vergoeding hiervoor is aangevraagd. Totdat de vergoeding voor ATO in deze groep is geregeld zal de hoog-risico arm van de HOVON 79 de standaardbehandeling zijn.
In de ATO/ATRA/idarubicine arm van de HOVON 138 bestaat de inductiekuur uit ATRA 45mg/m2 verdeeld over twee giften per dag vanaf dag 1 tot tenminste dag 28, of langer indien nog geen complete hematologische remissie is bereikt (maximaal 60 dagen), ATO 0,15 mg/kg per dag van dag 5 tot aan complete hematologische remissie en idarubicine 12 mg/m2 op dag 1 en 3 (dag 2 in plaats van dag 3 is ook toegestaan). ATO wordt op dit moment niet vergood voor hoog risico APL, een add-on aanvraag is ingediend.
Consolidatiebehandeling (hoog risico APL)
Na het behalen van een complete remissie en herstel van het bloedbeeld begint de consolidatiebehandeling. Deze behandeling bestaat uit vier gelijke blokken waarbij ATO 0,15 mg/kg per dag gedurende 5 dagen per week, gedurende 4 weken gegeven wordt, gevolgd door 4 weken rust. De ATRA wordt in 7 gelijke blokken van 45 mg/m2 verdeeld over twee giften per dag gegeven, gedurende 2 weken, gevolgd door 2 weken rust (zie module 12 voor schematische weergave).
In de hoog-risicoarm van de HOVON 79 bestaat de inductiekuur uit ATRA 45mg/m2 verdeeld over twee giften per dag tot aan complete hematologische remissie, gecombineerd met idarubicine 12mg/m2 op dag 2, 4, 6 en 8 (bij patiënten > 70 jaar dag 8 laten vervallen).
Bij een leukocytose (>10 x109/L) tijdens de behandeling wordt hydroxycarbamide toegevoegd (leukocyten: 10-50 x109/L dan 4 dd 500 mg; leukocyten >50 x109/L dan 4 dd 1000 mg) totdat de leukocyten weer < 10 x 109/L zijn.
De consolidatiekuren bestaan telkens uit: ATRA 45 mg/m2, verdeeld over twee giften per dag, gedurende 15 dagen gecombineerd met:
De onderhoudsbehandeling begint binnen een maand na het hematologische herstel van de laatste consolidatiecyclus en duurt twee jaar. Deze bestaat uit 6-mercaptopurine (1 dd 50 mg/m2 p.o.) en MTX (15 mg/m2 per week p.o.). Zie voor dosisreducties module 12. Elke 3 maanden wordt bovenstaande onderbroken voor 15 dagen behandeling met ATRA (45mg/m2 verdeeld over twee giften per dag, < 20 jaar 25 mg/m2).
Indien na de volledige consolidatiebehandeling geen complete moleculaire remissie is bereikt, dan moet een tweedelijnstherapie gestart worden. Tweedelijns behandeling bestaat uit de combinatie ATRA en ATO. Bij bereiken van een moleculaire complete remissie kan met een autologe HCT geconsolideerd worden. Bij persisterend positieve moleculaire MRD wordt bij voorkeur geconsolideerd met een allogene HCT.
De belangrijkste bijwerkingen van ATO zijn:
Derhalve is het uitdrukkelijke advies om het ECG minimaal 1 keer per week te verrichten en in geval van tekenen van QT-verlenging 2-3 keer per week.
Bij een QTc-tijd (berekend volgens de Framingham formule (QTc=QT+0.154*(1000-RR)) boven > 450 ms voor mannen en > 460 voor vrouwen wordt (conform Lo-Coco NEJM 2014) geadviseerd de toediening van ATO en ook andere medicatie met invloed op QTc-tijd te onderbreken en elektrolyten waar nodig te corrigeren. Bij normalisatie van de QTc-tijd wordt de ATO hervat met een dosering van 0,075 mg/kg (50%). Als in de eerste week geen verdere verlenging optreedt kan de ATO stapsgewijs wekelijks verder worden opgehoogd naar 0,11 mg/kg en uiteindelijk naar de volledige dosering. Aandacht voor normale waarden van de elektrolyten is hierbij ook van belang.
Bij graad 3-4 CTCAE hepatotoxiciteit (bilirubine en/of ASAT en/of AF > 5xULN) is het advies om de ATRA en/of ATO tijdelijk te staken. Deze kunnen met een dosering van 50% herstart worden als de leverwaarden zijn gedaald naar < 4xULN. Als dit gedurende een week goed gaat, mag de dosering ATRA en/of ATO op 100% worden hervat. Bij terugkeer van hepatotoxiciteit is het advies de middelen blijvend te staken.
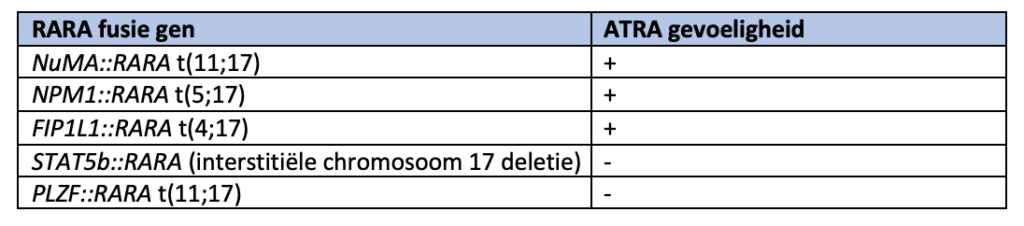
Genetische varianten van APL
Over het algemeen zijn patiënten met alternatieve (RARA) fusiegenen ATRA-gevoelig en dienen zij te worden behandeld met standaard ATRA-gebaseerd therapie, zoals hierboven beschreven. Patiënten met varianten waarvan bekend is dat deze resistent zijn tegen ATRA moeten worden behandeld met standaard AML-inductietherapie. Zie tabel hieronder.
4.1.7: Zeldzame vormen van AML
Blastair dendritische cel neoplasie (BPDCN)
Een BPDCN wordt historisch behandeld met ALL of AML gebaseerde chemotherapieschema’s (eventueel zelfs NHL-schema’s) waarbij de beste uitkomst werd verkregen na consolidatie met een allogene SCT25-27.
Ondertussen is tagraxofusp (12 ug/kg; dag 1-5, cyclusduur 21 dagen) door de FDA en EMA goedgekeurd. Tagraxofusp is een recombinant fusie eiwit van IL-3 en difterietoxine. Behandeling met tagraxofusp, met eventueel ook allogene hematopoëtische stamcel-transplantatie als consolidatie, geeft 72% CR/ complete klinische respons (een specifiek voor de studie gedefinieerd eindpunt) en een 2 jaars-overleving van 52%28. Gezien deze resultaten is tagraxofusp de gewenste (inductie) behandeling, gevolgd door consolidatie middels een allogene HCT. Voor de Nederlandse markt loopt een registratieaanvraag. Tot dit middel in Nederland beschikbaar komt is het op compassionate use basis verkrijgbaar.
Mixed Phenotype Acute Leukemia (MPAL)
Over het algemeen wordt een ALL-behandeling geadviseerd (de wetenschappelijke onderbouwing hiervoor is gering)29, maar er kan ook gestart worden met een AML- behandeling, gevolgd door allogene HCT. Indien een t(9;22) aanwezig is wordt een TKI aan de behandeling toegevoegd, bij voorkeur dasatinib 1 dd 140 mg, evt 100 mg op geleide van eventuele toxiciteit.
Aanbevelingen
|
Behandeling van AML vindt zo veel mogelijk in studieverband plaats |
SORT nvt |
|
De standaardbehandeling voor een patiënt (zonder IDH1 of TP53mutatie) met een nieuw gediagnosticeerde AML die niet fit is voor intensieve chemotherapie, maar wel (maximaal) behandeld wil worden, bestaat uit een hypomethylerend middel (azacitidine of decitabine) in combinatie met venetoclax. |
SORT A
|
|
Bij patiënten met een nieuw gediagnosticeerde AML met een IDH1mutatie die niet fit zijn voor intensieve chemotherapie geeft toevoeging van ivosidenib aan azacitidine een significant betere PFS en OS (vergeleken met monotherapie azacitidine) met een acceptabel bijwerkingenprofiel. |
SORT A
|
|
Bij patiënten met een nieuw gediagnosticeerde AML met een IDH1mutatie die niet fit zijn voor intensieve chemotherapie lijkt (hoewel niet “head tot head” vergeleken) azacitidine met ivosidenib een betere OS te geven dan azacitidine met venetoclax (mediaan >29 vs 15 maanden). |
SORT B
|
|
Patiënten die minder intensief behandeld willen worden kunnen kiezen uit monotherapie azacitidine s.c., decitabine i.v., decitabine/cedazuridine p.o., lage dosis cytarabine of enkel ondersteunende behandeling. |
SORT A |
Onderbouwing
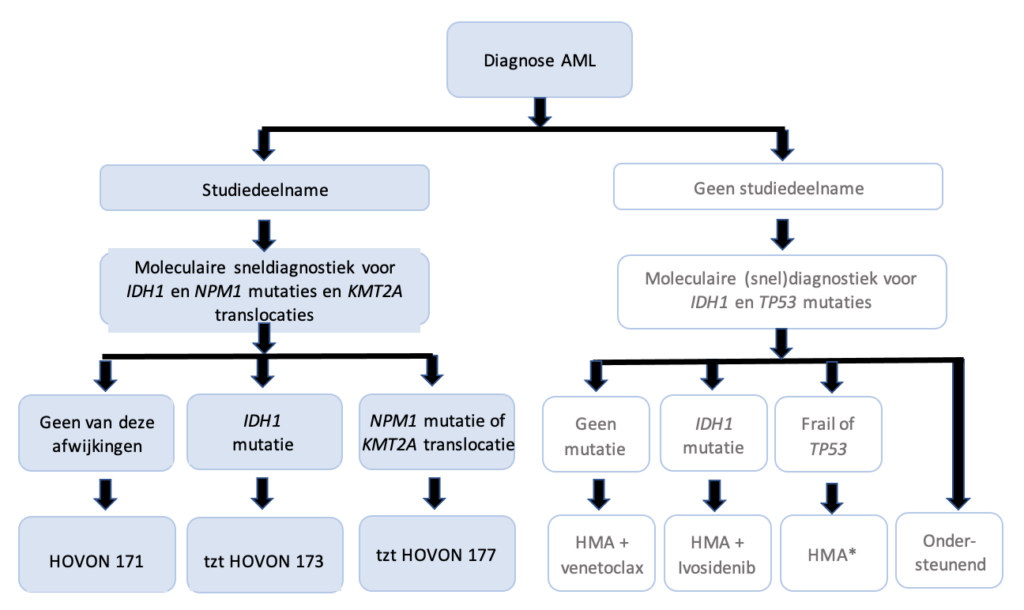
NB: De HOVON171 onderzoekt de farmaco-kinetische gelijkwaardigheid van door cobicistat “versterkte” venetoclax (cobicistat verhoogt de plasmaspiegel van venetoclax door CYP3A remming) in de combinatie met azacitidine (onafhankelijk van genetisch profiel).
De HOVON173 vergelijkt prospectief placebo-gecontroleerd azacitidine, ivosidenib met of zonder venetoclax.
De HOVON177 vergelijkt prospectief placebo-gecontroleerd azacitidine, venetoclax met of zonder revumenib.
* bij monotherapie met een HMA kan gekozen worden tussen azacitidine (75 mg/m2 gedurende 7 dagen s.c.), decitabine (20 mg/m2gedurende 5 dagen i.v.) of decitabine/cedazuridine (35 mg/100 mg gedurende 5 dagen p.o.).
Er zijn veel scoresystemen die de fysieke gesteldheid (in het Engels “fitness”) van een patiënt definiëren. Geen van allen zijn ideaal. De leukemiewerkgroep heeft ervoor gekozen om fitheid te beoordelen met behulp van de hematopoiëtische stamceltransplantatie co-morbiditeit index (HCT-CI) score30, 31. Patiënten met een score van > 3 (zonder meenemen van leeftijd) worden, gezien ca. 30% kans op overlijden tijdens de eerste 30 dagen bij intensieve behandeling, als ongeschikt voor intensieve behandeling beschouwd.
Internationaal worden daarnaast de zogenaamde “Ferrara criteria” veel gebruikt32. Hierin is “niet fit voor intensieve chemotherapie” o.a. gedefinieerd als:
De volledige criteria zijn als bijlage toegevoegd.
Voor patiënten die niet fit genoeg zijn voor intensieve behandeling of afzien van een intensief behandeltraject zijn diverse behandelingen beschikbaar. Ook hier heeft waar mogelijk behandeling in studieverband de voorkeur.
Hypomethylerende therapie met venetoclax
In een gerandomiseerde fase 3 studie (VIALE-A)33 is aangetoond dat toevoeging van venetoclax aan azacitidine het CR/ CRi percentage en de overleving significant verbetert (resp. van 28% naar 66% en van 9.6 maanden naar 14.7 maanden). Een soortgelijke fase 2 studie waarbij venetoclax aan decitabine wordt toegevoegd34 laat vergelijkbare getallen zien (CR/ CRi de novo AML 84%, secundaire AML 67%; OS 18.1 maanden).
In beide studies werden langdurige pancytopenieën en hieraan gerelateerde infectieproblemen gezien.
Nauwkeurige controle van het bloedbeeld is belangrijk voor eventuele transfusies en preventie van infecties (bacterieel en schimmel).
De werkgroep adviseert (pragmatisch) bij (diepe) neutropenie tot aan herstel van de neutropenie (na de eerste kuur of later) profylaxe met posaconazol. Hierbij dient de dosering venetoclax volgens bijgevoegd schema (module 12) aangepast te worden. Ook adviseert de werkgroep bij persisterende neutropenie (bij “blastencontrole”/ MLFS in het beenmerg) laagdrempelig G-CSF toe te voegen.
De werkgroep heeft geen voorkeur voor een van de twee DNA methyltransferase remmers in deze combinatie. In een vergelijkende fase 1b studie konden geen significante verschillen in CR/CRi (71% vs 74%) en OS (16.4 maanden vs 16.2 maanden) worden aangetoond35.
Aan de conventionele behandeling met azacitidine (75 mg/m2 gedurende 7 opeenvolgende dagen per 28 dagen) of decitabine (cyclus 1: 20 mg/m2 gedurende 10 dagen in cyclus 1 en 5 dagen bij vervolgcycli) wordt venetoclax toegevoegd, waarbij gedurende de eerste cyclus een ramp-up schema wordt gevolgd. Het aantal dagen venetoclax in de VIALE-studies was 28 dagen. Gezien de toxiciteit met diepe langdurige cytopenie, die hierbij gezien wordt, adviseert de werkgroep het aantal dagen venetoclax te verkorten (zie schema module 12). Deze aanpassing is gebaseerd op de publicatie van Pratz et al.36, een abstract op de ASH37 en expert opinion.
De bereikte remissie correleert met de duur van de mediane OS (met uitzondering van patiënten met een p53 mutaties). Patiënten die een CR/ CRi behalen hebben een verwachte mediane OS van ongeveer 24 maanden. Patiënten die een MRD negatieve remissie behalen hebben een verwachte mediane OS van ongeveer 34 maanden38, 39.
Bij patiënten met een TP53 mutatie is het de vraag of toevoeging van venetoclax aan een hypomethyleerder van toegevoegde waarde is. In de VIALE-A studie is geen overlevingsvoordeel van toevoeging van venetoclax aan de subgroep patiënten met een TP53 mutatie (EMA-rapport van de VIALE-A studie) aangetoond, echter wel een duidelijke toename in CR/CR1 (0% versus 55%). Er zijn geen studies waarbij dit gerandomiseerd is uitgezocht. De werkgroep adviseert om bij deze patiënten buiten studieverband venetoclax achterwege te laten.
Van azacitidine is een orale variant beschikbaar met een ander farmacokinetisch profiel (14 dagen 300 mg per dag, 14 dagen op en af; Onureg®) dat geregistreerd is voor onderhoudsbehandeling na intensieve chemotherapie. Van decitabine is een orale variant beschikbaar, dat decitabine combineert met de cytidine deaminase remmer cedazuridine (Inaqovi®) en een vergelijkbaar farmacokinetisch profiel heeft als intraveneus decitabine. Decitabine/cedazurine is geregistreerd als monotherapie. Gezien haar farmacokinetisch profiel en het patiënten gemak staat de werkgroep positief tegenover decitabine/cedazurine in plaats van intraveneus decitabine of subcutane azacitidine (als monotherapie).
Op basis van bovenstaande adviseert de werkgroep voor patiënten met een AML die in aanmerking komen voor hypomethylerende therapie een combinatie met venetoclax, behalve voor patiënten met een IDH1 ofTP53 mutatie (zie volgende Alinea).
Azacitidine met ivosidenib
In 2022 is de gerandomiseerde fase 3 AGILE studie gepubliceerd40. In deze studie werden patiënten met een IDH1 mutatie met azacitidine met placebo of ivosidenib behandeld. Deze studie toonde aan dat toevoegen van ivosidenib aan azacitidine resulteerde in een hoger percentage CR/CRh (53% vs 18%) en een significant betere mediane OS (24.0 vs. 7.9 maanden). Na langere follow-up was het verschil nog groter (mediane OS 29 versus 7.9 maanden)41. De frequentie van febriele neutropenie en infecties was lager in de ivosidenib-arm (resp. 28% vs 34% en 28% vs 49%), wellicht omdat ivosidenib de uitrijping bevorderde.
Op basis van bovenstaande adviseert de werkgroep voor patiënten met AML, niet fit voor intensieve chemotherapie en een IDH1 mutatie, behandeling met azacitidine en ivosidenib. Dit impliceert dat bij alle patiënten die niet fit zijnvoor intensieve chemotherapie moleculair onderzoek moet plaatsvinden om de aanwezigheid van een IDH1 mutatie te bepalen.
Monotherapie HMA en cytarabine
In het verleden (voor het beschikbaar komen van venetoclax en ivosidinib) hebben verschillende behandelstrategieën (zoals hypomethylerende middelen en lage dosis cytarabine) in prospectieve gerandomiseerde studies voordeel laten zien ten opzichte van conventionele behandeling34-38, 42-46. Bij ongunstige cytogenetische kenmerken houdt dit positieve effect alleen bij hypomethylerende middelen stand en is lage dosis cytarabine niet zinvol.
Buiten studieverband zijn afhankelijk van de patiënt (persoonlijke voorkeur, e.d.) en de inschatting van de arts (fysieke gesteldheid, biologie van de ziekte e.d.) onderstaande behandelingen nog steeds mogelijke opties:
Patiënten die (langdurig) succesvol met hypomethylerende middelen worden behandeld kunnen op een gegeven moment cytopenieën ontwikkelen door toxiciteit. Zonder aanwijzingen voor progressie wordt dosisreductie (voor azacitidine bijvoorbeeld 7 dagen 100 mg of behandelduurreductie van 5 dagen ipv van 7 dagen) of verlenging van het interval tussen de kuren als zinvol beschouwd.
Glasdegib:
In 2019 zijn data gepubliceerd van een gerandomiseerde fase 2 studie47 die low dose cytarabine met of zonder glasdegib (een remmer van de Hedgehog signaleringsroute) vergeleek. Bij een geplande primaire analyse was het verschil in mediane overleving niet statistisch significant (7,2 versus 4,1 maanden). Uiteindelijk bleek bij langere follow-up de mediane overleving 8,8 maanden in de glasdegib/LDAC arm en 4,9 maanden in de LDAC arm significant verschillend te zijn. Hoewel hiermee de werkzaamheid van glasdegib in AML aannemelijk is gemaakt, zijn deze data inferieur aan de resultaten die met decitabine monotherapie (HOVON 135; mediane OS 11 maanden) en met HMA in combinatie met venetoclax (mediane OS 14.7 maanden) bereikt worden. Daarom concludeert de werkgroep dat er (op basis van deze data) geen plaats is voor glasdegib voor de behandeling van oudere niet fitte patiënten met AML. Een fase 3 studie met azacitidine met of zonder glasdegib is gaande.
Aanbevelingen
|
De keuze voor een autologe dan wel allogene HCT vindt risico-gestuurd plaats op basis van de ELN 2022-genetische risico classificatie, CRe, hyperleukocytose bij diagnose, MRD na de 2einductiekuur en leeftijd. |
SORT B |
|
De Hematopoiëtische Cel Transplantie Co-morbiditeits Index (HCT-CI) score geeft richting bij de risico-inschatting van transplantatie gerelateerde mortaliteit voor een allogene HCT. |
SORT A |
Onderbouwing
De consolidatiebehandeling is afhankelijk van het risicoprofiel van de AML, de respons op deinductiebehandeling en de te verwachten toxiciteit van de verschillende behandelstrategieën. Omdat eenallogene hematopoiëtische celtransplantatie bij de grote meerderheid van de patiënten die wordt behandeldmet intensieve chemotherapie een integraal onderdeel is van de behandeling, is het belangrijk zo vroegmogelijk in het diagnostiek-/ behandeltraject te starten met het zoeken naar een geschikte stamceldonor.
Het door de werkgroep vastgestelde algoritme voor de “standaard of care” postremissie-behandeling bijpatiënten die in aanmerking komen voor intensieve behandeling en die in een complete hematologische remissie zijn na 2 intensieve chemokuren staat uitgewerkt in onderstaand schema. In bijzondere gevallen kan ervoor gekozen worden om direct na de eerste inductiekuur door te gaan met een allogene SCT. In studieverband kan de consolidatie afwijken van de in Nederland gangbare consolidatiebehandeling. Vergelijking tussen de diverse (internationale) schema’s is gezien wisselende inductiebehandelingen niet mogelijk.
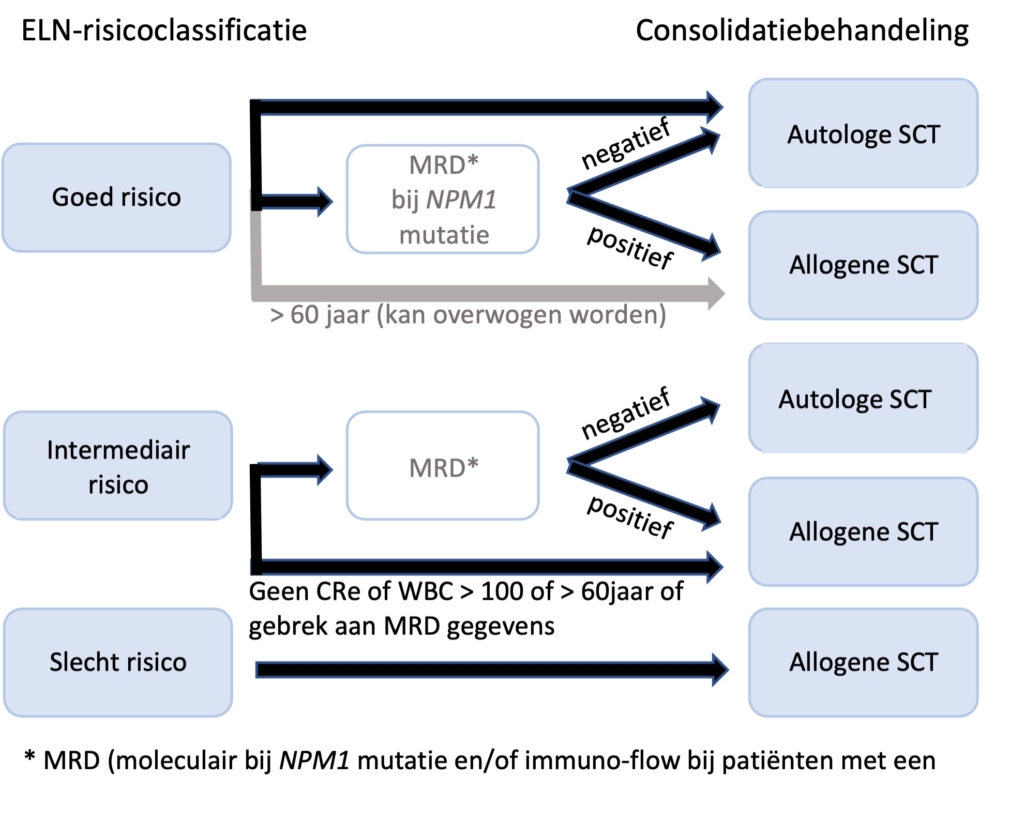
NB: Bij hogere leeftijd kan hiervan worden afgeweken omdat ook oudere patiënten met een ELN goed risico op basis van leeftijd een matige prognose hebben
NB: In de HOVON 132 studie, gebaseerd op bovenstaand schema, verloor MRD na 2 kuren zijn predictieve waarde, hetgeen suggereert dat bovenstaande een goede strategie is.
NB: De onderbouwing om ELN gunstig risicopatiënten en MRD negatieve intermediair risico patiënten te consolideren met een autologe HCT is gebaseerd op de HOVON 42 studie, die aantoonde dat patiënten met gunstig risicoprofiel een significant betere EFS (maar niet OS) hadden na autologe HCT in vergelijking met consolidatiechemotherapie.
Geïntegreerde EBMT HCT-CI score
Om de te verwachten toxiciteit/ non-relapse mortaliteit (NRM) van een reduced intensity allogene SCT in teschatten kan gebruik worden gemaakt van de geïntegreerde HCT-CI-EBMT score, gevalideerd in AML-CR1.De 2jaars-NRM per risicogroep is:
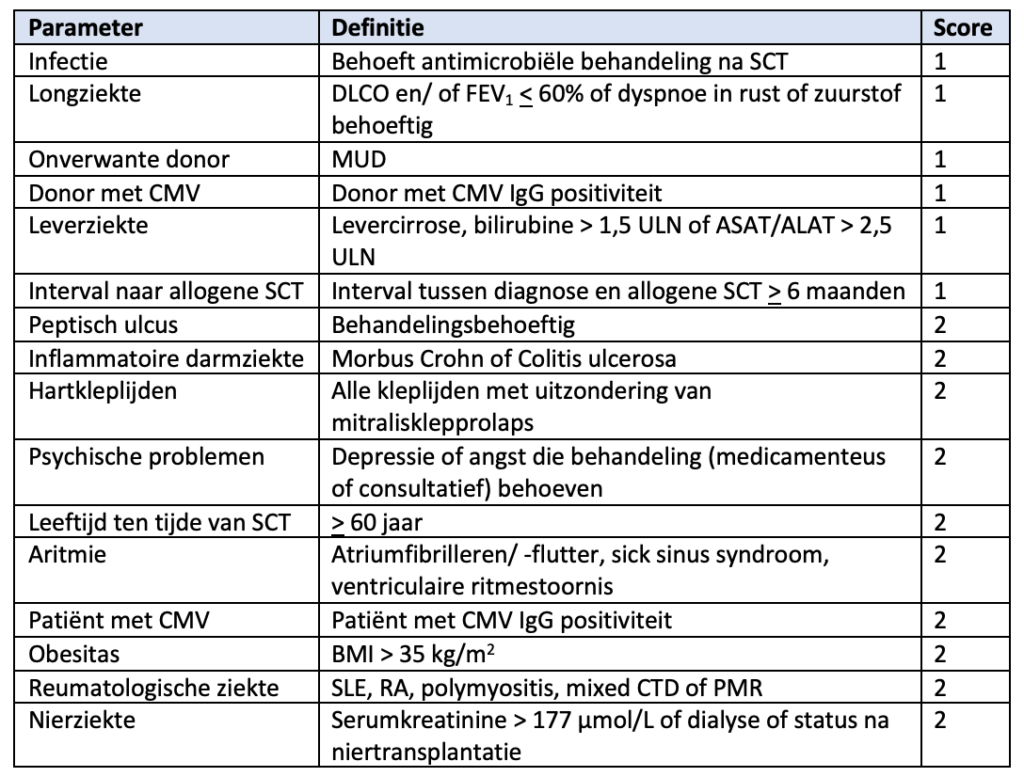
NB: deze score kan ook als leidraad gebruikt worden om te beoordelen of patiënten al dan niet in aanmerking komen voor intensieve behandeling.
Patiënten met een laag risico of een MRD negatief intermediair risico komen in aanmerking voor een consolidatiekuur indien een geplande autologe hematopoiëtische cel transplantatie niet gerealiseerd kan worden, bijvoorbeeld als de stamcelaferese niet lukt. De consolidatiekuur bestaat uit een cyclus mitoxantrone 10 mg/m2 en etoposide 100 mg/m2. Patiënten tot en met 60 jaar krijgen beide middelen gedurende 5 dagen. Patiënten vanaf 61 jaar worden gedurende 3 dagen behandeld. Op indicatie kan de consolidatiekuur gemitigeerd worden.
Alternatief voor een consolitatie met mitoxantrone en etoposide is behandeling met een intermediaire dosis cytarabine (dag 1-3: 2 dd 1500 mg/m2, bij leeftijd > 60 jaar 2 dd 1000 mg/m2; 3 uur infusie). Hiervan worden in principe drie cycli gegeven.
Aanbevelingen
|
Autologe stamcellen worden geoogst met behulp van G-CSF na de 2e inductiekuur. Er wordt gestreefd naar minimaal 2 x 106 CD34+ cellen/kg. |
SORT C
|
|
Het standaard conditioneringsschema voor een autologe hematopoëtische celtransplantatie bestaat uit busulfan in combinatie met cyclofosfamide, waarbij profylaxe tegen epileptische insulten gegeven dient te worden. |
SORT A |
Onderbouwing
Stamcelaferese
Autologe stamcellen worden geoogst na de tweede inductiekuur, mits de patiënt in CR was na de eerstekuur. Stamcelmobilisatie geschiedt met G-CSF (sc, 10 µg/kg verdeeld over twee giften per dag) en wordt afhankelijk van het centrum gestart als het aantal neutrofiele granulocyten is gestegen tot ≥ 0.5×109/L of vanaf dag 20. Plerixafor is gecontra-indiceerd omdat het leukemische stamcellen zou kunnen mobiliseren (bovendien wordt het niet vergoed voor de mobilisatie van stamcellen bij AML).
Een optimale timing van de aferese is van groot belang. Bij een stijging van de neutrofielen naar > 2×109/L en als een significant aantal CD34 positieve cellen in het perifere bloed verschijnt is de kans op een succesvolle aferese het grootst. Er wordt gestreefd naar minimaal 3*106 CD34+ cellen/ kg. Na succesvolle aferese wordt de G-CSF gestaakt.
Indien (bij herhaling van de procedure) niet voldoende stamcellen verkregen kunnen worden, wordt in plaats van een autologe SCT, een 3e chemotherapiekuur met mitoxantrone/ etoposide (consolidatiekuur) of tot 3 cycli intermediaire dosis cytarabine gegeven. (voor schema zie module 4.4.1).
Conditioneringsschema voor autologe hematopoiëtische cel transplantatie
De conditionering voor een autologe hematopoiëtische celtransplantatie bij een patiënt met AML bestaat uit busulfan per os 1 mg/kg (gecorrigeerd ideaal lichaamsgewicht) à 6 uur of busulfan intraveneus 0,8 mg/kg (gecorrigeerd ideaal lichaamsgewicht) à 6 uur (of 3,2 mg/kg in een enkele gift) op dag -7 tot en met -4 voor de stamcelreïnfusie. Cyclofosfamide intraveneus 60 mg/kg op de dagen -3 en -2 voor de stamcelteruggave.
Ter voorkoming van epileptische insulten wordt vanaf 9 dagen voor de SCT tot en met 4 dagen voor de SCT fenytoïne per os 5 mg/kg a 6 uur of diazepam 4 dd 5 mg p.o dag -8 tm -3 gegeven. De stamcelreïnfusie vindt op dag 0 plaats.
Aanbevelingen
|
Er bestaat geen algemeen als optimaal aanvaard conditioneringsschema voor een allogene hematopoëtische celtransplantatie bij een patiënt met AML. Veel verschillende factoren spelen bij de keuze voor een conditioneringsschema een rol (bijvoorbeeld remissie status, leeftijd, lokale ervaring met een bepaalde conditionering en donorkeuze). |
SORT nvt. |
Onderbouwing
Er bestaat geen algemeen aanvaard conditioneringsschema voor een allogene hematopoëtische stamceltransplantatie bij een patiënt met AML.
Voor gedetailleerde strategieën en overwegingen ten aanzien van dit onderwerp wordt verwezen naar de allogene stamceltransplantatiewerkgroep van de HOVON.
In algemene zin kan gesteld worden, dat de conditionering afhankelijk is van vier hoofdfactoren:
Bij een secundaire AML na een myeloproliferatieve ziekte moet rekening gehouden worden met een verhoogd risico op “non-engraftment”.
Bij een Fanconi anemie (en andere predispositiesyndromen ten gevolge van gestoorde DNA-reparatie) dient rekening gehouden te worden met extreme toxiciteit van bepaalde middelen.
De stamcelbron bepaalt eveneens het conditoneringsschema. De afkomst van de stamcellen en de manier van oogsting hebben doorgaans invloed op het conditioneringsschema.
Wat is de behandeling voor refractaire patiënten of patiënten met een (moleculair) recidief AML?
Aanbevelingen
|
De prognose van een patiënt met recidief AML is afhankelijk van de duur van de eerste remissie, de leeftijd ten tijde van het recidief, genetische afwijkingen (karyotype en moleculair) bij diagnose en recidief en het al dan niet hebben ondergaan van een eerdere allogene HCT. |
SORT A |
|
Een tweede allogene hematopoëtische stamceltransplantatie of donor lymfocyteninfusie kan een langdurige overleving geven bij patiënten met een recidief na een eerste allogene HCT. |
SORT A |
|
Er is geen algemeen aanvaarde standaard re-inductie intensieve chemotherapie van primair refractaire AML of recidief AML, wel wordt in vrijwel alle schema’s hoge dosis cytarabine gegeven. |
SORT C |
|
Hypomethylerende middelen (azacitidine en decitabine) zijn een beduidend minder toxisch alternatief dan hoge dosis chemotherapie, met name bij patiënten waarbij het recidief < 6 maanden na intensieve chemotherapie (inclusief allogene of autologe hematopoiëtische stamcel transplantatie) optreedt en/ of bij aanwezigheid van een TP53 mutatie. |
SORT C |
|
Toevoeging van venetoclax aan hypomethylerende middelen (azacitidine en decitabine) bij behandeling van een patiënt met een recidief/ refractaire AML leidt tot een significant hoger CR/CRi percentage en een betere overleving (add-on is aangevraagd). |
SORT B |
|
Ook in de recidiefsetting leidt behandeling gericht tegen een specifieke moleculaire afwijking (al dan niet in combinatie met chemotherapie of hypomethylerende therapie) in sommige gevallen tot betere overleving dan alleen chemotherapie of hypomethylerende therapie. |
SORT A |
|
Het is zinvol om bij een vermeend recidief te zoeken naar mutaties waarvoor gerichte behandeling mogelijk is (bij voorbeeld FLT3 en ), omdat:
|
SORT A |
|
Een patiënt met een recidief/ refractaire AML met een FLT3mutatie heeft met gilteritinib een significant langere OS (dan met standaardtherapie), de remissies zijn diep en de bijwerkingen minder vergeleken met andere therapieën. De werkgroep adviseert bij deze groep patiënten gilteritinib te gebruiken ter overbrugging naar een potentieel curatieve allogene hematopoiëtische cel transplantatie of potentieel curatieve DLI. |
SORT A |
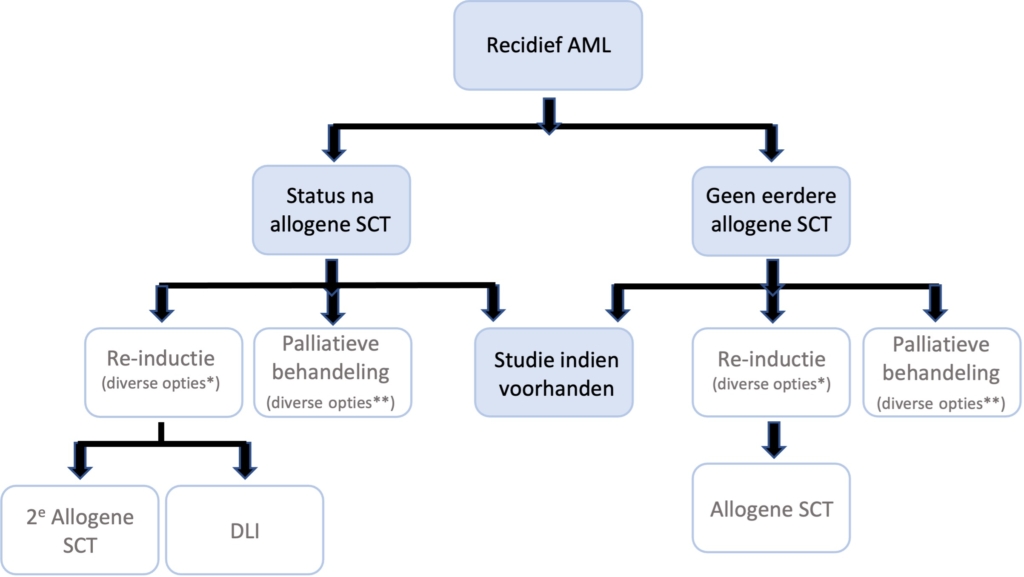
* diverse intensieve re-inductieschemata (zie verderop in deze paragraaf) OF HMA (+ venetoclax indien vergoeding is toegekend; + ivosidenib indien secundaire AML) OF gilteritinib (bij FLT3 mutatie)
**diverse palliatieve behandelingen: zie verderop in deze paragraaf
Onderbouwing
Refractaire AML wordt volgens de ELN 20221 gedefinieerd als het niet bereiken van een CR of CRi of CRh na 2 cycli intensieve inductiebehandelingen of een vooraf gedefinieerd eindpunt (bv 180 dagen bij minder intensieve therapie). Recidief hematologische ziekte wordt volgens ELN 2022 gedefinieerd als > 5% blasten in het BM, de aanwezigheid van circulerende blasten in het perifere bloed (minimaal 2x gemeten) of het ontwikkelen van extra-medullaire ziekte. Er is sprake van een MRD relaps als er na aanvankelijk MRD negativiteit (bij CR, CRi of CRh) weer sprake is van MRD positiviteit (flowcytometrisch of moleculair). Het verlies van MRD negativiteit moet worden bevestigd met een tweede meting.
Bij een recidief AML is het soms moeilijk om een recidief van een “nieuwe” therapie-gerelateerde AML te onderscheiden. Zeker in dit soort gevallen is het wenselijk om uit het volledige therapeutisch arsenaal van nieuw gediagnosticeerde leukemie te kunnen kiezen. Als bij moleculaire analyse nieuwe mutaties in bijvoorbeeld FLT3 en IDH1 worden gevonden wijst dit op progressie van een subkloon met een andere moleculaire opmaak dan de oorspronkelijke leukemie. Feitelijk is dan sprake van een secundaire AML en niet van een recidief en heeft dit therapeutische consequenties.
Voor patiënten met een recidief kan een inschatting worden gemaakt van de prognose op basis van de duur van de eerste remissie, de leeftijd ten tijde van het recidief, genetische afwijkingen (karyotype en moleculair) bij diagnose en relapse en het al dan niet hebben ondergaan van een eerdere allogene SCT2. Op basis van deze 4 factoren (exclusief moleculaire afwijkingen) kunnen 3 risicogroepen worden gedefinieerd.
Formule ter berekening van het risico:
0,016*(leeftijd in jaren) – 0,068*(recidiefvrij interval in maanden) – 0,50*[t(8;21), nee=0, ja=1] – 1,24*[t(16;16) of inv(16), nee=0, ja=1]+0,43*(eerdere SCT, nee=0, ja=1)

De enige in opzet genezende optie is immunologische controle over de ziekte, hetgeen bereikt kan worden met een (tweede) allogene hematopoëtische stamceltransplantatie of donorlymfocyteninfusie (DLI). Het “Center for International Blood and Marrow Transplant Research (CIBMTR)” heeft in een retrospectieve studie 3-jaarsoverlevingspercentages van 4%, 12%, 26% en 38% gevonden bij patiënten met een recidief van respectievelijk 6 maanden, 6-24 maanden, 2-3 jaar of > 3 jaar na een eerdere allogene hematopoëtische celtransplantatie3.
Er zijn verschillende strategieën voor re-inductie van de AML:
Hierbij dient opgemerkt te worden dat ook alleen ondersteunende behandeling zonder ziektemodulerende behandeling een heel goede keus kan zijn gezien de veelal sombere uitkomst. Vanzelfsprekend is de voorkeur van de patiënt belangrijk in het al dan niet kiezen voor (het type) re-inductie. Overwegingen bij de verschillende re-inductie strategieën:
Te overwegen bij:
Er zijn geen algemeen aanvaarde standaard re-inductie chemotherapiekuren voor primair refractaire of recidief AML. Er worden verschillende schema’s gebruikt. De voorkeur gaat uit naar die met intermediaire of hoge doses cytarabine. Hoewel eerder met name gebruik werd gemaakt van cytarabinedoseringen van 3 g/m2, worden de laatste jaren vooral schema’s gebruikt met een iets lagere (maar nog steeds hoge) dosis cytarabine (1-2 g/m2). Deze voorkeur is niet gebaseerd op wetenschappelijk bewijs. Veel gebruikte (door de ELN2022 geadviseerde) kuren1, 4, 5 (o.a. FLAG-IDA, MEC, CLAG-M, hoge of intermediaire dosis cytarabine) zijn weergegeven in module 12.
Voor patiënten met een FLT3 mutatie die fit zijn voor een allogene HSCT wordt bij een recidief of refractaire ziekte gilteritinib geadviseerd6
(zie verderop in deze module 6.3.)
Eerder werden hypomethylerende middelen (azacitidine en decitabine) vooral gegeven bij patiënten met:
De responspercentages (CR/CRi) (met hypomethylerende therapie, met name decitabine gedurende 10 dagen) bij patiënten met refractaire of recidief (R/R) AML liggen rond de 15-25%7, 8. Patiënten die een respons behalen hebben ook een duidelijk overlevingsvoordeel (mediane overleving CR en CRi rond de 15 resp. 25 maanden)8. Toevoeging van venetoclax aan hypomethylerende behandelingen verbetert ook bij patiënten met een R/R AML de responspercentages ten opzichte van monotherapie met hypomethylerende middelen 9.
Diverse meta-analyses bevestigen het gunstige effect van toevoeging van venetoclax aan een HMA in de recidief/ refactaire setting. 10, 11. Recent is een retrospectief cohortonderzoek gepubliceerd waarbij de respons met de combinatie significant beter is (CR/CRi 65.7% versus 23.6%, p < 0.0001) en ook resulteerde in een betere overleving12. Deze gunstige uitkomsten zijn bevestigd in andere cohorten (o.a. van DiNardo13). Een recente “How I treat refractory and relapsed acute myeloid leukemia” adviseert onder andere op basis van bovenstaande gegevens de combinatie HMA + venetoclax, indien een patiënt niet in aanmerking komt voor intensieve therapie of doelgerichte therapie14.
In Nederland wordt de combinatie HMA/ venetoclax in de recidief setting nog niet vergoed. Hiervoor is op basis van bovenstaande een add-on aanvraag ingediend. Indien goedkeuring wordt gegeven is het advies om bij patiënten met een R/R AML venetoclax aan de behandeling met een hypomethyleerder toe te voegen; behalve als er sprake is van een TP53-, of FLT3-mutatie, (zie ook module 4.2.)
Bij een recidief na allogene hematopoiëtische cel transplantatie is het beleid afhankelijk van het tijdstip van het recidief en het mutatiespectrum van het recidief. HMA al dan niet in combinatie met staken van immunosuppressieve therapie en DLI worden geadviseerd15-18:
Vanwege de klonale evolutie is het belangrijk om bij een recidief altijd de moleculaire analyse te herhalen. Zowel de bij diagnose dominante kloon als een aanvankelijke subkloon kunnen het recidief bepalen en mogelijk de keuze voor behandeling (bijvoorbeeld een FLT3-ITD/TKD mutatie kan nieuw ontstaan of kan juist verdwenen zijn).
FLT3 mutatie:
Recidieven bij patiënten met een FLT3 mutatie hebben een slechte prognose. Gilteritinib monotherapie is in een fase 3 studie19, 20 bij patiënten met een recidief/ refractaire AML vergeleken met verschillende intensieve en minder intensieve chemotherapie schemata (MEC, FLAG-IDA, LDAC, azacitidine). Hierbij bleek de mediane overleving voor de gilteritinib arm significant langer (9,3 versus 5,6 maanden) te zijn, bereikte ongeveer een derde van de patiënten die met gilteritinib was behandeld een CR/CRi en was het aantal SAEs graad 3 in de gilteritinib arm lager. Op basis van de data van deze fase 3 studie adviseert de werkgroep gilteritinib te gebruiken bij patiënten met een recidief of refractaire AML met een FLT3 mutatie ter overbrugging naar een potentieel curatieve allogene hematopoiëtische cel transplantatie of potentieel curatieve DLI. Gezien de kosten en het kleine verschil in EFS (2,8 maanden in de gilteritinib arm en 0,7 maanden in de controle arm, vindt de werkgroep het niet opportuun om gilteritinib in de puur palliatieve setting te gebruiken. Gilteritinib lijkt zijn effectiviteit in de recidief/ refractaire populatie te behouden bij patiënten die in de inductie-fase midostaurine hebben ontvangen21.
IDH1 of IDH2 mutatie:
Voor zowel de IDH1 remmer ivosidenib22 als voor de IDH2 remmer enasidenib23 zijn veelbelovende resultaten zijn gerapporteerd bij patiënten met een recidief of refractaire AML met een IDH1/2 mutatie (CR/CRi rond de 20-30%), %) in single arm studies. Een gerandomiseerde studie met enasidenib versus “conventional care regimens” in deze patiëntengroep haalde formeel het primaire eindpunt (overall survival) niet, waarbij mogelijk vroege uitval en beïnvloeding van het eindpunt door vervolgbehandelingen meespeelde24. Er zijn geen gerandomiseerde data voor ivosidenib in deze context. Gezien het gebrek aan overtuigende gerandomiseerde gegevens hebben de betrokken farmaceuten in 2020 de aanvragen voor registratie door de EMA teruggetrokken. Beide middelen zijn dan ook niet beschikbaar voor deze indicatie.
Men dient alert te zijn op “nieuwe” IDH1 mutaties, die wijzen op een nieuwe secundaire AML. Deze patiënten komen in aanmerking voor een behandeling met azacitidine met ivosidenib.
Indien een studie voorhanden is (zie HOVON-site) kan deelname overwogen worden en kan de patiënt zo nodig verwezen worden naar een centrum waar de studie open is.
De kans op een recidief APL binnen 3 jaar na behandeling met ATRA, idarubicine en cytarabine bedraagt 5-10% bij laagrisicopatiënten en 10-20% bij patiënten met een hoog risico. Het recidiefpercentage ligt lager na behandeling met arseentrioxide (ATO) en ATRA. Re-inductietherapie middels ATO en ATRA leidt tot een remissie bij 85-90% van de patiënten (die eerder met ATRA en chemotherapie zijn behandeld)25. Bij een recidief na ATO/ ATRA wordt im principe gereinduceerd met ATRA en chemotherapie. Er wordt in het algemeen verondersteld dat aansluitend aan een tweede complete remissie (CR2) nog een aanvullende behandeling noodzakelijk is. Het type van deze consolidatiebehandeling wordt bepaald door de remissiestatus na re-inductie. Bij een negatieve kwantitatieve PCR voor t(15;17) (PML::RARA) is een autologe stamceltransplantatie na conditionering met busulfan en cyclofosfamide de eerste keuze. Bij een persisterend positieve PCR na inductiebehandeling heeft een allogene stamceltransplantatie de voorkeur bij een daarvoor geschikte patiënt. Patiënten met een recidief APL hebben een grotere kans (5-10%) op CNS-betrokkenheid. Daarom wordt geadviseerd om na normalisatie van de stollingsstatus en de leukocytendifferentiatie, afhankelijk van aantoonbare liquorbetrokkenheid, profylactisch of therapeutisch cytarabine intrathecaal toe te dienen (volgens standaardschema).
Hoe en wanneer wordt de respons van een behandeling vastgesteld?
Aanbevelingen
|
Responsbeoordeling vindt plaats volgens de laatste ELN-criteria. |
SORT nvt. ELN-richtlijn |
|
Het gebruik van MRD-bepalingen wordt geadviseerd volgens het ELN-consensusdocument. |
SORT nvt. ELN-richtlijn |
Onderbouwing
De responsbeoordeling na een behandeling vindt plaats volgens de meest recente ELN-criteria1.
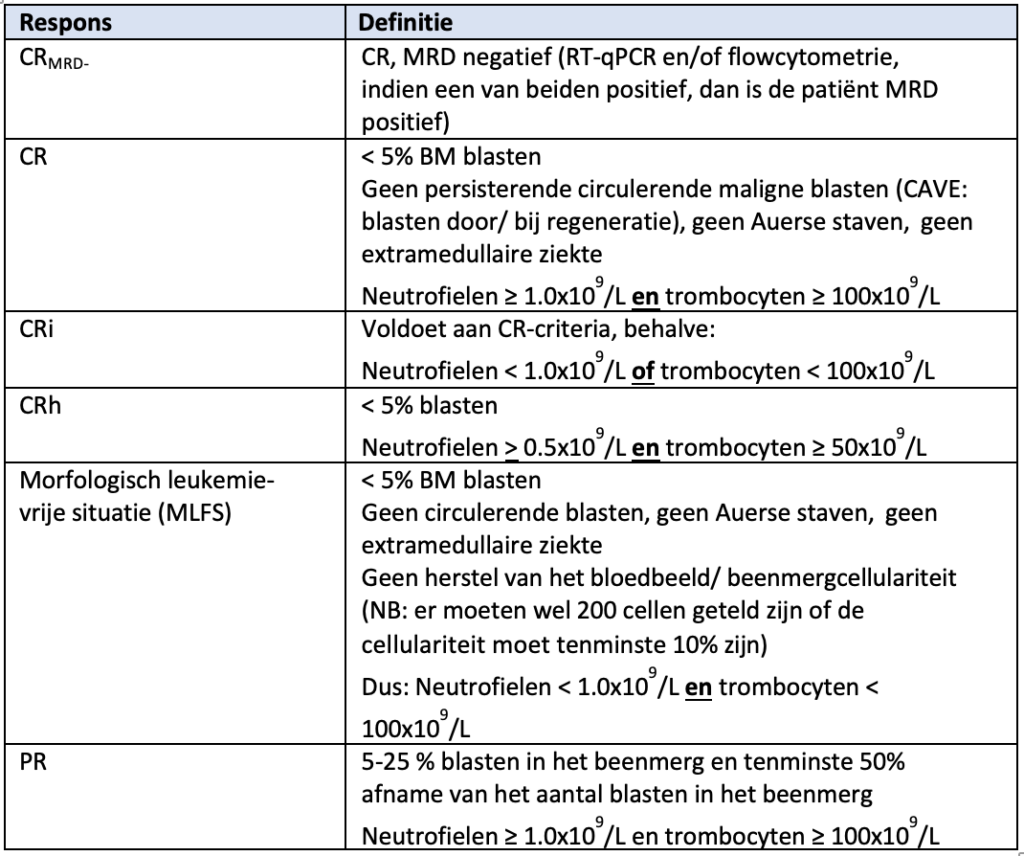
Van oudsher is de primaire responsbeoordeling gebaseerd op de cytomorfologische beoordeling van het beenmergaspiraat. Aangezien een nieuw gediagnosticeerde AML ongeveer 1012 AML blasten bevat, geeft een cytomorfologische beoordeling van het percentage blasten in het beenmerg (< 5%; 2 log10) een zeer bescheiden oordeel over de feitelijke respons op behandeling.
Door nieuwe technieken is het mogelijk om “dieper” te kijken en hiermee een nauwkeurigere, geïndividualiseerde voorspelling van de prognose (recidief vrije ziektetijd en/ of overleving) te geven. Meetbare restziekte (MRD) kan de aanwezigheid van leukemiecellen tot een diepte van 1 op 104-106 leukocyten detecteren. Er zijn meerdere redenen om MRD-metingen bij AML-patiënten te verrichten:
Hoewel ontwikkelingen snel gaan en er nieuwe technieken worden toegepast (zoals “digital droplet” PCR en “next-generation sequencing” (NGS)) voor de bepaling van MRD, zijn voor de klinische praktijk op dit moment twee methoden belangrijk voor het meten van MRD:
De ELN heeft in 20212 een uitgebreid advies ten aanzien van MRD-bepalingen uitgebracht voor flowcytometrie, moleculaire biologie en de klinische toepassing:
Flowcytometrie:
Moleculair biologisch:
Gemuteerde NPM1 MRD
De belangrijkste aanbevelingen volgens de ELN2021 ten aanzien van MRD zijn:
NPM1
NB: De ELN2021 MRD-aanbevelingen worden momenteel herschreven, met hierin nieuwe aanbevelingen m.b.t. mutant NPM1/ ABL1 MRD.
FLT3-ITD MRD
PML/RARA
Literatuurverantwoording
Aanbevelingen
|
Patiënten met hyperleukocytose hebben een slechtere korte- en langetermijnoverleving. |
SORT A |
|
Bij hyperleukocytose dienen leukostase en DIC direct behandeld te worden met cytoreductieve therapie met aandacht voor tumorlyse. |
SORT A |
Onderbouwing
Er wordt van hyperleukocytose gesproken als het aantal leukocyten > 100×109/L is. Ongeveer 5-20% van de AML-patiënten presenteert zich met hyperleukocytose.
De belangrijkste klinische manifestaties van hyperleukocytose zijn:
Hyperleukocytose geeft op de korte termijn een verhoogd overlijdensrisico (8% in eerste 24 uur, 20% in eerste week) door complicaties en op de lange termijn is het risico op recidief en sterfte (kortere overleving) toegenomen.
Leukostase is een bedreigende aandoening en veroorzaakt met name symptomen betreffende het centraal zenuwstelsel (25-35%), de ogen (5-15%) en de longen (ca. 40%), maar in theorie kunnen alle organengevolgen ondervinden van leukostase. Leukostase kan ook optreden bij leukocyten < 100×109/L, met namebij grote blastaire cellen zoals bijvoorbeeld bij een (myelo-) monocytaire AML.
Fundoscopie is het belangrijkste onderzoek om leukostase aan te tonen (bijvoorbeeld papiloedeem,gedilateerde vaten en retinabloedingen). Laboratoriumfenomenen die kunnen optreden bij hyperleukocytose zijn pseudohypoxemie (“leukocyte larceny syndrome” = consumptie van O2 in vitro) en pseudohyperkaliemie (door spontane tumorlyse in de afnamebuis).
De behandeling van hyperleukocytose bestaat uit behandeling van leukostase, DIC en tumorlyse (zie module 8.4).
Zowel asymptomatische als symptomatische hyperleukocytose behoeft directe behandeling met intensieve chemotherapie of hydroxycarbamide (bijvoorbeeld 3 dd 2 gram) teneinde snelle cytoreductie te bewerkstelligen. Meestal kan met hoge dosis hydroxycarbamide de tijd voor moleculaire screening ten behoeve van studiedeelname veilig overbrugd worden. Bij klachten passend bij hyperleukocytose wordt bij voorkeur gestart met de reguliere inductiebehandeling.
Bij een (vermoeden op) APL wordt altijd (onafhankelijk van het aantal leukocyten) meteen met ATRA gestart.
Overige aandachtspunten en of behandelmogelijkheden bij hyperleukocytose:
Literatuurverantwoording
Aanbevelingen
|
Geadviseerd wordt om bij focale neurologische klachten, extramedullaire ziekte, leukocytose (> 40 x 109/L) en blastaire dendritische cel neoplasie een diagnostische LP (met achterlaten van MTX of cytarabine) te verrichten (indien de blasten uit het perifere bloed geklaard zijn). |
SORT nvt ELN-richtlijn |
Onderbouwing
Het percentage patiënten met CZS-betrokkenheid bij AML is relatief laag (ca. 1-5%). Het risico op CZS-betrokkenheid is hoger bij focale neurologische klachten (zoals bijvoorbeeld nervus mentalis uitval: ‘numbchin’) of bij risicofactoren voor CZS-betrokkenheid, zoals bij extramedullaire ziekte (chloroom/ myeloïdsarcoom), hyperleukocytose, blastaire dendritische cel neoplasie.
Daarom adviseert de werkgroep een diagnostische liquorpunctie (morfologie en flowcytometrie) bij:
NB: bij neurologische symptomatologie wordt de lumbaalpunctie direct verricht. In alle andere gevallen wordt gewacht tot na klaring van blasten uit het perifere bloed.
Het ontstaan van een intracerebrale bloeding (ten tijde van circulerende blasten) wordt beschouwd als een CZS-lokalisatie.
Bij een APL kan intrathecale behandeling overwogen worden indien initieel sprake was van een intracerebrale bloeding. Bij een recidief is de kans op CZS-betrokkenheid tussen de 5-10%. Men dient zich te realiseren dat ATO in de liquor slechts een spiegel van 15% van de bloedspiegel bereikt. Door ATO te combineren met mannitol-infusies kan de CZS-penetrantie van ATO sterk worden verbeterd.
Bij de eerste LP wordt liquor afgenomen voor diagnostiek (cytomorfologie en flowcytometrie) en wordt cytarabine achtergelaten.
Bij aanwijzingen voor liquorbetrokkenheid dient naast de systemische behandeling intrathecale behandelingen gegeven te worden met cytarabine (100 mg) of MTX 15 mg aangevuld met steroïden (prednisolon 20 mg). Bij refractaire CZS-betrokkenheid kan het alternatieve cytostaticum gegeven worden.
Het schema hiervoor is als volgt:
Literatuurverantwoording
Aanbevelingen
|
Het APL-differentiatie syndroom (door ATRA en/of ATO) is een potentieel fatale complicatie waarvoor profylaxe met prednisolon (0,5 mg/kg tot tenminste dag 21) of dexamethason (2 dd 5 mg tot tenminste dag 15) gegeven dient te worden. Bij verdenking op het APL-differentiatie syndroom dient direct met dexamethason 2 dd 10 mg gestart te worden. |
SORT A |
|
De diagnose differentiatiesyndroom wordt “per exclusionem” gesteld en is een potentieel fatale complicatie. Het kan ook optreden bij behandeling met IDH-en FLT3-remmers. De behandeling bestaat uit het starten van steroïden en bij onvoldoende respons eventueel staken van de specifieke remmer. Overige maatregelen zijn afhankelijk van de presentatie en zijn gericht op het uitsluiten en behandelen van mogelijk onderliggende alternatieve oorzaken (zoals infecties). |
SORT A |
Onderbouwing
8.3.1: Differentiatiesyndroom bij APL (A-DS)
Het A-DS is een potentieel fatale complicatie van de inductiebehandeling (of in zeldzame gevallen ook later) van een APL, die bij ca. 25% van de patiënten in meer of mindere mate ontstaat door het massaal uitrijpen van blasten en promyelocyten met een snelle stijging van (grote) leukocyten in de bloedbaan.
Het A-DS wordt als ernstig beschouwd indien > 4 van de volgende kenmerken aanwezig is:
Patiënten met 2 of 3 van deze kenmerken worden geclassificeerd als matig ernstige A-DS.
Ter voorkoming van het A-DS wordt bij een leukocytenaantal van >5×109/L dexamethason (2 dd 5 mg; dag 1-15) of alternatief prednisolon (0.5 mg/kg gedurende 3 weken) gegeven. Ook wordt bij een leukocytose > 10×109/L hydroxycarbamide toegevoegd (zie module 4.1.6). Mocht desondanks een A-DS optreden, dan dient (onafhankelijk van de ernst) direct gestart te worden met dexamethason 2 dd 10 mg. In principe wordt de ATRA en/of ATO gecontinueerd, tenzij een intensive-care opname noodzakelijk is of als de patiënt al twee weken is behandeld met ATRA en/of ATO. Bij herstel van klachten kunnen de steroïden worden gestaakt en kan de ATRA/ATO, indien aan de orde, weer worden hervat (start met 50% dosisreductie, in een week op te bouwen tot de 100%-dosering).
8.3.2: FLT3-remmer geïnduceerd differentiatiesyndroom
Bij ca. 3.5% van de patiënten die met een FLT3 remmer als monotherapie behandeld worden wordt een differentiatiesyndroom (FLT3-DS) gezien. Het FLT3-DS kan direct en tot ca. 90 dagen na het starten optreden. De symptomen zijn aspecifiek en de diagnose FLT3-DS wordt per exclusionem gesteld.
Mogelijke symptomen zijn:
Bij het vermoeden op het FLT3-DS is het advies de patiënt hemodynamisch te bewaken en steroïden te geven (bijvoorbeeld dexamethason i.v. 2 dd 10 mg tot aan het verbeteren van de klachten, minimaal 3 dagen, zo nodig afbouwen). Als sprake is van ernstige tekenen/ symptomen die aanhouden na 48 uur behandeling met steroïden dient de FLT3 remmer onderbroken te worden. De FLT3 remmer kan (in dezelfde dosering) hervat worden indien de symptomen zijn afgenomen tot CTCAE < graad 2.
8.3.3: IDH-remmer geïnduceerd differentiatiesyndroom
Bij ca. 10-20% van de patiënten die met IDH-remmers behandeld worden wordt het IDH-remmer geïnduceerde differentiatiesyndroom (IDH-DS) beschreven. In combinatie met intensieve chemotherapie treedt het IDH-DS nauwelijks op. In tegenstelling tot andere differentiatiesyndromen wordt dit syndroom gemiddeld na 20-30 dagen gerapporteerd, maar de spreiding is groot (10 dagen tot 5 maanden). De mortaliteit bedraagt ca. 5-6%.
Symptomen passend bij het IDH-DS zijn niet specifiek en dus moeten andere mogelijk onderliggende oorzaken minder waarschijnlijk worden gemaakt. Symptomen die kunnen passen bij het IDH-DS zijn:
In het laboratoriumonderzoek kunnen verhoogde neutrofielen en of trombocyten worden gezien en ook in het beenmerg zijn rijpe leukocyten zichtbaar. Ook stollingsstoornissen zijn waargenomen.
Bij het vermoeden op het IDH-DS is het advies steroïden te geven (bijvoorbeeld dexamethason 2 dd 10 mg tot aan het verbeteren van de klachten, minimaal 3 dagen), een eventuele leukocytose met hydroxycarbamide (en zo nodig leukaferese) te onderdrukken en indien geïndiceerd furosemide te geven. Als sprake is van ernstige pulmonale en/ of renale problemen die aanhouden na 48 uur behandeling met steroïden dient ook de IDH-remmer onderbroken te worden. Gezien de lange halfwaardetijd van de IDH-remmers enasidenib en ivosidenib is onderbreken van behandeling met de remmer nooit een vervanging voor gebruik van steroïden.
Literatuurverantwoording
Clin. Cancer Res. 2020, 26
Aanbevelingen
|
Het risico op tumorlyse wordt bepaald door de mate van leukocytose, de nierfunctie (kreatinine > 124 μmol/l), het uitgangsurinezuurgehalte (> 450 μmol/l), LDH (> 4x ULN) en de cytotoxiciteit van de behandeling. |
SORT A |
|
Tumorlyse dient gemonitord te worden en op basis van het risico met hyperhydratie, allopurinol en/ of rasburicase voorkomen dan wel behandeld te worden. |
SORT A |
Onderbouwing
Tumorlyse kan op basis van laboratoriumuitslagen en klinische symptomen beoordeeld worden. Het gaat om metabole afwijkingen, die ontstaan door snelle en massale lyse van maligne cellen en daardoor vrijkomen van intracellulaire bestanddelen in de bloedbaan, wat vervolgens tot symptomen kan leiden.
Definitie volgens Cairo-Bishop

Klinische tekenen van tumorlyse ontstaat meestal 12-72 uur na oncolytische therapie, indien er sprake is van een grote tumormassa en wordt gekarakteriseerd door biochemische tumorlyse met tekenen van nierfalen, cardiale aritmie en insulten.
Symptomen zijn: misselijkheid, braken, diarree, anorexie, lethargie, oedeem, decompensatio cordis, hartkloppingen, syncope, hematurie, insulten, spierkrampen, tetanie, plotselinge dood.
Gradering van klinische tumorlyse volgens Cairo-Bishop
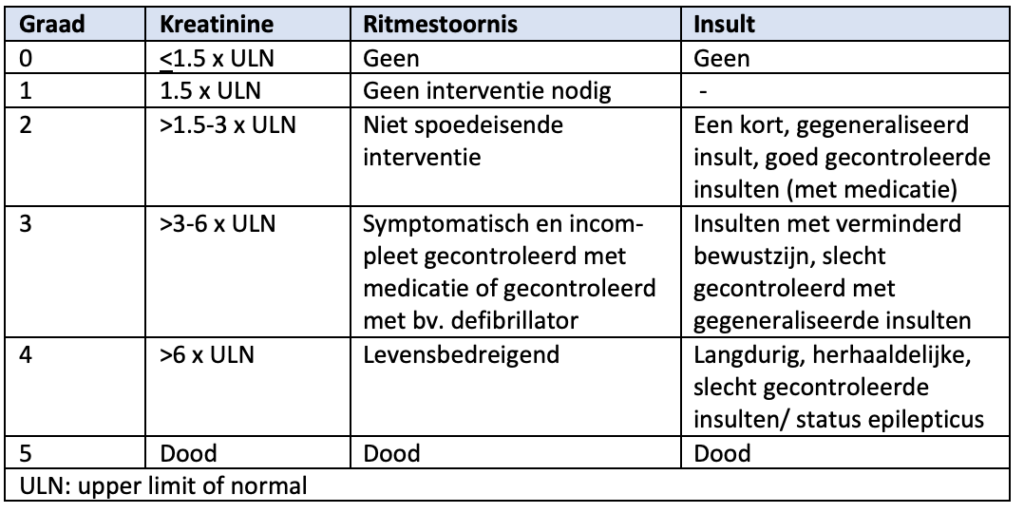
Risico-evaluatie
Het risico op tumorlyse bij AML wordt met name bepaald door de hoogte van de leukocytose. Overige parameters van belang bij het ontstaan zijn: de nierfunctie (kreatinine > 124 μmol/l), het uitgangsurinezuurgehalte (> 450 μmol/l), LDH (> 4xULN) en de cytotoxiciteit van de behandeling.
Risico-stratificatie volgens Coiffier met betrekking tot AML
Diagnostiek
Bij alle patiënten bij waarbij tumorlyse zou kunnen optreden dienen de volgende parameters bepaald te worden: kreatinine, urinezuur, kalium, calcium, fosfaat en LDH
Tijdstippen van bepaling:
Preventie en Behandeling
a. Hyperhydratie
Hyperhydratie wordt geadviseerd bij intermediair en hoog risico op tumorlyse en vindt doorgaans plaats met NaCl 0,9%, 500 ml à 4 uur (dus 3 liter per 24 uur). Bij neiging tot decompensatio cordis of gewichtstoename wordt een lisdiureticum (bijvoorbeeld furosemide) toegevoegd. De streefdiurese ligt boven de 100 ml/uur. Het is aan te raden het gewicht dagelijks te meten.
b. Allopurinol
Allopurinol is een xanthine-analoog en inhibeert het enzym xanthine-oxidase en voorkomt daarmee vorming van urinezuur. Dit middel wordt als standaardtherapie bij laag- en intermediair-(tumorlyse)risico patiënten gebruikt, tenzij er reeds spontane tumorlyse optreedt, er een relatieve contra-indicatie voor allopurinol bestaat of allopurinol onvoldoende effect sorteert. Het middel wordt bij voorkeur 48-24 uur voor cytoreductieve therapie gestart. De standaarddosering is 1 dd 300 mg per os, bij een nierinsufficiëntie met een klaring < 30 ml/min wordt dit verlaagd naar 1 dd 100 mg. Er kunnen interacties optreden bij gebruik samen met thiazidediuretica, ciclosporine, 6-MP, azathioprine, cyclofosfamide en andere cytostatica (groter risico op myelosuppressie) en amoxicilline (groter risico op rash).
c. Rasburicase
Rasburicase is een recombinant uraatoxidase en versnelt (katalyseert) de omzetting van urinezuur naar het zeer goed oplosbare allantoine. Dit middel is standaardtherapie bij hoog risicopatiënten en patiënten met een intermediair risico met tekenen van spontane tumorlyse en onvoldoende respons op allopurinol.
Het middel wordt vlak voor start van de cytoreductieve therapie gegeven in een dosering van 3 mg intraveneus, te herhalen bij persisterend hoog urinezuur (> 476 μmol/L). Dosisaanpassingen zijn niet nodig. Het middel is gecontra-indiceerd bij G-6-PD-deficiëntie, zwangerschap en lactatie. Rasburicase werkt door na bloedafname, derhalve dient het bloedmonster na rasburicase op ijs vervoerd en snel bepaald te worden anders kan het urinezuur vals-verlaagd zijn.
d. Ondersteunende maatregelen
Mogelijke ondersteunende maatregelen zijn gericht op correctie van ontstaande bloedafwijkingen:
Literatuurverantwoording
Aanbevelingen
|
De incidentie van neurotoxiciteit door cytarabine neemt toe met de leeftijd en de cumulatieve dosering en wordt mede bepaald door de nier- en leverfuncties en bijkomende middelen. |
SORT B |
|
Bij verdenking op neurotoxiciteit door cytarabine dient dit middel direct gestaakt te worden. |
SORT C |
Onderbouwing
Neurologische toxiciteit van cytarabine wordt bij hoge dosering gerapporteerd tot een incidentie van 14%, afhankelijk van de leeftijd, (cumulatieve) dosering, combinatiebehandeling, nier- en leverfuncties en het bijkomende gebruik andere neurotrope middelen (zoals anti-emetica). De in het CZS behaalde spiegels bedragen 20-50% van plasmaspiegels met een bifasische klaring (initiële halfwaardetijd 1 uur, terminale halfwaardetijd 3,4 uur). Er kan sprake zijn van snel optredende toxiciteit met name bij intrathecale toediening waarbij myelopathie en insulten gezien kunnen worden. Bij intraveneuze toediening wordt perifere neuropathie, gegeneraliseerde encefalopathie (somnolentie, verwardheid, geheugenverlies, psychose, insulten) en (acute) cerebellaire toxiciteit met ataxie, nystagmus en dysarthrie gezien. Tekenen vancerebellaire dysfunctie treden vooral tussen dag 3 en 8 na start van de behandeling op en verdwijnenmeestal in 3 tot 10 dagen (tot 30% houdt restverschijnselen of komt te overlijden).
Bij elke verdenking op neurotoxiciteit (regelmatig beginnend met nystagmus en of ataxie) moet cytarabineonmiddellijk worden gestopt. Gegevens over het herstarten van hoge dosis (d.w.z. > 2000 mg/m2)cytarabine zijn schaars. In de praktijk wordt cytarabine niet in hoge dosering hervat bij eerdere neurologische toxiciteit.
Bij nier- en leverfunctiestoornissen wordt bij hoge dosis cytarabine de dosering aangepast conform de “bccancer cancer drug manual”-adviezen (http://www.bccancer.bc.ca/health-professionals/clinical-resources/cancer-drug-manual button “Go to the Drug Index” en dan de monograph van het desbetreffende middel).
Literatuurverantwoording
Aanbevelingen
|
In zeldzame gevallen wordt bij het gebruik van hypomethylerende therapie en cytarabine een pneumonitis gezien. Direct staken van de behandeling en hoge dosis steroïden worden geadviseerd. |
SORT C |
Onderbouwing
Bij cytarabine en hypomethylerende therapie (zowel azacitidine als decitabine) wordt in zeer zeldzame gevallen (< 0.1%) een pneumonitisbeeld beschreven. Patiënten presenteren zich doorgaans met klachten van koorts, hoesten en kortademigheid. Omdat deze klachten aspecifiek zijn en vaker bepaald worden door infecties of andere onderliggende problemen, betreft het een diagnose per exclusionem. Het advies is het middel direct te staken en hoge dosis steroïden te geven omdat de mortaliteit ca. 20% bedraagt.
Literatuurverantwoording
Wat is familiaire predispositie, hoe wordt dit gediagnosticeerd en wat zijn de consequenties?
Aanbevelingen
|
Onderzoek naar genetische predispositie voor het ontwikkelen van AML wordt aangeraden bij een verdachte (familie)anamnese, specifieke klinische bevindingen bij lichamelijk onderzoek en/of bij een mutatie met een VAF > 40% in specifieke genen (zoals DDX41, CEBPA, GATA2 of RUNX1). |
SORT A |
Onderbouwing
Bij een deel van de AML-patiënten (schatting 5-10%) is sprake van een aangeboren aanleg voor het ontwikkelen van myeloïde maligniteiten. De onderliggende ‘germline’-mutaties kunnen overgeërfd zijn of ‘de novo’ ontstaan. De onderliggende mutaties leiden soms tot pre-leukemische syndromen (waaronder predispositie voor andere vormen van kanker), maar dit is niet altijd het geval. Het is van belang de aanwezigheid van germline-mutaties te identificeren omdat het belangrijke consequenties kan hebben voor de behandeling van de patiënt (indicatie en geschiktheid voor een allogene SCT; donorkeuze; conditionering) maar ook genetische counseling en surveillance. Dit belang is onderstreept door vastlegging van ‘myeloid neoplasms with germ line predisposition’ in de WHO-classificatie 2022 en in de ELN2022-richtlijnen (zie ook module 1).
Screening voor germline-predispositie bij een patiënt met AML dient (bij diagnose) ingezet te worden indien sprake is van een verdachte familieanamnese of bij lichamelijk onderzoek specifieke bevindingen worden gedaan (zoals beschreven in onderstaande tabel). Ook indien bij moleculair onderzoek een RUNX1, DDX41, GATA2, of een CEBPA-mutatie gevonden wordt met een VAF > 40% dient germline-aanwezigheid van de mutatie uitgesloten te worden. In het geval van een TP53 mutatie met een VAF > 40%, in combinatie met een familie-anamnese gekenmerkt door frequente tumoren op jongere leeftijd (< 50 jaar) is dit ook het geval. De frequentie van germline-mutaties bij een RUNX1 mutatie lijkt rond de 10% te liggen (de beschreven incidentie kent een grote spreiding, tot 30%, waarschijnlijk door bias, cohort verschillen, verschil in technieken en variabiliteit in het duiden van pathogeniciteit van varianten).
Diagnostiek vindt op indicatie plaats middels (panel-based of ‘whole exome’) sequencing van (kandidaat) predispositie genen (bijvoorbeeld via https://hema13.erasmusmc.nl/info/ToelichtingUitslagWebsiteMD_PDP.pdf). Voor het inzetten van de screening dient de patiënt geïnformeerd te worden over het doel en de mogelijke consequenties van de screening. Gekweekte huidfibroblasten zijn de gouden standaard als het gaat om het diagnostisch materiaal, maar speeksel, beenmerg in remissie na kuur 1 of ongekweekte huidbiopten kunnen ook zeer informatief zijn (met name ter uitsluiting van germline-betrokkenheid). Uitkomsten van genetische testen dienen bij voorkeur interdisciplinair besproken en geïnterpreteerd te worden. In het uitkomstgesprek met de patiënt is aandacht voor de betekenis van de test, de consequenties voor de behandeling alsmede eventuele aanbevelingen voor screening naar maligniteiten en surveillance. Voor informatie over erfelijkheid en de eventuele screening van familieleden wordt patiënt verwezen naar de afdeling Klinische Genetica – dit kan zeer belastend zijn voor patiënt en familie.
Bevindingen, die op een germline-mutatie zouden kunnen wijzen:
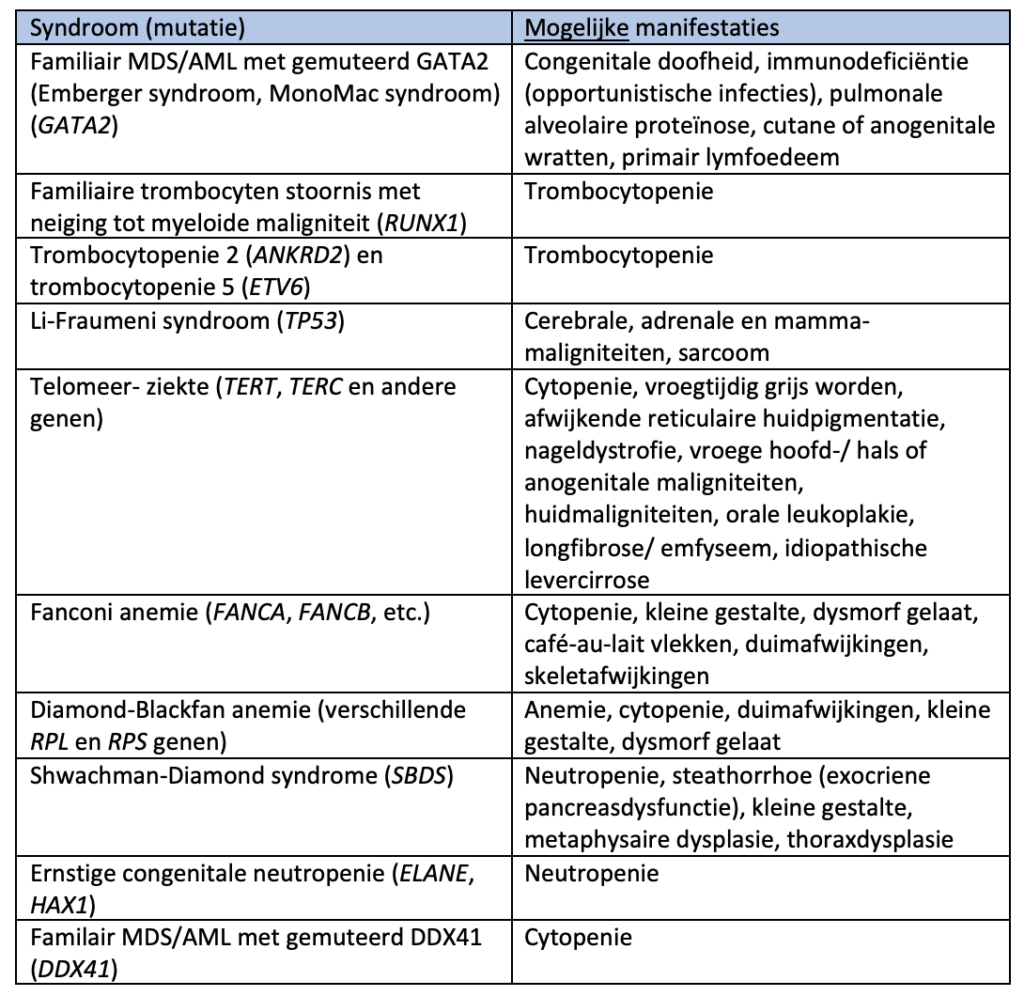
Literatuurverantwoording
Aanbevelingen
|
Door het gebruik van infectieprofylaxe (antibiotisch en antifungaal) is de overleving van patiënten met AML die intensief behandeld worden significant verbeterd. |
SORT A |
|
Ten aanzien van trombocytentransfusies en erytrocytentransfusies wordt het landelijke transfusiebeleid gevolgd. |
SORT A |
|
G-CSF als toevoeging aan de behandeling van AML met intensieve chemotherapie wordt niet standaard geadviseerd omdat het geen overlevingsvoordeel oplevert en niet kosteneffectief is gebleken. |
SORT A |
|
G-CSF verkort de neutropenieduur bij de behandeling met azacitidine/ decitabine in combinatie met venetoclax. En kan na klaring van blasten worden toegevoegd om langdurige neutropenie te voorkomen. |
SORT A |
De overleving van patiënten met een AML is in de afgelopen decennia, mede dank zij een verbetering van de ondersteunende behandeling, sterk verbeterd. Met name profylactische anti-infectieuze behandeling speelt hierbij een belangrijke rol.
Handige algemene adviezen voor optimale ondersteunende behandeling:
Het gebruik van groeifactoren (zoals G-CSF) verkort de neutropenieduur en ziekenhuisopname, maar vertaalt zich niet in een overlevingsvoordeel en is niet kosteneffectief gebleken in de context van intensieve chemotherapie. Derhalve wordt standaardgebruik niet geadviseerd, maar kan het gebruik in specifieke situaties (bijvoorbeeld wanneer in studieverband myelosuppressieve middelen gecombineerd worden met standaard inductiebehandeling) gerechtvaardigd worden. Ook in de context van behandeling met hypomethylerende therapie in combinatie met venetoclax kan bij klaring van beenmerg blasten en langdurige neutropenie G-CSF worden overwogen.
Literatuurverantwoording
Aanbevelingen
| AML veroorzaakt een grote psychosociale belasting voor de patiënt en naasten. | SORT A |
| Gestructureerde, professionele begeleiding van patiënt en naasten wordt met klem geadviseerd. | SORT C |
Onderbouwing
De diagnose AML, de behandeling en de periode daarna kunnen gepaard gaan met milde tot ernstigepsychosociale problematiek. In studies aangaande psychosociale belasting van AML wordt gerapporteerd dat veel patiënten angst en/ of depressie ervaren.
Basale psychosociale zorg dient derhalve onderdeel te zijn van de behandeling. In overeenstemming met deRichtlijn “Detecteren behoefte psychosociale zorg” vindt de werkgroep dat basale psychosociale zorg devolgende aspecten omvat:
Overwogen moet worden op verschillende meetmomenten (bijvoorbeeld bij diagnose, eens per 3 maanden gedurende behandeling, na voltooiing van de behandeling, bij constatering van een recidief, bij besluit tot palliatieve behandeling) ter detectie van behoefte aan psychosociale zorg de Lastmeter in te zetten. Metenbetekent ook bespreken van het ingevulde meetinstrument.
Literatuurverantwoording
Hoe dient de zorg voor patiënten met een AML georganiseerd te zijn?
Aanbevelingen
|
De noodzakelijke diagnostiek en de mogelijke behandeling voor patiënten met AML wordt steeds complexer. |
SORT A |
|
Behandelingsuitkomsten zijn afhankelijk van de expertise van het team. Dit wordt medebepaald door ervaringsuren (op het specifieke gebied) en het aantal behandelde patiënten (met een ziekte/ bepaalde behandeling). |
SORT A |
|
De leukemiewerkgroep is van mening dat alle patiënten met een AML voor start van de behandeling met een consulterend centrum besproken moeten worden om tot een wel overwogen therapieplan te komen. Regioafspraken zijn leidend voor “waar wat kan”. |
SORT C |
Onderbouwing
De ontwikkelingen rondom AML-diagnostiek brengen de laatste jaren een zeer snel toenemende complexiteit met zich mee. Derhalve is voor snelle, kwalitatief hoogwaardige diagnostiek centralisatie (in de regio) nodig.
Ten aanzien van de behandeling van patiënten met een AML zijn in het echeloneringsdocument van de Nederlandse Vereniging voor Hematologie basisvoorwaarden voor centra gedefinieerd die patiënten met een AML mogen behandelen.
De behandeling wordt door het toenemende aantal doelgerichte behandelingen en keuzemogelijkheden steeds ingewikkelder en vraagt om ervaren, genuanceerde toepassing van de bestaande mogelijkheden. Door de diversiteit aan therapeutische mogelijkheden wordt het aantal patiënten dat met eenzelfde soort therapie behandeld wordt steeds kleiner, wat het voldoende opbouwen van expertise bij kleinere aantallen ingewikkeld maakt.
Derhalve is onder andere het hoofdstuk “Veilige introductie van nieuwe geneesmiddelen in Nederland en de regio” voor de behandeling van patiënten met een AML van toepassing.
De werkgroep echelonering is van mening dat hierbij 2 zaken van belang zijn.
Onder het hoofdstukje intensieve en complexe hematologische zorg (van het echeloneringsdocument) staat onder andere vermeld, dat om deze zorg te kunnen leveren minimaal 3 hematologen in het betreffende centrum werkzaam moeten zijn en er 24/7 een internist-hematoloog beschikbaar moet zijn (eventueel met tussenkomst van een dienstdoende internist-oncoloog) om kwalitatief goede zorg te leveren voor patiënten met complexe ziektebeelden die intensief behandeld worden. De werkgroep stelde vast dat een exacte volumegrens niet hard te onderbouwen is maar dat
In de tabel op het einde van het echeloneringsdocument worden alle randvoorwaarden voor de verschillende ziekenhuis-echelons aangegeven.
De HOVON-leukemiewerkgroep conformeert zich aan de voorstellen van dit document en plaatst hierbij volgende expliciterende kanttekeningen:
Het verrichten van autologe en allogene stamceltransplantaties is vergunningsplichtige zorg. De vergunningen zijn verleend door het ministerie van VWS en gebaseerd op de criteria van de gezondheidsraad (‘Haematopoietic stem cells’; Health Council, 10-09-2003). De inspectie geschiedt via de JACIE-accreditatie-organisatie.
Literatuurverantwoording
Basischema
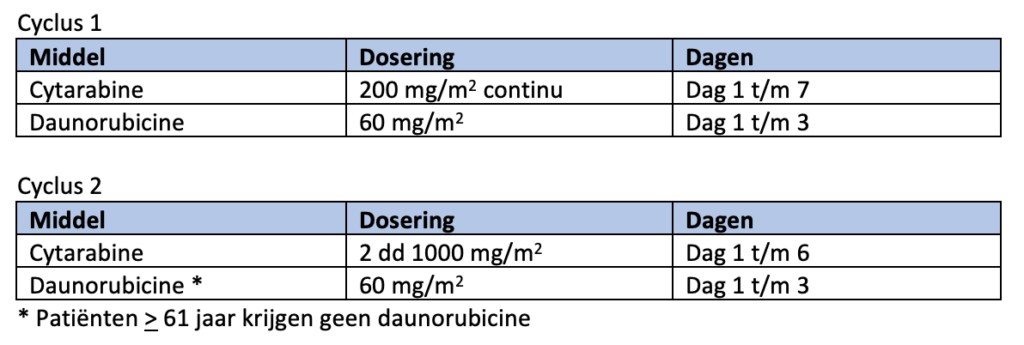
NB: bij aanwezigheid van FLT3 mutatie (zie uitleg in module 4.1):
Gemtuzumab ozogamicine gecombineerd met intensieve chemotherapie

Consolidatie intensieve therapie

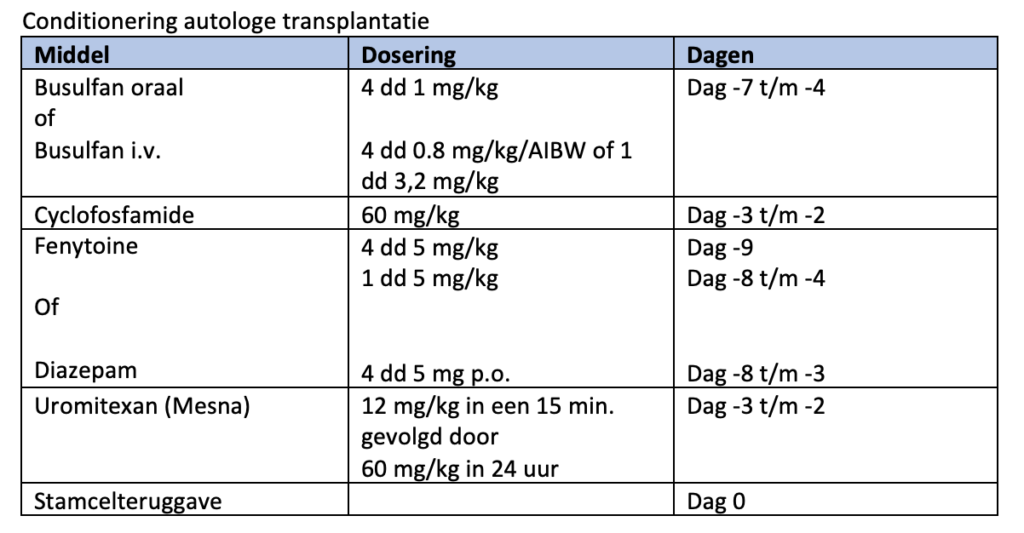
Onderhoudsbehandeling na intensieve therapie

HMA + venetoclax
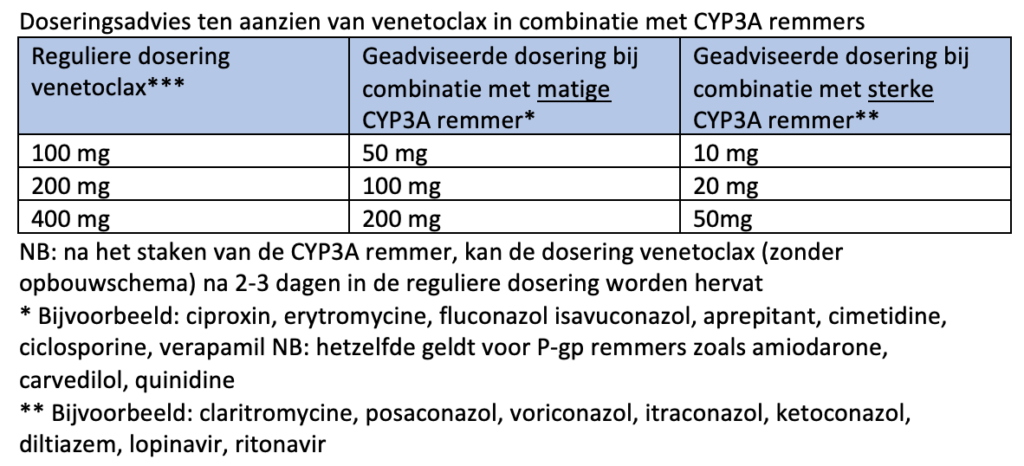
Dosering venetoclax per cyclus
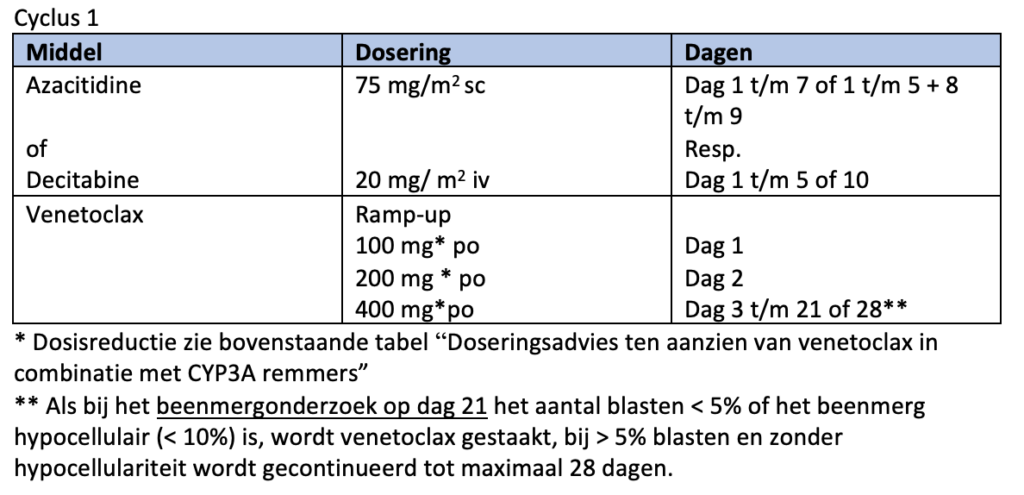

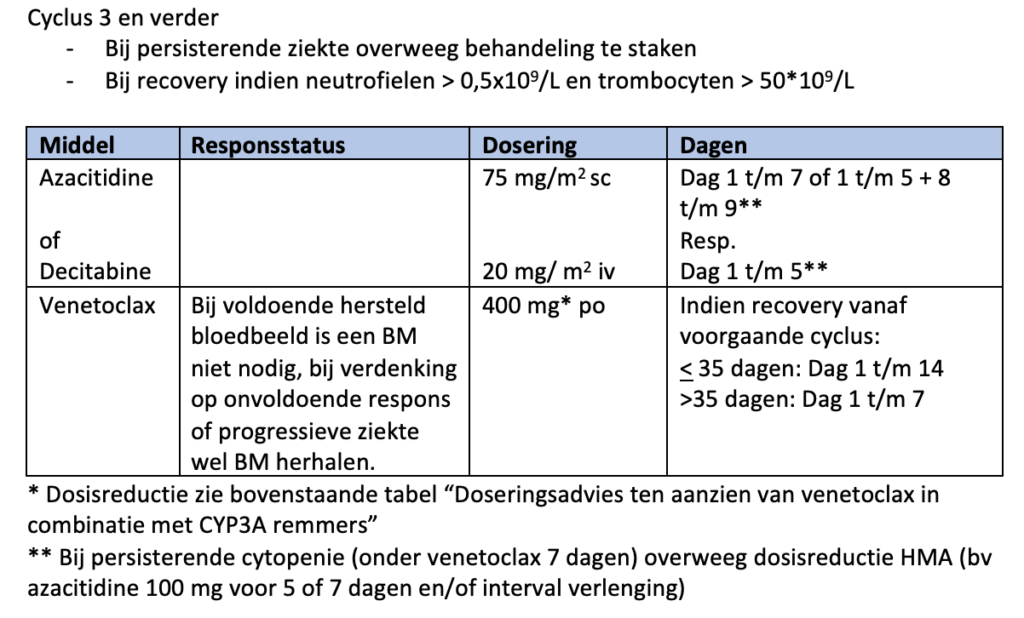
Azacitidine + ivosidenib

Decitabine
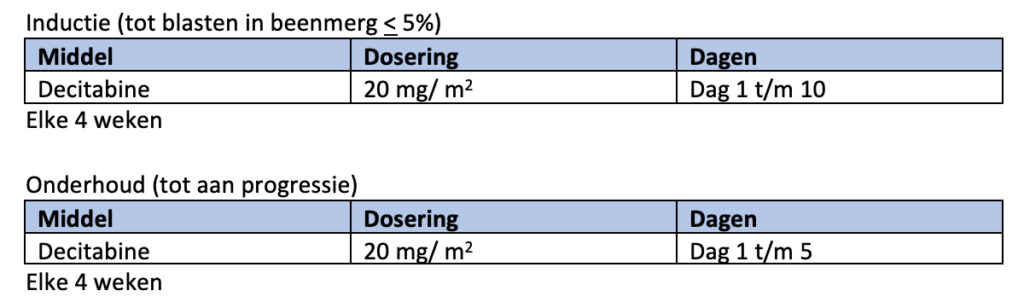
Azacitidine

Cytarabine (lage dosering sc)
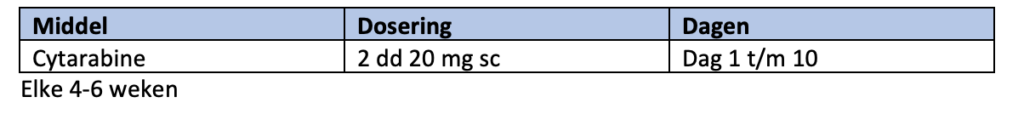
Refractaire AML of recidiefbehandeling
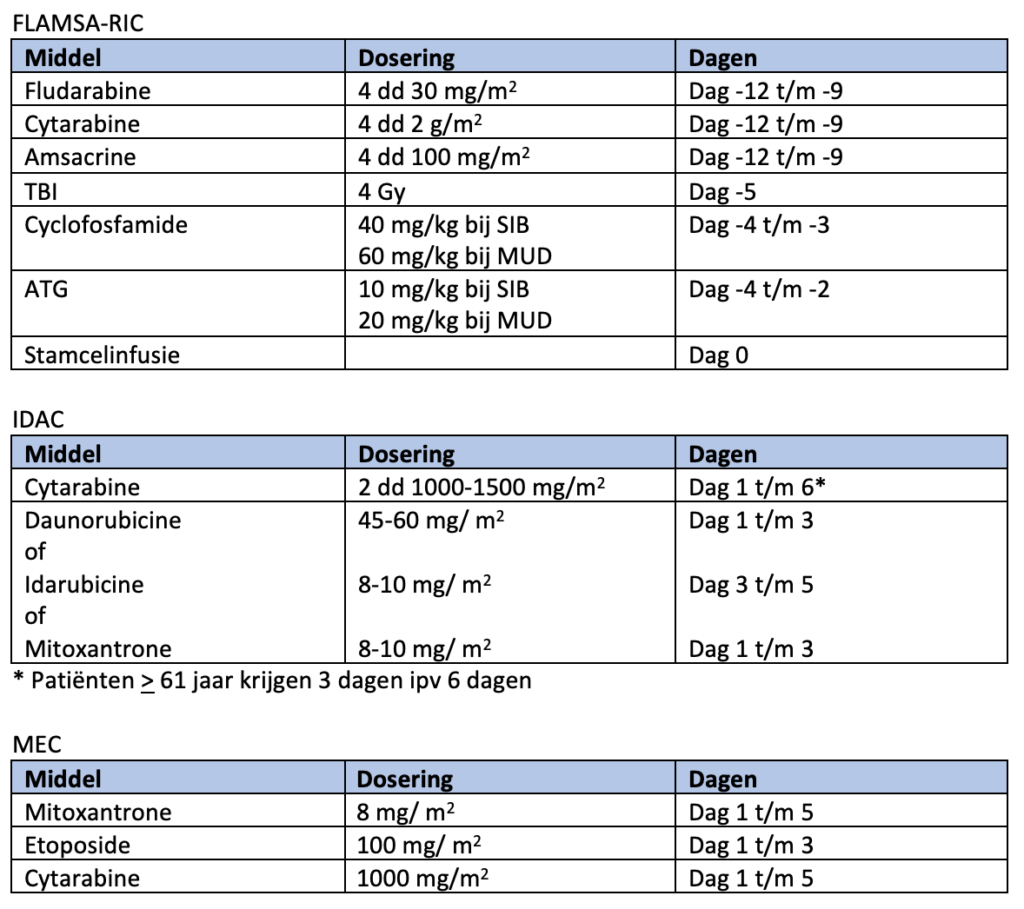
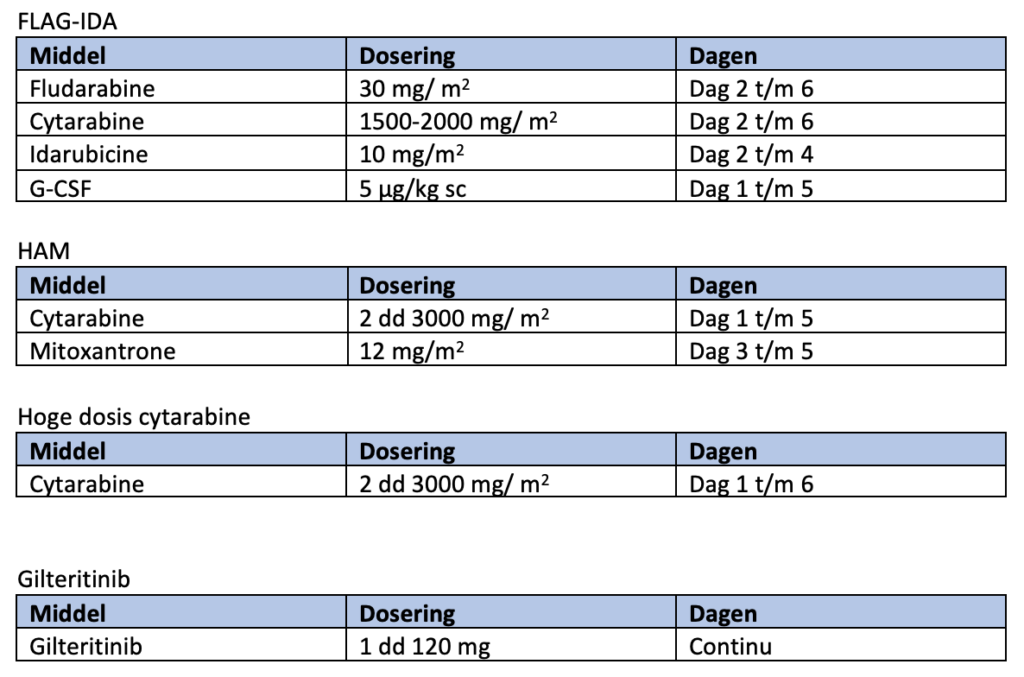
APL laag en intermediair risico
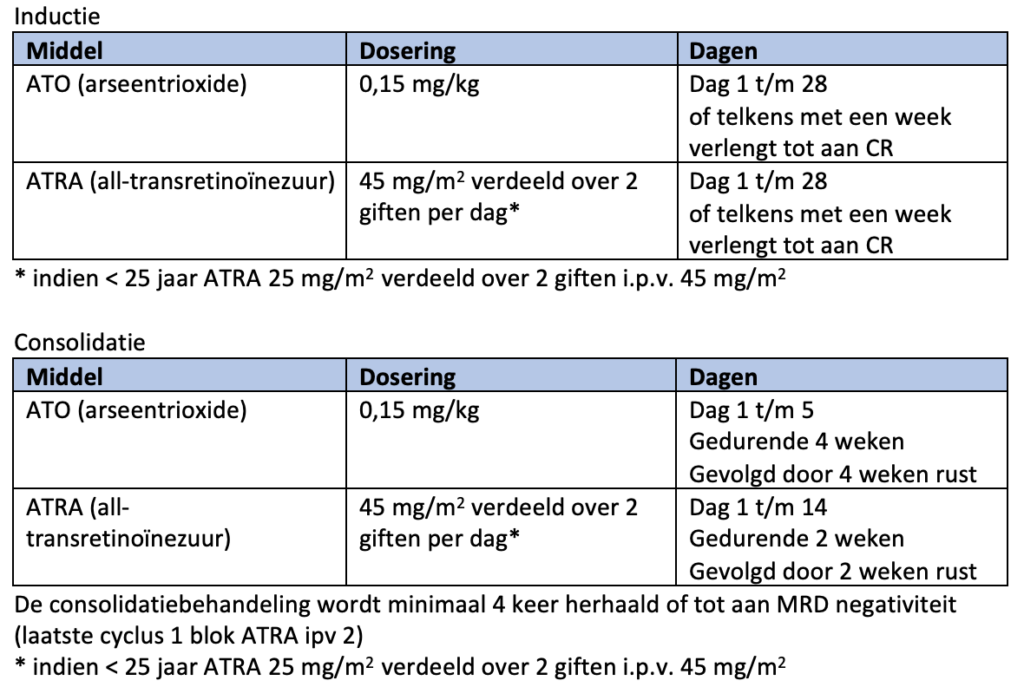
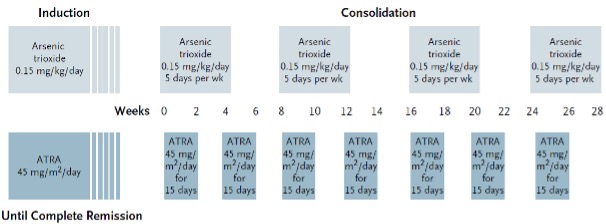
APL hoog risico (PETHEMA-schema)
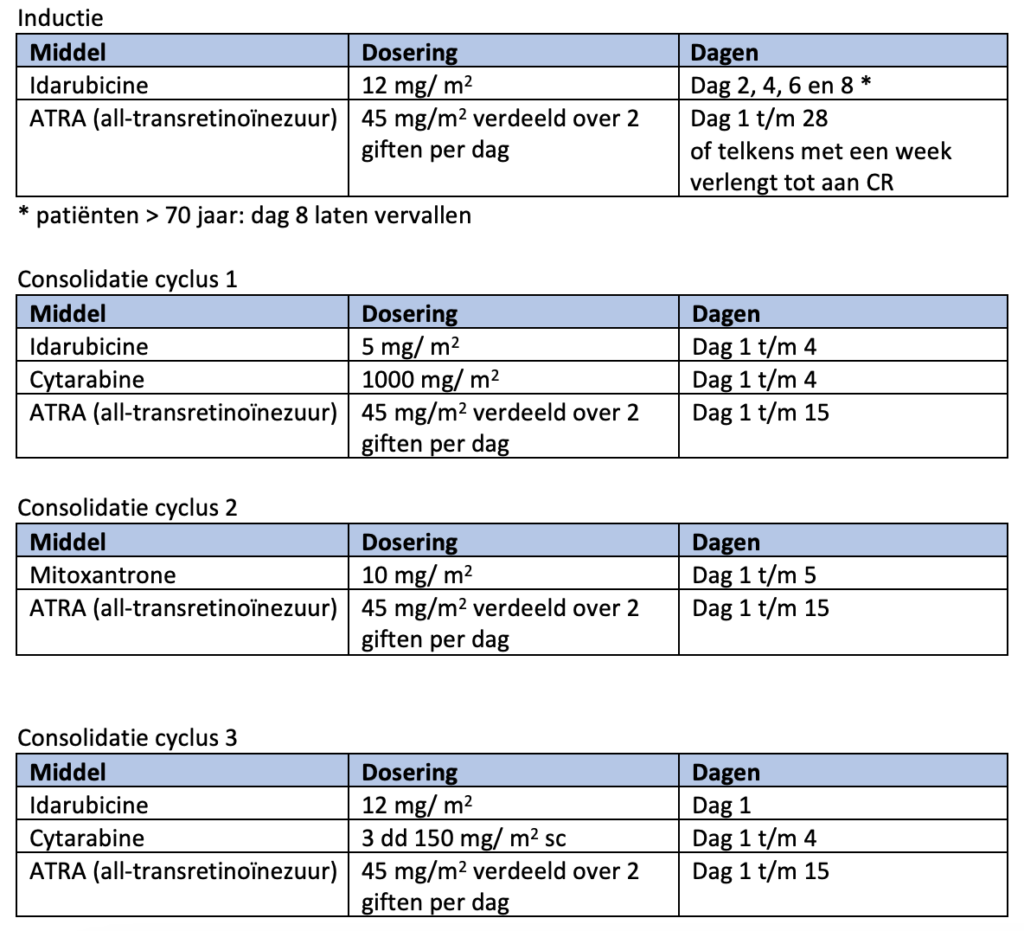

APL hoog risico (APOLLO/ HOVON 138 schema)
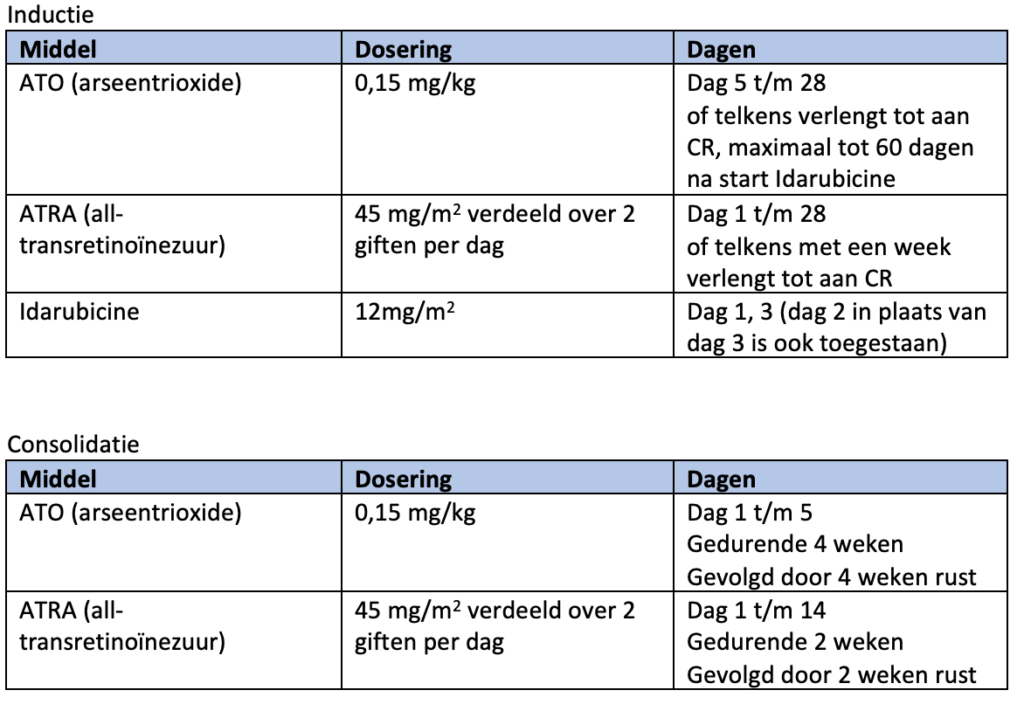
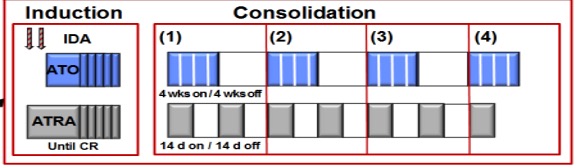
Werk afspraken (Ferrara criteria) ter definitie van “niet fit voor intensieve chemotherapie”
© 2022. Alle rechten voorbehouden