Terug naar het richtlijnenoverzicht
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van het BL bij volwassenen. Voorafgaand aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze betreffen een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een BL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, en tracht een betere uniformiteit van behandeling en daarmee een betere kwaliteit van zorg met uiteindelijk een betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van de bewijsvoering staat vermeld in de tekst. Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een BL, zoals internist-hematologen, internist-oncologen, pathologen, radiotherapeuten en algemeen internisten, maar ook radiologen, chirurgen, oncologieverpleegkundigen, IKNL-consulenten etc.
Dr. M.E.D. Chamuleau, Amsterdam UMC/locatie VUMC – voorzitter
Drs. H.I.L. Masquillier, Erasmus MC en Haaglanden Medisch Centrum
Drs. A. Demandt, MUMC+
Drs. P. Geerts, Isala
Dr. P. Mutsaers, Erasmus MC
Dr. A. Pulles, UMCU Utrecht
Dr. J. K. Doorduijn, Erasmus MC
Dr. J.E.C. Bromberg, Erasmus MC
Dr. K. Hebeda, Dr. L. van Kempen, Prof. Dr. D. de Jong, Dr. JW Leeuwis namens de Nederlandse Werkgroep HematoPathologie (NWHP) van de Nederlandse Vereniging voor Pathologie
Dr. J. Mol namens patiëntenorganisatie Hematon
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
In onderstaande tabel wordt een overzicht gegeven van de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
Dr. M.E.D. Chamuleau AUMC/VUMC – voorzitter |
Steering committee AbbVie (betaald) Internationale adBoards Novartis, AbbVie, BMS/Celgene (occasional, betaald) Deelname studies: klinische studie HOVON 152 (BMS) en HOVON 127 (KWF e Schumacher-Kramer Foundation) |
|
Drs. H.I.L. Masquillier Erasmus MC en Haaglanden Medisch Centrum |
– |
|
Dr. A. Demandt, MUMC |
– |
|
Dr. P. Geerts, Isala |
PRISMA platform als medisch specialist (betaald) |
|
Drs P. Mutsaers, Erasmus MC |
– |
|
Dr A. Pulles, UMCU Utrecht |
– |
|
Dr J. K. Doorduijn, Erasmus MC |
– |
|
Dr J.E.C. Bromberg, neuroloog, Erasmus MC |
– |
|
Namens de Nederlandse Werkgroep HematoPathologie (NWHP) van de Nederlandse Vereniging voor Pathologie: Dr K. Hebeda Prof. Dr. D. de Jong Dr. L. van Kempen Dr. JW Leeuwis |
– – – – |
|
Dr J. Mol patiëntenorganisatie Hematon |
– |
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht door de werkgroepleden. In een veel gevallen is afgezien van een systematische search met als mogelijke redenen: het ontbreken van voldoende gepubliceerde studies, de beschikbaarheid van recente internationale evidence-based richtlijnen of systematische reviews.
Werkwijze
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline en Cochrane. Aanvullend werd gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs.
Kwaliteitsindicator diagnostisch proces
Bij diagnostiek van het BL wordt histologisch onderzoek, beeldvormend onderzoek (PET-CT scan) en een diagnostische lumbaalpunctie (LP) verricht.
Kwaliteitsindicator behandeling
De eerstelijns behandeling (met curatieve opzet) van het BL bestaat uit systemische immuno-chemotherapie gecombineerd met centraal zenuwstelsel (CZS) profylaxe.
Strength-of-Recommendation Taxonomy (SORT)
|
Code |
Definition |
|
A |
Consistent, good-quality patient-oriented evidence * |
|
B |
Inconsistent or limited-quality patient-oriented evidence * |
|
C |
Consensus, disease-oriented evidence *, usual practice, expert opinion, or case series for studies of diagnosis, treatment, prevention, or screening |
* Patient-oriented evidence measures outcomes that matter to patients: morbidity, mortality, symptom improvement, cost reduction, and quality of life. Disease-oriented evidence measures immediate, physiologic, or surrogate end points that may or may not reflect improvements in patient outcomes (e.g. blood pressure, blood chemistry, physiologic function, pathologic findings).
De conceptrichtlijn is op 20-11-22 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Geen respondenten maakten van deze mogelijkheid gebruik.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon (Dr. J. Mol).
Voorafgaand aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen betreffen een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een BL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. De richtlijn beoogt derhalve niet een volledig leerboek te zijn.
Hieronder vindt u een samenvatting van de aanbevelingen (n.a.v. de vooraf vastgestelde uitgangsvragen) per hoofdstuk. Verdere adviezen t.a.v. diagnostiek, prognosticering, behandeling, responsevaluatie en follow-up zijn weergegeven in de betreffende hoofdstukken en paragrafen.
Diagnostiek
Uitgangsvraag 1:
Welke onderzoeken dienen te worden verricht bij de primaire diagnostiek van het BL?
Aanbeveling(en):
De primaire diagnostiek bij het BL bestaat uit
(1) anamnese, lichamelijk onderzoek, laboratorium onderzoek (bloedbeeld, nierfunctie en leverfunctie, tumorlysis parameters en virus serologie)
(2) histologisch onderzoek en classificatie volgens de geldende WHO classificatie1
(3) beeldvormend onderzoek mbv FDG-PET en diagnostische CT scan (hals thorax abdomen) ter stadiering2 en risicoclassificatie
(4) liquor analyse met celtelling, cytomorfologie en flow-cytometrie
Zonodig
(5) aanvullend onderzoek ter beoordeling orgaanfunctie
Prognose
Uitgangsvraag 2:
Hoe wordt de prognose van het BL bepaald?
Aanbeveling(en):
Er bestaan verschillende risico-classificaties. Voor de keuze van therapie gebruiken we de criteria, die in de prospectieve studies zijn gebruikt. Hoewel deze enigszins verschillen in de studies voldoen in vrijwel alle studies laag-risico patiënten aan alle onderstaande criteria:
NB alle andere patiënten dienen te worden beschouwd als hoog-risico.
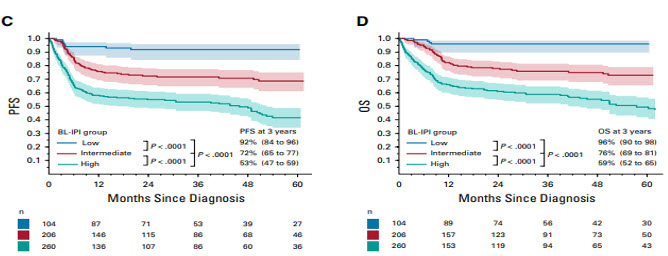
Voor een meer onderscheidende inschatting van de prognose voor een individuele patiënt wordt de meer recent ontwikkelde BL-IPI score aangeraden3. De BL-IPI score is ontwikkeld obv retrospectieve data maar is ook in een onafhankelijk cohort gevalideerd.
De BL-IPI bestaat uit de volgende factoren:
Indeling BL-IPI:
Laag-risico: 0 factoren. Intermediair-risico: 1 factor. Hoog-risico: 2,3 of 4 factoren.
Hiermee wordt een 3 jaar PFS van respectievelijk 92%, 72%, en 53%, en 3 jaar OS van 96%, 76% en 59% gezien.
Behandeling
Uitgangsvraag 3:
Wat is de eerstelijnsbehandeling van laag-risico BL?
NB Laag-risico patiënten voldoen aan alle onderstaande criteria:
Aanbeveling(en):
Indien mogelijk worden patiënten behandeld in studieverband. Op moment van verschijnen van deze richtlijn zijn er echter geen studies in de 1e lijn beschikbaar.
Buiten studieverband worden deze patiënten worden behandeld met:
of met
Met beide schema’s wordt een langdurige PFS en OS beschreven. Keuze tussen deze 2 schema’s kan gemaakt worden obv co-morbiditeiten en/of logistieke argumenten (bv klinisch vs poliklinisch).
Patiënten met een BL dienen te worden behandeld in gespecialiseerde centra, (echelon A/B/C-HIC) waar hoog-complexe hematologische zorg geleverd kan worden.
Uitgangsvraag 4:
Wat is de eerstelijns behandeling van hoog-risico BL Burkitt lymfoom?
NB Hoog-risico patiënten voldoen aan één van de volgende criteria:
Aanbeveling(en):
Indien mogelijk worden patiënten behandeld in studieverband. Op moment van verschijnen van deze richtlijn zijn er echter geen studies in de 1e lijn beschikbaar. Buiten studieverband gaat de voorkeur uit naar een behandeling met
Patiënten met een BL dienen te worden behandeld in gespecialiseerde centra, (echelon A/B/C-HIC) waar hoog-complexe hematologische zorg geleverd kan worden.
Uitgangsvraag 5:
Hoe dient BL met centraal zenuwstelsel (CZS) lokalisatie behandeld te worden?
Aanbeveling(en):
Uitgangsvraag 6:
Wat zijn de behandelingsmogelijkheden bij recidief BL?
Aanbeveling(en):
De zeldzaamheid van het Burkitt lymfoom (BL) maakt een breed gedragen richtlijn noodzakelijk.
Vanwege de zeldzaamheid van de ziekte en het gebrek aan gerandomiseerde studies, is een groot deel van de aanbevelingen en adviezen gebaseerd op consensus of expert opinion, veelal overgenomen uit internationale richtlijnen.
Welke onderzoeken dienen te worden verricht bij de primaire diagnostiek van het BL?
Aanbeveling:
De primaire diagnostiek bij het BL bestaat uit
(1) anamnese, lichamelijk onderzoek, en laboratorium onderzoek (bloedbeeld, nierfunctie en leverfunctie, tumor lysis parameters en virus serologie)
(2) histologisch onderzoek en classificatie volgens de geldende WHO classificatie9
(3) beeldvormend onderzoek mbv FDG-PET en diagnostische CT scan (hals thorax abdomen) ter stadiering2 en risicoclassificatie
(4) liquor analyse met celtelling, cytomorfologie en flow-cytometrie
Zonodig
(5) aanvullend onderzoek ter beoordeling orgaanfunctie
Uitwerking
Tabel 1. Aanbevolen onderzoek voor diagnose en stadiëring
|
Anamnese |
B-symptomen: onverklaarde koorts > 38oC, gewichtsverlies >10% in 6 mnd, nachtzweten |
|
Lichamelijk onderzoek |
Algemeen lichamelijk onderzoek Performance status, lymfeklieren, lever, milt, en extranodale ziektelokalisaties |
|
Primaire diagnostiek |
Histologisch biopt: bij voorkeur chirurgisch excisie of incisie biopt van een lymfklier of extranodale lokalisatie voor bevestiging van de diagnose volgens richtlijnen van de geldende WHO Classificatie Als chirurgisch biopt niet mogelijk is: (naald of endoscopische biopten) |
|
Laboratorium |
Bloedbeeld en differentiatie, evt. immunofenotypering bij perifere blasten Kreatinine, leverenzymen, LDH, TLS parameters (kalium, calcium, urinezuur, fosfaat) Op indicatie: zwangerschapstest |
|
Serologie |
Hepatitis B,C, HIV |
|
Beeldvorming |
CT-hals-thorax-abdomen (diagnostisch; met contrast) met FDG-PET/CT scan. Bij verdenking CZS lokalisatie MRI-cerebrum met afhankelijk van kliniek MRI wervelkolom |
|
Lumbaal punctie |
Altijd tenminste 1 keer bij diagnose om leptomeningeale lokalisatie uit te sluiten mbv celtelling, cytologische beoordeling en immunofenotypering. Bij negatieve liquor en hoge verdenking CZS lokalisatie tenminste 2 keer. |
|
Beenmergonderzoek |
Overweeg BM indien lokalisatie in BM de risico-classificatie (en daarmee de behandeling) beïnvloedt |
|
Aanvullend onderzoek vóór behandeling |
Op indicatie: ECG, echocardiografie of MUGA scan (voorafgaand aan anthracyclines) Denk aan cryopreservatie voor mannen. Gezien de meestal snel progressieve ziekte is er over het algemeen geen tijd voor eicelpreservatie bij vrouwen. Bij laag risico of lage ziekteload kan overleg met fertiliteit specialist overwogen worden. |
Onderbouwing
Er is geen systematische literatuuranalyse gedaan. Deze adviezen zijn tot stand gekomen o.b.v. expertise van de werkgroep.
Primaire histologische diagnostiek
De primaire histologische diagnostiek omvat het onderzoek dat nodig is de diagnose BL te stellen en andere lymfoomtypen uit te sluiten.
Een pathologische diagnose wordt gesteld volgens de meest recente WHO classificatie bij voorkeur op een (ruim excisie) biopt, op basis van de morfologie en immuunhistochemie met tenminste: een pan-B-cel marker (CD20, CD79a, CD22 of PAX-5), CD10, BCL2 en Ki-67. Cytologisch onderzoek en flowcytometrie kunnen de diagnose hooguit ondersteunen, vooral in het geval van een beperkte hoeveelheid weefsel of indien alleen vocht (bloed, ascites, liquor) beschikbaar is. Een analyse op alleen cytologisch materiaal is onvoldoende betrouwbaar voor het stellen van een primaire diagnose BL.
Onderzoek voor MYC translocatie wordt sterk aangeraden bij volwassenen. Indien deze aanwezig is moet bij volwassenen een bijkomende BCL2 en/of BCL6 translocatie uitgesloten worden. ISH EBER is meestal negatief in sporadisch BL in immunocompetente patiënten, maar kan positief zijn in immuundeficiëntie patiënten, b.v. in de context van HIV, immunosuppressieve behandeling ivm inflammatoire of auto-immuun ziekten of na orgaan transplantatie. Bij verdenking op immuundeficiëntie wordt EBER-ISH aangeraden.
Mede gezien de zeldzaamheid van de diagnose en de grote consequenties voor behandeling wordt het zeer sterk aangeraden de diagnose te bevestigen in een expert setting, b.v. door (regionaal, nationaal of internationaal) expert consultatie of (regionale) paneldiscussie.
Bekende lastige differentiaal diagnoses zijn hooggradig B-cel lymfoom met MYC en BCL2 en/of BCL6 translocatie, hooggradig B-cel lymfoom NOS, Burkitt-like lymfoom met 11q veranderingen, mantelcel lymfoom en B-lymfoblastair lymfoom/leukemie1.
Histologie en immuunfenotype
Bij diagnostiek van een lymfeklier of extranodale (orgaan) lokalisatie betreft dit bij voorkeur een volledige excisie of een ruim incisiebiopt. Afhankelijk van de klinische situatie kan een endoscopisch biopt of dikke naaldbiopt (bij voorkeur 14G) acceptabel zijn. De diagnose BL wordt gesteld op basis van morfologische, immunofenotypische en moleculaire criteria volgens de geldende WHO Classificatie. Een goede morfologie en een goede kwaliteit HE kleuring is essentieel. De immunohistochemie toont een karakteristiek immunofenotype met uniforme positiviteit voor pan-B-cel markers, CD10 en BCL6. Expressie van MYC is in het algemeen sterk en uniform positief, BCL2, TdT en CyclineD1 zijn negatief. De proliferatiemarker Ki67 komt in het algemeen zeer hoog tot expressie.
Bij lastig te bereiken lymfeklieren of bij extranodale lokalisatie is een excisie vaak niet haalbaar of wenselijk. In dat geval worden meerdere echo- of CT-geleide dikke naald biopten (14G) of endoscopische biopten geadviseerd. Cytologisch onderzoek en flowcytometrie kunnen dan van aanvullende waarde zijn.
Moleculaire diagnostiek
Het aantonen van een MYC rearrangement wordt sterk aangeraden bij volwassenen en indien aanwezig moet een BCL2en/of BCL6 translocatie uitgesloten worden. Standaard procedure hiervoor is FISH. Andere moleculaire technieken (b.v. next generation sequencing (NGS) technieken) kunnen, indien gevalideerd, een alternatief voor FISH zijn. ISH EBER is meestal negatief in sporadisch BL in immunocompetente patiënten, maar kan positief zijn in immuun-deficiënte patiënten, b.v. in de context van HIV, immuun-suppressieve behandeling ivm inflammatoire of auto-immuun ziekten of na orgaan transplantatie. Bij verdenking op immuundeficiëntie wordt EBER-ISH aangeraden. Mutatie analyse heeft op dit moment geen toegevoegde waarde. Onderzoek naar de klonaliteit van immuunglobuline zware keten (IGH) gen herschikking is bij primaire diagnose meestal niet nodig voor het stellen van de diagnose.
Stadiëring
Het BL wordt gestadieerd volgens het gereviseerd stageringssysteem voor primair nodale lymfomen2 (Tabel 2)
Tabel 2. Gereviseerd stageringssysteem voor primair nodale lymfomen (Lugano criteria).
|
Stadium |
Definitie |
|
I (IE) |
Eén lymfeklier of groep aangrenzende lymfeklieren IE: één extranodale lokalisatie zonder lymfeklier betrokkenheid |
|
II (IIE) |
Twee of meer lymfeklierstations aan dezelfde zijde van het diafragma IIE: stadium I of II door lymfeklier uitbreiding met beperkte dichtbijgelegen extranodale betrokkenheid |
|
III |
Twee of meer lymfklieren aan beide zijden van het diafragma met eventueel een gelokaliseerde extralymfatische lokalisatie of ingroei in omliggende weefsel vanuit deze lymfeklierstations, miltaantasting of beide |
|
IV |
Bijkomende niet aansluitende extranodale betrokkenheid |
Extranodale betrokkenheid: Betrokkenheid van extralymfatisch weefsel aan één kant van het diafragma door beperkte directe uitbreiding van een naastgelegen nodale locatie wordt aangeduid als extranodale uitbreiding en weergegeven door de letter E. De E categorie kan ook een discrete enkele extranodale lesie aanduiden die past bij uitbreiding van een regionale betrokken lymfeklier. Uitgebreidere extranodale ziekte, b.v. multipele extranodale lesies, worden geduid als stadium IV. Een enkele extralymfatische locatie als de enige locatie van ziekte hoort als stadium IE te worden aangegeven.
Nota Bene: 1. De volgende anatomische lymfeklier regio’s worden als een enkele regio beschouwd:
alle klieren aan een kant van de hals, b.v. de subregio’s supraclaviculair, cervicaal, submandibulair, occipitaal, preauriculair en postauriculair; de okselregio omvat de infraclaviculaire klieren; het mediastinum wordt als een regio beschouwd, inclusief de subcarinale en pericardiale klieren. 2. De longhilus wordt als een aparte regio beschouwd. Dus betrokkenheid van het mediastinum en een hilus lokalisatie betekent stadium II. 3. Hilus klieren worden als gelateraliseerd beschouwd en als aan beide kanten positief dus stadium II. 4. Tonsillen, Ring van Waldeyer en milt worden gezien als nodaal (lymfklier betrokkenheid).
Beeldvormend onderzoek
Inleiding
Beeldvormend onderzoek heeft tot doel de uitgebreidheid van de lymfadenopathie en eventuele orgaaninfiltratie en extranodale lokalisaties vast te stellen.
Samenvatting literatuur:
Vanwege het agressieve en hoog proliferatieve karakter is het BL bij diagnose altijd FDG- avide10. FDG-PET scan gecombineerd met een contrast-enhanced CT-scan bij diagnose kan nodale en extranodale lokalisaties in beeld brengen en is noodzakelijk voor de classificatie volgens Lugano2. Een PET-CT beoordeeld met visuele Deauville criteria aan het einde van de therapie correleert met PFS en OS10.
Semi-quantitatieve analyses (zoals totaal metabool tumor volume (MTV) en total lesion glycolyse (TLG)) op baseline PET correleren met respons en prognose zowel in kinderen11 als bij volwassen.12 Afname van MTV en TLG op EOT scan correleert ook significant met PFS en OS.13
Halverwege de behandeling wordt een CT scan geadviseerd. De rol van een interim PET scan is onduidelijk, zowel visuele als semi-quantitatieve analyses lijken niet te correleren met PFS en OS10,12,13. Interim PET wordt echter wel gebruikt om laag-risico patiënten minder cycli DA-EPOCH-R te geven8. Bij een negatieve interim PET-CT na 2 cycli kan met 3 cycli (ipv 6) volstaan worden.
Bij klinische verdenking op neurologische betrokkenheid wordt een MRI hersenen geadviseerd, en afhankelijk van de kliniek ook een MRI van de wervelkolom.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Bij diagnose (en aan het einde van de behandeling) wordt een PET-CT scan geadviseerd. |
|
C |
-Bij interim analyse wordt een CT scan geadviseerd. -Overweeg een interim PET-CT scan bij laag-risico patiënten die met DA-EPOCH-R behandeld worden (dan kan obv een negatieve interim PET-CT met 3 cycli (ipv 6) volstaan worden) |
|
C |
Bij klinische verdenking op neurologische betrokkenheid wordt een MRI cerebrum geadviseerd, en afhankelijk van de kliniek ook een MRI van de wervelkolom. |
Hoe wordt de prognose van patiënten met Burkitt lymfoom bepaald?
Aanbeveling(en):
Er bestaan verschillende risico-classificaties. Voor de keuze van therapie gebruiken we de criteria, die in de prospectieve studies zijn gebruikt. Hoewel deze enigszins verschillen in de studies voldoen in vrijwel alle studies laag-risico patiënten aan alle onderstaande criteria:
Voor een meer onderscheidende inschatting van de prognose voor een individuele patiënt wordt de meer recent ontwikkelde BL-IPI score aangeraden3. De BL-IPI score is ontwikkeld obv retrospectieve data maar is ook in een onafhankelijk cohort gevalideerd.
De BL-IPI bestaat uit de volgende factoren:
Definitie:
Laag-risico: 0 factoren. Intermediair-risico: 1 factor. Hoog-risico: 2,3 of 4 factoren.
Hiermee wordt een 3 jaar PFS van respectievelijk 92%, 72%, en 53%, en 3 jaar OS van 96%, 76% en 59% gezien.
Onderbouwing
Inleiding:
Voor de keuze van behandeling is het van belang om onderscheid te maken tussen laag- en hoog-risico ziekte. Er zijn verschillende scoringssystemen gehanteerd in klinische studies. Deze systemen verschillen van de BL-IPI score die gebruikt wordt voor het bepalen van een individuele prognose.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Gebruik voor therapie keuze de definitie voor hoog-risico: aanwezigheid van stadium III/IV, of verhoogd LDH, of PS>1 of massa ≥ 7 cm |
|
B |
Gebruik voor inschatten van de prognose voor een individuele patiënt de BL-IPI |
Er zijn verschillende risicofactoren geïdentificeerd in retrospectieve population-based studies. In de klinische studies zijn risico-groepen verschillend gedefinieerd. De BL-IPI score van Olszewksi3 is wel in een onafhankelijk cohort gevalideerd maar nog niet prospectief gevalideerd en in een klinische studie.
Daarom is er een verschil tussen de definitie die we adviseren te gebruiken voor de keuze van therapie en de score die we adviseren voor de het bepalen van een individuele prognose van een patiënt.
Samenvatting literatuur.
Er is geen systematische literatuuranalyse gedaan maar een gerichte analyse obv expertise van de werkgroep.
Retrospectieve studies
Er zijn geen eenduidige criteria voor de prognose van patiënten met BL. In retrospectieve population-based studies zijn verschillende prognostische factoren geïdentificeerd:
Castillo beschrijft in de SEER database (n= 2284 patiënten) dat leeftijd < 60, ras (black) en stadium III/IV significante slecht prognostische factoren zijn.14
Wasterlid heeft in een serie van 156 patiënten uit de Swedish registry leeftijd >40 jaar en WHO PS >1 als slecht prognostische factoren geïdentificeerd.15
Meest recent is prognostische score ontwikkeld gebaseerd op population-based data van 633 patiënten.16 Als belangrijke onafhankelijke factoren werden leeftijd > 40, PS ≥2, LDH >3 ULN en CZS lokalisatie geïdentificeerd. Deze factoren zijn gevalideerd in een onafhankelijk cohort van 457 patiënten en daarmee is de BL-IPI score ontwikkeld3, die patiënten verdeelt in 3 categorieën:
waarmee de volgende overleving wordt gezien: 3 jaar PFS 92%, 72%, en 53%, resp en 3 jaar OS 96%, 76% en 59%
Prospectieve interventie studies:
Het vertalen van retrospectief geïdentificeerde factoren is niet eenduidig gedaan in verschillende prospectieve interventie studies.
Zo gebruikt Mead in 2002 voor de definitie van hoog-risico BL: aanwezigheid van verhoogd LDH of WHO ≥ 2, of stadium III/IV of massa ≥10 cm.5 In een volgende studie in 2008 gebruikt hij voor hoog-risico aanwezigheid van 3 van de 4 factoren: verhoogd LDH of WHO ≥ 2, of stadium III/IV of ≥ 2 extranodale lokalisaties.4
Dunleavy gebruikt in de eerste trial naar de waarde van DA-EPOCH-R voor de definitie van hoog-risico aanwezigheid van CZS lokalisatie en/of >25 blasten in beenmerg.7 In de multicenter studie is de definitie van hoog risico: stadium III/IV, of verhoogd LDH, of PS > 1 of massa ≥ 7 cm.8
Ribrag gebruikt in de enige gerandomiseerde studie als definitie voor hoog-risico alle patiënten die geen gereseceerd st I/II hebben. Verder wordt in deze studie wel gestratificeerd op de aanwezigheid van CZS of BM betrokkenheid.17 In de HOVON 127 werd de definitie van Mead gebruikt.5
Overweging
Hoewel de definities van laag-risico in de studies verschillen, vindt de werkgroep het voor behandeladviezen verantwoord de volgende definitie van laag-risico van te gebruiken (aanwezigheid van WHO PS ≤1, en AA st I/II(E), en normaal LDH, en tumor massa < 7 cm). Alle andere patiënten zijn dan hoog-risico. Deze definitie omvat alle populaties van laag-risico en hoog-risico uit de verschillende studies met uitzondering van patiënten met st IIE die in de studie van Mead niet laag-risico zouden zijn.
Uitgangsvraag:
Wat is de eerstelijnsbehandeling van laag-risico BL?
NB Laag-risico patiënten voldoen aan alle onderstaande criteria (zie hoofdstuk prognose):
Aanbeveling(en):
Indien mogelijk worden patiënten behandeld in studieverband. Op moment van verschijnen van deze richtlijn zijn er echter geen studies in de 1e lijn beschikbaar.
Buiten studieverband worden deze patiënten worden behandeld met:
of met
Met beide schema’s wordt een langdurige PFS en OS beschreven. Keuze tussen deze 2 schema’s kan gemaakt worden obv co-morbiditeiten en/of logistieke argumenten (bv klinisch vs poliklinisch).
Patiënten met een BL dienen te worden behandeld in gespecialiseerde centra (echelon A/B/C-HIC), waar hoog-complexe hematologische zorg geleverd kan worden.
Onderbouwing
Inleiding:
Ongeveer 10-20% van de patiënten heeft bij diagnose een laag-risico BL5,18 en deze patiënten worden in de meeste studies met minder intensieve regimes behandeld. In de gepubliceerde studies zijn echter verschillende definities van laag-risico gebruikt, en zijn de aantallen laag-risico patiënten klein. Er zijn geen gerandomiseerde studies. Dit maakt een eenduidig advies lastig.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
De behandeling van patiënten met een laag-risico Burkitt lymfoom bestaat uit 3 cycli R-CODOX-M of 3-6 cycli DA-EPOCH-R met intrathecale profylaxe |
|
C |
Keuze voor een schema kan gebaseerd worden op de aanwezigheid van co-morbiditeiten (bijv nierinsufficientie of 3e ruimte) en/of logistieke gronden (klinisch versus poliklinisch of duur van de behandeling (max 9 weken bij R-CODOX-M vs max 18 weken bij DA-EPOCH-R). |
|
C |
Indien voor DA-EPOCH-R wordt gekozen kan bij een negatieve interim PET CT scan (na 2 kuren) volstaan worden met 3 cycli. |
Samenvatting literatuur:
Er is geen systematische literatuuranalyse gedaan maar een gerichte analyse obv expertise van de werkgroep.
De studie die de basis heeft gelegd voor het meest gebruikte regime, was ontwikkeld door Magrath en collega’s begin jaren negentig19. 20 Volwassenen en 21 kinderen werden behandeld met 3x CODOX-M als ze laag-risico waren en CODOX-M/IVAC 2x in geval van hoog-risico ziekte en bijkomend in beide groepen CZS-profylaxe middels methotrexaat en cytarabine intrathecaal. Laag-risico ziekte was gedefinieerd als stadium I ziekte <10cm en normaal LDH of volledig gereseceerde abdominale massa. Slechts 7 patiënten vielen in de laag-risico groep en waren long-term survivors. Voor de patiënten met stadium I, II en III ziekte gecombineerd was de EFS na 2 jaar 97%. Toxiciteit bestond met name uit ernstige myelosuppressie resulterend in significante aantallen infecties.
Een hierop volgende prospectieve internationale fase II studie was van Mead et al5. De mediane leeftijd in deze studie was 35 jaar. In deze studie vielen 12 van de 52 patiënten in de laag-risico groep. Zij werden ook behandeld middels 3 kuren CODOX-M. 2 jaar EFS was 83% en 2 jaar OS 82% voor deze groep, dus ook in deze studie goede resultaten maar toch beduidend lagere percentages dan in de kinderen/jongvolwassen studie.
Een vervolgstudie van Mead et al4 onderzocht de dosisreductie van methotrexaat naar 3g/m2. In deze studie werden 53 patiënten geïncludeerd, ook gestratificeerd naar hoog en laag-risico (n=11) gedefinieerd als 3 van de 4 factoren (normaal LDH, PS ≤1, Ann Arbor stage I/ II en EN sites ≤1). Voor de laag-risico groep bestond ook in deze studie de behandeling uit 3 cycli CODOX-M, alleen nu met aangepaste dosis methotrexaat (dmCODOX-M). 2 jaar OS was 82% voor de laag-risico groep. De effectiviteit leek gelijk ondanks de dosisreductie methotrexaat, maar er werd wel een duidelijke reductie in toxiciteit gerapporteerd, alhoewel er wel ook minder oudere patiënten geïncludeerd waren dan de bedoeling was. In deze studie werd geen rituximab gegeven.
Om te proberen de hoge toxiciteit met “standaard” schema’s terug te brengen, onderzochten Dunleavy et al7 de low-intensity therapy, bestaande uit DA-EPOCH-R in combinatie met 8x methotrexaat intrathecaal. In deze studie waren 30 patiënten geïncludeerd, waarvan 17 met een sporadische variant en 13 met een immunodeficiency-associated variant. Van de totale groep had 17% (n=5) laag-risico ziekte, gedefinieerd als gereseceerd stadium I of abdominaal stadium II. 2 Regimes werden getest, een standaard, dose-adjusted EPOCH-R schema in de HIV-negatieve patiënten (DA-EPOCH-R) en een combinatie met dubbele dosis rituximab in 11 HIV-positieve patiënten (SC-EPOCH-RR). De overall mediane leeftijd was 33 jaar en 40% was 40 jaar of ouder. Na een mediane follow-up van 86 maanden was de OS 100% voor de HIV-negatieve groep (waarin de 5 low risk patiënten zaten).
In een recentere studie van Roschewski et al8 werden tussen 2000 en 2017 113 patiënten geïncludeerd in 22 centra. 13% (n=15) van deze patiënten vielen in de laag-risico groep (gedefinieerd als st I/II plus PS ≤1 plus normaal LDH, plus tumor < 7 cm) . De mediane leeftijd was 49 jaar en 62% was ouder dan 40 jaar. Laag-risico patiënten kregen 3 cycli DA-EPOCH-R zonder CZS-profylaxe als de PET-scan na 2 kuren negatief was. Bij positieve PET-scan kregen ze 6 cycli DA-EPOCH-R en methotrexaat it. Dit was bij geen van de patiënten het geval. 1 patiënt kreeg een aangepast schema vanwege toxiciteit en een andere patiënt kreeg 4 kuren maar had een negatieve PET-CT. Bij een mediane follow-up van 58,7 maanden was de 4 jaar EFS 100% voor de laag-risico groep en OS 87% voor de hoog-en laag-risico patiënten samen.
Overwegingen:
De werkgroep adviseert voor behandeladviezen de volgende definitie van laag-risico te gebruiken (WHO PS ≤1, en AA st I/II(E), en normaal LDH, en tumor massa < 7 cm). De werkgroep adviseert voor laag-risico patiënten een schema te gebruiken uit de studies waarin > 10 geïncludeerde laag-risico patiënten met goede resultaten behandeld werden en te kiezen tussen twee schema’s:
Of
Keuze voor een schema kan gebaseerd worden op de aanwezigheid van co-morbiditeiten (bv nierinsufficiëntie of 3eruimte ongewenst bij MTX iv) en/of logistieke gronden (klinisch versus poliklinisch of duur van de behandeling (max 9 weken bij R-CODOX-M vs max 18 weken bij DA-EPOCH-R). Indien voor DA-EPOCH-R gekozen wordt kan bij een negatieve interim PET -CT scan wel volstaan worden met 3 cycli (dit was bij 14/14 patiënten die een interim PET-CT kregen het geval). In deze studie werd ook it profylaxe bij een negatieve interim PET-CT scan achterwege gelaten. Gezien de lage aantallen (n=14) vindt het werkgroep het nog niet verantwoord dit advies over te nemen.
Hoog-risico BL (fitte patiënt, <75 jaar)
Uitgangsvraag:
Was is de eerstelijns behandeling van hoog-risico BL patiënten?
NB Hoog-risico patiënten voldoen aan één van de volgende criteria (zie hoofdstuk prognose):
Aanbeveling(en):
Indien mogelijk worden patiënten behandeld in studieverband. Op moment van verschijnen van deze richtlijn zijn er echter geen studies in de 1e lijn beschikbaar. Buiten studieverband gaat de voorkeur uit naar een behandeling met
Er kan overwogen worden om, bij snel progressieve ziekte, in afwachting van een definitieve diagnose een eerste kuur R-CHOP te geven. Er is echter geen evidence om dit te ondersteunen.
Onderbouwing
Inleiding:
Het BL is een agressief, snel progressief B-cel non-Hodgkin lymfoom waarbij snelle therapie noodzakelijk is. In afwachting van een definitieve histologische diagnose kan overwogen worden reeds te starten met een eerste kuur R-CHOP. In de literatuur zijn echter geen goede gegevens te vinden binnen welke termijn met een eerste kuur gestart moet worden en wat het effect is van al dan niet eerder starten op de outcome.
Patiënten met een BL dienen te worden behandeld in gespecialiseerde centra, (echelon A/B/C-HIC) waar hoog-complexe hematologische zorg geleverd kan worden, conform afspraken in NVVH regionalisatie en echelonerings document. Deze centra dienen tevens te beschikken over een intensive care met ervaring in hematologische zorg.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
De behandeling van een hoog-risico Burkitt lymfoom bestaat uit 2 cycli dmR-CODOX-M / R-IVAC. Een alternatief schema bij patiënten zonder CZS lokalisatie is 6 cycli DA-EPOCH-R. In beide schema’s wordt intrathecale profylaxe gegeven. |
|
C |
In afwachting van de definitieve diagnose kan gestart worden met een 1ekuur R-CHOP |
Onderbouwing
Samenvatting literatuur:
Er is geen systematische literatuuranalyse gedaan maar een gerichte analyse obv expertise van de werkgroep.
Wereldwijd worden verschillende intensieve behandelschema’s gebruikt. Voor een overzicht van de respons, EFS/PFS en OS van deze schema’s verwijzen we naar tabel 4.
In een fase 2 studie door de UK Lymphoma Group (LY06 studie, door Mead et al5 waarin zowel laag-risico (3 maal CODOX-M) als hoog-risico (2 maal CODOX-M/IVAC) patiënten werden behandeld werd in 74% een CR en in 13% een PR bereikt. De EFS na 2 jaar was 59,5% met een OS na 2 jaar van 69,9%.
Barnes et al6 onderzocht retrospectief het effect van het toevoegen van rituximab aan de behandeling, bij zowel laag- als hoog-risico patiënten. De 3 jaar PFS nam hiermee toe van 61% naar 74% en de 3 jaar OS van 66% naar 77%. Voor specifiek de hoog-risico groep in deze studie was de 3 jaar PFS 64% en de 3 jaar OS 67%.
In het LMB protocol van Divine et al20 werden 72 laag- en hoog-risico patiënten behandeld, met een 2 jaar EFS van 65% en een 2 jaar OS 70%.
In de HOVON 27, gepubliceerd door van Imhoff et al21,22, waarin 27 patiënten met Burkitt lymfoom en 15 patiënten met lymfoblastic lymfoom behandeld werden met 2 inductiekuren en autologe stamceltransplantatie, werd in 81% een CR en in 11% een PR bereikt. De geschatte 5 jaar EFS was in deze studie 73% met een geschatte 5 jaar OS van 81% voor BL patiënten en 46 % en 40% voor lymphoblastic lymphoma patiënten.
Kelly et al23 deed een retrospectieve analyse van verschillende behandelprotocollen, met een OS variërend van 62% tot 89%. Gezien de grote variabiliteit in deze verschillende studies doen zij echter geen uitspraak naar een eventuele voorkeurstherapie.
In een retrospectieve analyse van Oosten et al24 van Nederlandse patiënten, werden de LMB, BFM, HOVON en CODOX-M/IVAC regimes met elkaar vergeleken. Er was geen significant verschil in de 5 jaar OS (69%, p= 0,966) en 5 jaar PFS (69% p= 0,981) in de verschillende groepen. Ook de toxiciteit was vergelijkbaar met als uitzondering dat er iets meer hepato-toxiciteit werd gezien in de CODOX-M/IVAC groep. CODOX-M/IVAC had het meest gunstige profiel wat betreft kosten, duur van de behandeling en percentage patiënten dat de kuur afmaakt.
Mead et al (LY10)4 ontwikkelde een aangepast schema van CODOX-M/IVAC met een dosisreductie van methotrexaat. Deze studie toonde even goede effectiviteit van een lagere dosis MTX (3g/m2 < 65j en 1g/m2 > 65j in vergelijking met de oorspronkelijke dosis van 6.7g/m2 (uit de LY06 studie), waardoor de toxiciteit (met name voorkomen van mucositis) aanzienlijk gereduceerd werd. De 2y PFS was 64% en 2y OS 67%, het betreft zowel laag- als hoog-risico patiënten. Ook door LaCasce et al.25 werd een vergelijkbare effectiviteit aangetoond met een lagere dosis methotrexaat.
In navolging van Barnes et al6 werd aangetoond dat toevoeging van rituximab aan het dmCODOX-M-IVAC schema voor een verbetering van de PFS en OS zorgde, hoewel deze verbetering niet statistisch significant was. Een significante verbetering door toevoeging rituximab werd gezien in de studie van Ribrag; 3 jaar EFS verbeterde van 62% naar 75% (HR 0.59 (CI 0.38-0.94), p=0.025) en 3 jaar OS van 70% naar 83% (HR 0.51 (0.3-0.86, p=0.012)17.
In 2013 publiceerde Dunleavy de eerste resultaten van het DA-EPOCH-R schema, een intermediate intensief schema dat gebruik maakt van 2 principes7,26;
Voordeel van dit schema is dat het poliklinisch gegeven kan worden omdat er geen hoge dosering gegeven worden er weinig misselijkheid gezien wordt. Patiënten hebben wel een centraal veneuze katheter nodig en een pomp.
In de eerste monocenter studie van Dunleavy7 werden 14 int/hoog-risico patiënten geïncludeerd (definitie int/hoog-risico; allen behalve st I/II gereseceerd). In deze studie was met een mediane FU van 73 maanden de EFS 95% en de OS 100%. Dit schema is vervolgens uitgetest in een multicenter trial door Roschewski et al8. In deze studie werden 98 hoog-risico (st > 2 of ECOG PS >1 of verhoogd LDH of massa ≥ 7 cm) patiënten geïncludeerd en behandeld met 6 cycli DA-EPOCH-R met CZS profylaxe (intrathecaal). Met een mediane follow-up van 57,8 maanden was de EFS 82,1% en de OS 84,9%. 2 patiënten ontwikkelden een CZS recidief.
Tabel 4. Overzicht van studies behandeling hoog-risico Burkitt lymfoom
Overwegingen:
In Nederland wordt al lange tijd R-CODOX-M/R-IVAC gegeven als ‘standaard’ therapie bij hoog-risico Burkitt lymfoom. In de literatuur worden echter meerdere schema’s gebruikt, waarbij het intermediate intensieve DA-EPOCH-R schema een alternatief zou kunnen zijn.
De HOVON 127 heeft deze 2 regimes in een gerandomiseerde fase III studie onderzocht. De studie is voortijdig gesloten na inclusie van 89 patiënten27. De eerste resultaten laten zien dat DA-EPOCH-R en R-CODOX-M/R-IVAC resulteren in gelijkwaardige complete metabole remissie percentages van respectievelijk 66% en 65%. DA-EPOCH-R behandeling was geassocieerd met significant minder transfusies van erytrocyten en trombocyten en ging gepaard met significant minder ziekenhuis opname-nachten en infecties. De overleving lijkt bij een mediane FU van 19 maanden gelijk. Langere FU data worden afgewacht en zullen hopelijk een indicatie geven of het minder toxische DA-EPOCH-R schema, in combinatie met CZS profylaxe, voor hoog-risico patiënten, als gelijkwaardig alternatief gebruikt kan worden.
Recent (2021) verscheen in Blood een review artikel waarin eveneens naar verschillende behandelschema’s gekeken wordt. Er wordt hierbij verwezen naar eerdere studies met onder andere R-CODOX-M/R-IVAC. Er lijkt een lichte voorkeur uit te gaan naar DA-EPOCH-R, met als kanttekening dat dit mogelijk minder goed is in preventie van CZS relapse28.
Hoog-risico BL (>75 jaar of niet fit)
Aanbeveling(en):
De literatuur aangaande de behandeling van het BL bij ouderen (>75) of niet fitte patiënten is beperkt. Er dient per patiënt een individuele afweging gemaakt te worden.
Overwogen kan worden ook oudere (fitte) patiënten te behandelen met dmR-CODOX-M / R-IVAC, of DA-EPOCH-R daar deze in de eerder genoemde studies soms meegenomen worden. Alternatieven zijn of R-(mini)-CHOP of radiotherapie.
Inleiding:
In de meeste eerder beschreven studies4-6,8,17,20,22,24,29 is het aantal patiënten >75 jaar (en zelfs >65 jaar) beperkt. De outcome (PFS/OS) is duidelijk slechter voor ouderen, ook als zij met intensieve therapie behandeld worden. Er is echter wel een plateau in overleving, dit suggereert dat een subgroep kan profiteren van een curatieve behandeling.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
C |
Bij oudere fitte patiënten kan gekozen worden voor dmR-CODOX-M / R-IVAC of DA-EPOCH-R met curatieve intentie. |
|
C |
Overweeg bij niet- fitte oudere patiënten R-(mini)-CHOP of radiotherapie in palliatieve setting. |
Samenvatting literatuur:
In de meeste eerder beschreven studies 4-6,8,17,20,22,24,29 is het aantal patiënten >75 jaar (en zelfs >65 jaar) beperkt. De outcome (PFS/OS) is duidelijk slechter voor ouderen, ook als zij met intensieve therapie behandeld worden.
Recente IKNL analyses hebben 24 patiënten > 75 jaar geanalyseerd. Slechts 10% had intensieve chemotherapie ontvangen (R-CODOX-M of DA-EPOCH-R), zo’n 20% kreeg R-CHOP, de rest kreeg geen therapie. Hiermee bleek 5 jaar relatieve overleving rond de 35% te liggen, er werd wel een plateau gezien, mogelijk aangevend dat behandeling voor een fittere oudere wel een curatieve optie kan zijn.30
Voor oudere patiënten (>75 jaar) of patiënten niet fit voor intensieve therapie zijn de behandelopties beperkt. Vaak wordt gekozen voor R-(mini)-CHOP of vergelijkbaar schema, in combinatie met intrathecale chemotherapie.31
De behandeling van een Burkitt lymfoom dient te gebeuren in gespecialiseerde centra (echelon A/B/C-HIC) die hoog-intensieve hematologische zorg verlenen en beschikken over een afdeling intensieve zorgen met ervaring in hematologische problematiek. Onderstaande bevat een overzicht van de voornaamste, supportief te nemen maatregelen tijdens de behandeling met R-CODOX-M / R-IVAC.
Centraal veneuze lijn
R-CODOX-M en R-IVAC en DA-EPOCH-R dienen te worden toegediend via een centraal veneuze lijn.
Tumorlysis profylaxe
Er is bij het Burkitt lymfoom over het algemeen een hoog tumor lysis risico. Preventieve maatregelen middels (hyper)hydratie en allopurinol of rasburicase zijn aangewezen (conform eigen ziekenhuis protocol).
Profylaxe
Patiënten dienen selectieve darm decontaminatie te krijgen gedurende de neutropene periode volgens lokaal protocol. Daarnaast wordt PJP profylaxe geadviseerd.
Denk aan tijdig staken cotrimoxazol (3 dagen voor tot 5 dagen na) de hoge dosis methotrexaat.
Denk aan monitoring en profylaxe bij eerder doorgemaakte HBV infectie.
Intrathecale therapie
Denk aan de intrathecale profylaxe conform het schema in appendix 11. 24 uur na intrathecaal methotrexaat dient 15 mg folinezuur per os te worden toegediend.
Anticonceptie
Denk aan anticonceptie bij vrouwen voor de menopauze.
Groeifactoren
Denk aan het toedienen van filgrastim (vanaf dag 13 bij R-CODOX-M en vanaf dag 7 bij R-IVAC) tot de neutrofielen > 1.0x10E9/L. Dosering is afhankelijk van gewicht, =< 80kg is de dosis 300μg/dag; > 80kg is de dosis 480μg/dag. In DA-EPOCH-R wordt standaard G-CSF dag 6-15 gegeven (en langer indien nog neutropeen).
Overige
Denk aan methylcellulose en dexamethason oogdruppels 0,5% gedurende behandeling met systemisch cytarabine.
Denk aan eventueel cryopreservatie bij mannen.
Gezien de meestal snel progressieve ziekte is er over het algemeen geen tijd voor eicelpreservatie bij vrouwen. Bij laag-risico of lage ziekteload kan overleg met fertiliteit specialist overwogen worden.
Uitgangsvraag: Hoe dient BL met centraal zenuwstelsel (CZS) lokalisatie behandeld te worden?
Aanbeveling(en):
Inleiding
De incidentie van CZS betrokkenheid bij diagnose varieert in de literatuur, met een incidentie van 5 tot 40%.31-33 In een studie van Wasterlid et al15 heeft 8,5% van de 258 patiënten CZS betrokkenheid. In een studie van Zayac et al33had 19% van de 641 patiënten CZS betrokkenheid, waarvan het in het merendeel gaat om leptomeningeale lokalisatie. Zonder profylaxe ontwikkelt 30-50% uiteindelijk leptomeningeale ziekte. Profylaxe, bestaande uit intrathecale- en systemische MTX is effectief in het reduceren van de kans op een CZS recidief naar 2-11%8,34,35. In de studie van Roschewski werd alleen it profylaxe gegeven zonder hoge dosis MTX, of andere bloed-hersen-barrière passerende middelen. Er werd bij slechts 2% CZS relapse gezien. Ondanks de beperkte aantallen suggereert dit dat it profylaxe een effectieve manier van reductie van CZS relapse is. Voor patiënten met een bewezen CZS lokalisatie is it behandeling alleen onvoldoende, al is de bewijsvoering beperkt in de literatuur en wordt een regime met hoge dosis methotrexaat geadviseerd.
Presentatie met enkel centraal zenuwstelsel betrokkenheid is uiterst zeldzaam en zal dan ook niet afzonderlijk besproken worden.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B/C |
Bij Burkitt lymfoom met bewezen CZS lokalisatie dient R-CODOX-M/R-IVAC gekozen te worden. |
Samenvatting literatuur:
De literatuur specifiek over behandeling van CZS lokalisatie is beperkt / afwezig en de meeste ‘standaard’ behandelschema’s omvatten intraveneuze therapie met CZS penetrantie en/of intrathecale chemotherapie.
In de studie van Wasterlid et al15 is CZS betrokkenheid geen onafhankelijke risicofactor voor slechte prognose. Op basis hiervan wordt gesuggereerd dat hoog-intensieve chemotherapie met onder andere HD-MTX en cytarabine dus voldoende therapie is voor CZS lokalisatie.
In de studie van Zayac et al33 is CZS lokalisatie echter WEL geassocieerd met slechtere prognose: minder patiënten bereiken een CR (59% versus 77%, p<0,001), patiënten hebben een slechtere 3 jaar PFS (adjusted hazard ratio [aHR], 1.53, 95% confidence interval [CI], 1.14-2.06, P=0.004) en slechtere overall survival (aHR, 1.62, 95%CI, 1.18-2.22, P=0.003). Ook in deze studie werden patiënten met en zonder CZS lokalisatie op dezelfde manier behandeld (als patiënten zonder CZS lokalisatie). In regimes met intraveneuze systemische middelen met hoge CZS penetrantie is de incidentie van CZS recidief lager.
Ondersteunende therapie bij de behandeling
De behandeling van een Burkitt lymfoom dient te gebeuren in gespecialiseerde centra (echelon A/B/C-HIC) die hoog-intensieve hematologische zorg verlenen en beschikken over een afdeling intensieve zorgen met ervaring in hematologische problematiek. Onderstaande bevat een overzicht van de voornaamste, supportief te nemen maatregelen tijdens de behandeling met R-CODOX-M / R-IVAC.
Centraal veneuze lijn
R-CODOX-M en R-IVAC en DA-EPOCH-R dienen te worden toegediend via een centraal veneuze lijn.
Tumorlysis profylaxe
Er is bij het Burkitt lymfoom over het algemeen een hoog tumor lysis risico. Preventieve maatregelen middels (hyper)hydratie en allopurinol of rasburicase zijn aangewezen (conform eigen ziekenhuis protocol).
Profylaxe
Patiënten dienen selectieve darm decontaminatie te krijgen gedurende de neutropene periode volgens lokaal protocol. Daarnaast wordt PJP profylaxe geadviseerd.
Denk aan tijdig staken cotrimoxazol (3 dagen voor tot 5 dagen na) de hoge dosis methotrexaat.
Denk aan monitoring en profylaxe bij eerder doorgemaakte HBV infectie.
Intrathecale therapie
Denk aan de intrathecale profylaxe conform het schema in appendix 11. 24 uur na intrathecaal methotrexaat dient 15 mg folinezuur per os te worden toegediend.
Anticonceptie
Denk aan anticonceptie bij vrouwen voor de menopauze.
Groeifactoren
Denk aan het toedienen van filgrastim (vanaf dag 13 bij R-CODOX-M en vanaf dag 7 bij R-IVAC) tot de neutrofielen > 1.0x10E9/L. Dosering is afhankelijk van gewicht, =< 80kg is de dosis 300μg/dag; > 80kg is de dosis 480μg/dag. In DA-EPOCH-R wordt standaard G-CSF dag 6-15 gegeven (en langer indien nog neutropeen).
Overige
Denk aan methylcellulose en dexamethason oogdruppels 0,5% gedurende behandeling met systemisch cytarabine.
Denk aan eventueel cryopreservatie bij mannen.
Gezien de meestal snel progressieve ziekte is er over het algemeen geen tijd voor eicelpreservatie bij vrouwen. Bij laag-risico of lage ziekteload kan overleg met fertiliteit specialist overwogen worden.
Uitgangsvraag:
Wat is de behandeling van recidief Burkitt lymfoom?
Aanbeveling(en):
Onderbouwing
Inleiding:
De prognose van een refractair of recidief Burkitt lymfoom is zeer slecht. Met name patiënten met refractaire ziekte of een recidief binnen 6 maanden na initiële therapie hebben een zeer slechte prognose. Er zijn slechts case reports en case series die mogelijkheden voor therapie beschrijven.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
De prognose van recidief/refractair Burkitt lymfoom na standaard 1e lijn therapie is zeer slecht36 |
|
B |
Wanneer respons bereikt wordt met ≥ 2e lijn therapie, is consolidatie middels autologe of allogene stamceltransplantatie te overwegen.37-39 |
Samenvatting literatuur:
Er is een systematische literatuuranalyse gedaan.
Er werd gezocht naar artikelen in PubMed conform de onderstaande PICO. Tevens werd gezocht naar andere bestaande richtlijnen en review artikelen om expert opinie te onderzoeken.
PICO
|
Patients |
Non endemic HIV- Burkitt, relapse or refractory, >18j |
|
Intervention |
Treatment |
|
Control |
No treatment |
|
Outcome |
OS, PFS, ORR, QoL |
Exclusie: HIV geassocieerd, Burkitt leukemia.
Search 1: How I treat Burkitt
Search 2: Burkitt guideline
Search 3: Burkitt AND (relapse OR refractory) >1000 hits
Search 4: 3 + filter clinical trial + adult >18j (58 hits)
Search 5: Burkitt AND autologous + adult >18j (97 hits)
Search 6: Burkitt AND allogeneic (76 hits)
Search 7: Burkitt AND CAR-T (4 hits)
Search 8: burkitt AND cytarabine AND (Relaps* OR Refrac*) (67 hits)
Search 9: Burkitt AND DHAP (3 hits)
Search 10: Burkitt AND ICE (4 hits)
Search 11: Burkitt AND ibrutinib (8 hits)
Andere richtlijnen
ESMO: geen richtlijn.
NHS: wel richtlijn.
ASCO: uit 2018 paper JCO.
NL: geen oude richtlijn.
Resultaten.
Er zijn slechts beperkte gegevens over de behandeling en prognose van recidief of refractair Burkitt lymfoom. De grootste case serie van 35 patiënten, waarvan 28 therapie ontvingen, beschrijft een overall response rate van 39% op verschillende 2e lijns regimes: 3 patiënten met partiële respons en 8 patiënten met complete respons.36 Bij patiënten met een recidief <6 maanden of refractaire ziekte werd geen respons gezien, alle responders hadden een recidief 6 maanden of later na afronden van 1e lijn therapie. De overleving na 1 jaar was 11% en bij de patiënten met een respons was de relapse free survival ook slechts 18% (2 patiënten).
In de serie van Short werd meestal HyperCVAD herhaald bij een late relaps. Andere patiënten kregen ICE, EPOCH, MOAD of een ander regime. Naast de hierboven beschreven behandelingen zijn diverse case reports met een respons op therapie beschreven: met imexon40, doxorubicine/topotecan41, alisertib42, idelalisib43 en blinatumomab44. Voorts werd in een serie bij 21 kinderen en tieners ibrutinib met R-ICE gecombineerd met een redelijke respons van ruim 50%.45 De meeste van deze middelen zijn niet regulier vergoed en zullen op andere wijze verkregen moeten worden. Tot slot zijn enkele case-reports met respons op CD19 of sequentiële CD22 en CD19 CAR-T behandeling beschreven.46-48 Iets grotere series zijn bij kinderen beschreven met CD19 dan wel verscheidene sequentiële CAR-T producten.49,50 Overigens zijn deze responsen niet altijd duurzaam en wordt alsnog een hoge mortaliteit beschreven. Ook deze therapie zal op anders dan reguliere wijze verkregen moeten worden.
Er zijn twee case series die de toepassing van hoge dosis chemotherapie met autologe stamceltransplantatie beschrijven bij recidief/refractair Burkitt lymfoom.37,39 Deze beschrijven in geval er geen respons is een slechte overall survival van respectievelijk 7% na 3 jaar in de eerste serie en 22% na 5 jaar in de tweede serie. Bij chemoresponsieve ziekte wordt een overall survival van respectievelijk 37% na 3 jaar en 53% na 5 jaar beschreven.
Tot slot beschrijven 2 case series de toepassing van allogene stamceltransplantatie bij recidief/refractair Burkitt lymfoom.37,38 De studie van Peniket beschrijft alleen resultaten voor de gehele populatie, waarbij wel genoemd wordt dat response voorspellend is voor de uitkomsten: progressievrije survival, non relapse mortality en overall survival na 4 jaar van respectievelijk 35%, 31% en 37%. De studie van Maramattom37 beschrijft bij chemo-refractaire resp. chemo-sensitieve ziekte een overleving van 12% resp. 28% na 4 jaar.
Er zijn geen gegevens beschreven over de toepassing van centraal zenuwstelsel profylaxe tijdens tweede of verdere lijn therapie. Vanuit expert opinie kan worden aangenomen dat de kans op centraal zenuwstelsel relapse niet lager is dan in de eerste lijn en wordt opnieuw profylaxe aanbevolen. Ifosfamide passeert de bloed-hersen-barrière goed, dus aanvulling met HD-MTX lijkt met ICE niet nodig. Gemcitabine en cisplatin passeren beperkt de bloed-hersenbarriere. Bij DHAP wordt daarom HD-MTX op dag 10 aanbevolen. Voor GDP is geen goed advies te geven omdat er geen data zijn van HD-MTX op dag 10 na GDP. Toediening na afloop kan overwogen worden maar kan het traject richting autologe stamceltransplantatie vertragen.
Recidief centraal zenuwstelsel
Overwegingen: Er zijn geen studies gedaan naar behandeling van recidief Burkitt lymfoom in CZS. Prognose van deze patiënten is zeer slecht. Evt palliatieve adviezen zijn afhankelijk van eerder gegeven schema’s, respons hierop en verwachte toxiciteit. Deze adviezen zullen vooral gericht zijn op middelen met CZS penetratie (HD-ARA-C, MTX, carmustine, thiothepa, ifosfamide, lenalidomide, ibrutinib) of radiotherapie.
Algemeen
Inleiding
Respons evaluatie dient tijdens en na de behandeling plaats te vinden.
Samenvatting literatuur:
Interim evaluatie:
Bij de behandeling van hoog-risico BL wordt halverwege de behandeling (dus na 1 cyclus R-CODOX-M/R-IVAC of na 3 cycli DA-EPOCH-R) een CT scan geadviseerd.
Patiënten met progressieve ziekte dienen over te gaan naar tweedelijns therapie (zie hoofdstuk Recidief behandeling BL)
De rol van een interim PET scan bij hoog-risico patiënten is onduidelijk, zowel visuele als semi-quantitatieve analyses lijken niet te correleren met PFS en OS.10,12,13
Bij de behandeling van laag-risico BL met 3 R-CODOX-M kan een interim CT na 2 kuren overwogen worden. Bij behandeling met DA-EPOCH-R is interim PET gebruikt om laag-risico patiënten minder cycli DA-EPOCH-R te geven (zie hoofdstuk Eerstelijns behandeling van laag-risico BL)8
Eind evaluatie:
Na afloop van (eerstelijns) behandeling wordt de respons op de diagnostische CT-scan bij voorkeur beoordeeld conform de Lugano criteria 2014.51
Bij patiënten met onvoldoende respons (minder dan partiële respons op CT scan), kan salvage therapie overwogen worden (zie hoofdstuk Recidief behandeling BL).
Conclusie
|
SORT Grade |
Conclusie |
|
B |
Aan het einde van de behandeling wordt een PET-CT scan geadviseerd. |
|
C |
Bij interim analyse wordt een CT scan geadviseerd. Overweeg een PET-CT scan bij laag-risico patiënten die met DA-EPOCH-R behandeld worden (dan kan obv een negatieve interim PET-CT na 2 kuren met 3 cycli (ipv 6) volstaan worden) |
Algemeen
Na de behandeling van BL adviseert de werkgroep controle in eerste jaar 3-maandelijks en in het tweede jaar 6-maandelijks. Er is geen bewijs voor het maken van CT-scans dan wel FDG-PET/CT-scans gedurende follow-up. De werkgroep adviseert 2 jaar follow-up, gezien de kleine kans op een recidief na het tweede jaar.
In het geval van radiotherapie adviseert de werkgroep om de follow-up te verlengen tot levenslang indien er sprake is van grote velden waarin vitale organen zoals het hart, longen, grote vaten en mammae zitten.
|
AA |
Ann Arbor |
|
ASCO |
American Society of Clinical Oncology |
|
BL |
Burkitt lymfoom |
|
BL-IPI |
Burkitt lymphoma International Prognostic Index |
|
BM |
Beenmerg |
|
CAR T cellen |
Chimeric antigen receptor T cellen |
|
CMV |
Cytomegalovirus |
|
CR |
Complete respons |
|
CT |
Computer Tomografie |
|
CZS |
Centraal zenuwstelsel |
|
DA |
Dose adjusted |
|
DLBCL |
Diffuus grootcellig B cellymfoom |
|
Dm |
Dose modified |
|
EBER-ISH |
Epstein-Barr encoding region in situ hybridization |
|
ECG |
Electrocardiogram |
|
ECOG PS |
Eastern Cooperative Oncology Group performance score |
|
EFS |
Event free survival |
|
EOT |
End of treatment |
|
ESMO |
European Society for medical Oncology |
|
FDG-PET/CT |
[18F] fluorodeoxyglucose positron emissive tomografie in combinatie met een low dose CT |
|
FISH |
Fluorescent in situ hybridization’ |
|
FU |
Follow-up |
|
HIC |
Hematologische Intensive Care |
|
HIV |
Humaan immunodeficiëntievirus |
|
HOVON |
(stichting) Hemato-Oncologie voor Volwassenen Nederland |
|
i.t. |
intrathecaal |
|
i.v. |
intraveneus |
|
IKNL |
Integraal Kankercentrum Nederland |
|
LP |
Lumbaalpunctie |
|
MTV |
metabool tumor volume |
|
MUGA scan |
Multigated Acquisition scan |
|
NGS |
Next Generation Sequencing |
|
NHS |
National Health Service (Verenigd Koninkrijk) |
|
NVVH |
Nederlandse Vereniging voor Hematologie |
|
ORR |
Overall response rate |
|
OS |
Overall survival |
|
PFS |
Progression free survival |
|
PJP |
Pneumocystis jirovecii Pneumonie |
|
PNP |
Polyneuropathie |
|
p.o. |
Per os |
|
PR |
Partiële respons |
|
s.c. |
Subcutaan |
|
TLG |
total lesion glycolyse |
|
TLS |
Tumorlysis syndroom |
|
ULN |
Upper limit of normal |
|
WHO PS |
World health organisation performance score |
|
y |
year |
Schema dose modified R-CODOX-M
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1 |
Cyclofosfamide |
800mg/m |
i.v. |
In 30 min |
|
Vincristine |
1,5mg/m2 (max 2mg) |
i.v. |
In 15 min |
|
|
Doxorubicine |
40mg/m2 |
i.v. |
In 15 min |
|
|
Cytarabine |
70mg |
i.t. |
|
|
|
Rituximab |
375mg/m2 (max 800mg) |
i.v. |
Lokaal protocol |
|
|
Dag 2-5 |
Cyclofosfamide |
200mg/m2 |
i.v. |
In 30 min |
|
Dag 3 |
Cytarabine |
70mg |
i.t. |
|
|
Dag 8 |
Vinristine |
1,5mg/m2 (max 2mg) |
i.v. |
In 15 min |
|
Dag 9 |
Rituximab |
375mg/m2(max800mg) |
i.v. |
Lokaal protocol |
|
Dag 10 |
Methotrexaat |
≤65j 300mg/m2 >65j 100mg/m2
Nadien ≤65j 2700mg/m2 >65j 900mg/m2 |
i.v. |
In 60 min
Continue over 23u |
|
Dag 11 |
Leukovorin |
100mg
Nadien 100mg (i.v.) of 90mg (p.o.) |
i.v.
i.v. of p.o. |
36u na start MTX |
|
Dag 13 |
Filgrastim |
≤80kg 300 ug/d * >80kg 480ug/d * |
s.c. |
|
|
Dag 15 |
Methotrexaat Dexamethason of Prednison |
15mg 4mg of 20mg |
i.t. |
|
|
Dag 16 |
Leukovorin |
15mg |
p.o. |
24u na MTX |
* Vanaf dag 13 te continueren tot ANC >1.0×109/L
Bij laag-risico patiënten start de 2 cyclus op de dag dat ANC > 1,0×109/L zijn, ten minste 3 dagen nadat filgrastim gestaakt is en met trombocyten aantal > 75×109/L. Bij hoog-risico patiënten zie: R-IVAC.
Bij hoog-risico patiënten start R-IVAC op de dag dat ANC > 1,0×109/L zijn, ten minste 3 dagen nadat filgrastim gestaakt is en met trombocyten aantal > 75×109/L. R-IVAC moet (in principe) binnen 5 weken na de start van R-CODOX-M starten.
Schema R-IVAC
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1-5 |
Etoposide |
60mg/m2/dag |
i.v. |
In 60 mijn |
|
Dag 1-5 |
Isofosfamide |
≤65j 1500mg/m2/d >65j 1000mg/m2/d |
i.v. |
In 60 min |
|
Dag 1-5 |
Mesna |
≤65j 300mg/m2/d >65j 200mg/m2/d
Nadien ≤65j 300mg/m2/d >65j 200mg/m2/d |
i.v. |
In 60 min
Elke 3 uur
|
|
Dag 1-2 |
Cytarabine |
≤65j 2000mg/m2/d (2 maal) >65j 1000mg/m2/d (2 maal) |
|
In 3 uur, elke 12 uur (totaal 4 doses) |
|
Dag 3 |
Rituximab |
375mg/m2/d (max 800mg) |
|
Lokaal protocol |
|
Dag 5 |
Methotrexaat Dexamethason of Prednison |
15mg 4mg of 20mg |
i.t. |
|
|
Dag 6 |
Leukovorin |
15mg |
p.o. |
24u na MTX |
|
Dag 7 |
Rituximab |
375mg/m2 (max 800mg) |
i.v. |
Lokaal protocol |
|
Dag 7 |
Filgrastim |
≤80kg 300ug/kg/d * >80kg 480 ug/kg/d * |
s.c. |
|
* Vanaf dag 7 te continueren tot ANC >1.0×109/L
Na 1 maal R-CODOX-M / R-IVAC volgt een responsmeting middels CT hals-thorax-abdomen. Bij respons wordt een 2e R-CODOX-M / R-IVAC gegeven. De volgende R-CODOX-M start op de dag dat ANC > 1,0×109/L is, ten minste 3 dagen nadat filgrastim gestaakt
Patienten starten behandeling met DA-EPOCH-R in dose level 1 (zie Dose modifications for toxicity during DA-EPOCH-R therapy) tijdens de eerste cyclus, volgens onderstaand schema. In volgende cycli zal de dosis voor doxorubicine, etoposide en cyclofosfamide worden verlaagd of verhoogd zoals beschreven in ‘Dose modifications for toxicity during DA-EPOCH-R therapy’.
|
Dag |
Middel |
Dosis |
Route |
Tijd |
|
Dag 1e |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
Lokaal protocol |
|
Dag 1 (cyclus 1 t/m 4)a |
Methotrexate |
15 mg |
i.t. d |
|
|
Dag 1 (cyclus 1 t/m 4)b |
Optional: Dexamethason or Prednisolon |
4 mg
25 mg |
i.t. d |
|
|
Dag 1-4 |
Etoposide |
afh van dose level (zie 11.3.1) |
i.v. |
Continue infusie 96 uur |
|
Dag 1-4 |
Doxorubicine |
afh van dose level (see 11.3.1) |
i.v. |
Continue infusie 96 uur |
|
Dag 1-4
|
Vincristine |
0.5 mg/dag |
i.v. |
Continue infusie 96 uur |
|
Dag 5 (cyclus 1 en 2 only), |
Rituximab |
375 mg/m2 (max 800 mg) |
i.v. |
Lokaal protocol |
|
Dag |
Cyclofosfamide |
afh van dose level (see 11.3.1) |
i.v. |
bolus |
|
Dag (cyclus 1-4) only)a |
Cytarabine |
70 mg |
i.t. d |
|
|
Dag 1-5 |
Prednisolon |
120 mg/m2 /dag |
p.o. |
60 mg/m2 b.i.d. |
|
Dag 6-15 of langer tot ANC > 5 x109/l boven nadir |
G-CSF |
≤ 80 kg 300 μg /dag > 80 kg 480 μg /dag |
s.c. |
|
a In totaal dienen 8 profylactische intrathecale injecties te worden gegeven. Twee injecties kunnen ook worden uitgesteld tot cyclus 5 of 6 (afhankelijk van de keuze van de arts of het gemak van de patiënt).
b i.t. volgens het lokale protocol kan dexamethason of prednisolon worden gegeven om arachnoïditis te voorkomen
c In totaal moeten 8 infusies met rituximab worden gegeven: in cyclus één en twee een oplaaddosis van twee infusies (op dag 1 en dag 5) en vanaf cyclus drie slechts één infusie op dag 1
d Lokale richtlijnen voor de toediening van intrathecale chemotherapie kunnen worden gevolgd. Dit kan betekenen dat de intrathecale chemotherapie op een andere dag wordt toegediend dan gespecificeerd hierboven.
e In geval van circulerende tumorcellen kan rituximab op dag 1 worden uitgesteld tot dag 10 (+ of -1 dag) om tumorlysis te voorkomen
Herhaal de cyclus na 21 dagen, Stel volgende cyclus uit tot ANC > 1 x 109/l en bloedplaatjes > 75 x 109/l. Als er na 21 dagen geen herstel is, gebruik dan G-CSF om de ANC te verhogen en begin met de volgende cyclus zodra het ANC herstelt.
Patiënten krijgen in totaal 6 cycli. Na 3 cycli vindt een responsevaluatie met CT-scan plaats. (Mid-treatment 18F-FDG PET wordt alleen gemaakt op indicatie). Bij respons of stabiele ziekte heeft, zullen nog eens 3 cycli DA-EPOCH-R worden gegeven.
De eerste kuur starten alle patiënten op dose level 1. Zodra sprake is van hematologisch herstel, gedefinieerd als ANC >1.0 × 10⁹/l en trombocyten >75 x 10⁹/l kan gestart worden met de volgende kuur. Voorafgaand aan de start van een volgende kuur wordt, aan de hand van neutrofielen en trombocyten getallen tijdens de vorige kuur, het nieuwe dose level bepaald voor doxorubicine, etoposide en cyclofosfamide. Daarom is het van groot belang dat deze patiënten in week 2 en 3 van de cyclus ook daadwerkelijk 2x/week gecontroleerd worden, om exact te kunnen zien hoe diep een eventuele neutro- en trombopenie is. Er moet 3 dagen zitten tussen de bloedafnames. Ook als er vaker bloed is geprikt gelden 2 waarden, waarbij de laagste waarde altijd wordt meegenomen.
Of
|
Drug |
Dosering per Dose Level |
|||||||
|
-2 |
-1 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
Doxorobucine (mg/m2/day) |
10 |
10 |
10 |
12 |
14.4 |
17.3 |
20.7 |
24.8 |
|
Etoposide (mg/m2/day) |
50 |
50 |
50 |
60 |
72 |
86.4 |
103.7 |
124.4 |
|
Cyclophosphamide (mg/m2/day) |
480 |
600 |
750 |
900 |
1080 |
1296 |
1555 |
1866 |
Dosisaanpassingen voor vincristine in geval van polyneuropathie worden gedaan naar oordeel van de behandelend arts (zie evt http://www.bccancer.bc.ca/)
Schema voor R-GDP kuren
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1-4 |
Dexamethason |
40mg |
p.o |
– |
|
Dag 1 |
Gemcitabine |
1000mg/m2 |
i.v. |
30 min |
|
Dag 1 |
Cisplatin |
75mg/m2 |
i.v. |
24 uur |
|
Dag 1 |
Rituximab |
375mg/m2 |
i.v. |
Lokaal protocol |
|
Dag 8 |
Gemcitabine |
1000mg/m2 |
i.v. |
30 min |
De cycli worden elke 21 dagen gegeven. Patiënten krijgen tot 3 cycli in totaal. Na 2 cycli volgt een interim respons evaluatie met CT-scan. Afhankelijk van de overwegingen/mogelijkheden voor consolidatie therapie kan al dan niet een 3e cyclus worden gegeven.
Schema voor R-DHAP kuren gecombineerd met hoge dosis methotrexaat
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1 |
Rituximab |
375mg/m2 |
i.v. |
Lokaal protocol |
|
Dag 1-4 |
Dexamethason |
40mg |
Dag 1 i.v, nadien oraal |
– |
|
Dag 1 |
Cisplatin |
100mg/m2 |
i.v. |
24 u |
|
Dag 2 |
Cytarabine |
2000mg/m2/d (2 maal) |
i.v. |
In 3 uur, elke 12 uur |
|
Dag 1,2 |
Hyperhydratie |
|
|
|
|
Dag 15 |
Methotrexaat |
300mg/m2
Nadien 2700mg/m2 |
i.v. |
60 min
Continue over 23u |
|
Dag 16 |
Leukovorin |
100mg
Nadien 100mg (i.v.) of 90mg (p.o.) |
i.v.
i.v. of p.o. |
36u na start MTX |
De cycli worden elke 28 dagen gegeven. Patiënten krijgen tot 3 cycli in totaal. Na 2 cycli volgt een interim respons evaluatie met CT-scan. Afhankelijk van de overwegingen/mogelijkheden voor consolidatie therapie kan na 2e of 3e cyclus stamceloogsting worden verricht.
Schema voor R-ICE kuren
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1 |
Rituximab |
375mg/m2 |
i.v. |
Lokaal protocol |
|
Dag 3-5 |
Etoposide |
100mg/m2 |
i.v. |
1 uur |
|
Dag 4 |
Carboplatin |
AUC = 5* (maximaal 800mg) |
i.v. |
30 min |
|
Dag 4 |
Ifosfamide gemengd met mesna |
Beiden 5000mg/m2 |
i.v. |
24 uur |
|
Dag 7-14 |
G-CSF |
5mcg/kg |
|
|
* Dosis = 5x[25+kreat klaring]; bij opname de kreatinine klaring berekenen.
De cycli worden elke 21 dagen gegeven. De volgende kuur start wanneer neutrofielen minimaal 1×109/L en trombocyten 50×109/L zijn. Patiënten krijgen tot 3 cycli in totaal. Na 2 cycli volgt een interim respons evaluatie met CT-scan. Afhankelijk van de overwegingen/mogelijkheden voor consolidatie therapie kan al dan niet een 3e cyclus worden gegeven.
|
Dag |
Middel |
Dosering |
Toedieningsweg |
Tijd |
|
Dag 1-4 |
Cytarabine |
2 dd 2000 mg/m2 |
i.v. |
3 uur |
|
Dag 1, dag 11 |
Rituximab |
375 mg/m2 |
i.v. |
Lokaal protocol |
|
Dag 1-10 |
Dexamethason oogdruppels |
2 dd 1 druppel |
oculair |
|
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie
Uiterlijk in 2024 bepaalt het bestuur van de HOVON of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De HOVON is als houder van deze richtlijn de eerst verantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.