Chronische Lymfatische Leukemie / kleincellig lymfocytair lymfoom
Autorisatiedatum: 10-12-2024
Terug naar het richtlijnenoverzicht
Terug naar het richtlijnenoverzicht
Chronische lymfatische leukemie (CLL) is de meest voorkomende leukemie in Nederland, met elk jaar ongeveer 600 nieuwe patiënten. De ziekte komt vooral voor bij oudere mensen, vaker bij mannen dan bij vrouwen. De behoefte aan uniform beleid in Nederland, de snelle ontwikkelingen in diagnostiek en behandelingsmogelijkheden, de stijgende kosten van de behandeling (vooral van de nieuwe middelen), maken een breed gedragen richtlijn noodzakelijk, waardoor een update nodig was van de richtlijn van 2021. Uitgangspunten bij het maken van behandelkeuzes in deze richtlijn waren: bewijs vanuit goed opgezette studies (bij voorkeur: gerandomiseerde gepubliceerde studies), effectiviteit (progressie-vrije overleving (PFS), tijd tot volgende behandeling (TTNT) en overleving (OS), langst bekende effectieve behandelsequentie, toxiciteit, behandelduur en behandelzwaarte. In de meeste studies bij CLL is het primaire eindpunt progressie vrije overleving. Het is echter onzeker of dit relevant is voor de overleving. Data over kwaliteit van leven en patiënt-gerelateerde uitkomsten (PROMS) ontbreken vaak in de registratie studies, en die er zijn tonen geen correlatie met PFS of TTNT. Wel hebben verschillende behandelopties een verschil in behandelduur, een ander bijwerkingen profiel en is er verschil in bekendheid van effectieve behandellijnen. Door relatieve prematuriteit van lange termijn data en het beschikbaar komen van zeer effectieve behandelingen in de recidief setting is er nog geen duidelijkheid of nieuwe behandelingen in de eerste lijn uiteindelijk ook tot verbeterde OS leiden. Er is derhalve niet altijd een “beste” behandeloptie, daarom geeft de werkgroep in de onderbouwing een toelichting op de verschillende opties. In deze CLL richtlijn zijn de aanbevelingen gebaseerd op basis van effectiviteit en niet gebaseerd op basis van kosten. Alhoewel de prijs voor chemo-immunotherapie substantieel lager is dan van nieuwe middelen zijn desondanks de werkelijke kosten van de behandelingen niet bekend en zijn er nog geen kosteneffectiviteit-studies beschikbaar in Nederland.
Deze richtlijn is bedoeld ter optimalisering van diagnostiek, behandeling en follow-up van CLL en toepasbaar in alle Nederlandse ziekenhuizen. (Geen echelonering van toepassing).
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met CLL, zoals internist-hematologen, internist-oncologen en verpleegkundig specialisten.
De HOVON-CLL-werkgroep verricht studies met financiële ondersteuning van de volgende firma’s: Abbvie, Astra Zeneca, Janssen.
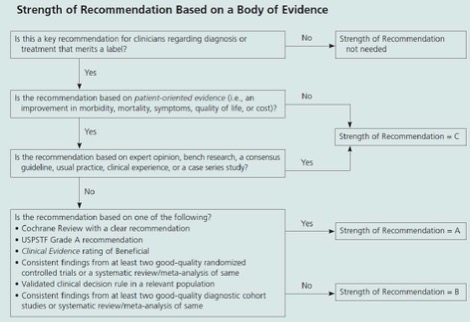
SORT grading
Kwaliteitsindicatoren
Kwaliteitsindicator diagnostiek bij diagnose
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Immunofenotypering volgens richtlijn
Kwaliteitsindicator behandeling 1
Behandelindicatie en behandelplan conform advies richtlijn
Kwaliteitsindicator behandeling 2
Cytogenetica (FISH) 17p-deletie of TP53-mutatie verricht vooraf aan behandeling
De conceptrichtlijn is voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Circa [5] respondenten maakten van deze mogelijkheid gebruik. Alle commentaren werden vervolgens beoordeeld en verwerkt door de werkgroep. De richtlijn werd op [01-09-2016] door de HOVON-CLL-werkgroep inhoudelijk vastgesteld. Ten slotte is de richtlijn ter autorisatie gestuurd naar de Nederlandse Vereniging voor Hematologie.
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder de professionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
Module 1: Diagnose CLL
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie Immunofenotypering (zie tabel 1)
Pathologie:
Voor de diagnose CLL is pathologische diagnostiek niet nodig. In geval van de diagnose SLL, dient wel pathologische confirmatie plaats te vinden.
Module 2: Stadiëring CLL
Stadiëring volgens Rai en Binet (tabel 2)
Vaststellen actieve ziekte (tabel 3)
Vaststellen behandelindicatie (tabel 4)
Module 3: Diagnostiek voor start behandeling
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Nierfunctie, leverfunctie, immuunglobulines, directe antiglobuline-test
Serologie hepatitis B, hepatitis C, HIV
Cytogenetica (FISH of Comparative genomic hybridization (CGH)-array): Tenminste 17p-deletie met cut-off 10%
Moleculair onderzoek aanwezigheid TP53-mutatie (aanwezigheid is: óf mutatie aangetoond met Sanger sequencing óf mutaties > 10% met next generation sequencing)
IGHV-mutatiestatus, met cutoff 2% (eventueel achterwege laten indien geen consequentie voor therapie-keuze. Subset 2 wordt gekarakteriseerd door expressie van stereotype B-cel receptor immunoglobulines (o.a. IGHV3-21/IGLV3-21).
NB voor moleculaire metingen, m.n. TP53-mutatie en IGHV-mutatiestatus heeft het de sterke voorkeur om dit te verrichten in een laboratorium met een ERIC certificaat voor de desbetreffende test, zie: http://www.ericll.org/diagnostics/
Beenmergonderzoek indien twijfel oorzaak trombocytopenie of anemie (vraagstelling: verdringing of auto-immuun afbraak)
Beeldvorming:
Eventueel CT-hals-thorax-abdomen volgens Cheson-criteria beoordelen (achterwege laten indien geen consequenties voor inschatten van tumorlyse risico of voor respons evaluatie).
Overweeg PET-CT indien er verdenking is op Richterse Transformatie.
Stadiëring volgens CLL-IPI score (tabel 5)
Stadiering SLL: gelijk aan lymfoom volgens Ann-Arbor criteria
Module 4: 1e lijns behandeling
Open/geplande HOVON-studies
1e lijns behandeling patiënten zonder of VAF < 10% 17p-deletie of TP53-mutatie met gemuteerde IGHV-status
Fitte patiënten:
1e keus: CIT:
2e keus: Venetoclax-Obinutuzumab (Ven-O)
Niet fitte patiënten:
1e keus: Chloorambucil-obinutuzumab (Chl-O)
2e keus: Chloorambucil-rituximab (Chl-R) òf Venetoclax-Obinutuzumab (Ven-O)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib
1e lijns behandeling patiënten zonder of VAF < 10% 17p-deletie of TP53-mutatie met ongemuteerdeIGHV-status en/of subset 2
Fitte patiënten, ≤ 65 jaar:
1e keus: Fludarabine-cyclofosfamide-rituximab (FCR) òf venetoclax-obinutuzumab (Ven-O)
2e keus: venetoclax-ibrutinib (Ven-I)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib
Fitte patiënten, > 65 jaar:
1e keus: Bendamustine-rituximab (BR90) òf venetoclax-obinutuzumab (Ven-O)
2e keus: venetoclax-ibrutinib (Ven-I)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib
Niet fitte patiënten:
1e keus: Chloorambucil-obinutuzumab òf venetoclax-obinutuzumab (Ven-O)
2e keus: Chloorambucil-rituximab (Chl-R) òf venetoclax-ibrutinib (Ven-I)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib
1e lijns behandeling patiënten met del (17p) of TP53 ≥ 10%
1e keus: Acalabrutinib òf ibrutinib òf zanubrutinib òf venetoclax-ibrutinib (Ven-I)
2e keus: Venetoclax-obinutuzumab (Ven-O)
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Module 5: Recidief behandeling
Open/geplande HOVON-studies
Recidief behandeling bij patiënten met een laat recidief zonder of VAF < 10% del (17p) of TP53
Patiënten met behandelindicatie ten minste 6 jaar na FCR, ten minste 4 jaar na bendamustine-rituximab of ten minste 2 jaar na chloorambucil-bevattende therapie:
1e keus: Venetoclax-rituximab (Ven-R)
2e keus: Chemo-immunotherapie*
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib
*fit: BR70, niet-fit: Chl-O of Chl-R
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Behandeling vroeg recidief, refractaire ziekte of recidief met del (17p) of TP53-mutatie ≥ 10% na eerdere chemotherapie of recidief na eerdere targeted therapie
Indien 1e lijn CIT:
Indien 1e lijn BTK-remmer:
Indien 1e lijn Ven-O:
Indien dubbel exposed maar niet refractair:
Indien dubbel exposed en refractair:
NB: deze groep patiënten heeft een zeer slechte prognose, daarom: overweeg behandeling in trial verband
Overweeg allogene stamceltransplantatie als consolidatie, indien in remissie bovenstaande behandelopties (zie module 6).
Module 6: Overwegingen voor allogene stamceltransplantatie
Module 7: Therapieschema’s
Module 8: Supportive care bij doelgerichte therapie en chemo-immunotherapie
Algemeen:
Infectiepreventie:
PCP-profylaxe met cotrimoxazol 1 dd 480 mg, tot 12 maanden na FCR, bendamustine-rituximab, idelalisib-rituximab.
Herpesprofylaxe op indicatie volgens lokale protocol
Geen standaard PCP-, herpes- en antischimmel profylaxe bij BTKi en venetoclax
Monitoring CMV-infectie bij PI3Ki, bijvoorbeeld 1x per maand
Bestraalde bloedproducten tot 6 maanden na FCR
Hieronder volgen specifieke richtlijnen tav toxiciteit door targeted therapieën
Venetoclax:
Tumorlyse-preventie bij venetoclax
Bereken tumorlyse risico volgens tabel 7
Neem voorzorgsmaatregelen ter preventie van tumorlyse volgens tabel 8
Volg ramp-up in dosering van venetoclax volgens tabel 6
Waarborg controle van laboratoriumuitslagen volgens tabel 8
Neutropenie bij venetoclax:
Als alleen neutropenie: start G-CSF, stop 1 week venetoclax en hervat daarna. Overweeg tijdelijk dosis halvering.
Omgaan ten aanzien van CYP3A4 remmers en inductoren bij Venetoclax:
Absolute contra-indicatie voor sterke CYP3A4 remmers, zoals ketaconazol
Relatieve contra-indicatie voor CYP3A4 remmers, zoals verapamil, diltiazem, amiodarone, voriconazol en itraconazol en P-glyco-proteinesubstraten zoals digoxine. Overleg met apotheker ten aanzien van dosisreductie
BTK-remmer (BTKi; acalabrutinib, ibrutinib en zanubrutinib)
Verhoogd bloedingsrisico:
Absolute contra-indicatie voor BTKi indien gebruik van vitamine-K-antagonist of DOAC in combinatie met een trombocytenaggregatieremmer of indien dubbele trombocytenaggregatieremmers
Switch bij voorkeur vitamine-K-antagonisten naar een DOAC
Staak BTKi, 3-7 dagen, rondom invasieve ingrepen
Staak BTKi bij een ernstige bloeding en dien trombocytentransfusie toe
Indien BTKi gestopt dient te worden en er geen spoed is, dan dient afgebouwd te worden bij patiënten die recent gestart zijn (<6 maanden na start), om tumor flare van CLL te voorkomen.
Atriumfibrilleren bij BTKi:
BTKi kan gecontinueerd worden bij atriumfibrilleren
Gebruik bij voorkeur een beta-blokker als anti-aritmica (gezien interactie van andere anti-aritmica en ibrutinib)
Start bij voorkeur een DOAC als antistolling noodzakelijk is; weeg bloedings- en trombose risico af.
Hypertensie bij BTKi:
Controleer bij elk polibezoek de bloeddruk en behandel zo nodig met een antihypertensivum. Op basis van de pathofysiologie en klinische ervaring blijken calciumantagonisten met name effectief te zijn.
Omgaan ten aanzien van CYP3A4 remmers en inductoren bij BTKi:
Absolute contra-indicatie voor sterke CYP3A4 remmers, zoals ketaconazol
Relatieve contra-indicatie voor CYP3A4 remmers, zoals verapamil, diltiazem, amiodarone, voriconazol en itraconazol en P-glyco-proteinesubstraten zoals digoxine.
Overweeg dosisreductie van BTKi bij vermoede toxicitieit van BTKi
Omgaan ten aanzien van protonpomp remmers bij BTKi:
De opname van acalabrutinib (niet de andere BTKi) wordt sterk verlaagd door PPI’s. Sterke voorkeur om PPI te staken. (NB: de nieuwe formulering van acalabrutinib is niet gevoelig voor een slechtere opname bij PPI (ten tijde van publicatie van deze richtlijn is de nieuwe formulering nog niet overal beschikbaar).
Infecties bij BTKi:
Overweeg tijdens een ernstige infectie BTKi tijdelijk te staken (pas op voor flare-up bij recent starten van BTKi, zie hierboven)
PI3Ki (Idelalisib):
Diarree en pneumonitis bij PI3Ki:
Staak PI3Ki bij gr 1-2 diarree, die langer dan 3 dagen aanhoudt en bij gr 3-4 diarree.
Staak PI3Ki zo nodig bij longklachten en hoge resolutie CT-afwijkingen niet passend bij lobaire pneumonie.
Dien zo nodig corticosteroïden toe
Transaminitis bij PI3Ki:
Monitor frequent ASAT en ALAT, met name in de 1e 3 maanden
Staak zo nodig PI3Ki of dien corticosteroïden toe
Module 9: Behandeling van CLL-gerelateerde complicaties
Behandeling complicaties
Warmte auto-immuun anemie of trombocytopenie:
Indien geen indicatie voor behandeling CLL zelf, dan behandeling gelijk aan primaire AIHA dan wel ITP
AIHA:
Indien geen respons op prednison/rituximab, dan CLL behandelen
Bij fulminante AIHA (levensbedreigend/grote transfusiebehoefte) wordt geadviseerd te overleggen met een expertisecentrum mbt AIHA.
Indien geen respons op steroïden/rituximab, dan CLL behandelen; dit heeft de voorkeur boven TPO-agonisten (SORT C)
Immuun cytopenie na purine-analogen:
Staken purine-analogen, start prednison 1 mg/kg
Indien geen verbetering: overweeg ciclosporine toevoegen
Recidiverende luchtweginfecties
Bij recidiverende infecties wordt naast diagnostiek allereerst antibiotica on demand aanbevolen. In het geval van ≥ 3 infecties per jaar is profylactisch antibiotica aangewezen: cotrimoxazol 1 dd 960 mg, azitromycine 3 keer per week 250mg of doxycycline 1 dd 100 mg (figuur 3).
Overweeg immunoglobuline suppletie bij:
Dosering immuunglobulines: 200-400mg/kg/week per 3-4 weken. Intraveneuze toediening of subcutane toediening is mogelijk. Streef een dalspiegel in geval van recidiverende infecties > 6 g/L of bij aanhoudende infecties en/of bij structurele schade (bronchiëctasieën) > 8 g/L.
Therapie evaluatie: Het effect van Immuunglobuline suppletie na 6 maanden tot 1 jaar evalueren. Indien de infecties onder controle zijn kan een dosisverlaging of op proef staken overwogen worden. Bij patiënten met complicaties is levenslange immuunglobuline suppletie geïndiceerd.
Vaccinaties:
Zie voor aanbevolen vaccinaties, richtlijn RIVM
Indien tijd het toelaat is de aanbeveling om vaccinaties te geven voorafgaand aan het starten van een behandeling. Dit geldt mn voor anti-CD20 bevattende behandeling en BTK-i.
Symptomatische lymfadenopathie en/of splenomegalie bij patiënt met contra-indicatie voor systemische therapie:
Radiotherapie 2×2 Gy
Aanvullende/complementaire zorg:
Voor aanvullende adviezen tav complementaire zorg, zie website van kanker.nl: https://www.kanker.nl/gevolgen-van-kanker/complementaire-zorg-aanvullende-zorg-bij-kanker/algemeen/complementaire-zorg-bij-kanker
Module 10: Follow-up en responsbeoordeling
Follow-up bij niet progressieve CLL zonder klinische symptomen:
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties.
Lichamelijk onderzoek: zo nodig vastleggen van grootte van lymfklieren, lever en milt
Bloedonderzoek: Hb, leukocyten, trombocyten, leukocytendifferentiatie
Follow-up CLL tijdens/na behandeling
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties.
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt
Bloeddrukregulatie gezien bijwerking hypertensie bij BTKi
Bloedonderzoek:
Beenmergonderzoek:
Indien cytopenie of indien consequenties bij complete remissie of minimale restziekte (zoals in studies)
Beeldvorming:
CT hals-thorax-abdomen volgens Cheson-criteria beoordelen (achterwegen laten indien geen consequenties)
Measurable residual disease (MRD):
In veel studies wordt MRD gemeten met flowcytometrie of met moleculair onderzoek. Voor zowel CIT als time-limited behandeling met venetoclax + een antistof correleert MRD sterk met PFS. Buiten studies echter, is er op dit moment geen klinische meerwaarde van het bepalen van MRD bij de respons evaluatie.
Er lopen studies naar behandelduur obv MRD, maar dat wordt buiten studies op dit moment niet toegepast.
Aanbevelingen
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Immunofenotypering (zie tabel 1) (SORT C)
Pathologie:
Voor de diagnose CLL is pathologische diagnostiek niet nodig. In geval van de diagnose SLL, dient wel pathologische confirmatie plaats te vinden.
Tabel 1: Immunofenotypering bij CLL1
|
Minimaal vereist |
|
|
CD19 |
Positief |
|
CD20 |
doorgaans zwakke expressie |
|
CD5 |
Positief |
|
CD23 |
Positief |
|
Kappa, Lambda |
Zwakke expressie, afwijkende ratio |
|
Additionele markers |
|
|
CD200 |
Positief |
|
CD43 |
Positief |
|
CD79b |
zwak tot negatief |
Achtergrondinformatie diagnostiek bij diagnose1,2
Bij CLL is er sprake van lymfocytose met in de morfologie van het perifere bloed kapot gestreken lymfocyten en kleine lymfocyten met grumelée kernstructuur.
Voor de diagnose CLL moet bij immunofenotypering het aantal circulerende monoklonale B-cellen >5 x 10^9/l zijn en de immunofenotypering passend bij CLL (o.a. CD19-positief, CD5-positief, CD23-positief).
De diagnose kleincellig lymfocytair lymfoom (‘small lymphocytic lymphoma’= SLL) kan gesteld worden, wanneer er lymfadenopathie en/of splenomegalie is, het aantal circulerende monoklonale B-cellen <5 x 10^9/l is en in de lymfklier een celbeeld met lymfoïde cellen met grumelée kernstructuur in combinatie met bij CLL/SLL passende membraanmarkers gezien wordt.
Indien het aantal circulerende monoklonale B-cellen <5 x 10^9/l is, er geen lymfadenopathie of organomegalie is, er geen cytopenie en geen ziektegerelateerde symptomen zijn, dan is er sprake van monoklonale B-lymfocytose (MBL). Bij MBL is de kans op progressie tot CLL met behandelindicatie doorgaans erg laag (rondom de 1%) en is specialistische follow-up niet noodzakelijk.
Literatuurverantwoording
Er is gebruik gemaakt van de ondergenoemde richtlijnen zonder aanvullende systematische literatuur-analyse:
Aanbevelingen
Stadiëring volgens Rai of Binet (tabel 2)
Vaststellen actieve ziekte (tabel 3)
Vaststellen behandel indicatie (tabel 4)
Tabel 2: Gereviseerde stadiering volgens Rai en Binet1
|
Stadium |
Definitie |
|
Rai |
|
|
Laag risico |
|
|
Rai 0 |
Lymfocytose > 5 x 10^9/l |
|
Intermediair risico |
|
|
Rai I |
Lymfocytose en lymfadenopathie |
|
Rai II |
Lymfocytose en hepato/splenomegalie met/zonder lymfadenopathie |
|
Hoog risico |
|
|
Rai III |
Lymfocytose en Hb <6,9 mmol/l* met/zonder lymfadenopathie/organomegalie |
|
Rai IV |
Lymfocytose en trombocytopenie <100 x 10^9/l* met/zonder lymfadenopathie/organomegalie |
|
Binet |
|
|
Binet A |
Hb ≥6,2 mmol/L, trombocyten ≥100 x 10^9/l, <3 lymfklierstations Hb ≥6,2 mmol/l, trombocyten ≥100 x 10^9/l, ≥3 lymfklierstations Hb <6,2 mmol/l, trombocyten <100 x 10^9/l* |
|
Binet B |
|
|
Binet C |
|
* indien anemie en trombocytopenie niet veroorzaakt wordt door autoantistoffen
Tabel 3: Criteria voor actieve ziekte1
Minstens 1 van de volgende criteria dient aanwezig te zijn:
|
1. |
Minstens 1 van de volgende ziektegerelateerde symptomen: a. Gewichtsverlies ≥10% in voorafgaande 6 maanden b. Extreme vermoeidheid (‘WHO-performance status’ ≥2) c. Koorts ≥38,6 °C gedurende ≥2 weken, in afwezigheid van infecties d. Nachtzweten gedurende meer dan een maand zonder aanwijzing voor infectie |
|
2. |
Toenemend beenmergfalen, zich uitend in ontwikkeling van of verergering van anemie en/of trombocytopenie |
|
3. |
Auto-immuun anemie en/of trombocytopenie die slecht reageert op 1e of 2e lijns behandeling |
|
4. |
Massale (>6 cm onder linker ribbenboog) of progressieve splenomegalie |
|
5. |
Massale klieren of pakketten (>10 cm in grootste diameter) of progressieve lymfadenopathie |
|
6. |
Progressieve lymfocytose met een stijging > 50% binnen 2 maanden, of een geanticipeerde verdubbelingstijd van minder dan 6 maanden |
Tabel 4: Indicaties voor start behandeling1
|
Behandeling Rai 0 of Binet A |
Nee |
|
Behandeling Rai I/II of Binet B |
Mogelijk (indien actieve ziekte; zie tabel 3) |
|
Behandeling Rai III/IV of Binet C |
Ja |
Onderbouwing
Achtergrondinformatie stadiëring1
Het klinisch stadium volgens Rai en Binet, waarbij het ziektestadium wordt gebaseerd op aan- of afwezigheid en uitgebreidheid van lymfadenopathie, spleno- en/of hepatomegalie en beenmergverdringing, wordt nog steeds gebruikt om mediane overleving te voorspellen en indicatie voor behandeling vast te stellen.1 Bij uitgebreid ziektestadium is er altijd een behandelindicatie. Bij vroeg stadium ziekte is er alleen behandelindicatie, indien er actieve ziekte aanwezig is. De criteria voor actieve ziekte bestaan uit ziekte-gerelateerde symptomen, beenmerg falen, refractaire auto-immuun anemie of trombocytopenie en de mate en progressie van splenomegalie, lymfadenopathie en lymfocytose. Voor het berekenen van progressieve lymfocytose is een uitgangswaarde vanaf 30 x 10^9/L een goede grens. Grenswaardes voor anemie <6,5 mmol/l of trombocytopenie <100 x 10^9/l kunnen aangehouden worden voor beenmerg falen, maar indien trombocytopenie stabiel is gedurende langere tijd hoeft dit niet automatisch te leiden tot behandelindicatie.
Er is gebruik gemaakt van de onderstaande richtlijn zonder aanvullende systematische literatuur-analyse:
Aanbevelingen
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Nierfunctie, leverfunctie, immuunglobulines, directe antiglobuline-test, beta2- microglobuline
Serologie hepatitis B, hepatitis C, HIV; hepatitisserologie m.n. van belang bij anti-CD20 behandeling. Indien positief, load m.b.v. PCR vervolgen en zo nodig start secundaire profylaxe
Cytogenetica (FISH of Comparative genomic hybridization (CGH)-array): tenminste 17p-deletie met cut-off 10%
Moleculair onderzoek aanwezigheid TP53-mutatie (aanwezigheid is: óf mutatie aangetoond met Sanger sequencing óf mutaties > 10% met next generation sequencing)
IGHV-mutatiestatus, met cutoff 2% (eventueel achterwege laten indien geen consequentie voor therapiekeuze). Subset 2 wordt gekarakteriseerd door expressie van stereotype B-cel receptor immunoglobulines (o.a. IGHV3-21/IGLV3-21).
NB voor moleculaire metingen, mn TP53-mutatie en IGHV-mutatiestatus is de grote voorkeur om dit te verrichten in een laboratorium met een ERIC certificaat voor de desbetreffende test, zie: http://www.ericll.org/diagnostics/ .
Beenmergonderzoek indien twijfel oorzaak trombocytopenie of anemie (vraagstelling: verdringing of auto-immuun afbraak)
Beeldvorming:
Eventueel CT hals-thorax-abdomen volgens Cheson-criteria beoordelen (achterwege laten indien geen consequenties voor inschatten van tumorlyse risico of voor respons evaluatie).
Overweeg PET-CT indien er verdenking is op Richterse Transformatie.
Stadiëring volgens CLL-IPI score (tabel 5)
Stadiering SLL: gelijk aan lymfoom volgens Ann-Arbor criteria
Onderbouwing
Achtergrondinformatie diagnostiek voor start van behandeling1
Aanvullend onderzoek is erop gericht om stadium van de ziekte vast te stellen, complicaties van de ziekte in kaart te brengen (hemolyse, auto-immuun trombocytopenie, hypogammaglobulinemie) en eventuele actieve of chronische infecties (hepatitis B, C, HIV), die kunnen verergeren door de behandeling te diagnosticeren. Daarnaast dienen 17p-deletie, TP53-mutatie en IGHV-mutatiestatus bepaald te worden om een inschatting te maken over prognose en (on)gevoeligheid voor chemo-immunotherapie. Ongeveer 50% van de CLL-patiënten heeft bij presentatie een ongemuteerde IGVH-status. CLL-cellen met een 17p-deletie, een TP53-mutatie of een ongemuteerde IGHV-status zijn genetisch instabieler met een hoger risico om ongunstige genetische mutaties te verwerven. Overleving en responsduur op chemo-immunotherapie zijn significant korter in deze groep. TP53-mutatie en IGHV mutatie status dienen bepaald te worden in een ERIC-gecertificeerd centrum, zie hiervoor: http://www.ericll.org/certifiedcentres-netherlands/ en http://www.ericll.org/ighv-gene-mutational-analysis-certification/. Een ongemuteerde IGHV-status is gedefinieerd als ≥98% sequence homology ten opzichte van de germ line sequentie. Een 17p-deletie en/of TP53 mutatie wordt in deze richtlijn gedefinieerd als ≥ 10%, zie voor beweegredenen verderop in deze richtlijn.
Beenmergonderzoek kan geïndiceerd zijn ter differentiatie van anemie of trombocytopenie als gevolg van beenmerg-verdringing of door auto-immuun afbraak. In de dagelijkse praktijk kan radiologische beeldvorming zeer beperkt blijven indien bij lichamelijk onderzoek lymfadenopathie en lever- en miltgrootte goed vast te leggen zijn. CT hals-thorax-abdomen maakt nauwkeurige respons-evaluatie mogelijk en maakt het mogelijk een inschatting te maken van de kans op tumorlyse syndroom.
Expert opinion werkgroep: CLL-IPI risico score combineert genetische, biochemische en klinische parameters in een prognostisch model, waardoor 4 prognostische groepen kunnen worden onderscheiden. Deze risico-score maakt gebruik van moderne prognostische factoren en is ook getest bij patiënten die behandeld worden met de nieuwere doelgerichte therapieën, zoals ibrutinib en venetoclax.3 Aangezien de score vooralsnog geen invloed heeft op therapiekeuze, is het niet noodzakelijk deze te bepalen buiten studieverband.
Stadiëring volgens CLL-IPI score (tabel 5)
Tabel 5: CLL-IPI risico score3
|
Variabele |
Punten |
|
TP53-mutatie en/of 17p deletie |
4 |
|
IGHV ongemuteerde status |
2 |
|
Beta2-microglobuline > 3,5 mg/L |
2 |
|
Binet stadium B/C of Rai stadium I-IV |
1 |
|
Leeftijd > 65 jaar |
1 |
|
Prognostische score |
5-jrs OS, % |
|
Laag, 0-1 |
93,2 |
|
Intermediair, 2-3 |
79,4 |
|
Hoog, 4-6 |
63,6 |
|
Zeer hoog, 7-10 |
23,3 |
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
1. Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL Blood 2018; 131(25):2745-2760.
3. CLL-IPI working group. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of individual patient data. Lancet Oncol 2016;May.
Fitte patiënten:
1e keus: CIT:
2e keus: Venetoclax-Obinutuzumab (Ven-O) (SORT B)
Niet fitte patiënten:
1e keus: Chloorambucil-obinutuzumab (Chl-O) (SORT A)
2e keus: Chloorambucil-rituximab (Chl-R) òf Venetoclax-obinutuzumab (Ven-O) (SORT A)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib (SORT A)
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Onderbouwing
Achtergrondinformatie 1e lijns behandeling bij patiënten zonder 17p-deletie of TP53-mutatie met gemuteerde IGHV-status
Er is geen overlevingsvoordeel (PFS en OS) aangetoond van Ven-O, ibrutinib, acalabrutinib en zanubrutinib, boven chemo-immunotherapie voor patiënten met laag risicoziekte, gedefinieerd als afwezigheid van 17p-deletie en TP53-mutatie en met gemuteerde IGHV-status. Voor jonge, fitte patiënten is FCR de standaardbehandeling, met verwachte mogelijkheid tot langdurige remissie (en functionele curatie) bij 50% van de patiënten. Bendamustine-rituximab wordt geadviseerd bij fitte patiënten boven 65 jaar, vanwege minder risico op infecties, secundaire beenmergpathologie (tMDS/AML) en secundaire maligniteiten vergeleken met FCR. Voor patiënten met significante comorbiditeit is chloorambucil-obinutuzumab eerste keus behandeling. Chloorambucil-rituximab (Chl-R) is een alternatief indien infusie-gerelateerde bijwerkingen als een te groot probleem worden ingeschat. Voor niet fitte patiënten patiënten zou Ven-O een optie kunnen zijn als alternatief van Chloorambucil bevattende behandeling, mogelijk is er een iets langere TTNT, maar meer onduidelijkheid op de langere termijn. Voor fitte patiënten zou Ven-O een optie kunnen zijn als alternatief voor FCR, vanwege minder risico op secundaire beenmergpathologie (tMDS/AML) op de langere termijn in geval van Ven-O. Echter van FCR is lange termijn data bekend (mediane follow-up: 19 jaar), waarbij na FCR behandeling de overleving lang is met gelijke overleving als leeftijdsgenoten zonder CLL, ondanks de hogere kans op tMDS en AML38, en is er meer onduidelijkheid over lange termijn effectiviteit en toxiciteit na Ven-O, derhalve heeft de CLL WG voorkeur voor FCR.
Expert opinion werkgroep voor de jonge, fitte patiënt, ≤ 65 jaar: FCR laat goede responses zien in patiënten met gemuteerde IGVH-status met een mediane PFS en OS die niet bereikt werd na 8 jaar. Het is non-inferieur aan ibrutinib wat betreft progressie vrije overleving (PFS) en overall survival (OS).7 Er kunnen langdurige remissies optreden, FCR is mogelijk curatief in ongeveer 50% van de patiënten met gemuteerde IGVH-status. Na een remissie van 6 jaar, treden er nog nauwelijks recidieven op en is de overleving lang met gelijke overleving als leeftijdsgenoten zonder CLL.38 FCR is daarom een valide optie bij jonge fitte patiënten met een gemuteerde IGHV gemuteerde status.
Expert opinion werkgroep voor de oudere patiënt > 65 jaar: Bendamustine-rituximab is niet direct vergeleken met chloorambucil-obinutuzumab, maar wel met chloorambucil-rituximab, en laat een betere PFS zien.5 Indirect vergelijk van gerandomiseerde studies met inclusie van patiënten die wat betreft leeftijd, WHO-performance status en moleculaire afwijkingen vergelijkbaar is geeft bendamustine-rituximab een betere progressie vrije overleving (PFS) (gemiddeld 3,3- 3,75 jaar) dan chloorambucil-obinutuzumab (gemiddeld 1,6-2,4 jaar),8,9 Een Chloorambucil-bevattend schema wordt wel beter verdragen met kans op infecties bij chloorambucil-obinutuzumab van 5% versus 15-19% bij bendamustine-rituximab. FCR wordt niet geadviseerd bij fitte patiënten > 65 jaar, vanwege een hogere mortaliteit, welke voornamelijk veroorzaakt wordt door overlijden ten gevolge van infecties, secundaire maligniteiten en secundaire beenmergpathologie (tMDS/AML). 10 Dit risico lijkt hoger in de oudere populatie. In een Duitse studie werden solide maligniteiten na FCR gezien in: 16,3 % (> 65 jaar) en 6,2 % (≤ 65 jaar) en tMDS/AML na FCR in 7,0% (> 65 jaar) en 1,6% (≤ 65 jaar).10 Een alternatieve optie voor fitte patiënten tussen 65 en 70 jaar is FCR in een gereduceerde dosering (fludarabine: 50%, cyclofosfamide: 60%), waarbij dit schema beter getolereerd wordt met minder infecties dan FCR100%. Echter de lange termijn complicaties, waaronder secundaire maligniteiten en tMDS-AML zijn onbekend.11 Bij patiënten > 65 jaar dient een individuele afweging gemaakt te worden waarbij het nastreven van een zo lang mogelijke progressie vrije overleving wordt afgezet tegen het zo veel mogelijk beperken van de toxiciteit van de behandeling.
Samenvatting bendamustine-rituximab versus chloorambucil-rituximab (Michallet et al)5
|
|
BR90 |
Chl-R |
Uitleg |
|
PFS |
+ |
– |
Mediane PFS BR: 39,6 mndn, Chl-R: 29,9 mndn |
|
OS |
+/- |
+/- |
Mediane OS BR: 43,8 mndn, Chl-R: niet bereikt |
|
Toxiciteit |
– |
+ |
Meer gr 3-5 toxiciteit bij BR, BR: 75% vs Chl-R: 64%, met name door meer infecties, BR: 19% vs Chl-R: 8% |
|
Behandelduur |
+ |
+ |
Beide: 6 maanden |
|
Behandelzwaarte |
i.v. elke 4 weken, |
i.v. elke 4 weken |
|
|
Comorbiditeit |
|
|
Bij meer comorbiditeit voorkeur voor Chl-R gezien minder toxiciteit |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting chloorambucil-obinutuzumab versus chloorambucil-rituximab (Goede et al)6
|
|
Chl-O |
Chl-R |
Uitleg |
|
PFS |
+ |
– |
Mediane PFS Chl-O: 26 mndn, Chl-R: 16 mndn |
|
OS |
+ |
– |
Follow-up 5 jr: mediane OS Chl-O: niet bereikt, Chl-R: 6 jaar |
|
TTNT |
+ |
– |
Mediane TTNT Chl-O: 56,4 mndn vs Chl-R: 34,9 mndn |
|
Toxiciteit |
+/- |
+ |
Infusie-gerelateerde reacties: Chl-O: 21%, Chl-R: 4%. Overige toxiciteit, mn infecties gelijk |
|
Behandelduur |
+ |
+ |
Beide: 6 maanden |
|
Behandelzwaarte |
i.v. elke 4 weken, maar 1e cyclus: 3x extra |
i.v. elke 4 weken |
|
|
Comorbiditeit |
|
|
Bij meer comorbiditeit voorkeur voor Chl-R gezien minder toxiciteit |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
4. Eichorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
5. Michallet AS, Aktan M, Hiddemann W, et al. Rituximab plus bendamustine or chlorambucil for chronic lymphocytic leukemia: primary analysis of the randomized, open-label MABLE study. Haematologica 2018 Apr;103(4):698-706
6. Goede V, Fischer K, Dye MJS, et al. Overall survival benefit of obinutuzumab over rituximab when combined with chlorambucil in patients with chronic lymphocytic leukemia and comorbidities: final survival analysis of the CLL11 study. EHA abstract 2018;June15:215923;S151.
7. Shanafelt TD, Wang XV, Kay NE, et al. Ibrutinib-Rituximab of Chemoimmunotherapy for Chronic Lymophocytic Leukemia. N Engl J Med 2019;381:432-43.
8. Woyach JA, Ruppert AS, Heerema NA, et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. N Engl J Med 2018 Dec;379:2517-28.
9. Moreno C, Greil R, Demirkan, et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (ILLUMINATE): a multicentre, randomized, open-lab, phase 3 trial. Lancet Oncol 2019 Dec;20:43-56.
10. Kutsch N, Bahlo J, Robrecht S, et al. Long Term Follow-up Data and Health-Related Quality of Life in Frontline Therapy of Fit Patients Treated With FCR Versus BR (CLL10 Trial of the GCLLSG). HemaSphere 2020;4:1.
11. Smolej L, Brychtová Y, Cmunt E, et al. Low-dose fludarabine and cyclophosphamide combined with rituximab in the first-line treatment of elderly/comorbid patients with chronic lymphocytic leukaemia/small lymphocytic lymphoma (CLL/SLL): long-term results of project Q-lite by the Czech CLL Study Group. Br J Haematol 2021.
38. Thompson PA, Bazinet A, Wierda WG, et al. Sustained remissions in CLL after frontline FCR treatment with very-long-term follow-up. Blood 2023;142:21.
Aanbevelingen
Fitte patiënten, ≤ 65 jaar:
1e keus: Fludarabine-cyclofosfamide-rituximab (FCR) òf Ven-O (SORT A)
2e keus: Venetoclax-ibrutinib (Ven-I) (SORT B)
3e keus: Ibrutinib òf acalabrutinib òf zanubrutinib (SORT B)
Fitte patiënten, > 65 jaar:
1e keus: Bendamustine-rituximab (BR90) òf Ven-O (SORT A)
2e keus: Venetoclax-ibrutinib (Ven-I) (SORT B)
3e keus: Ibrutinib òf acalabrutinib òf zanubrutinib (SORT B)
Niet fitte patiënten:
1e keus: Chloorambucil-obinutuzumab (Chl-O) òf Ven-O (SORT A)
2e keus: Chloorambucil + rituximab (Chl-R) òf Ven-I (SORT B)
3e keus: Ibrutinib òf acalabrutinib òf zanubrutinib (SORT B)
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Onderbouwing
Achtergrondinformatie 1e lijns behandeling bij patiënten zonder of VAF < 10% 17p-deletie of TP53-mutatie met ongemuteerde IGHV-status en/of subset 2.
Behandeling van 12 cycli met Venetoclax-O (Ven-O), 15 cycli met Venetoclax-Ibrutinib (Ven-I), of continue behandeling met ibrutinib, acalabrutinib en zanubrutinib geeft langere progressie vrije overleving dan behandeling met chemo-immunotherapie (FCR, bendamustine-rituximab of chloorambucil-obinutuzumab). Chemo-immunotherapie heeft de langst-bekende effectieve behandelopties na recidief (zie NTVH-artikel, v. Gelder et al.). Overall survival voordeel is tot op heden niet aangetoond in de studies. De studie van Shanafelt (FCR vs ibrutinib-R) laat als enige wel een OS-voordeel zien, maar in deze studie was de switch naar targeted therapie na FCR niet als cross-over onderdeel van de studie, en was de toegang tot deze middelen mogelijk beperkt. Het OS-voordeel in deze studie is hierdoor zeer waarschijnlijk veroorzaakt en niet goed vertaalbaar naar de huidige Nederlandse situatie (4/5 patiënten die zijn overleden aan progressie hebben geen targeted therapie als salvage gehad).
Expert opinion werkgroep ten aanzien van keus tussen ibrutinib, acalabrutinib of zanubrutinib
Voor de effectiviteit van acalabrutinib en zanubrutinib ontbreken vooralsnog 1e lijns data. Echter, omdat in de recidief setting bij directe vergelijking met ibrutinib geen duidelijk verschil in PFS werd gezien, meent de werkgroep dat de vergelijkbare effectiviteit extrapoleerbaar is naar de 1e lijn. Zowel acalabrutinib als zanubrutinib hebben mogelijk een gunstiger toxiciteitsprofiel dan ibrutinib. Zo lijkt acalabrutinib in vergelijking met ibrutinib significant minder bijwerkingen van gr I-II te hebben voor: diarree: 34,5% v 46.5%, arthralgieën: 15,8% vs 22,9%, atriumfibrilleren: 4,5% vs 12,2%, bloedingen: 38% vs 51,3%. Maar ten koste van meer hoofdpijn van gr I-II: 34,6% vs 20,2%. Minder patiënten met acalabrutinib moesten hun medicatie staken vanwege bijwerkingen, namelijk: 14,9% vs 22,3%35. Zanubrutinib heeft mogelijk een iets gunstiger toxiciteitsprofiel dan ibrutinib van gr I-II atriumfibrilleren: 2,7% vs 12,2% en gr > 3 atriumfibrilleren: 1,9% vs 3,8%. Wel wordt meer neutropenie gezien bij zanubrutinib. Minder patiënten met zanubrutinib moesten hun medicatie staken vanwege bijwerkingen, namelijk: 15,4% vs 22,2%.39 Atriumfibrilleren en acute hartdood zijn bijwerkingen van ibrutinib, acalabrutinib en zanubrutinib, mogelijk dat deze bijwerkingen iets minder vaak voorkomen bij acalabrutinib en zanubrutinib, echter deze bijwerkingen zijn zeer waarschijnlijk een klasse-effect van BTK-remmers en langere termijn data van acalabrutinib en zanubrutinib ontbreken vooralsnog.40
Expert opinion werkgroep ten aanzien van afweging chemo-immunotherapie versus nieuwe middelen (i.e. Ven-O, Ven-I, ibrutinib, acalabrutinib of zanubrutinib).
Bij de afweging tussen keuze nieuwe middelen en chemo-immunotherapie dienen een aantal aspecten meegenomen te worden. Progressie vrije overleving en tijd tot volgende behandeling is weliswaar verlengd bij nieuwe middelen ten opzichte van chemo-immunotherapie, maar dit is mogelijk niet altijd van direct klinisch belang bij een chronische ziekte als CLL (verlenging van PFS is niet geassocieerd met verbetering van kwaliteit van leven bij CLL), maar het kan ook zijn dat de follow-up in de gepubliceerde studies nog te kort is (mediaan: 28.1 – 38 maanden), en een langere follow-up nodig is, om een overlevingsvoordeel aan te tonen. Daarnaast kan langst-bekende effectieve behandelsequenties voor een patiënt belangrijk zijn.41 Verder is het percentage graad 3-5 toxiciteit tussen de nieuwe middelen (Ven-O, ibrutinib, acalabrutinib en zanubrutinib) en chemo-immunotherapie gelijk en de aard verschillend, en weging van deze verschillende vormen van toxiciteit verschilt per patiënt. Een voordeel van chemo-immunotherapie is de beperkte behandelduur (6 maanden). Daarnaast is de mediane follow-up in de studies nog relatief kort (mediaan: 28,1-38 maanden), en is er nog relatieve onbekendheid van de effectiviteit van achtereenvolgende salvage therapieën na nieuwe middelen, en zijn de kosten van chemo-immunotherapie waarschijnlijk lager (disclaimer: de ware kosten zijn niet bekend en bij de totale kosten moeten ook vervolgbehandeling meegerekend worden). Een nadeel van chemo-immunotherapie is het risico op lange-termijn complicaties zoals secundaire leukemie en MDS (tMDS/AML rond 2% bij FCR < 65jr). Daarnaast moet in ogenschouw worden genomen dat de lange-termijn complicaties van de nieuwe middelen nog onbekend zijn en er voornamelijk ook cardiale toxische effecten (6,5% gr 3-5 toxiciteit) en sudden deaths door ventriculaire arrhythmieën (1%) worden gemeld na ibrutinib en de andere BTK-i’s.7,12 In verband met bovenstaande argumenten is de CLL WG van mening, dat in tegenstelling tot de ons omringende landen, chemo-immunotherapie en nieuwe middelen gelijkwaardige alternatieven zijn, waarbij gezamenlijk met de patiënt de voor- en nadelen moeten worden afgewogen. Hier kan de CLL-keuzehulp ondersteunend in zijn. De werkgroep heeft een sterke voorkeur voor time-limited therapie.
Bij de keuze tussen de verschillende behandelmodaliteiten dienen samenvattend de volgende aspecten meegenomen te worden (zie ook afweging bij expert opinion): (1) behandelduur: 6 maanden (chemo-immunotherapie), 12 maanden (Ven-O), tot aan progressie (ibrutinib, acalabrutinib en zanubrutinib), (2) behandelzwaarte, (3) therapietrouw (oraal of iv), (4) comorbiditeit en bijwerkingen (bloedingsrisico, cardiovasculaire comorbiditeit en mogelijkheid van medicijn-interacties bij ibrutinib, acalabrutinib en zanubrutinib vs verminderde nierfunctie bij venetoclax-obinutuzumab), (5) lange-termijn complicaties (tAML/MDS na FCR, cardiale en hemostase effecten na ibrutinib, acalabrutinib en zanubrutinib, onbekendheid lange-termijn complicaties na venetoclax/BTK-remmers) en (6) nog relatieve onbekendheid van salvage therapie bij recidief na start met nieuwe middelen en langst-bekende effectieve behandelsequenties na chemo-immunotherapie.
Expert opinion werkgroep ten aanzien van Ven-I. Ven-I is in een fase 3 studie bij niet-fitte CLL-patiënten vergeleken met Chl-O.42 Ven-I geeft een langere PFS na 54 maanden: 66,5% vs 19% en TTNT na 54 maanden: 88% vs 54%). Ook is een verbeterde OS geconstateerd, waarbij een aanzienlijk deel van de sterfte ten gevolge van COVID-19 was. Het aantal patiënten dat overleed tijdens de behandeling was hoger in de Ven-I arm (6,6% vs 1,9%), met name ten gevolge van cardiaal overlijden tijdens de ibrutinib monotherapie ramp-up fase. Het aantal therapie-gerelateerde doden door Ven-I in de GLOW studie is aanzienlijk hoger dan de gepubliceerde data in andere (voornamelijk fase 2) studies. Op dit moment is de CLL-werkgroep is van mening dat de data van de GLOW studie, waar het OS-winst betreft, niet representatief is op de Nederlandse praktijk. Wat betreft Ven-I bij jonge fitte patiënten wordt verwezen naar H140-studie en UK-studie43,44, in deze studies werd laten zien dat PFS van Ven-I niet significatie verschillend is ten opzichte van Ven-O, maar wel significant langer ten opzichte van FCR/BR. Ven-I is een optie, maar gezien het feit dat er meer onzekerheid is op langere termijn, minder bekend over behandeling in recidief situatie is de CLL WG op dit moment van mening dat de voorkeur uitgaat naar een behandeling met CIT (FCR of BR), danwel Ven-O.
Expert opinion werkgroep ten aanzien van lange termijn complicaties.
Lange-termijn complicaties op secundaire maligniteiten en tAML/MDS na chemo-immunotherapie lijkt met name geassocieerd door CLL zelf en door FCR chemotherapie.13 Het risico op secundaire maligniteiten en tAML/MDS na FCR is voornamelijk fors verhoogd bij patiënten > 65 jaar. Kans op solide maligniteiten na FCR is: 16,3% (> 65 jaar) en 6,2% (≤ 65 jaar) en op tMDS/AML na FCR is: 7.0% (> 65 jaar) en 1,6% ((≤ 65 jaar).10 Kans op tAML/MDS na FCR varieert in de verschillende studies, er worden percentages gerapporteerd variërend van: 1,6%10, 1,9%14, 2%15, 3,8%13, 5,1%,16, 6%38, en 11%.17 Waarbij moet worden opgemerkt dat de laatste 2 studies die hoge percentages rapporteren16,17, retrospectieve studies uit de USA zijn met andere FCR schema’s (FCR3), er geen leeftijd gemeld wordt en er een mogelijke rol is voor rituximab, danwel GM-CSF als oorzaak van de hoge percentages tAML/MDS. De CLL WG is van mening dat de voordelen van FCR opwegen tegenover de lange-termijn complicaties na FCR bij fitte jonge patiënten < 65 jaar acceptabel is (ong 2% kans op tAML/MDS), met uitschieters naar 6%, met in deze studie zeer lange follow-up met een zeer goede levensverwachting in IGHV gemuteerde groep na FCR-behandeling.38 Daarbij moet in ogenschouw worden genomen dat de lange termijn complicaties van de nieuwe middelen nog onbekend zijn. Cardiale toxische effecten (6,5% gr 3-5 toxiciteit) en sudden deaths door ventriculaire arrhythmieën (1%) worden gemeld na ibrutinib en ook na acalabrutinib en zanubruitnib.7,12
Expert opinion werkgroep voor ibrutinib en acalabrutinib monotherapie vs gecombineerd met anti-CD20. Ibrutinib gecombineerd met rituximab (Ibrutinib-R) geeft geen langere progressie vrije overleving in vergelijking met ibrutinib monotherapie.8 Daarom is er geen indicatie voor ibrutinib gecombineerd met anti-CD20. Acalabrutinib gecombineerd met obinutuzumab geeft een langere progressie vrije overleving in vergelijking met acalabrutinib monotherapie mn in de IGHV ongemuteerde patiënten, alleen werd ook in de combinatie, acalabrutinib doorgegeven.19 Daarom is er geen indicatie voor acalabrutinib gecombineerd met anti-CD20 en heeft de werkgroep de voorkeur voor acalabrutinib monotherapie.
Expert opinion werkgroep voor afkappunt 17p-deletie en TP53 mutatie en subset 2. Bij 17p-deletie en TP53 gemuteerde klonen < 10% is een langere PFS aangetoond na nieuwe middelen ten opzichte van chemo-immunotherapie. Echter er is onvoldoende zekerheid om af te zien van chemo-immunotherapie, omdat geen OS-verschil is aangetoond op langere termijn.45 IGHV-subset 2, behoren tot de IGHV gemuteerde groep, maar laten in studies responsen zien vergelijkbaar als IGHV ongemuteerde groep met een langere PFS na nieuwe middelen ten opzichte van chemo-immunotherapie. Echter er is onvoldoende zekerheid om af te zien van chemo-immunotherapie, omdat er geen OS-verschil is aangetoond op langere termijn.46
Samenvatting FCR/BR90 versus Ven-O44
|
|
CIT (FCR/BR) |
Ven-O |
Uitleg |
|
PFS |
– |
+ |
2-jrs PFS: ~80% (FCR) vs ~90% (Ven-O) 2-jrs PFS: ~60% (BR) vs ~90% (Ven-O) |
|
OS |
+/- |
+/- |
|
|
TTNT |
– |
+ |
|
|
Toxiciteit |
+/- |
+/- |
Totale toxiciteit is gelijk. Meer gr 3 neutropene koorts en infecties bij CIT (FCR/BR) vs Ven-O: 10,6% vs 3,1% en 17,6% vs 13,2%). Wat betreft maligniteiten, meer gr 1-2 non-melanoom huidkanker bij CIT (FCR/BR) vs Ven-O: 4,6% vs 2,6% |
|
Behandelduur |
+ |
+/- |
CIT (FCR/BR): 6 maanden en Ven-O: 1 jaar |
|
Behandelzwaarte |
i.v. elke 4 weken |
1e 5 weken frequente controles en mogelijk opname ivm TLS. i.v. elke 4 weken en oraal |
|
|
Comorbiditeit |
|
Nierfunctiestrns |
Contra-indicatie voor Ven-O in geval van klaring < 30 ml/min. |
|
Effectieve behandelsequentie |
+ |
+/- |
Langere bekende effectieve behandelsequenties bekend41 |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting FCR versus ibrutinib-rituximab (Shanafelt)7
|
|
FCR |
Ibrutinib-R |
Uitleg |
|
PFS |
– |
+ |
5-jrs PFS: 51% (FCR) vs 78% (ibrutinib) |
|
OS |
+/- |
+/- |
|
|
Toxiciteit |
+/- |
+/- |
Gelijke gr 3-5 toxiciteit (FCR79.8% vs ibrutinib: 79.8%), gelijke infecties (FCR: 9.6% vs ibrutinib: 9.4%), maar minder neutropene koorts (FCR: 15.8% vs ibrutinib: 2.3%) en meer atriumfibrilleren (FCR: 3% vs ibrutinib: 7%) en hypertensie (FCR: 8.2% vs ibrutinib: 18%) |
|
Behandelduur |
+ |
– |
FCR: 6 maanden en ibrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
i.v. elke 4 weken |
oraal dagelijks |
|
|
Comorbiditeit |
|
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor ibrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
|
Effectieve behandelsequentie |
+ |
+/- |
Langere bekende effectieve behandelsequenties bekend41 |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting Bendamustine-rituximab versus ibrutinib (Woyach et al)8
|
|
BR |
Ibrutinib |
Uitleg |
|
PFS |
– |
+ |
2-jrs PFS: ~73% (BR) vs ~88% (ibrutinib) |
|
OS |
+/- |
+/- |
Geen OS voordeel aangetoond |
|
Toxiciteit |
+/- |
+/- |
Totale toxiciteit is gelijk. Meer gr 3-4 hematologische toxiciteit bij BR vs ibrutinib: 61% vs 41%, maar minder gr 3-4 non-hematologische toxiciteit bij BR vs ibrutinib: 63 vs 74%. Kans op infecties gelijk: BR: 15% vs ibrutinib: 20% |
|
Behandelduur |
+ |
– |
BR: 6 maanden en ibrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
i.v. elke 4 weken |
oraal dagelijks |
|
|
Comorbiditeit |
|
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor ibrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
|
Effectieve behandelsequentie |
+ |
+/- |
Langere bekende effectieve behandelsequenties bekend41
|
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting chlorambucil-obinutuzumab versus ibrutinib-obinutuzumab (Moreno et al)9
|
|
Chl-O |
Ibrutinib-O |
Uitleg |
|
PFS |
– |
+ |
2-jrs PFS: ~45% (Chl-O) vs ~88% (ibrutinib) |
|
OS |
+/- |
+/- |
geen OS voordeel aangetoond |
|
TTNT |
– |
+ |
TTNT na 31,3 mndn: 44% (Chl-O) en 4% (ibrutinib) |
|
Toxiciteit |
+/- |
+/- |
Alle gr 3-4 toxiciteit is gelijk: 70% (Chl-O) vs 68% (ibrutinib). Kans op gr 3-4 infecties gelijk: 5% (Chl-O) vs 10% (ibrutinib). Ibrutinib geeft meer non-hematologische toxiciteit (atriumfibrilleren en hypertensie) |
|
Behandelduur |
+ |
– |
Chl-O: 6 maanden en ibrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
i.v. elke 4 weken |
oraal dagelijks |
|
|
Comorbiditeit |
|
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor ibrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
|
Effectieve behandelsequentie |
+ |
+/- |
Langere bekende effectieve behandelsequenties bekend41 |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting chloorambucil-obinutuzumab versus venetoclax-obintuzumab (Fischer et al)18
|
|
Chl-O |
Ven-O |
Uitleg |
|
PFS |
– |
+ |
2-jrs PFS: ~50% (Chl-O) vs ~90% (Ven-O) |
|
OS |
+/- |
+/- |
geen OS voordeel aangetoond |
|
Toxiciteit |
+/- |
+/- |
Alle gr 3-5 toxiciteit is gelijk: 77% (Chl-O) vs 79% (Ven-O). Kans op gr 3-5 infecties gelijk: 15% (Chl-O) vs 17% (Ven-O). |
|
Behandelduur |
+ |
+/- |
Chl-O: 6 maanden en Ven-O: 1 jaar |
|
Behandelzwaarte |
i.v. elke 4 weken |
1e 5 weken frequente controles en mogelijk opname ivm TLS. i.v. elke 4 weken en oraal |
|
|
Comorbiditeit |
|
Nierfunctiestoornissen |
Contra-indicatie voor Ven-O in geval van klaring < 30 ml/min. |
|
Effectieve behandelsequentie |
+ |
+/- |
Langere bekende effectieve behandelsequenties bekend41 |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting chloorambucil-obinutuzumab versus acalabrutinib (Sharman et al)19
|
|
Chl-O |
Acalabrutinib (A) |
Uitleg |
|
PFS |
– |
+ |
2-jrs PFS: 47% (Chl-O) vs 87% (A) |
|
OS |
+/- |
+/- |
geen OS voordeel aangetoond |
|
Toxiciteit |
+/- |
+/- |
Alle gr 3-5 toxiciteit is gelijk: 69.8% (Chl-O) vs 49.7% (A). Kans op gr 3-5 infecties gelijk: 8.3% (Chl-O) vs 14% (A). Kans op atriumfibrilleren gr 1-5: 0% (Chl-O) vs 3.9% (A) en kans op hypertensie gr 1-5: 3.6% (Chl-O) vs 4.5% (A). |
|
Behandelduur |
+ |
– |
Chl-O: 6 maanden en acalabrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
i.v. elke 4 weken |
oraal dagelijks |
|
|
Comorbiditeit |
|
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor acalabrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting Acalabrutinib versus Ibrutinib35 (non-inferiority studie)
NB dit betreft patiënten met R/R CLL en del(17p) of del(11q)
|
|
Ibrutinib |
Acalabrutinib |
Uitleg |
|
PFS |
+/- |
+/- |
Non-inferiority studie in R/R setting en del(17p) of del(11q) |
|
OS |
+/- |
+/- |
Geen OS verschil |
|
Toxiciteit |
+/- |
+ |
Significant minder gr I-II bijwerkingen van diarree (35,4% vs 46,5%), arthralgieën (15,8% vs 22,9%), atriumfibrilleren (4,5% vs 12,2%), bloedingen (38% vs 51,3%) bij acalabrutinib, maar significant meer gr I-II bijwerkingen van hoofdpijn (34,6% vs 202%) bij acalabrutinib |
|
Behandelduur |
– |
– |
Ibrutinib en acalabrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
oraal dagelijks |
oraal dagelijks |
|
|
Comorbiditeit |
Cardiale VG Anticoagulantia |
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor ibrutinib en zanubrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting Zanubrutinib versus Ibrutinib39 (non-inferiority studie)
|
|
Ibrutinib |
Zanubrutinib |
Uitleg |
|
PFS |
– |
+ (echter non-inferiority studie) |
Non-inferiority studie in R/R setting. Zanubrutinib liet een langere PFS zien, echter betreft dit een non-inferiority studie (PFS was geen primair eindpunt van de studie). |
|
OS |
+/- |
+/- |
geen OS verschil |
|
Toxiciteit |
+/- |
+ |
Significant minder gr I-II bijwerkingen van atriumfibrilleren (2,7% vs 12,2%) en minder gr 3> atriumfibrilleren (niet significant; 1,9% vs 3,8%) bij zanubrutinib |
|
Behandelduur |
– |
– |
Ibrutinib en zanubrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
oraal dagelijks |
oraal dagelijks |
|
|
Comorbiditeit |
Cardiale VG Anticoagulantia |
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor ibrutinib en zanubrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
4. Eichhorst B, Robak T, Montserrat E. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
7. Shanafelt TD, Wang XV, Kay NE, et al. Ibrutinib-Rituximab of Chemoimmunotherapy for Chronic Lymophocytic Leukemia. N Engl J Med 2019;381:432-43.
8. Woyach JA, Ruppert AS, Heerema NA, et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. N Engl J Med 2018 Dec;379:2517-28.
9. Moreno C, Greil R, Demirkan, et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (ILLUMINATE): a multicentre, randomized, open-lab, phase 3 trial. Lancet Oncol 2019 Dec;20:43-56.
10. Kutsch N, Bahlo J, Robrecht S, et al. Long Term Follow-up Data and Health-Related Quality of Life in Frontline Therapy of Fit Patients Treated With FCR Versus BR (CLL10 Trial of the GCLLSG). HemaSphere 2020;4:1.
12. Lamspon BL, Yu L, Glynn RJ, et al. Ventricular arrhythmias and sudden death in patients taking ibrutinib. Blood 2017;18:2581-2584.
13. Cunha-Bang C, Rostgaard K, Andersen M.A., et al. Risk of new malignancies among patients with CLL treated with chemotherapy: results of a Danish population-based study. BJH 2021.
14. Zou Y, Tang G, Medeiros LJ, et al. Therapy-related myeloid neoplasms following fludarabine, cyclophosphamide, and rituximab (FCR) treatment in patients with chronic lymphocytic
15. Fischer K. Bahlo J, Fink A.M., et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood 2016;127(2) leukemia/small lymphocytic lymphoma. Modern Pathology 2012;25:237-245
16. Benjamini O, Jain P, Trinh L, et al. Second cancers in patients with Chronic Lymphocytic Leukemia who received frontline FCR therapy – Distribution and clinical outcomes. Leuk Lymphoma 2015 June;56(6):1643-1650.
17. Short NJ, Keating MJ, Wierda WG., et al. Fludarabine, Cyclophosphamide, and Multiple-Dose Rituximab as Frontline Therapy for Chronic Lymphocytic Leukemia. Cancer 2015 Nov;121(21):3869-3876.
18. Fischer K, Al-Sawa O, Bahlo J, et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions. N Engl J Med 2019 June;380:2225-2236.
19. Sharman, JP, Egyed M, Jurczak W, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE-TN): a randomised, controlled, phase 3 trial. Lancet 2020;395:1278-91.
35. Byrd JC, Hillmen P, Ghia P, et al. Acalabrutinib versus Ibrutinib in previously treated chronic lymphocytic leukemia: results of the first randomized phase III trial. J Clin Oncol 2021 Nov;1;39(31):3441-3452.
36. Brown JR, Eichhorst B, Hillmen P. Zanubrutinib or ibrutinib in relapsed or refractory chronic lymphocytic leukemia. NEJM 2023:388;4
40. Bhat S, Gambril J, Azali L, et al. Ventricular arrhythmias and sudden death events following acalabrutinib initiation. Blood 2021;
41. Van Gelder M, Nijziel M, Hoogendoorn M, et al. Nieuwe eerstelijns behandelingen en behandeldoelen voor CLL in breder perspectief. Ned Tijdschr Hematol 2023
42. Kater AP, Owen C, Moreno C, et al. Fixed-duration Ibrutinib-Venetoclax in patients with chronic lymphocytic leukemia and comorbidities. NEJM 2022;May 15
43. Munir T, Cairns DA, Bloor A, et al. Chronic lymphocytic leukemie therapy guided by measurable residual disease. NEJM 2023;Dec
44. Eichhorst B, Niemann CU, Kater AP, et al. First-line venetoclax combinations in chronic lymphocytic leukemia. NEJM 2023;388:1739-54.
45. Malcikova J, Pavlova S, Kunt Vonkova B, et al. Low-burden TP53 mutations in CLL: clinical impact and clonal evolution within the context of different treatment options. Blood 2021(138):25.
46. Agathangelidis A, Chatzikonstantinou A, Chatzikonstantinou T, et al. Immunoglobulin gene sequence analysis in chronic lymphocytic leukemia: the 2022 update of the recommendations by ERIC, the European Research Initiative on CLL. Leukemia 2022;36(8):1961-1968.
1e keus: Acalabrutinib òf ibrutinib òf zanubrutinib òf Ven-I (SORT B)
2e keus: Venetoclax-obinutuzumab (Ven-O) (SORT B)
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Onderbouwing
Achtergrondinformatie 1e-lijnsbehandeling bij patiënten met 17p-deletie en/ of TP53-mutatie
Patiënten met een 17p-deletie en/of TP53-mutatie dienen een eerstelijnsbehandeling te krijgen met één van de nieuwe middelen, te weten: ibrutinib, acalabrutinib, zanubrutinib, venetoclax-ibrutinib (Ven-I) of venetoclax- obinutuzumab (Ven-O). Chemo-immunotherapie is niet geïndiceerd vanwege de zeer korte respons op deze therapie. Zoals eerder vermeld heeft de werkgroep een voorkeur voor time-limited behandeling.
Expert opinion ten aanzien van BTK-remmers als eerste keus. De CLL WG heeft een voorkeur voor BTK-remmers in deze categorie, omdat in deze patiëntencategorie meer studies zijn verricht met ibrutinib met een langere follow-up. In de GLOW studie waren patiënten met 17pdel uitgesloten gezien de CIT controle arm. In de CAPTIVATE studie bleek er geen verschil in PFS tussen patiënten met en zonder 17pdel. Het voordeel van Ven-I boven BTKi monotherapie is de beperkte behandelduur en mogelijk de optie om bij recidief opnieuw een BTKi bevattend schema te geven. In geval van een (relatieve) contra-indicatie voor een BTK-remmer, zoals bijvoorbeeld het gebruik van antistolling, cardiovasculaire voorgeschiedenis en/of een sterke CYP3A4 remmer, kan gekozen worden voor venetoclax-obinutuzumab (Ven-O). De te verwachtte PFS bij patiënten met een 17pdel is echter wel lager dan bij patiënten zonder: 5-jrs PFS: 38% vs 65%. Een voordeel van venetoclax-obinutuzumab is de tijdelijke behandeling van 1 jaar.
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
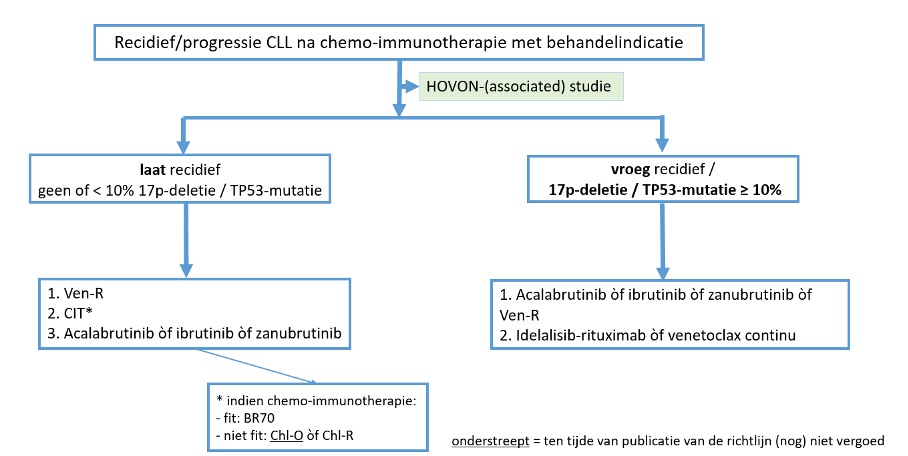
Laat recidief is: > 6 jaar na FCR, > 4 jaar na Bendamustine-rituximab, > 2 jaar na chloorambucil-bevattende therapie
Aanbevelingen
Fitte patiënten, ≤ 65-70 jaar, met behandelindicatie ten minste 6 jaar na FCR, ten minste 4 jaar na bendamustine-rituximab of ten minste 2 jaar na chloorambucil-bevattende therapie:
1e keus: Venetoclax-rituximab (Ven-R) (SORT A)
2e keus: Chemo-immunotherapie* (SORT C)
3e keus: Acalabrutinib òf ibrutinib òf zanubrutinib (SORT C)
*fit: BR70, niet-fit: Chl-O of Chl-R
Cursief: deze medicatie wordt ten tijde van publicatie van deze richtlijn (nog) niet vergoed
Samenvatting bendamustine-rituximab (BR) versus venetoclax-rituximab (Ven-R) (Seymour et al)20
|
|
BR70 |
Ven-R |
Uitleg |
|
PFS |
– |
+ |
Mediane PFS BR: 17 mndn, Ven-R: niet bereikt |
|
OS |
– |
+ |
3-jrs OS BR: 79.5%, Ven-R: 87.9% |
|
TTNT |
– |
+ |
2-jrs TTNT BR: ~50%, Ven-R: ~90% |
|
Toxiciteit |
+/- |
+/- |
Alle toxiciteit gelijk. Gr 3-4 neutropenie hoger in Ven-R: 57% vs 38% (BR), echter minder infecties: 17% (Ven-R) vs 21% (BR) en neutropene koorts: 3% (Ven-R) vs 8% (BR) |
|
Behandelduur |
+ |
– |
BR: 6 maanden, Ven-R: 2 jaar |
|
Behandelzwaarte |
i.v. elke 4 weken |
1e 5 weken frequente controles en mogelijk opname ivm TLS i.v. elke 4 weken en oraal |
|
|
Comorbiditeit |
|
Nierfunctie- stoornissen |
Contra-indicatie voor venetoclax, indien klaring < 30 ml/min |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel
Samenvatting Idelalisib-rituximab(IdR)/Bendamustine-rituximab(BR) vs acalabrutinib (Ghia et al)21
|
|
IdR/BR |
Acalabrutinib (A) |
Uitleg |
|
PFS |
– |
+ |
mediane PFS: 16.5 maanden (IdR/BR) vs NR (A) |
|
OS |
+/- |
+/- |
(nog) geen OS voordeel aangetoond |
|
Toxiciteit |
+/- |
+/- |
Alle gr 3-5 toxiciteit is gelijk tussen BR en A: 43% (BR) vs 45% (A) en 86% (IdR). Kans op gr 3-5 pneumonieën gelijk: 8% (IdR), 3% (BR) vs 5% (A). Atriumfibrilleren gr 0-5: 3% (IdR/BR) vs 5% (A), gr -5 hypertensie: 4% (IdR), 0% (BR) vs 3% (A), gr 0-5 bloedingen: 7% (IdR/BR) vs 26% (A) |
|
Behandelduur |
+ |
– |
IdR/BR: 6 maanden en acalabrutinib dagelijks tot aan progressie |
|
Behandelzwaarte |
i.v. elke 4 weken |
oraal dagelijks |
|
|
Comorbiditeit |
|
Cardiale VG Anticoagulantia |
Relatieve contra-indicatie voor acalabrutinib in geval van: cardiale voorgeschiedenis, anticoagulantia en CYP3A4 remmers |
+ = voordeel, – = nadeel, +/- = geen voordeel en geen nadeel, NR = not reached
Indien 1e lijn CIT:
Indien 1e lijn BTK-remmer:
Indien 1e lijn Ven-O:
Indien dubbel exposed maar niet refractair:
Indien dubbel exposed en refractair:
NB: deze groep patiënten heeft een zeer slechte prognose, daarom: overweeg behandeling in trial verband
Overweeg allogene stamceltransplantatie als consolidatie, indien in remissie bovenstaande behandelopties (zie module 6).
Onderbouwing
Achtergrondinformatie recidief behandeling
Net als bij eerstelijnsbehandeling dient de recidief behandeling pas te starten in symptomatische patiënten. Bij patiënten met een laat-recidief zijn zowel opties met nieuwe doelgerichte therapie of dienen de volgende aspecten overwogen te worden: (1) behandelduur: 6 maanden (chemo-immunotherapie), 24 maanden (Ven-R), tot aan progressie (ibrutinib), (2) behandelzwaarte, (3) therapietrouw (oraal of iv), (4) comorbiditeit en bijwerkingen (bloedingsrisico, cardiovasculaire comorbiditeit bij ibrutinib vs verminderde nierfunctie bij venetoclax) en (5) respons en bijwerkingen van eerdere therapie. Opnieuw behandelen met FCR heeft verhoogd risico op toxiciteit waaronder met name secundaire MDS en acute leukemie. Bij een vroeg recidief na chemo-immunotherapie of een 17p-deletie en/of TP53-mutatie is chemo-immunotherapie geen optie. In geval van staken BTK-i ivm bijwerkingen kan geswitched worden naar een andere BTK-i. In geval van progressie tijdens ibrutinib moet geswitched worden naar een venetoclax schema. In geval van een recidief na staken BTK-i, laten primaire data zien dat opnieuw gestart kan worden indien er een significante behandelvrije periode is geweest. Hoe lang deze moet zijn is niet duidelijk. Een optie is om specifiek naar de aanwezigheid van mutaties in het BTK en PLC-gamma te zoeken. Indien deze niet aanwezig zijn, kan opnieuw BTK-i overwogen worden. Indien er wel een mutatie is gevonden, laten genetische data zien dat deze mutatie weer verdwijnt onder venetoclax, waardoor een switch in de toekomst naar BTK-i wellicht mogelijk is. Recidief tijdens BTK-i: BTK-i doorzetten tot respons vervolgbehandeling, bij switch naar Ven-R: BTK-i door tot aan einde ramp-up om tumor flare te voorkomen. In geval van progressie tijdens venetoclax dient geswitched te worden naar een BTK-i. Indien een recidief optreedt na Ven-R met een redelijke treatment-vrije interval (≥ 2 jaar) laten de data van de Murano studie zien, dat de PFS-2 van opnieuw venetoclax bevattend schema of BTK-i vergelijkbaar zijn. Het bepalen van een Bcl-2 mutatie heeft weinig zin, omdat het ontstaan van venetoclax resistentie meerdere oorzaken kent, met een minderheid een specifieke bcl-2 mutatie. Indien dubbel refractair, kan een switch naar idelalisib-R worden overwogen. Denk aan infectie-profylaxe. 22
Expert opinion werkgroep ten aanzien van keus tussen verschillende middelen. De CLL-werkgroep is van mening dat de eerste keus in geval van recidief na chemotherapie of een BTK-remmer Venetoclax-rituximab (Ven-R) is, omdat Ven-R een betere PFS, TTNT en OS heeft laten zien ten opzichte van Bendamustine-Rituximab in de recidief setting.20 Daarnaast is het voordeel van Ven-R een tijdelijke behandeling van 2 jaar. Herhalen van chemo-immunotherapie dient alleen overwogen te worden indien er een zeer langdurige respons was op voorgaande chemo-immunotherapie (>6 jaar na FCR, > 4 jaar na bendamustine-rituximab en > 2 jaar na chloorambucil-bevattende therapie) en indien eerdere chemo-immunotherapie goed getolereerd werd. In geval van 17p-deletie en/of TP53 mutatie heeft de CLL-werkgroep een voorkeur voor een BTKi (acalabrutinib of ibrutinib). Alhoewel Ven-R en BTKi in de recidief-setting niet head-to-head met elkaar vergeleken zijn in deze situatie, zijn er aanwijzingen dat PFS mogelijk langer is in geval van 17p-deletie en/of TP53 mutatie.37
Expert opinion werkgroep in geval van recidief na venetoclax-rituximab: De vervolgbehandeling hangt af van de duur van respons op venetoclax-rituximab. Opnieuw behandelen kan overwogen worden bij een langdurige respons. BTK-i na venetoclax is ook effectief.22
Expert opinion werkgroep voor chemo-immunotherapie na nieuwe doelgerichte therapie. Indien er een recidief is na 2 lijnen van nieuwe doelgerichte therapie (venetoclax en ibrutinib/acalabrutinib) en er geen sprake is van een 17p-deletie en/of TP53-mutatie kan chemo-immunotherapie overwogen worden. Bij een eerste recidief na acalabrutinib/ibrutinib heeft switch naar venetoclax de voorkeur en bij een recidief na venetoclax heeft switch naar ibrutinib/acalabrutinib de voorkeur boven switch naar chemo-immunothearpie.22 Effectiviteit van chemo-immunotherapie na nieuwe doelgerichte therapie is niet bekend.
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
4. Eichhorst B, Robak T, Montserrat E.Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
20. Seymour JF, Kipps TJ, Eichorst B, et al. Venetoclax-Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. N Engl J Med 2018;378:1107-20.
21. Ghia P, Pluta A, Wach M, et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38.
22. Mato AR, Hill BT, Lamanna N, et al. Optimal sequencing of ibrutinib, idelalisib, and ventoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Annals of Oncology 2017;28:1050-56.
36. Flinn IW, Hillmen P, Montillo M, et al. The phase 3 DUO trial: duvelisib vs ofatumumab in relapsed refractory CLL/SLL. Blood 2018;132(23):2446-2455.
37. Byrd JC, Hillmen P, O’Brien S, et al. Long-term follow-up of the RESONATE phase 3 trial of ibrutinib vs ofatumumab. Blood 2019;133(19):2023-42.
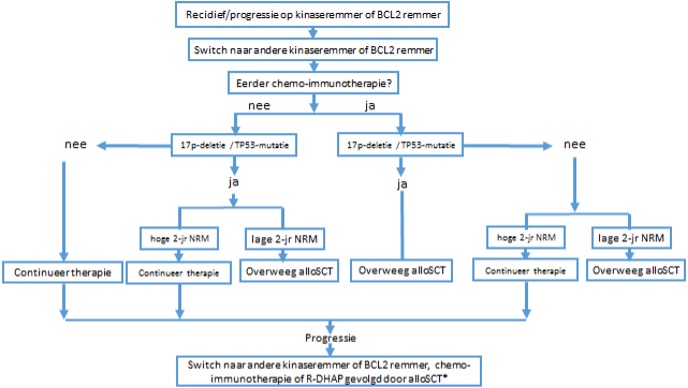
*Een lage kans op 2-jaar Non-relapse mortality (NRM): factoren die dit beïnvloeden zijn hogere leeftijd, slechte ‘WHO-performance’-score, geen 10/10 HLA-gematchte donor en vrouwelijke donor voor mannelijke patiënt en comorbiditeit
Expert opinion werkgroep ten aanzien van timing alloSCT:
AlloSCT kan ook later in het behandeltraject overwogen worden, waarbij de kans op het verkrijgen van een remissie vòòr alloSCT en de effectiviteit van alloSCT lager wordt ingeschat.
Onderbouwing
AlloSCT dient te worden overwogen in de volgende gevallen: (1): patiënten die refractair zijn op chemo-immunotherapie én op een kinaseremmer of venetoclax , met een 17p-deletie en/of TP53-mutatie, en nu responsief op een kinaseremmer of venetoclax, (2): patiënten die refractair zijn op chemo-immunotherapie en op een kinaseremmer of venetoclax met een lage kans op 2-jaar NRM, (3): patiënten die refractair zijn op een kinaseremmer of venetoclax met een lage kans op 2-jaar NRM, (4): patiënten die zowel refractair zijn op een kinaseremmer en op venetoclax en (5): patiënten een met een Richterse transformatie die klonaal gerelateerd is aan CLL. In het tweede en derde geval dient een alloSCT overwogen te worden en besproken te worden met de patiënt als een curatieve optie indien het risico op NRM laag is. Richterse transformatie, transformatie van CLL naar diffuus grootcellig B-cellymfoom (DLBCL), heeft een slechte prognose, waarbij mogelijk de prognose slechter is als DLBCL klonaal gerelateerd is aan de CLL. Daarom kan het meerwaarde hebben om de klonale relatie tussen DLBCL en CLL te onderzoeken middels IGHV sequencing. Behandeling bestaat uit chemotherapie middels R-CHOP (rituximab, cyclofosfamide, vincristine, doxorubicine en prednison) gevolgd door een alloSCT in geval van een klonaal gerelateerde DLBCL uit CLL. Als DLBCL niet klonaal gerelateerd is aan CLL, dient de ziekte als de novo DLBCL behandeld te worden. Transformatie van CLL naar Hodgkin is een andere entiteit met een veel betere prognose en dient behandeld te worden als een de novo Hodgkin.
Bij patiënten bij wie een allo-SCT overwogen wordt als consolidatie na Ven-R (patiënten met del(17) en/of gemuteerde TP53 en bij patiënten refractair op BTK-i) is er obv expert opinion aanvullende waarde van het bepalen van MRD in perifeer bloed op maand 9 van Ven-R. Indien deze <104 is de kans op een remissieduur van tenminste 2 jaar aanzienlijk hoger dan bij patiënten met een aantoonbare MRD.47 Derhalve kan overwogen worden om aan de hand van MRD te beoordelen of een alloSCT al dan niet direct opportuun is.
Expert opinion werkgroep voor indicatie alloSCT bij patiënten zonder 17p-deletie en TP53-mutatie met een recidief na ibrutinib of venetoclax-gebaseerde therapie in de eerste lijn.
Er worden (nu in studieverband en binnenkort buiten studieverband) steeds meer patiënten zonder 17p-deletie of TP53-mutatie in de eerste lijn behandeld met een kinase remmer of venetoclax. Het is bij deze groep patiënten onbekend of zij eventueel nog gevoelig zijn voor chemo-immunotherapie. Als deze patiënten refractair zijn op of intolerant voor een kinaseremmer of venetoclax dient opnieuw de gevoeligheid voor chemotherapie (17p-deletie/TP53-mutatie) te worden bepaald. Zijn deze afwijkingen niet aanwezig en zijn er daarnaast geen ongunstige kenmerken (zoals een complex karyotype), dan moet ervan uit worden gegaan dat zij in theorie nog chemotherapie-gevoelige ziekte hebben. Chemo-immunotherapie zou daarmee nog een optie kunnen zijn mochten zij falen op 2e lijns behandeling met een kinase remmer of venetoclax (er zijn echter geen data die dit ondersteunen). Op basis van dit argument hebben zij dan nog geen indicatie voor een allogene stamceltransplantatie.
Expert opinion werkgroep voor inductietherapie vooraf aan allogene stamceltransplantatie
Indien een allogene stamceltransplantatie overwogen wordt is het bereiken van partiële of complete remissie met een kinaseremmer of venetoclax aan te bevelen. Bij refractaire ziekte op zowel een kinaseremmer als venetoclax is R-DHAP een mogelijk effectieve inductie, deze is bij kinaseremmer en venetoclax naïve patiënten ook effectief bij patiënten met een 17p-deletie en/of TP53-mutatie. Bij kinaseremmer en/of venetoclax voorbehandelde patiënten is de effectiviteit van R-DHAP niet bekend. Een alternatieve mogelijkheid voor inductie is een schema volgens Castro met hoge dosis methylprednisolon in combinatie met rituximab.25
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijn:
4. Eichhorst B, Robak T, Montserrat E.Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
23. Dreger P, Ghia P, Schetelig J, et al. High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: integrating molecular and cellular therapies. Blood 2018; 132:892-902
24. Gribben JG, How and when I do allogeneic transplant in CLL. Blood 2018;132(1):31-39
25. Castro JE, Sandoval-Sus JD, Bole J, et al. Rituximab in combination with high-dose methylprednisolone for the treatment of fludarabine refractory high-risk chronic lymphocytic leukemia. Leukemia 2008;22(11):2048-53.
47. Kater AP, Seymour JF, Hillmen P, et al. Fixed duration of venetoclax-rituximab in relapsed/refractory chronic lymphocytic leukemia eradicates minimal residual disease and prolongs survival: post-treatment follow-up of the MURANO phase III study. J Clinic Oncol 2019;37(4):269-277.
|
Tabel 6: kuurschema’s |
|
|
FCR, streef 6 cycli
|
Fludarabine 40 mg/m2 per os dag 1-3, a 4 weken óf Fludarabine 25 mg/m2 i.v. dag 1-3, a 4 weken |
|
|
Cyclofosfamide 250 mg/m2 per os dag 1-3, a 4 weken |
|
|
Rituximab: eerste infusie 375 mg/m2 dag 1, daarna 500 mg/m2 dag 1, a 4 weken |
|
Bendamustine-Rituximab (BR90), streef 6 cycli, 1e lijn |
Bendamustine 90 mg/m2 i.v.dag 1-2, a 4 weken |
|
|
Rituximab: eerste infusie 375 mg/m2 dag 1, daarna 500 mg/m2 dag 1, a 4 weken |
|
Bendamustine-Rituximab (BR70), streef 4-6 cycli, 2e lijn |
Bendamustine 70 mg/m2 i.v.dag 1-2, a 4 weken |
|
|
Rituximab: eerste infusie 375 mg/m2 dag 1, daarna 500 mg/m2 dag 1, a 4 weken |
|
Chloorambucil voorkeursschema, streef 6 cycli |
chloorambucil 10 mg/m2 per os dag 1-7, a 4 weken |
|
Chloorambucil alternatieve schema’s |
chloorambucil 0,1-0,15 mg/kg/d per os continu, tot maximale respons, maximaal 1 jaar |
|
|
chloorambucil 10 mg per os dag 1-14, a 4 weken |
|
|
chloorambucil 0,4 mg/kg per os dag 1-14, a 4 weken |
|
|
chloorambucil 20 mg dag per os, dag 1-5, a 4 weken |
|
|
chloorambucil 0,5 mg/kg per os, dag 1 en 15, a 4 weken |
|
Anti-CD20 (in combinatie met chloorambucil), streef 6 cycli |
Obinutuzumab, cyclus 1 eerste infusie 100 mg+ 900 mg dag1,2, daarna 1000 mg dag 8 en 15, cyclus 2-6 1000 mg a 4 weken |
|
|
Rituximab: eerste infusie 375 mg/m2 dag 1, daarna 500 mg/m2 dag 1, a 4 weken |
|
Ibrutinib |
1 x daags 420 mg per os, continu tot aan progressie. (advies: 1e 6 maanden 3x140mg, bij stabiel ingesteld 1x420mg) |
|
Acalabrutinib |
2 x daags 100 mg per os, continue tot aan progressie. |
|
Zanubrutinib |
1 x daags 320 mg per os, continue tot aan progressie. |
|
Venetoclax – Obinutuzumab (12 cycli) |
Obinutuzumab, cyclus 1 eerste infusie 100 mg+ 900 mg dag1,2, daarna 1000 mg dag 8 en 15, cyclus 2-6 1000 mg a 4 weken |
|
|
Venetoclax 20 mg 1 x daags (cyclus 1, dag 22-28) Venetoclax 50 mg 1 x daags (cyclus 2, dag 1-7) Venetoclax 100 mg 1 x daags (cyclus 2, dag 8-14) Venetoclax 200 mg 1 x daags (cyclus 2, dag 15-21) Venetoclax 400 mg 1 x daags (cyclus 2, dag 22-28) Venetoclax 400 mg 1 x daags (cyclus 3-12, dag 1-28) |
|
Venetoclax – Rituximab (24 cycli)
|
Rituximab (dus pas starten na 5 weken dosis opbouw van venetoclax): eerste infusie 375 mg/m2 (cyclus 1), daarna 500 mg/m2 (in cyclus 2-6) dag 1, a 4 weken |
|
|
Venetoclax 20 mg 1 x daags (dosis opbouw, dag 1-7) Venetoclax 50 mg 1 x daags (dosis opbouw, dag 8-14) Venetoclax 100 mg 1 x daags (dosis opbouw, dag 15-21) Venetoclax 200 mg 1 x daags (dosis opbouw, dag 22-28) Venetoclax 400 mg 1 x daags (dosis opbouw, dag 28-35) Venetoclax 400mg 1 x daag (cyclus 1-24, dag 1-28) |
|
Venetoclax – Ibrutinib (15 cycli)
|
Ibrutinib 420 mg 1x daags (cyclus 1-15, dag 1-28) Venetoclax 20 mg 1 x daags (cyclus 4, dag 1-7) Venetoclax 50 mg 1 x daags (cyclus 4, dag 8-14) Venetoclax 100 mg 1 x daags (cyclus 4, dag 15-21) Venetoclax 200 mg 1 x daags (cyclus 4, dag 22-28) Venetoclax 400 mg 1 x daags (cyclus 5-15, dag 1-28) |
|
Venetoclax monotherapie (tot aan progressie)
|
Venetoclax 20 mg 1 x daags (dag 1-7) Venetoclax 50 mg 1 x daags (dag 8-14) Venetoclax 100 mg 1 x daags (dag 15-21) Venetoclax 200 mg 1 x daags (dag 22-28) Venetoclax 400 mg 1 x daags (vanaf dag 29 tot aan progressie) |
|
Idelalisib continu, Rituximab (max 8 keer) |
2 keer daag 150 mg per os, continu tot aan progressie |
|
|
Rituximab week 1: 375 mg /m2 dag 1, week 3, 5, 7, 9, 13, 17, 21: 500 mg /m2 dag 1 |
|
R-DHAP, 1-3 kuren, streef ten minste PR
|
Dexamethason 40 mg per os of i.v dag 1-4, a 4 weken Cisplastin 100 mg/m2 i.v. dag 1 Cytarabine 2000 mg/m2 i.v. a 12 uur dag 2 |
|
|
Rituximab: eerste infusie 375 mg/m2, daarna 500 mg/m2 |
|
HD-methylprednisolon-rituximab (max 3 keer) |
HD -methylprednisolon 1 g/m2 i.v. dag 1-5, a 4 weken |
|
|
Rituximab: 375 mg/m2, dag 1, 3, 5, 8, 17 en 22 (cyclus 1), dag 1, 7, 14 en 21 (cyclus 2-3) |
Aanbevelingen
Algemeen:
Infectiepreventie:
PCP-profylaxe met cotrimoxazol 1 dd 480 mg, tot 12 maanden na FCR, bendamustine- rituximab, idelalisib-rituximab.
Herpesprofylaxe op indicatie volgens lokale protocol
Geen standaard PCP-, herpes- en antischimmel profylaxe bij BTKi en venetoclax
Monitoring CMV-infectie bij PI3Ki, bijvoorbeeld 1x per maand
Bestraalde bloedproducten tot 6 maanden na FCR
Hieronder volgen specifieke richtlijnen tav toxiciteit door targeted therapieën
Venetoclax:
Tumorlyse-preventie bij venetoclax
Bereken tumorlyse risico volgens tabel 7
Neem voorzorgsmaatregelen ter preventie van tumorlyse volgens tabel 8
Volg dosis opbouw in dosering van venetoclax volgens tabel 6
Waarborg controle van laboratoriumuitslagen volgens tabel 8 (SORT B)
Neutropenie bij venetoclax:
Als alleen neutropenie: start G-CSF, stop 1 week venetoclax en hervat (SORT C)
daarna. Overweeg tijdelijk dosis halvering. Zie figuur 1.
Omgaan ten aanzien van CYP3A4 remmers en inductoren bij Venetoclax: (SORC C)
Absolute contra-indicatie voor sterke CYP3A4 remmers, zoals ketaconazol
Relatieve contra-indicatie voor CYP3A4 remmers, zoals verapamil, diltiazem, amiodarone, voriconazol en itraconazol en P-glyco-proteinesubstraten zoals digoxine.
Overleg met apotheker ten aanzien van dosisreductie.
BTKi (acalabrutinib/ibrutinib/zanubrutinib):
Verhoogd bloedingsrisico bij BTKi:
Absolute contra-indicatie voor BTKi indien gebruik van vitamine-K-antagonist of DOAC in combinatie met een trombocytenaggregatieremmer of indien dubbele trombocytenaggregatieremmers
Switch bij voorkeur vitamine-K-antagonisten naar een DOAC
Staak BTKi, 3-7 dagen, rondom invasieve ingrepen
Staak BTKi bij een ernstige bloeding en dien trombocytentransfusie toe
Atriumfibrilleren bij BTKi:
BTKi kan gecontinueerd worden bij atriumfibrilleren
Gebruik bij voorkeur een bètablokker als anti-aritmicum (gezien interactie van andere anti-aritmica en ibrutinib)
Start bij voorkeur een DOAC als antistolling noodzakelijk is; weeg bloedings- en tromboserisico af (SORT C)
Hypertensie bij BTKi:
Controleer bij elk polibezoek de bloeddruk en behandel zo nodig met een antihypertensivum Op basis van de pathofysiologie en klinische ervaring blijken calciumantagonisten met name effectief te zijn. (SORT C)
Omgaan ten aanzien van CYP3A4 remmers en inductoren bij BTKi:
Absolute contra-indicatie voor sterke CYP3A4 remmers, zoals ketaconazol
Relatieve contra-indicatie voor CYP3A4 remmers, zoals verapamil, diltiazem, amiodarone, voriconazol, itraconazol en P-glyco-proteinesubstraten zoals digoxine Overweeg dosisreductie van ibrutinib (SORT C)
Omgaan ten aanzien van protonpomp remmers bij BTKi:
De opname van acalabrutinib (niet de andere BTKi) wordt sterk verlaagd door PPI’s. Sterke voorkeur om PPI te staken. (NB: de nieuwe formulering van acalabrutinib is niet gevoelig voor een slechtere opname bij PPI (ten tijde van publicatie van deze richtlijn is de nieuwe formulering nog niet overal beschikbaar).
Infecties bij BTKi:
Overweeg tijdens een ernstige infectie BTKi tijdelijk te staken (pas op voor flare-up bij recent starten van BTKi, zie hierboven) (SORT C)
PI3Ki (Idelalisib):
Diarree en pneumonitis bij PI3Ki:
Staak PI3Ki bij gr 1-2 diarree, die langer dan 3 dagen aanhoudt en bij gr 3-4 diarree.
Staak PI3Ki zo nodig bij longklachten en hoge resolutie CT-afwijkingen niet passend bij lobaire pneumonie.26
Dien zo nodig corticosteroïden toe. (SORT C)
Transaminitis bij PI3Ki:
Monitor frequent ASAT en ALAT, met name in de 1e 3 maanden
Staak zo nodig PI3Ki of dien corticosteroïden toe.26 (SORT C)
Tabel 7: berekening tumorlyse risico bij venetoclax
|
TLS risico categorie |
grootste diameter van alle meetbare lymfeklieren |
|
absolute lymphocyte count (ALC) |
|
GFR |
|
laag |
< 5cm |
EN |
< 25 ´ 109/L |
EN |
> 50 ml/min |
|
Intermediair |
³ 5 en < 10 cm |
OF |
≥ 25 ´ 109/L |
EN |
> 50 ml/min |
|
hoog |
³ 5 en < 10 cm |
EN |
≥ 25 ´ 109/L |
OF |
30-50 ml/min |
|
> 10 cm |
|
Irrelevant |
|
|
Tabel 8: voorzorgsmaatregelen ter preventie van tumorlyse bij venetoclax
|
TLS risico categorie |
Voorzorgsmaatregelen |
Laboratorium bepaling*** |
|
|
|
Hydratie |
Anti-hyperuricemics |
Setting and frequentie van laboratorium bepalingen |
|
Laag
|
Oraal (1.5-2 L)* |
Allopurinol** |
Poliklinisch: 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg 2. Alleen vòòr start bij 1e gift van 100 mg, 200 mg, 300 mg en 400 mg |
|
Intermediair
|
Oraal (1.5-2 L)* en overweeg intraveneus op dagen van start venetoclax en bij 1eophoging naar 50 mg venetoclax |
Allopurinol** |
Poliklinisch: 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg 2. Alleen vòòr start bij 1e gift van 100 mg, 200 mg, 300 mg en 400 mg |
|
Hoog
|
Oraal (1.5-2 L)* en intraveneus (100-200 mL/hr) tot in ieder geval 24 uur na 1egift van 20 mg en 50 mg |
Allopurinol** Rasburicase wordt aanbevolen indien urinezuur is verhoogd**
|
Klinische opname bij start van 1e gift van 20 mg en 50 mg 1. Vòòr start én 6 tot 8 uur én 24 uur na 1e gift van 20 mg en 50 mg Poliklinisch bij start van subsequente doseringen met lab als bij 1 |
*gedurende de gehele ramp-up periode.
**allopurinol moet niet worden gegeven op dagen van rasburicase.
***De volgende laboratoriumbepalingen dienen bepaald te worden: vòòr start van elke ophoging in dosering: hemoglobine, leukocyten, lymfocyten, trombocyten, natrium, kalium, calcium, albumine, fosfaat, urinezuur, kreatinine en LDH. 6 tot 8 uur (én 24 uur) na elke 1e gift van opgehoogde dosering: kalium, calcium, fosfaat, urinezuur en creatinine.
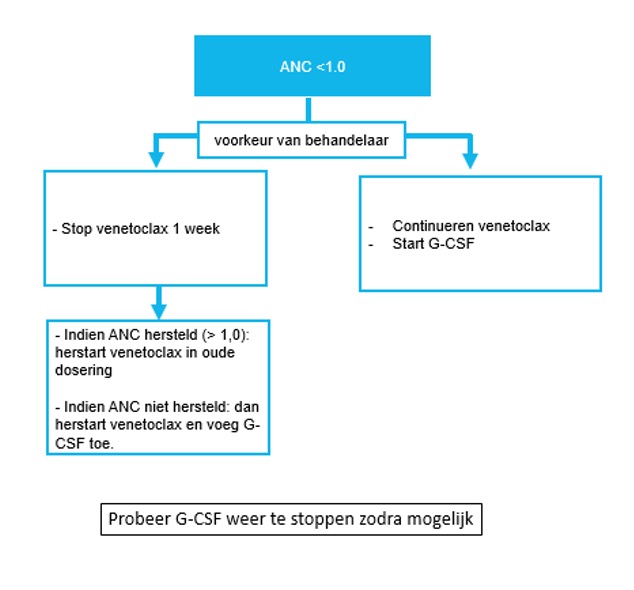
Figuur 1: G-CSF of tijdelijk staken venetoclax indien neutropenie bij venetoclax
Onderbouwing
Achtergrondinformatie maatregelen ter preventie en/of behandeling van bijwerkingen
Venetoclax. Venetoclax geeft een verhoogd risico op tumorlysis syndroom, daarom is een speciaal opbouwschema en maatregelen ter voorkoming van tumorlysis syndroom noodzakelijk. Vanwege de hogere kans op tumorlyse en omdat ventoclax niet getest is bij nierfunctiestoornissen met een klaring < 30 ml/min geldt een relatieve contra-indicatie voor venetoclax. Neutropenie treedt vaak op, wat overigens meestal niet gepaard gaat met neutropene koorts. G-CSF, pegfilgrastim of filgrastim, of tijdelijk staken venetoclax (1 week) wordt geadviseerd in geval van neutropenie volgens figuur 1. Meestal volstaat pegfilgrastim 6 mg 1 keer per 4 weken of filgrastim 5 mg/kg 1-2x per week.
BTKi (Ibrutinib, acalabrutnib en zanubrutinib). Ibrutinib geeft een verhoogde kans op ecchymoses en hematomen, de kans op ernstige bloedingen is echter klein. Vanwege het gebrek aan ervaring met vitamine-K-antagonisten is het advies om bij voorkeur te switchen naar een DOAC indien mogelijk. Er geldt geen absolute contra-indicatie voor ibrutinib bij gelijktijdig gebruik van vitamine-K-antagonisten of een DOAC, maar voorzichtigheid is geboden als er een alternatieve behandeling beschikbaar is. Gezien het verhoogde risico op bloedingen, bij het gebruik van zowel een vitamine-K-antagonist of een DOAC in combinatie met een tromocytenaggregatieremmer en bij het gebruik van dubbele trombocytenaggregatieremmers is dit een contra-indicatie voor ibrutinib. Verder is het advies om ibrutinib, 3-7 dagen te staken rondom invasieve ingrepen. Het onderbreken van de behandeling voor 8-14 dagen lijkt veilig en beïnvloedt de PFS niet. Ibrutinib geeft een hogere kans op atriumfibrilleren, reeds bekend atriumfibrilleren is echter geen contra-indicatie voor ibrutinib, maar voorzichtigheid is geboden, temeer als er een alternatieve behandeling is. Alhoewel er geen overtuigend bewijs is wordt ook voorzichtigheid geboden in geval van het bestaan van andere cardiale arrhythmieën en/of bij significante cardiovasculaire comorbiditeit. Indien er een alternatieve anti-CLL-therapie beschikbaar is, wordt deze geadviseerd. Ibrutinib en mogelijk de andere BTKi’s geeft een mogelijk licht verhoogde kans op infecties, met name opportunistische infecties zoals aspergillus, met name bij gelijktijdig steroïden gebruik. PCP-profylaxe wordt niet standaard geadviseerd, omdat het absolute risico laag is, maar alertheid op (opportunistische) infecties is nodig. Overweeg tijdens een ernstige infectie ibrutinib tijdelijk te staken. Acalabrutinib en zanubrutinib zijn ook een BTK-remmers en geven dezelfde bijwerkingen als ibrutinib, mogelijk komen de bijwerkingen als atriumfibrilleren en acute hartdood iets minder vaak voor bij acalabrutinib en zanubrutinib, echter deze bijwerkingen zijn zeer waarschijnlijk een klasse-effect en langere termijn data van acalabrutinib en zanubrutinib ontbreken nog.40 Voorzorgsmaatregelen en adviezen die voor ibrutinib gelden, gelden ook voor acalabrutinib en zanubrutinib.
Idelalisib. Idelalisib geeft meer toxiciteit dan ibrutinib en venetoclax. Dit betreft met name immuun-gemedieerde hepatitis en diarree. Bij idelalisib is er een verhoogde kans op ernstige infecties waaronder PCP-, herpes en CMV- reactivatie, en dient PCP en herpes profylaxe te worden voorgeschreven. Ook komen colitis, pneumonitis, transaminitis en huidtoxiciteit vaak voor. Management hiervan is elders beschreven.26,32 Door de bijwerkingen is dit middel alleen geïndiceerd wanneer er een contra-indicatie is voor ibrutinib en venetoclax.
Expert opinion ten aanzien van onderbreken ibrutinib. Indien ibrutinib onderbroken dient te worden, dient ibrutinib afgebouwd te worden bij patiënten die recent gestart zijn (<6 maanden na start), om flare-up van CLL te voorkomen (bij gebruik korter dan 6 maanden).
Expert opinion ten aanzien van gebruik CYP3A4 remmers bij ibrutinib en venetoclax. Ibrutinib en venetoclax worden gemetaboliseerd door CYP3A, daarom is voorzichtigheid geboden bij gelijktijdig gebruik van CYP3A4 remmers of inductoren, zoals bijvoorbeeld anti-aritmica (verapamil, diltiazem en amiodarone), antihypertensiva, of bepaalde antibiotica en/of antischimmelmiddelen. Voorzichtigheid is ook geboden met P-glycoproteine-substraten, zoals digoxine (zie voor aanbevelingen FK-kompas). Indien het noodzakelijk is om een anti-arrhythmicum voor te schrijven, zoals verapamil, diltiazem of amiodarone, of anti-schimmel-middelen, zoals voriconazol en itraconazol, overweeg verlaging van de dosering ibrutinib bij vermoede toxiciteit van ibrutinib. Doe dit indien mogelijk op geleide van bepaling van spiegels van ibrutinib. Farmacokinetische studies laten zien dat bij gelijktijdig gebruik van deze CYP3A4 remmers een reductie van ibrutinib naar 1 dd 140 mg een therapeutische spiegel van ibrutinib geeft.28,29 Er is een absolute contra-indicatie voor sterke CYP3A4 remmers bij gebruik van ibrutinib en venetoclax, zoals ketaconazol.
Expert opinion ten aanzien van verlaging van dosering bij ibrutinib Er zijn data die laten zien dat verlaagde dosering van ibrutinib (280 mg of 140 mg) gepaard gaat met gelijke effectiviteit en mindere toxiciteit, verlaging van dosering kan daarom overwogen worden bij toxiciteit. Wel moet hierbij vermeld worden, dat dit niet uitgebreid onderzocht is. De grootste studie van Mato et al betreft een retrospectieve studie van 37 CLL-patiënten met gereduceerde dosis ibrutinib die werd vergeleken met 160 CLL-patiënten met normale dosis ibrutinib. Dit betreft een studie met beperkte follow-up van gemiddeld 2 jaar.30 Daarnaast laat Chen et al, prospectief onderzoek zien van 11 CLL-patiënten met gereduceerde dosis ibrutinib met een follow-up van 1 jaar.31
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijnen:
4. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
26. Weerdt I, Koopmans SM, Kater AP, et al. Bijwerkingen van ibrutinib en idelalisib: een praktijkgerichte aanpak. Ned Tijdschr Hematol 2018;15:3-14
27. Stephens DM, Byrd JC. How I manage ibrutinib intolerance and complications in patients with chronic lymphocytic leukemia. Blood 2019;133(12):1298-1307
28. De Jong J, Hellemans P, De Wilde S, et al. A drug-drug interaction study of ibrutinib with moderate/strong CYP3A inhibitors in patients with B-cell malignancies. Leukemia & Lymph 2018; 1042-8194
29. De Zwart L, Snoeys J, De Jong J, et al. Ibrutinib dosing strategies based on interaction potential of CYP3A4 perpetrators using physiologically based pharmacokinetic modeling. Clin Pharmacol Ther 2016;100(5):548-557.
30. Mato AR, Timlin C, Ujjani C, et al. Comparable outcomes in chronic lymphocytic leukaemia (CLL) patients treated with reduced-dose ibrutinib: results from a multi-centre study. Br J Haematol 2018;181(2):259-61
31. Chen LS, Bose P, Cruz ND, et al. A pilot study of lower doses of ibrutinib in patients with chronic lymphocytic leukemia. Blood 18;132(21):2249-59
32. Coutre SE, Barrientos JC, Brown JR, et al. Management of adverse events of associated with idelalisib treatment: expert panel opinion. Leuk&Lymphoma 15;56(10):2779-2786
Aanbevelingen
Warmte auto-immuun anemie of trombocytopenie:
Indien geen indicatie voor behandeling CLL zelf, dan behandeling gelijk aan primaire AIHA dan wel ITP.
Indien geen respons op prednison/rituximab, dan CLL behandelen (SORT C) Bij fulminante AIHA (levensbedreigend/grote transfusiebehoefte) wordt geadviseerd te overleggen met een expertisecentrum mbt AIHA.
Indien geen respons op steroïden/rituximab, dan CLL behandelen; dit heeft de voorkeur boven TPO-agonisten (SORT C)
Immuun cytopenie na purine-analogen:
Staken purine-analogen, start prednison 1 mg/kg (SORT C)
Indien geen verbetering: overweeg ciclosporine toevoegen (SORT C)
Recidiverende luchtweginfecties
Bij recidiverende infecties wordt naast diagnostiek antibiotica on demand aanbevolen. In het geval van ≥ 3 infecties per jaar is profylactisch antibiotica aangewezen: cotrimoxazol 1 dd 960 mg, azitromycine 3 keer per week 250mg of doxycycline 1 dd 100 mg (figuur 3) (SORT A)
Hypogammaglobulinemie:
Overweeg immunoglobuline suppletie bij:
Dosering immuunglobulines: 100mg/kg/week of 200-400mg/kg per 3-4 weken. i.v. toediening of subcutane toediening is mogelijk. Streef een dalspiegel in geval van recidiverende infecties > 6 g/L of bij aanhoudende infecties en/of bij structurele schade (bronchiëctasieën) > 8 g/L. (SORT C)
Therapie evaluatie: Het effect van Immuunglobuline suppletie na 6 maanden tot 1 jaar evalueren. Indien de infecties onder controle zijn kan een dosisverlaging of op proef staken overwogen worden. Bij patiënten met complicaties is levenslange immuunglobuline suppletie geïndiceerd. (SORT C)
Vaccinaties:
Zie voor aanbevolen vaccinaties, richtlijn RIVM24 (SORT C)
Indien tijd het toelaat is de aanbeveling om vaccinaties te geven voorafgaand aan het starten van een behandeling. Dit geldt mn voor anti-CD20 bevattende behandeling en BTK-i.
Symptomatische lymfadenopathie en/of splenomegalie bij patiënt met contra-indicatie voor systemische therapie:
Radiotherapie 2×2 Gy (SORT C)
Aanvullende/complementaire zorg:
Voor aanvullende adviezen tav complementaire zorg, zie de website van kanker.nl: https://www.kanker.nl/gevolgen-van-kanker/complementaire-zorg-aanvullende-zorg-bij-kanker/algemeen/complementaire-zorg-bij-kanker
Figuur 3: stappenplan behandeling recidiverende infecties

Onderbouwing
Achtergrondinformatie complicaties4
Immunoglobuline suppletie heeft geen invloed op de overleving en moet alleen overwogen worden bij patiënten met recidiverende infecties en een hypogammaglobulinemie of patiënt met complicaties van de recidiverende infecties zoals longschade (bronchiëctasieën).33 Pneumococcen-vaccinatie en jaarlijkse griepvaccinatie wordt aanbevolen bij vroeg stadium CLL.34
Wanneer lymfadenopathie grote klachten geeft bij patiënten met een contra-indicatie voor chemo-immunotherapie of kinaseremmers kan lage dosis radiotherapie palliatie geven.
Expert opinion CLL-werkgroep ten aanzien van immunoglobuline suppletie. Een klinisch relevante hypogammaglobulinemie is in de praktijk veelal een totaal IgG ≤ 5 g/L. Bij suppletie dienen de volgende streefwaardes minimaal bereikt te worden: IgG dalspiegel > 6 g/L en in geval van aanhoudende infecties of structurele schade > 8 g/L. Op basis van extrapolatie van data van primaire immuundeficiënties zou een IgG dalspiegel van > 8 g/L optimaal zijn, maar hiervoor is geen direct bewijs bij CLL-patiënten.
Literatuurverantwoording
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de CLL-werkgroep en de richtlijnen:
4. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
33. Lucas M, Lee M, Lortan J, Lopez-Granados E, Misbah S, Chapel H. Infection outcomes in patients with common variable immunodeficiency disorders: relationship to immunoglobulin therapy over 22 years. J Allergy Clin Immunol.2010 Jun;125(6):1354-1360
34. Vaccinatie bij hematologische aandoeningen. LCI-richtlijnen (rivm.nl)
Aanbevelingen bij niet progressieve CLL zonder klinische symptomen:
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties.
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Aanbevelingen CLL tijdens/na behandeling:
Anamnese: niveau van functioneren (‘WHO-performance’-score), koorts, gewichtsverlies, nachtzweten en infecties.
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt
Bloeddruk regulatie gezien bijwerking hypertensie bij BTKi
Bloedonderzoek:
Hb, leukocyten, trombocyten, leukocytendifferentiatie
Lever- en nierfunctie
Tijdens ramp-up venetoclax en chemo-immunotherapie: tumorlyse lab
Beenmergonderzoek:
Indien cytopenie of indien consequenties bij complete remissie of minimale rest ziekte (zoals in studies)
Beeldvorming:
CT hals-thorax-abdomen volgens Cheson criteria beoordelen (achterwegen laten indien geen consequenties) (SORT C)
Measurable residual disease (MRD):
In veel studies wordt MRD gemeten met flowcytometrie of met moleculair onderzoek. Voor zowel CIT als time-limited behandeling met venetoclax + een antistof correleert MRD sterk met PFS. Buiten studies echter, is er op dit moment geen klinische meerwaarde van het bepalen van MRD bij de respons evaluatie. Er lopen studies naar behandelduur obv MRD, maar dat wordt buiten studies op dit moment niet toegepast.
Onderbouwing
Achtergrondinformatie follow-up en responsbeoordeling1,4
Alle patiënten dienen in principe levenslang follow-up te krijgen. Bij asymptomatische patiënten dient een bloedonderzoek en lichamelijk onderzoek te gebeuren elke 3-12 maanden afhankelijk van de dynamiek van de ziekte. CLL-patiënten hebben een verhoogde risico op het ontwikkelen van secundaire maligniteiten. CT hals-thorax-abdomen maakt nauwkeurige respons-evaluatie mogelijk en moet beoordeeld worden volgens de Cheson-criteria.
Expert opinion ten aanzien van follow-up. Eventueel kan patiënt met een rustige, stabiele CLL, met goede adviezen worden terugverwezen naar de huisarts voor follow-up.
Tabel 9: respons1
|
|
Complete remissie |
Partiële remissie |
Progressieve ziekte |
|
|
Respons definitie: |
Alle criteria nodig |
Ten minste 2 criteria van A plus 1 criterium van B (minimale duur van 2 maanden) |
Ten minste 1 criterium |
|
|
A
|
Lymfadenopathie |
Afwezig (geen ≥ 1,5 cm) |
≥50% afname vanaf start, geen toename of nieuwe laesies |
≥50% toename vanaf start of vanaf respons |
|
Hepato/splenomegalie |
Miltgrootte < 13 cm |
≥50% afname vanaf start |
≥50% toename vanaf start of vanaf respons |
|
|
B-symptomen |
Afwezig |
Niet van toepassing |
Niet van toepassing |
|
|
Bloed lymfocyten |
Normaal, <4,0 10^9/l |
≥50% afname vanaf start |
≥50% toename vanaf start(≥5,0×10^9/cellen) |
|
|
B |
Trombocyten |
≥ 100×10^9/l |
≥ 100×10^9/l of ≥50% toename vanaf start |
≥50% afname vanaf startsecundair aan CLL |
|
Hemoglobine |
>6,8 mmol/l |
>6,8 mmol/l of toename ≥50% na start |
Afname van >1,3 mmol/l vanaf start secundair aan CLL |
|
|
Beenmerg |
Normocellulair, geen CLL cellen, geen B-lymfoide nodi |
Aanwezigheid van CLL cellen of B-lymfoide nodi, of niet verricht |
≥50% toename van CLL cellen |
Literatuurverantwoording:
Er is gebruik gemaakt van onderstaande richtlijn zonder aanvullende systematische literatuur-analyse:
1. Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL Blood 2018; 131(25):2745-2760.
4. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2021 Jan;32(1):23-33
© 2022. Alle rechten voorbehouden