Terug naar het richtlijnenoverzicht
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk en/of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig wordt gemotiveerd afgeweken van de richtlijn.
Deze richtlijn is een document met aanbevelingen voor de dagelijkse praktijk van de diagnostiek en behandeling van CML bij volwassenen en beoogt bij te dragen aan een optimale overleving van deze patiënten. De richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Deze richtlijn is vooral bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met CML, zoals internist-hematologen, internist-oncologen, oncologieverpleegkundigen, verpleegkundig specialisten/physician-assistants, moleculair-biologen, klinisch chemici en klinisch genetici.
dr. J.J.W.M. Janssen (voorzitter, tevens gemandateerd door de NVVH)
dr. P. van Balen
prof. dr. B.J. Biemond
prof. dr. N.M.A. Blijlevens
drs. M. Donker
dr. P.A.W. te Boekhorst
dr. F.C.J.I. Heubel-Moenen
dr. M. Hoogendoorn
dr. L.G.M. van Hussen-Daenen
dr. A. Jie
dr. S. Kersting
dr. S.K. Klein
dr. E.F.M. Posthuma
dr. B. Van der Reijden
dr. W.M. Smit
dr. N. Thielen
drs. T. T. de Waal
dr. P.E. Westerweel
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen. Onderstaand overzicht toont de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van op voorhand opgestelde selectiecriteria.
Kwaliteitsindicatoren
De CML-richtlijnencommissie definieert hieronder een aantal kwaliteitscriteria.
Algemene voorwaarden voor optimale CML-behandeling:
Aanvullende algemene voorwaarden in geval er een indicatie voor een allo-SCT gesteld is:
Advies ten aanzien van beschikbaarheid van TKI
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast wordt er een toelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de NVVH website.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon.
De behandeling van chronische myeloïde leukemie (CML) is sinds de introductie van tyrosinekinaseremmers (TKI) in 2001 revolutionair veranderd. De meeste patiënten hebben tegenwoordig met orale middelen een uitstekend vooruitzicht qua overleving. Bij een deel van de patiënten kan de behandeling zelfs blijvend gestaakt worden. Voor patiënten die niet kunnen stoppen hebben bijwerkingen, ook al zijn deze meestal relatief mild, soms een grote negatieve impact op hun kwaliteit van leven. Daarnaast heeft een minderheid van de patiënten onvoldoende moleculaire respons op de beschikbare middelen en is daarom een allogene stamceltransplantatie (alloSCT) ook nu soms nodig om een meestal fatale blastencrisis te voorkomen.
De incidentie van CML neemt toe met de leeftijd en bedraagt in westerse landen globaal 1: 100.000.1 Door de goede behandelresultaten stijgt de geschatte prevalentie tot ongeveer 35 patiënten per 100.000 rond 2050.2,3
CML valt sinds 2017 onder het werkveld van de HOVON MPN-werkgroep. De MPN-werkgroep is van mening dat de behandeling van CML plaats moet vinden in centra waar aantoonbare interesse voor en kennis over CML-behandeling bestaat, zich onder meer uitend in lidmaatschap van de landelijke werkgroep, het aantoonbaar bijwonen van nascholing op het gebied van CML en/of participatie in wetenschappelijke CML-studies. Geadviseerd wordt patiënten naar deze centra te verwijzen en ten minste te wijzen op CMyLife (www.cmylife.nl) met betrouwbare en onafhankelijke informatie over diagnostiek, behandeling en begeleiding van patiënten met CML. Hierover meer verderop in deze richtlijn.
In deze richtlijn zijn vooral de nieuwste gegevens betreffende effectiviteit en veiligheid van de behandeling van CML beschreven. Voor alle nodige achtergrondinformatie verwijzen we naar eerdere versies van deze richtlijn. Veel aandacht wordt geschonken aan de noodzaak tot goede moleculaire monitoring, het omgaan met bijwerkingen van de verschillende TKI’s en het staken van de TKI behandeling. Daarnaast worden nieuwe ontwikkelingen in de behandeling van CML besproken.
De laatste versie van deze richtlijnen verscheen in 2018. Nieuwe diagnostische criteria en een aangepaste stadiumindeling door de WHO, het beschikbaar komen van het nieuwe middel asciminib, belangrijke gegevens omtrent de langetermijnbijwerkingen van met name de tweedegeneratie TKI’s en nieuwe inzichten over het stoppen van TKI behandeling maken een nieuwe update van de huidige richtlijnen noodzakelijk.
Voorafgaand aan de ontwikkeling van de richtlijn zijn een aantal uitgangsvragen geformuleerd. Deze betreffen een relatief beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met CML. De uitgangsvragen vormen de basis voor de volgende modules van deze richtlijn:
Aanbevelingen
Expert opinion
Achtergrond
Zeer recent is de 5e editie van de WHO Classification of Tumours, Haematolymphoid Tumours verschenen.4 Voorgaande edities kwamen voort uit een samenwerking tussen de WHO, de Society for Hematopathology (SH) en de European Association for Haematopathology (EAHP) ondersteund door adviezen van een klinische adviescommissie (CAC) die uit pathologen, hematologen, oncologen en genetici bestond. De WHO koos er nu echter voor om zelfstandig een nieuwe classificatie vorm te geven zonder hulp van een CAC, hetgeen de SH en EAHP deed besluiten dan maar zonder de WHO een eigen CAC samen te stellen die de WHO classificatie van 2016 moest updaten, leidend tot een zogenoemde International Consensus Classification (ICC).5
Naast vrij essentiële verschillen in andere myeloïde maligniteiten tussen de ICC en de nieuwe WHO classificatie is ook de indeling van CML in fasen duidelijk verschillend. De diagnostische WHO-criteria voor CML in het algemeen staan vermeld in Tabel 1. De WHO heeft de term acceleratiefase vervangen door “hoog-risico chronische fase” (zie Tabel 2 voor de diagnostische criteria), terwijl de ICC de naamgeving acceleratiefase heeft laten bestaan. Het hoofdstuk CML in de WHO classificatie is echter wel door een aantal clinici geschreven die ook deelnemen aan de richtlijnencommissie van het European Leukemia Net (ELN), waarin ook HOVON vertegenwoordigd is. Vandaar dat de HOVON CML richtlijncommissie het hier logischer vindt om de WHO classificatie te volgen.



CML met hoog-risico kenmerken
De reden voor de veranderde indeling van de CML fases is dat in de meeste gevallen een chronische fase met hoogrisicokenmerken (verder “CML in hoog-risico chronische fase” genoemd) nog steeds uitstekend kan reageren op behandeling met een tyrosinekinaseremmer.
Bij 5-10 % van de patiënten wordt bij diagnose niet een standaard translocatie tussen de chromosomen 9 en 22 gevonden, maar zijn meerdere (tot wel 5) chromosomen betrokken.6,7 In die gevallen is er altijd wel een BCR::ABL-fusie en zal bij FISH-onderzoek een normaal fusiesignaal aangetroffen worden. Dergelijke 3-, 4- of 5-wegtranslocaties hebben geen betekenis voor de prognose en er is normale activiteit van de TKIs te verwachten.6,8-14
Patiënten kunnen echter naast de al dan niet complexe translocatie tussen 9 en 22 nog andere afwijkingen hebben in de Philadelphia-chromosoom-positieve cellen, de zogenoemde additionele chromosomale afwijkingen (ACA’s), die de kans op progressie van de ziekte beïnvloeden. Hierbij wordt onderscheid gemaakt tussen hoog-risico ACAs en laag-risico ACAs. De hoog-risico ACAs betreffen: trisomie 8, trisomie 19, deletie 7/del(7q), verdubbeling van het Philadelphia chromosoom, isochromosoom 17q, afwijkingen aan 3q26.2 (waar het EVI1 locus zich bevindt), trisomie 21, 11q23 en complexe aberrante karyotypes.15-17
Indien chromosomaal onderzoek gebruikt wordt voor responsmonitoring kunnen bij 9% van de patiënten ook afwijkingen gezien worden in de Philadelphia-negatieve cellen.18 Het betreft soms uitgebreide afwijkingen. Hoewel in de meeste gevallen de additionele chromosomale afwijkingen voorbijgaand blijken te zijn, is recent gerapporteerd dat patiënten met dergelijke afwijkingen toch een slechtere overleving hadden dan andere patiënten met een 5-jaars kans op progressie van de ziekte van 24% versus 6% en een 5-jaars overleving van 79% versus 94%.19
De aanwezigheid van clonale cytogenetische afwijkingen in Ph-negatieve klonen gaat ook gepaard met een hoger risico op hematologische toxiciteit tijdens TKI behandeling.16
Naast chromosomale afwijkingen is bij een deel van de patiënten sprake van mutaties zoals ook gezien kunnen worden bij clonale hematopoiëse van onbekende betekenis. Bij CML blijkt uit nog vrij beperkte gegevens dat patiënten met deze mutaties, waaronder ASXL1 (voorkomend bij 14-24% van de patiënten bij diagnose) in het algemeen minder goed reageren op de behandeling en minder kans hebben op een succesvolle stop van de behandeling.20-23
Ook tijdens behandeling kunnen kenmerken van hoog-risico ziekte ontstaan. Deze betreffen:
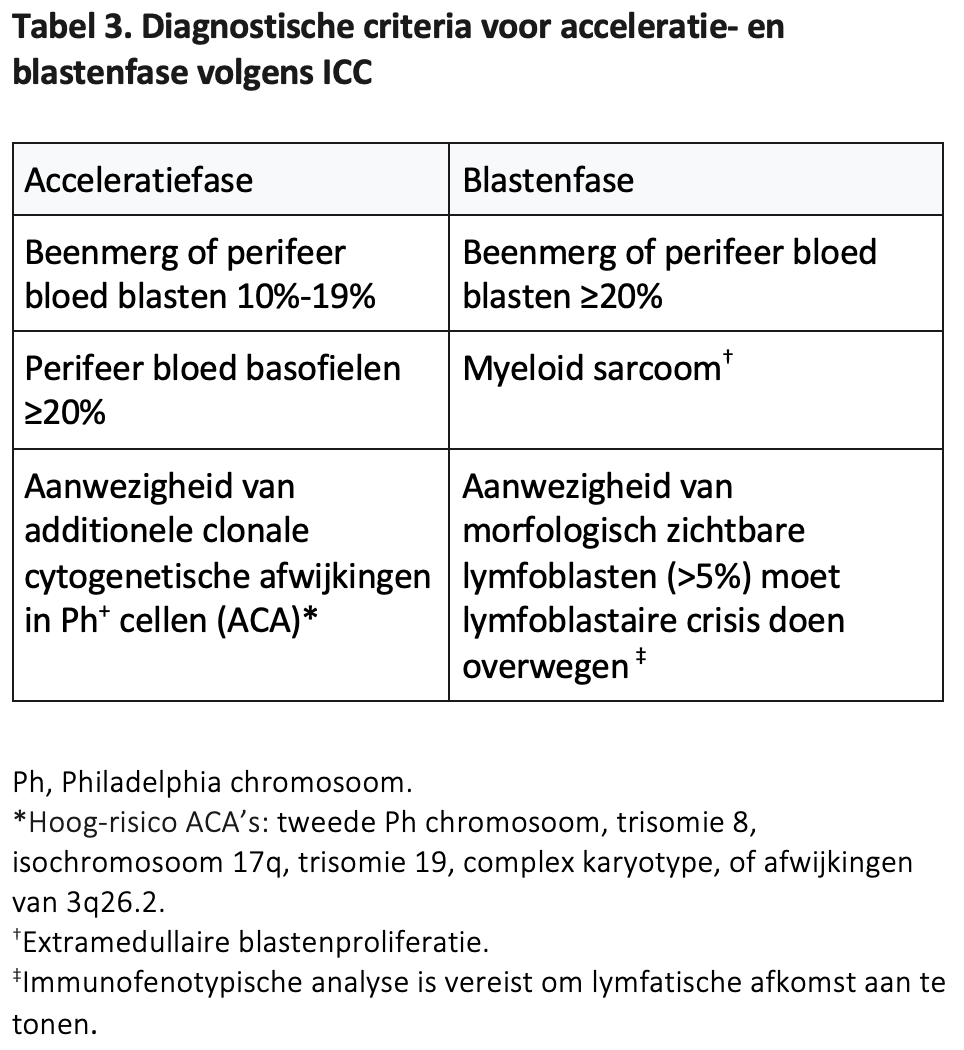
In Tabel 3 staan voor de volledigheid de ICC criteria voor CML-acceleratiefase en blastenfase opgesomd.
CML blastencrisis/blastenfase
Meestal presenteert de ziekte zich in de chronische fase, al of niet met hoog-risicokenmerken, maar bij <1% van de patiënten is de CML reeds in blastencrisis ten tijde van het stellen van de diagnose. Conform de WHO is er bij 20% of meer blasten in bloed of beenmerg sprake van een blastenfase. Dit komt overeen met de tot voorheen gehanteerde ziektedefinitie voor acute myeloïde leukemie: bij een percentage blasten ≥20% wordt gesproken van een blastencrisis, terwijl dit voorheen volgens de ELN pas bij ≥30% het geval was.25
Van speciaal belang is de bevinding van lymfoblasten in het perifere bloed of beenmerg. Volgens de WHO is een toename van het aantal lymfoblasten in bloed of beenmerg een criterium voor blastenfase CML, waarbij opgemerkt wordt dat het exacte percentage waarbij dat geldt onduidelijk is.4 De ICC noemt een percentage van >5% waarbij een blastenfase overwogen moet worden.5
In Tabel 4 staan de volledige WHO 2022-criteria voor de blastencrisis/blastenfase vermeld.
De leukemiewerkgroep geeft de voorkeur aan de WHO 2022-criteria voor de diagnose van CML in chronische fase of blastenfase, omdat recente grote en huidige lopende klinische studies deze criteria hebben aangehouden. De separate acceleratiefase wordt daarmee vervangen door chronische fase met hoog-risicokenmerken (Zie Tabel 2 en 4).4
Op basis van de voorgenoemde gegevens wordt de diagnose “Chronische myeloïde leukemie (CML) BCR::ABL1+” conform de WHO–classificatie van 2022 definitief gesteld en vastgesteld of de ziekte zich in chronische- of blastenfase (“blastencrisis”) bevindt (zie Tabel 2 en 4).
De richtlijncommissie adviseert, in afwachting van verder onderzoek en conform de ICC, een grens van >5% voor het percentage lymfoblasten in bloed of beenmerg als criterium voor blastenfase CML aan te houden.
Nederlands onderzoek heeft laten zien dat patiënten die volgens de vorige WHO classificatie als acceleratiefase werden geduid vanwege een blastenpercentage van 10-15 een even goede uitkomst hebben als patiënten met een lager blastenpercentage.26
De beste voorspeller van CML-gerelateerde dood van patiënten met CML in chronische fase die behandeld worden met een TKI is de ELTS-score.27 De berekening van de ELTS score is conform Tabel 5.
De richtlijncommissie is daarom van mening dat bij alle patiënten met een nieuw geconstateerde CML de ELTS score dient te worden berekend, zodat daarop therapeutische beslissingen kunnen worden gebaseerd. Ook wanneer besloten wordt geen risicogestuurde behandeling in te stellen, is de ELTS score van belang vanwege de prognostische waarde voor het bereiken van een goede moleculaire respons. Daarmee kan een hoge ELTS score leiden tot meer intensieve responsmonitoring.
Routinematig controleren van het cytogenetisch onderzoek van het beenmerg zal in het algemeen niet bijdragen aan aanpassingen in het gevoerde therapeutische beleid en wordt daarom niet geadviseerd.

BCR::ABL naamgeving
Vanwege verschillende redenen is door het HUGO Gene Nomenclature Committee voorgesteld om genfusies in het vervolg aan te geven door de naam van het 1e gen (in cursief en hoofdletters) gevolgd door een dubbele “dubbele punt” (::) gevolgd door de afkorting van het 2e gen.28 Dat betekent dat het BCR::ABL wordt in plaats van BCR-ABL of BCR/ABL. De achtergronden van deze wijziging worden in het gerefereerde artikel besproken en het voert voor deze richtlijn te ver om er hier op in te gaan.
Indeling TKI generaties
Ter verduidelijking volgen hier de definities van de verschillende generaties tyrosinekinaseremmers die beschikbaar zijn voor de behandeling van CML. Imatinib is de eerst geïntroduceerde TKI voor CML. Dit is de enige eerste generatie TKI. Het middel is vrij gevoelig voor een groot aantal mogelijke mutaties in en om de ATP bindingsplaats, waardoor het zijn activiteit verliest. Tweedegeneratie TKIs, zoals dasatinib, nilotinib en bosutinib (in het buitenland ook nog radotinib) zijn minder gevoelig voor de mutaties die imatinib onwerkzaam maken, maar blijven inactief tegen de meest voorkomende T315I mutatie. Ponatinib is een derdegeneratiemiddel, dat ook werkzaamheid behoudt tegen de T315I mutatie. Het werkingmechanisme van asciminib, een vierdegeneratiemiddel, is binding aan de myristoyl pocket, die relatief ver verwijderd is van de ATP bindingsplaats. Daarmee behoudt het middel werkzaamheid tegen vrijwel alle mutaties die conventionele TKIs inactiveren, maar mutaties in en om de myristoyl pocket kunnen de activiteit van het middel verminderen. Asciminib is meestal ook actief in aanwezigheid van de T315I mutatie.
Aanbevelingen voor diagnostiek bij diagnose
De richtlijncommissie adviseert in aanvulling op de kenmerken van hoog risico CML, zoals vermeld in tabel 2, in geval van ASXL1 mutaties, patiënten ook te beschouwen als behorende tot de hoog-risico groep.
Aanbevelingen
Achtergrond
Nederlands onderzoek toonde aan dat Hydrea voorbehandeling geen meerwaarde heeft bij de behandeling van CML en dit wordt daarom in het algemeen afgeraden, behalve bij klachten veroorzaakt door hyperleukocytose of door splenomegalie.
Bij de beslissing welke strategie voor de behandeling met TKIs van nieuw gediagnosticeerde CML te volgen en welk middel te kiezen kunnen de volgende factoren worden meegenomen: biologische hoogrisicofactoren, individuele voorkeuren en wensen van de patiënt op basis van risico op bijwerkingen, huidig cardiovasculair risicoprofiel, leefpatroon, beroep (bijvoorbeeld in ploegendienst), bijkomende medicatie (in verband met interacties) en kosten van de behandeling.
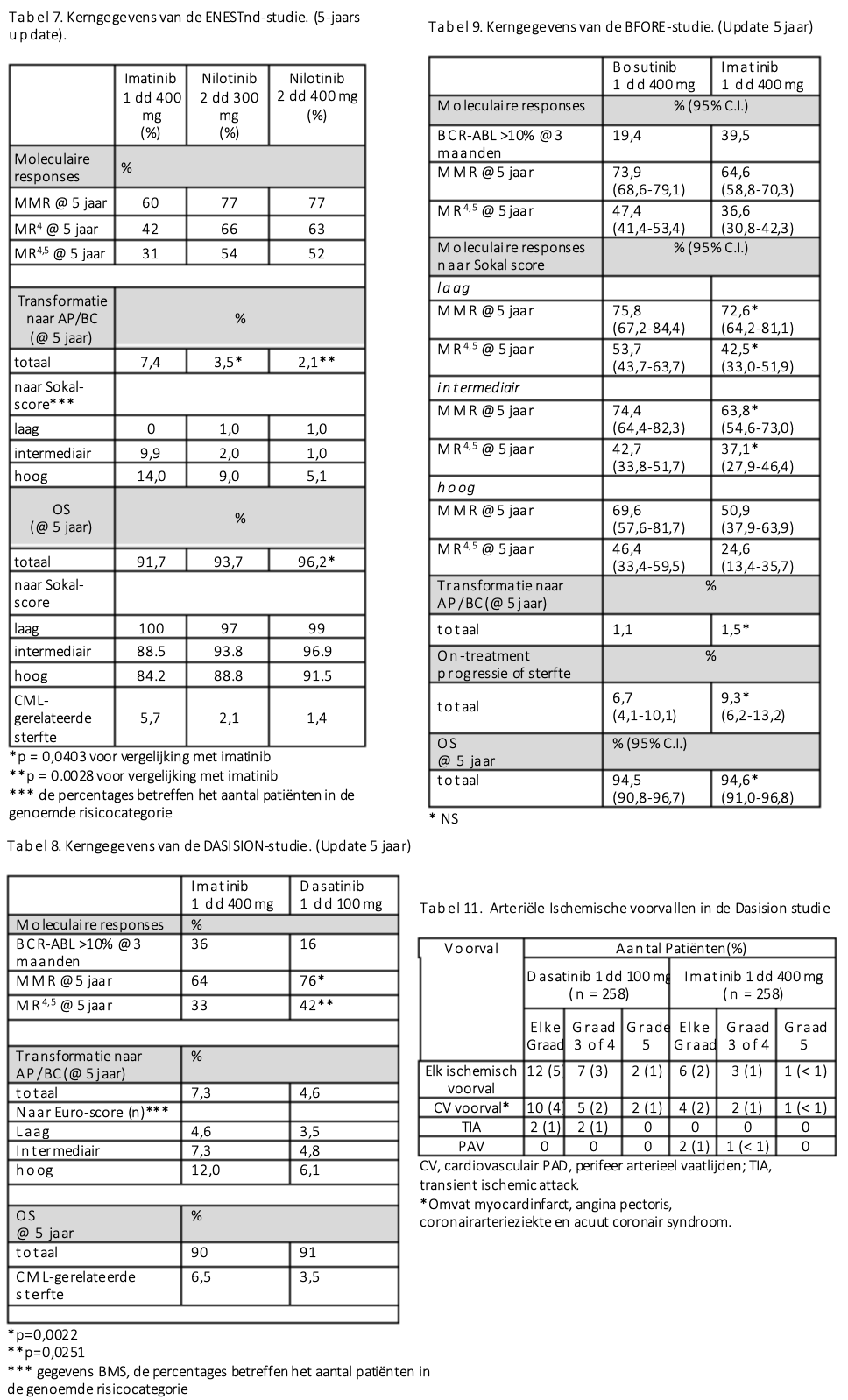
De mogelijkheid om eerder te kunnen stoppen met de behandeling door gebruik van 2G-TKIs kan eveneens meegewogen worden en dit kan bij een zwangerschapswens van groot belang zijn. Alle 2G-TKIs zijn in studies waarin ze vergeleken zijn met imatinib superieur gebleken wat betreft de snelheid en de diepte van de bereikte respons. 29-31 Daarnaast traden er minder progressies op in de 2G-TKI armen van de studies. Zie de overzichtstabellen 7, 8 en 9. Qua overleving is er echter geen verschil tussen imatinib en de verschillende andere TKIs aangetoond.
Patiënten met pre-existente longziekten, perifeer of centraal vaatlijden, of ongecontroleerde risicofactoren daarvoor, worden bij voorkeur met imatinib behandeld.
Wanneer dasatinib gegeven wordt, dient men alert te zijn op het ontstaan van pleuravocht en pulmonale arteriële hypertensie (PAH). Gebruik van nilotinib is geassocieerd met irreversibele vasculaire bijwerkingen. Het gaat hierbij om patiënten die myocardinfarcten, CVA’s en perifeer vaatlijden ontwikkelen.29 Daarnaast ontstaat bij 5-6% graad 3-4 hyperglycemie (glucose >13,9 mmol/L) en bij >40% hypercholesterolemie. (tegenover resp. 0% en 7,5% bij imatinib). In de eerstelijns ENESTnd studie werden patiënten met nilotinib (2 dd 300 of 2 dd 400 mg) dan wel met imatinib (1 dd 400 mg) behandeld. De patiënten werden ingedeeld op basis van hun Framingham cardiovasculaire risicoscore. In de eerste 5 jaar na de start van de behandeling was het risico op cardiovasculaire aandoeningen in de twee hoogste risicoklasses (van 3 klassen totaal) resp. 12,2 % en 15% in de nilotinib arm met 2 dd 300mg, en dat was zelfs resp. 19,2% en 28,9% in de 2 dd 400 mg arm.29
In de met imatinib behandelde patiënten waren deze percentages resp. 4,1% en 3,0%. Het verschil in de laagste risicocategorie was beperkter, namelijk 2,2% voor nilotinib 2 dd 300 mg, 4,0% voor nilotinib 2 dd 400 mg en 0,5% voor imatinib.29 Een update met de 10-jaarsdata toont dat ook in de laagrisicogroep duidelijk meer vasculaire complicaties optraden bij gebruik van nilotinib, zie tabel 10.32
Ook bij dasatinib lijkt het cardiovasculair risicoprofiel verhoogd ten opzichte van imatinib (zie tabel 11), maar de gegevens zijn wat meer uiteenlopend.30,33 In een meta-analyse waarin gesuggereerd wordt dat de vasculaire bijeffecten van dasatinib vrijwel even frequent zouden voorkomen als bij nilotinib, werd ook gebruik gemaakt van artikelen die resultaten van tweedelijnsbehandeling beschreven (na falen of suboptimale responses op imatinib) en tevens van een abstract van een onderzoek dat nooit in een peer-reviewed tijdschrift is geplaatst, waarmee de conclusies van de auteurs betwijfeld kunnen worden.34
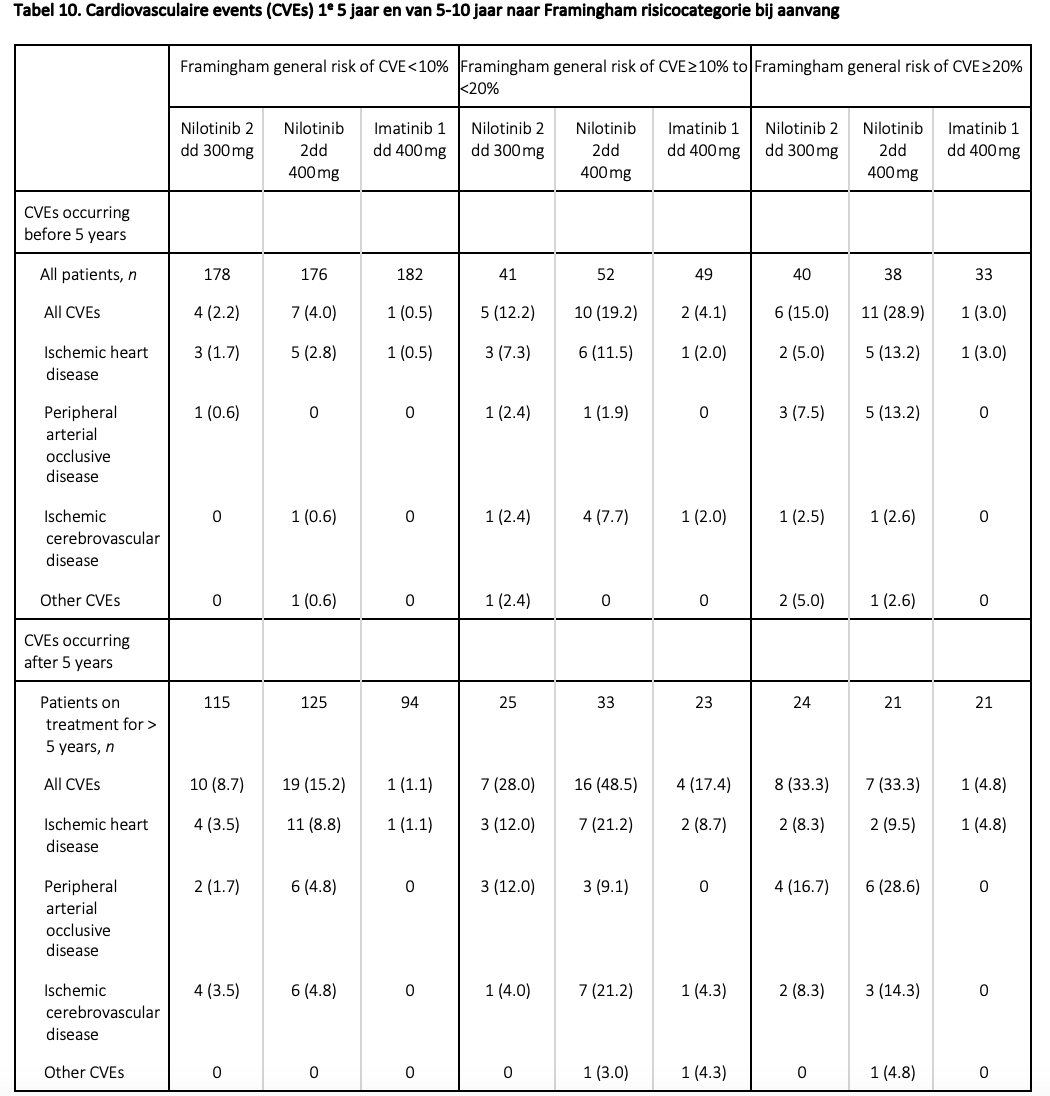
Datzelfde geldt voor een andere meta-analyse waarin ook verschillende studies werden verzameld en geconcludeerd werd dat nilotinib en ponatinib een duidelijk verhoogd risico op cardiovasculaire bijeffecten geven (resp 2,8 en 10,6 per 100 patiëntjaren), maar dat dit beperkt is voor dasatinib (1,1 per 100 patiëntjaren tegenover 0,8 in de niet aan TKIs blootgestelde groep) met juist een beschermend effect van imatinib (0,1 per 100 patiëntjaren). Hier werden 29 studies geanalyseerd, maar 23 hiervan betroffen abstracts en 1 van de studies was een tweedelijnsonderzoek. Een groot deel was onderzoek van ”real-world” cohorten.35 Los van de vasculaire effecten hebben ouderen bij gebruik van dasatinib meer kans op hartfalen, pleura- en pericardeffusies.36,37
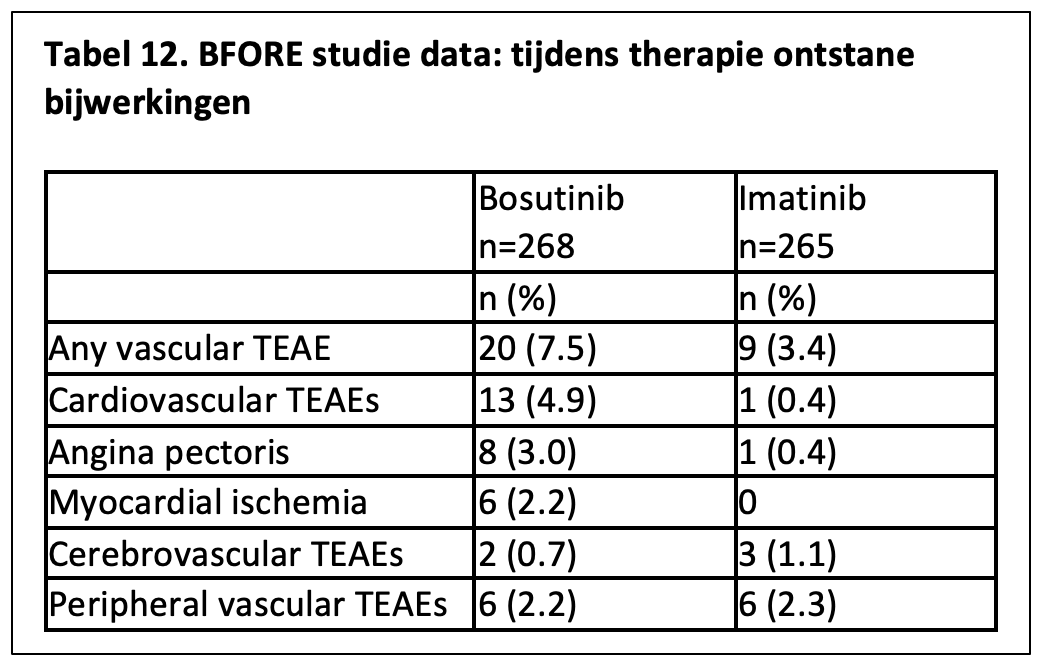
Bosutinib lijkt in de verschillende onderzoeken een relatief mild vasculair risicoprofiel te hebben. In 2 studies, waarin bosutinib in een dosis van 1 dd 500 mg of 1 dd 400 mg vergeleken werd met imatinib 1 dd 400 mg, bleek het percentage cardiovasculaire complicaties (excl. hypertensie) gelijk (4% in 30 maanden) dan wel wat hoger (7,5% na mediaan 55 maanden follow-up) in de bosutinib arm tegenover 3,4% voor de imatinib-arm wat mogelijk verband houdt met een hoger percentage patiënten met cardiovasculaire risicofactoren tussen de studiepopulaties.38,39 (zie tabel 12)
Progressies naar blastenfase (of hoog-risico chronische fase, eerder gedefinieerd als acceleratiefase) komen vooral voor bij de intermediaire en hoog-risico groepen. Een blastenfase heeft ondanks de introductie van diverse zeer krachtige TKIs nog steeds een zeer slechte prognose, die in feite niet verbeterd is sinds de introductie van imatinib.40,41
Behandeling met 2G-TKIs van intermediair en hoogrisicogroepen leidt tot minder gevallen van progressie. (zie tabel 7, 8 en 9) Het risico op progressie naar een late fase was in de ENESTnd studie 2,1-3,5% voor de nilotinib-armen, tegenover 7,4% voor de imatinib-arm, waarbij het verschil vooral bepaald werd door de patiënten in de intermediaire en hoogrisicogroepen.29 Datzelfde geldt voor de Dasision studie en de S0325 studie waarin dasatinib vergeleken werd met imatinib.30,42 Ook gebruik van bosutinib leidde tot minder progressies ten opzichte van imatinib.43 Desondanks is in geen enkele van de uitgevoerde studies een overlevingsvoordeel van de 2G-TKIs voor de gehele groep patiënten aangetoond, los van het genoemde hogere aantal gevallen van progressies in de imatinib-armen van deze studies. (zie tabellen 7, 8 en 9)
De kans op misselijkheid, braken en diarree door bosutinib vermindert wanneer gestart wordt met een dosis van 200-300 mg, welke vervolgens wekelijks wordt opgehoogd tot 1 dd 400 mg.
Tenslotte moet bij elke patient het belang van niet roken worden onderstreept, vanzelfsprekend in het kader van cardiovasculair risicomanagement, maar ook omdat roken de kans op progressie naar blastencrisis verhoogt.44,45
Steeds meer 2e generatie TKIs verliezen hun patentbescherming. Daarmee kan bijv. generiek dasatinib de drempel om een keuze te maken voor een 2G-TKI als eerstelijnstherapie verlagen. Imatinib en dasatinib kosten nu ongeveer 1300,- per jaar, terwijl de andere middelen nog tenminste 36.000,- per jaar kosten. Het patent van bosutinib loopt overigens ook af in september 2024.
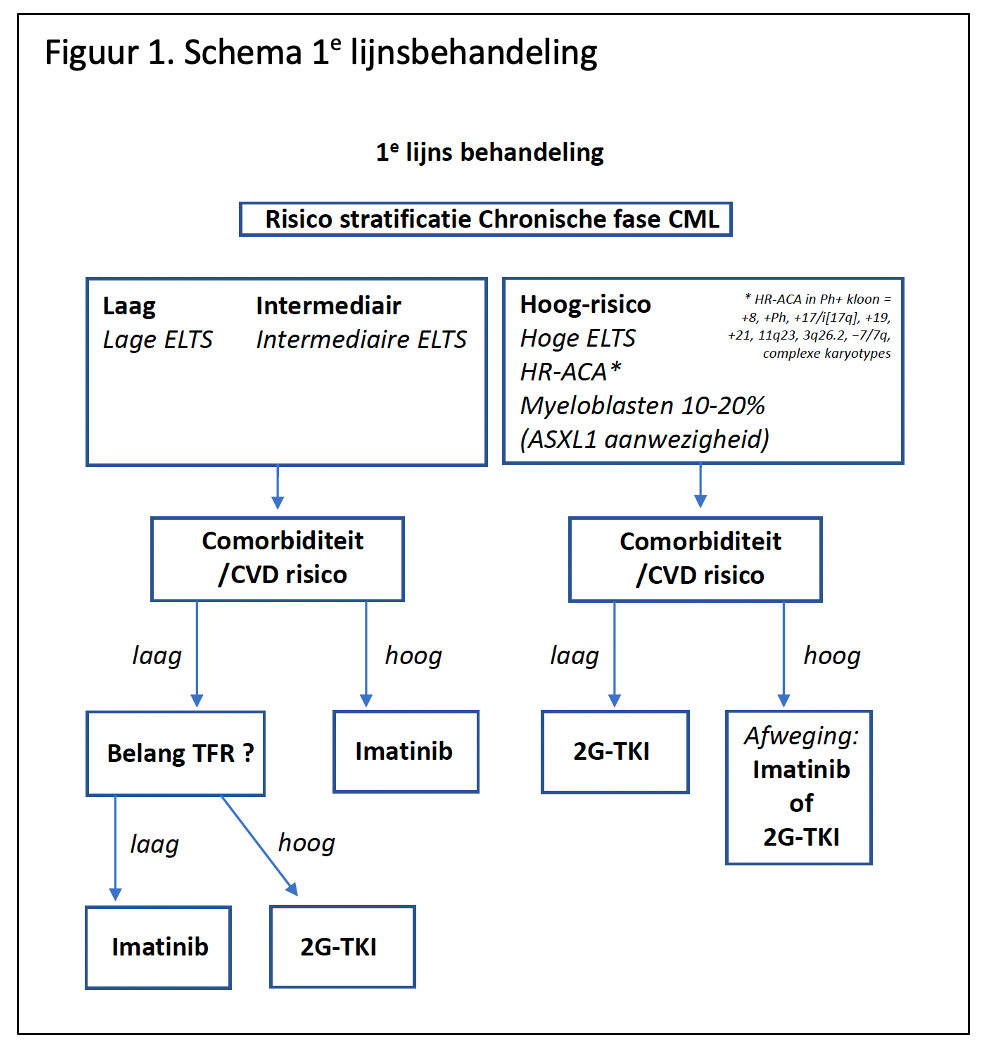
Figuur 1. geeft bovenstaande adviezen schematisch weer.
Aanbevelingen
Achtergrond
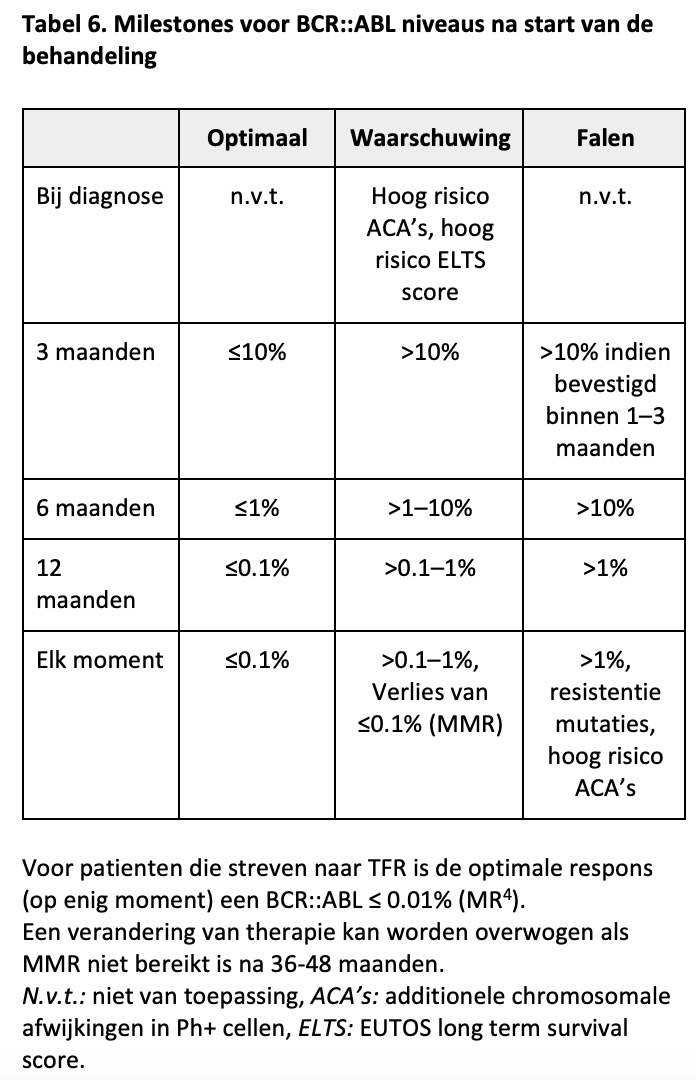
Vanzelfsprekend is een overkoepelend doel van deze richtlijn het bereiken van een normale levensverwachting met een optimale kwaliteit van leven van de CML-patiënt. Een essentiële voorwaarde voor een optimale overleving is het behalen van responsmijlpalen. Deze staan voor de eerstelijnsbehandeling vermeld in Tabel 6.
In het streven naar een optimale kwaliteit van leven past ook de therapievrije remissie als behandeldoel, aangezien dit de kwaliteit van leven kan bevorderen, kosten bespaart en bij een aanzienlijk deel van de patiënten haalbaar blijkt. (zie ook de sectie “Onder welke voorwaarden kan de behandeling met CML gestaakt worden en hoe dient follow-up in die setting te geschieden?”)
Een optimale respons betekent dat de therapie ongewijzigd kan worden voortgezet. Een waarschuwing betekent dat het uiteindelijke resultaat van de behandeling goed kan zijn, maar dat er extra aandacht noodzakelijk is voor de responsmonitoring en buiten studieverband is het veranderen van de therapie (nog) niet geïndiceerd. Bij falen van de therapie is echter onverwijld actie noodzakelijk.
Falen van de therapie kan veroorzaakt worden door onvoldoende therapietrouw, door verminderde resorptie en/of interacties met comedicatie of door mutaties in het ABL kinase, maar is ook vaak onverklaard. Een bloedspiegelbepaling kan worden verricht om farmacokinetische oorzaken van het gebrek aan respons vast te stellen en mutatieanalyse kan moleculaire resistentie aantonen. In afwachting van de resultaten van deze onderzoeken dient de patiënt bij falen van de therapie op een ander middel overgezet te worden.
Bij een subtherapeutische bloedspiegel van imatinib (zie Tabel 13) is een verhoging van de dosis naar 600 mg een mogelijke optie indien geen bijwerkingen, alternatief is overschakeling naar een 2G-TKI (afhankelijk van de keuze van 2G-TKI).
De responsmijlpalen voor de tweedelijnsbehandeling zijn in principe gelijk aan die van de eerstelijnsbehandeling en worden gehanteerd vanaf de start van de tweedelijnsbehandeling. Voor de derde en verdere lijn is het bereiken van een BCR::ABL niveau van <1% acceptabel. Dit komt overeen met een complete cytogenetische respons. Hogere waarden dan 1% zijn in het algemeen onvoldoende voor optimale overleving en definiëren daarmee falen van therapie. De diepte van de vereiste respons in de derde en verdere lijn is minder strikt, omdat het alternatief voor voortgezet gebruik van een TKI een allogene stamceltransplantatie zou zijn, met potentiële morbiditeit en mortaliteit.46
Aanbevelingen
Achtergrond
In Nederland wordt het BCR-ABL meestal met een Cepheid/GeneXpert machine kwantitatief bepaald. Hierbij wordt, naast het aantal kopieën BCR::ABL, parallel ook het aantal kopieën van een controle-gen meegemeten. Dit betreft bij de GeneXpert ABL, maar in andere methoden wordt soms GUSB gebruikt, hetgeen ook acceptabel is. De resultaten dienen weergegeven te worden in de internationale schaal, die gebaseerd is op een gemiddeld uitgangsniveau van 30 patiënten die aan de IRIS-trial meededen. Weergaves in zogenaamde “logreducties” of vergelijkingen ten opzichte van het initiële diagnosemateriaal van de patiënt zelf geven verwarring en/of zijn onduidelijk en zijn daarom niet acceptabel.
Wanneer in een monster geen BCR::ABL-transcripten meer kunnen worden aangetoond dient de term “complete moleculaire respons” vermeden te worden. In plaats daarvan moet een maat voor de gevoeligheid van de test aan het moleculaire responsniveau toegevoegd worden. Deze gevoeligheid van de test wordt bepaald door het gemeten aantal kopieën van het controle-gen.47
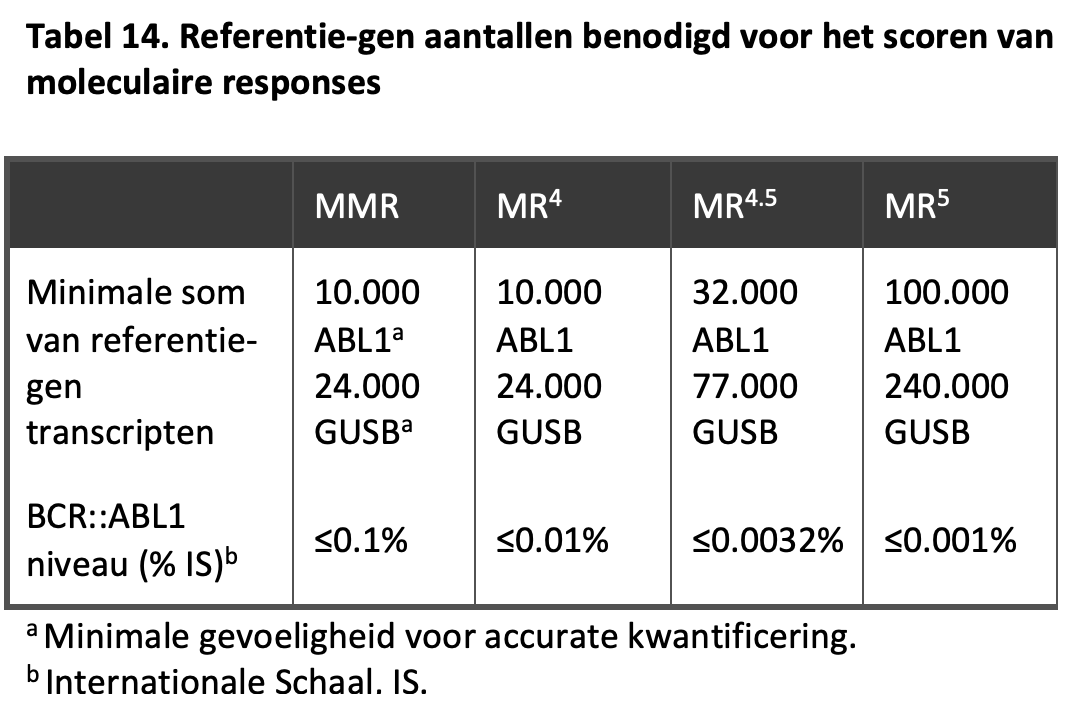
Een major moleculaire respons (MMR) betekent een meetbaar BCR-ABL niveau van 0,1% of lager, een MR4 betekent een meetbaar BCR::ABL-niveau onder 0,01%, òf een onmeetbaar niveau bij tenminste 10.000 ABL-transcripten of tenminste 24.000 GUSB-transcripten. Voor een MR4.5 geldt een meetbare waarde onder 0,0032% of een onmeetbaar niveau met 32.000-99.999 ABL-transcripten of 77.000-239.999 GUSB-transcripten. Een MR5 is gedefinieerd als een meetbaar BCR::ABL-niveau <0,001% of een onmeetbaar niveau met tenminste 100.000 ABL- of 240.000 GUSB-transcripten. Voor gedetailleerde informatie over de geadviseerde rapportage van de BCR::ABL-uitslagen wordt verwezen naar een vrij recente publicatie.47 Zie ook Tabel 14.
Het is van groot belang dat tijdens behandeling regelmatig en frequent het BCR::ABL-niveau gemeten wordt. Geadviseerd wordt dat bij een CML in chronische fase in het eerste jaar van de behandeling tenminste na 3, 6, 9 en 12 maanden te doen. Na een jaar kan de frequentie bij patiënten die een MMR hebben behaald terug naar eens per 4 maanden. Na 3 jaar stabiele MMR is controle elke 6 maanden acceptabel. Dit komt voort uit de zeer geringe kans op progressie als eenmaal een MMR bereikt is.48
Voor patiënten die op de genoemde tijdspunten geen optimale respons hebben behaald wordt geadviseerd 4-6- wekelijkse BCR::ABL-monitoring te verrichten teneinde het resultaat van eventuele aanpassingen van de therapie goed te kunnen controleren dan wel progressieve stijging van het BCR::ABL-niveau tijdig te kunnen onderkennen.
Na de diagnose kan volstaan worden met BCR::ABL-metingen in perifeer bloed.24 Beenmerganalyse wordt geadviseerd bij diagnose, bij aanhoudende graad 3-4 hematologische toxiciteit en in geval van falen van de therapie, teneinde progressie van de ziekte uit te sluiten. Daarnaast kan, voorbij de eerstelijnsbehandeling, een complete cytogenetische respons in het beenmerg in het geval het BCR::ABL-niveau rond 1% blijft fluctueren beschouwd worden als een acceptabele respons en dus als een reden de huidige behandeling niet te veranderen (zie ook volgende sectie).49
Poliklinische consulten kunnen na het bereiken van een stabiele MMR vervangen worden door video- of telefonische consulten. Bij verlies van respons of verdenking op bijwerkingen, zoals PAH of pleuravocht, moet de patiënt alsnog in het ziekenhuis gezien worden.
De commissie acht het van belang dat bij elk consult de “therapietrouw” en eventuele psychosociale gevolgen van de ziekte en/of behandeling met de patiënt besproken kunnen worden.
Aanbevelingen
Achtergrond
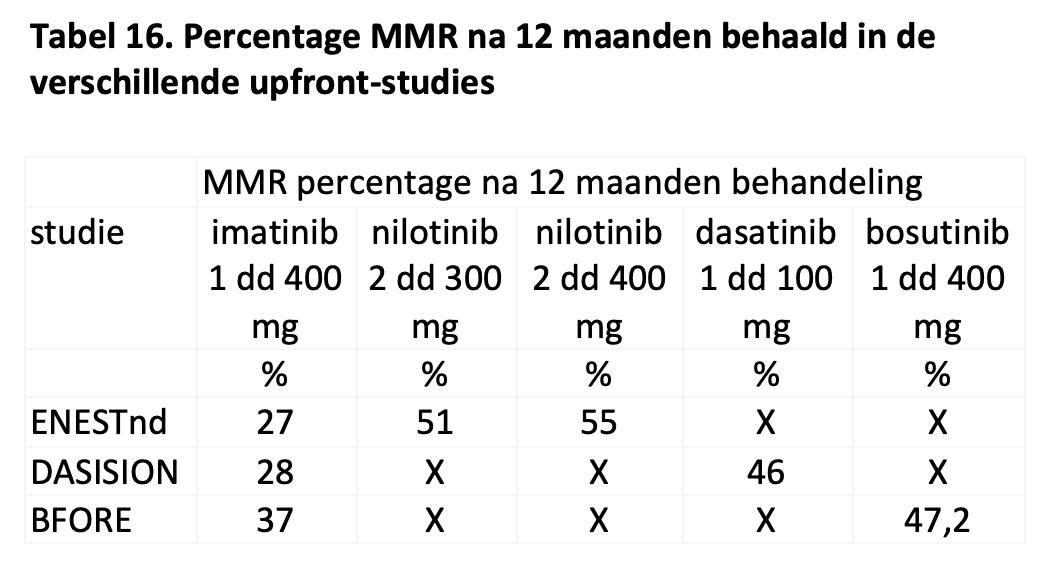
De meerderheid van de patiënten die met imatinib als eerstelijnsbehandeling worden behandeld bereikt geen major moleculaire respons na 1 jaar behandeling en voldoet daarmee niet aan de criteria voor een optimale respons. Met tweedegeneratie TKI’s is het percentage patiënten met een optimale respons beduidend hoger, maar nog altijd behaalt 45 tot 54% niet een BCR::ABL niveau <0,1% na 1 jaar behandeling.30,40,43 (zie Tabel 16) Dat is niet persé een probleem. Immers, een groot deel van de patiënten behaalt later alsnog een MMR. Het is vooral van belang de patiënten te identificeren die falen op de therapie. Dergelijke patiënten dienen overgezet te worden op een ander middel en tevens moet diagnostiek verricht worden om te kunnen begrijpen waarom de patiënt onvoldoende reageert en zo nodig gericht andere therapie in te zetten.
Voor het vaststellen van de oorzaken van onvoldoende respons is als eerste van belang therapietrouw uit te vragen. Ongeveer 25% van de patiënten neemt de voorgeschreven medicatie onvoldoende nauwkeurig in, hetgeen betekent dat meer dan 10% van de tabletten per maand niet wordt ingenomen.50,51 Daarnaast kunnen door interacties met andere geneesmiddelen onvoldoende spiegels worden opgebouwd waardoor het therapie-effect onvoldoende blijft. In beide gevallen kunnen spiegelmetingen uitkomst bieden. Indien subtherapeutische niveaus worden vastgesteld kan ofwel een verhoging van de dosis dan wel een verandering van middel worden gekozen. Bij de keuze van een ander middel vanwege adherentie-problemen is het innameschema van het nieuwe middel van belang. Nilotinib dient bijvoorbeeld tweemaal daags op een lege maag ingenomen te worden en is, naast de cardiovasculaire risico’s, ook daarom een minder geschikt middel dan de andere 2G-TKIs.
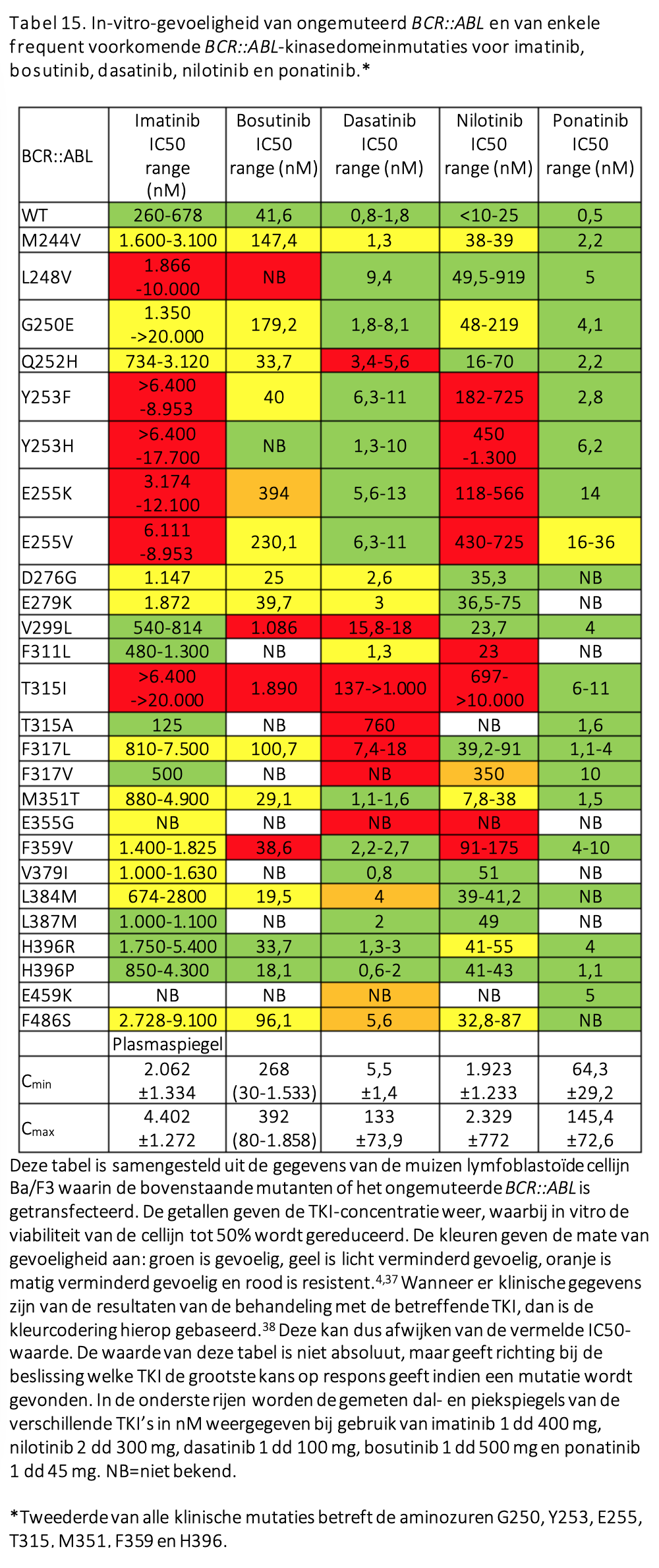
Voor patiënten die resistentie vertonen terwijl de bloedspiegels van het gebruikte middel wel adequaat zijn is aanvullend onderzoek in de vorm van mutatieanalyse van het ABL kinase-gen geïndiceerd. Mutaties die veroorzaken dat verschillende middelen minder goed kunnen binden aan de ATP-bindingspocket in het BCRABL eiwit komen in 25-45% voor bij patiënten die primair resistent zijn voor de eerstelijnsbehandeling, maar bij bijna 60% van de patiënten die in tweede instantie verlies van respons vertonen, dus na een initiële adequate respons (secundaire resistentie).
Mutaties kunnen de keuze van een volgende therapielijn sturen. Sommige mutanten zijn nog wel gevoelig voor dasatinib of bosutinib, dan wel nilotinib, maar de veelvoorkomende T315I mutatie is alleen gevoelig voor ponatinib (en voor asciminib, maar dat middel is niet voor de tweedelijn en niet voor T315I gemuteerde CML geregistreerd, zie verder).
Voor patiënten die intolerant zijn voor de eerstelijnsbehandeling is het advies om na imatinib in eerste instantie een keuze te maken uit dasatinib of bosutinib. Wanneer daarmee niet uitgekomen kan worden of bij duidelijke contra-indicaties tegen deze middelen is nilotinib een alternatief. Zie hiervoor ook de module “Hoe moet omgegaan worden met bijwerkingen van de behandeling?”.
Er kunnen redenen zijn om een stabiel BCR::ABL niveau van rond de 1% te accepteren in de eerste lijn, bijvoorbeeld als een oudere patiënt dit niveau bereikt heeft op imatinib en de 2G-TKIs (relatief) gecontra-indiceerd zijn vanwege, onder meer, cardiovasculaire comorbiditeiten.
Aanbevelingen
Achtergrond
In het algemeen bestaat er voor non-hematologische toxiciteit weinig kruisintolerantie.52
Pancreatitis kan bij alle TKIs voorkomen en kan recidiveren na het switchen van middel. De frequentie is het hoogst bij nilotinib, bosutinib en ponatinib (gemeld tussen 1 en 10%), maar het betreft hier vaak asymptomatische verhogingen van lipase en/of amylase.30,31 Desondanks kan het vóórkomen van pancreatitis of enzymverhoging tijdens behandeling met deze middelen een reden zijn om over te gaan op een ander middel dat wellicht minder vaak deze bijwerking veroorzaakt (bij dasatinib wordt pancreatitis of verhoging van lipase/amylase bij 0,1-1% gemeld). Moeheid is een hardnekkige bijwerking die vaak niet opknapt na overschakeling op een ander middel. Of dit ook geldt voor asciminib is nog onduidelijk.
Ook hematologische toxiciteit die in het algemeen als een indicatie van de anti-CML activiteit van het middel kan worden beschouwd verbetert vaak niet of onvoldoende na overschakeling naar een andere TKI.
De responsmijlpalen voor de tweedelijnsbehandeling zijn identiek aan die van de eerste lijn. (zie Tabel 6). Falen van tweedelijnstherapie is daarmee gedefinieerd als een persisterend BCR::ABL-niveau boven 1% na een jaar behandeling met een tweedelijnsmiddel; een optimale respons als een major moleculaire respons (MMR, BCR::ABL ≤0,1% (I.S.)).4
In de derde lijn wordt een BCR::ABL niveau van onder 1% als optimaal beschouwd. Dit houdt enerzijds verband met de geringe progressiekans bij dit BCR::ABL niveau en anderszins met de risico’s van derdelijnsbehandeling waarbij voor- en nadelen van bijvoorbeeld ponatinib en een allogene stamceltransplantatie moeten worden afgewogen tegen die van voortzetting van de tot dan toe gegeven tweedelijnstherapie.53
In een recente retrospectieve studie van 131 patiënten leidde het behalen van slechts een major cytogenetische respons (ongeveer overeenkomend met een BCR::ABL niveau van <10%) binnen twee jaar na het starten van de behandeling tot een 10-jaars overleving van 88%, met slechts 5% CML-gerelateerde sterfte.54 Dit betrof een geselecteerde serie patiënten die hun behandeling in een gespecialiseerd kankercentrum ontvingen en gezien het enkelvoudige en retrospectieve karakter van dit onderzoek acht de richtlijnencommissie een aanpassing van de responsmijlpalen voor het BCR::ABL op basis van alleen dit onderzoek niet gerechtvaardigd. Wel suggereren de gegevens dat, zeker bij oudere patiënten, een BCR::ABL niveau dat stabiel iets boven 1% blijft acceptabel kan zijn.
Indien een derdelijnsmiddel nodig is vanwege bijwerkingen kan een keuze gemaakt worden voor een van de resterende beschikbare conventionele TKIs of voor asciminib. Asciminib bleek in de fase 3 ASCEMBL studie superieur te zijn aan bosutinib bij het bereiken van het primaire eindpunt, MMR bij 24 maanden.55 In een subgroep analyse was dit verschil alleen significant voor de patiënten die vanwege gebrek aan respons op eerdere behandeling in de studie geïncludeerd werden. Het verschil in bereiken van MMR was bij 24 maanden in de gehele behandelde groep 12% en dit liep op naar 22% na 96 maanden. Tegelijkertijd was het aantal bijwerkingen in de asciminib arm duidelijk lager dan in de bosutinib arm en daarmee ook het aantal patiënten dat moest stoppen met de behandeling vanwege de bijwerkingen (resp. 7% voor asciminib en 25% voor bosutinib).
Er dienen een paar opmerkingen over deze studie gemaakt te worden. Ten eerste was het percentage patiënten dat vanwege gebrek aan effectiviteit geïncludeerd werd in de asciminib arm lager dan in de bosutinib-arm (61% vs 71%). In de asciminib arm werden dus meer patiënten vanwege multipele intoleranties geïncludeerd (38 vs 29%). Patiënten die multi-intolerant waren, mochten niet een MMR hebben bereikt, waarmee zij dus ook geen optimale respons hadden. Over het algemeen moet de eerste groep echter als resistenter worden geduid dan de tweede.
Het percentage patiënten dat 3 of meer eerdere TKIs had gebruikt was in de bosutinib arm hoger dan in de asciminib arm (61 vs 48%) en dus hadden meer asciminib patiënten slechts 2 lijnen gehad (62 vs 40%). Het gemiddelde BCRABL niveau was echter gelijk verdeeld over de 2 groepen.
Al met al zouden deze verschillen de effectiviteit van asciminib in deze studie bevoordeeld kunnen hebben. Daarnaast werd bosutinib in de destijds geregistreerde indicatie dosis van 500 mg gegeven, zonder een ramp-up fase. Daarmee samenhangend is het relatief hoge percentage bijwerkingen van gastro-intestinale aard, zoals misselijkheid en braken. Tevens was er duidelijk meer hepatotoxiciteit, dat juist zeer laag was in de asciminib arm. De keuze voor 500 mg werd gerechtvaardigd doordat dit destijds de geregistreerde dosis was.
Speciale aandacht hebben cardiovasculaire bijwerkingen in deze studie. Bij de 96 weken follow-up bleek in de bosutinib-arm 1% van de patiënten een dergelijke bijwerking (acuut coronair syndroom) te hebben ontwikkeld, waar dat 5% was in de asciminib-arm. Na correctie voor de expositieduur was dit respectievelijk 1,4 tegenover 3,0 per 100 patiëntenjaren. Het is vooralsnog lastig om deze cijfers goed op waarde te schatten omdat vrijwel alle patiënten met een CV bijwerking in deze studie eerdere expositie aan ponatinib en/of nilotinib en/of dasatinib hadden gehad en het dus onduidelijk is welk middel verantwoordelijk gehouden dient te worden voor het ontstaan van deze ernstige bijwerkingen.
Niettemin zijn de responsgegevens zeer overtuigend in het voordeel van asciminib. Daarbij meewegende het in het algemeen zeer milde bijwerkingenprofiel acht de richtlijncommissie asciminib daarmee superieur aan bosutinib als derdelijns optie bij therapieresistente patiënten.
De commissie plaatst tenslotte nog een andere kanttekening bij de studie en dat is de vergelijking die gemaakt is. Ten tijde van de start van de studie was ponatinib tijdelijk van de markt gehaald wegens het hierbij frequente voorkomen van cardiovasculaire bijwerkingen. Hoewel ponatinib wellicht een betere comparator was geweest dan bosutinib, was deze keuze destijds dus onmogelijk. De commissie wijst echter op de hoge incidentie van cardiovasculaire bijwerkingen bij gebruik van ponatinib.56 (zie ook volgende sectie)
Aanbevelingen
Achtergrond
Hoewel de bijwerkingen van de verschillende TKI’s in het algemeen mild zijn, zijn er een aantal die specifieke alertheid verdienen en deze worden daarom hier besproken. Voor een meer uitgebreide handleiding voor het omgaan met andere bijwerkingen wordt verwezen naar een overzichtsartikel.57 Een op dit overzichtsartikel gebaseerd, snel toegankelijk en uitgebreid overzicht over de incidentie, kinetiek en behandeling van bijwerkingen bevindt zich ook in de Hematology App (zie Guidelines > CML guidelines > CML Adverse events of TKIs guidelines 2016 (ELN))
De hematologische bijwerkingen van TKIs betreffen cytopenieën die onder behandeling, vooral in de eerste maanden na het starten van de therapie kunnen ontstaan. In de meeste gevallen volstaat een tijdelijke onderbreking van de medicatie totdat het trombocytengetal stijgt boven 75 x 109/l of de neutrofielen boven 1,5 x 109/l komen. Daarna herhaalt de cytopenie zich meestal niet bij hervatten van de medicatie. Mocht dat wel gebeuren in graad 3-4 dan dient het middel opnieuw gestaakt te worden en bij dezelfde waarden hervat, maar dan op één dosisniveau lager. Meestal herstelt de normale hematopoëse zich uiteindelijk wel. In sommige gevallen gebeurt dat echter niet en is adequate dosering van de TKI onmogelijk met gebrek aan respons tot gevolg.
Veranderen van medicatie kan dan soms leiden tot verbetering van het hemogram, maar meestal valt het effect daarvan erg tegen. Voor anemie kan dan epoetine gegeven worden en voor neutropenie filgrastim. Bij aanhoudende diepe trombopenie kan suppletie met trombocytenconcentraten nodig zijn om een trombopene periode te overbruggen. Van het toedienen van eltrombopag is gebleken dat een groot aantal patiënten (87%) hiermee alsnog een verbetering van het trombocytengetal bereikt die adequate dosering van de TKI mogelijk maakte.58 In het gerefereerde artikel is een maximum dosis van 300 mg voor eltrombopag gebruikt.
De commissie adviseert een dergelijk hoge dosis alleen te overwegen bij patiënten zonder andere goede therapie-opties, gezien het feit dat eigen ervaringen leren dat meestal met een lagere dosis, zoals genoemd max. 150 mg, kan worden volstaan. Wanneer ook met eltrombopag onvoldoende veilig geachte trombocytengetallen worden bereikt, dan biedt in feite alleen een allogene stamceltransplantatie een kans op aanhoudend herstel van de Ph-negatieve hematopoëse.
Door patiënten wordt moeheid zoals voorkomt bij de meerderheid van de TKI-gebruikers als een van de meest vervelende bijwerkingen ervaren. Ongeveer 75% heeft tenminste enige mate van vermoeidheid en bij een kwart is dat zelfs matige tot ernstige vermoeidheid.59 Hoewel er in het algemeen geringe kruisintolerantie tussen de TKIs bestaat geldt dat helaas niet voor deze bijwerking en het is de ervaring van de richtlijnencommissieleden dat het veranderen van TKI vanwege deze bijwerking vaak niet veel verbetering biedt, uitzonderingen daargelaten. Specifieke bijwerkingen van de verschillende beschikbare middelen worden hierna besproken.
Imatinib geeft bij 38% spierkrampen en bij 30-40% gastro-intestinale klachten in de vorm van misselijkheid en/of diarree.60 Daarnaast heeft vrijwel iedere patiënt in ieder geval enige mate van periorbitaal oedeem. Ondanks eerdere alarmerende berichten lijkt het ontstaan van hartfalen erg zeldzaam.61
Hypofosfatemie wordt eveneens vaak gezien. Het wordt waarschijnlijk veroorzaakt door een lichte hypocalciëmie als gevolg van remming van osteoclastenactiviteit en daardoor een verhoogd PTH-gehalte, waardoor vervolgens een verhoogde fosfaatuitscheiding met de urine. Ook de osteoblastenactiviteit wordt geremd door imatinib, waardoor het netto-effect op de botmineraaldichtheid waarschijnlijk neutraal is. Hypofosfatemie kan echter ook voorkomen bij vitamine D-deficiëntie en het verdient aanbeveling om dit zo nodig te suppleren.62
Dasatinib gaf bij 28 % van de patiënten pleuravocht, hoewel daarvan slechts 3% graad 3-4 betrof.30 Dit pleuravocht is een exsudaat en kan ook na enkele jaren gebruik nog optreden en is geassocieerd met een betere CML respons.63 Risicofactoren voor het ontstaan van pleuravocht zijn tweemaaldaagse dosering van dasatinib, pre-existente pulmonale of cardiale pathologie, hypertensie, een minder goede performance score en hogere leeftijd.64-66 Ondanks het ontstaan van pleuravocht kan 85% van de patiënten met de behandeling doorgaan, eventueel na aanpassing van de dosis.30
Pulmonale arteriële hypertensie (PAH) is een levensbedreigende bijwerking van dasatinib die bij 1-5% voorkomt.30,67 Na het staken van het middel treedt bijna altijd verbetering op, maar compleet herstel is niet gegarandeerd.68
Bosutinib geeft in de eerste tijd na het starten van de behandeling vaak diarree, maar dit is deels dosisafhankelijk (12% graad 3-4 bij 500 mg (BELA trial) versus 9% bij 400 mg (BFORE trial) versus resp. 1% en 1,1% bij imatinib in de BELA- en BFORE trial).38,39 Dit kan verminderd worden door met een lage dosis (200-300 mg) te starten en geleidelijk op te hogen naar de uiteindelijke onderhoudsdosis. Loperamide kan gegeven worden als er desondanks diarree optreedt. Gezien de resultaten van de BFORE trial is de geadviseerde dosis bosutinib 1 dd 400 mg, ook als tweedelijnsbehandeling, ondanks het gebrek aan harde data in die setting.43 Graad 3 ALAT- en ASAT-verhogingen (>5x ULN) komen bij dit middel geregeld voor (respectievelijk 19% en 9,7% in de BELA trial versus 20,9 en 10,4% in de BFORE trial) en lijken minder dosis-gerelateerd te zijn. Deze transaminasestijging verdwijnt meestal snel na staken en recidiveert niet of is minder uitgesproken bij hervatting. De commissie adviseert daarom bosutinib in een uiteindelijke dosering van 400 mg per dag voor te schrijven en frequent controle van de transaminases te verrichten met name in de eerste maanden van gebruik. Bij ernstige of recidiverende episoden van transaminase-verhoging door bosutinib kan eventueel prednison gegeven worden in een dosis van ongeveer 0,5 mg/kg met afbouwen op geleide van de leverenzymen.
Nilotinib induceert frequent hyperglycemie (rond 7% graad 3-4; >13,9 mmol/l) en hypercholesterolemie (vrijwel alleen graad 1-2 verhoging (<10,3 mmol/l)).40,69 Mogelijk mede hierdoor is er een verhoogde incidentie van cardiovasculaire bijwerkingen bij gebruik van het middel, maar er zijn ook directe ongunstige effecten van nilotinib op het endotheel. Dit is reeds eerder beschreven in deze richtlijn.
Bij nilotinib gebruik komt tevens vaak lipaseverhoging voor (9-10% graad 3-4; > 2x ULN), zelden met het klinische beeld van een pancreatitis (2-3% pancreatitis gr 1-4, ongeveer 0,5% graad 3-4). Verder komt fijnvlekkige huiduitslag, meestal met jeuk, regelmatig voor (38-40%, vrijwel alleen graad 1-2).29
Arteriële doorbloedingsstoornissen bij gebruik van de andere 2G-TKIs zijn reeds eerder uitgebreid in de sectie “Hoe dient een nieuw gediagnosticeerde CML in de chronische fase te worden behandeld?” in deze richtlijn besproken en dit wordt hier niet herhaald.
De 3G-TKI ponatinib induceert geregeld hypertensie (9%, graad 3-4 in 2%).70 Het middel kan tevens hyperglycemie, hypercholesterolemie en vaatlijden veroorzaken. In de eerstelijns EPIC studie waarin ponatinib vergeleken werd met imatinib had bij een korte follow-up van een jaar reeds 7% een arteriële complicatie, tegen 2% in de imatinib-arm, terwijl dit percentage in de 4-jaars update van de 2e-5e lijns PACE studie 28% was, waarvan 23% ernstig.71 De eerder genoemde meta-analyse meldt een incidentie van 10,6/100 patientenjaren.35
Net als bij nilotinib ontstonden deze arteriële bijwerkingen voornamelijk bij patiënten die reeds risicofactoren voor vaatlijden hadden, zoals hypertensie, roken, hypercholesterolemie en diabetes mellitus. Nog meer dan bij nilotinib is bij gebruikers van ponatinib cardiovasculair risicomanagement met agressieve behandeling van hyperglycemie, hypercholesterolemie en hypertensie geïndiceerd.
Gezien het beschikbaar komen van asciminib vanaf de derdelijn, kan dit middel als een alternatief voor ponatinib worden gebruikt. Van belang is, zoals boven beschreven, dat in de ASCEMBL studie de incidentie van cardiovasculaire complicaties in de asciminib arm hoger was dan die in de bosutinib arm.72 Voorzichtigheid met dit nieuwe middel is daarom op zijn plaats. Wel is het aantal patiënten dat onder asciminib hypercholesterolemie en hyperglycemie ontwikkelt zeer laag, hetgeen duidelijk anders is voor ponatinib en nilotinib.
Monitoring van cardiovasculaire risicofactoren is geïndiceerd bij de start van behandeling, na 3 maanden en vervolgens minimaal jaarlijks. Daarnaast kan overwogen worden als hulpmiddel voor de vroegdetectie van perifeer vaatlijden bij nilotinib en ponatinib jaarlijks een enkel-armindexmeting te verrichten.73,74 Hierbij wordt met een dopplerapparaatje en een bloeddrukband dan wel met een geautomatiseerd bloeddrukmeetsysteem aan beide kanten de systolische bloeddruk aan a. dorsalis pedis en aan de a. tibialis posterior gemeten en de hoogste waarde wordt gedeeld door de hoogst gemeten systolische bloeddruk aan de linker of rechter a. brachialis (ook met het dopplerapparaat). Normale waarden hiervan zijn >0,90 tot 1,3, waarbij een waarde ≤0,90 diagnostisch is voor obstructief arterieel vaatlijden.75
Aanbevelingen
Achtergrond
De WHO-criteria voor het vaststellen van een chronische fase met hoog-risicokenmerken of blastencrisis zijn vermeld in Tabel 1.4 Wanneer er bij diagnose reeds een chronische fase met hoog-risicokenmerken bestaat kan het resultaat van behandeling met TKIs uitstekend zijn. Wel wordt geadviseerd extra zorgvuldige responsmonitoring te verrichten met kleinere intervallen dan normaal totdat een optimale respons is bereikt, waarna reguliere monitoring plaats kan vinden. Behandeling met een 2G-TKI, dasatinib of bosutinib, heeft in dergelijke gevallen de voorkeur van de commissie.
Het is zeer ongewoon dat een chronische fase met hoog-risicokenmerken ontstaat tijdens behandeling met TKI als er telkens voldaan is aan de responsmijlpalen. Veelal zal het juist gaan om patiënten die onder verschillende lijnen van therapie onvoldoende respons hebben bereikt. Een zich ontwikkelende chronische fase met hoog-risicokenmerken is dan een sterke waarschuwing voor het ontstaan van een blastencrisis. Inmiddels zal in dergelijke gevallen reeds onderzoek gedaan zijn naar BCR::ABL-mutaties en dit dient bij het vaststellen van de hoog-risicokenmerken zeker opnieuw te gebeuren aangezien sequentiële mutaties geregeld voorkomen, als uiting van genetische instabiliteit van een niet goed onderdrukte CML-kloon (zie Tabel 15).76 Bij het vaststellen van een mutatie die gevoelig is voor een niet eerder gegeven middel, kan behandeling hiermee gestart worden, opnieuw onder strikte responsmonitoring met intervallen van 4-6 weken. Intussen is het bij geschikte patiënten verstandig te gaan zoeken naar een allogene donor, zodat bij uitblijven van een acceptabele respons een stamceltransplantatie verricht kan worden.
Indien er geen mutatie wordt gevonden bij gebruik van imatinib kan een 2G-TKI geprobeerd worden en bij uitblijven van een acceptabele respons nog ponatinib. Als derdelijns behandeling is asciminib ook een goede keus en wellicht te prefereren boven ponatinib wegens de betere tolerantie. Wanneer een acceleratie optreedt onder gebruik van een 2G-TKI dient direct met ponatinib gestart te worden indien geen richtinggevende mutatie gevonden wordt. Het advies een donorsearch te starten geldt vanzelfsprekend ook hier.
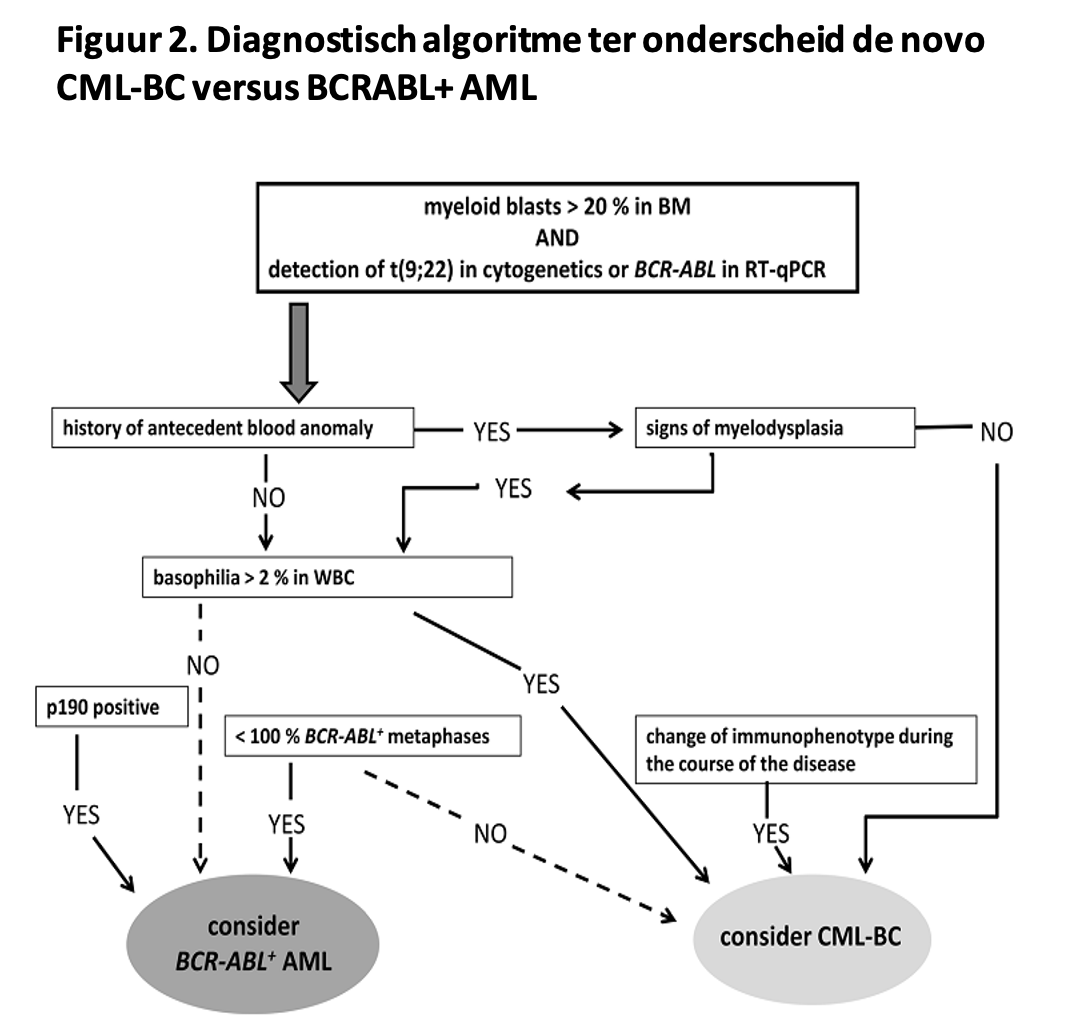
Zelden presenteert zich een CML in blastencrisis.77 Het is dan vaak moeilijk om vast te stellen dat er een chronische fase aan vooraf gegaan is. Als er een regulier p210 transcript bestaat, zoals gezien wordt bij een e13a2 of e14a2 fusie, dan betreft het waarschijnlijk toch een CML, hoewel de WHO in de 2022 update van de classificatie van hematologische neoplasmata ook de entiteit “AML with BCR::ABL1” heeft vastgelegd, daarmee aangevend dat in gevallen waarin een klinisch manifeste chronische voorfase ontbreekt de diagnose CML niet met zekerheid te stellen is.4
Bij deze AML met BCR::ABL1 translocatie worden mutaties of additionele chromosomale afwijkingen zoals vaak voorkomen bij myeloïde blastencrises die uit een chronische fase CML ontstaan minder vaak gezien.4 In geval van twijfel kan het diagnostische algoritme uit Figuur 1 gevolgd worden.78
In de lymfatische blastencrisis voortkomend uit chronische fase CML komen cryptische deleties in immuunglobuline- en T-cel receptorgenen vrijwel altijd voor en gaan dan gepaard met verlies van IKZF1 en/of CDNK2A/B genen zoals met CGH-array kan worden vastgesteld.76
Behandeling met imatinib van een de-novo blastencrisis (BC) CML induceert in 15-27% complete remissies, maar hoewel soms snel optredend zijn ze meestal van korte duur, bij lymfatische BC minder dan 100 (mediaan) en bij myeloïde BC minder dan 200 dagen.79-81 Er zijn geen head-to-head prospectieve vergelijkende studies verricht tussen imatinib en 2G-TKIs bij de behandeling van CML-BC, waardoor er geen hard oordeel te geven is over de beste TKI in deze setting. Wel werd in een retrospectieve serie een betere overleving gevonden bij patiënten die initieel met een 2G-TKI werden behandeld ten opzichte van imatinib.82 Daarnaast induceren dasatinib (en nilotinib) alsnog 35-80% complete hematologische remissies van CML-BC bij eerdere imatinib-resistentie, hoewel deze meestal ook niet duurzaam zijn.83-85 Dasatinib passeert bovendien beter de bloed-hersenbarrière dan imatinib.86,87 De commissie acht daarom initiële behandeling met dasatinib (1 dd 140 mg) voor een nieuw geconstateerde en niet eerder behandelde CML-BC superieur aan die met imatinib. Nilotinib is niet geregistreerd voor behandeling van CML-BC.
Ponatinib is in een fase 2 onderzoek getest in CML-BC en daarbij werd een major hematologisch respons percentage van 31% gezien. De mediane duur tot een MHR was 4,1 weken en bij de 47% van de patiënten die een MCyR bereikten had 66% die nog steeds na 1 jaar. Aangezien dasatinib en ponatinib niet met elkaar in een onderzoek zijn vergeleken kan de commissie geen voorkeur uitspreken voor dasatinib versus ponatinib. Wel is het vanzelfsprekend dat in geval er bij mutatieanalyse een dasatinib-resistente mutatie wordt gevonden, ponatinib wordt gegeven. Bosutinib is ook voor blastencrisis geregistreerd, maar het aantal patiënten dat in studies behandeld is, is beperkter dan voor dasatinib en ponatinib en bovendien was het responsniveau daarbij lager, zodat de commissie bosutinib als tweede keus middel na dasatinib of ponatinib beoordeelt.85,88-90 Van asciminib zijn nog te weinig gegevens bekend om een oordeel op te baseren.
Er zijn geen goede studies verricht om vast te stellen of TKIs wellicht met chemotherapie moeten worden gecombineerd wanneer een BC wordt gediagnosticeerd. Desondanks suggereren verschillende series dat een combinatie van AML gebaseerde behandeling met een TKI bij een myeloïde BC en van ALL gebaseerde chemotherapie in combinatie met een TKI de kans op het bereiken van een complete hematologische respons of complete remissie en het uiteindelijk bereiken van een allogene stamceltransplantatie verhoogt.82 Een recente studie suggereert overigens dat zowel een myeloïde als een lymfatische blastencrisis met een combinatie van FLAG-IDA chemotherapie plus ponatinib kan worden behandeld.91 Dit betreft een klein (n=17) en niet gerandomiseerd onderzoek en daarom is de bewijskracht voor het algemeen gebruik van dit regime, onafhankelijk van de myeloïde of lymfatische origine, beperkt.
Zeker bij patiënten die zich presenteren met zeer hoge leukocytengetallen, dan wel niet snel lijken te reageren op de ingestelde TKI-behandeling, moet daarom combinatietherapie overwogen worden.92,93 De combinatie verhoogt wel de kans op toxiciteit van zowel chemotherapeutica als TKI’s.
Chemotherapie dient ook overwogen te worden in die gevallen waarin het niveau van restziekte te hoog blijft onder TKI-behandeling. Het verrichten van een alloSCT in een complete hematologische remissie leidt tot betere resultaten dan wanneer de blastencrisis nog steeds actief is ten tijde van de alloSCT. Uit een retrospectieve analyse van een groot cohort Chinese patiënten(n=386) lijken diepere responsniveaus voor alloSCT tot betere resultaten te leiden, zowel bij myeloïde als bij lymfatische blastencrises. Moleculair ondetecteerbare ziekte onder behandeling van TKI met of zonder chemotherapie gaf de beste overleving (75% na 5 jaar), hetgeen beter was dan alleen een MMR, hetgeen weer beter was dan een CCyR of CHR, hetgeen weer beter was dan bij het uitblijven van een CHR.94 De commissie beveelt daarom aan tenminste een complete hematologische remissie na te streven ten tijde van de start van de conditionering van de alloSCT. Waarschijnlijk is een complete cytogenetische respons beter en een major moleculaire respons of ondetecteerbaar BCR::ABL een optimale uitgangssituatie voor de start van de alloSCT maar de bewijskracht van deze stelling is laag door de geringe kwaliteit van de weinige studies.95
De rol van blinatumomab in combinatie met dasatinib of ponatinib is wel in Ph+ ALL onderzocht, maar niet in lymfatische CML-BC.96,97 De resultaten van de combinaties in ALL zijn echter opvallend goed en dit suggereert dat ook bij een lymfatische CML-BC een dergelijke combinatie de voorkeur zou verdienen. Of hiermee ook een allogene stamceltransplantatie onnodig zou worden zoals gesuggereerd wordt in de genoemde studies is voor lymfatische CML-BC onduidelijk. Beschikbare gegevens wijzen op hogere persisterende MRD niveaus bij CML-BC dan bij Ph+ ALL onder behandeling met chemotherapievrije combinatietherapie.97 De commissie handhaaft daarom het advies om bij een lymfatische CML-BC te streven naar een alloSCT bij het bereiken van een goede respons.
Bij patiënten die geen AML of ALL-gebaseerde chemotherapie kunnen ondergaan dient de TKI als monotherapie voortgezet te worden tot aan progressie en dat geldt vanzelfsprekend ook voor patiënten die wel intensieve therapie hebben ondergaan, maar niet kwalificeren voor een alloSCT vanwege uiteenlopende redenen.
Bij het vaststellen van het optimale beleid dient de behandelaar zich te realiseren dat de uitkomsten van de behandeling van CML-BC nog immer teleurstellend zijn en dat in bepaalde gevallen palliatie de beste optie is.40,98
Bij patiënten die een BC ontwikkelen onder TKI-behandeling kan de patiënt onder 4-wekelijkse meting van het BCR::ABL-niveau zo lang de transplantatievoorbereiding loopt de volgende generatie TKI continueren.
In alle situaties moet beoordeeld worden of de patiënt met een BC in aanmerking kan komen voor een studie.
Over de conditionering voor de alloSCT is geen op bewijs gebaseerd advies te geven. Bij een chronische fase stelt de werkgroep voor een verminderd intensief schema te hanteren, te meer daar bij een eventueel recidief de kans op het alsnog bereiken van solide remissie onder invloed van donorlymfocyteninfusie zeer groot is.99 Bij een blastencrisis is een myelo-ablatief schema bij daarvoor geschikte patiënten wellicht te prefereren, maar de meerwaarde hiervan boven verminderd intensieve conditionering is onbewezen.
Er is onduidelijkheid over de rol van onderhoudsbehandeling en timing van TKIs ná een allogene stamceltransplantatie. De commissie adviseert bij patiënten met of zonder mutaties die eerder gevoeligheid hebben vertoond voor een al dan niet op de mutatie toegesneden TKI, deze door te zetten gedurende tenminste een jaar na de transplantatie waarbij minstens een jaar geen detecteerbaar BCR::ABL aantoonbaar moet zijn geweest. Wellicht is een langere onderhoudsbehandeling veiliger, maar het ontbreekt aan gegevens in de literatuur. Bij patiënten die ongevoelig bleken voor TKIs vóór de transplantatie is het doorzetten van deze middelen na transplantatie niet rationeel, tenzij de patiënt een mutatie blijkt te hebben waarvoor eerder niet het geschikte middel gegeven is.
Ook bij een blastencrisis dient bij diagnose mutatie-analyse verricht te worden, aangezien mutaties frequent voorkomen (tot >80%) en dit de behandeling kan sturen.100 Bij elk eventueel recidief dient deze analyse opnieuw plaats te vinden als er therapeutische consequenties aan de uitslag te verbinden zouden kunnen zijn.
Aanbevelingen
Achtergrond
In de Franse STIM-studie konden patiënten die een langdurig niet-detecteerbaar BCR::ABL-signaal hadden hun behandeling op proef staken. Inmiddels is na een gemiddelde follow-up duur van meer dan 8 jaar nog steeds 39% in een persisterende BCR::ABL negatieve therapievrije remissie (TFR).101 Recidieven traden vooral in de eerste 7 maanden op. Daarna nog een enkele na 12 en 13 maanden.
De grote pan-Europese EURO-SKI studie had minder stringente stop- en herstartcriteria: de 800 patiënten die meededen moesten tenminste 3 jaar met een TKI zijn behandeld, niet eerder van therapie zijn overgeschakeld wegens resistentie en moesten tenminste een jaar lang een BCR::ABL-niveau hebben van <0,01% (MR4).102 Bij verlies van major moleculaire respons (BCR::ABL-niveau boven 0,1%) werd de behandeling hervat. Het percentage succesvolle stoppers bedroeg na 6 maanden 62%, na 12 maanden 56% en na 24 maanden 52%. Er lijkt nog niet een volledig vlakke curve te ontstaan bij langduriger follow-up, maar de kans op alsnog verliezen van de MMR na meer dan 24 maanden succesvolle TFR wordt wel heel klein.103 In andere landen zijn inmiddels soortgelijke, minder grote stoponderzoeken verricht. Allen tonen globaal hetzelfde beeld. Zie hiervoor Tabel 17A. Stopstudies die gedaan zijn met gebruik van 2G-TKIs tonen ongeveer dezelfde succespercentages als na imatinib, maar deze worden bereikt na een gemiddelde behandelduur die duidelijk korter is dan die na imatinib (zie Tabel 17B). Aangezien er geen prospectieve vergelijkende studies verricht zijn, is niet zeker of dit betekent dat met 2G-TKIs patiënten gemiddeld eerder kunnen stoppen met de behandeling dan met imatinib.
In de STIM-studie waren mannelijk geslacht, Sokalscore en de duur van de behandeling met imatinib voor het staken gecorreleerd met succesvolle TFR.101 In de EUROSKI-studie was alleen de behandelduur en de daarmee samenhangende duur van de MR4 voorspellend voor succes. Minder dan 70 maanden (5,8 jaar) TKI-behandeling gaf een kans van 43% om na 6 maanden nog in remissie te zijn, tegenover 66% voor meer dan 70 maanden. Gemiddeld was er met elk jaar dat de behandeling langer had geduurd een toename van 16% in de kans op succesvolle TFR. Bij het vaststellen van het optimale moment van staken dient dit, naast de ernst van bijwerkingen en eventuele zwangerschapswens in de overwegingen meegenomen te worden meegewogen. De diepte van de respons vóór het staken en de Sokalscore bij diagnose waren niet predictief.102
Stoppen van de behandeling blijkt in het algemeen veilig, hoewel enkele casussen van blastencrisis beschreven zijn, op een totaal aantal gepubliceerde stoppers van > 2000.104,105 Patiënten die toch hun respons verloren en de behandeling moesten hervatten bereikten vrijwel allen op korte termijn weer een diepe respons en progressies naar latere fasen van de CML traden niet op.102 Wel ontstaat na het staken bij 25-30% van de patiënten een onbegrepen onthoudingssyndroom met pijnklachten in spieren, gewrichten, vooral in de schouders, bovenarmen en bovenbenen en soms (achilles-)pezen dat bij 5% zelfs ernstig is.106 Het begint vaak binnen enkele weken na het staken en kan wel meer dan een jaar aanhouden. Hervatting van de TKI leidt tot snel verdwijnen van de klachten. Laboratoriumafwijkingen van CK, aldolase en auto-immuunserologie werden niet gezien bij de patiënten waarbij hiernaar gekeken is. Soms is pijnstilling (paracetamol, NSAIDs) nodig en in ernstige gevallen kan kortdurend prednison gegeven worden met doorgaans snel resultaat. Helaas recidiveren de klachten vaak bij het afbouwen ervan.
Ondanks de soms ernstige klachten zijn er slechts zelden patiënten die hervatting van hun TKI prefereren als dat vanwege verlies van respons niet noodzakelijk is.
Het onthoudingssyndroom kan ook optreden bij geleidelijk afbouwen van de TKI dosis, zoals blijkt uit de resultaten van de Britse Destiny studie waarin patiënten voordat zij de behandeling staken de dosis halveren gedurende een jaar. Na het vervolgens staken van de behandeling meldde 40% van de patienten ook musculoskeletale klachten. 107
Voor een bespreking van de digitale PCR wordt verwezen naar een review door Kockerols et al. in Hemasphere.108
Twee grote “2e stop” onderzoeken, met belangrijke Nederlandse bijdragen, zijn inmiddels gesloten en gewacht wordt op de resultaten. Tot die tijd wordt door de commissie een 2e stoppoging buiten studieverband afgeraden.
Aanbevelingen
Achtergrond
Ongeveer 14% van de patiënten is bij diagnose in de fertiele levensfase tussen 20 en 40 jaar.109 De fertiliteit van mannen onder imatinib lijkt niet verminderd te zijn. Ook wordt geen verhoogde incidentie gezien van aangeboren afwijkingen, hoewel het totaal aantal gerapporteerde zwangerschappen waarbij de man een TKI gebruikt beperkt is en de data daarom niet heel hard zijn. Het lijkt echter vooralsnog onnodig voor de conceptie TKI-behandeling bij de man te onderbreken.110
TKI-gebruik door de vrouw moet sterk ontraden worden, met name in de eerste 12 weken van de zwangerschap in verband met een verhoogde incidentie van congenitale afwijkingen van ongeveer 10% bij een normale achtergrondincidentie van 3-4%. Het betreft onder andere schedel- en wervelanomalieën, hypospadie en buikwanddefecten.111
Om TKI-expositie van de foetus te vermijden kunnen verschillende strategieën gevolgd worden. Als eerste kan bij patiënten die een zeer goede respons hebben, gewacht worden tot het moment dat de behandeling volgens de eerder genoemde criteria gestaakt kan worden. Vervolgens kan weer een keuze gemaakt worden uit twee opties. De eerste is dat de patiënte zo snel mogelijk zwanger probeert te worden, in de hoop dat, wanneer een relapse optreedt, dit pas na het eerste trimester geschiedt, zodat TKI-behandeling eventueel mogelijk zou zijn. De andere optie is dat eerst gewacht wordt gedurende 6-7 maanden. Mocht er dan nog steeds sprake zijn van een aanhoudende MMR, dan is de kans op een later verlies daarvan klein geworden en de kans op een therapievrije zwangerschap groot.
Wanneer er echter geen sprake is van een voldoende diepe respons om staken van de behandeling mogelijk te maken, of patiënt niet aan de criteria daarvoor voldoet, dan is de veiligste benadering het overzetten van de behandeling op interferon-alfa in de hoop dat daarmee de respons op peil blijft. Interferon passeert de placenta niet en is daarom veilig voor de zwangerschap.112 Een alternatieve benadering zou kunnen zijn het staken van de behandeling en het beloop van het BCR::ABL af te wachten. Bij een stijging boven het MMR-niveau, eventueel boven 1% kan dan voor interferon gekozen worden, dan wel voor hervatting van de TKI in het tweede en derde trimester. Eventueel kan de start van de TKI uitgesteld worden tot verlies van een hematologische respons. Wie optimale veiligheid voor de foetus nastreeft zal ook in latere trimesters een voorkeur hebben voor interferon behandeling. Gezien de onzekerheid van de respons op interferon is dit echter niet de meest veilige benadering voor de patiënt zelf.
Wanneer een patiënte met een nieuw gediagnosticeerde CML zwanger blijkt te zijn, is het geadviseerde beleid afhankelijk van het trimester waarin de zwangerschap zich bevindt. In de eerste 12 weken kan gekozen worden voor behandeling met leukaferese bij een bedreigende leukocytose van >100 x 109/l.113,114 Een waarde daaronder lijkt veilig voor de placentadoorbloeding. Bij lagere leukocytengetallen of als leukaferese onvoldoende effectief is kan interferon werkzaam zijn. Een andere optie is het gebruik van hydroxycarbamide, hoewel dat in de vroege zwangerschapsfase niet met zekerheid veilig is, of toch gebruik van een TKI. Nilotinib passeert de placenta het minst en heeft daarom de voorkeur als niet zonder TKI uitgekomen kan worden.115
Ook in het tweede en derde trimester heeft qua medicamenteuze behandeling interferon ook de voorkeur, maar is er minder bezwaar tegen hydroxycarbamide of een TKI, hoewel ook dan beiden niet aangetoond veilig zijn.
Bij zwangere patiënten in blastencrisis moet het belang van de moeder voorop staan en is TKI-behandeling onafhankelijk van het stadium van de zwangerschap geïndiceerd. Bij een respons op de TKI kan gepoogd worden de zwangerschap uit te dragen alvorens een allogene stamceltransplantatie verricht wordt. Intensieve chemotherapie tijdens de zwangerschap geeft weliswaar een verhoogd risico op congenitale afwijkingen, maar wordt meestal goed verdragen door de foetus.116 Vanzelfsprekend dient ook een abortus provocatus in deze situatie besproken te worden.
Tabel 17A. Stopstudies met imatinib-behandelde patiënten
|
Naam studie |
Aantal geïncludeerde patienten |
Behandeling voor stop |
vereist responsniveau vóór stop |
herstart bij |
succespercentage (bij verschillende duur van follow-up) |
|
STIM1100 |
100 |
IFN daarna imatinib gedurende ≥3 jr |
CMR |
verlies van MMR of ≥1-log toename in BCR::ABL |
39% |
|
STIM2116 |
200 |
Imatinib gedurende ≥3 jr |
als STIM |
Als STIM |
46% |
|
ALLG CML117 |
40 |
Imatinib gedurende ≥3 jr |
ondetecteerbaar ≥2 jr |
verlies van MMR of bevestigd verlies van MR4,5 |
45% |
|
According to STIM118 |
80 |
Imatinib gedurende ≥3 jr |
zoals STIM; af en toe positieve BCR::ABL metingen toegestaan |
verlies van MMR |
64% |
|
EUROSKI101 |
868 |
Imatinib, nilotinib, dasatinib |
MR4 gedurende ≥1 jr; TKI gedurende ≥3 jr |
verlies van MMR |
54% |
|
ISTAV119 |
112 |
Imatinib |
ondetecteerbare BCR::ABL |
verlies van MMR |
52% |
|
DESTINY106 |
168 |
Imatinib, nilotinib, |
MR4 en stabiele respons onder de halve dosis gedurende 12 maanden |
verlies van MMR |
36-72% (afhankelijk van diepte van respons voor halveren en vervolgens staken van de behandeling |
Tabel 17B. Studies met 2G-TKIs vóór stop.
|
Naam studie |
Aantal geïncludeerde patienten |
Behandeling voor stop |
vereist responsniveau vóór stop |
herstart bij |
succespercentage (bij verschillende duur van follow-up) |
|
STOP 2G TKI pilot120 |
60 |
Nilotinib of dasatinib |
CMR voor mediaan 29 maanden* |
verlies van MMR |
56,7% |
|
ENEST freedom121 |
215 |
Nilotinib |
MR4.5 gedurende ≥1jaar |
verlies van MMR |
52% |
|
ENESTop122 |
117 |
Nilotinib |
MR4.5 gedurende ≥1jaar |
Bevestigd verlies van MR4 of elk verlies van MMR |
59% |
|
ENESTpath123 |
650 |
Nilotinib |
gerandomiseerd MR4.5 gedurende ≥1 jr vs ≥2 jr |
Bevestigd verlies van MR4 of elk verlies van MMR |
studie is bezig |
|
ENESTGoal124 |
300 |
Nilotinib |
MR4.5 gedurende ≥1jaar |
Bevestigd verlies van MR4 of elk verlies van MMR |
studie is bezig |
|
DASFREE125 |
~74 |
Dasatinib |
MR4.5 gedurende ≥1jaar |
verlies van MMR |
studie is bezig |
|
DADI126 |
63 |
Dasatinib |
diepe moleculaire respons gedurende ≥1jaar |
verlies van MMR |
48% |
|
CML V (TIGER) nilotinib +/ − PEG-IFN127 |
650 |
Nilotinib (3 jr) vs Nilotinib+PEG-IFN (2 jr) |
MR4 gedurende >1 jr + PEG-IFN onderhoud |
verlies van MMR |
studie is bezig |
*CMR: complete moleculaire respons, hier overeenkomend met MR4,5
© 2022. Alle rechten voorbehouden
Initiatief: HOVON MPN werkgroep
Geautoriseerd door: Nederlandse Vereniging voor Hematologie
Autorisatiedatum en geldigheid
Uiterlijk in 2028 bepaalt de HOVON MPN-werkgroep of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De HOVON MPN-werkgroep is als houder van deze richtlijn de eerstverantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk en/of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig wordt gemotiveerd afgeweken van de richtlijn.