In 2011 verscheen de richtlijn “Laboratoriumonderzoek bij een monoklonale gammopathie” van de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde (NVKC), het College van Medisch Immunologen (CMI) en Hemato-oncologie voor Volwassen Nederland (HOVON). Deze richtlijn was bedoeld voor zowel medisch- als laboratoriumspecialisten en beschrijft het doelmatig gebruik van de destijds beschikbare testen voor het detecteren van monoklonale immuunglobulinen. Deze richtlijn behoeft actualisatie met name vanwege de hernieuwde positie van de serum vrije lichte keten (sVLK) bepaling als multipel myeloom (MM) definiërend criterium, en het gebruik van therapeutische monoklonale antistoffen (t-mAb) die kunnen interfereren bij de detectie van M-proteïnen.
In 2011 verscheen ook de richtlijn “Diagnostiek bij Multipel Myeloom; de rol van beeldvorming, chromosoomanalyse en multiflowcytometrie” namens de HOVON Multipel Myeloom Werkgroep en de HOVON Werkgroep Hemato-oncologische Genoom Diagnostiek. Ook deze richtlijn behoeft een herziening.
Aangezien bovenstaande diagnostica een integraal onderdeel uitmaken van de diagnostiek en monitoring van therapierespons van een monoklonale gammopathie is besloten de twee richtlijnen uit 2011 samen te voegen.
Deel van de huidige diagnostische mogelijkheden worden alleen in studieverband toegepast en daar geëvalueerd. Omdat de diagnostische waarde van deze bepalingen nog niet altijd duidelijk is en dus kosteneffectiviteit ontbreekt, is in de huidige richtlijn bewust aangegeven welke bepalingen wel en niet noodzakelijk zijn bij patiënten die buiten studieverband worden behandeld.
Hoewel monoklonale M-proteïnen bij diverse ziektebeelden voorkomen maar niet altijd van belang zijn voor diagnose en therapie, richt deze richtlijn zich niet op M-proteïne diagnostiek bij B-cel Non Hodgkin lymfomen (B-NHL). Voor M-proteïnen bij het lymfoplasmacytair lymfoom, zie de recente “Richtlijn voor de diagnostiek, behandeling en follow-up van Waldenström’s Macroglobulinemie (WM) en immuunglobuline M (IgM) gerelateerde ziekten” (https://hematologienederland.nl/wp-content/uploads/2021/02/Richtlijn-Waldenstrom_def_geautoriseerd-2020.12.22-tekstaanpassing-2021.02.12.pdf). Voor diagnostiek bij verdenking amyloïdose wordt verwezen naar de “Richtlijn voor de diagnostiek, behandeling en follow-up van Amyloïd Light Chain amyloïdose”. (https://hematologienederland.nl/wp-content/uploads/2020/09/totaalDOC2020_NVvH_amyloidose_definitief-30092020.pdf)
Voor behandeling van patiënten met een multipel myeloom wordt verwezen naar richtlijn “Behandeling Multipel Myeloom 2021” (RICHTLIJN-behandeling-MM-2021-geautoriseerd-11.05.2021-1.pdf (hematologienederland.nl) van de HOVON werkgroep Multipel Myeloom, die op hun beurt voor diagnostiek verwijzen naar deze richtlijn.
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek van een monoklonale gammopathie. Hier wordt beschreven hoe effectieve en doelmatige diagnostiek bij diagnose en behandeling van de ziekte dient plaats te vinden. De richtlijn is zowel voor als door medisch- en laboratoriumspecialisten geschreven en betekent dat voor beide beroepsgroepen de benodigde informatie voldoende uitgebreid en snel toegankelijk moet zijn.
De richtlijn beoogt niet een volledig leerboek te zijn, maar beoogt aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht daarmee een betere uniformiteit van de diagnostiek en daarmee een optimale overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn geeft aanbevelingen over, of kan worden gebruikt bij, het geven van voorlichting aan patiënten. De richtlijn kan ook worden gebruikt voor het maken van informatiemateriaal voor patiënten. Op de website www.hematologienederland.nl wordt de patiëntinformatie aangepast aan de inhoud van deze richtlijn.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een monoklonale gammopathie, zoals internist-hematologen, internist-oncologen, oncologieverpleegkundigen, physican-assistants, verpleegkundig specialisten, klinisch chemici, medisch-immunologen, pathologen, moleculair-biologen, klinisch genetici en radiologen.
Voor het ontwikkelen van de richtlijn is een werkgroep ingesteld, bestaande uit leden van de HOVON Multipel Myeloom werkgroep, de NVKC, CMI, WGHD en NVC.
De werkgroep werkte gedurende een jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Voor het uitwerken van de verschillende diagnostische onderdelen zijn de volgende subwerkgroepen gevormd, steeds bestaande uit laboratoriumspecialisten en clinici. Hiermee heeft de werkgroep gepoogd om een goede aansluiting te krijgen tussen de werkvelden van beide beroepsgroepen.
Modules Diagnostiek M-proteine en classificatie ziektebeelden, Responsbepaling, Risicostratificatie
Module Technische laboratoriumaspecten
M-proteïne diagnostiek
Pathologie en flowcytometrie
Cytogenetica
Module Beeldvorming (volgt)
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. De belangenverklaringen kunt u inzien bij de Nederlandse Vereniging voor Hematologie.
In onderstaande tabel wordt een overzicht gegeven met de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
Prof Dr MC Minnema Internist hematoloog, UMC Utrecht, voorzitter |
Advisory board (paid to employer): BMS, Jansen Cilag, Gilead, Anylam, Hospitality : Celgene. |
|
Dr. J. Ruinemans-Koerts, klinisch chemicus, Rijnstate Arnhem |
geen |
|
Dr. J.F.M. Jacobs, medisch-immunoloog, Radboud UMC |
Houder van patent #19215329.4. Research support from Sebia, Siemens and The Binding Site. Consulting fees from Sebia, Celgene and Janssen Pharmaceutica for Radboudumc. |
|
Dr. A. Broijl, internist-hematoloog, Erasmus MC |
Honoraria from Celgene, Janssen, Amgen, and Takeda |
|
Dr. M. Stevens-Kroef, laboratorium specialist klinische genetica, Radboud UMC |
geen |
|
Dr. P.J. Poddighe, laboratorium specialist klinische genetica, Amsterdam UMC |
geen |
|
I.S. Nijhof, internist-hematoloog, Amsterdam UMC |
geen |
|
V.H.J. van der Velden, medisch-immunoloog, Erasmus MC |
Mede-uitvinder op het EuroFlow patent PCT/NL2013/050420, lid en bestuurslid van het EuroFlow consortium, contractresearch voor Janssen, Navigate, BD Biosciences, en Pfizer. |
|
A.C. Bloem, medisch-immunoloog, UMC Utrecht |
geen |
|
K. Lam, patholoog, Erasmus MC |
geen |
|
Prof. Dr. J.M. Zijlstra-Baalbergen, internist-hematoloog, Amsterdam UMC |
geen |
|
B. Zwezerijnen, (nucleair) radioloog, Amsterdam UMC |
geen |
Kwaliteitsindicatoren
Strength-of-Recommendation Taxonomy (SORT) gradering
Zoals beschreven in het artikel van Meijer E., et al4 is voor de richtlijn gekozen voor SORT gradering.
|
Code |
Definitie |
|
A |
Consistent, goede kwaliteit patiënt georiënteerd bewijs |
|
B |
Inconsistent of beperkte kwaliteit patiënt georiënteerd bewijs |
|
C |
Consensus, ziekte georiënteerd bewijs, gewoon in praktijk, expert mening, case studies |
Patiënt-georiënteerd bewijs meet uitkomsten belangrijk voor de patiënt; morbiditeit, mortaliteit, verbetering klachten, kostenreductie en kwaliteit van leven. Ziekte-georiënteerd bewijs meet surrogaat eindpunten die al dan niet verbeteringen in patiënten uitkomsten reflecteren.
Diagnostiek en classificatie
Responsbepaling (inclusief relaps en progressie ziekte)
Risicostratificatie
Technische laboratoriumaspecten
Detectie en kwantificering van M-proteïnen
Flowcytometrie en pathologie bij multipel myeloom
Cytogenetische diagnostiek
Aanbevelingen
|
|
SORT grade |
|
|
1 |
De aanvraag van een M-proteïne moet gedaan worden bij verdenking op klonale plasmacelziekte of lymfoplasmacytair lymfoom. |
A |
|
2 |
Om monoclonal gammopathy of clinical significance (MGCS) aandoeningen tijdig te kunnen onderkennen wordt geadviseerd bij iedere monoclonal gammopathy of unknown significance (MGUS) de anamnese, het lichamelijk onderzoek en laboratorium testen uit te breiden, naast de standaard testen die worden ingezet om Multipel Myeloom en/of lymfoplasmacytair lymfoom vast te stellen. |
C |
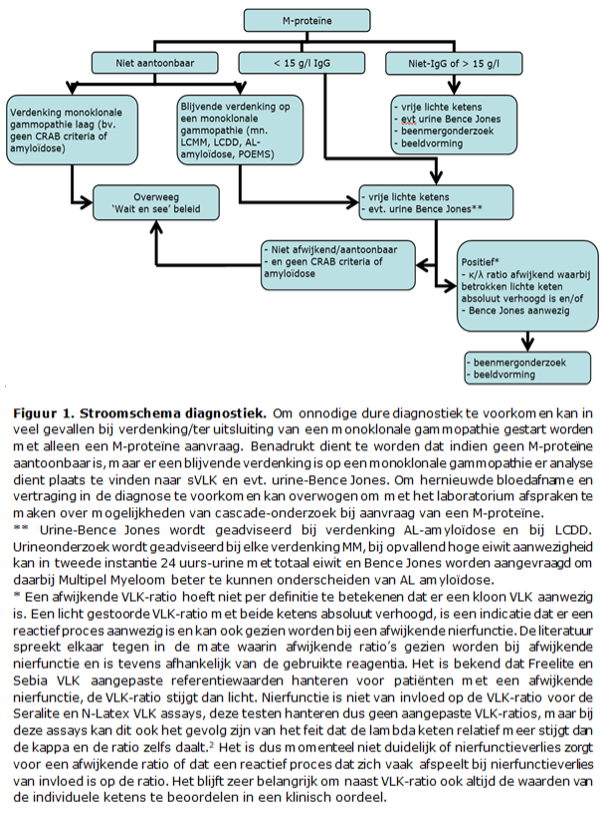
Onderzoek naar monoklonale immunoglobulinen impliceert het zoeken naar een M-proteïne, een monoklonaal intact immuunglobuline in serum of monoklonale VLK in serum of urine (Bence Jones). Belangrijk is te benadrukken dat diagnostiek alleen dient plaats te vinden bij een gerichte klinische vraagstelling: bijvoorbeeld verdenking op een klonale plasmacelziekte zoals multipel myeloom of onderzoek naar een M-proteïne als oorzaak van polyneuropathie of verdenking op amyloid light chain-amyloïdose (AL-amyloïdose). In het kader van lymfoomdiagnostiek kan een aanvraag voor M-proteïne zinvol zijn bij verdenking op een lymfoplasmacytair lymfoom (Waldenström’s Macroglobulinemie). Bij overige lymfomen worden regelmatig M-proteïnen gevonden, echter dit heeft meestal geen diagnostische of klinische consequenties. Tabel 1 geeft de klinische en diagnostische bevindingen weer die aanleiding kunnen zijn voor een screening op M-proteïne en/of VLK. In Tabel 2 zijn de diagnostische criteria voor verschillende stadia en typen van een monoklonale gammopathie te vinden die belangrijk zijn voor de classificatie van ziektebeelden.
In Figuur 1 is een stroomschema te zien voor de diagnostiek bij verdenking monoklonale gammopathie beginnende met de bepaling van het M-proteïne.
Het doel van follow–up van een monoclonal gammopathy of unknown significance (MGUS) is om op tijd de progressie naar symptomatisch MM vast te stellen voordat er orgaanschade met morbiditeit plaatsvindt. De meeste MGUS–patiënten zullen geen progressie naar een MM ontwikkelen en de follow–up is verschillend per risicogroep. Voordat de diagnose MGUS wordt gesteld is het belangrijk te realiseren dat er diverse MGUS–gerelateerde ziektebeelden zijn, de monoclonal gammopathy of clinical significance (MGCS), die wel behandeling nodig hebben. Onder de MGCS vallen bijvoorbeeld AL–amyloïdose, cryoglobulinemie, POEMS-syndroom, alle MGRS (monoclonal gammopathy of renal significance) ziektebeelden), IgM geassocieerde polyneuropathie, etc.5. Bij de vaststelling van MGUS is het daarom belangrijk om de anamnese en het lichamelijk onderzoek hierop te richten en in aanvulling N-terminaal proBNP (NT–proBNP) te meten, urine screening en ECG te beoordelen. In Tabel 3 is de risico-indeling op progressie te vinden volgens Mayo.
|
Tabel 1. Indicaties voor screening op M-proteïne en/of VLK |
|
|
Klinische symptomen |
Onverklaarde ernstige moeheid, botpijn, spontaan optredende fractuur, recidiverende infecties, hyperviscositeitsklachten, polyneuropathie, onbegrepen decompensatio cordis |
|
Klinische diagnoses |
Osteoporose, osteolytische laesies, nierinsufficiëntie, nefrotisch syndroom, amyloïdose, en hartfalen met behouden ejectiefractie (HFpEF) |
|
Laboratoriumbevindingen |
Onverklaarde hoge bezinking, onbegrepen anemie, hypercalciëmie, hyper- of hypogammaglobulinemie, onverklaarde proteïnurie |
|
Tabel 2. Classificatie: diagnostische criteria voor verschillende stadia en typen van een monoklonale gammopathie6 7 |
||
|
Stadium/type monoklonale gammopathie |
Definitie |
Opmerking |
|
M-proteïne MGUS |
|
In geval van een IgM M-proteïne dient er geen sprake te zijn van hyperviscositeit, lymfadenopathie en hepatosplenomegalie. |
|
Lichte keten MGUS |
|
Referentiewaarden van κ/λ ratio kunnen assay/apparatuur afhankelijk zijn (consulteer eigen laboratorium). |
|
Smouldering multipel myeloom |
|
|
|
Multipel myeloom |
|
Klonaliteit (κ/λ restrictie) dient met flowcytometrie, immunohistochemie of immunofluorescentie vastgesteld te worden. Percentage plasmacellen wordt bij voorkeur op een BM-biopt vastgesteld. In geval van discrepantie tussen aspiraat en biopt geldt de hoogste waarde. |
|
Solitair plasmacytoom |
|
|
|
Solitair plasmacytoom met minimale beenmergbetrokkenheid |
|
|
|
POEMS-syndroom |
|
– Verhoogde VEGFA waarde is een 3-4 keer hogere waarde dan de referentiewaarde van de gebruikte test. – Onder endocrinologische afwijking wordt geen diabetes of hypothyreoïdie verstaan. |
|
Systemische AL-amyloïdose |
Aan alle onderstaande criteria moet worden voldaan:
|
Zie ook richtlijn AL-amyloïdose |
|
MGRS |
Consensus criteria voor B cel of plasmacel klonale lymfoproliferatie met daarbij beide kenmerken:
|
Leung et al, Consensus statement of the International Kidney and Monoclonal Gammopathy Research Group, Nat Rev Nephrol, 2019 |
|
a. CRAB criteria: hypercalciëmie (> 0,25 mmol/l meer dan bovengrens normaalwaarde gebied of > 2,75 mmol/l), renale insufficiëntie (creatinine > 177 µmol/L of creatine klaring < 40 ml/min (gemeten of geschat), anemie (<6,2 mmol/l of > 1,2 mmol/l lager dan ondergrens referentie gebied), BM-laesies (1 of meer osteolytische laesies met radiografie, CT of PET-CT). b. de afkapgrens van sVLK is gebaseerd op de Freelite assay (The Binding Site) c. de grens van 10% plasmacelinfiltratie is niet gebaseerd op wetenschappelijke data en in contrast met gebruik in Nederland waar traditioneel de grens van 5% werd gebruikt. Individueel beleid afstemmen met patiënt wordt daarom geadviseerd (expert opinion) met in de overweging dat elke beenmergbetrokkenheid hogere kans op progressie geeft |
||
|
Tabel 3. MGUS risico-indeling op progressie volgens Mayo8 |
|||
|
Risicogroep |
Totaal punten* |
Totaal patiënten |
Progressie bij 20 jaar follow-up |
|
Laag |
0 1 |
449 420 |
5% 21% |
|
Intermediair |
2 |
226 |
37% |
|
Hoog |
3 |
52 |
58% |
|
*Elk criterium is 1 punt:
|
|||
Aanbevelingen
|
|
SORT grade |
|
|
1 |
Indien één van de sVLK gekozen wordt als te vervolgen tumormarker in het perifere bloed, hoeft de andere sVLK niet elke keer gemeten te worden, behalve voor de vaststelling partiele respons (PR) en stringent complete respons (sCR). |
A |
|
2 |
PET-CT kan ingezet worden voor de responsbepaling bij non-secernerend MM. |
B |
Welke M-proteïne meting het beste gebruikt kan worden voor het vervolgen van patiënten kan niet met gepubliceerde data worden onderbouwd, maar gezien zowel M-proteïnen als sVLK een maat zijn voor de mate van plasmacelinfiltratie kunnen beide gebruikt worden. De kinetiek van intacte immuunglobulines versus sVLK is verschillend waarbij de sVLK een korte halfwaardetijd hebben van 3-5 uur en intacte immuunglobulines van ongeveer 3 weken.
Het lijkt logisch en doelmatig om na eerste bepaling van beide parameters een vaste parameter te kiezen die goed te vervolgen is, omdat deze bijv. de hoogste uitslagwaarde bij diagnose heeft.
Het is niet noodzakelijk om bij keuze voor vervolgen op sVLK steeds de beide ketens kappa en lambda mee te nemen. De sVLK ratio is alleen bedoeld om bij diagnose klonaliteit mede te bepalen en om bij complete respons (CR) de stingent CR (sCR) status te kunnen bepalen (zie Tabel 1). Voor het vaststellen van CR dient ook een negatieve immuunfixatie van zowel serum als urine verkregen te worden en een beenmergonderzoek zonder klonale cellen in het biopt. Ook bij het responscriterium partiele respons (PR) zouden beiden gemeten moeten worden, omdat het officiële criterium is dat er een ≥ 50% afname moet zijn in het verschil tussen betrokken en niet betrokken sVLK, maar alleen indien de remissiestatus niet op basis van intact M-proteïne of Bence Jones kan worden bepaald. Overigens moet men zich wel realiseren dat deze respons criteria, PR, CR en sCR, voornamelijk bedoeld zijn om eenduidig respons te kunnen vaststellen van patiënten die in studieverband behandeld worden. Voor patiënten buiten studie verband kan hiervan afgeweken worden.
Een non–secernerend MM komt weinig voor, geschat op < 2% van alle MM.9 Volgens de tabel 1 zouden deze patiënten op percentage plasmacellen in het BM vervolgd moeten worden maar er zijn ook nieuwe data over gebruik van PET-CT scan bij deze groep. In een recente analyse van 2 studies blijkt dat bij diagnose bij alle patiënten diffuse beenmergopname te zien is, daarnaast bij 78% ook focale laesies in het BM en bij 11% extramedullaire laesies.10 Alhoewel officiële criteria van de Internationale Myeloom Werkgroep (IMWG) voor het non–secernerend myeloom ontbreken lijkt het zinvol om na te gaan of een PET CT uptake laat zien en of daarmee respons bepaald kan worden. De PET-CT lijkt zeer geschikt om respons te bepalen in de gehele groep van MM-patiënten, zie verder in de module Beeldvorming (volgt).11
|
Tabel 1. Responscriteria12 |
|
|
Responscategorie |
Responscriteria |
|
Stringent complete respons (sCR) |
CR plus normale sVLK-ratio* en afwezigheid klonale plasmacellen in BM-biopt gemeten met immuunhistochemie |
|
Complete respons (CR) |
Negatieve immuunfixatie originele M-proteïne in serum en urine, geen plasmacytomen meer aanwezig en ≤ 5% plasmacellen in BM |
|
Zeer goede partiele respons (VGPR) |
Serum/urine M-proteïne met immuunfixatie nog aantoonbaar maar niet in elektroferese of ≥ 90% reductie M-proteïne en urine-M-proteïne < 100 mg/24 uur |
|
Partiele respons (PR) |
≥ 50% reductie serum-M-proteïne en reductie in 24 uurs-urine-M-proteïne ≥ 90% of tot < 200 mg/24 uur. Indien plasmacytomen aanwezig tevens 50% afname daarvan. Indien geen M-proteïne of Bence Jones meetbaar is**, een ≥ 50% afname in het verschil tussen betrokken en niet betrokken VLK Indien geen meetbare M-proteïne of VLK, een afname ≥ 50% plasmacellen BM (indien bij diagnose > 30%) |
|
Minimale respons (MR) |
≥ 25% maar < 50% reductie M-proteïne en vermindering 24 uurs-urine met 50-89%. Indien plasmacytomen aanwezig tevens 50% afname daarvan |
|
Stabiele ziekte (SD) |
Voldoet niet aan criteria CR, VGPR, PR, MR of PD |
|
Progressieve ziekte (PD) |
Stijging serum-M-proteïne en/of urine-M-proteïne met minimaal 25% boven laagste waarde (nadir). Absolute stijging serum-M-proteïne moet ≥ 5 g/L zijn en urine-M-proteïne ≥ 200 mg/24 uur. En/of bij CR opnieuw verschijnen van oorspronkelijke M-proteïne in serum/urine En/of ≥ 5% plasmacellen BM En/of teken van progressie zoals nieuwe botlaesie, plasmacytomen of hypercalciëmie |
|
Klinisch recidief |
Eén van de volgende criteria:
|
|
Recidief van CR (alleen te gebruiken als Disease Free Survival (DFS) eindpunt is) |
Eén van de volgende criteria:
|
|
Recidief van MRD-negatief (alleen te gebruiken als DFS eindpunt is) |
Eén van de volgende criteria:
|
|
Alle responscategorieën vereisen 2 opeenvolgende bepalingen. * Het kan voorkomen dat de ratio VLK gestoord is omdat een van de lichte ketens onderdrukt is (onder de normaal waarde). Deze patiënten hebben gelijke prognose als patiënten met normale VLK-ratio en dienen dus ook sCR beschouwd te worden.13 ** meetbare marker bij diagnose/start therapie: M-proteine ≥ 10 g/L, Bence Jones ≥ 0,2 g/24 uur en betrokken vlk ≥100 mg/L (met gestoorde ratio)11 ***SPD = sum of the products of the maximal perpendicular diameters of measured lesions. |
|
|
Tabel 2. MRD-responscategorieën met bijbehorende responscriteria12 |
|
|
MRD-responscategorie |
MRD-responscriteria |
|
Constant MRD-negatief |
MRD-negatief in BM (NGF of NGS of beide) en in beeldvorming met minimaal 1 jaar verschil vastgesteld |
|
Flow MRD-negatief |
Afwezigheid van fenotypisch afwijkende klonale plasmacellen met NGF in BM-aspiraat gemeten d.m.v. Euroflow (of gevalideerd alternatief) met minimale sensitiviteit van 1 per 10-5 kernhoudende cellen of hoger |
|
Sequencing MRD-negatief |
Afwezigheid van klonale plasmacellen d.m.v. NGS in BM-aspiraat gebruik makend van LymphoSIGHT platform (of gevalideerd alternatief) met minimale sensitiviteit van 1 per 10-5 kernhoudende cellen of hoger |
|
Beeldvorming + MRD-negatief |
MRD-negatief d.m.v. NGS of NGF met verdwijnen van elk gebied van verhoogde tracer-uptake gezien op baseline of voorgaande PET-CT scan of afname tot minder mediastinaal bloed pool SUV (maximum standardised uptake value) of vermindering tot minder dan normale omgevende weefsel |
|
De MRD-responscategorie is momenteel alleen voor gebruik in studies en niet voor reguliere zorg. |
|
Risico–indeling gebeurt volgens het revised international staging system (R-ISS). Hiervoor werd het ISS toegepast met daarin de laboratoriummetingen van B2–microglobuline en albumine in serum (Tabel 1). In de R-ISS is daar aan toegevoegd lactaat dehydrogenase (LDH) en cytogenetica (Tabel 2). Het is belangrijk om te realiseren dat het R-ISS patiënten indeelt in verschillende prognosegroepen, maar dat dit op individueel patiëntniveau beperkte waarde heeft i.v.m. de spreiding binnen de prognosegroepen.
|
Tabel 1. International staging system14 |
||
|
Stadium |
Criteria |
Mediane overleving /OS spreidng mediaan (mnd) |
|
I |
Serum β2-microglobuline < 3,5 mg/L and serum albumine > 35 g/L* |
62 (59-64) |
|
II |
Niet passend bij I of III |
44 (42-46) |
|
III |
Serum β2 microglobuline > 5.5 mg/L |
29 (27-31) |
|
Tabel 2. Revised international staging system15 |
|||
|
Stadium |
Criteria |
Mediane progressievrije overleving (PFS) |
5 jaars overleving (OS) |
|
I |
Serum β2 mg < 3,5 mg/L, LDH < ULN Cytogenetica normaal |
62 mnd |
82% |
|
II |
Geen I of III |
44 mnd |
62% |
|
III |
Serum β2 mg > 5,5 mg/L + LDH > ULN OF Serum β2 mg > 5,5 mg/L +Hoog risico cytogenetica (t4,14), t(14,16) of 17p del |
29 mnd |
40% |
* Men dient zich bewust te zijn van het feit dat deze bepalingen methode afhankelijke referentiewaardes hebben en dus per ziekenhuis kunnen verschillen.
Aanbevelingen
|
|
SORT grade |
|
|
1 |
Door de introductie van sVLK assays is het niet meer nodig standaard Bence Jones-eiwitten in de urine te meten bij MGUS & MM |
A |
|
2 |
sVLK assays worden door verschillende leveranciers aangeleverd en zijn onderling niet vergelijkbaar. |
A |
Intacte M-proteïnen
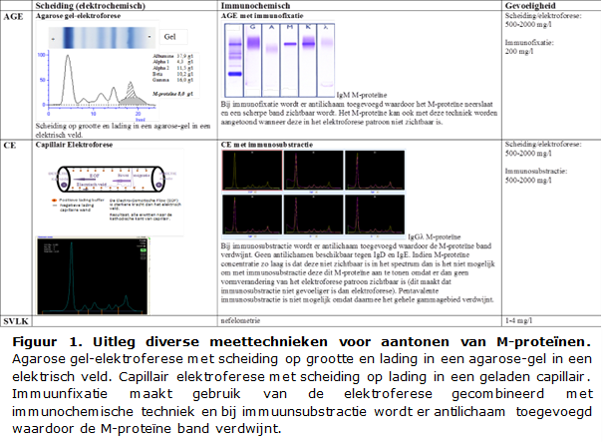
Een initiële screening op M-proteïne gebeurt middels een serum eiwitspectrum (ESP) gemaakt met gebruik van agarose gel elektroforese (AGE) of capillaire elektroforese (CE). Eventuele abnormaliteiten in het ESP worden bevestigd en verder gekarakteriseerd met gebruik van de meer sensitieve immunofixatie elektroforese (IFE) of immunosubtractie (ISUB). Bij een hoge verdenking van een klinisch relevante monoklonale gammopathie wordt ook bij een negatieve ESP geadviseerd een sVLK (en evt Bence Jones test) in te zetten. Kwantificering van het M-proteïne vindt plaats met behulp van het ESP-densitogram. De oppervlakte onder de M-proteïne piek (de zogenaamde M-spike, zie figuur 1) is evenredig met de hoeveelheid eiwit, waardoor de concentratie van het M-proteïne te berekenen is indien het totale serumeiwit bekend is (zie figuur 1). De M-spike kan verricht worden zonder aftrek van polyklonale immunoglobuline achtergrond (zogenaamde ‘perpendicular drop’) of met aftrek (zogenaamde ‘tangent skimming’), daarover bestaat geen internationale consensus.16 Wel is het belangrijk dat elk laboratorium kiest voor één van beide methoden.
Indien er twee monoclonale banden aanwezig zijn dan is het advies deze beide te typeren en te kwantificeren. Betreffen het twee banden van hetzelfde isotype dan is het mogelijk dat het een monomeer en dimeer (of pentameer) betreft van hetzelfde M-proteïne. Dit heeft geen klinische consequenties en hoeft derhalve niet noodzakelijkerwijs bewezen te worden middels een beta-mercaptoethanol behandeling. Bij meer dan twee bandjes wordt geadviseerd het beeld te omschrijven als ‘oligoklonale ontwikkeling’. Indien daarbij een dominant M-proteine aanwezig is (>5 g/L) wordt geadviseerd het isotype en de kwantificering daarvan afzonderlijk te vermelden.
Indien een M-spike niet zichtbaar is, bijvoorbeeld een M-proteïne gelegen in de β-fractie, dan wordt geadviseerd om dit M-proteïne te kwantificeren met een immunochemische bepaling van de betreffende immuunglobuline. Men dient zich in het geval van een IgM en IgA M-proteïne wel te realiseren dat een immunochemische bepaling vaak leidt tot overkwantificering. Dat wil zeggen dat het totaal immunoglobuline hoger is dan het daadwerkelijk M-proteïne, ook indien het totale immunoglobuline merendeels uit M-proteïne bestaat.17
Vrije lichte ketens
Bij een negatieve screen en klinische verdenking op een MM wordt een sVLK-bepaling geadviseerd. Het alternatief is een Bence Jones (VLK in urine)-bepaling maar deze is minder gevoelig en wordt daarom niet aangeraden. Voor screening van Bence Jones-eiwitten volstaat een urine portie. Voor de interpretatie van sVLK-uitslagen is het belangrijk te realiseren dat er verschillen bestaan tussen de diverse aanbieders van sVLK-reagentia en dat er daarom ook per leverancier referentiewaarden worden gedefinieerd.
In de laatste update van de IMWG is een afwijkende betrokken/niet-betrokken sVLK-ratio in serum ≥100 (de betrokken sVLK moet ≥100 mg/L zijn) beschreven als een myeloom-definiërend event (Tabel 2). In de IMWG-richtlijn staat specifiek gemeld dat deze afwijkende ratio ≥100 gebaseerd is op gebruik van de Freelite bepaling (Binding Site). Een gemiddelde Freelite-ratio van 100 komt niet overeen met sVLK-resultaten verkregen met reagentia van een andere leverancier. Over deze afwijkende ratio is recent meer discussie ontstaan omdat in later uitgevoerde studies, 5 in totaal, een nog lagere positief voorspellende waarde (PPV) werd gevonden dan in de originele studie. De originele studie haalde een PPV van 73% voor progressie binnen 2 jaar bij 586 patiënten met SMM, in latere studies was dit tussen de 30% en 64%.18 19 De N Latex test laat een vergelijkbare PPV van 67% zien bij een afkapwaarde van 100 tussen de 2 sVLK ketens en lijkt bij een afkapwaarde van 70 betere predictie te geven. Het gebruik van dit criterium, indien aanwezig als enige reden voor behandeling van MM, zou daarom tot overbehandeling kunnen leiden en het regelmatig vervolgen van deze patiënten is mogelijk een betere optie.
Zoals eerder bij figuur 1 is aangegeven kan een afwijkende sVLK-ratio ook gezien worden bij een afwijkende nierfunctie. De literatuur spreekt elkaar tegen in de mate waarin afwijkende ratio’s gezien worden bij afwijkende nierfunctie en is tevens afhankelijk van de gebruikte reagentia en gebruikte analyser. Het is bekend dat Freelite en Sebia VLK aangepaste referentiewaarden hanteren voor patiënten met een afwijkende nierfunctie, de VLK-ratio stijgt dan licht. Voor de Freelite wordt de aangepaste FLC ratio (0.37-3.10, 100% interval) gehanteerd bij chronisch nierfalen patiënten. Deze referentiewaarden zijn tot stand gekomen d.m.v. Freelite metingen op een BNII Nefelometer.20
Tijdens ASH 2021 werden de resultaten van Freelite metingen in de iStopMM studie getoond en de relatie met chronisch nierfalen. In deze grote studie met meer dan 6000 gezonden (geen plasmacelziekte) en enige vorm van nierfalen werd oa aangetoond dat de groep met een eGFR < 30 ml/min/1.73m2 de FLC ratio tussen de 0.67-2.17 (97.5% interval) was en dus anders dan tot nu toe gehanteerd. Deze metingen werden gedaan op een ander instrument, namelijk de Optilite Turbidimeter die niet veel gebruikt wordt in Nederland. Of deze uitslagen daarom nu standaard ingevoerd moeten worden zal verder onderzocht moeten worden. Nierfunctie is niet van invloed op de VLK-ratio voor de Seralite en N-Latex VLK assays.2
Onderzoek naar Bence Jones-eiwitten in de urine is alleen geïndiceerd in het kader van klinische trials of bij verdenking op AL-amyloïdose en LCDD. Wel moet bij iedere MGUS en MM-patiënt een urine screening gedaan worden voor mogelijk nefrotisch syndroom en bij hoge proteïnurie wordt geadviseerd een 24 uurs-urine meting te doen voor totaal eiwit en Bence Jones.
sVLK-analyse versus urine Bence Jones-analyse
Analyse van Bence Jones-eiwitten in urine wordt niet meer geadviseerd voor elke nieuw gediagnosticeerde MM-patiënt maar wel dient een urine screening gedaan te worden. Deze urine screening is bedoeld om patienten met eventueel nefrotisch syndroom op te sporen en daarmee mogelijkheid voor AL amyloïdose ipv MM. Het is niet bedoeld om VLK op te sporen omdat daarvoor de sVLK test beter is. Een recente studie heeft aangetoond dat bij patiënten met een lichte keten MM de sVLK de voorkeur heeft boven Bence Jones-analyse wat betreft: 1) identificeren van patiënten met detecteerbare ziekte; 2) monitoren van respons op therapie; 3) prognostische waarde betreffende therapierespons en algemene survival.21 22 Bij patiënten die behandeld worden in studieverband worden doorgaans nog wel metingen middels Bence Jones-analyse op 24-uurs urine gedaan omdat de officiële responscriteria deze nog vermelden.
Interferentie van therapeutische monoklonale antistoffen
Bij de MM-behandeling met humane t-mAb zoals daratumumab kunnen concentraties van het biological tot 1 g/L bereikt worden. In dergelijke concentraties kan de t-mAb met elektroforese-technieken zichtbaar zijn als kleine monoklonale band. Co-migratie van een IgG-kappa biological levert problemen op bij het vaststellen van een complete remissie met behulp van IFE/ISUB. Om bij een MM-patiënt die goed reageert op het t-mAb daratumumab een onderscheid te kunnen maken tussen het oorspronkelijke IgG-kappa M-proteïne en het IgG-kappa biological, is voor daratumumab een zogenaamde shift-assay ontwikkeld waarbij een veranderd daratumumab migratie-patroon wordt verkregen door toevoegen van een daratumumab-specifieke antistof.23 Deze daratumumab shift-assay is uitsluitend geïndiceerd voor het vaststellen van complete remissie bij een patiënt met een IgG-kappa M-proteïne dat co-migreert met daratumumab en die een diepe respons heeft bereikt (M-proteïne ≤2 g/L). Op het moment van schrijven van deze richtlijn zijn er voor andere t-mAb nog geen shift-assays verkrijgbaar.
Heavy-lite analyse bij diagnose en follow-up van monoklonale gammopathie
Er wordt geadviseerd om M-proteïnen die in de β-fractie migreren, te monitoren middels totaal immuunglobuline. Nadeel daarvan is dat deze bepaling zowel de monoklonale- als polyklonale-Ig fractie meet. De Hevylite immunoassay is in staat om IgGκ/IgGλ, IgAκ/IgAλ, en IgMκ/IgMλ afzonderlijk van elkaar te meten waarbij de uitslagen in paren worden beoordeeld.24 Bij een patiënt met een IgA-kappa M-proteïne dat co-migreert met andere eiwitten in de β-fractie, kan dus zowel de aangedane IgAκ keten gemeten worden en de polyklonale niet-aangedane IgAλ keten als alternatief voor een totaal IgA-meting. Een abnormale ratio is een surrogaat marker voor IgA monoklonaliteit. Daarbij weerspiegelt de hoogte van de polyklonale niet-aangedane keten de mate van immuunsuppressie. De Hevylite immunoassay kan de reguliere M-proteine diagnostiek ondersteunen maar vormt daar geen standaard onderdeel van.
M-proteïne diagnostiek middels massaspectrometrie
Nieuwe effectieve behandelingen voor MM hebben geleid tot meer patiënten die een sCR bereiken, waarbij met gebruik van reguliere diagnostiek het M-proteïne niet langer detecteerbaar is in bloed en/of urine.12 Sinds 2014 worden er massaspectrometrie-technieken beschreven voor het gevoelig kwantificeren van M-proteïnen.25 Potentiële voordelen van M-proteïne diagnostiek middels massaspectrometrie is dat deze methode monitoren van minimale restziekte in serum mogelijk maakt en dat t-mAb niet interfereren bij de metingen. Op dit moment wordt de klinische waarde van massaspectrometrie binnen de M-proteïne diagnostiek verder onderzocht in klinische studies. M-proteïne diagnostiek middels massaspectrometrie heeft op dit moment dus geen plek in de reguliere diagnostiek.
Aanbevelingen
|
|
|
SORT grade |
|
1 |
Omdat met flowcytometrie zeer geringe aantallen klonale plasmacellen nog kunnen worden vastgesteld is deze techniek zeer geschikt bij MGCS, voor het vaststellen van beenmergbetrokkenheid bij een solitair plasmacytoom en voor MRD-metingen. |
A |
|
2 |
Het gebruik van goed gedefinieerde antistofpanels gekoppeld aan het meten van grote aantallen cellen (5-10 miljoen) is essentieel voor een betrouwbare en gevoelige MRD-bepaling. |
A |
Morfologisch en flowcytometrisch onderzoek spelen een rol bij de diagnostiek van MM. Terwijl de morfologie met name relevant is bij de primaire diagnose en voor het vaststellen van CR, speelt de flowcytometrie ook een rol bij monitoring van de ziekte.
Beenmergbiopt bij multipel myeloom
Een adequaat BM-biopt levert door de geringere kans op bloedbijmenging een realistische inschatting van de mate van infiltratie door neoplastische plasmacellen op. Daarnaast is het BM-biopt van belang als er naast een rijpe plasmacelneoplasie differentiaal diagnostisch ook andere ziekten worden overwogen, met name plasmacytoid uitrijpende kleincellige B-cel lymfomen.
In een recente grote retrospectieve studie blijkt bij het achterwege laten van het BM-biopt de kans op het missen van MM of hoog risico SMM bij afwezig zijn van alle andere diagnostische criteria en signalerende laboratoriumwaarden minder dan 1% te zijn.26 Het BM-biopt kan onder deze omstandigheden achterwege worden gelaten (zie ook figuur 1, flow diagram).
Voor het bevestigen van de diagnose en inschatting van de mate van infiltratie moeten de volgende immunohistochemische markers op een BM-biopt worden verricht: CD138, kappa en lambda. Indien de plasmacellen CD138 negatief zijn: additioneel CD38, CD56, cycline D1, CD5 en CD20.
Indien plasmacytoïd uitrijpend kleincellig lymfoom in de differentiaal diagnose: additioneel CD20 en CD3.
Indien de tumorcellen niet lymfoid of plasmacytoid blijken te zijn: immunohistochemie aan de hand van het histologisch beeld.
Flowcytometrische immunofenotypering
Flowcytometrische immunofenotypering heeft een aantal specifieke eigenschappen die bij de diagnostiek van MM relevant zijn. Dit betreft:
Flowcytometrie speelt daarmee een rol in:
Deze indicaties zullen hieronder uitgebreider worden toegelicht. Flowcytometrie is niet geschikt voor het bepalen van de plasmacelinfiltratie in het beenmerg en zal altijd een onderschatting geven.27
Aantonen van afwijkende plasmacellen bij diagnose
MM is een beenmerg-gelokaliseerde aandoening; bij diagnose wordt een BM-punctie verricht. De IMWG adviseert het volgende t.a.v. bepaling van percentage en klonaliteit van plasmacellen in BM:
In onbehandelde patiënten brengen zowel normale als abnormale plasmacellen in de meeste gevallen CD38 en CD138 tot expressie, en deze markers zijn dan ook bij uitstek geschikt om plasmacellen te identificeren in BM, bloed of andere materialen (let wel: in patiënten behandeld met CD38-therapie kan dit anders zijn, zie “monitoren van MRD tijdens en na behandeling”). Normale plasmacellen laten een heterogene expressie zien van CD19, CD45, CD27, CD56 en CD81 en brengen cytoplasmatisch (cy) immunoglobuline tot expressie met een CyKappa/CyIgLambda-ratio tussen 0.7 en 2.8. De meerderheid van normale plasmacellen zijn positief voor CD38, CD138, CD19, CD45 (zwak), CD27, CD81 en zijn negatief voor CD56.29 Patiënten met MM hebben per definitie klonale plasmacellen die monotypische expressie vertonen van cytoplasmatische Ig-lichte ketens, kappa of lambda (CyIgkappa of CyIglambda, respectievelijk). Deze plasmacellen zijn veelal positief voor CD138 en CD38 met afwijkende expressie van CD19, CD45, CD27 en/of CD81, ook CD28 en CD117 kunnen afwijkend tot expressie komen. Vaak zijn klonale plasmacellen bij patiënten met MM positief voor CD56.29 30
Bij een verdenking op een plasmacelmaligniteit dienen volgens de criteria van de Nederlandse Vereniging voor Cytometrie (NVC) tenminste CD45, CD19, CD38, CD56, CyIgKappa en CyIgLambda te worden bepaald.31 Tevens dient óf CD138 óf VS38c (een intracellulair antigeen dat ook specifiek is voor plasmacellen) te worden bepaald. Deze markers zijn onder andere ook aanwezig in het EuroFlow-panel voor plasmacelmaligniteiten (Tabel 1A)32, maar ook andere (lokale) panels kunnen hiervoor gebruikt worden. Eerdere data suggereerden dat de expressie van CD138 niet stabiel zou zijn na afname van het monster.33 Onze ervaring is echter dat dit effect zeer variabel is en zeker niet in het merendeel van de MM-patiënten wordt waargenomen zolang het monster binnen 36 uur na afname wordt gemeten. Voor het BM-monster kan zowel EDTA als heparine als anticoagulans worden gebruikt.
Het aantal afwijkende klonale plasmacellen dat met flowcytometrie wordt gevonden in BM-monsters van MM-patiënten is vaak aanzienlijk lager dan de percentages die morfologisch en histologisch worden vastgesteld.27 De toegevoegde waarde van flowcytometrie ligt dan ook niet in het vaststellen van het percentage afwijkende plasmacellen, maar in het aantonen van de aanwezigheid van afwijkende klonale plasmacellen. Omdat met flowcytometrie ook zeer lage percentages afwijkende plasmacellen geïdentificeerd kunnen worden, is de methode ook bij uitstek geschikt voor BM-analyses van patiënten met een verdenking op bijvoorbeeld plasmacelziektes zoals MGCS, amyloïdose, POEMS-syndroom, of de beoordeling van mogelijke BM-betrokkenheid bij een primair plasmacytoom, is. Bij dit soort vraagstellingen is het daarom raadzaam om flowcytometrie uit te voeren.
Recente studies laten zien dat bij nagenoeg alle patiënten met MM ook in het perifeer bloed afwijkende plasmacellen kunnen worden aangetoond middels immunofenotypering.34 In studieverband blijkt het aantal circulerende maligne plasmacellen bij diagnose gecorreleerd te zijn met de mate van BM-infiltratie, en tevens met slecht-prognostische kenmerken, en een kortere overleving van MM-patiënten met actieve ziekte.34 Ook het monitoren van patiënten met MM tijdens therapie door MRD-analyse in bloed lijkt klinisch relevant te zijn en prognostische waarde te hebben.35 Echter verdere studies zijn nodig om deze bevindingen te bevestigen voordat flowcytometrische analyse van bloed diagnostisch kan worden geïmplementeerd en deze test wordt daarom op dit moment niet aanbevolen voor standaard zorg.
Naast ondersteuning bij het diagnosticeren van een plasmacelmaligniteit kan flowcytometrie bij primaire diagnose ook bijdragen aan het beter monitoren van de ziekte tijdens en na therapie (MRD), omdat dan het immunofenotype van de te monitoren populatie bekend is.
Daarnaast kan flowcytometrie bij primaire diagnose maar ook tijdens en na therapie bijdragen aan het vaststellen welke antigenen op de MM-cellen tot expressie komen, zodat “targeted”-therapieën, zoals bispecifieke antistoftherapie gericht tegen het antigen BCMA en CD3 of GPRC5D en CD3, mogelijk gerichter kunnen worden ingezet.36
Monitoren van MRD tijdens en na behandeling
Flowcytometrische MRD-analyse is nog geen standaarddiagnostiek, maar heeft wel prognostische waarde waardoor het momenteel nagenoeg in alle lopende studies (centraal) uitgevoerd wordt.12 De interesse voor het bepalen van MRD is de afgelopen jaren toegenomen, doordat door de komst en implementatie van nieuwe behandelingen het percentage patiënten dat een CR bereikt met therapie is toegenomen, waarmee de behoefte is gegroeid om diepere responsen te kunnen aantonen.
Bij het flowcytometrisch onderzoek zijn een drietal zaken van groot belang:
Antistof panel
Voor een betrouwbare MRD-meting is het cruciaal dat de klonale plasmacellen worden onderscheiden van de normale plasmacellen. Logischerwijs spelen antigenen die aberrant tot expressie komen op de afwijkende plasmacellen een belangrijke rol, in combinatie met het aantonen van klonaliteit met behulp van een CyIgKappa/CyIgLambda-kleuring. Indien flowcytometrische MRD-analyse wordt verricht bij patiënten met MM, dient gebruik te worden gemaakt van internationaal gestandaardiseerde protocollen, zoals het Euroflow-protocol (Tabel 1B).29 37 of andere gevalideerde protocollen die dezelfde resultaten geven zoals het Memorial Sloan Kettering Cancer Center (MSKCC)-panel38; lokale protocollen dienen niet gebruikt te worden.
De internationaal gestandaardiseerde protocollen bevatten CD38 en CD138 als markers voor de identificatie van plasmacellen. Dit kan echter tot problemen bij de identificatie leiden als de patiënten behandeld worden of recent behandeld zijn met daratumumab, een volledig humaan monoklonaal immuunglobuline gericht tegen CD38.39 Daratumumab, en ook andere antistoffen gericht tegen CD38, zoals isatuximab, kan de diagnostiek verstoren, enerzijds omdat de therapeutische antistof de diagnostische antistof kan blokkeren, en anderzijds omdat de CD38-positieve plasmacellen tijdens daratumumab-therapie CD38-laag / tot zelfs nagenoeg negatief kunnen worden.40 Binnen EuroFlow is daarom in het MM MRD-panel gekozen voor een CD38 multi-epitope antistof-combinatie, die ook in de aanwezigheid van therapeutische antistoffen nog steeds kan binden aan het CD38-antigeen. In onze ervaring zijn op deze wijze klonale plasmacellen in alle gevallen goed te identificeren. Ter controle of er afscherming optreedt, kan de aankleuring van CD38 op voorloper-B-cellen worden bekeken, deze zijn normaliter sterk CD38-positief. Als alternatief voor CD38 kunnen eventueel ook andere plasmacelmarkers worden gebruikt, zoals VS38C. De bruikbaarheid van deze marker wordt momenteel in studies uitgetest.
Aantal gemeten cellen
Recente data laten zien dat een goede flowcytometrische MRD-meting een gevoeligheid dient te behalen van tenminste 0,001% / 10-5.28 36 Een dergelijke gevoeligheid kan niet worden behaald indien gebruik wordt gemaakt van vol BM, en daarom is een cel verrijkingsstap voorafgaande aan de kleuring een absolute voorwaarde. Waar vroeger nog wel eens gebruik werd gemaakt van mononucleaire cellen na Ficoll-scheiding, is tegenwoordig ‘bulklysis’ de gouden standaard. Deze verrijkingsstap heeft geen invloed op de cellulaire samenstelling van het te meten monster.29 41 Door na de bulklysis de cellen op te nemen in een klein volume wasbuffer kan een celsuspensie worden verkregen van 100 miljoen per ml; door 100 µl hiervan te kleuren kunnen na de procedure minimaal 5 miljoen cellen worden gemeten. De IMWG heeft MRD-negativiteit gedefiniëerd als “Absence of phenotypically aberrant clonal plasma cells by NGF on bone marrow aspirates using the EuroFlow standard operation procedure for MRD detection in multiple myeloma (or validated equivalent method) with a minimum sensitivity of 1 in 105 nucleated cells or higher”.12 Kortom, het gebruik van goed gedefinieerde antistof-panels gekoppeld aan het meten van grote aantallen cellen (5-10 miljoen) is essentieel voor een betrouwbare en gevoelige MRD-bepaling. Bij het rapporteren van MRD-data dient altijd het aantal gemeten leukocyten te worden vermeld, naast het aantal klonale plasmacellen en het percentage MRD. Gebaseerd op de aanwezigheid van respectievelijk ≥20 en ≥50 afwijkende plasmacellen en het gemeten aantal leukocyten kan de “limit of detection”(LOD) en de “limit of quantitation”(LOQ) worden bepaald en gerapporteerd. Een recente studie toont aan dat het IMWG criterium voor flow “MRD-negatief” in de dagelijkse diagnostische praktijk zeer goed toepasbaar is en een sensitieve, meetbare behandelingseffectiviteit in MM-patiënten mogelijk maakt.42 In deze studie behaalden 45% van de patiënten MRD-negativiteit na consolidatie, en slechts 7% van deze patiënten ontwikkelde progressieve ziekte (mediane follow-up tijd: 40 maanden). Het bereiken van MRD-negativiteit was prognostisch meer voorspellend dan de aanwezigheid van slecht-prognostische kenmerken bij diagnose, zoals hoog-risico cytogenetische afwijkingen.
Data-analyse
Naast het gebruiken van de juiste procedures en antistofpanels en het meten van voldoende cellen, is de analyse van de verkregen data cruciaal. Zoals eerder is aangegeven worden de plasmacellen vaak gedefinieerd op basis van CD38 en CD138 expressie, waarna aberrante marker-expressies in combinatie met klonaliteit worden beoordeeld. Voor de interpretatie van de data zijn kennis en ervaring van het immunofenotype van normale plasmacellen en het immunofenotype van andere leukocyten die in het BM aanwezig kunnen zijn, essentieel. Recent zijn er ook tools ontwikkeld om de analyse (deels) software-ondersteund uit te voeren. Door middel van clustering-algoritmen en multidimensionale analyses worden normale en afwijkende cellen hierbij automatisch geïdentificeerd en benoemd.29 43 Deze methode maakt de analyse robuuster, completer, sneller, objectiever en dus ook reproduceerbaarder. Het ligt in de verwachting dat dergelijke tools in de nabije toekomst een belangrijkere plaats gaan innemen in de analyse en interpretatie van flowcytometrische data.
Uiteraard is een goede MRD-meting afhankelijk van goed materiaal, en daarom is een goed BM met zo min mogelijk bloedbijmenging een vereiste. Voor een MRD-meting is veelal 2-3 ml BM voldoende, het optrekken van meer BM wordt vanwege bovengenoemde reden afgeraden. De kwaliteit van het BM kan met behulp van morfologie worden beoordeeld. Momenteel zijn er nog geen goede, op flowcytometrische analyses gebaseerde, kwaliteitscriteria. Echter, hieraan wordt gewerkt en deze zullen wellicht in de nabije toekomst een bijdrage gaan leveren.
MRD middels moleculaire methoden
Naast flowcytometrie kan MRD ook worden vastgesteld met moleculaire methoden. MM ontstaat door klonale uitgroei van één aberrante plasmacel, die veelal zowel Ig-genherschikkingen, een klassenswitch en somatische hypermutaties heeft ondergaan. Deze processen resulteren in een patiënt-specifieke Ig-sequentie, die beschouwd kan worden als de DNA-vingerafdruk van de MM-cellen. Bij diagnose kan de Ig-sequentie worden bepaald middels PCR’s met consensus primers gericht tegen de V- en J-genen van de zware (IGH) of lichte (IGK) keten-loci, gevolgd door Sanger sequencing. Complementair aan dit gebied wordt vervolgens een patiënt-specifieke primer/probeset ontworpen. Deze primers worden in een kwantitatieve PCR (qPCR) gebruikt om residuele MM-cellen in follow-up materiaal te detecteren en te kwantificeren.44 Bij de recente high-throughput VDJ-sequencing wordt er net zoals bij PCR en Sanger sequencing gebruik gemaakt van consensus primers die gericht zijn tegen de V- en J-genen van de Ig-loci. Echter, in tegenstelling tot Sanger sequencing, waarbij slechts één sequentie per PCR-reactie kan worden verkregen, wordt bij NGS van elk DNA-fragment dat gevormd is in de PCR-reactie de afzonderlijke sequentie bepaald. Na identificatie van de MM-specifieke Ig-sequentie in het diagnosemateriaal, kan PCR en NGS van het follow-up materiaal worden uitgevoerd, zodat kan worden vastgesteld of MM-cellen met dezelfde sequentie nog detecteerbaar zijn. Een monster wordt ‘sequencing MRD-negatief’ genoemd als er middels het LymphoSIGHTTM-protocol (Adaptive Biotechnologies) of een gevalideerde equivalente techniek minder dan twee immunoglobulinesequenties worden gedetecteerd die identiek zijn aan die van de MM-cellen bij diagnose, met een minimale sensitiviteit van 1×10-5.12 Moleculaire MRD-analyse wordt, conform flowcytometrische MRD, momenteel alleen nog in studieverband uitgevoerd.
De 2 meest onderzochte technieken voor het bepalen van MRD zijn de reeds genoemde NGF, en next-generation VDJ-sequencing; beide technieken kennen hun eigen voor- en nadelen.
Daarnaast is MRD ook middels beeldvormende technieken (PET-CT) te bepalen (module volgt). Ook dit wordt in studieverband verder geëxploreerd.
De IMWG heeft MRD in 2016 opgenomen in de IMWG herziene responscriteria, waarbij het MRD als volgt is gedefinieerd: “Minimal residual disease (MRD) negative – Absence aberrant clonal plasma cells by next-generation flow cytometry or next-generation sequencing on bone marrow aspirates with a minimum sensitivity of 1 in 105 nucleated cells or higher”; zie Module Responsbepaling, Tabel 2.12 45
De impact van MRD op PFS en OS is onderzocht in verschillende studies en ook geanalyseerd in een grote meta-analyse met hierin gepoolde data van 21 klinische studies.46 Het behalen van MRD-negativiteit is geassocieerd met verbeterde PFS (mediaan 54 versus 26 maanden, HR 0.41) en verbeterde OS (mediaan 98 versus 82 maanden, HR 0.57).
MRD lijkt dus een goede prognostische marker. Het is echter vooralsnog geen predictieve marker richtinggevend voor het nemen van therapeutische beslissingen. Er zijn nog geen gerandomiseerde studies gepubliceerd die MRD-status als een leidinggevende marker voor therapeutische beslissingen hebben geïntegreerd, zoals het continueren, of juist wijzigingen of staken van therapie op basis van MRD-positiviteit of -negativiteit.
Voordat MRD in de dagelijkse praktijk kan worden geïmplementeerd, moet er nog een aantal stappen worden gezet. Dit betreft enerzijds technische aspecten, de optimale gevoeligheid, en het tijdstip voor het vaststellen van MRD. Daarnaast zal moeten blijken of het behalen of het behouden van MRD (sustained MRD) meer voorspellend is, en op welke manier MRD moet worden ingezet (als prognostische marker, als predictieve marker voor het aanpassen van therapie, of als indicator van een subgroep van patiënten die zeer langdurige remissies bereiken op therapie). Dit soort informatie zal naar verwachting uit recente (HOVON95) en lopende MM-studies (o.a. HOVON131, EMN17) beschikbaar komen.
Aantonen en kwantificeren van antigenen op MM-cellen, ten behoeve van antistoftherapieën of CAR T therapieën
Tenslotte kan flowcytometrie bij primaire diagnose maar ook tijdens en na therapie bijdragen aan het vaststellen welke antigenen op de MM-cellen tot expressie komen, zodat “targeted”-therapieën, zoals antistoftherapieën (CD38, CS1, BCMA, GPRC5d, PD-(L)1, etc.), bispecifieke antistoftherapieën (gericht tegen het antigen BCMA en CD3 of GPRC5D en CD3), en CAR T therapieën mogelijk gerichter kunnen worden ingezet.36 Op dit moment zijn er nog geen criteria waar de expressie van de target-antigenen aan moet voldoen om in aanmerking te komen voor de “targeted”-therapie.
Aanbeveling
|
|
SORT grade |
|
|
1 |
Bij diagnose wordt geadviseerd een cytogenetisch panel in te zetten met de volgende bepalingen del(17p), t(4;14) en t(14;16), gain 1q21, deletie in 1p32, monosomie 13 of deletie van 13q14, en hyperdiploïdie. |
A |
Inleiding
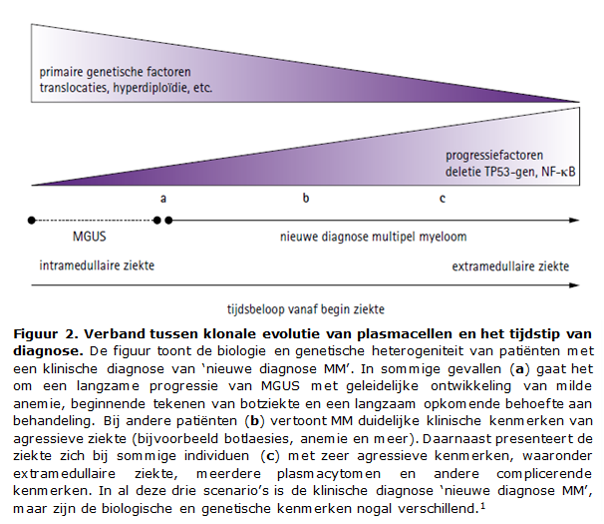
MM is een heterogene plasmacelziekte. De klinische heterogeniteit wordt voornamelijk bepaald door genetische veranderingen in de plasmacellen. Deze genetische veranderingen betreffen zowel chromosomale afwijkingen (deleties, gains en translocaties) alsook genmutaties. De genetische veranderingen kunnen worden verdeeld in primaire, ziekte-initiërende genetische veranderingen, en secundaire genetische veranderingen, die meestal gerelateerd zijn aan verdere progressie van de ziekte (Figuur 2).1 De primaire genetische veranderingen kunnen worden verdeeld in hyperdiploïdie, met 48 tot 75 chromosomen als gevolg van verschillende trisomieën van met name de oneven chromosomen, en nonhyperdiploïdie, vaak gekenmerkt door een translocatie met betrokkenheid van het immuunglobuline IGH-gen in chromosoomband 14q32.47
Bij de overgang van MGUS naar SMM en dan MM, is vaak een toename van genetische instabiliteit, die gepaard gaat met een toename van additionele genetische afwijkingen. De meest agressieve vormen van MM worden relatief frequenter gekenmerkt door MYC- en/of RAS-disregulatie, door secundaire immuunglobuline-translocaties of door verlies/mutaties in het TP53-gen op chromosoom 17p13.
Cytogenetische onderzoekstechnieken
In de 2011 richtlijn is geadviseerd om voor de detectie van cytogenetische afwijkingen bij MM interfase fluorescentie in situ hybridisatie (FISH) op verrijkte CD138-positieve plasmacellen te gebruiken. Sinds enige tijd kunnen veranderingen in kopie-aantallen opgespoord en geïdentificeerd worden via zogeheten ‘SNP-based genomic microarray’, ook wel SNP-array genoemd. Omdat met het genomische SNP-array onderzoek het hele genoom wordt onderzocht met één test, worden alle prognostisch relevante chromosoomdeleties en -gains geïdentificeerd.48 49
Zowel de IMWG als de European Myeloma Network (EMN) hebben het prognostisch belang van een t(4;14)(p16;q23), t(14;16)(q32;q23) en deletie 17p13 vastgesteld.50 51 Tevens werd in de HOVON95/EMN02 aangetoond dat een tandem hoge dosis melfalan (HDM) gevolgd door autologe stamceltransplantatie (ASCT) de slechte prognose van patiënten met hoog-risico cytogenetica, d.w.z. hebbende een t(4;14), t(14;16) en/of een del17p, teniet kan doen.50 De IMWG adviseert daarnaast om onderzoek naar gain 1q, deletie 1p, deletie 13q, en de ploidie-status uit te voeren om een beeld van de cytogenetische samenstelling van de afwijkende plasmacellen te krijgen.
Toekomstige en nieuwe technieken in de (cyto)genetica
De MMprofiler met SKY92 berekent de expressie levels van 92 genen in myeloom plasmacellen. Op grond van deze expressie kan de prognose worden bepaald, en kunnen patiënten verdeeld worden in hoog-risico of standaard-risico. Daarnaast kan met behulp van de MMprofiler aanwijzingen worden verkregen voor de aanwezigheid van onder andere t(4;14), t(14;16), t(14;20), en t(11;14).52 53
De laatste jaren wordt steeds duidelijker dat niet alleen de klassieke cytogenetische afwijkingen, maar ook mutaties in oncogenen en tumorsuppressorgenen, zoals bijvoorbeeld NRAS, KRAS, TP53, FAM46C, DIS3 en BRAF, een rol spelen bij het ontstaan van myeloom.54-56 Het is echter nog niet duidelijk hoe genexpressie-analyse middels de MMprofiler en de analyse van mutaties in oncogenen en tumorsuppressorgenen geïntegreerd zal gaan worden in de standaard-diagnostiek ten behoeve van prognose en individuele behandeling van MM-patiënten. Vandaar dat op dit moment deze bepalingen niet standaard worden geadviseerd danwel in de diagnostische laboratoria worden uitgevoerd.
Dankzij de introductie van nieuwe technieken voor de detectie van chromosoomafwijkingen is de verwachting dat technieken zoals whole-genome sequencing en high-resolution optical mapping, ook wel de Next Generation Cytogenetics genoemd, met één enkele test alle aanwezige chromosoomafwijkingen, deleties, gains én translocaties, kunnen worden opgespoord.57 Mogelijk kan binnen afzienbare termijn met één van deze technieken zowel de FISH als array testen worden vervangen.
Aanbevelingen voor de cytogenetische diagnostiek
Omdat het percentage plasmacellen in het BM-aspiraat bij een deel van de patiënten redelijk laag is, dient de cytogenetische analyse op CD138-verrijkte plasmacellen worden uitgevoerd.
De HOVON MM werkgroep en de Werkgroep Hemato-oncologische Genoom Diagnostiek (WHGD) zijn overeengekomen om bij nieuw gediagnosticeerde MM-patiënten naast onderzoek naar de essentiële afwijkingen del(17p), t(4;14) en t(14;16) ook diagnostiek te verrichten naar gain 1q21, deletie in 1p32, monosomie 13 of deletie van 13q14, en hyperdiploïdie (zie Tabel 2 voor aanbevolen cytogenetische diagnostiek en onderbouwing).
Voor de detectie van translocaties bestaat nog geen test voor whole-genome analyse. Gebalanceerde chromosoomafwijkingen, zoals IGH-translocaties, kunnen niet met SNP-array worden opgespoord; hiervoor blijft FISH op geïsoleerde plasmacellen vooralsnog de aangewezen test. De t(4;14) en t(14;16) dienen minimaal getest te worden. Tevens kan er op verzoek aanvullend FISH onderzoek worden verricht naar een translocatie t(11;14), wanneer dit kan helpen bij het bepalen van het beleid van behandeling van de patiënt en bepaling t(11:14) wordt zeker geadviseerd bij verdenking AL amyloïdose.
Voor het opsporen van ongebalanceerde chromosoomafwijkingen mag volgens de HOVON MM en de WHGD werkgroepen zowel FISH als SNP-array worden uitgevoerd.
Progressie van de ziekte kan gepaard gaan met additionele cytogenetische afwijkingen, echter is onbekend hoe vaak additionele afwijkingen worden gezien. Daarom kan het zinvol zijn om bij recidief MM cytogenetisch onderzoek uit te laten voeren. Echter over de prognostische betekenis van cytogenetische afwijkingen bij recidief MM is niet veel bekend. De aanwezigheid van nieuwe en/of additionele cytogenetische chromosoomafwijkingen, met name een del(17p) of gain 1q21, heeft minimaal dezelfde slechte prognostische betekenis als bij diagnose.
De HOVON MM werkgroep en de WHGD adviseren ook buiten studieverband genetisch onderzoek te verrichten, omdat de keuze van initiële therapie, maar ook van de therapie bij een relapse van de ziekte en onderhoudstherapie, bepaald kan worden aan de hand van het genetisch profiel.
Onderbouwing
Deletie 17p13
Voor de detectie van een del(17p) kan o.a. FISH en genoomwijde SNP-array gebruikt worden. Met beide technieken kan een kloon ter grootte van 10% betrouwbaar aangetoond worden, en daarom zal deze afwijking alleen gerapporteerd worden indien deze in tenminste 10% van de cellen aanwezig is.
Een del(17p) wordt geassocieerd met verlies van het tumorsuppressorgen TP53 en wordt beschouwd als een cytogenetische hoog-risicofactor door zowel de IMWG als de EMN.45 46 In de literatuur is er echter onduidelijkheid over de te hanteren drempelwaarde voor de del(17p) kloon-grootte in het kader van prognostische betekenis. Er zijn studies welke een ongunstige prognose laten zien bij een drempelwaarde van 10%58 andere studies hanteren een drempelwaarde van 20%50, en weer andere een drempelwaarde van 50% of 55%.50 59-63
In de HOVON95/EMN02 studie werd aangetoond dat met een tandem HDM/ASCT de slechte prognose van patiënten met een del(17p) met een drempelwaarde van 20%, t(4;14) en/of een t(14;16) grotendeels werd opgeheven.64 Een 20% of hoger del(17p) kloon kan een indicatie zijn voor dubbele autologe SCT bij NDMM (zie hiervoor Richtlijn behandeling Multipel Myeloom 2021). Om deze reden zal de kloon-grootte van de del(17p) expliciet in de uitslag van het cytogenetisch onderzoek worden vermeld.
Een mogelijke verklaring voor de onduidelijkheid omtrent de drempelwaarde voor de del(17p) kloon-grootte is het al dan niet aanwezig zijn van een bijkomende TP53 mutatie (‘double hit disease’), hetgeen in een studie van Walker werd geobserveerd.65 In ongeveer een derde van de patiënten met een del(17p) wordt een TP53 mutatie aangetroffen naast een del (17p).66 Recent toonde Corre et al aan, dat indien de grootte van de kloon >55% is het negatieve effect op de prognose onafhankelijk is van het al dan niet aanwezig zijn van een TP53 mutatie.63 67 Omdat op dit moment er geen specifiek behandelbeleid bestaat voor patiënten met een del(17p) en TP53 mutatie is bepaling van de TP53 mutatiestatus niet nodig. In toekomstige klinische studies zal de waarde van geïsoleerde TP53 mutaties alsmede de impact van de grootte van de kloon van del(17p) worden bepaald.
Onderbouwing translocatie t(4;14)(p16;q32)
Bij de translocatie t(4;14)(p16;q32) wordt de expressie van MMSET (MM SET domain) gedereguleerd. Daarnaast ontstaat in een deel van de patiënten met een t(4;14) overexpressie van het FGFR3 (fibroblast groeifactor receptor 3)-gen, wat leidt tot een verhoogde celproliferatie en celoverleving. Deze IGH-FGFR3 rearrangement wordt over het algemeen geassocieerd met een hoog-risico afwijking met snelle relapse en korte OS.50 51 62 68 69 Meerdere studies hebben laten zien dat de slechte prognose van patiënten met een t(4;14) deels teniet kan worden gedaan door bortezomib-bevattende therapie, maar zeer recent ook met dara-RD combinatie en langere follow up aangetoond.70-73 Zoals eerder genoemd werd in de HOVON95/EMN02 aangetoond dat een tandem HDM gevolgd door ASCT de slechte prognose van patiënten met hoog-risico cytogenetica, d.w.z. hebbende een t(4;14) en/of een del17p, teniet kan doen.50
Onderbouwing translocatie t(14;16)(q32;q23)
De t(14;16)(q32;q23) leidt tot overexpressie van de transcriptiefactor MAF. De t(14;16) wordt vaak geassocieerd met een ongunstige prognose, en gaat vaak gepaard met andere cytogenetische afwijkingen, zoals gain 1q, en nierfalen.50 51
Onderbouwing translocatie t(11;14)(q13;q32)
Een t(11;14)(q13;q32) zorgt voor overexpressie van het cycline D1 gen, dat een belangrijke rol speelt in celcyclusregulatie. Deze translocatie heeft een neutrale prognose.74 Recente literatuur heeft namelijk laten zien, dat patiënten met een primaire MM en een t(11;14) een goede respons geven bij behandeling met de proteasoom-inhibitor bortezomib in combinatie met venetoclax therapie.74 In geval een dergelijke therapie overwogen wordt, kan het bepalen van de t(11;14) van belang zijn.
Onderbouwing translocatie t(14;20)(q32;q11)
De t(14;20)(q32;q11) wordt geassocieerd met een ongunstige prognose.50 Vanwege de lage incidentie wordt de translocatie t(14;20)(q32;q11) niet standaard onderzocht.
Onderbouwing hyperdiploïdie
Hyperdiploïdie (meer dan 48 chromosomen) is geassocieerd met een gunstige prognose.75 Hierbij dient opgemerkt te worden dat de aanwezigheid van goede prognostische markers, zoals hyperdiploïdie, niet de slechte prognostische markers t(4;14), deletie 17p13 en/of gain 1q21 kan opheffen. De analyse is met name van belang om de gegevens uit verschillende HOVON-studies met elkaar te vergelijken en met studies in de internationale literatuur.
Onderbouwing hypodiploidie
Over het algemeen worden MM-patiënten met een hypodiploïd karyotype geassocieerd met een slechte prognose.76
Onderbouwing monosomie 13 of deletie 13q14
De relatief vaak voorkomende (bij ongeveer 50% van de patiënten met MM) monosomie 13 of deletie 13q14, wordt meestal samen met andere chromosoomafwijkingen waargenomen. Een geïsoleerde chromosoom 13 afwijking wordt tegenwoordig niet meer beschouwd als een hoog-risicofactor.50 De analyse is met name van belang om de gegevens uit verschillende HOVON-studies met elkaar te vergelijken en met studies in de internationale literatuur.
Onderbouwing +1q
Duplicatie 1q wordt over het algemeen geassocieerd met een kortere PFS en OS.50 51 60 77 Bij diagnose wordt +1q bij dmv FISH bij ongeveer 40% van de patiënten vastgesteld en is daarmee een de meeste voorkomende cytogenetische afwijkingen.78 Over het algemeen wordt met de schrijfwijze gain(1q)+ bedoeld plasmacellen met 1 extra kopie, dus 3 totaal, en amp(1q)+ plasmacellen met amplificatie gedefinieerd als 2 of meer extra kopieën, dus totaal 4 of meer.79 Bij MM-patiënten lijkt de prognostische impact dosis-afhankelijk te zijn van genen uit de 1q21 regio, zoals het CKS1B-gen.50 Daarnaast wordt een +1q vaak waargenomen in combinatie met andere prognostisch ongunstige chromosoomafwijkingen, zoals t(4;14) en del(17p), waardoor de betekenis van + 1q als onafhankelijke risicofactor niet duidelijk is.50 60 Echter dit geldt met name voor de gain(1q)+ terwijl amp(1q)+ wel geassocieerd is met slechtere overleving.79
Onderbouwing deletie 1p32
Een deletie in 1p32, met betrokkenheid van de genen CDKN2C en FAF1, wordt over het algemeen geassocieerd met een kortere PFS en OS.50 51 60 80 81
Onderbouwing deletie in 1p12
Een deletie in 1p12, waarbij het FAM46C-gen is betrokken, wordt geassocieerd met een kortere OS en PFS dan patiënten zonder een deletie in 1p.49 81 De deletie 1p12 kan niet met FISH, maar wel met SNP-array worden waargenomen en zal dan ook gerapporteerd worden.
Onderbouwing deletie in 1p21-22
De prognostische betekenis deletie in 1p21-22, met betrokkenheid van de genen MTF2 en TMED5 is nog niet duidelijk.82 De deletie 1p21-22 kan niet met FISH, maar wel met SNP-array worden waargenomen en zal dan ook gerapporteerd worden.
Onderbouwing chromothripsis
Met SNP-array diagnostiek kunnen ook andere genetische afwijkingen worden waargenomen zoals chromothripsis: complexe chromosome-rearrangements binnen een chromosoom of chromosoom arm.83 De prognostische betekenis van deze chromosoomafwijking is tot op heden nog niet duidelijk, maar wordt bij andere tumoren over het algemeen geassocieerd met een ongunstige prognose en zullen derhalve wel vermeld worden in de uitslagbrief.
|
Tabel 1A. 8-kleuren EuroFlow PCD panel. |
||||||||
|
Tube |
PO |
PB |
FITC |
PE |
PerCP-Cy5.5 |
PC7 |
APC |
APCH7 |
|
1 |
CD138 |
CD45 |
CD38 |
CD56 |
ß2miicro |
CD19 |
CD117 |
CD81 |
|
2 |
CD138 |
CD45 |
CD38 |
CD56 |
CD27 |
CD19 |
CyIgK |
CyIgL |
|
Tabel 1B. 8-kleuren EuroFlow MM MRD-panel. |
||||||||
|
Tube |
BV421 |
BV510 |
FITC |
PE |
PerCP-Cy5.5 |
PC7 |
APC |
APCH7 |
|
1 |
CD138 |
CD27 |
CD38 (ME)* |
CD56 |
CD45 |
CD19 |
CD117 |
CD81 |
|
2 |
CD138 |
CD27 |
CD38 (ME) |
CD56 |
CD45 |
CD19 |
CyIgK |
CyIgL |
|
*ME: multi-epitope |
||||||||
|
Tabel 2. Prognostische impact van genetische en cytogenetische afwijkingen bij patiënten met MM (en MGUS). |
|||||
|
Genetische afwijking |
Gen(en) |
Incidentie |
Klinische impact |
SORT |
Referentie |
|
Deletie 17p13a,b |
TP53 |
5-15% |
Hoog-risico cytogenetische marker. Deze afwijking valt in de hoog-risicoclassificatie (zie www.hovon.nl). |
A |
50 60-62 |
|
t(4;14)(p16;q32) |
FGFR3/ MMSET |
12-15% |
Hoog-risico cytogenetische marker. Deze afwijking valt in de hoog-risicoclassificatie (zie www.hovon.nl). |
A |
50 68 69 |
|
t(14;16)(q32;q23) |
IGH; MAF |
4% |
Hoog-risico cytogenetische marker. Deze afwijking valt in de hoog-risicoclassificatie (zie www.hovon.nl). |
A |
50 84 |
|
Gain 1q |
CKS1B |
10-15% |
ongunstige prognose |
A |
50 60 77 |
|
Deletie 1p32 |
CDKN2C |
20-30% |
ongunstige prognose |
A |
50 60 80 81 |
|
Hyperdiploïdie |
nvt |
45-50% |
gunstige prognose |
A |
75 |
|
t(11;14)(q13;q32) |
CCND1; IGH |
15-20% |
neutrale prognosec |
A |
74 |
|
Deletie 1p21-22 |
MTF/ TMED5 |
? |
ongunstige prognose |
B |
82 |
|
Deletie 1p12 |
FAM46C |
? |
ongunstige prognose |
B |
49 |
|
t(14;20)(q32;q11) |
IGH; MAFB |
1% |
ongunstige prognose |
A |
50 |
|
Hypodiploidie |
Nvt |
? |
ongunstige prognose |
C |
76 |
|
Deletie 13q14 / monosomie 13 |
Nvt |
44% |
geen prognostische betekenis; komt vaak voor in associatie met andere cytogenetische afwijkingen. |
A |
50 |
|
Chromothripsisd |
Nvt |
? |
ongunstige prognose |
B |
83 |
|
a. Patiënten waarbij de deletie 17p in meer dan 50% van de CD138-verrijkte plasmacellen voorkomt hebben een slechtere prognose.59 b. Patiënten met een double hit (bi-allelische inactivatie van TP53) hebben een zeer ongunstige prognose.65 85 c. Mogelijk van belang bij keuze van therapie d. Chromothripsis betreffen complexe chromosome rearrangements binnen een chromosoom of chromosoom arm. M.b.v. o.a. SNP-array kunnen dit type afwijkingen worden aangetoond. |
|||||
|
AGE |
agarose gel elektroforese |
|
AL-amyloïdose |
amyloid light chain-amyloïdose |
|
ASCT |
autologe stamceltransplantatie |
|
BCMA |
B-cell maturation antigen |
|
BM |
beenmerg |
|
B-NHL |
B-cel non hodgkin lymfoom |
|
CAR |
chimere antigeen-receptor |
|
CE |
capillaire elektroforese |
|
CMI |
College van medisch immunologen |
|
CR |
complete respons |
|
CRAB |
hypercalciëmie, renale insufficiëntie, anemie, beenmerglaesies |
|
Cy |
cytoplasmatisch |
|
DFS |
disease free survival |
|
EDTA |
ethyleendiaminetetra-azijnzuur |
|
EMN |
European Myeloma Network |
|
ESP |
serum eiwitspectrum |
|
FDA |
Food and Drug Administration |
|
FISH |
fluorescentie in situ hybridisatie |
|
GPRC5d |
G protein-coupled receptor family C group 5 member d |
|
HDM |
hoge dosis melfalan |
|
HFpEF |
hartfalen met behouden ejectiefractie |
|
HOVON |
Hemato-oncologie voor Volwassen Nederland |
|
IFE |
immunofixatie elektroforese |
|
IgM |
immuunglobuline M |
|
IMiD |
immunomodulerende imide drugs |
|
IMWG |
Internationale Myeloom Werkgroep |
|
ISUB |
immunosubtractie |
|
LDH |
lactaat dehydrogenase |
|
MGCS |
monoclonal gammopathy of clinical significance |
|
MGUS |
monoclonal gammopathy of unknown significance |
|
MM |
multipel myeloom |
|
MMSET |
multiple myeloma SET domain |
|
MR |
minimale respons |
|
MRD |
minimale residuale ziekte |
|
MRI |
magnetic resonance imaging |
|
MSKCC |
Memorial Sloan Kettering Cancer Center |
|
NEQAS |
National External Quality Assessment Services |
|
NGF |
next-generation flow |
|
NGS |
next-generation sequencing |
|
NT-proBNP |
N-terminaal proBNP |
|
NVC |
Nederlandse Vereniging voor Cytometrie |
|
NVKC |
Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde |
|
OS |
algemene overleving |
|
PD |
progressieve ziekte |
|
PD-L1 |
programmed death-ligand 1 |
|
PFS |
progressievrije overleving |
|
PGNMID |
proliferative glomerulonephritis with monoclonal IgG deposits |
|
POEMS |
Polyradiculoneuropathie, organomegalie, endocrinopathie, klonale plasmacelaandoening, en huidafwijkingen |
|
PR |
partiele respons |
|
qPCR |
kwantitatieve polymerase chain reaction |
|
R-ISS |
revised international staging system |
|
SD |
stabiele ziekte |
|
SKML |
Stichting Kwaliteitsbewaking Medische Laboratoriumdiagnostiek |
|
SMM |
smoldering MM |
|
SNP |
enkelvoudig nucleotidepolymorfisme |
|
SORT |
Strenght-of-Recommendation Taxonomy |
|
SPD |
sum of the products of the maximal perpendicular diameters of measured lesions |
|
SUV |
maximum standardised uptake value |
|
t-mAb |
therapeutische monoklonale antilichamen |
|
VGPR |
zeer goede partiele respons |
|
VKGL |
Vereniging Klinisch Genetisch Laboratoriumspecialisten |
|
VLK |
vrije lichte keten |
|
WHGD |
Werkgroep Hemato-oncologische Genoom Diagnostiek |
|
WM |
Waldenström’s Macroglobulinemie |
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie