Het diffuus grootcellig B-cel lymfoom (DLBCL) is het meest voorkomende subtype non-Hodgkin lymfoom, met een incidentie van circa 1250 nieuwe patiënten per jaar in Nederland. De klinische presentatie wordt gekenmerkt door lymfadenopathie en met name bij de uitgebreidere stadia door malaise, gewichtsverlies en soms extranodale manifestaties als hepato-splenomegalie. De mediane leeftijd van presentatie van DLBCL is 65-70 jaar.
Doelgroep: internisten-hematologen, internisten-oncologen, radiotherapeuten, nucleair-geneeskundigen, radiologen, (hemato-)pathologen, verpleegkundigen, IKNL-consulenten etc.
Doelstelling: Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van diagnostiek, behandeling, respons evaluatie en follow-up van het DLBCL.
Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd volgend uit een knelpuntinventarisatie gehouden in het veld bij professionals. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek en behandeling van diffuus grootcellig B-cel lymfoom [bij volwassenen]. Hierbij is beschreven wat de diagnostiek en behandelingsmogelijkheden zijn met hun effectiviteit en invloed op kwaliteit van leven. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals en patiënten. De meest relevante knelpunten zijn uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met diffuus grootcellig B-cel lymfoom. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht daarmee een betere uniformiteit van behandeling en daarmee een betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn geeft aanbevelingen over, of kan worden gebruikt bij, het geven van voorlichting aan patiënten. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal. Op de website www.hematologienederland.nl wordt de patiëntinformatie aangepast aan de inhoud van deze richtlijn.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met diffuus grootcellig B-cel lymfoom, zoals internist-hematologen, internisten, radiologen, nucleair geneeskundigen, pathologen, klinisch chemici, huisartsen, oncologieverpleegkundigen en IKNL-consulenten.
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met diffuus grootcellig B-cel lymfoom. De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 3 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon.
Rinske Boersma, Amphia, Internist-Hematoloog
Rolf Brouwer, Reinier de Graaf Gasthuis, internist Hemato-oncoloog
Martine Chamuleau, Amsterdam UMC, Internist-Hematoloog
Djamila Issa, Jeroen Bosch Ziekenhuis, Internist-Hematoloog
Marcel Nijland, UMCG, Internist-Hematoloog
Marjolein van der Poel, Maastricht UMC, Internist-Hematoloog
Tjeerd Snijders, Medisch Spectrum Twente, Internist-Hematoloog
Anne Arens, Radboud UMC Nijmegen, Nucleair geneeskundige, namens NvNG
Daphne de Jong, Amsterdam UMC, Patholoog, namens NVvP
Jan Mol, Stichting Hematon, Bestuurslid Hematon
P.G.N.J. Mutsaers, Erasmus MC Rotterdam, Internist-hematoloog/klinisch-immunoloog
Michelle Mohlmann, OLVG Oost, Internist-Hematoloog
Lara Böhmer, Hagaziekenhuis, Internist-Hematoloog
Aart Beeker, Spaarne Gasthuis, Internist Hemato-oncoloog
Jacoline Bromberg, Erasmus MC Rotterdam, Neuro-Oncoloog
Rogier Mous, UMC Utrecht (Cancer Center), Internist-Hematoloog
Wendy Stevens, Radboud UMC Nijmegen, Internist-Hematoloog
Pieternella Lugtenburg, Erasmus MC Rotterdam, Internist-Hematoloog
Monique Minnema, UMC Utrecht (Cancer Center), Internist-Hematoloog
Liane te Boome, Haaglanden MC, Internist-Hematoloog
Bastiaan Ta, Maastro (Maastricht), Radiotherapeut-oncoloog, namens LPRH
Jeanette Doorduijn, Erasmus MC Rotterdam, Internist-Hematoloog
Richard van der Maazen, Radboud UMC Nijmegen, Radiotherapeut, namens LPRH
Clara Klerk, Westfriesgasthuis/Dijklander Ziekenhuis, Internist-Hematoloog
Marie José Kersten, Amsterdam UMC, Internist-Hematoloog, namens NVvH
Jet Quarles van Ufford, Haaglanden Medische Centrum, Radioloog, namens NVvR
Josée Zijlstra, Amsterdam UMC, Internist-Hematoloog, namens NVvH
Alle werkgroep leden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen. In onderstaande tabel wordt een overzicht gegeven van de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
Aart Beeker |
HOVON studies Industrie gesponseerde studies via HOVON |
|
Anne Arens |
Geen |
|
Bastiaan Ta |
Geen |
|
Clara Klerk |
Ten tijde van het schrijven van de huidige richtlijn neemt de afdeling Hematologie van het Dijklanderziekenhuis deel aan de HOVON 902, HOVON 152 en de HD21 |
|
Daphne de Jong |
Geen |
|
Djamila Issa |
Geen |
|
Jacoline Bromberg |
Geen |
|
Jan Mol |
Geen |
|
Jeanette Doorduijn |
Research grant Roche (HOVON 105) |
|
Jet Quarles van Ufford |
Geen |
|
Lara Böhmer |
Geen |
|
Liane te Boome |
Geen |
|
Marcel Nijland |
Research grant Roche (HOVON 151 studie) Research grant Takeda (Brentuximab imaging studie) Research grant BMS (HOVON CC99282) Research grant Abbvie (HOVON 168) |
|
Marie José Kersten |
Wetenschappelijk onderzoek (klinische studies en translationeel onderzoek) wordt gefinancierd door KWF, EU, Roche, Takeda, Kite/Gilead, Novartis, Miltenyi Biotech, Astra Zeneca, Beigene. |
|
Marjolein van der Poel |
Geen |
|
Martine Chamuleau |
Gesponserde HOVON studies H152 BMS H902 Gilead Researchgrant GenMab, Gilead,Celgene/BMS, AbbVie |
|
Michelle Mohlmann |
Geen |
|
Monique Minnema |
Geen |
|
P.G.N.J. Mutsaers |
Geen |
|
Pieternella Lugtenburg |
Extern gefinancierd onderzoek: principal investigator van diverse HOVON studies voor de behandeling van patiënten met een agressief non-Hodgkin lymfoon. Hiertoe is financiële ondersteuning verkregen van KWF en farmaceutische industrie (Roche, Takeda en Servier) |
|
Richard van der Maazen |
Geen |
|
Rinske Boersma |
Geen |
|
Rogier Mous |
Geen |
|
Rolf Brouwer |
Geen |
|
Tjeerd Snijders |
Geen |
|
Wendy Stevens |
Geen |
|
Josée Zijlstra |
Wetenschappelijk onderzoek (klinische studies en Imaging onderzoek) van JM Zijlstra wordt gefinancierd door KWF, Hanarth, Roche, Takeda en Gilead. |
Methode ontwikkeling
Evidence based.
Werkwijze richtlijnwerkgroep
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline, Cochrane [en, zo nodig, Embase]. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van op voorhand opgestelde selectiecriteria.
Procedure herziening
Uiterlijk 2 jaar na verschijnen van deze richtlijn wordt door het bestuur van de lymfoom werkgroep en van de NVvH beoordeeld of deze richtlijn nog actueel is. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen het nodig maken om eerder een herzieningstraject te starten.
Juridische betekenis
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk en/ of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig wordt gemotiveerd afgeweken van de richtlijn.
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is/wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast is/wordt er een toelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de website van NVvH.
Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals en patiënten (vertegenwoordigers). De meest relevante knelpunten worden uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met diffuus grootcellig B-cel lymfoom. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. De richtlijn beoogt derhalve niet een volledig leerboek te zijn.
Diagnostiek
Behandeling
Aanbevelingen: (SORT A)
De initiële diagnostiek bij het DLBCL bestaat uit:
Onderbouwing
De lymfoomdiagnose wordt gesteld op basis van de criteria van de meest recente WHO-classificatie.1 De stadiëring gaat volgens de Ann Arbor en Lugano classificatie.2
Naast algemeen onderzoek gericht op de co-morbiditeit en conditie (WHO performance status, score met bijvoorbeeld lastmeter), dient er in de anamnese speciale aandacht besteed te worden aan symptomen die wijzen op orgaandysfunctie (m.n. cardiopulmonaal) en psychosociale omstandigheden.
Het lichamelijk onderzoek is gericht op het vaststellen van de grootte en lokalisatie van de lymfeklieren, aanwezigheid van hepato-splenomegalie en eventuele extranodale lokalisaties.
Aanvullend onderzoek is er verder op gericht om het stadium van de ziekte vast te stellen, respons op therapie te voorspellen, complicaties van de ziekte in kaart te brengen en eventuele actieve of chronische infecties (HIV, hepatitis B, C), die interfereren met de behandeling of kunnen verergeren door de behandeling met monoklonale antistoffen, te diagnosticeren.
Tabel 1 Samenvatting van de aanbevolen diagnostiek nadat de histologische diagnose is gesteld.
| Anamnese | Performance status, mentale fitheid, psychosociale omstandigheden |
| Lichamelijk onderzoek | Algemeen lichamelijk onderzoek met speciale aandacht voor hart en longen, lymfeklieren, lever- en miltgrootte |
| Laboratorium | Hematologie en chemie: volledig bloedbeeld inclusief leukocytendifferentiatie, BSE, kreatinine, leverenzymen, glucose, albumine, LDH Serologie: hepatitis B, C, HIV Bij vrouwen in de fertiele leeftijd zwangerschapstest Op indicatie: pro-BNP, troponine |
| Liquor diagnostiek | Op indicatie (zie specifieke uitgangsvraag) |
| Functieonderzoek |
ECG Op indicatie: echocardiogram (antracyclines) |
| Beeldvorming |
Bij diagnose: FDG-PET/CT-scan met een CT-scan met contrast van hals, thorax en abdomen |
Referenties:
Aanbeveling: (SORT A)
Volledige classificatie volgens de geldende WHO-classificatie op basis van histologisch onderzoek (excisie) van een betrokken nodale of extranodale lokalisatie is noodzakelijk voor het stellen van de diagnose DLBCL1.
Aanbeveling: (SORT A)
Histologische onderbouwing van recidief ziekte op basis van een excisie of biopt van een (meest) betrokken nodale of extranodale lokalisatie wordt aanbevolen1.
Onderbouwing:
De primaire diagnose van alle subtypes maligne lymfoom, waaronder ook DLBCL, moet gesteld worden o.b.v. histologisch onderzoek, bij voorkeur een volledige lymfeklier of een ruim excisie- of incisiebiopt van een lymfeklier of extranodale tumorlokalisatie. Bij uitzondering (bijvoorbeeld acute medische situaties, zeer hoge leeftijd, zeer slecht bereikbare tumorlokalisaties) kan een dikke naald biopt (14G) volstaan. Cytologisch onderzoek is onvoldoende voor het stellen van een primaire diagnose2.
De diagnose DLBCL wordt gesteld op basis van de criteria van de geldende WHO-classificatie. Daarvoor is adequate morfologische en immunohistochemische beoordeling noodzakelijk.
Voor de differentiatie met “agressief B-cel lymfoom met MYC en BCL2 en/of BCL6 translocatie” (DH/TH), een variant van agressief B-cel lymfoom, is het verrichten van FISH-onderzoek geïndiceerd. Voor volledige classificatie is MYC-FISH een inherent onderdeel van de primaire diagnostiek van agressief B-cel lymfoom, BCL2 en BCL6 FISH alleen bij positieve MYC-FISH. Hoewel de fusie partner van MYC (Ig-MYC versus non Ig-MYC) een belangrijke prognostische waarde lijkt te hebben, heeft dit nog geen invloed op de keuze van therapie3.
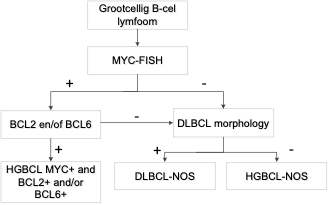
‘Cell-of-origin’ (COO) classificatie o.b.v. immunohistochemisch onderzoek is niet vereist als hieraan geen klinische consequenties verbonden worden. Als COO-markers verricht zijn, wordt dit in de microscopie vermeld, maar het wordt afgeraden COO-klasse in de conclusie te vermelden. Gen-expressie-gebaseerde COO-classificatie is maar beperkt mogelijk in Nederland en heeft daarmee geen plaats in de standaard diagnostiek.
Mutatie-onderzoek heeft (nog) geen consequenties voor behandelingsbeslissingen en wordt alleen op research-basis uitgevoerd.
Regionale expert-consultatie (bijvoorbeeld regionaal lymfoompanel) wordt geadviseerd voor het bevestigen van de primaire diagnose DLBCL.
Referentie:
Aanbeveling:
FDG-PET/ CT-scan aangevuld met een diagnostische CT-scan van de hals, thorax en abdomen met contrast dient onderdeel te zijn van de stadiering bij patiënten met een nieuw ontdekt DLBCL.1,2,3 (SORT A)
Referenties:
Aanbeveling (tijdens behandeling):
In plaats van een interim CT-scan met contrast wordt aanbevolen een interim PET-low dose CT-scan te maken na 2 kuren R-CHOP om vroege response te evalueren, indien dit de keuze van therapie beïnvloedt. (SORT B).
Bij een negatieve Interim-PET/CT scan kan dit leiden tot de-escalatie van therapie.
De negatief voorspellende waarde van een interim-PET/CT is hoog (> 80%).4,5
Bij positieve interim-PET wordt geadviseerd patiënt in een MDO te bespreken.
Een positieve PET met afname van FDG-aviditeit wordt geduid als een Partiele Metabole Remissie. In dat geval wordt geadviseerd de behandeling met R-CHOP voort te zetten.
Er is geen onderbouwing om therapie te escaleren op basis van een positieve interim FDG-PET-uitslagen6,7, bij responderende ziekte (SORT A).
Een positieve PET zónder afname van FDG-aviditeit dan wel toename van intensiteit of aantal laesies wordt geduid als metabool stabiele ziekte of metabool progressieve ziekte.
In dat geval wordt geadviseerd na 2 kuren R-CHOP behandeling te staken en over te gaan op tweedelijns behandeling.
Bij patiënten met een stadium I-II DLBCL non bulky (<10 cm) en een negatieve interim PET-scan (Deauville score 1-3) kan gekozen worden voor totaal 4 kuren R-CHOP kuur in plaats van 3 kuren met additionele radiotherapie.6
Bij patiënten met een stadium II-IV ziekte en een negatieve interim PET-scan kan worden volstaan met totaal 6 R-CHOP kuren zonder 2 extra giften rituximab.7
Onderbouwing:
Uit een gerandomiseerde Fase-III studie7 en een meta-analyse van 8 internationale Fase-II en Fase-III studies met een interim-PET,4 waaronder de HOVON84 studie, bij in totaal 1692 de novo DLBCL patiënten bleek de NPV zowel bij i-PET2 als i-PET4 > 80% en de PPV variërend van 30-70% afhankelijk van tijdstip en response criteria. Het optimale moment voor een interim-PET blijkt derhalve na 2 kuren R-CHOP.
De stralingsbelasting van een PET met low-dose CT is lager dan de stralingsbelasting van een diagnostische CT-scan van hals, thorax en abdomen (7 mSv vs 13.2 mSv).8
Het achterwege laten van 2 giften Rituximab inclusief kosten dagbehandeling levert een forse besparing op die opweegt tegen de extra kosten van een PET-low dose CT-scan.9
| Beeldvorming |
Bij diagnose:
Bij interim evaluatie
Einde behandeling:
|
Referenties:
4. Eertink JJ et al, Optimal timing and criteria of interim PET in DLBCL: a comparative study of 1692 patients, Blood Adv 2021;5(9):2375-2384.
5. Burggraaff CN et al Predictive value of interim positron emission tomography in diffuse large B-cell lymphoma: a systematic review and meta-analysis. Eur J Nucl Med Mol Imaging 2019 Jan;46(1):65-79.
6. Persky DO, Positron Emission Tomography-Directed Therapy for Patients With Limited-Stage Diffuse Large B-Cell Lymphoma: Results of Intergroup National Clinical Trials Network Study S1001 J Clin Oncol 2020;38(26):3003-3011.
7. Dührsen U et al; Positron Emission Tomography-Guided Therapy of Aggressive Non-Hodgkin Lymphomas (PETAL): A Multicenter, Randomized Phase III Trial. J Clin Oncol. 2018 Jul 10;36(20):2024-2034
8. Smith-Bindman et al. International variation in radiation dose for computed tomography examinations: prospective cohort study. BMJ 2019;364:K4931
9. Zorginstituut Nederland. Kostenhandleiding: Methodologie van kostenonderzoek en referentieprijzen voor economische evaluaties in de gezondheidszorg.
Aanbeveling (na behandeling):
Het maken van een FDG-PET/CT na systemische behandeling van een DLBCL-patiënt wordt beschouwd als standaard zorg. (SORT A). Meestal volstaat een PET-low dose CT. Indien metingen van klieren van belang zijn dient ook een diagnostische CT-scan gemaakt te worden.
Het interval tussen de laatste chemotherapiekuur en de beoordeling van respons na behandeling dient bij voorkeur minimaal 4-6 weken te zijn.
Het interval tussen radiotherapie en beoordeling van respons na behandeling dient bij voorkeur tenminste 3 maanden te zijn. Dit om fout-positieve FDG-PET/CT-scan als gevolg van radiatie/inflammatie te voorkomen.
Consequentie negatieve PET-scan
De voorspellende waarde van een negatieve PET/CT na afloop van R-CHOP behandeling is groot1 ,2 De 2-jaars Progressievrije overleving is 76-97%.3
Ook bij patiënten met bij presentatie bulky disease en een negatieve PET-scan na R-CHOP kan radiotherapie veilig achterwege gelaten worden.4
Consequentie positieve PET-scan
De positief voorspellende waarde van een PET/CT na R-CHOP behandeling is suboptimaal.
Bij persisterende FDG PET aviditeit zijn er verschillende opties. Advies om dergelijke patiënten in een MDO te bespreken. Indien mogelijk PA bevestiging van persisterend DLBCL.
Referenties:
Aanbeveling:
Er is geen plek voor routinematig gebruik van CT of FDG-PET/CT in de follow-up van patiënten met een behandeld DLBCL (SORT B). Er zijn aanwijzingen dat de incidentie van maligniteiten toeneemt na herhaaldelijk gebruik van CT-scans. Controle in de follow-up periode dient te bestaan uit anamnese en lichamelijk onderzoek, eventueel aangevuld met beperkt laboratorium onderzoek (LDH).1-7
Referenties:
Aanbevelingen: (SORT A)
Stadiumindeling volgens de Lugano classificatie (tabel 1).
Tabel 1. Lugano criteria
|
Stadium |
Betrokkenheid |
Extranodale (E) status |
|
Limited |
||
|
I |
1 lymfeklier groep |
1 extranodale laesie zonder lymfeklier betrokkenheid |
|
II |
≥2 lymfeklier groepen aan dezelfde kant van het diafragma |
Stadium I of II door lymfeklier uitbreiding met beperkte dichtbij gelegen extranodale betrokkenheid |
|
Advanced |
||
|
III |
Lymfeklieren aan beide kanten van het diafragma; Lymfeklieren boven het diafragma met milt betrokkenheid |
Niet van toepassing |
|
IV |
Bijkomende niet aansluitende extranodale betrokkenheid |
Niet van toepassing |
Onderbouwing:
In 2014 zijn nieuwe stadiëring en respons criteria (Lugano criteria) vastgesteld voor maligne lymfomen. In de Lugano criteria wordt sterk aanbevolen voor aanvang van therapie een FDG-PET scan te maken. 1
Referenties:
Voor prognostische doeleinden dient de IPI (International Prognostic Index) en aaIPI (age-adjusted International Prognostic Index) berekend te worden (tabel 2).
Ter bepaling van het risico op een CNS recidief wordt de CNS-IPI berekend (tabel 2). 12% van de patiënten heeft een hoog CNS-IPI risico. Bij deze patiënten dient CNS profylaxe overwogen te worden5. (zie uitgangsvraag pag 45)
Tabel 2. Prognose.
|
Prognostisch ongunstige factoren IPI: |
Leeftijd > 60 jaar LDH > 1 x normaal Performance status ≥ 2 Stadium III of IV > 1 extranodale lokalisatie Nier en/of bijnier betrokkenheid (alleen CNS-IPI) |
|
IPI: |
|
|
Laag risico |
0 of 1 risicofactor |
|
Laag intermediair risico |
2 risicofactoren |
|
Hoog intermediair risico |
3 risicofactoren |
|
Hoog risico |
4 of 5 risicofactoren |
|
“Age adjusted” IPI (aaIPI) NB geen punten voor extranodale lokalisaties; leeftijd vervalt |
|
|
Laag risico |
Geen risicofactor |
|
Laag intermediair risico |
1 risicofactor |
|
Hoog intermediair risico |
2 risicofactoren |
|
Hoog risico |
3 risicofactoren |
|
CNS IPI: |
|
|
Laag |
0-1 risico factor |
|
Intermediair risico |
2-3 risico factoren |
|
Hoog risico |
4-6 risico factoren |
Onderbouwing:
De IPI score is ook in het rituximab tijdperk nog onderscheidend voor kans op remissie en overleving.1-4
Referenties:
Aanbevelingen:
Onderbouwing:
Bij DLBCL is het van therapeutisch en prognostisch belang om te weten of er sprake is van beenmergbetrokkenheid. De gouden standaard was tot recent nog het beenmergbiopt. Recente studies, publicaties en guidelines suggereren echter dat in alle of in ieder geval de meeste gevallen, het beenmergbiopt achterwege gelaten kan worden indien er een FDG-PET/CT gemaakt is.1-7
Referenties:
Nieuwe aanbeveling:
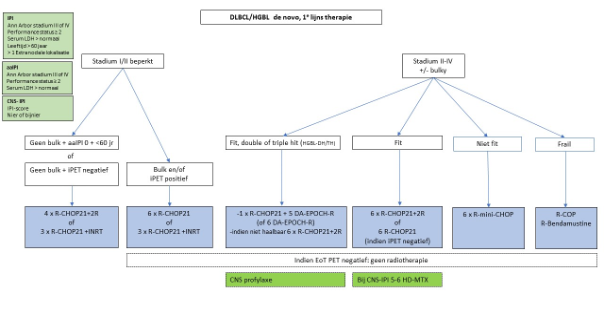
Onderbouwing:
Stadium I/II beperkt , zonder bulk, < 60 jaar en aaIPI 0
4x R-CHOP21 + 2R
of
3x R-CHOP21 + involved node radiotherapie
De fase III FLYER studie heeft laten zien dat bij patiënten met aaIPI 0, <60 jaar (zonder bulk) 4x R-CHOP21 + 2R even effectief en minder toxisch is dan 6x R-CHOP21.1 Op grond hiervan heeft dit schema met beperkte chemotherapie en zonder radiotherapie nu de voorkeur.
Eventueel kan ook gekozen worden voor 3x R-CHOP + involved node radiotherapie3
Stadium I/II beperkt, zonder bulk, alle leeftijden, PET-gestuurd
4x R-CHOP21 (indien iPET negatief)
of
3x R-CHOP21 + involved node radiotherapie
De keuze van therapie is afhankelijk van de verwachte toxiciteit van de radiotherapie (lokalisatie, grootte bestralingsveld) versus de verwachte toxiciteit van antracyclines.
Indien de voorkeur uitgaat naar omissie van radiotherapie, kan er worden volstaan met 4x R-CHOP21 kuren mits de interim PET-scan na 2 kuren negatief is2. In geval van een positieve interim PET-scan wordt behandeling met 6 kuren R-CHOP21 geadviseerd.
Twee retrospectieve studies laten zien dat de combinatie van R-CHOP met Involved Node RT qua effectiviteit en toxiciteit vergelijkbaar is met Involved Field RT6,7, waardoor de voorkeur uitgaat naar involved node radiotherapie.
Stadium I/II beperkt, bulk
Bij patiënten met bulk wordt aangeraden te behandelen als een stadium 2-4 ziekte middels 6x R-CHOP21.
Het weglaten van 2R na 6x R-CHOP21 was veilig in de MInT trial5, met als kanttekening dat dit alleen bij patiënten <60 jaar was. De werkgroep is van mening dat bij beperkte ziekte de 2 extra giften rituximab ook bij patiënten boven de 60 jaar weggelaten kunnen worden.
Indien niet 6x R-CHOP21 niet haalbaar vanwege toxiciteit, overweeg dan 3x R-CHOP21 + INRT3.
Stadium II-IV
Geen double of triple hit lymfoom
6x R-CHOP21 (+ 2R)
Alternatief: 6x R-CHOP14 (+ 2R)
Overwegingen om voor 3-wekelijks schema te kiezen
In 2004, in het pre-rituximab tijdperk, publiceerde Pfreundschuh een significant betere overall survival voor patiënten >60 jaar met CHOP 1x per 14 dagen versus CHOP 1x per 21 dagen (5-year OS 53,3% en 40,6%, respectievelijk).10 Waarschijnlijk is er in het rituximab tijdperk geen toegevoegde waarde meer voor dose dense toediening.
Delarue bevestigde dit bij patiënten van 60-80 jaar; 8 cycli R-CHOP14 en 8 cycli R-CHOP21 lieten geen verschil zien in OS. Cycli a 21 dagen waren duidelijk minder toxisch (minder G-CSF ondersteuning, minder dosis reducties, minder transfusies).11 De werkgroep geeft de voorkeur aan 3-wekelijkse schema’s en ziet bij uitzondering plek voor een 2-wekelijks schema indien er een sterke wens voor een kortere behandelduur is (bijvoorbeeld bij jonge fitte patiënt die snel weer aan het werk wil).
Overwegingen om voor 6 cycli R-CHOP te kiezen
Voor patiënten >60 jaar liet de RICOVER-60 studie zien dat 6 cycli R-CHOP14 (+2R) een betere OS geven dan 8 cycli door daling in toxiciteit.9 Bij patiënten > 60 jaar waren er dus al langer aanwijzingen dat 3-wekelijkse schema’s en het geven van 6 kuren minder toxisch zijn. Cunningham demonstreerde in 2013 dat 6 x R-CHOP14 met 2R of 8 x R-CHOP21 geen verschil liet zien in effectiviteit bij patiënten > 18 jaar.12
Sindsdien werd voor jongere patiënten 8x R-CHOP21 of 6x R-CHOP14 (+2R) geadviseerd. 6x R-CHOP21 versus 8x R-CHOP21 is nooit gerandomiseerd uitgezocht. De MInT trial liet al een veelbelovende 3-jaars OS zien van 93% met 6x R-CHOP21, maar in deze studie werden alleen goed risico patiënten geïncludeerd met een aaIPI van 0 of 1.5
Echter, in steeds meer landen en in studies wordt 6x R-CHOP21 als standaardarm gegeven voor alle IPI groepen (standaard in ROBUST en ReMODL-B studie en keuze-arm in 2 Phoenix en GOYA studie).13-16
Er zijn steeds meer data beschikbaar die het geven van 6x R-CHOP21 kuren ondersteunen:
Onderbouwing behandeling 6 kuren R-CHOP zonder 2 extra kuren rituximab
Er zijn 2 studies waarin 6 R-CHOP zonder 2R uitstekende resultaten heeft laten zien: de MInT studie voor patiënten < 60 jr met aaIPI 0 met 6 kuren R-CHOP.5
Daarnaast lijkt er geen toegevoegde waarde van 2 extra kuren rituximab na 6x R-CHOP bij patiënten 18-80 jaar met alle IPI scores een negatieve PET interim scan na 2 kuren R-CHOP.19
Overwegingen met betrekking tot 6 kuren R-CHP plus polatuzumab vedotin naar aanleiding van de Polarix trial20
In een Fase-III dubbel blind, placebo gecontroleerde studie bij DLBCL patiënten met IPI 2-5 is R-CHOP21 vergeleken met R-CHP polatuzumab vedotin; in beide armen 6 cycli plus 2 giften rituximab (n=879). Na een mediane follow up van 28 maanden bleek de 2 jrs-PFS in de R-CHP-pola behandelde groep 76.7% vs 70.2% in de R-CHOP groep. HR 0.73 (95% CI 0.57-0.95). De studie toonde geen verschil in 2 jrs-OS (88.7% vs 88.6%). De studie toonde ook geen verschil in percentage patiënten in complete metabole remissie na beëindigen van behandeling.
Een niet vooraf gedefinieerde subgroep analyse toonde een mogelijk voordeel in de experimentele arm voor specifieke subgroepen patiënten (ouder dan 60 jaar, IPI >2, bulky disease of non-GCB subtype). De studie is echter onvoldoende gepowered om een uitspraak te kunnen doen over deze subgroepen.
De werkgroep is van mening dat er momenteel geen indicatie is om R-CHP polatuzumab vedotin te adviseren, gezien het relatief kleine verschil in 2 jrs-PFS en ontbreken van verschil in 2 jrs-OS.
Double en triple hit HGBL (DH/TH HGBL):
1x R-CHOP 21 en 5x DA-EPOCH-R met CNS profylaxe (of 6x DA-EPOCH-R indien bij diagnose DH/TH bekend is)
of
–6 x R-CHOP met lenalidomide (R2CHOP) met CNS profylaxe
Alternatief: 6x R-CHOP21 met CNS profylaxe
Patiënten met een MYC en BCL2 en/of een BCL6 translocatie (DH en TH HGBL) hebben een slechtere prognose na behandeling met R-CHOP dan patiënten zonder translocaties.21-23Intensievere chemotherapie schema’s geven een hoger CR percentage en langere PFS.23-25 Patiënten met een DH en TH lymfoom hebben een hogere kans op CNS recidief waarvoor bij alle patiënten CNS profylaxe geadviseerd wordt.23
Buiten studieverband wordt DA-EPOCH-R met CNS profylaxe geadviseerd; dit schema geeft het hoogste CR percentage en langere PFS (geen OS voordeel).22-24 Dit schema is ook prospectief geëvalueerd en resulteerde in een 4-jaars EFS van 71% en OS van 77% (ook SH patiënten werden geïncludeerd).26
Data van de HOVON 130 studie, waarin SH/DH/TH patiënten 6x R-CHOP + 2R met lenalidomide kregen, laten vergelijkbare overlevingsresultaten zien (mFU 25.4 maanden, 2-jaars estimate OS 73%, PFS 75% (34 patiënten at risk)). Langere FU data laten 2-jaars OS van 74% zien (60 patiënten at risk) met een betere overleving vergeleken met een propensity based gematchte controle groep uit de HOVON 900. R2CHOP heeft als voordeel dat het een poliklinisch schema is.27 Add-on vergoeding van lenalidomide voor DH/TH lymfoom is goedgekeurd (lenalidomide 15 mg, dag 1-14 Cyclus 1-6). Bij R2CHOP wordt groeifactor en tromboseprofylaxe geadviseerd.
Indien DA-EPOCH-R te toxisch wordt geacht, kan 6x R-CHOP21 met CNS profylaxe gegeven worden. Er is geen evidence om in complete remissie te consolideren met een autologe stamceltransplantatie.8
NB1 In de nieuwste WHO classificatie worden patiënten met een MYC en BCL6 translocatie (MYC/BCL6 DH) op biologische gronden als een aparte entiteit beschouwd.9 De klinische studies waarin de MYC/BCL6 DH patiënten apart geanalyseerd zijn, zijn niet eenduidig, maar de meeste series laten een slechtere prognose van deze patiënten op standaard behandeling zien10-14. Op grond hiervan wordt voor deze patiënten vooralsnog behandeling conform MYC/BCL2 DH geadviseerd.
NB2 Dubbel expressors (hoge MYC en BCL2 eiwitexpressie), DH/TH stadium I en single hit (SH) MYC positieve patiënten lijken geen significant slechtere prognose te hebben na behandeling met R-CHOP; voor deze patiënten wordt 6x R-CHOP21 zonder CNS profylaxe geadviseerd.23,29-31
Referenties:
Advies
Er is geen uniforme consensus over het beste instrument ter evaluatie van de fitheid van oudere patiënten met een DLBCL. Ondanks het ontbreken van robuuste data, kan een inschatting van fitheid voor therapie gemaakt worden op basis van de simplified geriatric assessment (sGCA) welke een combinatie is van de ADL, IADL, CIRS-G scores en leeftijd. Dit model onderscheidt de volgende 3 groepen: fit, niet fit en kwetsbaar, welke gebruikt kunnen worden in de keuze van systeemtherapie.

Toelichting
Hoewel er verschillende geriatrische evaluatie-instrumenten beschikbaar zijn om de fitheid van oudere patiënten te beoordelen, worden deze in de routinepraktijk niet op grote schaal toegepast. Uitgebreide geriatrische beoordelingen zijn meestal tijdrovend, vereisen vaak een geriater of gespecialiseerd verpleegkundige en zijn niet gevalideerd om de behandeling op te sturen. Bovendien zijn de meeste van deze historisch gebruikte beoordelingen statisch en meten zij niet of de behandeling resulteert in terugkeer van de vitaliteit.1
Simplified comprehensive geriatric assessment
De Fondazione Italiana Linfomi heeft een prognostische index gedefinieerd en gevalideerd, de elderly prognostic index (EPI), gebaseerd op een vereenvoudigde geriatrische beoordeling (sCGA) in combinatie met leeftijd, specifiek voor patiënten die voor agressief lymfoom worden behandeld.2 De sGCA is een model dat op basis van 4 variabelen (ADL, IADL, CIRS-G en leeftijd) 3 groepen onderscheidt: fit, niet fit en kwetsbaar (frail). Wanneer sCGA werd geïntegreerd met leeftijd < of > 80 jaar, was de OS in de verschillende groepen significant verschillend.
ADL-score
Bij de Katz activities of daily live (ADL) score wordt aan 6 handelingen 1 punt toegekend.
IADL-score
Bij de Lawton instrumental activities of daily living (IADL) wordt aan 8 activiteiten een punt toegekend.
|
ADL activiteiten |
IADL activiteiten |
|
Hulp bij baden of douchen |
Telefoneren |
|
Hulp bij aankleden |
Winkelen |
|
Hulp bij toiletgang |
Eten klaarmaken |
|
Gebruik van incontinentie materiaal |
Huishoudelijke taken |
|
Hulp bij transfer van bed naar stoel |
Was- en strijkgoed |
|
Hulp bij eten |
Gebruik maken van (openbaar) vervoer |
|
|
Afhandelen medicatie gebruik |
|
|
Afhandelen financien |
Cumulative Illness Rating Scale Geriatics
Bij de Cumulative Illness Rating Scale Geriatics (CIRSG) wordt op 14 domeinen het functioneren ingeschat op een schaal van 0 tot 5: 0 = geen beperking; 1 = mild probleem; 2 = matig probleem dat 1ste lijn therapie nodig maakt; 3 = ernstig of chronisch probleem; 4 = zeer ernstig probleem
|
CIRS-G domeinen |
||
|
Hart |
Bovenste tractus digestivus |
Spier en bewegingsapparaat |
|
Vasculair |
Onderste tractus digestivus |
Neurologisch |
|
Hematopoeitisch |
Lever |
Endocrien |
|
Respiratoir |
Nieren |
Psychiatrisch |
|
KNO en ogen |
Urogenitaal |
|
Referenties:
Advies
Toelichting
Bij oudere patiënten zijn er verschillende therapeutische opties. Hoewel R-CHOP het meest effectieve schema is en bij geselecteerde patiënten tot op hoge leeftijd gegeven kan worden1,2 , zal de keuze van therapie afhangen van de fitheid van patiënt. Bij fitte oudere patiënten die behandeld worden met R-CHOP zal dosis de-escalatie afhangen van de geobserveerde toxiciteit.
Bij patiënten die niet fit zijn is het redelijk om te streven naar een cumulatieve antracycline dosering van 50-75% van de cyclofosfamide en doxorubicine en aanpassing van de dosering vincristine en prednisolon.3 Hoewel de 2-jaars overleving van patiënten behandeld met R-mini-CHOP met 59% tov de totale populatie 20% lager ligt wordt het in zijn algemeenheid goed verdragen lager.4
|
Comparison of dosing in R-CHOP and R-mini-CHOP |
||
|
|
R-CHOP |
R-mini-CHOP |
|
Rituximab |
375mg/m2 d1 |
375mg/m2 d1 |
|
Cyclophosphamide |
750mg/m2 d1 |
400mg/m2 d1 |
|
Doxorubicine |
50mg/m2 d1 |
25mg/m2 d1 |
|
Vincristine |
1.4mg/m2 (cap 2mg) d1 |
1mg |
|
Prednisolon |
100mg d1-5 |
40mg/m2 d 1-5 |
Bij kwetsbare ouderen dient een afweging gemaakt te worden of gestart wordt met R-mini-CHOP, maar alternatieve opties zijn R-COP, R-Gemox, R-Bendamustine en R-Bendamustine.5-6 Uit IKNL data blijkt dat 35% van de patiënten >75 jaar niet meer start met systeemtherapie (data IKNL).
|
Treatment options for elderly patients unfit for R-CHOP |
|||||
|
|
R-COP |
R-Gemox |
R-Benda |
R-mini-CHOP |
R-CHOP |
|
Author |
Laribi et al. |
Shen et al. |
Storti et al. |
Peyrade et al. |
Wieringa et al. |
|
Year |
2016 |
2018 |
2018 |
2011 |
2013 |
|
N |
43 |
60 |
49 |
150 |
154 |
|
Age |
> 80 |
75 |
> 70 |
> 80 |
61-80 |
|
IPI-score 4-5 (%) |
50 |
26 |
57 |
40 |
19 |
|
CR (%) |
37 |
47 |
53 |
62 |
67 |
|
2-year OS |
37 |
72 |
53 |
59 |
67 |
Wat is het advies bij patiënten met een cardiale voorgeschiedenis?
Voor patienten die een cardiale dysfunctie hebben (LVEF ≤45%, hartfalen NYHA klasse 2 of een coronair infarct) wordt behandeling met volle dosis antracyclines ontraden. Bij deze patienten kan doxorubicine vervangen worden door etoposide.
|
Agent |
Dose/day |
Route of administration |
Days |
|
Etoposide |
50 mg/m2 |
i.v. |
1 |
|
Etoposide |
100 mg/m2 |
oral |
2-3 |
Welke speciale voorzorgsmaatregelen zijn nodig bij oudere patiënten?
Pre fase prednisolon
Voor start van R-(mini)-CHOP wordt bij niet fitte en of oudere patiënten een prefase met steroiden geadviseerd (5 dagen prednisolon , 60 – 100 mg/dag).7
G-CSF
Ondersteuning met G-CSF wordt in ieder geval geadviseerd bij de 1ste cyclus (PEG-filgastrim 6 mg s.c. op dag 2 van de cyclus).
Hydrocortisone
Voor patiënten die ernstige vermoeidheid ervaren na staken van de prednisolon, kan hydrocortison worden voorgeschreven (20 mg in de morgen en 10mg in de avond).
Referenties:
Aanbeveling:
Re-inductie therapie met R-DHAP of R-GDP gevolgd door BEAM en autologe stamceltransplantatie bij de fitte patiënt met responsieve ziekte. (SORT A)
Onderbouwing:
Patiënten met een recidief of refractaire ziekte van het DLBCL hebben een prognose van enkele maanden zonder behandeling. Patiënten met primair refractaire ziekte hebben een mediane overleving van 6.3 maanden indien 2e lijnstherapie wel wordt gestart. Patiënten met recidief DLBCL en tijdens 2e lijns behandeling chemosensitieve ziekte hebben een ziektevrije overleving van 30-60%.1,2
Patiënten komen in principe in aanmerking voor hoge dosis chemotherapie en autologe stamceltransplantatie tot de leeftijd van 70 jaar (SORT B). Vanaf 70 jaar is het een individuele beslissing, op basis van co-morbiditeit (SORT B).3 De non-relapse mortality blijkt rond de 7% zijn in een retrospectieve studie.
Fitte patiënten komen in aanmerking voor hoge dosis chemotherapie en autologe stamceltransplantatie. Voor minder fitte patiënten is het een individuele beslissing.
Indeling fitheid op klinische gronden (SORT C).
|
Fit |
Patiënten zonder co-morbiditeit (doorgaans jonger dan 65-70) |
|
Minder fit |
Patiënten met enige co-morbiditeit; WHO 0-2* |
|
Niet fit |
Patiënten met ernstige co-morbiditeit; WHO 3-4* |
* indien niet veroorzaakt door ziekteactiviteit (cytopenie, lymfadenopathie, B-symptomen)
Re-inductie therapie:
Er zijn drie gerandomiseerde studies verricht, R-DHAP versus R-ICE en R-DHAP versus R-GDP, R-DHAP versus O-DHAP (SORT A).4
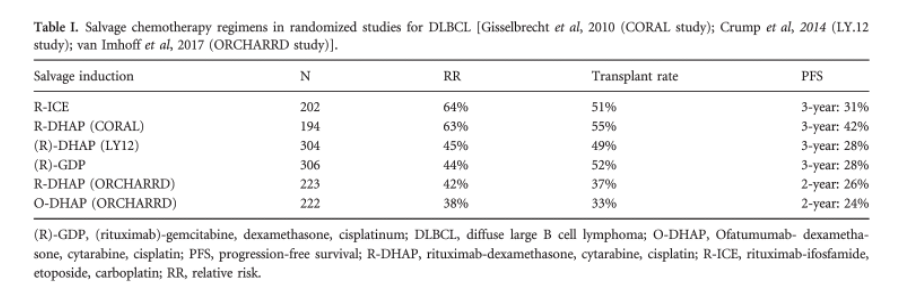
Re-inductie therapie met R-ICE en R-DHAP geven dezelfde uitkomst: ORR 63%, CR 38% (SORT A).5 Er wordt geen verschil gezien in 3-jaars EFS (26% vs 35%) en OS (47% vs 51%), mogelijk is R-DHAP beter voor GCB lymfomen.
Re-inductie therapie met R-GDP en R-DHAP, geven dezelfde uitkomst in ORR, EFS en OS (SORT A).6 R-GDP is minder toxisch en kan poliklinisch worden gegeven.
Re-inductie met ofatumumab-DHAP is niet beter dan rituximab-DHAP gevolgd door autologe stamceltransplantatie (SORT A).7
De 2-jaars EFS (16% vs 18%) en de OS (38% vs 41%) zijn niet significant verschillend.
R-DHAP
|
Rituximab |
375 mg/m2 dag 1 |
|
Dexamethason |
dexamethason 40 mg i.v. of oraal dag 1-4 |
|
Cisplatine |
100mg/m2 dag 2 dag 2 |
|
Cytarabine |
2d 2000mg /m2 dag 3 |
R-GDP
|
Rituximab |
375mg/m2 i.v. dag 1 |
|
Gemcitabine |
1000 mg/m2 i.v. dag 1 en 8 |
|
Dexamethason |
dexamethason 40 mg i.v. of oraal dag 1-4 |
|
Cisplatine |
cisplatine 75 mg/m2 i.v. dag 1 |
Overige re-inductie schema’s:
|
R-ICE |
Rituximab, ifosfamide, carboplatine, etoposide |
|
R- DHAC |
Rituximab, dexamethason, cytarabine, carboplatine Bij nierinsufficiëntie of verminderde LVEF |
|
R-VIM |
Rituximab, etoposide, ifosfamide, methotrexaat |
|
R-Gem OX |
Rituximab, gemcitabine, oxaliplatine |
Conditioneringsschema pre-autologe stamceltransplantatie
Het meest gebruikte conditionering schema pre-autologe stamceltransplantatie is BEAM (carmustine, etoposide, cytarabine, melfalan). Een vergelijkende retrospectieve studie van de EBMT laat zien dat TEAM (thiotepa i.p.v. carmustine) geen significant verschil laat zien in effectiviteit (SORT B).8
Onderhoudstherapie rituximab post-transplantatie
Er is geen indicatie voor onderhoudsbehandeling rituximab na autologe stamceltransplantatie, dit is uitgezocht in een gerandomiseerde studie (SORT A).9
Referenties:
Het recidief dient histologisch bevestigd te worden. Er kan sprake zijn van een andere ziekte, zoals sarcoïdose, tuberculose of een carcinoom. Ook kan er een verandering zijn opgetreden in het type lymfoom, hetgeen gevolgen kan hebben voor de keuze van behandeling.
Voor patiënten die recidiveren na R-CHOP en niet in aanmerking komen voor re-inductie chemo-immunotherapie gevolgd door een autologe stamceltransplantatie, zijn er in het algemeen geen curatieve mogelijkheden voor behandeling. De behandeling zal gericht zijn op goede palliatie en zo mogelijk behoud van kwaliteit van leven. Soms zal ook in overleg met de patiënt gekozen worden om niet te behandelen. Er is geen standaard therapie. De lymfoom werkgroep is van mening dat behandeling in studieverband de voorkeur geniet. Er zijn nieuwe middelen in ontwikkeling. Het is daarom zinvol met een van de academische centra te overleggen of er mogelijkheden zijn voor een studie. Kijk tevens op www.HOVON.nl/werkgroep LLPC. De mediane overleving voor deze patiënten is 6-12 maanden.
Voor volwassen patiënten met recidiverend of refractair (r/r) DLBCL na 2 of meer lijnen systemische therapie zijn momenteel 2 geregistreerde CAR T-celtherapieën: tisa-cel en axi-cel. In Nederland zijn meerdere studies met CAR T-cellen open voor deelname. Ondanks dat er nog geen langdurige follow-up is, zijn er patiënten die al zeer lang in remissie zijn na een infusie van CAR T-cellen (zie Uitgangsvraag CAR T-cel therapie)
Er zijn diverse mogelijkheden voor palliatieve behandeling met chemo-immunotherapie. In Nederland is veel ervaring met het R-PECC regime (rituximab, chloorambucil, lomustine, etoposide, prednison). In Duitsland en Frankrijk wordt vaak een combinatie van gemcitabine en oxaliplatine met rituximab toegepast. Andere mogelijkheden zijn rituximab-bendamustine en rituximab-lenalidomide. Zie tabel 1 voor diverse behandelregimes, responspercentages en mediane PFS en OS. De keuze van behandeling zal afhankelijk zijn van co-morbiditeit, restverschijnselen van eerdere behandelingen en potentiële toxiciteit (SORT C). Pixantrone is als monotherapie geregistreerd voor 3de of 4de lijns behandeling. In de Pivotal studie werd een ORR van 41% bereikt, de responsduur bedroeg echter slechts 5.7 maanden.10
Recent is registratie en vergoeding verkregen voorde combinatie polatuzumab vedotin met rituximab-bendamustine. In een gerandomiseerde fase 2 studie gaf dit in vergelijking met rituximab-bendamustine een significante winst in de totale overleving (Tabel 1) van 12.4 mnd vs 4.7 maanden ten opzichte van behandeling met Bendamustine-rituximab11.
In een multicenter fase 2 studie werden patiënten met R/R DLBCL die niet geschikt waren voor autologe stamceltransplantatie behandeld met tafasitamab in combinatie met lenalidomide. Patiënten met primair refractaire ziekte of met double/triple hit lymfoom werden ge-excludeerd. Er werd een ORR gevonden van 58%, mediane OS 33.5 maanden en mediane PFS 11.6 maanden15.
De combinatie tafasitamab met lenalidomide wordt niet opgenomen in het basispakket van de zorgverzekering en is daarom niet beschikbaar in Nederland.
Daarnaast kan ook palliatieve radiotherapie overwogen worden (SORT C).
Table 1. Regimens for patients ineligible for transplant: selection of prospective studies in DLBCL
|
Reference |
Patients subsets |
Treatment |
No pts |
Response rates |
Survival |
|
Chao et al.1 |
relapsed |
CEPP (B) 6 cycles |
61 |
CR 30%, PR 30% |
median PFS 7 months median OS 12 months |
|
Lopéz et al.2 |
relapsed, refractory |
GEMOX-R 6-8 cycles
|
32 |
CR 34%, PR 9% |
median OS 9.1 months 1-yr PFS 29% 1 yr OS 41% |
|
Corazzelli et al.3 |
Relapsed, refractory |
GEMOX-R 6 cycles |
17 |
CR 47%, PR 12% |
NS |
|
Mounier et al.4 |
Relapsed, refractory |
GEMOX-R 8 cycles |
49 |
after 4 cycles CR 44%, PR 17% end of treatment CR 38%, PR 8% |
median PFS 5 months 5 yr PFS 13% 5 yr OS 14% |
|
Ohmachi et al.5 |
Relapsed, refractory |
R-bendamustine 6 cycles |
59 |
CR 37%, PR 25% |
median PFS 6.7 months |
|
Vacirca et al.6 |
Relapsed, refractory |
R-bendamustine 6 cycles |
59 |
CR 15%, PR 30% |
median PFS 3.6 months |
|
Lugtenburg et al.7 |
Relapsed, refractory |
R-PECC |
61 |
after 4 cycles CR 23%, PR 28% |
Median PFS 9 months |
|
Czuczman et al.8 |
Relapsed, Refractory ≥ 3th line |
Lenalidomide 1 dd 25 mg D1-D21 g 28 daysq |
51 |
CR 10%, PR 17% |
Median PFS 3.5 months |
|
Zinzani, PL, et al.9 |
Relapsed, refractory |
R-lena 4 x , Lena maint 8 x R D1 + D21, lena 1 dd 20 mg q 28 days |
23 |
ORR 35% CR 35% after maintenance
|
Median duration CR 5 yrs |
|
Pettengell et al.10 |
Relapsed, Refractory 3th, 4th, 5th line |
pixantrone |
64 |
CR 23%, PR 18% |
median PFS 5.7 months |
|
Sehn et al.11 |
Relapsed, refractory ≥ 2nd line |
Polatuzumab vedotin + R-bendamustine vs R-bendamustine |
113 |
CR 40% vs 18% |
Median PFS 11.1 months vs 7.7 months Median OS 12.4 months vs 4.7 months |
Referenties:
Aanbeveling(en)
*Op dit moment is axicel door de EMA goedgekeurd en in NL geregistreerd voor 2e lijnsbehandeling, echter er is nog geen vergoeding (wel voor ≥3e lijn). Tisacel is niet geregistreerd voor 2e lijnsbehandeling, wel voor ≥3elijn. Lisocel is EMA-goedgekeurd voor 2e en ≥3e lijn, maar nog niet vergoed in NL.
Onderbouwing:
Inleiding
Patiënten met een recidief/refractair diffuus grootcellig B-cellymfoom na twee eerdere lijnen systemische behandeling hebben met de huidige behandelingsmogelijkheden een slechte prognose. Behandeling met CD19-gerichte CAR T-cellen leidt bij 30-40% van deze patiënten tot een langdurige ziektevrije overleving. Patiënten met een 1e recidief DLBCL of recidief ≤1 jaar na afronden 1e lijnsbehandeling hebben eveneens een slechte prognose met een mediane overleving van ~6 maanden. Twee gerandomiseerde fase III studies laten een significant voordeel in EFS en QoL zien voor CAR T-celbehandeling versus standaard chemotherapie bij patiënten met DLBCL, refractair na R-CHOP of recidief ≤1 jaar na afronden R-CHOP. Een van deze studies (ZUMA-7 studie) laat ook een duidelijk significant OS voordeel zien.
Conclusies
|
SORT Grade |
Conclusie |
|
A |
Er zijn 2 gerandomiseerde fase III studies die een significant voordeel in EFS en QoL laten zien voor CAR T-celbehandeling versus standaard therapie bij patiënten met DLBCL, refractair na R-CHOP of recidief ≤1 jaar na afronden R-CHOP. Eén van deze studies laat ook een OS voordeel zien. |
|
B |
De prognose van patiënten met recidief/refractair DLBCL na 2 of meer eerdere lijnen systemische behandeling, is slecht, met een mediane overleving van 6 maanden. Dit geldt ook voor patiënten met een primair refractair DLBCL of progressie ≤12 maanden na R-CHOP. |
|
B |
CD19-gerichte CAR T-celbehandeling leidt bij patiënten met DLBCL inclusief PMBCL en tFL die tenminste twee eerdere lijnen systemische behandeling hebben gehad, bij 30-40% van de patiënten die de infusie hebben ondergaan tot langdurige ziektevrije overleving |
Samenvatting literatuur
Wat zijn CD19 CAR T-cellen en onder welke wet- en regelgeving vindt behandeling plaats?
CAR T-cellen zijn genetisch gemodificeerde T-cellen die een chimere antigeenreceptor (CAR) tot expressie brengen. De CD19 CAR bestaat uit een van een antistof afkomstig CD19-specifiek single chain Fv domein, gekoppeld aan een intracellulaire T-celreceptor zeta keten en een costimulatoir domein (CD28 i.g.v. axicabtagene ciloleucel en 4-1BB i.g.v. tisagenlecleucel en lisocabtagene maraleucel). Het B-celspecifieke antigeen CD19 komt voor op normale B-cellen, B-ALL en op bijna alle B-NHL. Om CAR T-cellen te kunnen produceren worden autologe mononucleaire cellen middels een aferese afgenomen. Deze mononucleaire cellen worden vervolgens in een gespecialiseerd laboratorium gestimuleerd, waardoor expansie en activatie optreedt van T-cellen, die vervolgens m.b.v. een retro- of lentivirale vector worden voorzien van een chimere antigeenreceptor. Na expansie en formulering zullen de patiënt-specifieke CAR T-cellen middels een enkele infusie teruggeven worden aan de patiënt. In de patiënt zullen deze CAR T-cellen binden aan CD19, vervolgens expanderen en kunnen ze CD19-positieve (tumor)cellen herkennen en doden. CAR T-cellen zijn ‘een levend medicijn’ en deze behandeling valt onder verschillende vormen van wet- en regelgeving: het is een vorm van cellulaire therapie, meer specifiek een ATMP (advanced therapeutic medicinal product) en om die reden is het ook een medicijn. Ook is er sprake van genetische modificatie van de cellen en om die reden is er ook wet- en regelgeving m.b.t. gentherapie van toepassing. Voor behandeling in studieverband geldt dat het betreffende CAR T-centrum een vergunning moet hebben van het Ministerie voor Infrastructuur&Milieu. Daarnaast kan de behandeling in Nederland alleen plaatsvinden in centra die JACIE-geaccrediteerd zijn en ATMP’s mogen vrijgeven en toedienen. Hierbij zijn ook de WVKL (Wet Veiligheid en Kwaliteit Lichaamsmateriaal), GMP (Good Manufacturing Practice), GDP (Good Distribution Practice) en de richtlijnen van de IGJ (Inspectie Gezondheidszorg en Jeugd) van belang. Voor toediening van commerciële produkten (axicabtagene ciloleucel (Yescarta) en tisagenlecleucel (Kymriah), en in de nabije toekomst lisocabtagene maraleucel (Breyanzi)) moeten centra volgens richtlijnen van de EMA gekwalificeerd zijn (o.a. m.b.t scholing en beschikbaarheid tocilizumab). De EMA heeft deze kwalificatieprocedure neergelegd bij de farmaceutische bedrijven die de CAR T-cellen op de markt brengen. Daarnaast moeten de centra voldoen aan de kwaliteitseisen van de commissie CIEBAG, zoals mede opgesteld door de leden van de Nederlandse CAR T-cel tumorboard.
CAR T-cellen worden in principe eenmalig toegediend aan de patiënt. Voorafgaand aan de CAR T-cel infusie krijgt de patiënt lymfodepleterende chemotherapie (met fludarabine en cyclofosfamide) met als doel persistentie en daarmee te activiteit van de CAR T-cellen te bevorderen.
CAR T-cel behandeling na ≥2 eerdere lijnen therapie
Prognose van recidief/refractair diffuus grootcellig B cel lymfoom (DLBCL) en primair mediastinaal B cel lymfoom (PMBCL) met huidige behandelingen
DLBCL is de meest voorkomende vorm van non-Hodgkin lymfoom (NHL), met ongeveer 1200 nieuwe patiënten in Nederland per jaar. Ongeveer 60% van de patiënten wordt in de eerste lijn genezen met immunochemotherapie (R-CHOP). Een deel van de patiënten (fit en < 70 jaar) met een recidief/refractair DLBCL kan worden genezen met salvage chemotherapie, gevolgd door hoge dosis chemotherapie en een autologe stamceltransplantatie (SCT). De kans op genezing is echter klein bij patiënten die eerder zijn behandeld met rituximab, primair R-CHOP refractair zijn, of een recidief hebben binnen 12 maanden na R-CHOP. De vooruitzichten voor patiënten die niet in aanmerking komen voor een autologe SCT (omdat ze hiervoor qua leeftijd/conditie niet in aanmerking komen of geen remissie bereiken op salvage chemotherapie), of een recidief hebben snel na de autologe SCT zijn zeer slecht. In de SCHOLAR-1 analyse bleek dat in een groep van 636 patiënten met refractair DLBCL (primair refractair of recidief binnen 1 jaar na autologe SCT) slechts 26% een respons op salvage chemotherapie had en slechts 7% een complete respons. De mediane overleving van deze groep beperkte zich tot 6.3 maanden. PMBCL is een zeldzame vorm van agressief lymfoom, die vaker bij jonge vrouwen voorkomt en waarbij meestal sprake is van een grote mediastinale massa. Deze aandoening wordt in het algemeen behandeld met dezelfde therapie als DLBCL-NOS.
Resultaten CAR T-celbehandeling bij DLBCL/tFL/PMBCL
Een multicentrische, industrie gesponsorde fase II studie waarin patiënten werden behandeld met een eenmalige infusie met CD19 CAR T cellen (axicabtagene ciloleucel, ZUMA-1 studie) laat in een qua patiënten-karakteristieken met de SCHOLAR-1 vergelijkbare groep van 101 patiënten met refractair DLBCL, getransformeerd folliculair lymfoom (tFL) of PMBCL een overall responspercentage zien van 83% waarvan 57% complete respons. Bij een mediane follow up van 63 maanden was na 12 maanden nog 60% van de patiënten in leven en na 60 maanden nog 43% (ziekte-specifieke overleving 51%). Bij patiënten die op 6 maanden na de infusie van de CAR T cellen een metabole complete remissie hadden bereikt, zijn binnen de nu beschikbare follow-up periode nog nauwelijks recidieven opgetreden (na 60 maanden was nog 31% van de patiënten in remissie). Er is dus een duidelijk plateau in de overlevingscurve bereikt waardoor van curatieve therapie kan worden gesproken.
In een andere multicentrische, industrie gesponsorde fase II studie met tisagenlecleucel (JULIET studie) werden vergelijkbare resultaten bereikt: bij 115 patiënten met refractair DLBCL die een infusie met tisagenlecleucel kregen was er sprake van een overall responspercentage van 53% en een complete responspercentage van 39%. Ook hier traden nauwelijks recidieven op na 6 maanden; de progressievrije overleving na 12 maanden was 35%. Bij een mediane follow-up van 40 maanden is de mediane duur van de respons niet bereikt en is de progressievrije overleving 31%.
Recent werden ook resultaten gepubliceerd van de TRANSCEND studie, een fase II studie waarin 294 patiënten met DLBCL/PMBCL werden behandeld met lisocabtagene maraleucel. In deze studie was de ORR 73% met 53% CR en werd bij een mediane follow up van 12 maanden de mediane duur van de respons nog niet bereikt. Lisocabtagene maraleucel is bij het verschijnen van deze richtlijn goedgekeurd door de FDA en EMA.
Alle drie de studies tonen aan dat het bij een substantiëel deel van de patiënten (30-40%), voor wie voorheen geen reguliere opties meer waren, gaat om een curatieve behandelingsoptie. Kanttekeningen die geplaatst kunnen worden bij de behandeling zijn dat er geen gerandomiseerde gegevens zijn in deze lijn van behandeling (vanwege gebrek aan een standaardbehandeling) en dat in de JULIET studie ongeveer een derde van de in de studie geïncludeerde patiënten niet aan infusie toekwam, vooral vanwege lange wachttijd tussen aferese en aflevering van de cellen. Naar de mening van de werkgroep is het echter, gezien het eenmalige karakter van deze cellulaire therapie redelijk om naast intention-to-treat’ (ITT) ook de ‘modified’ intention-to-treat’ analyse mee te nemen. Bij modified ITT worden effectiviteit en toxiciteit alleen beoordeeld voor de patiënten die de infusie hebben ontvangen: immers, als geen behandeling plaatsvindt kunnen effectiviteit en toxiciteit niet worden beoordeeld. Dit is vergelijkbaar met het beoordelen van de effectiviteit en toxiciteit van allogene stamceltransplantatie: ook daar wordt gekeken naar de patiënten die daadwerkelijk een allogene SCT ondergingen. Wel is het van belang om in de ‘real world’ de haalbaarheid van deze behandeling nauwkeurig te volgen evenals de lange termijn effecten en om beter te definiëren welke patiënten mogelijk baat hebben bij deze behandeling.
Er is, vanwege ontbreken van een rechtstreeks vergelijkende studie, verschillen in patiëntenpopulatie, wel of niet toestaan van overbruggende chemotherapie, verschil in lymfodepleterende chemotherapie en verschil in gradering van cytokine release syndroom geen rechtstreekse vergelijking mogelijk tussen de 3 producten. Alle 3 leiden bij een deel van de patiënten tot langdurige respons waarbij er een plateau in de overlevingscurve is ontstaan, hetgeen bij deze agressieve vorm van lymfoom en met inmiddels meer dan 5 jaar mediane follow-up voor de JULIET en ZUMA-1 studies waarschijnlijk betekent dat deze patiënten gecureerd zijn.
Inmiddels zijn ook ‘real world’ resultaten van meerdere cohorten van patiënten gepubliceerd. In de door Nastoupil in JCO gepubliceerde ‘real world’ studie lijken de responspercentages en effectiviteit vergelijkbaar met studiedata, ook al voldeed ongeveer de helft van de patiënten niet aan de in/exclusiecriteria van de studies en werden er dus ziekere patiënten behandeld. Overigens was de toxiciteit vergelijkbaar met de in studieverband behandelde patiënten. Deze data zijn in lijn met de resultaten van grote Europese cohorten en ook de data van de eerste 145 in Nederland met axicabtagene ciloleucel buiten studieverband behandelde patiënten laten hoge complete responspercentages zien en langdurige progressievrije overleving bij 30-40% van de behandelde patiënten.
Naar de mening van de werkgroep voldoet CD19-gerichte CAR T-celbehandeling met axicabtagene ciloleucel, tisagenlecleucel of lisocabtagene maraleucel derhalve aan de stand van wetenschap en praktijk voor behandeling van patiënten met DLBCL (inclusief getransformeerd folliculair lymfoom (tFL), FL graad 3B en PMBCL), die tenminste twee eerdere lijnen systemische behandeling hebben gehad, mits patiënt voldoet aan de voorwaarden voor deze behandeling.
CAR T-celbehandeling in de 2e lijn
Op basis van de resultaten van de PARMA studie is in Nederland de standaardbehandeling van patiënten < 70 jaar met een DLBCL refractair op R-CHOP of 1e recidief DLBCL salvage chemotherapie (R-DHAP, R-VIM of R-GDP), gevolgd door hoge dosis chemotherapie en een autologe stamceltransplantatie (SCT) bij patiënten die een remissie bereiken op de salvage therapie. Uit o.a. de resultaten van de HOVON98 ORCHARRD studie, een gerandomiseerde fase III studie waar de resultaten van de standaardarm (3x R-DHAP gevolgd door BEAM en autoSCT in responders) werden vergeleken met de experimentele arm (3x ofatumumab-DHAP ipv R-DHAP), bleek dat ofatumumab geen verbetering gaf op het primaire eindpunt. Belangrijke data uit deze studie laten zien dat patiënten met primair refractair DLBCL (geen CR) of een CR ≤12 maanden een significant slechtere PFS en OS (mediane OS 10 maanden) hadden dan patiënten met een eerste CR >12 maanden. Ook kon slechts 1/3 van alle patiënten die met salvage therapie begonnen de geplande autoSCT ondergaan, meestal vanwege onvoldoende respons.
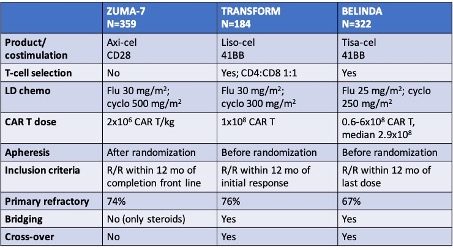
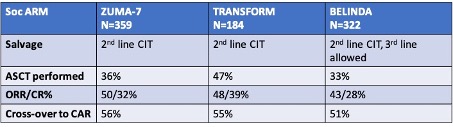
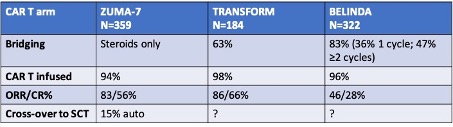
Recent zijn resultaten gepubliceerd van 3 gerandomiseerde studies waarin patiënten met primair refractair DLBCL of recidief <12 mnd na 1e lijnsbehandeling met R-CHOP werden gerandomiseerd tussen de standaardarm (salvage chemotherapie (R-DHAP, R-VIM of R-GDP), gevolgd door hoge dosis chemotherapie en autoSCT bij patiënten die een remissie bereiken op de salvage therapie) of de experimentele arm, waarbij patiënten lymfodepleterende chemotherapie kregen, gevolgd door CD19 CAR T-celtherapie (ZUMA-7, axicel, TRANSFORM, lisocel, BELINDA, tisacel). De belangrijkste kenmerken van deze studies en de uitkomsten per arm zijn samengevat in onderstaande tabellen.
Opvallend is dat in alle drie de studies slechts ongeveer 1/3 van de patiënten die hadden gerandomiseerd werden voor de standaardarm, ook daadwerkelijk toekwamen aan de autoSCT. In de CAR T-cel arm kreeg 94-98% van de patiënten de geplande CAR T-infusie.
Voor ZUMA-7 en TRANSFORM was er een significante toename van ORR en CRR voor de CAR T arm, de BELINDA studie liet geen verbetering van de respons zien. Eventfree survival was het primaire eindpunt van de studies en deze was significant langer in de ZUMA-7 arm (mediaan 8.3 vs 2 mnd; TRANSFORM 10.1 vs 2.3 mnd) maar niet in de BELINDA studie (3 vs 3 mnd). Het feit dat er geen voordeel werd gevonden voor tisacel in de BELINDA studie kan meerdere oorzaken hebben, o.a. gelegen in de opzet van de studie, de definitie van het primaire eindpunt, de langere wachttijd tussen aferese en infusie en het product zelf.
Lange termijn resultaten van de ZUMA-7 studie lieten recent, ondanks het feit dat 57% van de patiënten in de standaardarm in de 3e lijn alsnog CAR T-celbehandeling kregen, ook een significante toename in overall survival zien: bij een mediane follow-up van 48 maanden was de OS 46% in de standaardarm vs 54.6% in de axicel ar, mediaan 31.1 mnd vs not reached, HR 0.726, p=0.0168. Belangrijk is tevens dat in de ZUMA-7 studie, waarbij de mediane leeftijd 58-60 jaar was en 28-32% ≥65 jaar was, het verschil in EFS groter was bij patiënten ≥65 jaar (HR 0.276 (0.16-0.46) vs HR 0.49 (0.36-0.67) in patiënten <65 jaar).
In de 18m follow-up analyse van de TRANSFORM studie was de toename in OS (60.6% in de standaardarm vs 73.1% in de lisocel arm, HR 0.724, p=0.0987) niet statistisch significant, dit kan echter worden verklaard door de relatief kleine sample size van deze studie (92 patiënten in elke arm) en de geplande cross-over van patiënten die progressie hadden in de standaardarm. De EFS na 18 mnd was 52.6% vs 20.8%, HR 0.356.
Ook lieten analyses van kwaliteit van leven (QoL) bij zowel de ZUMA-7 als de TRANSFORM studie een significant voordeel zien t.g.v. de CAR T-cel arm, zowel in toename op gevalideerde QoL schalen, als ook in termijn waarbinnen de QoL verbeterde.
Naar de mening van de werkgroep voldoet CD19-gerichte CAR T-celbehandeling met axicabtagene ciloleucel of lisocabtagene maraleucel derhalve aan de stand van wetenschap en praktijk voor behandeling van patiënten met DLBCL (inclusief getransformeerd folliculair lymfoom (tFL), FL graad 3B en PMBCL), waarbij er sprake is van een primair refractair DLBCL of recidief ≤12 maanden na afronden R-CHOP, mits patiënt voldoet aan de voorwaarden voor deze behandeling.
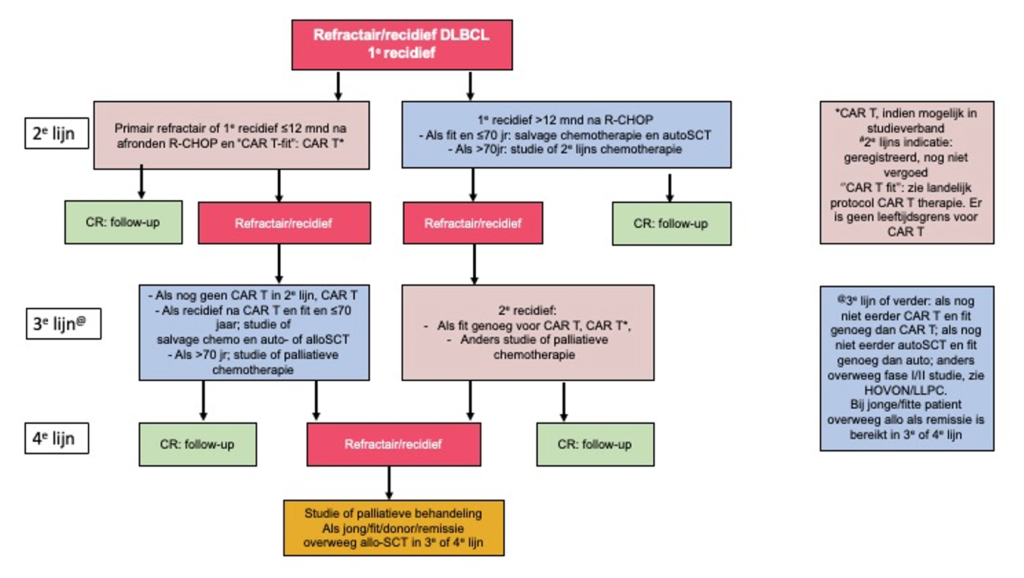
In onderstaande figuur is de plaats van CD19-gerichte CAR T-celbehandeling in het behandelalgoritme van patiënten met recidief DLBCL/tFL/PMBCL aangegeven. In alle gevallen verdient het bij deze nieuwe therapie de voorkeur om patiënten waar mogelijk in studieverband te behandelen. Op de HOVON website (www.hovon.nl, lymfoomwerkgroep en LLPC werkgroep) kunt u terecht voor een actueel overzicht van de CAR T-celtherapie studies en voor de in/exclusiecriteria en aanmeldprocedure voor behandeling met CD19-gericht CAR T-cellen buiten studieverband (hovon.nl/behandelrichtlijnen/lymfoom). Voor patiënten die in aanmerking komen voor commerciële behandeling met CD19 CAR T-cellen is in 2023 de HOVON161 studie van start gegaan, waarin Point-of-Care geproduceerde CAR T-cellen in een gerandomiseerde fase II opzet worden vergeleken met commercieel geproduceerde CD19 CAR T-cellen.
Bijwerkingen CAR T-celbehandeling bij DLBCL/PMBL
De belangrijkste bijwerkingen na CAR T-celinfusie zijn cytokine release syndroom (CRS), immune-effector cell associated neurotoxicity syndrome (ICANS), infecties, cytopenie en B-celdepletie waardoor hypogammaglobulinemie. Voor een recente review van de toxiciteit en management daarvan wordt verwezen naar het artikel van Neelapu et al. Behandeling met CAR T-cellen kan i.v.m. wet- en regelgeving en de noodzaak voor gespecialiseerde zorg alleen plaatsvinden in daarvoor gekwalificeerde CAR T-cel behandelcentra. Voor CD19 CAR T-celbehandeling bij DLBCL/PMBL is een landelijk behandelprotocol opgesteld (zie HOVON website, hovon.nl/behandelrichtlijnen/lymfoom).
Registratie haalbaarheid, effectiviteit en toxiciteit
Om haalbaarheid van deze behandeling, effectiviteit en toxiciteit van de behandeling goed te kunnen vervolgen zullen gegevens van alle patiënten die naar een CAR T-cel centrum worden verwezen in Nederland prospectief worden verzameld en periodiek worden terug gerapporteerd aan de belangrijkste stakeholders (o.a. VWS en zorgverzekeraars). Hierbij zal ook worden bijgehouden welke patiënten niet in aanmerking bleken te komen voor de behandeling en welke patiënten wel de aferese ondergingen maar geen infusie hebben gehad. Daarnaast vindt er ook registratie plaats in de EBMT database zoals vereist door de EMA bij registratie in de EU.
Referenties
Bewijskracht literatuur
2e lijn: Level A, consistent (2 van de 3 gerandomiseerde studies laten vergelijkbaar voordeel zien in EFS, QoL. 1 studie laat ook voordeel zien in OS.
3e lijn: Level B, consistent. Er zijn geen data beschikbaar van gerandomiseerde studies, echter dit komt doordat er in deze lijn van behandeling geen standaardbehandeling is en dus geen goede vergelijkende arm kon worden gekozen. Er zijn 3 fase II studies en meerdere real world cohorten met vergelijkbare resultaten.
Zoeken en selecteren
Er werd voor deze uitgangsvraag geen systematische literatuursearch verricht, aangezien er voor de 3e lijn slechts 3 gepubliceerde prospectieve multicenter studies zijn, die alle drie zijn meegenomen in deze analyse. Voor de 2e lijn zijn er resultaten van 3 gerandomiseerde studies, die alle drie zijn meegenomen in de analyse. Er zijn geen meta-analyses gedaan. Wel werd in Pubmed gezocht naar relevante richtlijnen met de zoektermen relapsed/refractory DLBCL, axicabtagene ciloleucel, tisagenlecleucel, lisocabtagene maraleucel, guideline.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed. Publicaties werden gecontroleerd op relevantie (prospectieve studies, retrospectieve studies, real world analyses, meta-analyses en review artikelen).
Overwegingen
Ad aanbeveling 1
Behandeling van patiënten met R/R DLBCL wordt waar mogelijk geadviseerd in studieverband. Hoewel de resultaten van behandeling met CD19 CAR T-cellen veelbelovend zijn, is er nog steeds een aanzienlijk deel van de patiënten dat niet op deze behandeling reageert, een recidief krijgt of aanzienlijke toxiciteit van de behandeling ondervindt. Ook zijn er nieuwe CAR T-celproducten in ontwikkeling met een mogelijk hogere effectiviteit en/of gunstiger bijwerkingenprofiel.
Ad aanbeveling 2
Op basis van de resultaten van 2 gerandomiseerde studies van CD19 CAR T-celtherapie versus standaardbehandeling, voldoet CD19 CAR T-celtherapie met axicel of lisocel aan de stand van wetenschap en praktijk voor patiënten met DLBCL (inclusief getransformeerd folliculair lymfoom (tFL) en PMBCL), die primair refractair zijn op 1e lijnsbehandeling met R-CHOP, ofwel een recidief hebben binnen 12 maanden na 1elijnsbehandeling.
Ad aanbeveling 3
Ondanks het feit dat er geen data beschikbaar zijn van gerandomiseerde fase III studies, is op basis van 3 grote fase II studies en ‘real world’ data naar de mening van de werkgroep voldoende therapeutische meerwaarde aangetoond op basis van overall overleving voor axicel, tisacel en lisocel ten opzichte van historische controles. Hierbij moet wel worden aangemerkt dat zorgvuldige selectie op basis van de geschiktheid van patiënten belangrijk is. Hiertoe zullen eventuele kandidaten voor deze behandeling worden besproken in een landelijke tumorwerkgroep.
Ad aanbeveling 4
Gezien het feit dat de resultaten van CD19 CAR T-celbehandeling minstens even goed zijn bij patiënten ≥65 jaar als bij patiënten <65 jaar is er geen bovenste leeftijdsgrens voor behandeling. Wel moeten patiënten voldoen aan de geschiktheidscriteria zoals vastgesteld in het landelijk CAR T behandelprotocol.
Ad aanbeveling 5
Gezien de wet- en regelgeving en eisen die worden gesteld aan CAR T-celbehandeling, zal de behandeling vooralsnog in een beperkt aantal centra plaatsvinden. Deze centra dienen gekwalificeerd te zijn voor toediening van de verschillende CD19 CAR T-cellen. Om haalbaarheid van deze behandeling en effectiviteit en toxiciteit van de behandeling goed te kunnen vervolgen zullen gegevens van alle patiënten die worden doorverwezen prospectief worden verzameld in een database om de effectiviteit en kwaliteit van zorg routinematige te evalueren.
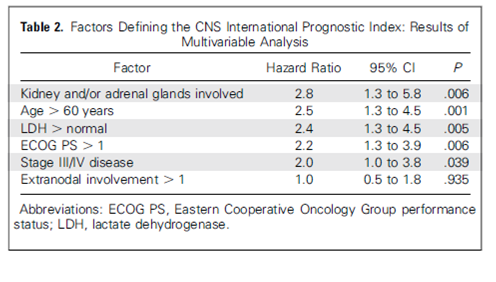
Elk item van de tabel wordt los als 1 punt gescoord.
Profylactisch Methotrexaat
Gezien de slechte prognose van secundair CZS recidief is geprobeerd dit te voorkomen met intrathecale/intraveneuze methotrexaat, bij de groep met een hoog risico van > 10%.
Het effect van intrathecale profylaxe is onzeker en nooit gerandomiseerd onderzocht. Een systematic review ondersteunt het effect van intrathecale profylaxe echter niet. [16] Systemische CZS profylaxe met hoge dosis MTX bleek in een aantal studies effectief,[17, 18] hoewel de data ook hier beperkt zijn. Er is geen bewijs wat het beste moment is voor het geven van HD-MTX.
Verschillende retrospectieve studies hebben geen verbetering aangetoond van intrathecale of intraveneuze toediening van methotrexaat bij patienten met DLBCL en hoog risico op CZS recidief. [19-21] [22, 23]. In de laatstgenoemde internationale retrospectieve studie van Lewis et al, onder 2418 high risk DLBCL patienten, werd een absolute risico reductie van 1.6% met HD-MTX gevonden. 63 patienten zouden profylaxe moeten krijgen om een enkel CZS event te voorkomen (Number-to-treat, NNT = 63).
Advies vanuit de werkgroep (Sort C):
Het risico op CZS recidief is m.n. zeer hoog (> 30%) bij lokalisatie in nier, bijnier, uterus.
Indien besloten wordt om HD-MTX profylaxe te geven, dan is het advies 2 x HD-MTX iv, in de standaarddosis 3 g/m2, om ook daadwerkelijk goede penetratie in CNS te bereiken.
Specifieke situaties
Testislymfoom
In de 5e editie van de WHO classificatie is het primaire testis lymfoom onderdeel van de subgroep primair grootcellig B-cel lymfoom van immune-priviliged sites.[24]. Het testis lymfoom heeft een zeer hoog risico op de ontwikkeling van een CZS recidief, >30%. In 2 kleine prospectieve fase II studies lijkt het geven van CZS profylaxe hier wel effectief, met een daling naar 6% na 5 jaar (IELSG10 studie) en zelfs geen CZS recidieven (IELSG30 studie) [25, 26]
Advies vanuit de werkgroep (Sort C):
Bij patienten met testislokalisatie wordt R-CHOP gecombineerd met intrathecale MTX profylaxe, 4x, en bij bereiken van complete remissie wordt aansluitend nog 2 x HD-MTX iv geadviseerd (en bestraling van contra-laterale testis).
Intravasculair lymfoom
Het intravasculair B-cellymfoom is een aparte entiteit onder de grootcellige B-cellymfomen. De tumorcellen groeien in kleine bloedvaten, en lymfadenopathie ontbreekt meestal. [24] Er is een hoge incidentie van CZS lokalisatie, die vaak niet eenvoudig aan te tonen is. [27] Standaard CZS profylaxe, 4x intrathecaal en 2x HD-MTX iv, wordt geadviseerd, en is in een kleine prospectieve fase 2 studie onderzocht. [13]
Advies vanuit de werkgroep (Sort C):
Bij patienten met intravascular B-cellymfoom wordt R-CHOP gecombineerd met 4x intrathecale MTX profylaxe, en 2x HD-MTX intraveneus.
DLBCL bij HIV positieve patienten
Vooral in het pre-HAART tijdperk had DLBCL bij HIV positieve patienten een slechte prognose, en een hoge incidentie van CZS lokalisatie. Er zijn geen data over het risico op CZS recidief bij DLBCL bij HIV positieve patienten. Op basis van historische ervaring wordt geadviseerd laagdrempelig een diagnostische LP te verrichten. Er zijn geen data die bij HIV infectie een ander beleid betreffende CZS-profylaxe ondersteunen dan bij afwezigheid van HIV infectie.
High grade B-cel lymfoom met MYC en BCL2 rearrangement (HGBL-MYC/BCL2), en met MYC en BCL6 rearrangement HGBL-NOS (MYC/BCL6)
Patiënten met MYC rearrangements hebben zonder CZS profylaxe een risico tot 15% op CZS recidief.[15] Het behandeladvies is voor zowel patiënten met HGBL-MYC/BCL2 als met HGBL-NOS (MYC/BLC6) CZS profylaxe te geven. Hoewel patiënten met HGBL-NOS (MYC/BCL6) een biologische andere entiteit lijken te vormen en mogelijk een iets betere prognose hebben zijn er vooralsnog te weinig data om bij deze groep de it profylaxe weg te laten. Het advies is deze patiënten conform de H152 studie te behandelen met DA-EPOCH-R en 6 x MTX it op dag 1. HD-MTX is niet te combineren met DA-EPOCH-R. Als alternatief kan ook R-CHOP, lenalidomide met 5 x it MTX (conform de H130) worden gegeven, of R-CHOP met 3 x HD-MTX.
Vooralsnog zijn er geen data om CZS profylaxe te overwegen in de relapse setting.
Referenties
Na de behandeling van een DLBCL patiënt adviseert de werkgroep controle in eerste jaar 3-maandelijks en in het tweede jaar 6-maandelijks. Er is geen bewijs voor het maken van CT-scans dan wel FDG-PET/CT-scans gedurende follow-up. Recente literatuur en de ESMO richtlijn1,2,3 suggereren dat 2 jaar follow-up voldoende is, gezien de kleine kans op een recidief na het tweede jaar (SORT B).
In het geval van radiotherapie adviseert de werkgroep om de follow-up te verlengen tot levenslang indien er sprake is van grote velden waarin vitale organen zoals het hart, longen, grote vaten en mammae zitten. De follow-up kan dan volgens het ‘BETER’ protocol worden verricht en begint 5 jaar na de behandeling.4
Referenties:
Indicaties voor radiotherapie
Aanbevelingen:
Onderbouwing:
Voor beperkte stadia zijn de lange termijn resultaten van ‘abbreviated chemotherapy’ in combinatie met radiotherapie equivalent aan ‘extended course’ chemotherapie.1-6
‘Extended course’ chemotherapie kan gepaard gaan met meer hartschade, myelosuppressie, ernstige infecties en inductie van MDS/AML. Daarom wordt, zeker voor de oudere patiëntengroep, geadviseerd om een beperkt aantal kuren chemotherapie te combineren met beperkte radiotherapie, om de toxiciteit van beide modaliteiten te beperken en zodoende de therapeutische ratio te vergroten.
Ofschoon het vervangen van het IF-RT principe door het IN-RT/IS-RT-principe niet gerandomiseerd onderzocht is, worden tegenwoordig alleen de initieel aangedane lokalisaties bestraald als de bestraling wordt gecombineerd met chemotherapie.7-12
Het is niet altijd mogelijk om bij een patiënt met een beperkt stadium DLBCL chemotherapie te geven (leeftijd, co-morbiditeit, wens van patiënt). Dan kan toch besloten worden tot in opzet curatieve radiotherapie. Ofschoon de resultaten daarvan beduidend slechter zijn dan bij combinatie radio-chemotherapie kan toch nog bij 40 – 50% van de patiënten met een stadium I DLBCL genezing bereikt worden.13,14
Hierbij wordt IF-RT geadviseerd.
Referenties:
Aanbevelingen:
Onderbouwing:
Consolidatieve radiotherapie verbetert significant de kans op een complete respons en de lokale controle bij een metabool actieve restlocatie (Deauvillescore 4-5) in alle stadia, indien er na eerstelijnsbehandeling middels systeemtherapie onvoldoende respons is bereikt. Mogelijk verbetert dit ook de DFS en cause-specific survival (CSS).1-5 Er zijn echter geen fase III trials in het rituximab-tijdperk verricht. De plaats van consolidatieve radiotherapie ten opzichte van andere behandelingen in de tweede lijn is onbekend. De kliniek, de mogelijkheid om PA-bevestiging te verkrijgen en de alternatieven (herhalen van het aanvullend onderzoek, systeemtherapie) worden hierin meegewogen. Op basis van de end-of-treatment PET kan bij een Deauville score van 1-3 consolidatieve radiotherapie weggelaten worden zonder significante afname van de PFS. Dit geldt ook voor bulky en botlocalisaties4.
Involved-site of involved-node radiotherapie tot een dosis van 36-40 Gy op de metabool actieve restlaesie(s) is voldoende, met als doel een complete remissie te verkrijgen en/of andere (toxische) salvage behandelingen uit te stellen.1-4 Het aantal lymfoom locaties dat in consolidatieve setting bestraald wordt, dient beperkt te blijven, waarbij de toxiciteit en de klinische relevantie van consolidatie meegenomen moeten worden. Factoren geassocieerd met een hogere kans op progressie na consolidatieve radiotherapie zijn een Deauville score 5 bij respons-PET na initiële chemotherapie en een hogere initiële IPI-score.1,5
Referenties:
Aanbevelingen:
Onderbouwing:
De behandeling van uitgebreide stadia (stadia II, III – IV; behalve beperkte stadia II) bestaat uit ‘full course’ chemotherapie. Het nut van aanvullende bestraling is niet in gerandomiseerde studies aangetoond. Wel is aangetoond dat de ‘in-field’ recidiefkans in bestraalde gebieden significant wordt beperkt. Of dit zich ook vertaalt in een verbeterde ‘overall survival’ is niet duidelijk.2-5
Retrospectieve analyses laten zien dat ‘bulky disease’ een slechte prognostische factor is.1,2,6
Een gecombineerde analyse van patiënten behandeld in de gerandomiseerde RICOVER-60 trial (met bestraling) en vergelijkbare patiënten (na amendering van de RICOVER-60 trial; RICOVER-no RTh; zonder bestraling) laat zien dat bestraling (met 36 Gy) van ‘bulky’ lokalisaties van DLBCL leidt tot verbeterde 3-jaars overleving (in een ‘per protocol’ analyse). Bulk wordt in deze studie gedefinieerd als een tumormassa met een afmeting van ≥7,5 cm.8
De analyse naar de rol van bestraling van botlokalisaties bij patiënten met DLBCL en bot-betrokkenheid liet zien dat bestraalde patiënten een significant betere 3-jaars EFS hadden en een trend naar een betere OS. De systeemtherapie moest dan wel minimaal geleid hebben tot een PR (anders kwamen patiënten in aanmerking voor tweedelijns therapie).9
Beide analyses8,9 stammen uit de tijd dat er na de systeemtherapie nog geen end-of-treatment PET gemaakt werd. In een recent gepubliceerde (2021) eveneens retrospectieve studie met 723 patiënten wordt een vergelijkbare 3-jaars time-to-progression gerapporteerd tussen patiënten mét en patiënten zónder bulky- of botlocaties in het geval van een metabole CR op de end-of-treatment PET.10 Aangezien een end-of-treatment PET nu standard-of-care is lijkt het veilig om af te zien van consolidatieve RT van de initiële bulky- of botlocaties indien deze PET-negatief geworden zijn.
Referenties:
Aanbevelingen:
Onderbouwing:
Patiënten die recidiveren na autologe SCT doen dat met name op plaatsen waar de ziekte aanwezig was ten tijde van het recidief.2-4 Lokale controle is dus een significant probleem en onderstreept het mogelijke nut van bestraling.1
Een PET-scan gestuurde strategie lijkt een goed verdedigbare stelling. Indien er voor of na autologe SCT nog veel PET-positieve afwijkingen aanwezig zijn, lijkt er sprake van refractaire ziekte en lijkt bestraling niet zinvol. Bij een beperkt aantal laesies (≤3) lijkt bestraling bij te dragen aan langdurige remissie.5
Of bestraling van PET-positieve afwijkingen daadwerkelijk gegeven wordt, dient sterk geïndividualiseerd te worden en hangt dus af van
Er zijn geen gerandomiseerde studies die het effect van bestralen vergelijken met het achterwege laten van bestralen bij patiënten die voor of na autologe SCT nog PET-positieve restafwijkingen laten zien.6
Er zijn ook geen studies die een voordeel aantonen van bestraling voorafgaande aan de autologe SCT in vergelijking met bestraling na autologe SCT. Er zijn zowel redenen om dit voorafgaand (minder tumor load ttv conditionering; patiënt in goede conditie) of na afloop te doen (geen uitstel van transplantatie; kleinere bestralingsvelden, waardoor minder toxiciteit).7
Referenties:
In de palliatieve setting is bestraling van klachten gevende lokalisaties van DLBCL of locaties waarvan verwacht wordt dat ze op korte termijn klachten gaan veroorzaken een goede therapie van keuze. Het kunnen klachten zijn van pijn of klachten als gevolg van een (dreigende) dwarslaesie, vena cava syndroom, obstructie van tractus digestivus of tractus urogenitalis.
De dosis en fractionering zijn afhankelijk van meerdere factoren (conditie van patiënt, verwachte overleving, grootte van de afwijkingen, uitgebreidheid van de ziekte, agressiviteit van de ziekte, eerdere radiotherapie) en kan variëren van 1 x 8 Gy tot 13 x 3 Gy.1-3
Referenties:
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie
Uiterlijk in 2025 bepaalt het bestuur van de lymfoom werkgroep en de NVvH of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De lymfoom werkgroep is als houder van deze richtlijn de eerst verantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerst-verantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.