Terug naar het richtlijnenoverzicht
Essentiele trombocytemie (ET) behoort samen met polycythemia vera (PV) en primaire myelofibrose (PMF) tot de Philadelphia chromosoom-negatieve myeloproliferatieve aandoeningen (MPN). Het is een relatief zeldzame aandoening met een geschatte incidentie van 0,2-2,3 per 100.000 inwoners per jaar. De ziekte manifesteert zich meestal in patiënten tussen 50-60 jaar, iets meer bij vrouwen dan bij mannen. Bij 50-60% van de ET patiënten kan een JAK2 V617F mutatie aangetoond worden, bij 30% een CALR mutatie en bij 3% een MPL mutatie. Ongeveer 12% van de patiënten heeft geen van deze 3 mutaties (tripel negatief). Swerdlow 2017 De richtlijn is reeds eerder geactualiseerd vanwege herziening van de diagnostische criteria in 2016 en de richtlijnen van European Leukemia Net (ELN) Arber 2016, Barbui 2018 De richtlijn is grotendeels gebaseerd op deze aanbevelingen. De huidige herziening is vanwege nieuwe WHO criteria en tekstuele afstemming met de andere MPN richtlijnen.
Deze richtlijn is bedoeld ter optimalisering van de diagnostiek, behandeling en poliklinisch vervolgvan ET toepasbaar in alle Nederlandse ziekenhuizen (geen echelonering van toepassing).
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling enbegeleiding van patiënten met ET, zoals internist-hematologen, internist-oncologen, internisten, etc.
De richtlijn werd beoordeeld en becommentarieerd door de navolgende leden van de werkgroep:
Totstandkoming
Voor het ontwikkelen van de richtlijn is in 2017 de richtlijnwerkgroep MPN van de CML/MPN werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met MPN. Het betreft hierbij een aanpassing/actualisatie van de reeds bestaande richtlijn uit 2018.
Op voorstel van de richtlijnbeheerder dr. P.A.W. te Boekhorst heeft de richtlijnwerkgroep deconceptrichtlijnen per e-mail en fysieke bijeenkomsten becommentarieerd en aangepast. Deuitgangsvragen werden hierbij besproken en aanbevelingen gemaakt.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Procedure voor commentaar en autorisatie
Een conceptversie van de richtlijn werd op 04-09-2023 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Er is door de leden van de NVvH wel gebruik gemaakt van de commentaarronde. De richtlijn werd op 19-12-2023 door de HOVON-CML/MPN-werkgroep inhoudelijk vastgesteld en ter autorisatie gestuurd naar de Nederlandse Vereniging voor Hematologie (NVvH). Het bestuur van de NVvH heeft de richtlijn op XX-XX-XXXX geautoriseerd.
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van deaanbevelingen.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder deprofessionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
De leden van de richtlijncommissie hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen [zie bijlage – Code KNAW/KNMG] ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties ofinstellingen die in verband staan met het onderwerp van de richtlijn. Een overzicht hiervan kunt u bij hetsecretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
|
|
Belangen |
|
dr. P.A.W. te Boekhorst, internist-hematoloog/transfusiespecialist |
Novartis, Celgene (sprekersgeld), Abbvie (internationale adviesraad) KWF (onderzoeksgeld) |
|
dr. S. Kersting, internist-hematoloog |
Geen |
|
dr. R. Raymakers, internist-hematoloog |
Geen |
|
dr. N.P.M. Schaap, internist-hematoloog |
Onderzoeksgeld: Bristol Myers Squibb, Novartis, Abbvie, ZonMW, KWF |
|
dr. M.A. de Witte, internist-hematoloog |
Geen |
|
dr. M. Wondergem, internist-hematoloog |
Novartis Steering Committee MPN Trial |
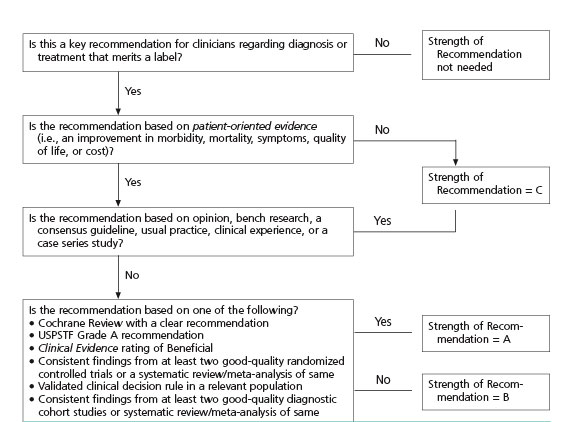
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast wordt er eentoelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de websites van de NVvH (www.hematologienederland.nl) en HOVON (www.hovon.nl).
De patiëntenorganisatie voor deze categorie patiënten is de MPN-stichting. Vertegenwoordigers van de MPN-stichting hebben zitting in de richtlijn werkgroep. Het bestuur is over de conceptrichtlijngeïnformeerd en in staat gesteld te reageren op de inhoud van deze richtlijn.
Aanbevelingen:
Aanbevelingen:
Aanbevelingen:
Aanbevelingen:
Aanbevelingen:
Aanbevelingen:
Het gebruik van ropeginterferon alfa-2b (Besremi®) tijdens de zwangerschap wordt niet geadviseerd omdat er onvoldoende data beschikbaar zijn.
Aanbevelingen
Tabel 2: Diagnostische criteria WHO 2022Khoury 2022
|
Major criteria |
|
|
Minor criterium |
|
|
Diagnose ET |
|
|
Onderbouwing
Om de diagnose volgens WHO criteria te stellen is onderzoek van bloedbeeld en moleculair onderzoek noodzakelijk in combinatie met een beenmergonderzoek (Tabel 2). Hiermee kan een onderscheidgemaakt worden tussen ET en (pre-)fibotische myelofibrose.Khoury 2022 Indien er bij bloedonderzoek aleen moleculaire driver mutatie (JAK2, CALR, MPL mutatie) gevonden is en er is een geïsoleerdetrombocytose zonder indicatie voor het starten van cytoreductieve therapie, kan overwogen worden het beenmergonderzoek uit te stellen.
Aangezien het risico op trombotische complicaties bij ET mede afhankelijk is van cardiovasculairerisicofactoren dienen deze bij diagnose bepaald te worden.Barbui2018 Indien er een indicatie is voor het starten van cardiovasculair risico management programma kan dat ook via de huisarts plaatsvinden. Verworven von Willebrand ziekte type II (VvWD) kan voorkomen bij extreme trombocytose maar ook bij lagere trombocyten aantallen, waarbij een verminderde ratio (<0,7) van von Willbrand ristocetine activiteit ten opzichte van von Willebrand antigeen het meest voorspellend is.Tiede 2011 De werkgroep adviseert daarom in geval van verhoogde bloedingsneiging en/of indien er ingrepen met hoog bloedingsrisico verricht gaan worden VvWD uit te sluiten. De ristocetine activiteit normaliseert indien trombocytengetal wordt teruggebracht.
Ook patiënten met ET hebben vaak klachten die de kwaliteit van leven ernstig beïnvloeden. Dit kan bij diagnose en follow-up vastgelegd worden met de MPN-SAF vragenlijst.Emanuel 2012
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de World HealthOrganisation (WHO) classificatie, de Europese richtlijn (ELN) aangevuld met literatuur op basis vanexpertise van de richtlijnwerkgroep.
Referenties
Aanbevelingen
|
Risico factor |
HR |
score |
|
Leeftijd >60 jaar |
1.50 |
1 |
|
Cardiovasculaire risicofactoren |
1.56 |
1 |
|
Eerdere trombo- embolische complicatie |
1.93 |
2 |
|
JAK2V617F mutatie |
2.04 |
2 |
|
Laag risico score 0-1 Intermediar risico 2 Hoog risico ≥ 3 |
||
Onderbouwing
Patiënten met ET hebben een verhoogd risico op het optreden van trombo-embolische complicaties,veroorzaakt door meerdere factoren. Dit kan ingeschat worden met de IPSET criteria, waarbij ook deklassieke cardiovasculaire risicofactoren zoals roken, hypertensie, hypercholesterolemie en diabetesmellitus worden meegewogen (Tabel 3).Barbui 2012 Deze risico inschatting is met name behulpzaamindien er een afweging gemaakt moet worden tussen wel of niet starten van trombocyten aggregatieremming bij laag risico patiënten.
Aangezien het trombose risico met de leeftijd toeneemt, is de werkgroep, conform de ELN criteria, van mening dat alle patiënten ouder dan 60 jaar ongeacht de IPSET score behandeld moetenworden met trombocyten aggregatie remming en cytoreductieve therapie.Barbui 2018
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de Europese richtlijn.
Aanbevelingen
Vanwege het verhoogde risico op trombo-embolische complicaties is trombocyten aggregatieremming (TAR) in principe bij alle patiënten geïndiceerd. Barbui 2018 Indien er sprake is van klinische bloedingsneiging en/of VvWD (ratio van von Willbrand ristocetine activiteit ten opzichte van von Willebrand antigeen <0,7) dient dit eerst met cytoreductieve therapie behandeld te worden. In geval van VvWD en een ristocetine activiteit <0,35% is adviseert de werkgroep om trombocyten aggregatie remming te staken en te hervatten na effectieve cytoreductieve therapie. Indien patiënt om andere redenen een verhoogd risico op bloedingen heeft, moet dit worden afgewogen tegen het risico op trombose. Hierbij kan de IPSET criteria voor trombose risico (Tabel 3) behulpzaam zijn. Bij patiënten een laag trombose risico hebben vanwege jonge leeftijd, zonder cardiovasculaire risicofactoren en zonder JAK2V617F mutatie kan overwogen worden geen trombocyten aggregatieremming te starten.Barbui 2018 In een retrospectieve studie bij patiënten met CALR mutatie bleek een hogere incidentie op bloedingen en geen effect op trombose.Alvarez-Larrán 2016
Beperkte data verkregen via een studie bij patiënten met essentiële trombocytose (ET) laten zien dat tweemaal daags doseren van TAR effectiever kan zijn in vergelijking met eenmaal daags doseren. Rocca 2020 Meerdaags doseren kan echter wel leiden tot meer bijwerkingen. De werkgroep adviseert om deze reden om vooralsnog niet om standaard tot een tweemaal daagse doseringsregime over te gaan. Daarnaast zijn er beperkte data die laten zien dat een avond dosering van TAR effectiever kan zijn dan een ochtend dosering. Deze data zijn gebaseerd op in vitro onderzoek verricht bij gezonde vrijwilligers (n=12) zonder klinische eindpunten. Racca 2019 Op grond van deze data is de werkgroep van mening dat overwogen kan worden een avond dosering te adviseren in plaats van een ochtend dosering.
Bij patiënten met een indicatie voor clopidogrel moet een inschatting gemaakt worden ofdubbeltherapie met acetylsalicylzuur of carbasalaatcalcium opweegt tegen het bloedingsrisico vandeze combinatie. Er zijn onvoldoende gegevens beschikbaar over clopidogrel monotherapie bij ET.
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de Europese richtlijn,de referentielijst van deze richtlijn en expertise van de richtlijnwerkgroep.
Aanbevelingen
Vanwege het verhoogde risico op trombo-embolische complicaties dat afhankelijk is van de leeftijd van de patiënt en zijn voorgeschiedenis, is het advies te starten met cytoreductieve therapie zodra patiënt 60 jaar wordt of indien er een trombo-embolische complicatie heeft plaatsgevonden. Het doel van de therapie is het verminderen van het risico op (nieuwe) trombo-embolische complicaties door bereiken van normale aantal trombocyten.Barbui 2018 Om het risico op bloedingen te verkleinen, dient cytoreductieve therapie plaats te vinden bij patiënten met trombocyten >1500 x109/l of VvWD. Om het bloedingsrisico te verkleinen is normalisatie van trombocyten aantal niet per se noodzakelijk, zolang er complete remissie is van VvWD. Indien alleen trombocytose gerelateerde symptomen de reden zijn om te starten met therapie kan de laagst effectieve dosering cytoreductie gegeven worden. Indien er sprake is van splenomegalie bij ET bestaat een grote kans dat er overgang is naar post-ET myelofibrose en wordt BM biopt aanbevolen.
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de Europese richtlijn enexpertise van de richtlijnwerkgroep.
Aanbevelingen
Hydroxycarbamide en gepegyleerd interferon α worden beschouwd gelijkwaardige 1e lijns behandelopties.Barbui 2018 Recente data in PV suggereren dat interferon een “disease modifying effect” heeft na langdurig gebruik, lopende studies bij ET met ropegintron alfa-2b zullen hierop een antwoord geven.Gisslinger 2020 Inmiddels heeft de European Medicines Agency (EMA) ropeginterferon alfa-2b (Besremi®) goedgekeurd als monotherapie voor gebruik bij volwassenen voor de behandeling van PV zonder symptomatische splenomegalie. Dit middel is echter niet voor de behandeling van ET geregistreerd.
De keus voor 1 van beide middelen is sterk afhankelijk van individuele patiënt factoren en wensen en dient door de behandelaar samen met de patiënt genomen te worden. Een recente publicatie toonde ook een beter effect van gepegyleerd interferon op de allelic burden aan in vergelijking met hydroxycarbamide behandeling. Mascarenhas 2023 Histopathologische beenmerg responsen werden echter met hydroxycarbamide behandeling vaker waargenomen in vergelijking met gepegyleerd interferon behandeling. In deze studie werd geen verschil in het optreden van trombo-embolische complicatie dan wel ziekte progressie waargenomen. Derhalve heeft de werkgroep geen duidelijke voorkeur voor behandeling met één van deze middelen, en zal de behandelkeuze tussen gebaseerd moeten worden op individuele patiëntfactoren. Hierbij dient tevens een hogere incidentie van non-melanoma huidmaligniteiten na langdurig hydroxycarbamide gebruik in de overweging te worden meegenomen.
Gezien het bijwerkingen profiel van gepegyleerd interferon α 2a kan een startdosering van 45 microgram/week s.c. verkozen worden boven een hogere startdosering. Het optimaliseren van de doseerfrequentie van gepegyleerd interferon α 2a (Pegasys®) hangt af van effectiviteit en ondervonden bij werkingen. Verlenging van het interval (2-4 weken) bij stabiele hematologische respons kan overwogen worden. Indien patiënt intolerant is of onvoldoende respons heeft op behandeling is er uitgebreide keuze aan 2e lijns behandelingen.
Anagrelide is een goede 2e lijns mogelijkheid voor patiënten die zowel op hydroxycarbamide als gepegyleerd interferon α onvoldoende respons hebben of de noodzakelijke dosering niet verdragen.Barbui 2018 Ruxolitinib is niet geregistreerd voor ET en er zijn onvoldoende gegevens om off-label gebruik teadviseren. Een gerandomiseerde fase 2 studie liet bijvoorbeeld geen voordeel zien van het gebruik van ruxolitinib versus best-available-therapie in de 2e lijn.Harrison 2017
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de Europese richtlijnen expertise van de richtlijnwerkgroep.
Aanbevelingen (SORT C)
|
Risicofactor |
|
Trombose in voorgeschiedenis |
|
Bloeding in voorgeschiedenis |
|
Bij eerdere zwangerschap ≥3 spontane abortus binnen eerste trimester |
|
Bij eerdere zwangerschap spontane abortus in tweede of derde trimester |
|
Bij eerdere zwangerschap intra-uteriene sterfte |
|
Bij eerdere zwangerschap pre eclampsie <37 weken, intra-uteriene groei achterstand of aanwijzingen voor placentadysfunctie |
|
Bij eerdere zwangerschap bloeding of post-partum bloeding met transfusie noodzaak |
|
Vooraf of tijdens huidige zwangerschap trombocyten >1000 x 109/l |
Onderbouwing
Zwangere patiënten met myeloproliferatieve ziektes hebben meer risico op het krijgen vancomplicaties van zowel moeder als kind. Het risico hierop kan ingeschat worden op basis vanklassieke risicofactoren bij ET (zoals trombose, bloeding en trombocytose) en zwangerschap specifieke risicofactoren.Harrison 2011 (zie Tabel 4) Behandeling is erop gericht het risico te verkleinen door middel van geneesmiddelen die veilig geacht worden in de zwangerschap. In het kraambeddient tromboseprofylaxe middels hoog profylactisch LMWH gegeven te worden, tenzij er een indicatie is voor behandeling met therapeutisch antistolling.
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een expert opinionartikel over dit onderwerp.
Aanbeveling
Splanchnische veneuze trombose (SVT) is een veneuze trombo-embolie van een of meer van de abdominale venen (porta, lienalis, mesenterica, of supra-hepatische of intra-hepatische (Budd-Chiari syndroom) venen) en kan ernstige bloedingen als gevolg van portale hypertensie, splenomegalie en varices veroorzaken. Indien er sprake is van PV volgens de WHO criteria is er een indicatie voorcytoreductieve therapie op basis van het optreden van een trombo-embolische complicatie.Barbui 2018 In principe is er bij alle patiënten met SVT een indicatie voor therapeutische antistolling, maar dit dientafgewogen te worden tegen het risico op bloedingen.Riva 2012, Candeloro 2022 Bij SVT in het kader van een MPN heeft levenslange therapeutische antistolling (tenzij contra-indcatie) de voorkeur boven teruggaan op Acetylsalicylzuur 80 mg/Carbasalaatcalcium 100 mg/ dag na de initiële periode van antistolling; een systematische review laat zien dat antistolling, in combinatie met cytoreductieve therapie, het recidief risico na trombose het meest effectief verlaagd.Hamulyak2021 Er zijn onvoldoende gegevens beschikbaar om algemene aanbevelingen te doen over het toevoegen van trombocytenaggregatieremming naast therapeutische antistolling, aangezien vooral het bloedingsrisico hierdoor wordt vergroot. Bij de individuele patiënt kan dit overwogen worden in geval van een recidief trombose onder adequate antistollingstherapie en met afweging van risicofactoren voor bloeding. Ten aanzien van het gebruik van DOACs i.p.v. vitamine K antagonisten of LMWH kan het volgende gesteld worden: op basis van niet-gerandomiseerde studies lijken DOAC even effectief en veilig in het verlagen van het recidief risico na trombose als andere types antistolling (LMWH, VKA) en kunnen dus worden overwogen.Ageno 2022 Een duidelijke voorkeur voor het type antistolling is niet te geven, en dient per patiënt te worden afgewogen mede in afweging van hepatologische factoren. Ageno 2022, Candeloro 2022
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van de Europese richtlijn,een expert opinion artikel over dit onderwerp en expertise van de richtlijnwerkgroep.
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie (NVvH)
Uiterlijk in 2027 bepaalt dr. P.A.W te Boekhorst en het bestuur van de NVvH of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. Dr. P.A.W. te Boekhorst is als houder van deze richtlijn de eerstverantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevanteontwikkelingen binnen hun vakgebied.