De klassieke haarcelleukemie of hairy-cell leukemia (HCLc) is een rijpcellige chronische B cel maligniteit, gekarakteriseerd door pancytopenie vanwege beenmerginfiltratie met fibrose, splenomegalie en symptomen van vermoeidheid en infecties. Het is een zeldzame aandoening die in Nederland gemiddeld 60 keer per jaar wordt vastgesteld, 4 keer zo vaak bij mannen als bij vrouwen. De mediane leeftijd bij presentatie is 59 jaar. Dinmohamed 2017
Bij HCLc is er bijna altijd een BRAFV600E mutatie, waardoor activatie optreedt van BRAF, MEK en ERK, de zogenoemde ‘MAPK pathway’. Tiacci 2011
Variant HCL (HCLv) heeft geen BRAFV600E mutatie en wordt beschouwd als een aparte entiteit en niet in deze richtlijn besproken. (zie richtlijn Haarcellleukemie variant (HCLv))
De “Hairy cell Leukemia Foundation” heeft in 2017 op basis van een internationale conferentie een consensus richtlijn opgesteld voor diagnose en beleid bij patiënten met HCLc. Grever 2017 Dit is de belangrijkste bron waar deze richtlijn op gebaseerd is.
Richtlijn voor optimale diagnostiek, behandeling en follow-up van HCLc in dagelijkse praktijk, zoals deze in alle Nederlandse ziekenhuizen kan worden uitgevoerd (geen echelonering van toepassing).
Voor diagnostiek, behandeling en follow-up van HCLv verwijzen we naar de richtlijn Haarcellleukemie variant (HCLv).
Internisten (oncologen, hematologen)
Met medewerking van:
Met ondersteuning van beleidsmedewerker NVvH
De conceptrichtlijn is voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Geen van de leden heeft commentaar ingezonden. De richtlijn werd op 9-11-2017 door de HOVON-CLL-werkgroep inhoudelijk vastgesteld. Ten slotte is de richtlijn ter autorisatie gestuurd naar de Nederlandse Vereniging voor Hematologie. Autorisatie heeft plaatsgevonden op 14-03-2018.
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder de professionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
Diagnostiek
Uitgangsvraag
Welke diagnostiek dient verricht te worden bij verdenking HCLc?
Aanbevelingen
Uitgangsvraag
Welke diagnostiek dient verricht te worden vooraf aan therapie voor HCLc?
Aanbevelingen
Stadiëring
Uitgangsvraag
Wat zijn criteria voor symptomatische HCLc?
Aanbevelingen
Prognosticering
Uitgangsvraag
Welke onderzoeken moeten gedaan worden om prognose in te schatten bij primaire diagnose HCLc?
Aanbevelingen
Uitgangsvraag
Wat is het beleid bij asymptomatische HCLc?
Aanbevelingen
Uitgangsvraag
Wat is de eerstelijns behandeling van symptomatisch HCLc?
Aanbevelingen
Uitgangsvraag
Welke aanvullende maatregelen moeten genomen worden bij behandeling met cladribine?
Aanbevelingen
Uitgangsvraag
Wat is het doel van behandeling bij HCLc?
Aanbevelingen
Uitgangsvraag
Wat is de behandeling van een symptomatisch HCLc recidief > 2 jaar na behandeling?
Aanbevelingen
Uitgangsvraag
Wat is het beleid bij een symptomatisch HCLc recidief <2 jaar na behandeling?
Aanbevelingen diagnostiek
Aanbevelingen behandeling
Uitgangsvraag
Wat is de follow-up na behandelde HCLc?
Aanbevelingen
Aanbevelingen
Uitgangsvraag
Wat zijn patiënt specifieke aandachtspunten bij diagnostiek, behandeling en follow-up van HCL?
Aanbevelingen
Stroomdiagram behandeling
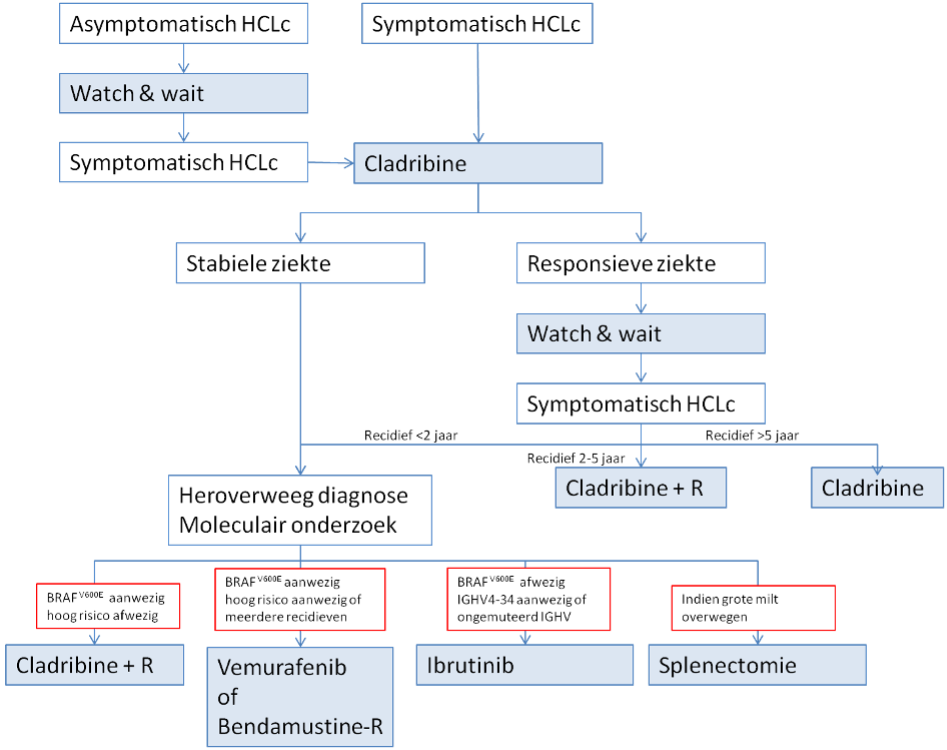
Uitgangsvraag
Welke diagnostiek dient verricht te worden bij verdenking HCLc?
Aanbevelingen
Anamnese: klachten van anemie, infecties, koorts, vermoeidheid, gewichtsverlies, klachten passend bij splenomegalie
Lichamelijk onderzoek: Lymfadenopathie (meestal afwezig), lever en milt grootte
Bloedonderzoek:
Beenmergonderzoek (alleen indien diagnose niet eenduidig op basis van perifeer bloed leukocytendifferentiatie en immunofenotypering)
Tabel 1: Immunofenotypering bij HCLc
|
Minimaal vereist |
Expressiepatroon HCLc |
|
CD45 |
positief |
|
CD5 |
negatief |
|
CD10 |
negatief |
|
CD19 |
positief |
|
CD20 |
positief |
|
CD23 |
negatief |
|
CD38 |
negatief |
|
CD11c |
positief |
|
CD25 |
positief |
|
CD 103 |
positief |
|
smIg-Kappa, smIg-Lambda |
smIg lichte keten restrictie (Kappa of Lambda) |
|
Additionele markers |
|
|
CD22 |
positief |
|
CD123 |
positief |
|
CD43 |
merendeel negatief |
|
FCM7 |
positief |
|
CD79b |
merendeel positief |
|
CD200 |
positief |
Conclusies
|
Conclusie |
Grade |
|
Immunofenotypering |
B |
|
Beenmergonderzoek alleen op indicatie |
Expert opinion |
Onderbouwing
HCLc is een diagnose die overwogen moet worden indien een patiënt zich presenteert met (opportunistische) infecties en pancytopenie. In de morfologie van het perifere bloed is er een opvallende monocytopenie en een vaak klein percentage afwijkende lymfocyten, mediane grootte met een ovale of boonvormige of niervormige kern, fijn chromatine, minder gecondenseerd dan in rijpe lymfocyt, geen nucleoli, bleek cytoplasma en harige uitsteeksels. Er is een karakteristiek immunofenotyperings patroon waarbij, indien aanwezig, de diagnose op perifeer bloed gesteld kan worden. Tabel 1 vermeldt het minimaal vereiste panel en een additioneel panel voor de immunofenotypering van rijpe B-celmaligniteiten en tevens het expressiepatroon van HCLc. De panels zijn opgesteld door de Nomenclatuurcommissie van de Stichting Kwaliteitsbewaking Medische Laboratoriumdiagnostiek (SKML), sectie Immunologische en Moleculaire Celdiagnostiek (IMCD) (zie Richtlijnen op de website www.cytometrie.nl). Uitgangspunt van deze panels is de WHO richtlijn van 2008. Swerdlow 2008 Het additionele panel betreft markers die niet essentieel zijn maar wel duidelijk toegevoegde waarde hebben.
Naast immunoglobuline lichte keten restrictie en positiviteit voor de pan-B-celmerkers CD19, CD20 (sterke expressie) en CD22 (sterk), wordt het immunofenotype van HCLc gekenmerkt door de co-expressie van CD11c (sterk), CD25, CD103, CD123 (sterk) en CD200 (sterk).Swerdlow 2008, DelGuidice 2004, Dong 2009, Stetler-Stevenson 2011, Venkataraman 2011, Jones 2012, Shao 2013, Matutes 2015, Grever 2017, Brunetti 2009, Pillai 2013 HCLc is zelden positief voor CD5, CD10, CD23, CD43 en CD38.Shao 2013, Matutes 2015 In tegenstelling tot HCLc cellen, zijn HCLv cellen vrijwel altijd negatief voor CD25, CD123 en CD200. Stetler-Stevenson 2011, Venkataraman 2011, Jones 2012, Shao 2013, Matutes 2015, Grever 2017, Pillai 2013, Robak 2011, Cornet 2014, Robak 2015, Quest 2015
Bij flowcytometrische immunofenotypering is een accurate gate-setting essentieel. HCLc cellen kunnen worden gemist indien de gate-setting niet op de juiste wijze gebeurt. In de scatter plot bevinden HCLc cellen zich deels in het gebied waar normaliter de monocyten liggen. Yasuda 2015 De lymfocytengate moet dus ruimer dan gebruikelijk worden gezet.
Indien de diagnose bij uitzondering niet gesteld kan worden op immunofenotypering van perifeer bloed, kan een beenmergonderzoek verricht worden. Ook geeft het beenmergonderzoek informatie over de mate van beenmerginfiltratie en resthematopoiese. Bij 10% is er een hypocellulair beenmerg. Het aspiraat is vaak een dry tap door de fibrose. Grever 2017 In het biopt wordt een lymfoide infiltratie gezien, variërend van meer interstitieel naar diffuus gelegen. Het ruime cytoplasma geeft het typische “gebakken ei” aspect. Verder zijn er typische “bloedmeertjes” en reticuline vervezeling met korte dikke vezeltjes. Noodzakelijke immuunhistochemische kleuringen zijn ten minste CD20, CD79a, CD3, CD5 en CyclineD1. Bij een dry tap is uitgebreidere immunohistochemische kleuringen op ‘Formalin Fixed Paraffin Embedded’(FFPE) materiaal noodzakelijk om HCL te differentiëren van andere kleincellige B-cel lymfomen met lokalisatie in het beenmerg (afhankelijk van de differentiaal diagnose bv CD10, BCL6, BCL2, CD23, CD138, Kappa/Lambda, immuunglobuline zware ketens, SOX11, LEF1) en om de diagnose HCL verder te onderbouwen (bv BRAFV600E-immuunhistochemische kleuring, AnnexineA1, CD25, CD123). Swerdlow 2017
Zoekverantwoording
Alleen voor immunofenotypering is een literatuur analyse verricht. In PubMed is tot 10 jaar terug gezocht naar Engelstalige publicaties met in de titel het trefwoord “hairy cell leuk(a)emia”. Dit leverde 411 hits op. Op basis van de abstracts zijn hieruit 19 publicaties geselecteerd waarin flowcytometrische immunofenotypering van HCL aan de orde komt. Tevens zijn de publicaties teruggezocht waar naar gerefereerd wordt in de WHO classificatie van 2008 in het hoofdstuk “Hairy cell leukaemia” onder de alinea “Immunophenotype”. Voor de overige diagnostiek is geen systematische literatuur analyse verricht, maar gebruik gemaakt van de World Health Organisation classificatie, de internationale richtlijn en expertise van de richtlijnwerkgroep.
Referenties
Uitgangsvraag
Welke diagnostiek dient verricht te worden vooraf aan therapie voor HCLc?
Aanbevelingen
Anamnese: niveau van functioneren (‘WHO performance’-score), klachten van anemie, infecties [risico op (vaak atypische) tuberculose], koorts, gewichtsverlies, klachten passend bij splenomegalie, familiair voorkomen hematologische maligniteiten en/of auto-immuunziekten
Lichamelijk onderzoek: vastleggen van grootte van milt
Bloedonderzoek:
Beeldvorming:
Conclusies
|
Conclusie |
Grade |
|
Bloedonderzoek |
C |
|
Beeldvorming |
C |
Onderbouwing
Aanvullend onderzoek is erop gericht om symptomatologie en uitgebreidheid van de ziekte in kaart te brengen. In de dagelijkse praktijk kan radiologische beeldvorming zeer beperkt blijven indien bij lichamelijk onderzoek miltgrootte goed vast te leggen is. Bepaling van de nierfunctie is belangrijk vanwege eventueel noodzakelijke dosisaanpassingen van cladribine. (https://www.bccancer.bc.ca/drug-database-site/Drug%20Index/Cladribine_monograph_1Sept2013_formatted.pdf)
Omdat chronische of actieve hepatitis B of C kan verergeren na behandeling met anti-CD20 monoklonale antistof, dient serologisch onderzoek vooraf aan behandeling met anti-CD20 monoklonale antistof verricht te worden. Grever 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van de internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Grever 2017
Uitgangsvraag
Wat zijn criteria voor symptomatische HCLc?
Aanbevelingen
Anamnese: koorts, recidiverende of ernstige infecties, klachten van splenomegalie, extreme vermoeidheid, gewichtsverlies > 10% in 6 maanden
Lichamelijk onderzoek: progressieve splenomegalie
Bloedonderzoek: Hb < 6,8 mmol/l of trombocyten < 100 x 109/l of neutrofiele granulocyten < 1,0 x 109/l
Conclusies
|
Conclusie |
Grade |
|
Bloedonderzoek |
C |
Onderbouwing
Er bestaat geen stadiumindeling voor HCLc. In de praktijk is het belangrijk onderscheid te maken tussen asymptomatisch en symptomatische HCLc. Het merendeel van de patiënten (ongeveer 90%), heeft bij diagnose een symptomatische HCLc en een behandelindicatie. Na behandeling met purine analoga wordt het merendeel van de patiënten gedurende (vele) jaren asymptomatisch. Grever 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van de internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Grever 2017
Uitgangsvraag
Welke onderzoeken moeten gedaan worden om prognose in te schatten bij primaire diagnose HCLc?
Aanbevelingen
Geen aanvullend onderzoek
Conclusies
|
Conclusie |
Grade |
|
Geen aanvullend onderzoek |
Expert opinion |
Onderbouwing
Patiënten met HCL hebben een uitstekende prognose die in Nederland gelijk is aan die van patiënten zonder HCL.Dinmohamed 2017 De werkgroep is van mening dat aanvullende moleculaire bepalingen vooraf aan behandeling en stringente remissie beoordeling na behandeling niet nodig zijn bij een standaard HCLc patiënt.
Zoekverantwoording
Er is geen systematische literatuur analyse verricht maar gebruik gemaakt van de expertise van de richtlijnwerkgroep.
Referentie
Dinmohamed 2017
Open/geplande HOVON-studies
https://www.hovon.nl/studies/studies-per-ziektebeeld/cll.html
Uitgangsvraag
Wat is het beleid bij asymptomatische HCLc?
Aanbevelingen
Vervolgen elke 3-6 maanden op criteria passend bij symptomatische HCLc
Conclusies
|
Conclusie |
Grade |
|
Wait and see bij asymptomatische HCLc |
C |
Onderbouwing
Een minderheid van 10% van de patiënten is asymptomatisch bij diagnose en kan vervolgd worden tot het ontstaan van symptomatische HCL. Grever 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van de internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Grever 2017
Uitgangsvraag
Wat is de eerstelijns behandeling van symptomatisch HCLc?
Aanbevelingen
Cladribine
Alternatief als eerste aanpak bij ernstige infecties en neutropenie:
Conclusies
|
Conclusie |
Grade |
|
Cladribine als eerstelijns behandeling |
B |
|
Interferon bij ernstige infecties en neutropenie |
C |
Onderbouwing
Behandeling met purine-analogen leidt bijna altijd tot een respons, meestal een complete remissie. Hoewel nooit direct vergeleken, lijken cladribine en pentostatine even effectief. Vanwege een gemakkelijker toedieningschema wordt cladribine het meeste gebruikt, waarbij intraveneuze of subcutane toediening gelijkwaardig zijn. Grever 2017 Cladribine geeft bij 72-98% van de patiënten een complete remissie na een kuur van 5-7 dagen.Thompson 2017
Bij infecties en ernstige neutropenie kan er een contra-indicatie zijn voor cladribine, vanwege het immuunsuppressieve effect. Grever 2017Behandeling met filgrastim leidt niet tot vermindering van infecties. Grever 2014 Behandeling met interferon alfa, eventueel in combinatie met filgrastim, kan leiden tot verbetering van bloedgetallen en controle van de infectie, waarna vervolgens behandeling met purine-analogen kan plaatsvinden. Grever 2014
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van internationale richtlijnen en expertise van de richtlijnwerkgroep.
Referentie
Grever 2017
Thompson 2017
Grever 2014
Uitgangsvraag
Welke aanvullende maatregelen moeten genomen worden bij behandeling met cladribine?
Aanbevelingen
Overweeg herpes profylaxe: valaciclovir 2dd500mg tot 6 maanden na behandeling
Overweeg pneumocystis jirovecci pneumonie (PCP) profylaxe: cotrimoxazol 1dd480mg vanaf 1 week na laatste cladribine (i.v.m. kans op huidtoxiciteit bij combinatie) tot 6 maanden na behandeling
Bestraalde bloedproducten: tot 1 jaar na behandeling
Conclusies
|
Conclusie |
Grade |
|
Valaciclovir ter preventie van herpes adimplex en herpes zoster |
C |
|
Cotrimoxazol ter preventie van PCP |
Expert opinion |
|
Bestraalde bloedproducten vanwege risico op transfusie-gerelateerde ‘graft-versus-host’ ziekte |
C |
Onderbouwing
Behandeling met cladribine geeft naast myelumsuppressie ook langdurige T-cel depletie, waarbij meestal de eerste 6 maanden het aantal CD4+ T-cellen <0,2 x10^9/l is en de mediane duur tot herstel naar normale waarde 40 maanden is. Toch komen opportunistische infecties weinig voor. Thompson 2017 Er zijn geen studies waarbij herpesprofylaxe of PCP profylaxe zijn onderzocht. Het is van belang patiënten te instrueren hoe infecties voorkomen kunnen worden en wanneer acute behandeling nodig is, zoals bij koorts en neutropenie of gordelroos.Grever2017 Om het risico op transfusie-gerelateerde ‘graft-versus-host’ ziekte door de diepe T-cel depletie als gevolg van cladribine te verkleinen is het advies bestraalde bloedproducten toe te dienen.CBO richtlijn bloedtransfusie 2011
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van internationale richtlijnen en expertise van de richtlijnwerkgroep.
Referenties
Thompson 2017
Grever 2017
CBO richtlijn bloedtransfusie 2011
Uitgangsvraag
Wat is het doel van behandeling bij HCLc?
Aanbevelingen
Induceren van een symptoomvrij interval: partiële of complete remissie op klinische parameters en bloedbeeld
Conclusie
|
Conclusie |
Grade |
|
Behandeldoel is partiële of complete remissie op klinische parameters en bloedbeeld |
Expert opinion |
Onderbouwing
Patiënten met een complete remissie na behandeling hebben de beste prognose. Echter, ook patiënten met een partiële remissie kunnen een uitstekende prognose hebben.Thompson 2017 De werkgroep is van mening dat in de dagelijkse praktijk het doel van de behandeling is om de symptomatische HCLc te wijzigen in een asymptomatische HCLc, waarbij het verkrijgen van complete remissie of minimale restziekte (minimal residual disease=MRD) geen primair doel is. Stabiele ziekte is geen acceptabele respons, omdat behandeling gestart is vanwege symptomatologie of cytopenie. Verbetering van symptomatologie, splenomegalie en perifere bloedwaardes is voldoende om effect van therapie te beoordelen. In studies zijn responsbeoordeling volgens tabel 2 noodzakelijk.Grever 2017
Tabel 2: respons beoordeling HCLc
|
Respons |
Criteria voor respons |
|
Complete remissie* |
Hb > 6.8 mmol/L, trombocyten > 100×109/L, neutrofiele granulocyten > 1,5×109/L. Normale milt bij lichamelijk onderzoek. Morfologische afwezigheid van HCL in perifeer bloed en beenmerg |
|
Complete remissie +/- MRD |
Complete remissie + op beenmergbiopt immunohistochemische beoordeling van percentage HCL infiltraten |
|
Partiële remissie |
Hb > 6.8 mmol/L, trombocyten > 100×109/L, neutrofiele granulocyten > 1,5×109/L, > 50% afname in organomegalie en > 50% afname in HCL infiltraten in beenmergbiopt |
|
Stabiele ziekte |
Geen tekenen van remissie |
|
Progressieve ziekte |
Toename van ziekte symptomen, 25% toename in organomegalie of 25% afname in perifere bloedwaardes (niet veroorzaakt door therapie) |
|
Morfologisch recidief |
Terugkeer van HCL in perifeer bloed en/of beenmerg zonder cytopenie |
|
Hematologisch recidief |
Hb < 6.8 mmol/L, trombocyten < 100×109/L, neutrofiele granulocyten <1,5×109/L |
* beenmergonderzoek niet verrichten voor 4-6 maanden na cladribine
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van internationale richtlijnen en expertise van de richtlijnwerkgroep.
Referenties
Thompson 2017
Grever 2017
Uitgangsvraag
Wat is de behandeling van een symptomatisch HCLc recidief > 2 jaar na behandeling?
Aanbevelingen
Recidief > 5 jaar na behandeling:
Recidief 2-5 jaar na behandeling:
Conclusies
|
Conclusie |
Grade |
|
Cladribine bij recidief > 5 jaar na behandeling |
C |
|
Cladribine + rituximab bij recidief 2-5 jaar na behandeling |
Expert opinion |
Onderbouwing
De duur van de eerste remissie is meestal langer dan de duur van de 2e remissie en de kans op complete remissie na recidief behandeling is minder groot dan bij eerstelijns behandeling. Grever 2017 Indien eerstelijns behandeling een responsduur van tenminste 5 jaar heeft gegeven kan deze herhaald worden. Als er een relatief vroeg recidief is (tussen 2 en 5 jaar), is de werkgroep van mening dat potentiële versterking van het therapie effect van cladribine gewenst is. Uit kleine studies blijkt dat combinatie van rituximab met purine-analogen in 1e en 2e lijn tot een hoog percentage CR leidt, met ook MRD negativiteit. Thompson 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van internationale richtlijnen en expertise van de richtlijnwerkgroep.
Referenties
Thompson 2017
Grever2017
Aanbevelingen diagnostiek
Tabel 3: immunohistochemische kleuringen beenmergbiopt
|
Minimaal vereist |
Additioneel ter onderbouwing HCLc |
|
CD20 |
Immuunhistochemische kleuring BRAFV600E |
|
CD79a |
Annexine A1 |
|
CD5 |
CD25 |
|
Cycline D1 |
CD123 |
|
|
Additioneel bij overweging andere kleincellig B cel lymfomen |
|
|
CD10 |
|
|
BCL6 |
|
|
BCL2 |
|
|
CD23 |
|
|
CD138 |
|
|
Kappa/Lambda |
|
|
Immuunglobuline zware ketens |
|
|
SOX11 |
|
|
LEF1 |
Aanbevelingen behandeling
Conclusies
|
Conclusie |
Grade |
|
Cladribine-rituximab indien snel recidief HCLc met BRAFV600E aanwezig en geen hoog risico factoren |
C |
|
Vemurafenib bij snel recidief HCLc met BRAFV600E en hoog risico factoren aanwezig |
Expert opinion |
|
Vemurafenib bij meerdere relapsen HCLc met BRAFV600E aanwezig |
Expert opinion |
|
Bendamustine –rituximab bij snel recidief HCLc met BRAFV600E en hoog risico factoren aanwezig |
Expert opinion |
|
Bendamustine –rituximab bij meerdere relapsen HCLc met BRAFV600E aanwezig |
Expert opinion |
|
Ibrutinib bij HCL waarbij BRAFV600E afwezig en IGHV4-34 aanwezig |
Expert opinion |
|
Splenectomie bij snel recidief HCLc met grote milt |
Expert opinion |
Onderbouwing
Indien er een snel recidief is opgetreden, is het belangrijk de diagnose te heroverwegen en een verklaring te vinden voor de korte remissieduur. Hoog risico kenmerken voor kortere responsduur zijn ernstige anemie of massale milt bij 1e behandeling, aanwezigheid van TP53 defecten (del(17p) of TP53 mutatie), aanwezigheid van IGHV-34 mutatie en ongemuteerde IGHV. Grever 2017 De afwezigheid van de BRAFV600E mutatie is ook een hoog risico factor. Daarom moet voor het bepalen van de BRAFV600E mutatie een gevoelige techniek worden gebruikt waarmee de mutatie in 10% of minder leukemische cellen in perifeer bloed of beenmergaspiraat kan worden aangetoond, zoals allel-specifieke PCR of next generation sequencing. Grever 2017
De moleculaire variant van HCL zonder BRAFV600E en met IGHV4-34 rearrangement of ongemuteerd IGHV heeft een klinisch agressief beloop met suboptimaal resultaat op purine-analogen.Thompson 2017 Bij deze groep suggereren preklinische data effectiviteit van ibrutinib. Sivina 2014 Er is geen standaard advies voor patiënten met HCLc met een hoog risico profiel. Grever 2017 Er is 1 studie verricht met vemurafenib in recidief en refractair HCL (met BRAFV600E), met een respons van 96%-100%.Tiacci 2015 Ook bendamustine-rituximab is effectief in recidief/refactair HCLc. Burotto 2013 Splenectomie is een palliatieve optie als er geen andere mogelijkheden zijn. Thompson 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van internationale richtlijnen, de referentielijst van de richtlijnen en expertise van de richtlijnwerkgroep.
Referenties
Grever 2017
Thompson 2017
Tiacci 2015
Sivina 2014
Burotto 2013
Uitgangsvraag
Wat is de follow-up na behandelde HCLc?
Aanbevelingen
Responsbeoordeling 4-6 maanden na behandeling:
Aanbevelingen
Indien partiële remissie of complete remissie follow-up a 3-12 maanden:
Onderbouwing
Omdat cladribine langdurige myelosupressie geeft is het van belang het effect van de behandeling pas 4-6 maanden later te beoordelen. Het beoogde resultaat van behandeling is tenminste partiële remissie. Ook bij partiële remissie kan er jarenlang asymptomatische ziekte zijn. Grever 2017 De werkgroep is van mening dat buiten studies er geen noodzaak is voor aanvullend beenmergonderzoek indien er bij anamnese, lichamelijk onderzoek en bloedonderzoek aanwijzing is voor partiële of complete remissie.
Na cladribine is er langdurige T-cel depletie, terwijl opportunistische infecties zeldzaam zijn. Er is geen standaard aanbeveling voor monitoring van het aantal CD4+ T-cellen. Grever 2017
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van de internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Grever 2017
Uitgangsvraag
Wat zijn patiënt specifieke aandachtspunten bij diagnostiek, behandeling en follow-up van HCL?
Aanbevelingen
Onderbouwing
Patiënten worden door hun ziekte geconfronteerd met nieuwe situaties waarin belangrijke beslissingen genomen dienen te worden. Als er verschillende opties voor zorgverlening mogelijk zijn, die wat betreft bijwerkingen, effectiviteit of gevolgen voor de patiënt gelijkwaardig zijn, dient de voorkeur van de patiënt meegewogen te worden. Dit gezamenlijke besluitvormingproces wordt ook wel ‘shared decision making’ of ‘samen beslissen’ genoemd, met als doel hogere patiënttevredenheid en betere uitkomst van zorg.(Shared decision making in de praktijk) Hulpmiddelen om dit besluitvormingsproces goed te laten verlopen kunnen patiëntrichtlijnen, keuzehulpen en informatie of lotgenotencontact van de patiëntenvereniging zijn.(https://www.demedischspecialist.nl/samen-beslissen) (https://www.hematon.nl/leukemie/hairy-cell+leukemie+hcl)
Het is van belang patiënten te instrueren hoe infecties voorkomen kunnen worden en wanneer acute behandeling nodig is, zoals bij koorts en neutropenie of gordelroos. Grever 2017
Patiënten met verminderde weerstand door leukemie of medicatie komen in aanmerking voor het griepvaccinatieprogramma. (https://www.snpg.nl)
Omdat het krijgen van kanker een ingrijpende verstoring in lichamelijk, emotioneel, sociaal, praktisch en levensbeschouwelijk opzicht kan geven, kan dit leiden tot problemen/distress. Daarom moet tijdig gesignaleerd worden of er sprake is van distress en/of een zorgbehoefte. De ‘Lastmeter’ (= thermometer met probleemlijst en de vraag naar verwijswens), is een instrument dat bij diagnose, en eventueel tijdens of na de behandeling kan worden ingezet om tijdig distress en zorgbehoefte vast te stellen.
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van expertise van de vertegenwoordiger van de patiëntenvereniging en de richtlijnwerkgroep.
Referenties
https://www.demedischspecialist.nl/samen-beslissen
https://www.hematon.nl/leukemie/hairy-cell+leukemie+hcl
Grever 2017
Het is niet bekend of behandeling met cotrimoxazol invloed heeft op het optreden van infecties na behandeling met cladribine en hoe lang deze behandeling zou moeten duren
Het is niet bekend of toevoeging van rituximab aan cladribine in 1e of 2e lijn leidt tot langere progressie vrije overleving
Er is geen bewijs voor wat de optimale therapie is bij snel recidief HCL
Kwaliteitsindicator diagnostiek bij diagnose
Bloedonderzoek: Hb, leukocyten, trombocyten, leukocytendifferentiatie
Immunofenotypering
Kwaliteitsindicator behandeling
eerstelijns behandeling is cladribine, tenzij een contra-indicatie
Kwaliteitsindicator bij recidief <2 jaar
Moleculaire diagnostiek (allel-specifieke PCR of next generation sequencing) BRAF V600E
op beenmergaspiraat/bloed OF immunohistochemische kleuring BRAFV600E op beenmergbiopt
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie