Grootkorrelige lymfocyten leukemie (large granular lymphocyte leukemie = LGL leukemie) is een weinig voorkomende ziekte met een indolent beloop. De classificatie van de Wereldgezondheidsorganisatie (WHO) kent sinds 2008 twee chronische LGL-aandoeningen, namelijk T-cel LGL-leukemie (T-LGL leukemie) en de chronische lymfoproliferatieve aandoening van ‘natural killer’ cellen (NK-CLPD), waarbij T-LGL leukemie de meest voorkomende entiteit is.(Swerdlow 2017) Beide aandoeningen hebben soortgelijke, klinische en biologische eigenschappen. LGL leukemie presenteert zich typisch op oudere leeftijd (gemiddeld 60 jaar) en laat meestal een indolent klinisch beloop zien.(Lamy 2017) De belangrijkste klinische kenmerken betreffen chronische neutropenie en/of anemie en hepato-/splenomegalie; verder is LGL leukemie frequent geassocieerd met auto-immuunziekten (33%) en andere maligniteiten (13%). LGL leukemie is zeldzaam, met een voor leeftijd gestandaardiseerde incidentie van 0.72 per 1.000.000 persoonsjaren en is niet verschillend voor mannen en vrouwen. (Dinmohamed 2016)
IN SAMENWERKING MET: Nederlandse Vereniging voor Hematologie, Network for Molecular Diagnostics of Hematologic Malignancies (MODHEM), Nederlandse vereniging voor cytometrie (NVC), Nederlandse Vereniging voor Hemato-Pathologie (NVHP), patiënten organisatie Hematon
SAMENSTELLING SUBWERKGROEP (ALFABETISCH)
Dr. J.K. Doorduijn, internist hematoloog, Erasmus MC Rotterdam
Dr. M. van Gelder, internist-hematoloog, MUMC+, Maastricht
Dr. S. Kersting, internist-hematoloog, Haga ziekenhuis, Den Haag
Dr. M. van der Klift, internist-hematoloog, Amphia Ziekenhuis Breda
Dr. Y. Sandberg, internist-oncoloog/hematoloog, Erasmus MC Rotterdam, Maasstad Ziekenhuis Rotterdam
Met medewerking van:
Dr. A.W. Langerak, medisch immunoloog en moleculair bioloog, Erasmus MC Rotterdam
Dr K. Hebeda, Dr. J.W Leeuwis, Dr. M.M.M.H. Huibers, Prof. Dr. D. de Jong, namens de Nederlandse Vereniging voor Hematopathologie (NVHP)
Dr. W.A.F. Marijt, Dr. ir. J. Ruinemans-Koerts, namens de Nederlandse Vereniging voor Cytometrie
Dhr Out, commissie belangenbehartiging, Stichting Hematon, Utrecht
De HOVON-CLL-werkgroep verricht studies met financiële ondersteuning van de volgende firma’s: Roche/Genentech, Janssen, Abbvie
|
|
Belangenconflict |
|
Dr. J.K. Doorduijn |
geen |
|
Dr. M. van Gelder |
Vergoedingen voor consulting van Advisory Board: Janssen, Roche, Gilead, Celgene, Abbvie |
|
Dr. S. Kersting |
Vergoeding voor consulting van Advisory Board: Novartis, Gilead, Abbvie |
|
Dr. M. van der Klift |
geen |
|
Dr. Y. Sandberg |
geen |
Gezien de zeldzaamheid van de diagnose en het ontbreken van gerandomiseerde studies is er geen bewijs voor superioriteit van een specifiek behandelschema of behandelduur.
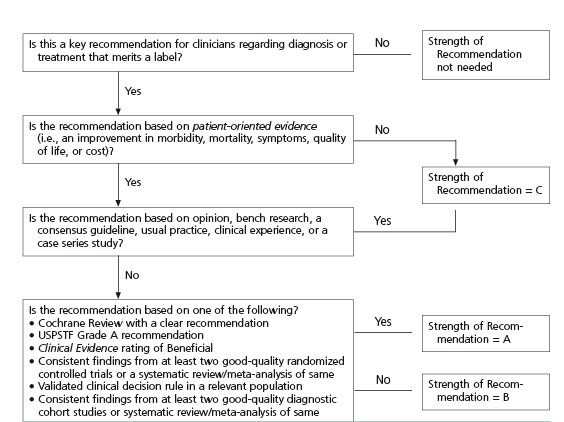
De conceptrichtlijn is voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Circa [] respondenten maakten van deze mogelijkheid gebruik. Alle commentaren werden vervolgens beoordeeld en verwerkt door de werkgroep. De richtlijn werd op [] door de HOVON-CLL-werkgroep inhoudelijk vastgesteld. Ten slotte is de richtlijn ter autorisatie gestuurd naar de Nederlandse Vereniging voor Hematologie.
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder de professionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
Diagnostiek
Welke diagnostisch onderzoek dient verricht te worden bij verdenking LGL leukemie?
Aanbevelingen
Anamnese: klachten van anemie, infecties, koorts, vermoeidheid, klachten passend bij splenomegalie, klachten passend bij auto-immuun aandoeningen (met name artritis)
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt, gewrichtsonderzoek (artritis aanwezig), huidafwijkingen (passend bij systeemziekte)
Bloedonderzoek:
Hb, leukocyten, trombocyten, manuele leukocytendifferentiatie
Nierfunctie, leverfunctie, immuunglobulines, directe antiglobuline-test
Serologie hepatitis B, hepatitis C, HIV
Reuma factor, antinucleaire antistoffen, bezinking
Immunofenotypering perifeer bloed (tabel 1)
Indien klonaliteitsonderzoek gewenst is bij verdenking T-LGL:
Moleculair onderzoek:
TCRB en TCRG genherschikkingsonderzoek, eventueel op experimentele basis mutatieanalyse met behulp van next generation sequencing (NGS) (o.a. STAT3/STAT5b)
Indien verdenking op NK-CLPD:
Immunofenotypering met KIR antistoffen (zo nodig materiaal opsturen naar MUMC) of via CD94/HLA-DR analyse (zo nodig materiaal opsturen naar Erasmus MC)
Op indicatie indien diagnose niet eenduidig of indien differentiaal diagnose aplastische anemie/ puur rode bloedcellen anemie of MDS:
Beenmergonderzoek: cytomorfologie, immunofenotypering, histologie en immuunhistochemie.
Op indicatie bij aanvullende vragen:
x-thorax (indien aanwijzing voor infectie of andere longafwijking)
echo abdomen (indien aanwijzingen voor hepato-/splenomegalie, maar niet bij lichamelijk onderzoek betrouwbaar vast te stellen)
CT thorax-abdomen (indien aanwijzingen voor lymfadenopathie, maar niet bij lichamelijk onderzoek betrouwbaar vast te leggen)
Stadiëring
Wanneer is er een behandelindicatie voor een LGL leukemie?
Aanbevelingen
Anamnese: recidiverende infecties, B-symptomen, symptomatische anemie, symptomatische auto-immuunziekte
Bloedonderzoek: Hb < 6,2 mmol/l of trombocyten < 50 x 109/l of neutrofiele granulocyten < 0,5x 109/l
Prognosticering
Welke onderzoeken moeten gedaan worden om prognose in te schatten bij LGL leukemie?
Aanbevelingen
Geen aanvullend onderzoek
Behandeling
Wat zijn behandelopties bij LGL leukemie?
Aanbevelingen
1e keus: Methotrexaat 10mg/m2/week, tenminste 4 maanden (geen foliumzuur noodzakelijk).
Indien na 4 maanden onvoldoende respons overweeg andere therapie.
Indien partiele respons overweeg continueren gedurende 1 jaar.
Indien complete hematologische respons overweeg staken 1 maand later.(Loughran 2015)
Alternatief, met name bij anemie of puur rode bloedcellen anemie of na onvoldoende respons op methotrexaat: Cyclofosfamide 100mg/dag, tenminste 4 maanden. Bij respons continueren gedurende 8-12 maanden of tot 1 maand na complete hematologische respons. (Loughran 2015)
Alternatief: Ciclosporine 5-10 mg/kg/ dag, verdeeld over 2 doses, met streefspiegel 200-350 ng/mL). (Batiwalla 2003) Bij respons continueren of overweeg staken 1 maand na complete hematologische respons.
Wat is het doel van behandeling bij LGL leukemie?
Aanbevelingen
Verminderen van symptomatologie en verbetering van bloedbeeld
Welke aanvullende maatregelen kunnen genomen worden bij symptomatische LGL leukemie?
Aanbevelingen
(peg) filgrastim of prednison 1mg/kg bij problematische neutropenie
Prednison 20-60mg/dag bij auto-immuun symptomen (bijv reumatoide artritis)
Welke behandelmogelijkheden zijn er voor patiënten met LGL leukemie die refractair zijn op zowel methotrexaat, cyclofosfamide en ciclosporine of dit niet verdragen?
Aanbevelingen
Purine analogen (cladribine, fludarabine, bendamustine)
Splenectomie bij patiënten met symptomatische splenomegalie
Wat is de follow-up bij LGL leukemie?
Aanbevelingen
Controlefrequentie: elke 3-12 maanden
Anamnese: recidiverende infecties, B-symptomen, symptomatische anemie, symptomatische auto-immuunziekte
Bloedonderzoek: Hb < 6,2 mmol/l of trombocyten < 50 x 109/l of neutrofiele granulocyten < 0,5x 109/l
Wat zijn patiënt specifieke aandachtspunten bij diagnostiek, behandeling en follow-up van LGL leukemie?
Aanbevelingen
Uitleg over diagnose, prognose en behandeling, eventueel verwijzen naar patiëntenrichtlijn en Hematon
Uitleg over meerdere behandelopties en gezamenlijke besluitvorming over behandelplan
Uitleg over infectiepreventie en wanneer noodzaak is voor acute behandeling, zoals bij koorts en neutropenie
Advies griepvaccinatie
Aandacht voor eventuele psychosociale problematiek, overweeg de ‘Lastmeter’ bij diagnose, na start behandeling en na afsluiten van behandeling
Aanbevelingen
Anamnese: klachten van anemie, infecties, koorts, vermoeidheid, klachten passend bij splenomegalie, klachten passend bij auto-immuun aandoeningen (met name artritis)
Lichamelijk onderzoek: vastleggen van grootte van lymfklieren, lever en milt, gewrichtsonderzoek (artritis aanwezig), huidafwijkingen (passend bij systeemziekte)
Bloedonderzoek:
Hb, leukocyten, trombocyten, manuele leukocytendifferentiatie
Nierfunctie, leverfunctie, immuunglobulines, directe antiglobuline-test
Serologie hepatitis B, hepatitis C, HIV
Reuma factor, antinucleaire antistoffen, bezinking
Immunofenotypering perifeer bloed (tabel 1)
Indien klonaliteitsonderzoek gewenst is bij verdenking T-LGL:
Moleculair onderzoek:
TCRB en TCRG genherschikkingsonderzoek, eventueel op experimentele basis mutatieanalyse met behulp van next generation sequencing (NGS) (o.a. STAT3/STAT5b)
Indien verdenking op NK-CLPD:
Immunofenotypering met KIR antistoffen (zo nodig materiaal opsturen naar MUMC) of via CD94/HLA-DR analyse (zo nodig materiaal opsturen naar Erasmus MC)
Op indicatie indien diagnose niet eenduidig of indien differentiaal diagnose aplastische anemie/ puur rode bloedcellen anemie of MDS:
Beenmergonderzoek: cytomorfologie, immunofenotypering, histologie en immuunhistochemie.
Op indicatie bij aanvullende vragen:
x-thorax (indien aanwijzing voor infectie of andere longafwijking)
echo abdomen (indien aanwijzingen voor hepato-/splenomegalie, maar niet bij lichamelijk onderzoek betrouwbaar vast te stellen)
CT thorax-abdomen (indien aanwijzingen voor lymfadenopathie, maar niet bij lichamelijk onderzoek betrouwbaar vast te leggen)
Tabel 1: Rijp T-cel / NK-cel panel immuunfenotypering
|
Minimaal vereiste markers: |
Typisch expressiepatroon voor LGL leukemie |
|
CD45 (lymfocyten) |
positief |
|
TdT |
negatief |
|
CyCD3 (indien SmCD3-) |
positief |
|
CD1 |
negatief |
|
CD2 (T-cel) |
positief |
|
CD3 (T-cel) |
positief |
|
CD4 (T-cel) |
zelden positief |
|
CD5 (T-cel) |
afwezige of verminderde expressie |
|
CD7 (T-cel) |
afwezige of verminderde expressie |
|
CD8 (T-cel) |
positief |
|
CD16 |
positief |
|
CD25 |
negatief |
|
CD56 |
Negatief |
|
CD57 (T-cel) |
positief |
|
Additionele markers: |
|
|
CD10 |
negatief |
|
CD30 |
negatief |
|
CD52 |
positief |
|
TCR alfa-beta* |
positief |
|
TCR gamma-delta* |
zelden positief |
|
*(indien SmCD3+) |
|
|
Markers voor verdere bevestiging LGL: |
|
|
CyPerforine |
positief |
|
CyGranzyme |
positief |
|
CD45RA |
positief |
|
CD45RO |
negatief |
|
CD27 |
negatief |
Conclusies
|
Conclusie |
Grade |
|
Algemeen onderzoek |
Expert opinion |
|
Immunofenotypering |
B |
|
Beenmergonderzoek alleen op indicatie |
B |
|
Moleculaire diagnostiek |
B |
|
Beeldvorming |
Expert opinion |
Onderbouwing
LGL leukemie is een diagnose die overwogen moet worden indien een patiënt zich presenteert met cytopenie, recidiverende infecties en/of een auto-immuun ziekte. Ook maligniteiten zijn met LGL leukemie geassocieerd. (tabel 2) In de morfologie van het perifere bloed worden middelgrote, ronde of ovale lymfocyten met excentrische nuclei met gecondenseerd nucleair chromatine zonder duidelijke nucleolus en met een opvallend ruim cytoplasma met daarin een aantal azurofiele granulae gezien. Deze kunnen echter morfologisch niet onderscheiden worden van normale reactieve cytotoxische lymfocyten. In zeldzame gevallen gaat de klonale lymfocytose niet gepaard met de typische morfologie of is er een relatief lage LGL telling (<1×109/L). Aanvullend beenmergonderzoek kan dan in de meerderheid van de gevallen infiltratie van LGL aantonen, meestal in een sinusoidaal of interstitieel patroon. De cytopenie is geen verdringing, maar uiting van auto-immuniteit. Het beenmerg is namelijk meestal normo- tot hypercellulair. Beenmergonderzoek kan ook van toegevoegde waarde zijn indien puur rode bloedcellen anemie (pure red cell aplasia=PRCA), aplastische anemie of myelodysplastisch syndroom (MDS) als oorzaak van anemie wordt vermoed, al dan niet in combinatie met LGL.(Lamy 2017) Daarnaast kunnen LGL proliferaties, meestal hyperplasieën, voorkomen bij indolente B-cel non-Hodgkin lymfomen zoals chronische lymfatische leukemie/kleincellig lymfocytair lymfoom of hairy cel leukemie en in de context van iatrogene immuunderegulaties (o.a. lenalidomide). Geadviseerd wordt immuunhistochemisch te kleuren tegen ten minste CD3, CD4, CD8, CD56 en CD57, waarbij daarnaast CD2, CD5, CD7, TIA1 en/of GranzymeB, en B-cel markers (zoals CD20, CD79a) aangeraden worden.(Swerdlow 2017) LGL leukemie toont soms verlies van CD5 en/of CD7. B-cel markers kunnen een reactief lymfoid infiltraat accentueren, of een onderliggend laaggradig B-cel non-Hodgkin lymfoom aantonen. CD56 is meestal negatief in LGL leukemie, en indien positief, veelal bij negatieve CD57, dient een chronisch lymfoproliferatieve ziekte van NK-cellen overwogen te worden.
Bij immunofenotypering van de LGL is het belangrijk onrijpe T-cel neoplasmata uit te sluiten. De panels zijn opgesteld door de Nomenclatuurcommissie van de Stichting Kwaliteitsbewaking Medische Laboratoriumdiagnostiek (SKML), sectie Immunologische en Moleculaire Celdiagnostiek (IMCD) (zie Richtlijnen op de website www.cytometrie.nl). Uitgangspunt van deze panels is om vast te stellen dat het om een rijpcellig T cel neoplasma gaat. De T cel definiërende markers membraan CD3 en/of cytoplasmatisch CD3 zijn hiervoor essentieel. Om een onrijpe/voorloper T cel maligniteit uit te sluiten wordt gebruik gemaakt van CD1 en TdT. De andere markers worden gebruikt om andere rijpcellige T cel neoplasmata te herkennen dan wel om verlies van markers vast te stellen wat een ondersteuning kan bieden om de verdenking op een rijpcellig T cel neoplasma uit te spreken.(Swerdlow 2017)
Met immunofenotypering is geen definitieve monoclonaliteit vast te stellen. Indien dit gewenst is dient aanvullend moleculair onderzoek plaats te vinden met behulp van TCRB en TCRG genherschikkingsonderzoek op bloed, beenmergaspiraat of beenmergbiopt.
NK-CLPD is een diagnose die alleen bij duidelijke toename van NK-cellen in bloed of beenmerg vermoed kan worden. Er is geen standaard test om monoklonaliteit vast te stellen. Door middel van immunofenotypering met antistoffen tegen killer-cell immunoglobulin-like receptor (KIR) of een combinatie van CD94 en HLA-DR kan monoklonaliteit waarschijnlijker gemaakt worden.(Barcena 2015)
LGL proliferaties ontstaan uit normale cytotoxische LGL cellen die 10-15% van de mononuclaire cellen in het bloed vormen (~85% van NK-cel origine, ~15% van T-cel origine). De LGL lymfoproliferaties vormen een ziektespectrum, variërend van polyklonale, geactiveerde celpopulaties, via “T-cell clonopathy of undetermined significance” (TCUS) en chronische lymfoproliferaties van NK-cel origine, tot klinisch evidente LGL leukemie. Hoewel de etiologie en pathofysiologie van LGL lymfoproliferaties nog (grotendeels) onbekend zijn, bestaat er een hypothese dat chronische antigene stimulatie een rol speelt in de pathogenese van deze ziekte. Dit past bij het effector fenotype en de “skewed” TCR expressiepatronen zoals die worden gezien in T-LGL leukemie patiënten. Daarnaast wordt verondersteld dat secundaire moleculaire events noodzakelijk zijn voor transformatie van de chronisch gestimuleerde LGL cellen, zoals de beschreven STAT3 / STAT5b mutaties in m.n. CD8+ T-LGL en NK-LGL proliferaties.(Jerez 2012, Koskela 2012) Deze genetische afwijkingen komen echter maar in een deel van de patiënten (STAT 3 in 25% tot 78% van T-LGL en 30% tot 48% in NK-CLPD) voor en kunnen dus niet de hele LGL leukemogenese verklaren.(Lamy 2017) Moleculaire bepaling van STAT3 of STAT5b mutaties spelen dan ook nog geen rol bij diagnose.
Tabel 2Lamy2017
|
Ziekten geassocieerd met LGL leukemie |
Frequentie (%) |
|
Solide maligniteit |
4-10 |
|
Auto-immuun cytopenie |
5 |
|
B-cel maligniteiten |
5 |
|
Auto-immuun ziekte/systeemziekte (RA*) |
10-20 (10-18) |
|
MDS^ |
3-10 |
|
overig |
<1 |
|
* RA=reumatoide artritis ^MDS=myelodysplastisch syndroom |
|
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een recente internationale review, de referentieslijst van de review en expertise van de richtlijnwerkgroep.
Referentie
Aanbevelingen
Anamnese: recidiverende infecties, B-symptomen, symptomatische anemie, symptomatische auto-immuunziekte
Bloedonderzoek: Hb < 6,2 mmol/l of trombocyten < 50 x 109/l of neutrofiele granulocyten < 0,5x 109/l
Conclusies
|
Conclusie |
Grade |
|
Anamnese |
C |
|
Bloedonderzoek |
C |
Onderbouwing
Er bestaat geen stadiumindeling voor LGL. In de praktijk is het belangrijk te onderscheiden wanneer er een behandelindicatie is. Iets minder dan de helft van de patiënten heeft ergens in het ziektebeloop behandeling nodig.(Dinmohamed 2016) Indicaties voor behandeling zijn ernstige neutropenie of milde neutropenie met recidiverende infecties, symptomatische of transfusie-afhankelijke anemie of geassocieerde auto-immuunziekte met behandelindicatie.(Lamy 2017, NCCN 2015)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een publicatie van IKNL registratie, een recente internationale review, een internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Aanbevelingen
Geen aanvullend onderzoek
Conclusies
|
Conclusie |
Grade |
|
Geen aanvullend onderzoek |
Expert opinion |
Onderbouwing
LGL leukemie wordt beschouwd als een indolente ziekte. Patiënten met LGL leukemie hebben een goede prognose. (Dinmohamed 2016) Ziekte gerelateerd overlijden worden met name veroorzaakt door ernstige infecties, die bij < 10% van de patiënten voorkomen.(Lamy 2017)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht maar gebruik gemaakt van de expertise van de richtlijnwerkgroep.
Referentie
Open/geplande HOVON-studies
Aanbevelingen
1e keus: Methotrexaat 10mg/m2/week, tenminste 4 maanden (geen foliumzuur noodzakelijk).
Indien na 4 maanden onvoldoende respons overweeg andere therapie.
Indien partiele respons overweeg continueren gedurende 1 jaar.
Indien complete hematologische respons overweeg staken 1 maand later.(Loughran 2015)
Alternatief, met name bij anemie of puur rode bloedcellen anemie of na onvoldoende respons op methotrexaat:Cyclofosfamide 100mg/dag, tenminste 4 maanden. Bij respons continueren gedurende 8-12 maanden of tot 1 maand na complete hematologische respons. (Loughran 2015)
Alternatief: Ciclosporine 5-10 mg/kg/ dag, verdeeld over 2 doses, met streefspiegel 200-350 ng/mL). (Batiwalla 2003) Bij respons continueren of overweeg staken 1 maand na complete hematologische respons.
Conclusies
|
Conclusie |
Grade |
|
Methotrexaat |
B |
|
Cyclofosfamide |
B |
|
Ciclosporine |
B |
Onderbouwing
Immuunsuppressieve therapie is de standaard behandeling voor LGL leukemie gebaseerd op het idee dat LGL leukemie veroorzaakt wordt door continu geactiveerde cytotoxische lymfocyten. Uit retrospectieve studies komen uiteenlopende responsen zonder een duidelijk verschil tussen methotrexaat, cyclofosfamide of ciclosporine, met een mediane respons van 50%, variërend van 21% tot 85%.Complete responsen komen minder vaak voor, 21% bij methotrexaat, 33% voor cyclofosfamide en minder dan 5% voor ciclosporine. Gemiddelde responsduur met methotrexaat is 21 maanden, echter recidieven komen vaak voor. Patiënten die onvoldoende respons hebben op methotrexaat kunnen met cyclofosfamide vaak alsnog een respons krijgen. Patiënten die op zowel methotrexaat als cyclofosfamide geen respons hebben kunnen alsnog op ciclosporine responderen. Methotrexaat en ciclosporine kunnen gecontinueerd worden zolang het goed verdragen wordt, met controle op hepatitis en longtoxiciteit voor methotrexaat en nierfunctie en hypertensie voor ciclosporine. Indien er complete hematologische respons optreedt kan overwogen worden te staken.(Loughran 2015) Cyclofosfamide dient niet langdurig gebruikt te worden vanwege het potentiele risico op ontwikkeling van maligniteiten.(Lamy 2017 NCCN guidelines 2015, Sanikommu 2018) Aangezien het doel van de behandeling met methotrexaat het uitschakelen van de cytotoxische lymfocyten is, is rescue met foliumzuur niet nodig.
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een recente internationale review, recente internationale studies, een internationale richtlijn en expertise van de richtlijnwerkgroep.
Referentie
Uitgangsvraag
Wat is het doel van behandeling bij LGL leukemie?
Aanbevelingen
Verminderen van symptomatologie en verbetering van bloedbeeld
Conclusie
|
Conclusie |
Grade |
|
Verminderen van symptomatologie en verbetering van bloedbeeld |
Expert opinion |
Onderbouwing
Vanwege het indolente beloop van LGL leukemie is het nastreven van complete remissie geen behandeldoel. Stabiele ziekte is geen acceptabele respons, omdat behandeling gestart is vanwege symptomatologie of cytopenie. In de dagelijkse praktijk kan op klinische parameters responsbeoordeling plaatsvinden, waarbij verbetering van symptomatologie en perifere bloedwaardes voldoende zijn om effect van therapie te beoordelen. Responsbeoordeling op zijn vroegst na 4 maanden behandeling verrichten. In studies zijn responsbeoordeling volgens tabel 3 noodzakelijk.(Lamy2011)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een internationale review en expertise van de richtlijnwerkgroep.
Referentie
Tabel 3: Responsbeoordeling LGL leukemie 4 maanden na start therapie(Lamy 2011)
|
Respons |
Criteria voor respons |
|
Complete immunologische remissie |
Hematologische complete remissie + normale flowcytometrie |
|
Complete moleculaire remissie |
Hematologische complete remissie + geen T-cel kloon met polymerasekettingreactie |
|
Hematologische complete remissie |
Hb > 7,5 mmol/L, trombocyten >150×109/L, neutrofiele granulocyten > 1,5×109/L , lymfocyten > 4×109/L en in differentiatie normaal aantal LGL |
|
Hematologische partiële remissie |
Verbetering van bloedwaardes maar niet voldoen aan complete remissie (zoals neutrofiele granulocyten > 0,5×109/L of vermindering van transfusie noodzaak) |
|
Behandelfalen |
Geen van bovengenoemde responsen na 4 maanden behandeling |
|
Progressieve ziekte |
Verergering van cytopenie of organomegalie |
Aanbevelingen
(peg) filgrastim of prednison 1mg/kg bij problematische neutropenie
Prednison 20-60mg/dag bij auto-immuun symptomen (bijv reumatoide artritis)
Conclusies
|
Conclusie |
Grade |
|
(peg) filgrastim bij problematische neutropenie |
C |
|
Prednison bij problematische neutropenie |
C |
|
Prednison bij auto-immuun symptomen |
C |
Onderbouwing
Bij problematische neutropenie kan behandeling met (peg) filgrastim het aantal neutrofiele granulocyten snel laten stijgen. Ook kan prednison 1 mg/kg effectief zijn bij ernstige immuun-neutropenie. Behandeling van de LGL leukemie blijft dan toch geïndiceerd. Monotherapie met prednison heeft weinig respons op LGL leukemie, maar kan wel reumatische klachten verminderen. (Lamy2017) De dosering kan dan in overleg met de reumatoloog worden afgestemd.
Zoekverantwoording
Er is geen systematische literatuur analyse verricht, maar gebruik gemaakt van een recente internationale review en expertise van de richtlijnwerkgroep.
Referentie
Aanbevelingen
Purine analogen (cladribine, fludarabine, bendamustine)
Splenectomie bij patiënten met symptomatische splenomegalie
Conclusies
|
Conclusie |
Grade |
|
Purine analogen |
C |
|
Splenectomie |
C |
Onderbouwing
Vanwege de zeldzaamheid van de diagnose en het ontbreken van klinische studies zijn er geen bewezen behandelopties bij een LGL leukemie die niet of onvoldoende reageert op methotrexaat, cyclofosfamide en ciclosporine. Goede remissies bij behandeling met purine analogen (cladribine, fludarabine, bendamustine) zijn beschreven, waarbij gestreefd is naar korte behandelingen (1-3 kuren) om toxiciteit te beperken. Splenectomie bij patiënten met splenomegalie geeft bij ongeveer de helft van de patiënten een tijdelijke respons.(Lamy2017)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een recente internationale review en expertise van de richtlijnwerkgroep.
Referentie
Aanbevelingen
Controlefrequentie: elke 3-12 maanden
Anamnese: recidiverende infecties, B-symptomen, symptomatische anemie, symptomatische auto-immuunziekte
Bloedonderzoek: Hb < 6,2 mmol/l of trombocyten < 50 x 109/l of neutrofiele granulocyten < 0,5x 109/l
Conclusies
|
Conclusie |
Grade |
|
Controle frequentie |
Expert opinion |
|
Anamnese |
C |
|
Bloedonderzoek |
C |
Onderbouwing
LGL leukemie is een indolente ziekte die alleen behandeld hoeft te worden bij symptomatologie of cytopenie. Infectieuze complicaties als gevolg van neutropenie zijn het grootste risico. Indien patiënt behandeld wordt met immuunsuppressieve behandeling dienen controles gericht op bijwerkingen van deze medicatie plaats te vinden (hepatitis en longtoxiciteit voor methotrexaat en nierfunctie en hypertensie voor ciclosporine).(Lamy 2017)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van een recente internationale review en expertise van de richtlijnwerkgroep.
Referentie
Aanbevelingen
Uitleg over diagnose, prognose en behandeling, eventueel verwijzen naar patiëntenrichtlijn en Hematon
Uitleg over meerdere behandelopties en gezamenlijke besluitvorming over behandelplan
Uitleg over infectiepreventie en wanneer noodzaak is voor acute behandeling, zoals bij koorts en neutropenie
Advies griepvaccinatie
Aandacht voor eventuele psychosociale problematiek, overweeg de ‘Lastmeter’ bij diagnose, na start behandeling en na afsluiten van behandeling
Onderbouwing
Patiënten worden door hun ziekte geconfronteerd met nieuwe situaties waarin belangrijke beslissingen genomen dienen te worden. Als er verschillende opties voor zorgverlening mogelijk zijn, die wat betreft bijwerkingen, effectiviteit of gevolgen voor de patiënt gelijkwaardig zijn, dient de voorkeur van de patiënt meegewogen te worden. Dit gezamenlijke besluitvormingproces wordt ook wel ‘shared decision making’ of ‘samen beslissen’ genoemd, met als doel hogere patiënttevredenheid en betere uitkomst van zorg.(https://www.zorginzicht.nl/kennisbank/Paginas/Richtlijnen-en-shared-decision-making-in-de-praktijk.aspx#platform) Hulpmiddelen om dit besluitvormingsproces goed te laten verlopen kunnen patiëntrichtlijnen, keuzehulpen en informatie of lotgenotencontact van de patiëntenvereniging zijn.( https://www.demedischspecialist.nl/samen-beslissen)(Hematon.nl)
Het is van belang patiënten te instrueren hoe infecties voorkomen kunnen worden en wanneer acute behandeling nodig is, zoals bij koorts en neutropenie of gordelroos.
Patiënten met verminderde weerstand door leukemie of medicatie komen in aanmerking voor het griepvaccinatieprogramma. (https://www.snpg.nl)
Omdat het krijgen van kanker een ingrijpende verstoring in lichamelijk, emotioneel, sociaal, praktisch en levensbeschouwelijk opzicht kan geven, kan dit leiden tot problemen/distress. Daarom moet tijdig gesignaleerd worden of er sprake is van distress en/of een zorgbehoefte. De ‘Lastmeter’ (= thermometer met probleemlijst en de vraag naar verwijswens), is een instrument dat bij diagnose, en eventueel tijdens of na de behandeling kan worden ingezet om tijdig distress en zorgbehoefte vast te stellen. (https://www.oncoline.nl/detecteren-behoefte-psychosociale-zorg)
Zoekverantwoording
Er is geen systematische literatuuranalyse verricht, maar gebruik gemaakt van expertise van de vertegenwoordiger van de patiëntenvereniging en de richtlijnwerkgroep.
Referentie
https://www.demedischspecialist.nl/samen-beslissen
https://www.oncoline.nl/detecteren-behoefte-psychosociale-zorg
© 2022. Alle rechten voorbehouden