Terug naar het richtlijnenoverzicht
Richtlijn voor de diagnostiek, behandeling en follow-up van het marginale zone lymfoom (MZL)
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van het MZL bij volwassenen. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een MZL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, en tracht een betere uniformiteit van behandeling en daarmee een betere kwaliteit van zorg en uiteindelijk betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij, het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een MZL, zoals internist-hematologen, internist-oncologen, radiotherapeuten en algemeen internisten, maar ook radiologen, maag-darm-leverartsen, chirurgen oncologieverpleegkundigen, IKNL-consulenten etc.
Voor het ontwikkelen van de richtlijn is in 2018 een werkgroep ingesteld. De werkgroep leden zijn door HOVON of de betrokken wetenschappelijke verenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 1 jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn en bestond uit:
De werkgroepleden (en overige betrokkenen) hebben schriftelijk verklaard dat ze in de laatste vijf jaar geen (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. De belangenverklaringen kunt u bij het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
Methode ontwikkeling
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht door de werkgroepleden. In een veel gevallen is afgezien van een systematische search met als mogelijke redenen: het ontbreken van voldoende gepubliceerde studies, de beschikbaarheid van recente internationale evidence-based richtlijnen of systematische reviews.
Werkwijze
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline en Cochrane. Aanvullend werd gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs.
De conceptrichtlijn is op 8 juli 2021 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Er werd van deze mogelijkheid geen gebruik gemaakt.
Dr. J. Mol heeft als afgevaardigde van Hematon de richtlijn beoordeeld vanuit patiëntenperspectief.
Marginale zone lymfomen (MZL) vormen een heterogene groep van indolente lymfomen, die gezamenlijk zo’n 10-15% van de non Hodgkin-lymfomen uitmaken in de Westerse wereld. De gemiddelde leeftijd bij diagnose is 60 jaar, en het MZL wordt iets meer bij vrouwen dan bij mannen gevonden. De incidentie van het MZL lijkt te zijn toegenomen in de afgelopen jaren, vermoedelijk t.g.v. verbeterde diagnostiek. De incidentie van H. pylori geassocieerde MALT lymfomen van de maag is afgenomen[1].
Voordat het lymfoom klinisch manifest wordt, kunnen soms al klonale B cellen in het bloed gevonden worden. Dit werd recent beschreven als ‘klonale B cel lymfocytose van marginale zone origine’ (CBL-MZ)[2].
In de WHO classificatie wordt onderscheid gemaakt tussen 3 typen MZL[3]
1) Extranodaal marginale zone lymfoom van mucosa-geassocieerd lymfoïd weefsel (eMZL; MALT lymfoom). Deze groep beslaat ca 2/3 van alle MZL en kunnen ontstaan op elke extranodale locatie, meestal in de context van chronische antigene stimulatie t.g.v. infecties of auto-immuun aandoeningen. De maag is de meest aangedane plek, gevolgd door de adnexa van de ogen, de longen en de speekselklieren. Andere typen eMZL, zoals dat van de schildklier en dura, zullen vanwege het extreem zeldzame voorkomen niet in deze richtlijn behandeld worden.
2) Splenisch marginale zone lymfoom (sMZL), met of zonder villeuze lymfocyten. Het sMZL is zeldzaam en behelst minder dan 2% van alle lymfoïde maligniteiten (ca 20% van alle MZL). De gemiddelde leeftijd waarop de ziekte zich presenteert is 69 jaar. Meestal is er naast betrokkenheid van de milt ook betrokkenheid van bloed en/of beenmerg.
3) Nodaal marginale zone lymfoom (nMZL), met of zonder monocytoïde B cellen. Het nMZL is een zeldzaam lymfoom (2% van alle lymfomen). De mediane leeftijd van diagnose is ongeveer 60 jaar, echter er is wel een grote spreiding. De prevalentie tussen mannen en vrouwen is gelijk. De meeste patiënten presenteren zich met een stadium III of IV ziekte.
In deze richtlijn komen diagnostiek, behandeling en follow-up van deze drie typen MZL afzonderlijk aan bod. T.b.v. het primair cutane marginale zone lymfoom is een separate richtlijn in ontwikkeling.
De behoefte aan uniform beleid in Nederland, de zeldzaamheid en verscheidenheid aan varianten van dit type lymfoom, de ontwikkelingen in diagnostiek en de betrokkenheid van diverse disciplines bij de behandeling, maken een breed gedragen richtlijn noodzakelijk. Hoewel in de behandeling van het MZL vaak richtlijnen zoals die gelden voor andere typen indolent lymfoom, met name het folliculaire lymfoom, gevolgd kunnen worden, zijn er m.b.t. het MZL toch enkele specifieke vragen die separate behandeling vragen. Waar relevant wordt verwezen naar de vigerende richtlijn FL.
Bovengenoemde overwegingen waren voor de lymfoomwerkgroep aanleiding een ‘evidence based’ richtlijn te ontwikkelen voor het beleid bij het marginale zone lymfoom. Vanwege de zeldzaamheid van de ziekte, de hoge variabiliteit in klinische presentatie en het gebrek aan wetenschappelijke data, is een groot deel van de aanbevelingen en adviezen echter gebaseerd op consensus of expert opinion, veelal overgenomen uit internationale richtlijnen.
Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals. Patiënten (vertegenwoordigers) hebben de conceptversie van de richtlijn gelezen en commentaar kunnen aanleveren. De meest relevante knelpunten worden uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een MZL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. De richtlijn beoogt derhalve niet een volledig leerboek te zijn.
Hieronder vindt u een samenvatting van de aanbevelingen (n.a.v. de vooraf vastgestelde uitgangsvragen) per hoofdstuk. Verdere adviezen t.a.v. diagnostiek, prognosticering, behandeling, respons evaluatie en follow-up zijn weergegeven in de betreffende hoofdstukken en paragrafen.
Stadiëring
Uitgangsvraag 1:
Is voor de stadiëring van MZL een beenmergonderzoek noodzakelijk?
Aanbeveling(en):
Voor de stadiering van een nMZL, gedissemineerd eMZL of sMZL wordt geadviseerd altijd een beenmergaspiraat en biopt te verrichten bij primaire diagnose. Als er op grond van beeldvorming sprake is van stadium III of IV ziekte of er geen behandelindicatie is, kan hiervan worden afgezien.
Bij een lokaal eMZL of MALT lymfoom van de maag is het verrichten van een beenmergaspiraat en biopt niet strikt noodzakelijk.
Uitgangsvraag 2:
Hoe wordt het MALT lymfoom van de maag gestadieerd?
Aanbeveling(en):
Voor het stellen van de diagnose MALT lymfoom van de maag dienen er multipele biopten te worden genomen van slokdarm-maag overgang, maag en duodenum volgens de zogenaamde ‘gastric mapping’ procedure.
Het minimale aantal biopten dat uit macroscopische afwijkingen moet worden genomen is 10. Uit macroscopisch normaal weefsel moeten 4 (antrum) resp. 2 (fundus) biopten genomen worden.
Een EUS kan worden overwogen als de uitbreiding op CT niet goed beoordeelbaar is, als er twijfel is over de diagnose en/ of als er via EUS een regionale klier aangeprikt moet worden voor diagnostiek.
Behandeling
Uitgangsvraag 3:
Wat is de eerstelijnsbehandeling van H. pylori positief MALT lymfoom van de maag?
Aanbeveling(en):
Voor het H. pylori positieve MALT lymfoom van de maag geldt voor alle stadia: H. pylori eradicatie.
Responsevaluatie vindt plaats na 3 maanden met feces H. pylori antigeen test en gastroscopie.
NB Stadium IIE of IV ziekte met symptomen: laagdrempelig starten (dus eventueel ook al eerder dan 3-6 maanden na H. pylori eradicatie) met radiotherapie of systeemtherapie gezien de lage responspercentage op alleen H. pylori eradicatie (zie ook verder).
Uitgangsvraag 4:
Wat is de eerstelijns systemische behandeling voor het MALT lymfoom van de maag voor patiënten die in aanmerking komen voor systemische therapie?
Aanbeveling(en):
R-chloorambucil is de eerste keuze, vanwege de hogere EFS en PFS dan die van beide middelen afzonderlijk.
Bij een agressiever beloop kan combinatie therapie zoals beschreven voor het nodale MZL toegepast worden (R-CVP, R-Bendamustine)
Voor patiënten voor wie behandeling met chemo-immunotherapie niet mogelijk is, is behandeling met rituximab monotherapie (of chloorambucil monotherapie) een goed alternatief.
Uitgangsvraag 5:
Wat is de eerstelijnsbehandeling van het sMZL?
Aanbeveling(en):
Vanwege de goede responskans en minimale toxiciteit heeft rituximab monotherapie de voorkeur als eerstelijnsbehandeling van het sMZL boven splenectomie.
Splenectomie is relatief gecontraïndiceerd bij hoog risico ziekte met uitgebreide tumorload en bij patiënten met een verhoogd operatie risico. Daarentegen is het een optie voor fitte patiënten die cytopenieën hebben ten gevolge van hypersplenisme.
Toevoeging van chemotherapie aan rituximab dient alleen overwogen te worden indien patiënten een hoog risico profiel hebben (3-4 risicofactoren FIL score, zie ‘Prognose’).
Bij een respons op inductiebehandeling met immunotherapie kan onderhoudsbehandeling met rituximab gedurende één tot twee jaar worden overwogen omdat het de progressievrije overleving verlengt.
Uitgangsvraag 6:
Wat is de eerstelijnsbehandeling van uitgebreid stadium nMZL?
|
Asymptomatisch/ non-bulky |
|
|
Watch & wait |
|
|
Symptomatisch/ behandelindicatie |
|
|
Immunochemotherapie |
R-CVP R-bendamustine of R-CHOP |
|
Radiotherapie |
4 Gy |
|
Onderhoudsbehandeling |
Niet aanbevolen |
Samenvatting:
De diagnostiek bij MZL bestaat uit het pathologisch onderzoek dat benodigd is om de diagnose te stellen, en uit onderzoek om de uitgebreidheid van de ziekte in kaart te brengen (stadiëring, tabel 1).
Tabel 1. Aanbevolen onderzoek voor diagnose en stadiëring
|
Anamnese |
B-symptomen* |
|
Lichamelijk onderzoek |
Algemeen lichamelijk onderzoek Performance status, lymfeklieren, lever, milt, en extranodale ziektelokalisaties |
|
Primaire diagnostiek |
Histologisch (excisie) biopt lymfklier of aangedane extranodale lokalisatie voor morfologie en immuunhistochemie Als chirurgisch biopt niet mogelijk: (naald)biopten |
|
Laboratorium |
Bloedbeeld en differentiatie, evt. immunofenotypering Kreatinine, leverenzymen, urinezuur, LDH; evt. IgA, IgG, IgM, M-proteïne, ß2M Op indicatie: zwangerschapstest |
|
Serologie |
Hepatitis B,C Op indicatie: HIV |
|
Beeldvorming |
CT-hals-thorax-abdomen (diagnostisch; met contrast) Op indicatie: FDG-PET/CT scan |
|
Beenmergonderzoek |
Bij sMZL en nMZL; op indicatie: bij eMZL Aspiraat voor morfologie, evt. immunofenotypering Biopt voor morfologie en immuunhistochemie |
|
Vóór behandeling |
Op indicatie: ECG, echocardiografie of MUGA scan (voorafgaand aan anthracyclines) Op indicatie: counseling fertiliteit** |
|
Extra bij sMZL |
Directe antiglobuline test Op indicatie: cryoglobuline, van Willebrand factor, etc. |
|
Extra bij eMZL |
|
|
MALT lymfoom maag |
Gastroduodenoscopie met biopten volgens ‘gastric mapping’ protocol EUS (als uitbreiding op standaard CT onderzoek niet goed beoordeelbaar) H. pylori diagnostiek (IHC), als negatief: evt serologie/ feces antigeen Optioneel: moleculaire diagnostiek (t(11;18)) |
|
OAMZL*** |
MRI met contrast van de orbita PCR Chlamydia Psitacci op diagnosemateriaal Onderzoek/ serologie syndroom van Sjögren |
|
BALT****lymfoom |
Bronchoscopie + lavage |
|
eMZL speekselklieren |
Onderzoek/ serologie syndroom van Sjögren MRI/CT met contrast van hoofd/hals gebied |
* B symptomen: onverklaarde koorts > 38oC, gewichtsverlies >10% in 6 mnd., nachtzweten;
** zie ook: Fertiliteitsbehoud bij vrouwen met kanker;
*** ocular adnexal marginal zone lymphoma;
**** bronchial associated lymphoid tissue
De primaire diagnostiek omvat het onderzoek dat nodig is de diagnose MZL te stellen en andere lymfoomtypen uit te sluiten. De diagnose marginale zone lymfoom wordt gesteld op basis van integratie van het klinisch beeld en histologisch onderzoek. Dit onderzoek omvat, volgens de systematiek van de WHO classificatie, histologisch onderzoek, immuunfenotypering/ immuunhistochemie en, waar relevant, moleculair/ cytogenetisch onderzoek[3].
Bij diagnostiek van een lymfklier betreft dit bij voorkeur een volledige lymfklier óf een ruim incisiebiopt.
Richtlijnen van de ‘European Society of Medical Oncology’ (ESMO) en de ‘National Comprehensive Cancer Network’ (NCCN) [4] [5] als ook de WHO [3] onderschrijven het belang van een histologisch biopt voor de diagnose MZL. Bij lastig te bereiken lymfklieren of bij extranodale lokalisatie is een excisie vaak niet haalbaar of wenselijk. In dat geval worden meerdere echo- of CT-geleide dikke naald biopten, laparoscopische of endoscopische biopten geadviseerd.
Hoewel lymfoomcellen kunnen worden aangetoond in cytologische puncties, en bepaalde eigenschappen m.b.v. flowcytometrie bevestigd kunnen worden, is histologie van essentieel belang voor het stellen van een classificerende diagnose. Bij twijfel, of discrepantie tussen kliniek en histologische diagnose, verdient het de aanbeveling om een nieuw biopt te nemen of een lymfklier/ extranodale afwijking te extirperen, eventueel op geleide van een FDG-PET/CT-scan (meest FDG-avide laesies benaderen).
De hoeveelheid materiaal voor histologisch onderzoek varieert van kleine biopten tot resecties van (delen van) organen. Morfologisch is er infiltratie door kleine tot middelgrote B-cellen met een wisselende hoeveelheid cytoplasma. Vaak is er aantasting van klierbuizen met vorming van lymfo-epitheliale laesies, maar dit is niet vereist voor de diagnose en is ook niet geheel specifiek voor eMZL; het kan ook gezien worden bij reactieve aandoeningen.
Immuunhistochemisch onderzoek moet verricht worden om de diagnose van B-cel lymfoom te bevestigen en andere lymfoomtypen uit te sluiten. Hierbij wordt gebruik gemaakt van ten minste de volgende markers: CD20, CD10, BCL6, CD3, CD5, CD23, cycline D1. Onderzoek naar lichte keten expressie (kappa, lambda) is aanbevolen om de diagnose lymfoom en de aanwezigheid van plasmacel differentiatie te ondersteunen.
In het geval van MALT lymfoom van de maag is onderzoek naar de aanwezigheid van H. pylori aangewezen.
Onderzoek naar de aanwezigheid van H. pylori
De relatie tussen een chronische infectie met Helicobacter pylori en het MALT lymfoom van de maag werd voor het eerst beschreven in 1991 [6]. Hoewel de overgrote meerderheid van het MALT-lymfoom van de maag is geassocieerd met een chronische Helicobacter pylori infectie kunnen ook andere Helicobacter soorten, zoals bijv. H.heilmannii de oorzaak van een MALT-lymfoom zijn [7]. De aanwezigheid van H.pylori kan worden aangetoond in de gewone HE-coupes. In geval van twijfel kan aanvullende (immuno-)histochemie worden gebruikt.
De toegevoegde waarde van fecesonderzoek naar H.pylori-antigeen bij niet aantoonbaar zijn van H.pylori in biopten is onzeker. (Deze test wordt namelijk vooral gebruikt bij dyspeptische klachten indien geen endoscopie wordt verricht). Ook voor serologisch onderzoek is de toegevoerde waarde dubieus.
Recent antibiotica gebruik, en het minder dan 2 weken voor een endoscopie gebruik van protonpomp-remmers moeten worden uitgesloten voordat geconcludeerd wordt dat er sprake is van een H. pylori negatief MALT lymfoom van de maag [8, 9]. Aanvullend serologisch onderzoek kan in deze situatie worden overwogen.
De diagnose sMZL wordt bij voorkeur gesteld op een splenectomie preparaat, maar een splenectomie zal niet vaak verricht worden. De diagnose zal dan gesteld worden op basis van typische cytomorfologie in bloed en beenmerg, een passend immuunfenotype en intrasinusoidale ligging in het beenmergbiopt in de juiste klinische context (splenomegalie, meestal geen lymfadenopathie) [10].
sMZL toont in de milt een micronodulaire infiltratie van de witte pulpa met daarnaast infiltratie van de rode pulpa met invasie van sinussen.
Betrokkenheid van het bloed in sMZL is frequent. De circulerende lymfocyten tonen ronde kernen met gecondenseerd chromatine en basofiel cytoplasma met korte villi.
Het beenmerg is vrijwel altijd aangedaan, maar de mate van beenmerginfiltratie is variabel. Hierbij is typisch sprake van intrasinusoidale infiltratie met bijkomende nodulaire infiltratie bij ziekteprogressie. Immuunhistochemie met B-cel markers (bijv. CD20) helpt om subtiele beenmerginfiltratie te detecteren. Het minimale immuunhistochemische panel is gelijk aan dat bij eMZL (zie boven). Immuunhistochemisch onderzoek dient om de diagnose van B-cel lymfoom te bevestigen, om de mate van infiltratie te bepalen en om andere lymfoomtypen uit te sluiten.
Flowcytometrie is een waardevolle techniek om een diagnose van sMZL te ondersteunen en andere lymfoomtypen uit te sluiten.
Nodaal MZL is per definitie beperkt tot lymfklieren met eventueel beenmerglokalisatie. Ter bevestiging van de diagnose en ter uitsluiting van andere vormen van lymfoom geldt hetzelfde immuunhistochemische panel als beschreven onder eMZL. Beenmerg betrokkenheid wordt gezien in 30-60% van de patiënten.
Een echt nMZL moet onderscheiden worden van de andere twee typen MZL. Het nMZL is soms ook moeilijk te onderscheiden van een lymfoplasmacytair lymfoom. In lastige gevallen wordt het onderscheid tussen nMZL en lymfoplasmacytair lymfoom gemaakt door integratie van de bevindingen bij klinisch en beeldvormend onderzoek (aanwezigheid lymfadenopathie), beenmergonderzoek, laboratoriumonderzoek (M-proteïne) en moleculaire diagnostiek; de aanwezigheid van een MYD88 L265P mutatie kan de diagnose lymfoplasmacytair lymfoom steunen, maar is niet geheel specifiek hiervoor en ook beschreven in nMZL. Hetzelfde lijkt te gelden voor mutaties in het CXCR4 gen [11].
Chromosomale translocaties, leidend tot activatie van het NF-kappa B pad, zijn aanwezig in een deel van de eMZL, waarbij de frequentie afhankelijk is van de lokalisatie. In het geval van eMZL van de maag is een associatie beschreven tussen de aanwezigheid van een t(11;18)(q21;q21)BIRC3/MALT1 en ongevoeligheid voor H. pylori eradicatie [12]. Karyotypering of FISH o.a. naar t(11;18) kan worden verricht op het biopt maar is bij het initiële onderzoek niet direct geïndiceerd, aangezien dit geen directe consequenties heeft voor het beleid. Hoewel de aanwezigheid van deze translocatie in H. pylori positieve MALT lymfomen van de maag geassocieerd is met een lagere kans op respons op eradicatietherapie, is er vaak wel voldoende tijd om het effect van de behandeling af te wachten. In sMZL en nMZL komen deze translocaties niet voor. In de overgrote meerderheid van de situaties kan de diagnose eMZL gesteld worden zonder translocatie-onderzoek. In lastige gevallen kan translocatie-onderzoek helpen de diagnose eMZL te ondersteunen.
Bij de differentiaaldiagnose tussen MZL en andere lymfoomtypen kan translocatie-onderzoek helpen, bijvoorbeeld BCL2 translocatie-onderzoek ter ondersteuning van een diagnose van folliculair lymfoom.
Voor zowel eMZL, sMZL als nMZL zijn in de afgelopen jaren studies verricht waarbij terugkerende mutaties worden gevonden. Vooralsnog heeft mutatiedetectie echter geen rol in de dagelijkse praktijk ten aanzien van diagnose, prognosestelling of bepaling van therapie.
Indien op basis van morfologie en immuunfenotypering geen onderscheid gemaakt kan worden tussen lymfoom of een reactieve aandoening kan immuunglobuline (IG) clonaliteitsonderzoek gebruikt worden.
In zowel eMZL, sMZL als nMZL kan transformatie naar een agressievere vorm van lymfoom optreden, meestal diffuus grootcellig B-cel lymfoom (DLBCL) [13-15]. Histologische transformatie wordt gedefinieerd als de ontwikkeling van velden grote (blastaire) B-cellen in een (eerder) gediagnosticeerd indolent lymfoom met morfologische en immuunfenotypische veranderingen die passend zijn bij een agressief non Hodgkin lymfoom (meestal een diffuus grootcellig B-cellymfoom, maar ook Hodgkin en Burkitt).
De gemiddelde tijd tot het optreden van histologische transformatie varieert van 1-15 jaar. In series wordt een risico op histologische transformatie van 3-5% benoemd, waarbij er geen verschil bestaat tussen de diverse varianten van marginale zone lymfoom m.b.t. het risico op transformatie[16, 17].
Bij het ontwikkelen van één of meer van de volgende symptomen moet aan transformatie van het MZL worden gedacht:
De diagnose moet gesteld worden op basis van een histologisch biopt. Omdat niet alle lymfoomlokalisaties getransformeerd hoeven te zijn, is er kans op sampling error. De FDG-PET-scan kan hierbij behulpzaam zijn; het biopteren van de lymflier/ lokalisatie met hoogste FDG opname geeft de meeste kans op het aantonen van transformatie (expert opinion)[18, 19].
Net als bij de primaire diagnose heeft het verwijderen van een gehele lymfklier/ extranodale lokalisatie of een ruim incisiebiopt de voorkeur. Indien de lokalisatie die de meeste FDG opname laat zien slecht bereikbaar is, kan eventueel getracht worden met (liefst meerdere) dikke naaldbiopten tot een diagnose te komen.
In uitzonderingssituaties kan de diagnose eventueel op basis van een cytologische punctie gesteld worden.
Algemeen
Het MZL wordt gestadieerd volgens het gereviseerd stageringssysteem voor primair nodale lymfomen (Tabel 2) [20]. Voor het extranodale MZL wordt veelal een aparte stadiëring gebruikt (zie (zie voor stadiëring specifieke subtypes de paragrafen verderop in dit hoofdstuk).
Tabel 2. Gereviseerd stageringssysteem voor primair nodale lymfomen (Lugano criteria).
|
Stadium |
Definitie |
|
I (IE) |
Eén lymfeklier of groep aangrenzende lymfeklieren IE: één extranodale lokalisatie zonder lymfeklier betrokkenheid |
|
II (IIE) |
Twee of meer lymfeklierstations aan dezelfde zijde van het diafragma IIE: stadium I of II door lymfeklier uitbreiding met beperkte dichtbijgelegen extranodale betrokkenheid |
|
III |
Twee of meer lymfklieren aan beide zijden van het diafragma met eventueel een gelokaliseerde extralymfatische lokalisatie of ingroei in omliggende weefsel vanuit deze lymfeklierstations, miltaantasting of beide |
|
IV |
Bijkomende niet aansluitende extranodale betrokkenheid |
Extranodale betrokkenheid: Betrokkenheid van extralymfatisch weefsel aan één kant van het diafragma door beperkte directe uitbreiding van een naastgelegen nodale locatie wordt aangeduid als extranodale uitbreiding en weergegeven door de letter E. De E categorie kan ook een discrete enkele extranodale lesie aanduiden die past bij uitbreiding van een regionale betrokken lymfeklier. Uitgebreidere extranodale ziekte, b.v. multipele extranodale lesies, worden geduid als stadium IV. Een enkele extralymfatische locatie als de enige locatie van ziekte hoort als stadium IE te worden aangegeven.
Nota Bene:
1. De volgende anatomische lymfeklier regio’s worden als een enkele regio beschouwd:
2. De longhilus wordt als een aparte regio beschouwd. Dus betrokkenheid van het mediastinum en een hilus lokalisatie betekent stadium II.
3. Hilus klieren worden als gelateraliseerd beschouwd en als aan beide kanten positief dus stadium II.
4. Tonsillen, Ring van Waldeyer en milt worden gezien als nodaal (lymfklier betrokkenheid).
Dit heeft tot doel de uitgebreidheid van de lymfadenopathie en eventuele orgaaninfiltratie vast te stellen. Om die reden is dan ook diagnostisch CT-onderzoek van hals, thorax en abdomen (i.v. en oraal contrast) aanbevolen (i.p.v. echografie of conventioneel röntgenonderzoek). Beeldvormend onderzoek dient bij diagnose, maar zeker vóór en na afronding van behandelingen plaats te vinden.
M.b.t. indicaties voor een FDG-PET/CT-scan gelden in principe de aanbevelingen zoals voor het folliculair lymfoom (link).
Uitgangsvraag:
Is voor de stadiëring van MZL een beenmergonderzoek noodzakelijk?
Aanbeveling(en):
Voor de stadiering van een nMZL, gedissemineerd eMZL of sMZL wordt geadviseerd altijd een beenmergaspiraat en biopt te verrichten bij primaire diagnose. Als er op grond van beeldvorming sprake is van stadium III of IV ziekte of er geen behandelindicatie is, kan hiervan worden afgezien.
Bij een lokaal eMZL of MALT lymfoom van de maag is het verrichten van een beenmergaspiraat en biopt niet strikt noodzakelijk.
Inleiding:
Beenmergbetrokkenheid bij marginale zone lymfoom komt in <10% van de gevallen voor. Voor specifieke entiteiten ligt dit percentage echter heel anders. Zo is er bij nodaal marginale zone lymfoom tot 70% beenmergbetrokkenheid en is er bij splenisch marginale zone lymfoom vrijwel altijd beenmergbetrokkenheid.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
C |
Voor de stadiëring van een nodaal marginale zone lymfoom, gedissemineerd eMZL of splenisch marginale zone lymfoom wordt geadviseerd altijd een beenmergaspiraat en biopt te verrichten bij primaire diagnose (expert opinion/ consensus). |
|
C |
Bij een lokaal eMZL of MALT lymfoom van de maag is het verrichten van een beenmergaspiraat en biopt niet strikt noodzakelijk (expert opinion/ consensus). |
Samenvatting literatuur:
Resultaten: Bij het ontbreken van vergelijkende studies baseren we ons op internationale richtlijnen, waarbij het al dan niet verrichten van beenmergdiagnostiek gebeurt volgens de adviezen bij andere non-hodgkin lymfomen [4, 10, 21, 22].
Indien beeldvormend onderzoek al minimaal een stadium III laat zien, de patiënt asymptomatisch is en (nog) geen behandeling behoeft (en het perifere bloedbeeld geen beenmerg-verdringing suggereert), kan van beenmergdiagnostiek worden afgezien, aangezien de uitkomst ervan in die situatie geen consequenties heeft. In alle andere gevallen dient beeldvormend onderzoek aangevuld te worden met beenmergonderzoek, inclusief aspiraat, histologisch biopt en immunofenotypering d.m.v. immuno-histochemie (en/ of flowcytometrie).
Daarnaast is de algemene consensus dat bij lokaal eMZL of MALT lymfoom van de maag de kans op beenmergbetrokkenheid dusdanig klein is, dat bij een gebrek aan behandelconsequenties het beenmergonderzoek achterwege gelaten kan worden. De kans op beenmergbetrokkenheid bij non-gastrisch eMZL is wat hoger, en geassocieerd met een slechtere prognose. In die gevallen is beenmergonderzoek dus wel te overwegen (NCCN en ESMO richtlijn)[23].
Bewijskracht van de literatuur. level 2, consistentie n.v.t.
Uitgangsvraag:
Hoe wordt het MALT lymfoom van de maag gestadieerd?
Aanbeveling(en):
Voor het stellen van de diagnose MALT lymfoom van de maag dienen er multipele biopten te worden genomen van slokdarm-maag overgang, maag en duodenum volgens de zogenaamde ‘gastric mapping’ procedure.
Het minimale aantal biopten dat uit macroscopische afwijkingen moet worden genomen is 10. Uit macroscopisch normaal weefsel moeten 4 (antrum) resp. 2 (fundus) biopten genomen worden.
Een EUS kan worden overwogen als de uitbreiding op CT niet goed beoordeelbaar is, als er twijfel is over de diagnose en/ of als er via EUS een regionale klier aangeprikt moet worden voor diagnostiek.
Inleiding:
Een goede stadiëring is belangrijk voor de keuze van therapie voor het MALT lymfoom van de maag.
Voor het MALT lymfoom van de maag wordt veelal een apart stageringssysteem gebruikt (Tabel 3)[24, 25]. Deze stagering is ontwikkeld in de periode voorafgaand aan het gebruik van endo-echografie en neemt de diepte van mucosa betrokkenheid niet mee. Tot op heden zijn er echter geen revisies beschikbaar en ontbreekt consensus over eventuele aanpassingen in dit stageringssysteem.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
B |
Vanwege multifocaal voorkomen zijn multipele biopten geïndiceerd[26-28] |
|
C |
Aantal biopten uit afwijkend resp. normale mucosa[28, 29] |
|
B |
EUS superieur t.o.v. CT-onderzoek[30, 31] |
|
C |
EUS in specifieke situaties geïndiceerd (expert opinion) |
Samenvatting literatuur:
Resultaten:De basis voor een ‘gastric mapping’ procedure is het multifocaal voorkomen van het MALT lymfoom van de maag, voor het eerst beschreven na uitvoerig histopathologisch onderzoek van resectie preparaten en later ook in endoscopische studies[26-28].
Zeker als op grond van het endoscopisch beeld (of bij CT-onderzoek of EUS) de maagwand verdikt is, vaak met grove plooien, dienen de biopten voldoende diep te reiken voor een goede typering van het lymfoom [27, 29]. Het minimale aantal biopten dat uit macroscopische afwijkingen moet worden genomen is 10. Het aantal biopten van macroscopisch normale mucosa wordt minder duidelijk omschreven in deze richtlijnen. Vier biopten van respectievelijk antrum en corpus en 2 uit de fundus lijkt in ieder geval redelijk [28, 29].
Endo-ultrasonografie (EUS) lijkt superieur t.o.v. de CT-scan in het detecteren van (regionale) lymfklierbetrokkenheid en in het kaart brengen van de wand dikte en verschillende lagen van de maag [30]. In een vergelijkende studie bleek EUS superieur ook aan een CT-scan met watervulling van de maag [31].
Bewijskracht van de literatuur. level 2-3, consistentie n.v.t.
Overwegingen:
Allereerst dient echter onderscheid te worden gemaakt tussen een (heftige) gastritis, vaak Helicobacter pylori geassocieerd, waarbij het kan helpen biopten van verschillende plekken in de maag te vergelijken. Niet alleen om de uitgebreidheid en eventueel mutifocaal voorkomen van het MALT lymfoom van de maag zijn meerdere biopten nodig, maar vooral ook om het juiste type lymfoom vast te stellen, waarbij vooral het onderscheid tussen een (laaggradig) MALT lymfoom en een grootcellig B-cel lymfoom, in het verleden ook wel hooggradig MALT lymfoom genoemd, van belang is. Het is belangrijk grote neoplastische B-cellen te onderscheiden van resten van reactieve kiemcentra, waarvoor immunohistochemische kleuringen behulpzaam kunnen zijn (CD10, bcl-6 en bcl-2 kleuringen). In het verleden was er regelmatig een discrepantie tussen het type lymfoom vastgesteld in het biopt en het definitieve type lymfoom in het resectiepreparaat, maar een resectie voor een maaglymfoom is heden ten dage vrijwel nooit meer nodig [32].
M.b.t. de EUS: de inter-observer variatie kan groot zijn en niet elk centrum heeft ervaring met EUS. Bovendien hebben de bevindingen bij een EUS geen consequenties voor de behandeling; stadium I t/m IIE worden hetzelfde behandeld. Voor het diagnosticeren van stadium IV volstaat een CT-scan. Derhalve is de aanbeveling voor de stadiering van het MALT lymfoom van de maag een diagnostische CT hals-thorax-abdomen met i.v. contrast. Een EUS kan worden overwogen als de uitbreiding op de CT-scan niet goed beoordeelbaar is, als er twijfel is over de diagnose en/ of als er via EUS een regionale klier aangeprikt moet worden voor diagnostiek [4, 29, 30, 33].
Zoals boven beschreven kan met een conventionele CT worden volstaan voor de stadiëring van het MALT lymfoom van de maag. In sommige centra wordt een CT-scan volgens maagprotocol gebruikt, zoals deze bij het stadiëren van andere maligniteiten van de maag ook wel wordt toegepast. Een CT-scan volgens maagprotocol wordt door de werkgroep niet routinematig geadviseerd voor de stadiëring van het MALT lymfoom van de maag.
Tabel 3. Stageringssysteem voor gastro-intestinale lymfomen (Lugano classification) [23, 24, 34].
|
Stadium |
Definitie |
|
I |
Beperkt tot de tractus digestivus (1 solitaire laesie of meerdere niet aaneengesloten laesies) |
|
II |
Uitbreiding naar abdominaal vanuit de primaire laesie II(1) lokale nodale betrokkenheid (perigastrische klieren) II(2) nodale betrokkenheid buiten perigastrische klieren (maar nog regionaal) |
|
IIE |
Doorbraak door de mucosa met ingroei in nabijgelegen orgaan of weefsel met of zonder abdominale klieren |
|
IV |
Extranodale betrokkenheid of bijkomende nodale betrokkenheid boven het diafragma |
Het primair extranodaal marginale zone lymfoom van de oculaire adnexa (conjunctivae, traanklieren, orbita en oogleden) oftewel ocular adnexal Marginal Zone Lymphoma (OAMZL) is een zeldzame aandoening (gerapporteerde incidentie in de VS 0.28/100.000; ongeveer 1-2% van alle NHL)[35, 36]. Het grootste deel van de patiënten (> 75%) heeft stadium IE bij diagnose; dus enkel betrokkenheid van de oculaire adnexa waarvan ongeveer 2/3 orbitaal en 1/3 conjunctivaal. In de meerderheid van de gevallen (85-90%) is de ziekte unilateraal. De mediane leeftijd bij diagnose is 62 jaar, en vrouwen (55%) zijn iets vaker aangedaan mannen[37]. Zoals ook andere MZL komt OAMZL vaker voor bij mensen met een auto-immuun ziekte, vooral Sjögren syndroom.
Primair wordt gestadieerd volgens Ann-Arbor. Een gedetailleerdere stadiering van het lokale proces kan gedaan worden middels een specifiek voor deze diagnose ontworpen TNM classificatie: ‘TNM-based AJCC staging system for ocular adnexal lymphomas’[38]. Dit laatste heeft op dit moment geen klinische consequenties en is vooral ontworpen voor gebruik in onderzoeksverband.
Naast stadiëring middels diagnostische CT hals-thorax-abdomen met i.v. contrast en een beenmergonderzoek, moet lokale stadiëring middels een MRI orbita met i.v. contrast plaatsvinden. Ook wordt aangeraden om te testen op virale hepatitis (gezien associatie met name hepatitis C infectie) en om in het diagnose materiaal te testen op Chlamydia psitacci infectie.
Primair extranodaal marginale zone lymfoom van de long, oftewel Bronchial Associated Lymphoid Tissue (BALT) lymfoom, is een zeldzame aandoening (de precieze incidentie van BALT lymfoom is niet bekend, alle longlymfomen samen zijn slechts 0.4% van alle NHL).
Het grootste deel van de patiënten (86%) heeft stadium I-II bij diagnose. De mediane leeftijd bij diagnose is 62 jaar. Bij diagnose hebben de meeste patiënten geen B-symptomen (85%), een lage IPI (95%) en 55% heeft geen pulmonale klachten. De prognose wat betreft overleving is erg goed, de mediane overall survival werd bij 205 patiënten met een zeer lange follow up (tot > 15 jaar) niet bereikt en in de SEER database (860 patiënten) werd een mediane overall survival van 72% bereikt na 5 jaar, met een mediane leeftijd bij diagnose van 68 jaar[39, 40].
Er is geen specifiek radiologisch beeld, een FDG-PET/CT-scan was bij de meerderheid (93%) positief [40], maar wordt niet routinematig aanbevolen.
De diagnose is vaak lastig te stellen; in de grootste retrospectieve serie lukte het bij slechts 50% van de patiënten in het eerste biopt de diagnose te stellen. Regelmatig blijkt een biopt ontoereikend en wordt de diagnose uiteindelijk chirurgisch gesteld.
Stadiëring kan plaatsvinden volgens gemodificeerde Ann-Arbor stadiëring [41].
Tabel 4. Stageringssysteem voor BALT lymfomen
|
Stadium |
Definitie |
|
I E |
Eenzijdige of bilaterale presentatie van de long |
|
II 1E |
(1E) Longpresentatie met betrokkenheid van hilaire lymfeklieren (2E) Longpresentatie met betrokkenheid van mediastinale lymfeklieren (2EW) Longpresentatie met betrokkenheid van de thoraxwand of diafragma |
|
III E |
Longpresentatie met betrokkenheid van abdominale lymfeklieren |
|
IV E |
Longpresentatie met betrokkenheid van abdominale lymfeklieren extranodale betrokkenheid |
Het MALT lymfoom van de speekselklieren wordt doorgaans op hogere leeftijd vastgesteld, en komt circa 3x vaker voor bij vrouwen dan bij mannen, waarschijnlijk als gevolg van de associatie met auto-immuunziekten, voornamelijk het syndroom van Sjögren (SS). In een serie van 247 patiënten met MZL van de speekselklieren, had 1/3 SS [42]. De prevalentie van NHL bij SS is 4,3%, waarvan het merendeel van het eMZL/MALT type is. De lymfoomdiagnose volgt gemiddeld 7,5 jaar na de vaststelling van SS [43].
In tegenstelling tot de gelokaliseerde klinische presentatie van andere vormen van het MALT lymfoom, presenteert het MALT lymfoom van de speekselklieren zich regelmatig in alle speekselklieren (parotis, submandibulair en kleinere speekselkliertjes) [42, 44], hoewel de parotiden het meeste zijn aangedaan [45], en is er vaker betrokkenheid van meerdere orgaansystemen [46].
Lokale stadiëring dient plaats te vinden middels MRI/CT met contrast van hoofd/hals gebied. Daarnaast vindt stadiëring plaats middels diagnostische CT hals-thorax-abdomen met i.v. contrast en een beenmergonderzoek zoals voor andere type eMZL, vooral als hier therapeutische consequenties aan verbonden zijn.
Primair wordt gestadieerd volgens Ann-Arbor. In 2011 werd door onderzoekers in het UMCG een vereenvoudigde stadiëring voorgesteld. Deze is in de dagelijkse praktijk zeer bruikbaar, maar wordt internationaal nog niet gebruikt [45].
De werkgroep beveelt aan om de initiële diagnostiek inclusief de beeldvorming te bespreken, en het therapie plan te formuleren in een multidisciplinair overleg (MDO), waarbij minimaal aanwezig: hematoloog, radiotherapeut, nucleair geneeskundige met radiologische expertise en/of een radioloog met nucleair geneeskundige expertise en kennis van de Lugano classificatie, een patholoog met hematologische expertise, en een MDL-arts of oogarts (indien van toepassing). De werkgroep is van mening dat de patiënt steeds opnieuw ingebracht moet worden in het MDO op het moment dat er een (nieuwe) behandelindicatie ontstaat.
Om een inschatting te maken van de prognose van het MZL wordt in de dagelijkse praktijk vaak gebruik gemaakt van de IPI of FLIPI score, maar deze scores zijn niet gevalideerd voor MZL. Behalve m.b.t. het sMZL en MALT lymfoom (van de maag), zijn er m.b.t. de overige entiteiten slechts kleine series, waarin enkel melding wordt gemaakt van mogelijk prognostisch ongunstige factoren zoals hoge leeftijd, slechte WHO performance status, verhoogd LHD en verhoogd β2M. Er is dus op dit moment geen prognostische score die routinematig kan worden aanbevolen?
In 2017 is specifiek voor MALT lymfoom (van de maag) een eerste publicatie verschenen over de MALT-IPI, een prognostische score die gebruikt maakt van 3 parameters; leeftijd > 70 jaar, Ann Arbor stadium III of IV en LDH > ULN [47]. De 3 categorieën (laag, intermediair en hoog) komen overeen met duidelijk verschillende 5-jr EFS, te weten 70%, 56% en 29% respectievelijk[47].
|
Risico groep |
Aantal factoren |
5-jaars LFS |
|
laag |
0 |
70% |
|
Intermediair |
1 |
56% |
|
Hoog |
2-3 |
29% |
Een prognostische score voor sMZL (FIL-score) is in 2006 [48] ontwikkeld, met als prognostische factoren het hemoglobinegehalte, LDH >ULN en albumine < 35 g/L. Op basis van deze 3 parameters werd een laag-, intermediate- en hoog risico patiëntengroep onderscheiden. Deze indeling is later gereviseerd in meerderde internationale studies [49-51] met de onderstaande 4 prognostische parameters:
|
Risico groep |
Aantal factoren |
% patiënten |
5-jaars LFS |
|
laag |
0 |
36% |
95% |
|
Intermediair |
1-2 |
56% |
87% |
|
Hoog |
3-4 |
8% |
68% |
Het is nog onduidelijk of deze prognostische scoringssystemen ook daadwerkelijk de therapiekeuze zullen sturen.
In de behandeling van het MALT lymfoom van de maag wordt onderscheid gemaakt tussen Helicobacter pylori (H. pylori) positieve en H. pylori negatieve lymfomen. Zie voor de behandeling van het MALT lymfoom van de maag ook het flow diagram behandeling, respons evaluatie en follow up MALT lymfoom van de maag (figuur 1).
Figuur 1. Flowdiagram behandeling, respons en follow up MALT lymfoom van de maag
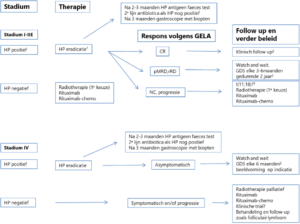
1. NB bij stadium IIE ziekte met symptomen laagdrempelig starten met radiotherapie of systeemtherapie gezien de lage responspercentage op alleen HP eradicatie;
2. Overweeg continueren van jaarlijks gastroscopie bij persisterend beeld van gastritis met endoscopische macroscopische afwijkingen (nodulair oppervlak, vlekkig erytheem of teleangiëctastieën);
3. patienten met een t(11;18) translocatie responderen minder goed op alkylerende middelen alleen.
Uitgangsvraag:
Wat is de eerstelijnsbehandeling van H. pylori positief MALT lymfoom van de maag?
Aanbeveling(en):
Voor het H. pylori positieve MALT lymfoom van de maag geldt voor alle stadia: H. pylori eradicatie.
Responsevaluatie vindt plaats na 3 maanden met feces H. pylori antigeen test en gastroscopie.
NB Stadium IIE of IV ziekte met symptomen: laagdrempelig starten (dus eventueel ook al eerder dan 3-6 maanden na H. pylori eradicatie) met radiotherapie of systeemtherapie gezien de lage responspercentage op alleen H. pylori eradicatie (zie ook verder).
Inleiding:
Vanwege de sterke oorzakelijke rol van H. pylori infectie en het ontstaan van het MALT lymfoom van de maag, is eradicatie de eerste stap. De kans op regressie van het lymfoom hangt echter (o.a.) sterk af van de uitgebreidheid van het lymfoom.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
H. pylori eradicatie lokaal beperkt MALT van de maag [52-55] |
|
C |
H. pylori eradicatie hogere stadia MALT van de maag (expert opinion)[23] |
|
B |
Bij microscopisch persisterende ziekte: afwachtend beleid[56-58] |
Samenvatting literatuur:
Resultaten: De kans dat er remissie van het MALT lymfoom optreedt hangt nauw samen met het stadium van de ziekte en met de uitbreiding van het lymfoom in de maagwand. De kans op een complete remissie is bij stadium II (en hoger) aanzienlijk lager dan in stadium I (56% vs 78%) [52]. De diepte van invasie zoals met EUS vastgesteld is van invloed op de kans om met H. pylori eradicatie een complete remissie te bereiken [53-55, 59].
Het is belangrijk te realiseren dat de tijd tot aan CR 3 tot 28 maanden is. In geval van een persisterende of gerecidiveerde Helicobacter pylori infectie is hernieuwde eradicatie aangewezen, bij voorkeur op geleide van kweek en resistentiebepaling. Resistentie (<5% kans op respons op antibiotica) is geassocieerd met een t(11;18) translocatie, welke bij ongeveer 1/3 van de patiënten wordt gevonden [60]. Advies van de werkgroep is dan ook om bij uitblijven van respons op H. pylori eradicatie t (11;18) translocatie onderzoek in te zetten.
Stadium IIE en IV patiënten hebben <10% kans op complete respons op H. pylori eradicatie therapie alleen, maar eradicatie therapie wordt uiteindelijk wel geadviseerd voor deze groep patiënten [4, 23, 29]. Bij H. pylori positieve stadium IIE patiënten kan het effect van H. pylori eradicatie worden afgewacht, maar dient bij klinische noodzaak laagdrempelig gestart te worden met radiotherapie of systeemtherapie. Bij H. pylori positieve stadium IV patiënten dient H. pylori eradicatie te worden gestart, en dient alleen bij klachten de behandeling aangevuld te worden met radiotherapie of systeemtherapie (NCCN guidelines 2019) [4, 23].
Indien na succesvolle eradicatie van Helicobacter pylori en normalisatie van de endoscopische afwijkingen nog steeds foci van MALT lymfoom in de biopten worden gevonden, is niet onmiddellijk andere behandeling zoals radiotherapie of chemotherapie noodzakelijk. In eerste instantie werden sinds 2002 patiënten met nog persisterend lokalisatie van een MALT lymfoom van de maag na succesvolle eradicatie van Helicobacter pylori en normalisatie van de endoscopische afwijkingen alleen vervolgd als zij aanvullende “oncologische” behandeling, zoals radiotherapie of chemotherapie, weigerden. Dit bleek veilig, zoals ook bleek bij langduriger follow-up van een grotere groep patiënten. Ook wanneer er beperkte maar stabiele endoscopische afwijkingen zijn, lijkt dit een te verdedigen beleid. Een strikte follow-up is wel vereist[56-58].
Bewijskracht van de literatuur. level 2-3, consistentie n.v.t.
Overwegingen:
H. pylori eradicatie wordt bij alle stadia van het H. pylori -positieve maaglymfoom geadviseerd, mede om ulceratieve afwijkingen in de maag te behandelen en de kans op bijv. bloeding te verminderen.
H. pylori eradicatie therapie
Voor wat betreft de algemene behandeling van Helicobacter wordt verwezen naar vigerende richtlijnen zoals opgesteld door MDL-artsen en huisartsen, omdat resistentiepatronen in de loop van de jaren kunnen veranderen.
Als ook die kuur faalt, moet de patiënt worden doorverwezen voor endoscopie met kweek en resistentiebepaling.
Samenvatting
Voor alle stadia geldt dat H. pylori eradicatie overwogen kan worden (zie verder).
Stadia I t/m IIE
Stadium IV
Achtergrond
Er is een duidelijke daling van de incidentie van het MALT lymfoom van de maag, zoals te zien is in de PALGA-data (De Jong, persoonlijke mededeling). Ongetwijfeld hangt dit samen met de dalende prevalentie van een chronische Helicobacter pylori infectie. Het (relatieve) aandeel van het H. pylori negatieve MALT lymfoom van de maag neemt hierdoor toe en dit is in meerdere Europese centra waargenomen (Madrid 2017 EGILS meeting).
Bij het H. pylori negatieve MALT lymfoom wordt vaker een t(11;18) translocatie gevonden en deze lymfomen reageren zelden op Helicobacter pylori eradicatie [60].
In het kader van auto-immuunziekten kunnen in diverse organen MALT lymfomen ontstaan (schildklier, speekselklieren, oogadnexen bv). Ook MALT lymfomen van de maag zijn beschreven bij auto-immuunziekten. Dergelijke MALT lymfomen hebben een mindere kans op remissie na Helicobacter pylori eradicatie [61]. Niettemin zijn bij het H. pylori negatieve MALT lymfoom van de maag wel remissies van het lymfoom beschreven na H. pylori eradicatie. Meest waarschijnlijk is er dan sprake van een “waxing and waning” van het lymfoom, hoewel niet geheel kan worden uitgesloten dat er micro-organismen bij die patiënten een vergelijkbare rol in de pathogenese gespeeld hebben. Het lijkt dus te verdedigen ook bij deze groep patiënten een “Helicobacter pylori eradicatie” schema te proberen [62], maar gezien het gebrek aan overtuigend bewijs wordt dit niet standaard aanbevolen. Het natuurlijk beloop bij deze groep is vaak ook indolent[63].
Uitgangsvraag:
Wat is de eerstelijns systemische behandeling voor het MALT lymfoom van de maag voor patiënten die in aanmerking komen voor systemische therapie?
Aanbeveling(en):
R-chloorambucil is de eerste keuze, vanwege de hogere EFS en PFS dan die van beide middelen afzonderlijk.
Bij een agressiever beloop kan combinatie therapie zoals beschreven voor het nodale MZL toegepast worden (R-CVP, R-Bendamustine)
Voor patiënten voor wie behandeling met chemo-immunotherapie niet mogelijk is, is behandeling met rituximab monotherapie (of chloorambucil monotherapie) een goed alternatief.
Inleiding:
Zowel chemotherapie, immunotherapie als gecombineerde chemo-immunotherapie zijn effectief in de behandeling van patiënten met eMZL/MALT van de maag, met symptomatische, uitgebreide ziekte, contra-indicaties voor radiotherapie, of na falen van antibiotische behandeling en lokale therapie.
Er zijn nauwelijks vergelijkende studies verricht; en weinig middelen zijn zelfs specifiek in eMZL getest.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
Immunochemotherapie is effectiever m.b.t. PFS/EFS dan immuno- resp chemotherapie alleen, maar zonder verschil in OS [64, 65] |
|
B |
Monotherapie met rituximab leidt tot een acceptabele ORR [66, 67] |
|
A |
R-bendamustine leidt tot een hoge CR en EFS [68] |
|
B |
R-fludarabine is zeer effectief, maar heeft een hoge toxiciteit [69] |
Samenvatting literatuur:
Resultaten: Er is 1 fase 3 gerandomiseerde studie (IESLG-19) waarin het effect van rituximab-chloorambucil is vergeleken met rituximab monotherapie en leukeran monotherapie in 454 patiënten met nog residueel MALT lymfoom (van de maag) na behandeling met antibiotica[64] [65]). De combinatietherapie resulteerde in een significant hogere CR, PFS en EFS, maar er was geen OS voordeel. De EFS na 5 jaar was 51% (95% CI, 42 tot 60) met chloorambucil alleen, 50% (95% CI, 42 tot 59) met rituximab alleen, en 68% (95% CI, 60 tot76) met de combinatie (P = .0009). De OS na 5 jaar was ongeveer 90% in iedere arm.
Er zijn 2 studies verricht met rituximab monotherapie. In een studie van Conconi et al., kregen 35 patiënten, onbehandeld of met een recidief MALT lymfoom van de maag, 4 wekelijkse giften rituximab. De ORR was 73% (95% CI, 56%-87%), met 15 complete responsen en 10 partiële responsen. Hierbij was de ORR in de chemotherapie-naïeve patiënten (57%) hoger dan in de voorbehandelde patiënten (45%). De mediane responsduur was 10,5 maanden, en er was weinig toxiciteit[66]. In een tweede studie in 27 patiënten resistent tegen, of niet in aanmerking komend voor H. pylori eradicatie, was de ORR 77%, met een pathologische en klinische CR in 12 patiënten (46%). Na een mediane follow-up van 33 maanden, waren slechts 2 patiënten gerecidiveerd (na 14 resp 26 maanden)[67].
In een fase II studie van de GELTAMO met R-Bendamustine voor (o.a.) MALT lymfoom patiënten bij wie H.P. eradicatie therapie had gefaald, was de EFS na 2 jaar 93% (95% CI 84-97) en na 4 jaar 88% (95% CI 74-95)[68]. Vijfenzeventig procent van de patiënten had een CR na 3 cycli en ontving (volgens protocol) in totaal 4 kuren.
R-fludarabine is in een fase 2 studie in 26 patiënten (met eMZL, sMZL en nMZL) weliswaar zeer actief gebleken (ORR 84% (95% CI 65-96%), met 54% CR (95% CI 63-96%), maar met hoge toxiciteit. Slechts 58% van de patiënten kon de volledige behandeling van 6 kuren ondergaan, vanwege hematologische en infectieuze problemen[69].
Bewijskracht van de literatuur. Level 2, consistent
Overwegingen:
Vanwege het vaak indolente beloop van het eMZL, is relatief milde therapie met R-chloorambucil, of eventueel rituximab of chloorambucil monotherapie, vaak voldoende om een acceptabel EFS/PFS te bereiken. Bij een agressiever beloop kan combinatie therapie zoals beschreven voor het nodale MZL toegepast worden (R-CVP, R-CHOP of R-Bendamustine). MALT lymfomen van de maag met een t(11;18) lijken slechter te responderen op chloorambucil [70]. Bij deze patiënten verdient de combinatie R-bendamustine derhalve de voorkeur. Zoals boven beschreven, is de combinatie van bendamustine met rituximab effectief, met als mogelijk voordeel dat er maar een beperkt aantal cycli gegeven hoeft te worden. Voor R-fludarabine lijkt gezien het hoge toxiciteitsprofiel geen plaats in de behandeling van het eMZL. Ook de combinatie van rituximab met lenalidomide lijkt actief, maar is vooralsnog niet beschikbaar voor deze indicatie[71]. Anthracyclines worden doorgaans gereserveerd voor patiënten bij wie transformatie is opgetreden[72]. Vanwege het ontbreken van data over het nut van onderhoudsbehandeling met rituximab in deze patiënten, wordt dit niet standaard aanbevolen.
Samenvatting
Stadium I-II
Stadium III-IV (zeldzaam)
Behandeling met doxycycline kan overwogen geworden, vooral als Chlamydia psittaci wordt gevonden en er geen acute behandelindicatie is.
Achtergrond
Er zijn geen internationale richtlijnen beschikbaar over de behandeling van OAMZL. Gezien de zeer goede prognose is het belangrijk te waken voor toxiciteit.
Bij asymptomatische ziekte (ongeacht stadium) is het kiezen voor ‘watch and wait’ een optie gezien de gunstige prognose; zo ook bij patiënten bij wie de diagnostische resectie radicaal was of leidde tot de gewenste klinische verbetering, of wanneer radiotherapie tot significante morbiditeit kan leiden; zie [4] en NCCN guidelines 2019.
Bij non-gastrische MALT lymfomen in het algemeen wordt ‘involved site’ radiotherapie aangeraden bij lokale ziekte, en immunochemotherapie bij hogere stadia.
Op basis van retrospectieve data is de 10 jaars ziektespecifieke overleving van de hele groep 91% (niet verschillend op basis van stadium). Van de behandelde patiënten (gehele groep) bereikte 68% een complete remissie. De mediane PFS van alle behandelde patiënten was 29 maanden, in ongeveer de helft van de gevallen was het recidief wederom oculair [37]. Patiënten met stadium IE hadden op basis van retrospectieve data een betere 10 jaars ziektevrije overleving (95%) na bestraling dan patiënten die behandeld werden met rituximab +/- chemotherapie (86%). Patiënten met stadium III/IV die behandeld werden met chemotherapie + rituximab hadden een betere 10-jaars ziektevrije overleving (96%) dan patiënten die behandeld werden met alleen chemotherapie (63%). Uiteraard kan hier op basis van deze retrospectieve data selectiebias meespelen [37].
De voornaamste lange termijn bijwerking van radiotherapie is het ontstaan van cataract. In het algemeen wordt een dosis van 24 Gy in 12 fracties aanbevolen, en daarmee is de 5-jaars PFS 81% en de 5-jaars lokale controle 92%[73, 74].
Ook kan bij beperkte extra-oculaire lokalisaties maar veel lokale klachten alsnog gekozen worden voor lager gedoseerde radiotherapie (4 Gy).
Er is veel discussie over de rol van Chlamydia psittaci (CP) bij het ontstaan van de ziekte en of behandeling hierop gericht moet worden. In een prospectieve trial (n=34) werd met 3 weken doxycycline een 48% ‘overall respons rate’ gevonden, zowel bij CP-positieve (64%) als CP-negatieve patiënten (38%), met een 5 jaar PFS van 55% [75]. In de NCCN guideline 2019 en ESMO richtlijn wordt wel genoemd dat behandeling met doxycycline genoemd als een optie die overwogen kan worden als er geen haast is (geen bedreigde visus etc)[23].
Samenvatting
Stadium I-II
Stadium III-IV
Achtergrond
Gezien de zeer goede prognose is een belangrijke overweging toxiciteit te besparen. Er is geen consensus over de behandeling van het BALT lymfoom. Er zijn geen richtlijnen beschikbaar over de behandeling van het BALT lymfoom (alleen richtlijnen over non-gastrische MALT lymfomen in bredere zin). De keuze voor behandeling moet gemaakt worden op individueel niveau op basis van ziekte –en patiëntkarakteristieken.
Bij een radicaal geopereerd BALT lymfoom hoeft gezien de gunstige PFS geen nabehandeling plaats te vinden.
Bij asymptomatische patiënten is mede gezien het indolente beloop ‘watch and wait’ te overwegen. Indien curatieve radiotherapie technisch een haalbare optie is, dient dit uiteraard overwogen te worden met daarbij meegenomen de te verwachten toxiciteit van de radiotherapie op basis van de uitgebreidheid van de ziekte en leeftijd en conditie van de patiënt.
Bij symptomatisch ziekte is het advies te behandelen. Als curatieve bestraling mogelijk is heeft dit de voorkeur mits dit qua toxiciteit acceptabel is. Dit zal bij BALT lymfoom afhankelijk zijn van de lokalisatie en uitgebreidheid van het proces in de thorax. Het is dus belangrijk hierover met de radiotherapeut te overleggen. Het is belangrijk om daarbij te bedenken dat over radiotherapie bij BALT lymfoom amper data beschikbaar zijn.
Andere behandelopties zijn rituximab monotherapie, immunochemotherapie of lage dosis radiotherapie.
Globaal zijn de opties zoals die in de literatuur genoemd worden (met in percentages hoe vaak ze werden toegepast in de grootste retrospectieve serie van 205 patiënten, CR, PR en SD percentage en PFS)[40]:
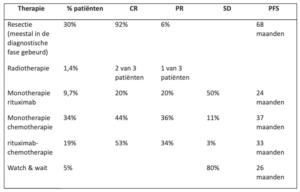
Van de hele groep had 32% een progressie/recidief event na mediaan 70 maanden follow up. De PFS was het langst (68 maanden) met chirurgie (maar dat waren in deze retrospectieve serie dus bijna allemaal patiënten die kennelijk een curatief te opereren lesie hadden). De patiënten met systemische therapie hadden een kortere PFS, maar dit was dus waarschijnlijk de groep patiënten met uitgebreidere ziektelast, die niet lokaal behandeld konden worden. Een recente retrospectieve analyse van 123 patiënten uit MSKCC laat vergelijkbare resultaten zien, met een significant betere EFS na resectie dan na systemische therapie of actieve surveillance. Ook in dit cohort heeft deze gunstiger uitkomst waarschijnlijk te maken met de uitgebreidheid van de ziekte [76]. Het is op basis van deze retrospectieve data moeilijk te bepalen wat de optimale behandeling is.
In de enige gerandomiseerde studie naar MALT lymfoom werd gerandomiseerd voor R-monotherapie, chloorambucil monotherapie of R-chloorambucil. Voor de gehele groep van MALT lymfomen was in deze studie R-chloorambucil superieur aan rituximab of chloorambucil alleen (eventfree survival respectievelijk niet bereikt; 5,6 jaar, 5.1 jaar). Er werden 42 patiënten met BALT lymfoom geïncludeerd, deze werden niet separaat gerapporteerd [65].
Associaties van het BALT lymfoom met bepaalde micro-organismen zijn onzeker. Er is twijfel over de rol van Achromobacter (Alcaligenes) xylosoxidans maar antibiotica worden niet aanbevolen als behandeling.
Samenvatting
Stadium I-II
Stadium III-IV
Neem ziekteactiviteit syndroom van Sjögren (SS) in overweging; zie onder.
Achtergrond
De optimale behandeling is niet met zekerheid vast te stellen; internationale richtlijnen ontbreken. De keuze moet gemaakt worden op individueel niveau op basis van ziekte –en patiëntkarakteristieken. Gezien de zeer goede prognose is een belangrijke overweging in de keuze voor een behandeling om toxiciteit te besparen
In de grootste retrospectieve serie van patiënten met MZL van de speekselklieren (n=247), was de mediane overleving 18,3 jaar, en de PFS na behandeling 9,3 jaar; onafhankelijk van het type behandeling. Patiënten die met rituximab waren behandeld, hadden een betere overleving. Ook patiënten met onderliggend SS hadden in deze serie een significant betere overleving [42].
Vanwege de multi-glandulaire presentatie en kans op permanente restschade is er zelden plaats voor chirurgie. Radiotherapie in hogere doses gaat gepaard met het risico op xerostomie [77], en waarschijnlijk geeft een lagere dosis van 4 Gy voldoende ziektecontrole.
In een serie van 35 patiënten met een MALT lymfoom van de speekselklieren, leek initieel een hoge SS activiteit (aanwezigheid M proteïne, cryoglobulines, IgM reuma factor > 100 KIU/L, ernstige extraglandulaire ziektemanifestaties) geassocieerd met een slechtere uitkomst van het lymfoom of SS [45]. In deze patiënten dient behandeling met immunochemotherapie eerder overwogen te worden.
Over het algemeen heeft het sMZL een goede overleving. De meerderheid van de patiënten bereikt een overleving van meer dan 10 jaar. Dertig procent van de patiënten toont echter een ongunstiger beloop en 5-10% transformeert naar een diffuus grootcellig B-cellymfoom.
Bij 20% van de patiënten worden daarnaast auto-immuun fenomenen gezien zoals auto-immuun hemolytische anemie, immuuntrombopenie, koude agglutininen, C1-esterase deficiëntie, van Willebrand ziekte[72].
Een derde van de patiënten heeft geen tot weinig (milde cytopenie) klachten van het sMZL. Bij deze patiënten verdient het, vergelijkbaar met andere indolente lymfomen, aanbeveling om te wachten met de behandeling.
De belangrijkste criteria voor het starten van de behandeling bij sMZL zijn symptomatische splenomegalie en/of progressieve cytopenieën (hemoglobine < 6,2 mmol/L, trombocyten < 80 x 109/L, neutrofielen < 1 x 109/L). Auto-immuunziekten zoals AIHA of ITP moeten, indien aanwezig, specifiek worden behandeld [23].
Als er sprake is van HCV infectie, kan overwogen worden het effect van antivirale therapie af te wachten (zie paragraaf 5.4).
Uitgangsvraag:
Wat is de eerstelijnsbehandeling van het sMZL?
Aanbeveling(en):
Vanwege de goede responskans en minimale toxiciteit heeft rituximab monotherapie de voorkeur als eerstelijnsbehandeling van het sMZL boven splenectomie.
Splenectomie is relatief gecontraïndiceerd bij hoog risico ziekte met uitgebreide tumorload en bij patiënten met een verhoogd operatie risico. Daarentegen is het een optie voor fitte patiënten die cytopenieën hebben ten gevolge van hypersplenisme.
Toevoeging van chemotherapie aan rituximab dient alleen overwogen te worden indien patiënten een hoog risico profiel hebben (3-4 risicofactoren FIL score, zie ‘Prognose’).
Bij een respons op inductiebehandeling met immunotherapie wordt onderhoudsbehandeling met rituximab gedurende één tot twee jaar aanbevolen omdat het de progressievrije overleving verlengt.
Inleiding:
Er is weinig consensus over de behandeling van het sMZL. Er zijn geen prospectief gerandomiseerde studies beschikbaar. Wel werden er meerdere artikelen, case reports en reviews gepubliceerd. De literatuur beschrijft de volgende behandelopties: splenectomie, monotherapie rituximab, rituximab in combinatie met chemotherapie, en radiotherapie.
Conclusie(s):
|
SORT grade |
Conclusie |
|
A |
Monotherapie rituximab geeft in vergelijking met splenectomie de langste PFS en de beste OS [78, 79]. |
|
A |
Splenectomie effectief, maar geeft kans op achterblijven van restziekte [78, 79]. |
|
C |
Er is nog onvoldoende bewijs dat toevoegen van chemotherapie aan rituximab tot een beter resultaat leidt dan rituximab alleen [78, 79]. |
|
B |
Onderhoudsbehandeling gedurende 1 (of 2) jaar verbetert de PFS, maar niet OS [80] |
Samenvatting literatuur:
Resultaten:
Splenectomie. Hypothetisch kan splenectomie zorgen voor minder abdominale klachten en minder milt sequestratie waardoor cytopenieën kunnen verminderen of herstellen. Daarnaast kan een splenectomie ook bijdragen aan het bevestigen van de diagnose sMZL. Tussen 1991 en 2015 zijn er 12 case-series gepubliceerd van patiënten met een sMZL die splenectomie ondergingen (samengevat door Arcaini et al., Blood 2016). De ORR wisselt tussen 60 en 100%. De progressievrije en overall overleving bedroeg respectievelijk 35-80% en 61-95%. Er bestaat een korte termijn risico op complicaties (trombose, bloeding) en een lange termijn risico (infectie met gekapselde bacteriën) na splenectomie. De grote wisselingen in respons zouden te maken kunnen hebben met deze complicaties, de benaderingswijze (laparoscopisch of open procedure), en het overblijven van restziekte in beenmerg danwel bijmilt. Verder zijn de studies slecht vergelijkbaar aangezien een groot deel van de patiënten die een splenectomie ondergingen aanvullend chemotherapie ontvingen [78, 79].
Rituximab monotherapie. Sinds de introductie van rituximab in 2007 werd deze anti-CD20 monoklonale antistof gezien als goed alternatief voor de behandeling van o.a. het sMZL. Indien toegepast als eerstelijnsbehandeling wordt een ORR van minimaal 88% met een zeer goede progressie vrije overleving van 73-92% na 3-5 jaar en een 5-jaars overal respons van > 90% bereikt. De toxiciteit van de behandeling is minimaal waardoor rituximab monotherapie een goed alternatief is ten opzichte van splenectomie [78, 79].
Rituximab + chemotherapie. De combinatie van rituximab met verscheidene vormen van chemotherapie (purine analogen, antracyclines, alkylerende middelen) werd onderzocht waarbij goede resultaten werden gezien.
De BRISMA-trial is een prospectieve trial die de combinatie van rituximab – Bendamustine onderzocht. Complete remissies werden bereikt in 91% versus 73% bij alleen rituximab. De 3-jaars PFS was 93% versus 96%. 25% van de patiënten ondervond echter ernstige bijwerkingen, met name van hematologische aard [81].
Ondanks de goede resultaten van bovenstaande combinaties toont onderzoek echter dat rituximab in combinatie met chemotherapie niet superieur is aan monotherapie rituximab maar wel meer toxiciteit toont. Daarnaast is het nog niet duidelijk welke chemotherapie de meeste toegevoegde waarde heeft [81, 82].
Onderhoudsbehandeling. Onderhoudsbehandeling met rituximab (2-maandelijks gedurende 1-2 jaar) leidt tot betere progressie vrije overleving. De 5- en 10-jaars PFS waren 70% en 64% respectievelijk. De PFS was significant beter bij patiënten die onderhoudsbehandeling hebben gekregen in vergelijking met patiënten die alleen inductiebehandeling ontvingen (7-jaar PFS 75% vs 39%, p < 0.0004); er was hierbij nauwelijks verschil tussen 1 of 2 jaar onderhoud. Vooralsnog werd echter geen verschil in OS gevonden. Dit betreft echter wel een retrospectieve studie [80].
Bewijskracht van de literatuur. Level 3; consistent
Overwegingen:
In de literatuur worden meerdere behandelopties voor het sMZL beschreven. Per behandeloptie verschilt de mate van evidence. Zo leken studies naar het ondergaan van een splenectomie in de richting te wijzen van betere PFS en OS. Echter in veel van deze studies werd daarnaast ook chemotherapie gegeven en bleef er restziekte in het beenmerg bestaan. De werkgroep is van mening dat splenectomie alleen overwogen moet worden bij patiënten die geen systemische behandeling kunnen/ willen ondergaan, en bij wie gestreefd wordt naar vermindering van abdominale klachten en cytopenieën.
Studies naar de effectiviteit en toxiciteit van monotherapie rituximab tonen een hoge ‘overall respons rate’ en een betere PFS en OS in vergelijk met splenectomie. Daarnaast wordt de behandeling door de meeste patiënten goed verdragen. De werkgroep is van mening dat monotherapie rituximab een goede keus is voor de eerstelijnsbehandeling, maar ook in latere lijnen bij klachten van het sMZL. De kans op infusiereacties op de eerste gift rituximab is bij het sMZL hoger dan bij andere indolente iNHL. Daarom kan overwogen worden de eerste dosis te verdelen, waarbij op de eerste dag 50 mg/m2 in 4 uur gegeven wordt, en de resterende hoeveelheid (325 mg/m2) op dag 2 of 3 [69].
Er is nog onvoldoende bewijs van de toegevoegde waarde van chemotherapie aan rituximab. Ondanks meerdere studies met goede resultaten blijft vooralsnog onduidelijk wat de toegevoegde waarde van het chemotherapeuticum boven op het effect van rituximab is, en is nog onduidelijk welke chemotherapie de voorkeur verdient. Daarnaast was er wel een sterk verhoogde kans op toxiciteit van de behandeling. De werkgroep is van mening dat de combinatie van chemotherapie en rituximab alléén overwogen dient te worden bij hoog risico patiënten, aangeduid met een FIL-score van 3 of hoger.
Onderhoudsbehandeling met rituximab geeft verlenging van de PFS (in een retrospectief cohort). Omdat onderhoudsbehandeling met rituximab goed verdragen wordt, adviseert de werkgroep ook bij het sMZL onderhoudsbehandeling na 1e danwel latere lijns behandeling te overwegen. Dit conform het advies bij folliculair lymfoom.
|
Curatieve intentie |
|
|
Radiotherapie |
24 Gy (12×2 Gy) |
|
Geen curatieve intentie – asymptomatisch |
|
|
Watch & wait |
|
|
Geen curatieve intentie – symptomatisch |
|
|
Radiotherapie |
4 Gy |
|
Rituximab monotherapie |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1,8,15,22, evt gevolgd door onderhoudsbehandeling tot aan progressie |
Achtergrond
Er zijn geen gerandomiseerde studies m.b.t. de optimale behandeling van nMZL met beperkt stadium. De data werd verkregen uit series van verschillende indolente lymfomen. De huidige standaard behandeld is conform met internationale richtlijnen [4, 5]
Curatieve radiotherapie. Indien er curatieve intentie is wordt radiotherapie aangeraden (12×2 Gy) [83-85]. Dit geldt voor patiënten met stadium I ziekte, en patiënten met stadium II ziekte met maximaal 2 aangrenzende aangedane lymfkierregio’s. Er is geen rol voor chemotherapie na radiotherapie [86].
Palliatieve radiotherapie. Indien patiënten behandeld worden met palliatieve intentie dan kan volstaan worden met 4 Gy radiotherapie. Dit geeft vaak zeer goede ziekte controle [87, 88]. Ziekte controle (complete danwel partiële respons) in patiënten met beperkt stadium MZL wordt in 87% van de patiënten bereikt. Een enkele patiënt respondeert niet op lokale radiotherapie (3%).
Imuuntherapie. Indien radiotherapie niet mogelijk is kan rituximab monotherapie overwogen worden. Geadviseerd wordt inductietherapie te geven met wekelijks rituximab (375mg/m2) voor 4 weken. In indolente, beperkt stadium lymfomen werd een ‘overall response rate’ gevonden van 40% (RESORT E4402)[89]. In specifiek nMZL (slechts 28 patiënten) werd geen CR gevonden, het PR/SD percentage was 96%. Indien patiënten responderen dan wordt aangeraden om rituximab maintenance te starten (1x 3 maanden 375mg/m2 tot aan progressie). In de indolente lymfomen populatie wordt de mediane tijd tot treatment failure verlengd naar 4.8 jaar.
Gezien de goede resultaten met radiotherapie danwel rituximab monotherapie is er geen indicatie voor immuno-chemotherapie in de 1ste lijn voor het beperkt stadium nMZL.
Uitgangsvraag:
Wat is de eerstelijnsbehandeling van uitgebreid stadium nMZL?
Aanbeveling(en):
|
Asymptomatisch/ non-bulky |
|
|
Watch & wait |
|
|
Symptomatisch/ behandelindicatie |
|
|
Immunochemotherapie |
R-CVP R-bendamustine of R-CHOP |
|
Radiotherapie |
4 Gy |
|
Onderhoudsbehandeling |
Niet aanbevolen |
Inleiding:
Er zijn geen curatieve opties voor het uitgebreid stadium nMZL. Na initiële behandeling zal de ziekte vrijwel zeker recidiveren, de timing van de behandeling moet goed overwogen worden. Verschillende factoren moeten in overweging genomen worden, zoals het klinisch beloop, de biologie ziekte, verwachtingen van de therapie en toxiciteit en de verwachtingen en wensen van de patiënt alsmede de co-morbiditeit, kwaliteit van leven en psychische gevolgen van het wel of niet behandelen.
Conclusie(s):
|
SORT Grade |
Conclusie |
|
A |
Indien asymptomatisch: W&W (zie richtlijn FL; link) |
|
B |
Indien symptomatisch: chemo-immunotherapie[90-93] |
|
B |
Rituximab onderhoud verlengt PFS, niet standaard aanbevolen[93-95](expert opinion) |
Samenvatting literatuur:
Resultaten: Er zijn geen gerandomiseerde fase 3 studies om de optimale behandeling van het uitgebreide (st III-IV en stadium II niet in aanmerking komend voor curatieve radiotherapie) nMZL vast te stellen. De meeste gegevens zijn verkregen vanuit retrospectieve series danwel gerandomiseerde studies uitgevoerd in patiënten met uitgebreid stadium indolent lymfoom.
Watch and wait. Zoals beschreven in de richtlijn van folliculair lymfoom uit 2019, zijn er 3 gerandomiseerde trials die laten zien dat vroeg starten met behandeling geen verbetering geeft t.o.v. starten van therapie bij symptomen [96-98]. Dit geldt mogelijk ook voor inductietherapie met rituximab vroeg in de behandeling. Hoewel FL patiënten die direct behandeld werden met rituximab een significant langere tijd tot nieuwe behandeling (TTNT) en progressievrije overleving (PFS) hadden (HR 0.35 (0.22-0.56; p<0.0001) resp. HR 0.55 (0.37-0.83; p=0.0034)) dan patiënten die pas behandeld werden bij symptomen van de ziekte, was er geen verschil in algehele overleving[99].
Immunochemotherapie. De toevoeging van rituximab aan chemotherapie heeft de uitkomst van de behandeling sterk verbeterd, zowel betreft de respons, PFS als algehele overleving. Dit wordt hier verder niet onderbouwd.
In Nederland worden zowel R-CVP, R-CHOP als R-bendamustine (BR) toegepast voor uitgebreide indolente lymfomen met behandelindicatie. R-CVP (1x in de 3 weken, 6-8 cycli) is een veel gebruikt schema in Nederland, en leidt tot een goede ORR van 88%, met hierbij 60% CR. De mediane duur van respons is 28.3 maanden bij nMZL [90]. De effectiviteit van R-CVP en R-CHOP komt redelijk overeen. Er is een duidelijk voordeel van R-CHOP boven R-CVP met betrekking tot kans op complete respons en progressievrije overleving, maar dit leidt niet tot een toename van de algehele overleving[91]. R-CVP heeft een gunstiger bijwerkingenprofiel, vooral wat betreft hematologische toxiciteit en cardiotoxiciteit. R-CVP wordt aangeraden als 1ste lijn therapie, indien patiënten stabiele ziekte of progressie hebben bepaald tijdens de interim respons kan de therapie geïntensiveerd worden met R-CHOP, of BR. BR is non-inferieur aan R-CVP/R-CHOP in de eerste lijn in patiënten met indolente lymfomen. De algemene respons (ORR) voor BR en R-CVP/R-CHOP is 97% en 91%, respectievelijk[92]. In een subgroep analyse van slechts 67 patiënten binnen een gerandomiseerde fase 3 studie tussen BR en R-CHOP was geen verschil in PFS in MZL [93]. De bijwerkingen van BR zijn in het algemeen milder. We adviseren dan ook een keuze basis van ervaring en voorkeur van arts en patiënt.
Rituximab onderhoud. Er zijn geen grote gerandomiseerde studies met betrekking tot onderhoudsbehandeling met rituximab specifiek voor nMZL. Wel wordt deze subgroep meegenomen in de verschillende studies bij indolente lymfomen. De E1496 studie bewijst dat rituximab onderhoud een verlenging geeft van PFS in patiënten die inductie therapie hebben gehad middels CVP (3-yr PFS is 68% met RM vs 33% observatie) [100]. Overigens laat deze studie geen OS verschil voor de lange termijn analyse [101]. Gemeld moet worden dat van de 307 patiënten, 282 een FL had. In een subanalyse van patiënten met MZL in de GALLIUM studie werd ook een verbetering van de PFS gezien[95]. In een fase II studie specifiek in MZL (n=119) leidde rituximab onderhoud weliswaar ook tot een langere PFS, maar deze was in de observatie al 92 maanden[94].
Bewijskracht van de literatuur. level 2, consistentie n.v.t.
Overwegingen
Bij ouderen en geriatrische patiënten met een behandelindicatie voor nMZL en met co-morbiditeit kan gekozen worden voor milde therapie in de vorm van inductie therapie met rituximab, danwel rituximab gecombineerd met chloorambucil.
M.b.t. onderhoudsbehandeling met rituximab, is de werkgroep van mening dat deze gezien het ontbreken van een OS voordeel, en het feit dat de PFS ook zonder onderhoudsbehandeling vaak al uitstekend is, niet standaard aanbevolen moet worden.
Bij klinisch agressief beloop kan onderhoudsbehandeling overwogen conform de aanbeveling voor FL (link).
Patiënten met een chronische hepatitis C infectie hebben een verhoogde kans op het ontwikkelen van een NHL (relatief risico ca 2-3) [102, 103]. Deze lymfomen komen doorgaans aan het licht na een lange duur van de infectie; gemiddeld na zo’n 15 tot 25 jaar. MZL en DLBCL zijn verreweg de meest voorkomende histologische subtypen; bij een aanzienlijk deel van de DLBCL blijkt er sprake te zijn van transformatie uit een indolent NHL (voornamelijk MZL), hetgeen suggereert dat MZL waarschijnlijk het meest voorkomende type lymfoom geassocieerd met HCV is, en dat deze MZL een hoog risico kennen op transformatie naar een agressiever lymfoom (review in [104]).
Alle 3 de subtypen van het MZL (eMZL, sMZL en nMZL) worden gevonden bij patiënten met hepatitis C, maar het lymfoom presenteert zich veelal in beenmerg/ bloed en milt, en gaat vaker gepaard met cryoglobulinemie en de aanwezigheid van een reuma factor [105].
Patiënten met een hepatitis C-geassocieerd MZL kunnen behandeld worden met antivirale therapie (AT), na overleg met MDL-arts danwel internist-infectioloog. Zeker als immuno-/chemotherapie niet direct nodig is, kan het effect van AT afgewacht worden. Na behandeling met Interferon α-2b subcutaan 3 x per week 3 miljoen EH gedurende 6 maanden toegevoegd aan ribavirine 1000/1200 mg per dag was de gemiddelde duur tot respons 7 maanden. Ook zonder immuno-/chemotherapie kan behandeling van hepatitis C leiden tot een betere OS van het MZL [105, 106]. Ook nieuwere behandelingen van hepatitis C (welke geen interferon meer bevatten) op het HCV-geassocieerde lymfoom lijken effectief [107].
Bij falen van AT (m.b.t. het lymfoom) kan toevoegen van immuno-/chemotherapie toegevoegd worden. Bij behandeling met een anti-CD20 antistof dient de HCV infectie wel onder controle te zijn.
In de context van recidief/refractaire ziekte zijn er amper data specifiek voor MZL te vinden. Verwezen wordt naar de behandelopties in de eerste lijn, en naar de ‘Richtlijn Folliculair lymfoom 2019’ . In het algemeen geldt dat bij een lokaal recidief radiotherapie overwogen kan worden, en voor een asymptomatisch recidief doorgaans afgewacht kan worden (‘watch and wait’).
Recidieven na het bereiken van een CR zijn zelden beschreven en hiervoor zijn dan ook geen eenduidige adviezen te geven. Bij opnieuw aantonen van Helicobacter dient uiteraard opnieuw eradicatie te worden gegeven. Voorts kan hetzelfde behandel algoritme als in de 1e lijn kan worden gevolgd.
Waar mogelijk moeten patiënten met R/R MZL geïncludeerd worden in studies, bv met nieuwe vormen van immuuntherapie of ‘targeted drugs’.
Er is activiteit beschreven van BTK- en PI3-kinase remmers bij patiënten met uitgebreid voorbehandelde MZL. In een fase II studie onder 63 patiënten die tenminste 1 (mediaan 2; range 1-9) anti-CD20 antistof bevattende voorbehandeling hadden gehad, werd met ibrutinib een ORR van 48% bereikt (vnl. PR; 95% CI, 35-62), en een mediane PFS van 14,2 maanden[108]. Ook de PI3-kinase remmers idelalisib [109, 110], umbralisib [111] en copanlisib [112] hebben in fase II studies in (kleine groepen) patiënten met R/R MZL effectiviteit laten zien, met een ORR van 46,7%, 49,3% resp 78,3%. Er lopen momenteel meerdere studies naar de activiteit van BTK-remmers is zowel onbehandelde als R/R MZL patiënten. De toxiciteit komt in deze studies overeen met hetgeen gezien werd in studies met deze middelen voor andere indicaties. Deze middelen worden vooralsnog niet vergoed.
Er zijn geen prospectieve studies beschikbaar naar de plaats van stamceltransplantatie (autoloog en allogeen) voor het R/R MZL. Er zijn enkele retrospectieve cohorten beschreven.
Het grootste cohort (EBMT/FIL-GITMO) bestaat uit 199 patiënten die tussen 1994 en 2013 ASCT ondergingen vanwege R/R MZL (111 extranodaal, 55 nodaal en 33 milt), van wie 95 procent chemosensitieve ziekte had. Geschatte percentages van recidief/progressie, ‘non-relapse’ mortaliteit, tweede maligniteit en OS na vijf jaar waren respectievelijk 38, 9, 6 en 73 procent. Het risico op recidief nam af met de tijd vanaf transplantatie, wat curatie in een deel van de patiënten suggereert. Bij multivariate analyse waren hogere leeftijd en sMZL geassocieerd met slechtere overleving [113].
De NCCN en ESMO adviseren, conform het beleid bij folliculair lymfoom (link) hoge dosis therapie en autologe stamceltransplantatie te reserveren voor patiënten met chemosensitieve ziekte met een agressiever beloop; bij voorkeur in tweede of derde remissie [23].
Allogene stamceltransplantatie kan toegepast worden analoog aan de toepassing bij andere indolente NHL, maar selectiecriteria kunnen niet worden gegeven vanwege de afwezigheid van data.
Er zijn geen gerandomiseerde studies gedaan naar de beste behandeling voor het getransformeerde MZL (tMZL). Voor de behandeling van het tMZL wordt verwezen naar de richtlijnen ‘DLBCL’ en ‘folliculair lymfoom’.
De overwegingen en aanbevelingen m.b.t. de behandeling van het tMZL zijn hieronder kort uitgewerkt.
Situatie 1: de patiënt is niet eerder behandeld voor het MZL
Hiervoor kan de richtlijn voor de eerstelijns behandeling van DLBCL gevolgd worden.
Hier geldt dat autologe stamceltransplantatie als consolidatie geen overlevingsvoordeel geeft, alleen een langere progressie-vrije overleving. Indien een goede remissie wordt bereikt na R-CHOP hoeft deze dus niet gevolgd te worden door een consolidatie met autologe stamceltransplantatie, conform de richtlijn voor het folliculair lymfoom [114].
Er is geen onderzoek gedaan naar de rol van rituximab onderhoudsbehandeling in deze setting. Dit wordt, conform de richtlijnen voor de behandeling van het DLBCL, niet aanbevolen in de eerste lijn.
Situatie 2: de patiënt is eerder met chemotherapie behandeld voor het MZL
Inductie met R-CHOP-21 6x (of R-DHAP/R-VIM/R-DHAP indien patiënt al R-CHOP heeft gekregen), gevolgd door consolidatie met een autologe stamceltransplantatie.
Indien er geen stamcellen gemobiliseerd kunnen worden, of er contra-indicaties zijn voor autologe stamceltransplantatie (leeftijd, orgaandysfunctie), kan een expectatief beleid worden gevoerd na bereiken van een complete remissie.
Situatie 3: de patiënt is refractair op inductie met R-CHOP of R-DHAP.
Autologe stamceltransplantatie is voor deze patiënten de enige kans op langduriger overleving. Wel dient dan eerst salvage therapie te worden gegeven om een remissie te bereiken. Hier moet inclusie in lopende studies overwogen worden, bijvoorbeeld met CAR-T cellen.
|
R-CVP (8x, à 3 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1, vincristine 1.4 mg/m2 i.v. (max 2 mg) d1, prednison 40 mg/m2 p.o. d1-5 |
|
R-CHOP (6x, à 3 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, cyclofosfamide 750 mg/m2 i.v. d1, , doxorubicine 50 mg/m2 i.v. d1, vincristine 1.4 mg/m2 (max 2 mg) i.v. d1, prednison 100 mg d1-5 |
|
R- bendamustine (6 x, à 4 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, bendamustine 90 mg/m2 i.v. d1, 2 |
|
R-chloorambucil (6-12 x, à 4 weken) |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1, chloorambucil 10 mg p.o. d1-14 óf 10 mg/m2 p.o. d1-7 |
|
Rituximab monotherapie |
rituximab 375 mg/m2 i.v. (of 1400 mg s.c.) d1,8,15,22, evt gevolgd door onderhoudsbehandeling |
Conform het standpunt van de FMS (https://www.demedischspecialist.nl/onderwerp/biosimilars), en voor wat betreft studies onder de voorwaarden van de HOVON lymfoomwerkgroep, kunnen biosimilars van rituximab gebruikt worden in de behandeling van MZL. Waar in deze richtlijn in behandelschema’s rituximab wordt genoemd, kan er ook gebruik gemaakt worden van biosimilars.
Bij overgevoeligheidsreacties op anti-CD20 antistof, kan onderscheid gemaakt worden tussen:
De eerste twee type reacties kunnen snel na start van de infusie optreden.
Meestal betreft het CRS, en zal deze reactie bij opeenvolgende infusen steeds minder sterk zijn. Geadviseerd wordt om een volgende gift te starten met een zeer langzame toedieningssnelheid en profylaxe toe te passen met H1 en H2 receptor blokkers, steroïden, en evt. een leukotrieën antagonist.
De kans op infusiereacties op de eerste gift rituximab is bij het sMZL hoger dan bij andere indolente iNHL. Daarom kan overwogen worden de eerste dosis te verdelen, waarbij op de eerste dag 50 mg/m2 in 4 uur gegeven wordt, en de resterende hoeveelheid (325 mg/m2) op dag 2 of 3 [63].
Indien er sprake is van een type I overgevoeligheidsreactie, zal deze niet uitdoven. Afhankelijk van of bekend is tegen welk middel de reactie optreedt (de antistof of hulpstoffen), zou een ander type antistof ingezet kunnen worden. Er is in dit kader enige ervaring met ofatumumab, maar dit middel is niet meer beschikbaar. M.b.t. het vervangen van rituximab vanwege allergie door obinutuzumab is zeer beperkte ervaring [115]. Een alternatief is desensitisatie.
Voor een volledig overzicht over het beleid bij rituximab intolerantie wordt verwezen naar overzichtsartikelen over dit onderwerp [116].
Voor de behandeling van het marginale zone lymfoom is, net zoals bij bijvoorbeeld het FL, in het algemeen een beperkte dosis radiotherapie voldoende.
Bij beperkte stadia wordt een dosis van 24 tot 30 Gy geadviseerd, waarbij het involved site principe wordt aangehouden (richtlijnen uitgebracht door de International Lymphoma Radiation Oncology group, ILROG)[84, 117].
Hoewel er aanwijzingen zijn dat een lagere dosis van 4 Gy uitstekende lokale controle geeft, liet de FoRT trial, waarin 548 patiënten met FL en MZL(n=46) in alle stadia (47% st. I) werden gerandomiseerd tussen 24 Gy en 4 Gy, zien dat de tijd tot lokale progressie korter was voor de lage dosis groep (11.7 vs. 19.3 maanden) [85, 88]. Diverse niet-gerandomiseerde studies laten wel een uitstekend resultaat zien voor lage dosis radiotherapie als in opzet curatieve optie bij beperkt stadium MZL, maar de follow-up tijd is doorgaans kort en het aantal patiënten is beperkt.
Voor grotere bestralingsvolumes moet het risico op late toxiciteit door radiotherapie worden meegewogen in het advies. Omdat de dosis relatief laag is, en met moderne bestralingstechnieken de dosis op omliggende organen doorgaans beperkt gehouden kan worden, zal het risico doorgaans beperkt zijn. Voor adviezen over de ‘dose constraints’ in de verschillende ‘organs at risk’ zijn meerdere publicaties beschikbaar (HOVON richtlijnen HL en DLBCL).
Bij gevorderde stadia geeft een lage dosis van 4 Gy op klachten gevende locatie(s) doorgaans uitstekende resultaten met minimale bijwerkingen [87, 118].
Stadium I en II
Involved site radiotherapie 24 Gy (12×2 Gy, 5x per week).
Voor beperkt stadium MALT lymfoom van de maag (t/m st. IIE volgens stadiëring gastro-intestinale lymfomen) adviseert de ILROG een dosis van 30 Gy (15×2 Gy, 5x per week). In opzet curatieve radiotherapie is de eerste keus behandeling bij H. pylori negatief MALT lymfoom van de maag en bij resistente of persisterende ziekte na antibiotische therapie bij H. pylori positief lymfoom. . In de literatuur wordt ook van een dosis van 24 Gy goede resultaten beschreven, echter bij kleine groepen patiënten en soms beperkte follow-up [119, 120]. In Nederland zijn beide doseringen (30 Gy en 24 Gy) gangbaar.
Indien bestralingsveld bij st. II te uitgebreid (d.w.z. te veel late toxiciteit verwacht): behandelen conform uitgebreide ziekte.
Stadium III en IV (uitgebreide ziekte)
In de meeste gevallen palliatieve dosis 1x 4 Gy voldoende.
Radiotherapie kan in hogere dosis gegeven worden bij onvoldoende respons op systemische therapie of bij bulky lokalisaties, m.n. die moeilijk te monitoren zijn en waarbij progressie risico geeft op orgaanfalen (b.v. retroperitoneum). Dosis bijvoorbeeld 30-40 Gy (15-20×2 Gy, 5x per week); dosis en fractionering te individualiseren.
Recidief “beperkt” of palliatief
4 Gy in 1 fractie op de klachten gevende lokalisatie(s).
Halverwege, en aan het einde van inductiebehandeling met immuno(-chemo)therapie moet beeldvormend onderzoek worden verricht.
Interim evaluatie:
Eind evaluatie:
Na afloop van (eerstelijns) behandeling wordt de respons op de diagnostische CT-scan bij voorkeur beoordeeld conform de Lugano criteria 2014[20].
Patiënten met een partiële respons op de CT-scan na inductiebehandeling kunnen in de onderhoudsfase alsnog een complete respons bereiken.
Bij patiënten met onvoldoende respons (minder dan partiële respons op CT scan), moet salvage behandeling overwogen worden.
Ongeveer 3 maanden na H. pylori eradicatie dient respons evaluatie van het MALT lymfoom van de maag plaats te vinden middels een gastroscopie met biopten. Hierin worden adviezen van de NCCN en ESMO gevolgd [4, 28, 34].
Tevens dient er controle op H. pylori eradicatie gedaan te worden.
Zowel de ureum ademtest als de Helicobacter feces antigeen bepaling is hiervoor afdoende. Zuurremmende therapie dient 14 dagen te worden gestopt alvorens een patiënt betrouwbaar kan worden getest met biopten of een fecestest. Routinematige diagnostiek naar H. pylori tijdens endoscopie wordt niet aanbevolen.
Als er na eradicatie therapie nog Helicobacter wordt aangetoond in het biopt en/of de H. pylori feces antigeen is nog positief dan kan een 2e lijn antibiotica worden overwogen. In Nederland is dit wellicht weinig zinvol aangezien resistentie nauwelijks voorkomt.
Histologische respons evaluatie van het MALT lymfoom van de maag is niet eenvoudig. Er is geen definitie voor histologische remissie. Het meest gebruikte histologische scoringssysteem voor MALT lymfomen is het GELA scoring system: zie tabel 5 GELA grading system [121]. Het is belangrijk om te realiseren dat het 3-28 maanden kan duren tot histologisch een CR is bereikt. Dit betekent dat zo lang er na therapie een histologische respons wordt gezien, maar nog wel aanwezigheid van lymfoom (b.v. een ‘responding residual disease’) afgewacht kan worden tot een histologische CR is bereikt. Er bestaat op dat moment nog geen indicatie voor een volgende lijn behandeling. Zelfs wanneer een histologische relapse optreedt na een CR, kan afgewacht worden tenzij patiënt ook klinisch een relapse heeft. Er is aangetoond dat een histologische relapse spontaan weer in een CR kan komen. Advies is om minimaal 2 jaar te wachten alvorens een 2e lijn te starten. Een MALT lymfoom heeft immers een lage kans uit te breiden en/of te transformeren.
Tabel 5. GELA grading system voor histologische respons MALT lymfoom
|
Respons (score) |
Beschrijving |
Histologie |
|
CR |
Complete histologische remissie |
Normale of lege LP en/of fibrose. Afwezige of verspreid plasmacellen en/of kleine lymfocyten, geen LEL |
|
pMRD |
‘Probable minimal residual disease’ |
Lege LP en/of fibrose, aggregaten lymfoïde cellen of noduli in LP/MM en/of SM, geen LEL |
|
rRD |
‘Responding residual disease’ |
Focaal lege LP en/of fibrose met dense, diffuus of nodulaire lymfoide infiltraten, rondom klieren in LP, focale of afwezige LEL |
|
NC |
|
Dicht, diffuus of nodulaire lymfoide infiltraat, LEL meestal aanwezig |
LP= lamina propria, LEL = lymfoepitheliale laesies, NC= no change, MM = muscularis mucosa, SM= submucosa
De follow-up bij een MZL is erop gericht om progressie van het MZL en/ of een behandelindicatie vast te stellen. Beeldvormend onderzoek wordt niet routinematig verricht en moet alleen verricht moet worden als er klinisch verdenking op progressie is en er mogelijke behandelconsequenties zijn. Afhankelijk van de dynamiek van het MZL dienen de controles elke 3-6 maanden plaats te vinden.
Patiënten die met radiotherapie behandeld zijn, dienen ook gecontroleerd te worden op late effecten van deze behandeling. Er bestaan geen specifieke richtlijnen voor MZL patiënten, maar de BETER richtlijn voor HL en DLBCL patiënten kan als leidraad gebruikt worden (link).
Tabel 6 geeft een suggestie m.b.t. controles (en frequentie) voor de follow-up van het MZL
Tabel 6. Follow-up MZL
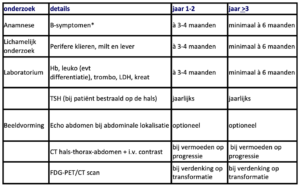
*onverklaarde koorts, gewichtsverlies >10% in 6 maanden, nachtzweten
De frequentie van follow up scopieën is afhankelijk van de uitslag van de scopie (lymfoom negatief, restziekte (pMRD of MRD) of geen verandering) en van de symptomen van patiënt. Zie ook ‘respons evaluatie’ en figuur 1 (Diagnostiek, 1.1. MALT lymfoom van de maag)
Vanwege het soms multifocaal voorkomen van het MALT-lymfoom van de maag is ook tijdens follow-up biopteren volgens een vast “mapping-protocol” aan te raden [123]. Langdurige follow-up wordt aangeraden, ook omdat er verhoogd risico is op de ontwikkeling van een adenocarcinoom van de maag, eveneens gerelateerd aan een chronische Helicobacter pylori infectie [122, 124, 125].
Er is geen plek voor EUS in de follow up van het MALT lymfoom van de maag. Een EUS blijkt niet accuraat de histologie te kunnen voorspellen m.a.w. een afwijkende EUS kan normale histologie hebben zonder aanwezigheid van lymfoom en andersom [126, 127].
© 2022. Alle rechten voorbehouden