Terug naar het richtlijnenoverzicht
De behandeling van symptomatisch multipel myeloom in Nederland, revisie van richtlijn 2021
Definitie symptomatisch multipel myeloom:
De aanbevelingen voor behandeling zoals in deze modules zijn beschreven gelden voor symptomatisch MM.
De diagnose MM wordt gesteld als voldaan wordt aan onderstaande criteria:
≥10% klonale plasmacellen in het beenmerg of biopsie-bewezen bot- of extramedullair plasmacytoom EN één of meer van de volgende myeloom definiërende kenmerken*:
* Myeloom definiërende kenmerken:
Orgaanschade die toegeschreven kan worden aan de onderliggende plasmacel proliferatie:
Biomarkers van maligniteit:
De richtlijn revisie beoogt een praktisch handvat te bieden aan professionals die betrokken zijn bij de behandeling en begeleiding van patiënten met MM. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan. De richtlijn tracht daarmee uniformiteit in Nederlandse ziekenhuizen van de behandeling van multipel myeloom te bewerkstelligen door beschrijving van de best bekende, in Nederland geregistreerde medicijnen/medicijncombinaties. Op dezelfde evidence-based wijze worden voor de supportive care maatregelen bij deze ziekte adviezen gegeven.
Voor het ontwikkelen van de revisie van de richtlijn is een richtlijn-werkgroep ingesteld, bestaande uit leden van de HOVON Multipel Myeloom werkgroep. Voor de module supportive-care zijn enkele niet-myeloom werkgroep leden gevraagd een bijdrage te leveren. Elk lid van de richtlijn-werkgroep is door de Nederlandse Vereniging voor Hematologie gemandateerd voor deelname. De richtlijn-werkgroep werkte gedurende een jaar aan de totstandkoming van de revisie van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn.
In de tabel wordt een overzicht gegeven van de richtlijn-werkgroepleden en hun relevante belangen.
|
Naam |
Belangen |
|
A. Broijl |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): Janssen, Sanofi, Amgen, Pfizer, BMS Reputatiemanagement: bestuur myeloom werkgroep |
|
R. Brouwer (geen lid werkgroep MM, bijdrage module 4 supp care) |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): organisatie Masterclass Zoetermeer, sponsoring Novartis, Amgen, Incyte, Takeda, Janssen Reputatiemanagement: Lid van Hovon LWG |
|
A. Croockewit |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
N.W.C.J van de Donk |
Extern gefinancierd onderzoek: Janssen Pharmaceuticals, AMGEN, Celgene, Novartis, Cellectis and BMS Participatie aan advisory board zonder persoonlijke financiële vergoeding: Janssen Pharmaceuticals, AMGEN, Celgene, BMS, Sanofi, Takeda, Roche, Novartis, Bayer, Adaptive, Pfizer, AbbVie, and Servier, all paid to institution Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: bestuur myeloom werkgroep |
|
C.H.M.J. Van Elssen |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: Sanofi Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
E.de Kort |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
A.Kleinjan |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
M.van der Klift |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
K.Meijer (geen lid werkgroep MM, bijdrage module 4 supp care) |
Extern gefinancierd onderzoek: NWO, fonds BOOTHR, Federatie Nederlandse Trombosesdiensten Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: voorzitter NVvH, medevoorzitter Transmuraal Trombosecentrum NoordNederland (onbezoldigd) Overig: Sprekersvergoedingen van Alexion, Bayer en CSL Behring, vergoedingen voor deelname aan studie-commissies voor Bayer, Astra Zeneca en Octapharma, vergoeding voor consultatie voor Uniqure en Therini. Alle betalingen gaan naar het instituut. Onbezoldigde deelname aan DSMB voor Alife2 studie. |
|
M.C. Minnema |
Extern gefinancierd onderzoek: Analysis of rare cancer AL amyloïdosis within Europe, private fund, CAR T resistance in Multiple Myeloma, private fund, Eureka – Bonding molecular genotyping and phenotyping to outcome measures in AL amyloidosis: A EUropean REgistry and sample sharing networK to promote the diagnosis and management of light chain Amyloidosis. European Joint Programme Rare Diseases, ZonMW, DEDECIT-ERA4H Develop a nanotracer for early diagnosis of cardiac amyloidosis and disease monitoring, NWO Participatie aan advisory board zonder persoonlijke financiële vergoeding: Jansen-Cilag, CDR life, GSK, BMS Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: 2006 onwards: member HOVON working party multiple myeloma, lymphoma, LLPC and Immune Effector Cell (IEC) 2014 onwards: board member Nederlandse Vereniging van Hematologie 2019 onwards: program committee Symposium on Systemic Amyloidosis 2019 onwards: Women in Lymphoma steering committee (international) 2022 onwards: lid KWF beoordelingscommissie Ontwikkeling en Implementatie May 2022 onwards: bestuurslid HOVON Myeloom WG August 2022 onwards: member MPE’s Medical Advisory Committee Sept 2022 onwards: member IWMF Scientific Advisory Sub-Committee on the Waldenstrom’s Macroglobulinemia (WM) Global Awareness Building Initiative Oct 2022 onwards: member International Myeloma Working Group Sep 2023 onwards: voorzitter van Wetenschapscommissie van NVvH |
|
M.Mohlmann |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): 2022 Pfizer Reputatiemanagement: lid HOVON lymfoom werkgroep en HOVON myeloom werkgroep |
|
I. Nijhof |
Extern gefinancierd onderzoek: nvt Participatie aan advisory board zonder persoonlijke financiele vergoeding: nvt Adviesraad (met persoonlijke vergoeding): nvt (vergoeding congreskosten: Janssen) Reputatiemanagement: nvt
|
|
R.Oostvogels |
Extern gefinancierd onderzoek: Janssen BV, Hematon Participatie aan advisory board zonder persoonlijke financiële vergoeding: nvt Adviesraad (met persoonlijke vergoeding): nvt Reputatiemanagement: nvt |
|
J.Regelink |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
W.Roeloffzen |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: Janssen, BMS, Amgen, Sanofi (vergoeding congreskosten: AbbVie, Janssen, Takeda) Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
C van Rooijen |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
M.Seefat |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement:geen |
|
S.Soechit |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: NvvH lid, lid Hovon myeloom werkgroep |
|
P. Sonneveld |
Extern gefinancierd onderzoek: MMRF, EMN Participatie aan advisory board zonder persoonlijke financiële vergoeding: Janssen, Sanofi, Pfizer Adviesraad (met persoonlijke vergoeding): Janssen, Sanofi, Pfizer Reputatiemanagement: president EMN, HOVON MWG, EHA Governance committee, ASH I2 Committee, IMS Board |
|
E. van der Spek |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: bestuur NVvH |
|
F.Spoelstra (geen lid werkgroep MM, bijdrage module 4 supp care) |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
C.Stege |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: Sanofi, Janssen Adviesraad (met persoonlijke vergoeding): Janssen Reputatiemanagement: Redactieraad Hemato-Oncologie |
|
E. de Waal |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: lid NvvH, lid van patientenvereniging hematon, lid van de werkgroep multipel myeloom |
|
R.Wester |
Extern gefinancierd onderzoek: geen Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: geen |
|
P.Ypma |
Extern gefinancierd onderzoek: Sanquin Participatie aan advisory board zonder persoonlijke financiële vergoeding: geen Adviesraad (met persoonlijke vergoeding): geen (vergoeding congreskosten: Janssen) Reputatiemanagement: bestuurslid HOVON Myeloom Werkgroep |
|
S. Zweegman |
Extern gefinancierd onderzoek: Janssen, Takeda Participatie aan advisory board zonder persoonlijke financiële vergoeding: BMS, Janssen, BMS, Oncopeptides, Sanofi Adviesraad (met persoonlijke vergoeding): geen Reputatiemanagement: voorzitter HOVON Myeloom Werkgroep, lid bestuur Nederlandse Vereniging voor Hematologie, lid werkgroep Hematologie van de Horizonscan Geneesmiddelen Zorg Instituut Nederland, lid taakgroep Multipel Myeloom Zorg Instituut Nederland, lid adviesraad Myeloma Patients Europe. |
Binnen de vergadering van de HOVON myeloom Werkgroep is eind 2022 gevraagd wie interesse had in deelname aan de richtlijn werkgroep. Geïnteresseerden zijn ingedeeld bij elk van de vier modules ter revisie van bestaande teksten. De module-groepen zijn voorgezeten door een voorzitter die de teksten prepareerde met een ieders input. In een drietal bijeenkomsten, waaronder twee reguliere vergaderingen, zijn knelpunten in de richtlijnteksten besproken en per mail zijn de versies met de richtlijn-werkgroepleden gedeeld. Als voorbereiding op de myeloomwerkgroep-vergadering van oktober 2023, kregen alle (160) geadresseerden van de mail van de myeloomwerkgroep de teksten toegestuurd, en na de vergadering hadden alle leden 14 dagen de tijd om opmerkingen en vragen te versturen aan de voorzitter van de richtlijn-werkgroep. Deze richtlijn is zoveel mogelijk gebaseerd op gepubliceerd wetenschappelijke onderzoek te weten gerandomiseerde of niet gerandomiseerde klinische studies of consensus. Daarnaast werden de data die recent bij internationale congressen werden gepubliceerd gebruikt. Het niveau van bewijsvoering staat vermeld in de onderbouwing. Deze is vrij uitgebreid om het niveau van de bewijsvoering te onderbouwen en de lezer achtergrondinformatie te verstrekken.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld.
In de verschillende fasen van de richtlijn revisie is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast wordt er een toelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de websites www.hovon.nl en www.hematologienederland.nl. De richtlijn geeft aanbevelingen over, of kan worden gebruikt bij, het geven van voorlichting aan patiënten. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal. Op de website www.hematologienederland.nl wordt de patiëntinformatie aangepast aan de inhoud van deze richtlijn.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon. Deze vertegenwoordiger is aanwezig bij de vergaderingen van de HOVON werkgroep multipel myeloom en staat in de werkgroep geadresseerden-lijst om per mail alle updates met betrekking tot de richtlijn-revisie te ontvangen.
Module 1 Initiële behandeling bij patiënten die in aanmerking komen voor een autologe stamceltransplantatie
Submodule 1: inductietherapie bij patiënten met symptomatisch multipel myeloom voor een autologe stamceltransplantatie
AANBEVELINGEN/ CONCLUSIES
Submodule 2: stamcelmobilisatie bij patiënten met symptomatisch multipel myeloom voor een autologe stamceltransplantatie
AANBEVELINGEN/ CONCLUSIES
Submodule 3: op welke wijze wordt een autologe stamceltransplantatie uitgevoerd?
AANBEVELINGEN/CONCLUSIES
Submodule 4: consolidatietherapie na autologe stamceltransplantatie
AANBEVELINGEN/ CONCLUSIES
Submodule 5: hoe zijn de adviezen ten aanzien van onderhoudstherapie na autologe stamceltransplantatie?
AANBEVELINGEN/CONCLUSIES
Module 2 Initiële behandeling bij patiënten die niet in aanmerking komen voor een autologe stamceltransplantatie
AANBEVELINGEN/CONCLUSIES
Module 3 Behandeling bij patiënten met een recidief multipel myeloom
Submodule 1: (tweede) autologe stamceltransplantatie in de recidief behandeling bij MM
AANBEVELINGEN
Uitgestelde eerste autologe transplantatie
Tweede autologe transplantatie
Submodule 2a: behandeling van recidief MM indien niet refractair voor lenalidomide
AANBEVELINGEN/CONCLUSIES
Submodule 2b: behandeling van recidief MM indien refractair voor lenalidomide
AANBEVELINGEN/CONCLUSIES
Submodule 3: behandelingen die worden verwacht als behandelmogelijkheid bij recidief MM
CONCLUSIES
Module 4 Supportive care bij patiënten met (symptomatisch) multipel myeloom
Submodule 1: medicamenteuze behandeling voor botondersteuning bij patiënten met multipel myeloom
1a Welke botafbraak-remmende medicatie
1b Dosis, frequentie en duur van de behandeling
1c Aaspecten m.b.t. hypocalciëmie, osteonecrose en nierinsufficiëntie
AANBEVELINGEN/CONCLUSIES
1a. Botafbraak-remmende medicatie
1b. Dosis, frequentie en duur van de behandeling
1c. Monitor veiligheid t.a.v. nierinsufficiëntie, hypocalciëmie en osteonecrose
Submodule 2: Indicatie voor aanvullende behandeling bij myeloom botziekte: Radiotherapie (a), kyfoplastiek (b) of chirurgische interventie (c)
AANBEVELINGEN/CONCLUSIES
Submodule 3: Trombosepreventie bij patiënten met multipel myeloom
3a risico-inschatting op trombose in MM patiënten
3b wanneer tromboseprofylaxe aan patiënten met multipel myeloom
3c welke tromboseprofylaxe
AANBEVELINGEN
CONCLUSIES
Submodule 4: Infecties en multipel myeloom
4a: indicatie voor infectie profylaxe bij patiënten die een behandeling krijgen voor MM?
4b: indicatie voor hervaccinatie of actieve immunisatie van patiënten met MM?
4c: indicatie voor immuunglobuline substitutie therapie (IVIG)?
AANBEVELINGEN
a.Profylaxe
b. Vaccinaties
c. Intraveneuze Immunoglobulinen (IVIG) bij recidiverende infecties
Submodule 5: Aanbevelingen overige bijwerkingen en complicaties bij de behandeling van multipel myeloom (anemie, neutropenie, en lenalidomide geïnduceerde diarree)
AANBEVELINGEN
Anemie
Neutropenie
G-CSF kan ter ondersteuning worden gestart bij patiënten met lenalidomide of pomalidomide-geïnduceerde neutropenie CTC graad 4 (ANC<0.5 x10e9/L) of indien CTC graad 2-3 (neutrofielen 0.5-1.0 x10e9/L), gecompliceerd door koorts en/of infectie (SORT C).
Diarree bij lenalidomide gebruik
Bij lenalidomide-geïnduceerde diarree, die veroorzaakt kan zijn door galzuurmalabsorptie, adviseert de MWG vermindering van de intake van vet (tot 20% van de totale calorie-intake) en het starten van een galzuurbindend hars, zoals colestyramine (Questran©), maximaal 6 maal daags 4 g (= 1 sachet) >4 uur voor en na lenalidomide-inname. De dosering individualiseren op geleide van het effect; verlagen bij obstipatie en bij persisterende diarree, de dosering eventueel ophogen naar maximaal 24 g (= 6 sachets) per dag (SORT C). Alternatief voor colestyramine is colesevelam (Cholestagel©) tot maximaal 6 maal daags 625 mg >4 uur voor en na lenalidomide-inname, ingenomen samen met voeding.
De laatste richtlijn voor de behandeling van het Multipel Myeloom (MM) is in 2021 gepubliceerd, namens de Myeloom Werkgroep (MWG) van stichting Hemato-Oncologie Volwassenen Nederland (HOVON). In de afgelopen jaren zijn verschillende grote gerandomiseerde studies gepubliceerd, die wijziging van de richtlijn rechtvaardigen. Deze herziene richtlijn is gebaseerd op informatie uit deze studies, alsmede op expert-opinies van de leden van de MWG. Hierbij worden effectiviteits- en toxiciteits-data in ogenschouw genomen. Behandeling van patiënten in (HOVON)studieverband is essentieel. Bij alle aanbevelingen is dit dan ook het primaire uitgangspunt. Alleen op deze wijze kan de waarde van nieuwe behandelingsmodaliteiten vastgesteld worden.
Voor HOVON-studies: overleg zo nodig met het consult-verlenend ziekenhuis en zie: http://www.hovon.nl/studies/studies-per-ziektebeeld/mm.html
Indien geen HOVON-studie beschikbaar is: overleg met het consult-verlenend ziekenhuis en zie: http://www.hovon.nl/werkgroepen/studiewerkgroepen/myeloma.html
Deze richtlijn geeft tevens aanbevelingen voor patiënten die niet willen of kunnen participeren in studies. Bij deze aanbevelingen is, waar mogelijk, uitgegaan van overlevingsvoordeel als parameter. In geval er (nog) geen overlevingsvoordeel is aangetoond maar behandeling wel in een langere progressie-vrije overleving resulteert en gepaard gaat met een verwachte verbetering van de kwaliteit van leven is de werkgroep van deze parameter in haar aanbevelingen uitgegaan
Zeker bij de behandeling van het recidief of resistent MM ontbreken niet zelden gegevens over de optimale duur van de behandeling. Dan is uitgegaan van de duur zoals beschreven in de grootste beschikbare studies.
Deze richtlijn dient als basis voor regionale multidisciplinaire overlegsituaties (MDO). Gedurende dit MDO wordt een behandelplan vastgelegd en kan aangetoond worden dat er op goede indicatie, efficiënt en verantwoord gebruik gemaakt wordt van geneesmiddelen. Dit ondersteunt het voorschrijven van deze middelen ook buiten het UMC. In deze richtlijn gaan we uit van de veiligheid en de noodzaak tot het voorschrijven van dure geneesmiddelen in alle ziekenhuizen ongeacht hun echelon status, dus in echelon A-D. Zijn er redenen om daarvan af te wijken, is dat specifiek aangegeven. Voor autologe stamceltransplantaties geldt dat deze onder de Wet op bijzondere medische verrichtingen valt en een het transplantatiecentrum een JACIE-accreditatie behoeft; deze behandeling kan derhalve alleen in geaccrediteerde centra met een wettelijke vergunning uitgevoerd worden.
Sommige van de behandelcombinaties die in de richtlijn beschreven zijn, zijn nog niet vergoed en/of geregistreerd. Gezien het feit dat dit snel kan wijzigen, is besloten dit niet consistent in de tekst te benoemen maar in een separate tabel: “Status van registratie en vergoeding van nieuwe behandelcombinaties” in de bijlagen aan het einde van het document.
Het aantal patiënten in Nederland met plasmacelziekten is stijgend, in 2022 was het aantal nieuw gediagnosticeerde patiënten met multipel myeloom 1561 (bron: NKR-cijfers, IKNL 2022; figuur).
De reden om de bestaande richtlijn te herzien is beschreven in de inleiding en komt voort uit de sterk toegenomen behandelingsmogelijkheden zowel in eerste lijn als bij terugkeer van de ziekte. Er zijn tot heden geen curatieve opties.
Overzicht van de uitgangsvragen:
|
Module |
Uitgangsvra(a)g(en) /submodules |
|
1 Initiële behandeling bij patiënten die in aanmerking komen voor een autologe stamceltransplantatie |
1: Wat is de inductietherapie bij patiënten met symptomatisch multipel myeloom voor een autologe stamceltransplantatie? |
|
2: Hoe vindt stamcelmobilisatie plaats bij patiënten met symptomatisch multipel myeloom voor een autologe stamceltransplantatie? |
|
|
3: Op welke wijze wordt een autologe stamceltransplantatie uitgevoerd? |
|
|
4: Wordt consolidatietherapie gegeven na autologe stamceltransplantatie? |
|
|
|
|
|
2 Initiële behandeling bij patiënten die niet in aanmerking komen voor een autologe stamceltransplantatie |
Wat is de eerstelijnsbehandeling van patiënten met multipel myeloom die vanwege leeftijd en/of verminderde fitheid niet in aanmerking komen voor een autologe stamceltransplantatie? |
|
|
|
|
3 De behandeling bij patiënten met een recidief multipel myeloom |
1: Wat is de plaats van een (tweede) autologe stamceltransplantatie in de recidief behandeling bij multipel myeloom? |
|
2a: Welke aanbevelingen zijn er met betrekking tot behandeling van recidief MM indien niet refractair voor lenalidomide? 2b: Welke aanbevelingen zijn er met betrekking tot behandeling van recidief MM indien refractair voor lenalidomide? |
|
|
3: Welke behandelingen worden verwacht als behandelmogelijkheid bij recidief multipel myeloom? |
|
|
|
|
|
4 Supportive care bij patiënten met (symptomatisch) multipel myeloom |
1: Welke medicamenteuze behandeling voor botondersteuning wordt geadviseerd bij patiënten met multipel myeloom? 1a: Welke botafbraak-remmende medicatie wordt toegepast? 1b: Wat is de dosis, frequentie en duur van de behandeling? 1c: Welke aspecten zijn van belang m.b.t. hypocalciëmie, osteonecrose en nierinsufficiëntie? |
|
2: Wanneer is er indicatie voor aanvullende behandeling bij myeloom botziekte ? Radiotherapie (a), kyfoplastiek (b) of chirurgische interventie (c) |
|
|
3: Wat is de beste wijze van trombosepreventie bij patiënten met multipel myeloom? 3a: Hoe wordt een risico-inschatting op trombose in MM patiënten gemaakt? 3b: Wanneer moet tromboseprofylaxe gegeven worden aan patiënten met multipel myeloom? 3c: Welke tromboseprofylaxe wordt geadviseerd aan patiënten met multipel myeloom? |
|
|
4: Infecties en multipel myeloom 4a: Is er een indicatie voor infectie profylaxe bij patiënten die een behandeling krijgen voor MM? 4b: Is er een indicatie voor hervaccinatie of actieve immunisatie van patiënten met MM? 4c: Is er een indicatie voor immuunglobuline substitutie therapie (IVIG)? |
|
|
5: Aanbevelingen supportive care overige bijwerkingen en complicaties bij de behandeling van multipel myeloom (anemie, neutropenie, en lenalidomide geïnduceerde diarree) |
De MWG is van mening dat patiënten die in aanmerking komen voor een autologe stamceltransplantatie behandeld dienen te worden binnen studieverband.
In 2023 zijn de CARTITUDE-6 studie en de EMN33 (Taurus studie) opengegaan. Cartitude-6 is een gerandomiseerde fase III studie waarin daratumumab-bortezomib-lenalidomide-dexamethason-inductie wordt gevolgd door cilta-cel (CART-cel therapie) of hoge dosis melfalan en autologe stamceltransplantatie. De EMN33 studie is een fase II studie met daratumumab-VRD gevolgd door HDM en autologe stamceltransplantatie en consolidatie met daratumumab-VRD, waarbij onder andere MRD-bepaling op perifeer bloed en beenmerg alsmede dosis aanpassing van bortezomib en dexamethason bij toxiciteit belangrijke onderzoeksvragen zijn. Tevens zijn studies open die de onderhoudsfase na autologe stamceltransplantatie onderzoeken: de EMN30 studie onderzoekt lenalidomide versus teclistamab+ lenalidomide in de onderhoudsfase van behandeling in de eerste lijn en de EMN26 onderzoekt (in fase 2 studie) iberdomide als onderhoudstherapie. Voor patiënten die buiten studieverband worden behandeld gelden de aanbevelingen beschreven in de submodules 1 t/m 5.
AANBEVELINGEN/ CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur inductietherapie
Het doel van inductietherapie is het bereiken van een zo diep mogelijke respons, omdat uit diverse studies is gebleken dat de mate van respons die bereikt wordt door inductietherapie zich vertaalt in een langere progressie vrije overleving (PFS) en overall survival (OS) na de autologe stamceltransplantatie.1-5
In de afgelopen jaren is aangetoond dat de combinaties van daratumumab met zowel bortezomib/thalidomide/dexamethason als met bortezomib/lenalidomide/dexamethason (quadrupel-combinaties) de respons verhogen alsmede de PFS verlengen ten opzichte van triple combinaties. 6,7,11
Overwegingen met betrekking tot de literatuur
Een analyse van de HOVON 131/Cassiopeia studie toonde dat de toevoeging van daratumumab aan VTD tijdens inductietherapie en consolidatie resulteerde in een significant hoger (stringent) complete respons percentage (39% versus 26%) en MRD-negativiteit (64% versus 44%) 100 dagen na de transplantatie.6,7 Bij een follow-up van 35.4 mnd, mediane PFS was nog niet bereikt in de dara-VTD arm, en 46.7 mnd in de VTD arm (HR 0.53; 95% CI 0.42–0.68; P <0.0001).7 Derhalve heeft Dara-VTD de voorkeur als inductietherapie.
Een recente analyse van de Griffin studie toonde een hoger stringent complete respons percentage aan het einde van de consolidatiefase door toevoeging van daratumumab aan VRD-inductietherapie en consolidatie (42% vs 32%; OR 2,82; p=0.06), nog verder verbeterend met langere follow-up tot sCR van 62% vs 45% ten faveure van dara-VRD. MRD negativiteit percentages waren eveneens hoger in de dara-VRD vs de VRD arm, namelijk 51% vs 20% gemeten na 22 maanden follow-up. 8,9,10 De mediane PFS in deze studie is voor beide armen nog niet bereikt ten tijde van de laatst gerapporteerde follow-up van 49,6 maanden.10 De PFS-rate na 48 maanden follow-up bedraagt 87% vs 70% (dara-VRD vs VRD).7,8 Recent toonde de eerste analyse van de fase 3 Perseus studie eveneens dat toevoeging van daratumumab aan VRD inductie en consolidatie, de PFS op 48 maanden deed verbeteren met 84.3% (dara-VRD) versus 67.7% (VRD) (HR 0.42; 95% CI 0.3-0.59; P <0.0001).11 In de Perseus studie vond maintenance plaats met daratumumab-lenalidomide (dara-VRD arm) versus lenalidomide (VRD arm). Vanwege de effectiviteits-data en de lagere kosten van daratumumab-VRD ten opzichte van daratumumab-VTD (lenalidomide is generiek voorschrijfbaar), alsmede de (in Nederland) wisselend beperkte beschikbaarheid van thalidomide, gaat de voorkeur van de MWG uit naar daratumumab-VRD. Daratumumab-VRD is per november 2022 goedgekeurd als off label indicatie (voor patiënten die een stamceltransplantatie ondergaan). Dit betreft de inductie- en consolidatie behandeling (respectievelijk 4 cycli voor en 2 cycli na de stamceltransplantatie).
Qua toxiciteit worden in quadrupel combinaties met daratumumab toevoeging aan VTD en VRD meer neutropenie, trombopenie en anemie gerapporteerd.7,8,11 In vergelijkingen tussen studies met VTD-inductietherapie en VRD-inductietherapie worden bij het thalidomide bevattende schema hogere percentages neuropathie graad 2-4 gemeld dan bij VRD inductietherapie, hoewel directe vergelijkingen ontbreken en bortezomib een belangrijk aandeel heeft in het optreden van polyneuropathie.12-15 Een recente meta-analyse waarin de twee inductieregimes met vier middelen (waaronder daratumumab) werden vergeleken (dara-VTD en dara-VRD) met de triple combinaties VTD en VRD, toonde een gering verminderd relatief risico op perifere neuropathie (RR 0,92) ten faveure van de quadrupel combinaties.16 In de Griffin (dara-VRD) en Cassiopeia trial (dara-VTD) 6,8 was de incidentie van neuropathie vergelijkbaar (in Griffin graad 3/4 neuropathie 7,1% en 7,8% in de dara-VRD en VRD arm respectievelijk 8 en in Cassiopeia maximale graad > 3 neuropathie in 10% van de patiënten).6 In de Perseus studie werd perifere sensore neuropathie graad 3-4 gerapporteerd bij respectievelijk 4,3% (dara-VRD) en 4% (VRD).11
In het algemeen wordt een autologe stamceltransplantatie verricht in patiënten die 65 jaar of jonger zijn.2-6 Bij patiënten tussen de 65 en de 70 jaar, die in goede klinische conditie zijn, kan een autologe stamceltransplantatie worden overwogen; de Griffin studie includeerde patiënten tot 70 jaar.7
Indien overwogen wordt andere regimes te gebruiken dan Dara-VTD of Dara-VRD zijn de gegevens van onderstaande studies van belang:
Een meta-analyse waarin bortezomib-based (n=787) versus non-bortezomib-based (n=785) inductietherapie werd vergeleken toonde dat het percentage patiënten dat na de autologe stamceltransplantatie een CR of near CR behaalde significant hoger was in de bortezomib-behandelde patiënten (38% versus 24%). De PFS was significant langer en daarnaast bleek de OS op 3 jaar statistisch significant hoger te zijn; 80% versus 75%.17
Er is één gerandomiseerde studie en één retrospectieve case-matched studie waarin werd aangetoond dat VTD in een betere respons resulteerde dan VCD, respectievelijk CR 13 versus 9%, ≥VGPR 66 versus 56% en ≥ PR 92 versus 83% en CR 19 versus 7%, ≥VGPR 43 versus 32% en ≥PR 93 versus 84% 8,9.18,19 Om die reden heeft VTD de voorkeur boven VCD. De incidentie van graad 2-4 polyneuropathie was echter 21.9% met VTD, versus 12.9% met VCD, met noodzaak voor dosisreductie.18
Een retrospectieve analyse waarin verschillende inductietherapieën (VCD, VRD, VD, RD, TD en VAD) werden vergeleken, gevolgd door een autologe stamceltransplantatie, toonde dat VRD tot een betere respons na de transplantatie en OS leidde dan VCD en VD.20
Er is niet gerandomiseerde data over bortezomib-lenalidomide-dexamethason (VRD) en carfilzomib-thalidomide-dexamethason (KTD) met een vergelijkbare respons voor autologe stamceltransplantatie als VTD echter niet head to head vergeleken. In geval van KTD trad polyneuropathie graad 3-4 slechts bij 1% van de patiënten op.21 De fase II Master study onderzocht MRD status bij patiënten die een carfilzomib bevattende quadrupel inductiebehandeling kregen (daratumumab-KRD) gevolgd door autologe stamceltransplantatie en consolidatiebehandeling met dara-KRD.22 Naast hoge responspercentages (80% MRD negativiteit), werden lage incidenties van neuropathie waargenomen (2%).22 Om die reden stelt de MWG carfilzomib voor als alternatief voor bortezomib (niet geregistreerd, niet vergoed).
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG
REFERENTIES
AANBEVELINGEN/ CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur stamcelmobilisatie
De minimale dosis te reïnfunderen stamcellen voor stamceltransplantatie na hoge dosis melfalan is 2 x 106 CD34+ cellen/kg lichaamsgewicht, een dubbele hoeveelheid zou moeten worden geoogst indien een tandem transplantatie wordt overwogen dan wel een transplantaat wordt bewaard voor de recidiefsetting bij patiënten < 67 jaar. Naast oogsting na toediening van cyclofosfamide (meest gebruikte dosering 2000mg/m2) en filgrastim (G-CSF), zijn ook (niet gerandomiseerde) data beschikbaar met betrekking tot steady-state oogsten (met alleen G-CSF) bij patiënten die quadrupel inductietherapie ondergingen (daratumumab en lenalidomide bevattende schema’s). Cyclo-priming voor oogst levert meer stamcellen op en in minder oogst-dagen, bij de steady-state procedure is sprake van meer gebruik van plerixafor en mogelijk hogere kosten.
Overwegingen met betrekking tot de literatuur
Aantal cellen: Mobilisatie en collectie van stamcellen uit het perifere bloed voor autologe stamceltransplantatie bij multipel myeloom wordt geadviseerd in een minimale dosis van 2 x 106 CD34+ cellen/kg lichaamsgewicht.1,2 Bij patiënten die in aanmerking komen voor een tandem autologe stamceltransplantatie (high risk cytogenetica, zie submodule 3) en voor patiënten < 67 jaar ten tijde van oogsting wordt een dubbele hoeveelheid stamcellen geoogst (>4 x 106 CD34+ cellen/kg lichaamsgewicht), zodat bij recidief behandeling na re-inductie therapie een tweede hoge dosis therapie met stamcelteruggave kan worden overwogen. Reïnfusie van hogere doseringen stamcellen dan de minimale hoeveelheid van 2 x 106 CD34+ cellen/kg lichaamsgewicht is geassocieerd met snellere recovery van trombocyten en neutrofielen, maar de meest ideale hoeveelheid stamcellen voor reïnfusie is niet duidelijk.3 In het algemeen wordt niet geadviseerd voor drie reïnfusies te oogsten in geval van hoog risico cytogenetica.
Er zijn verschillende manieren van stamcelmobilisatie:
De veiligheid en efficiëntie van oogsten met alleen G-CSF met standaard toevoeging van plerixafor bij MM-patiënten werd reeds onderzocht in 2013, waarbij bij een groep van 99 myeloom patiënten in 98% voldoende cellen konden worden geoogst in mediaan 1 aferese-dag.7 In deze trial was een zeer gering aantal patiënten met lenalidomide inductietherapie geïncludeerd. Een meta-analyse van 18 studies betreffende multipel myeloom patiënten (retrospectieve data en 2 RCTs) vergeleek de efficiëntie, veiligheid en overall survival van patiënten die een mobilisatie met cyclofosfamide+ G-CSF ondergingen met stamcelmobilisatie met G-CSF alleen.7 Met cyclopriming werd een hoger aantal stamcellen geoogst in een kortere tijdsduur van aferese in vergelijking met steady-state oogsting. Wel werden hogere incidenties van koorts en ziekenhuisopnames gedurende de mobilisatieperiode waargenomen bij de chemo-mobilisatie.7 Ook in deze meta-analyse waren relatief weinig patiënten geanalyseerd die lenalidomide in de inductie fase hadden gekregen. Een observationele studie van Johnsrud et alvergeleek veiligheid en efficiëntie van chemomobilisatie met cyclofosfamide met steady state mobilisatie bij bijna 400 myeloom patiënten.8 Het betrof retrospectieve data van 303 patiënten die mobiliseerden met cyclo-priming 4 gr/m2 + GCSF en 95 patiënten met alleen G-CSF, in beide groepen werd on demand plerixafor toegediend.8 Ruim 85% van deze patiënten onderging lenalidomide bevattende inductietherapie voorafgaande aan de mobilisatie. Er werden significante verschillen gevonden in de totale CD34-oogst, en de oogst op de eerste dag ten faveure van de chemomobilisatie, maar geen verschil in oogst-falen en (uiteindelijk) bereiken van minimale stamcel aantallen.8 Tevens was de mediane aferese-duur 1 dag in de chemomobilisatie groep versus 2 dagen in de steady-state groep en werd bij 12,3% vs 49,5% van de patiënten plerixafor toegediend.8 In de chemo-mobilisatie groep werd bij 30% een complicatie waargenomen versus 7,4% in de G-CSF-only groep, waaronder significante verschillen in koorts, spoedeisende hulp bezoeken en ziekenhuisopnames.8 Met betrekking tot engraftment werd een significant sneller trombocyten-herstel gezien (mediaan 15 vs 17 dagen bij resp. chemomobilisatie en steady-state methode) ), gecorreleerd aan hoger aantal CD34 cellen bij reïnfusie. Johnsrud et al vonden lagere kosten in de steady-state mobilisatie groep, maar met onzekerheden en veel assumpties m.b.t. de werkelijke kosten.8 Kosten van chemomobilisatie in vergelijking met (standaard) toediening van plerixafor werden vergeleken in een observationele studie van van der Wyngaert et al.9 In deze analyse waren de kosten van plerixafor-gebruik significant hoger dan bij de toediening van cyclofosfamide als mobiliserend medicament en was de duur van de ziekenhuisopnames niet verschillend.9
Effect inductie-therapie op mobilisatie: lenalidomide, daratumumab. Het effect van lenalidomide op stamcel mobilisatie werd reeds voor 2010 beschreven in retrospectieve studies, waarbij zonder cyclopriming relatief vaak falen van stamceloogst werd gezien10 en een lager aantal stamcellen en meer oogstdagen bij patiënten die lenalidomide bevattende inductie schema’s hadden gekregen.2,10,11 Ook de studie van Johnsrud et al beschrijft een negatief effect van lenalidomide inductietherapie op de stamceloogst, maar dit wordt pas gezien bij een aantal inductiekuren van 6 of meer.8 Gezien dit effect van lenalidomide op stamcelmobilisatie wordt geadviseerd de oogst na 4 kuren inductie te verrichten.2
Ook daratumumab heeft een nadelig effect op stamcelmobilisatie. In de Cassiopeia studie werd in de Dara-VTd arm een lager aantal CD34-positieve cellen geoogst; 6,7 x 106/kg dan in de VTd groep; 10 x 106/kg. Daarnaast bleken meer patiënten plerixafor nodig te hebben in de Dara-VTd arm; 22% versus 8% in de VTd arm en vond de oogst plaats in mediaan 1,9 (Dara-VTD) versus 1,4 (VTD) aferese-dagen.12 Overigens bleek in de studie het aantal patiënten dat de behandeling vervolgde met een autologe stamceltransplantatie en het hematopoietische herstel gelijk in beide armen.12
In een recent gepubliceerde analyse van mobilisatie-data van de fase 2 Master en Griffin trials (Dara-KRD in de Master trial en Dara-VRD vs VRD in Griffin) werd oogst-efficiëntie, plerixafor gebruik en hematopoïetisch herstel beschreven.13 In deze trials vond geen chemomobilisatie plaats, maar uitsluitend steady-state mobilisatie. Het mediane aantal CD34+ cellen was 6×106/kg (range 2.2 to 13.9) na Dara-KRD inductie, 8.3×106 /kg (range 2.6 to 33) na Dara-VRD inductie, en 9.4 x 106 /kg (range 4.1 to 28.7) na VRD inductietherapie.13 Mediane aantal collectie-dagen was 2 (Dara-KRD), 2 (Dara-VRD) en 1 (VRD). Plerixafor gebruik, vooraf of als “rescue”, was hoger bij patiënten die Dara-KRd (97%) en Dara-VRD (72%) kregen in vergelijking met degenen die VRD-inductietherapie ondergingen (55%).13 De mediane tijd tot herstel van neutrofielen was 12 dagen in alle drie behandelgroepen. In de beide trials was een verschillende definitie voor trombocyten-herstel; engraftment data met betrekking tot trombocyten zijn er derhalve niet.13 In de fase 3 Perseus studie werd mediaan 5.5 x 106 /kg CD34+ cellen geoogst (dara-VRD) versus 7.4 x 106 /kg CD34+ cellen in de VRD arm; mediane tijd tot hematopoïetisch herstel was gelijk (14 dagen beide armen).14
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG
REFERENTIES
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur autologe stamceltransplantatie
Gezien de zeer goede resultaten van de inductietherapie met introductie van nieuwe middelen is onderzocht of een autologe transplantatie in eerstelijn nog steeds noodzakelijk is. Er zijn meerdere studies die aantonen dat een autologe stamceltransplantatie van toegevoegde waarde is. In geen van deze studies is echter anti-CD38 therapie in de inductie behandeling gebruikt. Vier fase 3 studies en 1 fase 2 studie worden in onderstaande toegelicht.1-6
Overwegingen met betrekking tot de literatuur
In een Italiaanse studie werd een vergelijking gemaakt tussen behandeling met melfalan-prednison-lenalidomide (MPR) en hoge dosismelfalan (HDM) gevolgd door een autologe stamceltransplantatie, na inductie met lenalidomide-dexamethason. Vervolgens vond een tweede randomisatie plaats tussen onderhoudstherapie met lenalidomide of geen onderhoudsbehandeling. De studie toonde aan dat intensieve therapie met HDM en autologe SCT superieur was in PFS en OS ten opzichte van MPR 1.
De IFM studiegroep (IFM 2009 studie) vergeleek behandeling met 3 cycli VRD gevolgd door een autologe stamceltransplantatie na conditionering met HDM en vervolgens 2 consolidatie cycli met VRD versus 8 cycli VRD. Zowel de respons (CR 59% versus 48% en ontbreken van Minimaal Residuale Ziekte (MRD) 79% versus 65%) als de PFS (50 versus 36 maanden) waren significant beter in de patiënten die een transplantatie in eerste lijn ondergingen. De OS was niet verschillend2.
De HOVON 95/EMN02 studie, waarin na 4 cycli met VCD gerandomiseerd werd tussen een autologe stamceltransplantatie na conditionering met HDM versus bortezomib-melfalan-prednison (VMP), toont een soortgelijk resultaat (mediane PFS 56.7 maanden versus 41.9 maanden) 3. Een recente analyse toonde tevens een langere OS 4.
In de recente analyse van de Forte trial, een driearmige fase 2 studie (4 kuren carfilzomib-lenalidomide-dexamethason(KRD)/HDM-auSCT/4 KRD consolidatiekuren versus 12 KRD kuren versus 4 kuren carfilzomib-cyclofosfamide-dexamethason (KCD)/HDM-auSCT/4 KCD consolidatiekuren) werd onderzocht of er een toegevoegde waarde was van een autologe stamceltransplantatie na inductie.5 In beide armen werd nadien onderhoudstherapie gegeven met lenalidomide of lenalidomide plus carfilzomib 5. De PFS was beduidend langer in de groep met KRD/HDM-autoSCT dan in de groep met KRD12 en KCD/HDM-auto-SCT) (4-jaar PFS resp 69%, 56% en 51%)
In de DETERMINATION trial werd gerandomiseerd tussen 8 cycli VRD enerzijds en 3 cycli VRD gevolgd door HDM en autologe stamceltransplantatie anderzijds. Beide groepen kregen lenalidomide onderhoud. Autologe transplantatie gaf een duidelijk verbetering van de PFS (67,5 vs 46,2 maanden). Er werd geen toename in OS gezien 6.
De dosering melfalan is onderzocht in een gerandomiseerde studies waarin 200 mg/m2 vergeleken werd met 100 mg/m2. 200 mg/m2 bleek tot een significant betere event free survival te leiden ten opzichte van 100 mg/m2.7 Bij een kreatinineklaring <40 ml/min wordt een dosering van 140 mg/m2 aanbevolen. Hiermee blijkt, weliswaar niet head to head vergeleken, de effectiviteit gelijk aan 200 mg/m2, terwijl de toxiciteit acceptabel is 7. In retrospectieve data lijkt bij oudere patiënten het effect van 140 mg/m2 gelijk aan dat van 200 mg/m2, maar de keuze van de dosis lag daar in handen van de behandeld arts8. In een retrospectieve analyse van EBMT-data waarbij werd gekeken naar het verschil tussen melfalan 140 mg/m2 en 200 mg/m2werd in de subgroep van patiënten met ≥VGPR geen verschil gevonden tussen, maar bij patiënten met een PR of minder werd een significant voordeel van melfalan 200 mg/m2 gevonden9. Uit deze gegevens blijkt dat bij een oudere patiënt met een goede respons op therapie 140 mg/m2 melfalan ook een goede behandeling is.
De waarde van een tweede autologe transplantatie in aansluiting op de eerste (tandem transplantatie) was tot de HOVON95/EMN02 studie alleen gerandomiseerd onderzocht in een tijdperk waarin de nieuwe middelen nog niet beschikbaar waren. De IFM toonde (in 2003) zowel PFS als OS voordeel, echter een (post hoc) subanalyse leerde dat alleen de patiënten die na de eerste transplantatie minder dan een VGPR bereikten baat hadden bij een tweede transplantatie. 10,11 Daarnaast bleek bij een langere follow-up het PFS en OS voordeel niet meer aanwezig.12
De Amerikaanse STaMINA trial randomiseerde tussen autologe transplantatie, tandem autologe transplantatie of autologe transplantatie met VRD-consolidatie, waarbij geen verschil werd gevonden tussen de armen in PFS, ook niet bij patiënten met hoog risico cytogenetica.14 De follow up na zes jaar laat echter wel een verschil zien in de “as treated” populatie (per-protocol), waarbij de zes-jaars PFS in de groep met hoog risico cytogenetica 46% was bij tandem autoloog, vs 26% in de andere groepen. 13
Twee recente analyses van de HOVON95/EMN02 studie waarin gerandomiseerd werd tussen 1 of 2 autologe stamceltransplantaties toonde een significant voordeel voor zowel de PFS als de OS van twee autologe stamceltransplantaties (PFS na 5 jaar 44.9% versus 53.5%, OS na 10 jaar 42% en 55%). Het verschil bleek met name aanwezig in de subgroep van patiënten met een cytogenetisch hoog risico profiel, gedefinieerd als del(17p), t(4;14) of t(14;16) (mediane PFS 46 maanden met een dubbel transplantatie versus 26.7 maanden met 1 transplantatie). Dit verschil was het meest uitgesproken bij patiënten met een del(17p). In deze groep deed een tandem transplantatie het slecht risico vrijwel geheel teniet (3- jaar PFS met del(17p) 72% bij tandem auSCT, zonder del(17p) 73%). 4,14 In HOVON95/EMN02 werden samples verzameld voordat de cut-off van het percentage plasmacellen met del17p werd gedefinieerd. Wel is een minimum van 20 % gedefinieerd in het protocol. Met die beperking is de HR 0.24 (p=0.006) voor PFS met dubbele versus enkele auSCT.4,14 Voor de andere groepen met ongunstige cytogenetica is het voordeel in de studie minder uitgesproken of onbekend en wordt geen tandem transplantatie geadviseerd.14
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG
REFERENTIES
AANBEVELINGEN/ CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur
De HOVON95/EMN02 studie is de enige studie waarbij gerandomiseerd is tussen wel of geen consolidatietherapie, waarbij een PFS voordeel is aangetoond voor de groep met VRD consolidatietherapie. De CASSIOPEIA/HOVON 131 en Griffin studie tonen verdieping van respons na consolidatietherapie versus na autologe stamceltransplantatie.
Overwegingen met betrekking tot de literatuur
Diverse studies hebben een toename in respons getoond na consolidatietherapie 1-8.
In de HOVON95/EMN02 studie werd initieel na de inductietherapie met bortezomib-cyclofosfamide-dexamethason gerandomiseerd tussen bortezomib/melfalan-prednison (VMP), 1 of 2 autologe stamceltransplantatie na hoge dosis melfalan. Nadien volgde een separate tweede randomisatie tussen wel of geen consolidatietherapie, welke een verbetering van PFS toonde met consolidatietherapie met bortezomib/lenalidomide-dexamethason (VRD); mediane PFS 59 vs 45 maanden, HR 0.81 (0.68-0.96). Dit is de enige studie die gerandomiseerd heeft voor consolidatietherapie. Hierbij werd een duidelijk verschil in PFS gezien, echter er werd wel een andere inductietherapie (VCD) gebruikt dan momenteel geadviseerd wordt in de submodule 1 van de huidige richtlijn (dara-VRD).1
De HOVON 131/Cassiopeia studie randomiseerde bij start tussen VTD en daratumumab-VTD kuren als inductie- en consolidatietherapie. Alle deelnemers ondergingen consolidatietherapie na autologe stamceltransplantatie. In deze studie werd een diepere respons gezien voor beide groepen na consolidatietherapie versus na >100 dagen na autologe stamceltransplantatie (toename stringente complete respons (sCR) 13% vs 29% in de daratumumab-VTD groep en 9% vs 20% in de VTD groep). MRD werd gemeten na consolidatietherapie, hiermee kan derhalve niets gezegd worden over de toegevoegde waarde van consolidatietherapie op MRD. De studie toonde dat er geen differentiatie mogelijk was op basis van risicostratificatie of respons voor of na transplantatie.2
In de Griffin studie werd bij start gerandomiseerd tussen VRD en daratumumab-VRD als inductie- en consolidatietherapie. Ook hier onderging iedereen consolidatietherapie na autologe stamceltransplantatie. De Griffin studie gaf ook een diepere respons weer na consolidatietherapie versus na autologe stamceltransplantatie (sCR 21% vs 42% in de daratumumab-VRD groep en 14% vs 32% in de VRD groep). Daarnaast werd er een toename van MRD negativiteit (gedefinieerd met minimale threshold 1 op 105 kernhoudende cellen gemeten met NGS; clonoSEQ Assay 2.0) als secundair eindpunt beschreven na afronding van inductietherapie versus na afronding van consolidatietherapie (21% vs 47% in de daratumumab-VRD arm en 6% vs 16.5% in de VRD arm). Dit is zowel effect van hoge dosis melfalan als van consolidatietherapie. MRD bepaling vond plaats cf. “International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma”. MRD negativiteit heeft een aangetoond verband met PFS en mogelijk ook OS. 3,4
Op basis van deze gegevens is het advies om elke patiënt die een autologe stamceltransplantatie ondergaat consolidatiebehandeling te geven met 2 cycli daratumumab-VRD (zie voor overwegingen in keuze van therapie submodule 1: inductietherapie). Dit advies is onafhankelijk van respons of risicoprofiel en wordt zowel geadviseerd na 1 als 2 autologe stamceltransplantaties. Advies is om na autologe stamceltransplantatie minimaal 30 dagen te wachten met starten van consolidatietherapie. Bij hematologische herstel kan, bij voorkeur binnen 3 maanden na transplantatie, gestart worden met consolidatietherapie. Hierbij dient rekening te worden gehouden met een toegenomen kans op beenmergdepressie/toxiciteit gezien de voorbehandeling, waarbij dosisreducties overwogen moeten worden.
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG.
REFERENTIES
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur
Lenalidomide onderhoudsbehandeling geeft een verlenging van progressie vrije overleving van 20-30 naar 40-50 maanden alsmede een overall-survival voordeel. De onderhoudstherapie wordt geadviseerd tot progressie van ziekte of toxiciteit. Aangezien de beschreven studies een PFS-voordeel beschrijven van lenalidomide onderhoud bij alle verschillende gebruikte inductie regimes is de aanname van de MWG dat dit ook zal gelden voor een daratumumab bevattend regime.
Overwegingen met betrekking tot de literatuur
Lenalidomide
Er zijn vier gerandomiseerde studies die de waarde van lenalidomide onderhoudstherapie onderzoeken. Alle studies laten ongeveer een verdubbeling van de PFS zien na de randomisatie tussen wel of geen lenalidomide onderhoudstherapie van 20-30 maanden (zonder lenalidomide onderhoud) naar 40-50 maanden (met lenalidomide onderhoud).1-4 Subgroepanalyse toont dat er geen subgroep te detecteren is die geen baat heeft bij deze behandeling. In de gerandomiseerde studies zijn verschillende regimes gebruikt, waarbij de MWG vasthoudt aan het regime beschreven in de MCR XI studie: 10 mg op dag 1-21 van een 28 dagen cyclus.4 Een overlevingsvoordeel van lenalidomide onderhoudstherapie op de lange termijn werd getoond in een belangrijke meta-analyse van drie van de bovenstaande studies; mediane overleving niet bereikt versus 86 maanden met een HR 0.74 (0.62–0.89).5
Voor de duur van behandeling met lenalidomide onderhoud tonen meerdere retrospectieve studies een voordeel van het continueren van lenalidomide langer dan 3 jaar. In de MRC IX studie, bleek het PFS-voordeel van lenalidomide maintenance ook nog significant na 2, 3 en 4 jaar continueren van lenalidomide onderhoud vergeleken met de deelnemers die geen lenalidomide onderhoud hadden ontvangen.6 Daarna leek dit effect te verdunnen. Ook de data van de DETERMINATION en STAMINA-studie toonden een verbeterde PFS voor deelnemers met lenalidomide onderhoud na 3 jaar versus deelnemers die deze behandeling- niet gerandomiseerd- gestaakt hadden na 3 jaar. De uitkomsten van deze drie studies zijn tot op heden (nog) niet gepubliceerd. Wel gepubliceerd is een retrospectieve studie, waarin patiënten die ³ 3 jaar lenalidomide onderhoud ontvingen werden vergeleken met patiënten die stopten. De landmark analyse op 3 jaar toont een mediane PFS van 7,2 versus 4,4 jaar met een 5-jaars OS van 100% versus 85% in het voordeel van de patiënten die lenalidomide continueerden.7
Belangrijke redenen voor staken van lenalidominde onderhoud zijn bijwerkingen; 27%,10% en 28% van de patiënten in respectievelijk de IFM, de CALGB en de MRC XI studie.2-4 De graad 3-4 bijwerkingen waren met name hematologisch van aard (58% in de IFM, 48% in de CALGB en 33% neutropenie, 7% trombocytopenie en 4% anemie in de MRC XI studie). De meest opmerkelijke bevinding was de toename van tweede primaire tumoren in de lenalidomide arm. Hierbij gaat het zowel om hematologische maligniteiten (MDS/AML, ALL en DLBCL) alsook solide tumoren (met name huidtumoren). In de meest recente MRC XI studie bedroeg de 3-jaars cumulatieve incidentie van secundaire maligniteiten 3% (lenalidomide onderhoud) versus 1% (placebogroep) en de 3-jaars cumulatieve sterfte ten gevolge van secundaire maligniteiten 2% (lenalidomde onderhoud) versus 0.9% (placebogroep).4 Wanneer deze tweede primaire tumoren als event werden gedefinieerd blijft de benefit-risk ratio nog steeds positief voor het gebruik van lenalidomide onderhoud. Ook de EFS bleef superieur (IFM studie 40 versus 23 maanden, CALGB studie 47% risicoreductie in events).2,3
Lenalidomide onderhoudsbehandeling wordt ook geadviseerd bij de tandem transplantaties, daar in de GIMEMA-RV-209 een PFS-voordeel werd gezien voor Lenalidomide onderhoudstherapie, ook bij de deelnemers die standaard een tandem autologe transplantatie ontvingen HR 0.42 (0.24-0.73).8 Hierbij dient de kanttekening te worden gemaakt dat de tandem transplantatie standaard was in dit protocol en niet alleen de hoog risicopatiënten deze ondergingen.
Tot op heden bestaan er geen prospectief, gerandomiseerde data die het effect van lenalidomide onderhoud onderstrepen bij het gebruik van een in Nederland geregistreerd, daratumumab bevattend inductie en consolidatie regime. Aangezien de eerdere beschreven studies een PFS-voordeel beschreven van lenalidomide onderhoud bij alle verschillende gebruikte inductie regimes is de aanname van de MWG dat dit ook zal gelden voor een daratumumab bevattend regime.
Daratumumab
Deelnemers aan de CASSIOPEIA studie ondergingen een tweede randomisatie na consolidatie maar voor start onderhoudsbehandeling, waarin daratumumab 1 maal per 8 weken werd vergeleken met observatie. Overigens is er in deze studie geen vergelijking gemaakt met lenalidomide onderhoud.9 Na 35.4 maanden follow up werd er een PFS-voordeel gezien voor onderhoudsbehandeling met daratumumab versus observatie (mPFS niet bereikt versus 46.7 maanden). In de op voorhand gespecificeerde subgroep analyse bleek dit verschil alleen te bestaan in de groep die geen daratumumab bevattend inductie en consolidatie regime had ontvangen (HR 0.34 (0.24-0.47)) en werd dit niet gezien in de groep die wel daratumumab in de inductie en consolidatie ontvangen had (HR 1.05 (0.73-1.51)).9 Daratumumab is in Nederland niet vergoed noch geregistreerd voor deze indicatie.
In de GRIFFIN studie werd 4 maal D-VRd inductie, autologe stamceltransplantatie, 2 maal D-VRd consolidatie en daratumumab + lenalidomide onderhoud, vergeleken met 4 maal VRd inductie, autologe stamceltransplantatie en lenalidomide onderhoud.10 De uitkomsten zijn in het voordeel voor de groep die zowel in inductie, consolidatie en onderhoud daratumumab hebben gekregen (stringente CR 42.4% versus 32% post consolidatie, en 62.6% versus 45.4% na 22,1 maanden follow up).10 Er is echter geen tweede randomisatie geweest die het voordeel van lenalidomide en daratumumab vergeleek met lenalidomide monotherapie voor de patiënten die reeds daratumumab tijdens inductie en consolidatie hadden ontvangen. Derhalve kan op basis van deze gegevens geen superioriteit van de toevoeging van daratumumab aan lenalidomide in de onderhoudsbehandeling wordt bevestigd (SORT B).
Ook de PERSEUS studie zal geen antwoord kunnen geven of het toevoegen van daratumumab aan lenalidomide onderhoud een voordeel geeft, daar ook in deze studie geen tweede randomisatie werd gedaan alvorens onderhoudsbehandeling te starten.11 In deze studie wordt in de maintenance fase wel bekeken of MRD-status kan selecteren voor een vaste duur van maintenance met daratumumab plus lenalidomide.
Aanvullende overwegingen bij hoog-risico MM
Bij patiënten die bij diagnose een multiple myeloom hebben dat classificeert als hoog-risico, adviseert de MWG, daar waar mogelijk, behandeling binnen studieverband waar de standaardtherapie met lenalidomide onderhoud wordt vergeleken met een experimenteel middel met of zonder lenalidomide. Dit gezien het feit dat lenalidomide onderhoudstherapie weliswaar de progressie-vrije overleving verbeterde in deze populatie, maar de negatieve invloed op de progressie-vrije overleving niet geheel tenietdeed in de gerandomiseerde studies. Ditzelfde advies voor behandeling binnen studies geldt ook voor patiënten met nog aantoonbare ziekte na consolidatie (niet in CR of in MRD positieve CR). Ook deze patiënten hebben in de verschillende studies die gebruik maken van een daratumumab bevattend inductie regimes een verminderde PFS en OS vergeleken met patiënten zonder aantoonbare ziekte.
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG
REFERENTIES
De adviezen in deze module betreffen patiënten die op basis van hun leeftijd (alle patiënten ouder dan 70 jaar) of kwetsbaarheid niet in aanmerking komen voor een autologe transplantatie.
De MWG is van mening dat patiënten die niet in aanmerking komen voor een autologe stamceltransplantatie behandeld dienen te worden binnen studieverband. Begin 2024 zal de HOVON 174 studie starten (Fabulous studie), waarbij gerandomiseerd wordt tussen continueren van behandeling met daratumumab-lenalidomide-dexamethason (DRd) en staken van de behandeling na 12 maanden, waarna de behandeling herval zal worden bij een biochemisch recidief (behandel-vrij interval).
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING – LITERATUUROVERZICHT
Samenvatting literatuur
|
Naam studie |
ALCYONE7-9 |
MAIA1-4 |
FIRST15,16 |
SWOG12-14 |
||||
|
Behandeling |
MPV |
Dara-MPV |
Rd |
Dara-Rd |
Rd |
Rd |
Rd |
VRd |
|
Behandelduur |
9 cycli (54 wk) Dara continu |
Continu |
Continu |
72 wk |
Continu |
8 cycli |
||
|
Mediane follow up |
78,8 maanden |
64,5 maanden |
– |
84 maanden |
||||
|
Aantal patiënten |
356 |
350 |
369 |
368 |
535 |
541 |
261 (109 >65jr) |
264 (93 > 65jr) |
|
Onderhoud |
– |
Dara |
Continu |
Continu |
Continu |
– |
Continu |
Rd continu |
|
Leeftijd (mediaan) (jr) |
71 |
71 |
74 |
73 |
73 |
73 |
63 |
63 |
|
% > 75 jaar |
30 |
30 |
43,5 |
43,6 |
35 |
36 |
– |
– |
|
% hoog risico cytogenetica |
15,9 |
15,9 |
13,6 |
15 |
17 |
20 |
– |
– |
|
Mediane PFS (maanden) |
19,3 |
36,4 |
34,4 |
61,9 |
26 |
21 |
25,8 (>65jr) |
33,1 (>65jr) |
|
% CR |
25 |
46 |
30,1 |
51,1 |
22 |
20 |
12,1 |
24,2 |
|
% CR + VGPR |
55 |
71 |
56,9 |
81,5 |
48 |
47 |
53,2 |
74,9 |
|
Mediane OS (maanden) |
53,6 |
82,7 |
65.5 |
NR |
59,3 |
62,3 |
53 (>65jr) |
62.9 (>65jr) |
|
Mediane OS > 75 jaar |
49,7 |
59,1 |
54,8 |
NR |
– |
– |
– |
– |
Tabel: samenvatting studies
Behandelcombinaties; effectiviteit
Er zijn vijf behandelopties voor de initiële behandeling van patiënten die niet in aanmerking komen voor een autologe stamceltransplantatie; Daratumumab-lenalidomide-prednison (Dara-Rd), Daratumumab-melfalan-prednison-bortezomib (Dara-MPV), Bortezomib-lenalidomide-dexamethason (VRd), Melfalan-prednison-bortezomib (MPV/VMP) en lenalidomide-dexamethason (Rd).
De MAIA-studie, waarin Dara-Rd werd vergeleken met Rd, toonde een verbetering van de PFS (61.9 versus 34.4 maandenHR, 0.55; 95% CI, 0.45-0.67; P<0.0001), en ook OS (66.6% versus 53.6% na 60 maanden).1,2,3 De laatste update toonde 34% reductie in het risico te overlijden met Dara-Rd versus Rd; mediane OS was niet bereikt met Dara-Rd versus 65.5 maanden met Rd (HR, 0.66; 95% CI 0.53-0.83; P=0.0003).3 Ook was de PFS2 significant langer; niet bereikt (Dara-Rd) versus 51 maanden (Rd) (HR 0,65; 95% CI 0.52-0.83; P=0.0005).4 De frailty score bleek niet van invloed op de verbetering in PFS die bereikt werd door toevoeging van daratumumab. Na mediaan 36.4 maanden follow up werd een PFS voordeel gevonden in de non-frail (fit en intermediate fitte patiënten) van dara-Rd ten opzichte van Rd van niet bereikt versus 41,7 maanden (HR 0.48; 95% CI 0.34–0.68; P < 0.0001) in de frail subgroep (met name patiënten >75 jr) een verschil van niet bereikt (dara-Rd) versus 30,4 maanden (Rd) met een HR 0.62 (95% CI 0.45–0.85; P = 0.003).5 Hoewel er derhalve in niet-fitte patiënten een minder lange PFS werd beschreven, was percentueel de risicoreductie van PFS onafhankelijk van de mate van frailty gedefinieerd door een alternatieve frailty index, de simplified frailty index.5,6 Dara-Rd bleek ook bij patiënten met een verminderde nierfunctie (gedefinieerd als een klaring <60 ml/minuut) effectiever dan Rd met een HR van 0.60 (95% CI 0.41-0.84); de HR bij patiënten met een klaring >60ml/minuut was 0.52 (95% CI 0.36-0.74).1 Dara-Rd was bij een eerste analyse niet superieur ten opzichte van Rd in patiënten met cytogenetisch hoog risico (HR 0.85 (95% CI 0,44-1,65) versus 0.49 (95% CI 0,36-0,67)) bij patiënten met standaard risico).1 In deze analyse was een kleine groep patiënten betrokken.
De ALCYONE-studie, waarin 9 cycli Dara-MPV werd vergeleken met MPV, toonde een verbetering van de PFS (mediane PFS van 36,4 dara-MPV versus 19,3 maanden met follow up van 78,8 maanden) als van de PFS2.7-9 Bij progressie ontving 76% in de Dara-MPV groep en 77% in de MPV-groep en een volgende lijn van behandeling, de PFS2 bedroeg respectievelijk ‘niet bereikt’ versus 42,3 maanden (35·8– niet bereikt).8 Hierbij moet vermeld worden dat slechts 10% van de patiënten die in eerste instantie MPV kregen, bij een recidief behandeld werden met daratumumab.8 Daarnaast werd een significante verbetering in OS aangetoond in de Dara-MPV behandelde groep, bij de analyse in 2022, bleek de mediane OS 82,7 maanden versus 53,6 maanden in de controlearm (HR, 0.63; 95% CI, 0.51-0.78; P <0.0001).9
De leeftijd bleek niet van invloed op de verbetering in PFS die bereikt werd door toevoeging van daratumumab. In de eerste rapportage van de Alcyone studie werd voor patiënten > 75 jaar een vergelijkbare PFS ten opzichte van patiënten < 75 jaar gerapporteerd (Dara-MPV mediane PFS beide niet bereikt met overlappende curves, MPV mediane PFS 20.4 maanden bij ≥75 jaar versus 17.9 maanden <75 jaar).7 Er bestond eveneens een significant voordeel van het toevoegen van daratumumab aan MPV in alle frailty groepen (gedefinieerd door een alternatieve frailty index, de simplified frailty index).6,10 Toevoeging van daratumumab aan MPV in non-frail patiënten resulteerde in een mediane PFS van respectievelijk 45.7 mnd vs. 19.1 mnd en in frail patiënten 32.9 vs.19.5 mnd (Dara-MPV vs MPV; HR 0,36; 95% CI 0,28-0,47).10 In zowel de totale non-frail populatie als de frail populatie in Alcyone werd een OS voordeel gerapporteerd. De mediane OS was in beide armen bij de meest recente rapportage niet bereikt bij mediane follow up van 40,1 mnd; de OS bij 36 maanden bedroeg 83,6% versus 74.5% (Dara-MPV versus MPV) in non-frail en in frail groep respectievelijk 71,4% en 59% (Dara-MPV versus MPV).10 Dara-MPV bleek ook bij patiënten met een verminderde nierfunctie (gedefinieerd als een klaring <60 ml/minuut) effectiever dan MPV met een HR van 0.36 (95% CI 0.24-0.56). De HR bij patiënten met een klaring >60ml/minuut was 0.63 (95% CI0,45-0,88).7 Dara-MPV was niet superieur ten opzichte van MPV in patiënten met cytogenetisch hoog risico (HR 0.78 versus 0.39 bij patiënten met standaard risico).7 Langere follow-up toonde een significante verbetering van de OS bij patiënten met een verminderde nierfunctie; in de subgroepen van ouderen ≥75 jaar) en cytogenetisch hoog risico werden geen significante verschillen gezien.7,8
De toevoeging van daratumumab liet in een gepoolde analyse van de MAIA en de Alcyone data met betrekking tot hoog-risico cytogenetica (HRCG) zien dat bij een mediane follow up van 43,7 maanden, het risico op progressie of overlijden bij HRCG- patiënten die daratumumab kregen in die studies (totaal N=101) met 41% gereduceerd was ten opzichte van de HRCG-patiënten in de controlearmen van deze studies (N=89)( HR voor PFS 0.59; 95% CI 0.41-0.85). 11
De SWOG-studie waarin VRd werd vergeleken met Rd toonde een verbetering van zowel de PFS (41 versus 29 maanden; HR 0.742 (96% Wald CI 0.594- 0.928; p= 0.003)) als de OS (NR versus 69 maanden; HR 0.709 (96% Wald CI 0.543-0.926; p=0.0114)) met het triple-regime.12,13 Van belang is dat in deze studie ook patiënten werden behandeld die in aanmerking kwamen voor een stamceltransplantatie; slechts 43% was ouder dan 65 jaar. In de patiëntengroep ≥65jr (n=202) was de mediane PFS was 33.1 en 25.8 maanden voor VRD respectievelijk Rd (HR=0.83, 95% CI: 0.60-1.16); de mediane OS respectievelijk 62.9 maanden (VRD) en 53 maanden (Rd) (HR=0.83, 95% CI: 0.55-1.23).14
Zoals hierboven beschreven is er een voorkeur voor dara-MPV boven MPV.
Zoals boven beschreven is er een voorkeur voor dara-Rd boven Rd. Met betrekking tot de keuze Rd zijn de volgende data van belang. In de FIRST-studie werden lenalidomide-dexamethason tot aan progressie (Rd), lenalidomide-dexamethason gedurende 18 maanden (Rd18) en MPT (12 zesweekse cycli, dus ook 18 maanden) met elkaar vergeleken.15 De mediane PFS bleek significant langer in de Rd groep (25.5 versus 20.7 (Rd18); HR 0,70; 95%CI 0,6-0,82; p<0,001).15 Er was geen verschil in 4 jaars OS tussen Rd tot progressie en Rd18 in deze studie bij bereiken van ten minste partiele remissie.16 De patiënten die > VGPR bereikten in de Rd (continu) arm toonden een time-to next -treatment (TTNT) van ongeveer 5 jaren.17 De TTNT (Rd vs Rd18) bedroeg bij bereiken van ten minste VGPR 60,7 maanden versus 31,8 maanden (HR 0,45; 95% CI 0,34-0,60) en bij bereiken van ten minste PR 49,8 maanden versus 31,8 maanden (HR 0,70; 95% CI 0,58-0,85).17
In de FIRST-studie bleek geen voordeel te zijn van Rd ten opzichte van MPT bij patiënten met een kreatinineklaring <30 ml/min.16
In een gerandomiseerde fase 3 studie waarbij intermediate-fit patiënten volgens de IMWG frailty-score werden behandeld met lenalidomide-dexamethason 9 cycli gevolgd door lenalidomide 10 mg tot progressie (Rd-R) vs. lenalidomide-dexamethason (Rd) tot progressie, werd in beide armen een vergelijkbare PFS (20.2 vs 18.3 mnd; HR 0,78; 95%CI 0,55-1,1) en OS (74% vs 63% na 3 jr; HR 0,62; 95% CI 0,37-1,03) gevonden, terwijl er minder non-hematologische toxiciteit optrad in de Rd-R arm.16De mediane event free survival (EFS) (event gedefinieerd als graad 4 hematologische AE, graad 3-4 niet-hematologische AE, second primary malignancy, staken van lenalidomide, progressieve ziekte of dood) was langer in de Rd-R arm (10.4 mnd versus 6.9 mnd in Rd; HR 0,70; 95% CI 0,51-0,95).16
Toxiciteit van Dara-Rd, Dara-MPV, MPV en Rd
De toxiciteit van de hierboven beschreven therapieën is verschillend.
Bij bortezomib-bevattende regimes (Dara-MPV, MPV, VRd) is polyneuropathie (PNP) een frequent voorkomende non-hematologische adverse event.7,12 In de VISTA-studie (MP versus VMP) werd bij 44% PNP beschreven, waarvan 13% tenminste graad 3.19 Echter, van belang is dat in de VISTA studie bortezomib intraveneus werd toegediend, met de huidige subcutane toediening wordt de kans op PNP ongeveer met de helft gereduceerd.20 In de ALCYONE-studie werd bortezomib subcutaan én eenmaal per week (vanaf de 2e cyclus) toegediend en werd gerapporteerd: graad 3 en 4 PNP 1.4% met Dara-MPV versus 4% met MPV.7
In een post-hoc analyse van de gerandomiseerde fase 3 studie VMP vs VMPT van de GIMEMA werd het effect van een protocol amendement in verband met hoge incidentie van neuropathie, nl van twee maal per week intraveneus bortezomib naar eenmaal per week bortezomib, geëvalueerd.21 Een frequentie van één versus twee keer per week intraveneuze toediening had geen negatief effect op de effectiviteit, terwijl de incidentie van non-hematologische toxiciteit in het algemeen, en graad 3-4 PNP significant afnam.21 Er zijn geen gerandomiseerde trials betreffende een- versus tweemaal per week toediening van bortezomib subcutaan. In een indirecte vergelijking beschrijven Mateos et al. analyse van de gepoolde data van de GIMEMA- en Alcyone-trials (eenmaal per week bortezomib) met de VISTA-trial (tweemaal per week borteomib) en vinden gelijke effectiviteit, maar significante afname van neuropathie bij eenmaal per week doseren.22
De toevoeging van Daratumumab aan een regime gaat gepaard met een verhoogd risico op graad 3-4 infecties; in de MAIA studie traden graad 3-4 infecties op bij 32.1% vs 23.3% van de patiënten (Dara-Rd vs Rd) en pneumonie bij 13.7% resp 7.9%.1 In Alcyone betreft de rapportage graad 3-4 infecties 23.1% vs. 14.7% (Dara-MPV resp. MPV) en pneumonie bij 11.3% resp. 4% van de patienten.7 Daarnaast nam de incidentie van graad 3-4 bijwerkingen toe in frail ten opzichte van intermediate-fitte en fitte patiënten (“total nonfrail”) wanneer daratumumab werd toegevoegd aan Rd of MPV.5,10
In een gerandomiseerde trial bij patiënten met RRMM (relapsed / refractory multiple myeloma) werd aangetoond dat monotherapie daratumumab als subcutane toediening even effectief is als intraveneuze toediening, gemeten aan de effectiviteit (respons, PFS en OS).23 De bijwerkingen waren vergelijkbaar, behoudens afname van IRR’s; injectie gerelateerde toxiciteit kwam voor bij 12.7% (1,5% graad 3) bij subcutane toediening en infusie gerelateerde toxiciteit in 34.5% (5,4% graad 3) bij intraveneus daratumumab.23 Patiënten in de daratumumab-subcutaan-groep van deze Columba studie, meldden een hogere score op de “Cancer Therapy Satisfaction Questionnaire (CTSQ)” ten opzichte van de patiënten die intraveneuze daratumumab kregen toegediend.24
Toediening van IMiDs in combinatie met andere middelen gaat gepaard met onder andere een verhoogde kans op trombose. Zie hiervoor de module ‘supportive care’ (Module 4); bij nieuw gediagnosticeerd multipel myeloom is het advies het VTE-risico in te schatten met behulp van de IMPEDE VTE score.25
In de MM-015 studie (MPR-R vs. MPR vs. MP) was een opmerkelijke bevinding een toename van het aantal tweede maligniteiten bij de patiënten die lenalidomide kregen, ongeacht de duur van de therapie (ook in de MPR-arm zonder R onderhoud; 7% versus 3% in de MP arm).26 Wanneer de tweede primaire tumoren als events werden gedefinieerd was de EFS nog superieur. In de HOVON 87 was het percentage en de “incidence rate” van tweede primaire tumoren vergelijkbaar tussen thalidomide en lenalidomide; 6.6% en 2.8/100 persoonsjaren in de MPT-T-arm versus 6.2% en 2.4/100 persoonsjaren in de MPR-R arm.27 In de FIRST trial bedroegen deze percentages in de Rd, Rd18 en de MPT-arm respectievelijk 3, 6 en 5%.16 Voor zowel daratumumab als bortezomib is niet aangetoond dat de incidentie van tweede primaire tumoren toeneemt In de MAIA-studie werd een tweede maligniteit gerapporteerd bij resp. 8.8% en 7.1% van de patiënten (Dara-Rd vs. Rd), waarvan “invasieve maligniteiten” bij 3.3% vs. 3.6% van de patiënten en in Alcyone bij 2,3% vs 2,5% (Dara-MPV vs. MPV).1,7
Overwegingen met betrekking tot de literatuur
Dara-Rd, Dara-MPV, VRd, MPV of Rd?
Gezien de mediane PFS van 61,9 maanden en de langdurige overall survival heeft Dara-Rd de voorkeur boven Dara-MPV (PFS 36.4 maanden), hoewel Dara-Rd niet direct vergeleken is met Dara-MPV. Dit was ongeacht de frailty level, vastgesteld met de simplified frailty index Gezien boven beschreven resultaten van toevoeging van daratumumab aan Rd en aan MPV in alle frailty groepen, is het advies geldend voor iedere patiënt ongeacht frailty.
In principe geldt bovenstaand advies eveneens voor iedere patiënt ongeacht de cytogenetische risicoclassificatie. De volgende overwegingen worden daarbij in ogenschouw genomen. In een vergelijking tussen MPV en Rd zijn de resultaten met betrekking tot het effect op patiënten met een hoog risicoprofiel niet eenduidig. In een retrospectieve analyse uit 2020 verricht door de Italiaanse GIMEMA-groep waarin de uitkomst van patiënten met een cytogenetisch hoog risicoprofiel (gedefinieerd als del17p, t(4;14) of t(14;16)) , die in afzonderlijke klinische studies met MPV of Rd werden behandeld, onderzocht.30 Er bleek geen verschil aantoonbaar in PFS en OS tussen standaard en hoog risicopatiënten als ze behandeld waren met MPV, echter wel als ze behandeld waren met Rd. MPV deed in deze analyse derhalve in tegenstelling tot Rd de negatieve invloed van hoog risico cytogenetica teniet. De mediane PFS voor standaard en hoog risicopatiënten was 23 versus 30.8 maanden in de MPV-groep, en 21.3 versus 15.2 maanden in de Rd groep.30 Voor OS waren deze getallen respectievelijk 67.2 versus 61.4 maanden (MPV) en 73.3 versus 43.2 maanden (Rd).28 Gezien de analyse van de GIMEMA zoals boven beschreven en de literatuur in ogenschouw nemende, is er toch een voorkeur voor bortezomib gezien het (ten dele) tenietdoen van slecht risico cytogenetische kenmerken, terwijl dat voor lenalidomide niet beschreven is. Overigens gaf de toevoeging van daratumumab aan MPV en Rd geen significante verbetering in PFS en OS ten opzichte van MPV en respectievelijk Rd bij patiënten met een hoog cytogenetisch risico in de afzonderlijke analyses van de Alcyone- en MAIA studie.1,7 Echter, de gepoolde analyse toonde dit voordeel van toevoeging van daratumumab wel.11 Het kleine aantal patiënten met hoog cytogenetisch risico (n=92) in de MAIA-studie en ook in de Alcyone studie (n=98; 14%) en daarmee de grote spreiding van de HR verhindert een harde uitspraak over Dara-Rd bij hoog cytogenetisch risico, waardoor onduidelijk is of er een voorkeur is voor Dara-Rd of Dara-MPV in deze groep.1,7 Aangezien er ook geen theoretische redenen zijn voor een afwezigheid van effect in deze groep, heeft de MWG ook een voorkeur voor daratumumab toevoeging in deze situatie. De absolute PFS en een langere follow up is nodig om een keuze tussen Dara-Rd en Dara-MPV te onderbouwen voor patiënten met een hoog cytogenetisch risicoprofiel. Indien overwogen wordt andere regimes te gebruiken dan de voorkeursregimes (Dara-Rd of Dara-MPV), zijn de gegevens van onderstaande studie van belang: in een real-world fase IV studie waarin oudere patiënten werden gerandomiseerd tussen behandeling met MPV versus Rd, bleek de PFS gelijk (mediaan 29.6 versus 26.2 maanden,) en gaf MPV een trend tot een superieure OS (2 jaar OS 89% versus 75%).31 In patiënten met hoog risico cytogenetica bleek er een voordeel van MPV ten opzichte van Rd (HR 0.21 in hoog risico; HR 1.25 in niet-hoog risico-patiënten).31
Daratumumab gaf onafhankelijk van de nierfunctie (< of > 60 ml/min) een risicoreductie in progressie in combinatie met MPV (HR 0.36) en Rd (HR 0.60).1,7 Bij ernstige nierinsufficiëntie (Cr klaring < 30 ml/min) is het advies Dara-MPV te gebruiken, gezien de mate van risicoreductie en de diverse analyses die een grotere kans op herstel van de nierfunctie tonen bij bortezomib ten opzichte van IMiDs.32,33 De IMWG richtlijn (international myeloma working group) zoals recent gepubliceerd, adviseert op grond van grondige review, bortezomib bevattend schema te starten indien sprake is van myeloom-gerelateerde vermindering van nierfunctie. 34
zie ook tabel 1 in ‘Therapieschema’s module 4′
Het risico op voortijdig staken van effectieve therapie ten gevolge van toxiciteit is een reëel probleem bij de oudere patiënt met co-morbiditeit en bij de fragiele patiënt. Voor frail en/of oudere patiënten is daarom het advies de dosering aan te passen zoals beschreven in de paragraaf met therapieschema’s om voortijdig staken van de therapie te voorkomen. Deze aanpassingen zijn gebaseerd op voornamelijk niet-gerandomiseerde studies en expert opinions.35,36
Bortezomib. In de GIMEMA-studie (MPVT-VT vergeleken met MPV) werd in verband met een hoge incidentie van polyneuropathie besloten over te gaan op een eenmaal per week bortezomib schema.21 Hiermee daalde het percentage graad 3 of meer PNP van 28 naar 8%. Dat de effectiviteit van het eenmaal per week –schema niet minder effectief was, had waarschijnlijk te maken met het feit dat de cumulatieve dosering bortezomib in beide groepen gelijk was; 39.4 versus 40.1 mg/m2 bortezomib.21
Gezien het feit dat dosisaanpassingen op expert opinions zijn gebaseerd en de kalenderleeftijd geen goede voorspeller is van de biologische leeftijd werd de HOVON 123 ontwikkeld.37 In deze studie werd bij patiënten ≥75 jaar MPV toegediend in een aangepaste dosering en voor aanvang en tijdens de therapie er diverse geriatrische assessments (zowel vragenlijsten als functionele testen) verricht om te onderzoeken of het aantal patiënten dat de therapie moet staken met deze aangepaste dosering minder was dan in de VISTA trial waarin MPV ook bij patiënten ≥75 jaar in de standaarddosering werd toegepast en 34% van de patiënten de therapie voortijdig moest staken vanwege toxiciteit.38 Ook werd onderzocht of geriatrische assessments voorspellers zijn voor haalbaarheid van de therapie. Analyse toonde dat 46% van de frail patiënten en 27% van de niet fitte patiënten de inductietherapie bestaande uit 9 cycli voortijdig moest staken. Zes cycli bleken in een hoger aantal van de patiënten mogelijk: respectievelijk 37% van de frail en 23% van de niet fitte patiënten moesten de therapie voortijdig staken.37
Op basis hiervan kan overwogen worden bij niet fitte en frail patiënten een kortere inductiefase te vervolgen met onderhoudsbehandeling met bortezomib. Bijvoorbeeld: 6 cycli MPV gevolgd door 2 jaar onderhoudsbehandeling met bortezomib (1 gift bortezomib per 2 weken of 1 cyclus bortezomib per 3 maanden).
Lenalidomide
Het is vooralsnog niet duidelijk uit de FIRST-trial welke patiënten baat hebben bij voortzetten van Rd; 39% van de patiënten gebruikte nog steeds Rd na 24 maanden.17 De keuze tussen Rd en Rd18 moet daarom op individuele basis gemaakt worden; in de studie was geen overall survival verschil.17 Een subgroep analyse op basis van respons is hier behulpzaam bij. Als een patiënt een VGPR of beter bereikte resulteerde voortzetting van Rd versus gedurende 18 cycli tot een verlenging van de TTNT van bijna 2.5 jaar. Dit effect was minder uitgesproken bij patiënten met een PR; ongeveer 1.5 jaar.15
De hierboven beschreven Italiaanse GIMEMA-studiegroep rapporteerde verlengde EFS bij verlaging van lenalidomide van 25mg naar 10 mg alsmede staken dexamethason na 9 cycli.18 Dit ondersteunt een aanpassing van de dosering bij intermediate fit patiënten, en tevens bij de frail patiënten, die weliswaar niet aan dit onderzoek participeerden, maar voor wie bekend is dat de toxiciteit sneller leidt tot staken van de therapie hetgeen de PFS en OS negatief beïnvloedt.39-41
REFERENTIES
Br J Haematol. 2021;193(6):1213-1219.
De MWG is van mening dat patiënten die in aanmerking komen voor een recidief behandeling zoveel mogelijk behandeld dienen te worden binnen studieverband. Voor studies in de recidief setting wordt verwezen naar de HOVON-website (http://www.hovon.nl/werkgroepen/studiewerkgroepen/myeloma.html).
De adviezen voor recidief behandeling (buiten studieverband) staan beschreven in de onderstaande submodules. In submodule 1 wordt de rol van een eerste of tweede autologe stamceltransplantatie beschreven, in submodule 2 de opties voor tweedelijns en verdere lijnen van behandeling. In submodule 3 worden toekomstige behandelopties beschreven voor patiënten met een recidief of refractair MM. Opties die bij de recidief behandeling worden benoemd, zijn veelal zowel bij eerste – én verdere recidieven toepasbaar, met een aantal uitzonderingen van combinaties die uitsluitend vanaf de derde lijn geregistreerd zijn. In de aanbevelingen worden deze combinaties expliciet benoemd. Omdat de voorkeursbehandelingen in tweede en verdere lijnen verschillend zijn, vindt u de adviezen voor tweedelijnsbehandeling en de behandelingen vanaf de derde lijn separaat samengevat in respectievelijk figuur 1 en 2.
Bij de keuze voor therapie spelen het type en de mate van refractair zijn, patiëntkarakteristieken, toxiciteit van eerdere behandeling en de wensen van de patiënt een belangrijke rol. Vanaf de derde- of vierdelijns-behandeling zullen patiënten over het algemeen lenalidomide- en anti-CD38 monoklonale antistof- refractair zijn en meestal ook refractair zijn voor een proteasoomremmer. Gezien de slechte prognose zijn er geen duidelijke adviezen te geven over welk recidief schema dan het meest effectief zal zijn. Daarom adviseert de MWG voor deze categorie patiënten contact op te nemen met het consult-verlenend ziekenhuis ter beoordeling van participatie in studies.
Onderstaande figuren tonen een overzicht van de aanbevelingen, de toelichting is per submodule uitgewerkt.
Figuur 1: behandelcombinaties voor tweedelijnstherapie, vetgedrukt de voorkeurstherapie, alternatieve keuzes eronder.
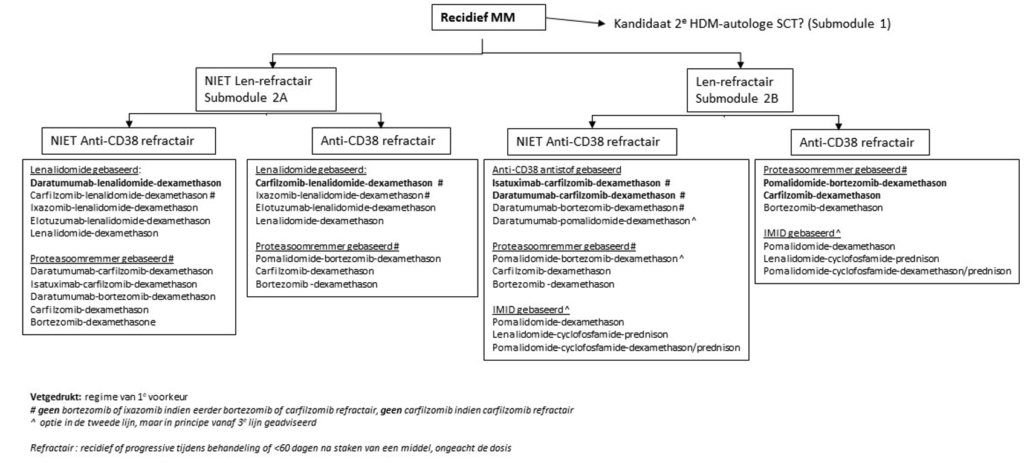
Figuur 2: behandelcombinaties voor behandelingen vanaf de derde lijn
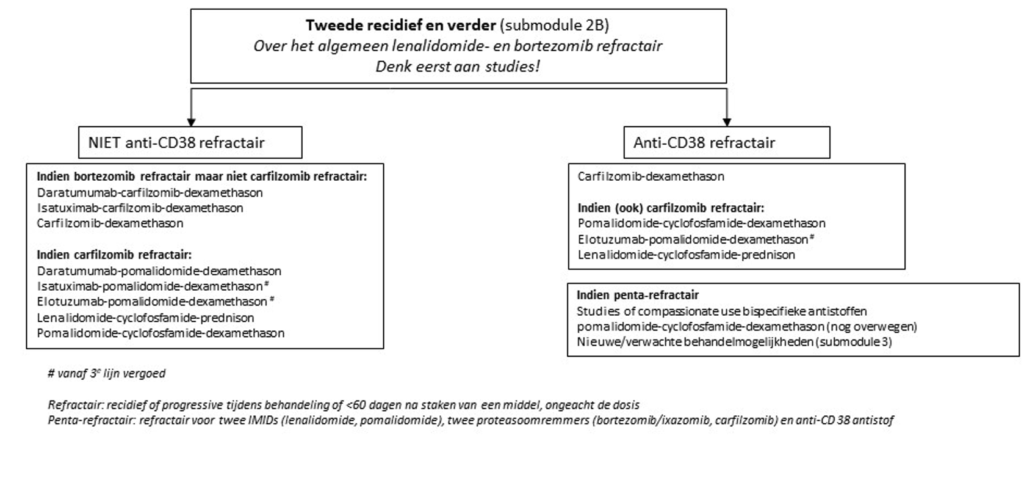
Tabel 1: overzicht van (fase 3) studies bij RRMM
|
Trial (exp arm-st arm) |
Regimens |
Eerdere lijnen (mediaan) |
Lena exposed |
Lena refractair (%) |
PI exposed |
PI refractair (%) |
Response rate (%) ORR |
PFS (mnd) |
Referentie |
|
POLLUX fase3 |
DRd vs. Rd |
1 |
18% |
3% |
86-86% |
21-20% |
93 vs. 76 |
44.5 vs. 17.5 (na 1 lijn: PFS 53.3 vs 19.6) |
Dimopoulos, NEJM 2016 Dimopoulos, JCO 2023 Bahlis, Leukemia 2020 |
|
ASPIRE fase3 |
KRd vs. Rd |
2 |
20% |
– |
66% |
11-4% (1L) 19-22% (2L) |
87 vs. 67 |
26.3 vs. 16.6 |
Stewart, NEJM 2015 Siegel, JCO 2018 |
|
TOURMALINE-MM1 fase3 |
IRd vs. Rd |
1 |
12% |
NR (21% refr IMID meeste thal) |
69%-70% |
1-2% |
78 vs. 72 |
20.6 vs. 14.7 |
Moreau, NEJM 2016 |
|
ELOQUENT-2 Fase3 |
ERd vs. Rd |
2 |
5-6% |
NR |
68-71% |
NR |
79 vs. 66 |
19.4 vs. 14.9 |
Lonial, NEJM 2015 |
|
CANDOR Fase3 |
DKd vs. Kd |
2 |
39-48% |
32-36% |
87-92% |
28-31% |
84 vs. 75 |
28.4 vs. 15.2 |
Dimopoulos, Lancet 2020 Usmani, Bl adv 2023 |
|
IKEMA Fase3 |
IsaKd vs. Kd |
2 |
40-48% |
32-34% |
93-85% |
31-36% |
87 vs. 84 |
35.7 vs. 19.2 |
Moreau, Lancet 2021 Martin, Bl Canc J 2023 |
|
CASTOR Fase3 |
DVd vs. Vd |
2 |
36-49% |
24-33% |
67-70% |
– |
85 vs 63 |
16.7 vs. 7.1 |
Palumbo, NEJM 2016 Matteos, Clin Lymph, Myel & Leuk 2020 |
|
OPTIMISMM Fase3 |
PVd vs. Vd |
2 |
100% |
55-51% (<65j) 60% (>65j) |
83-72% 42-47% |
12-8% 8-5% |
82,2 vs. 50 |
11.2 vs. 7.1 22 vs 13 (<65j) 17,6 vs 9,9 (>65j) (bij 1ste relaps) |
Richardson, Lancet Oncol 2019 Richardson, Eur J hematol 2022 |
|
ENDEAVOR Fase3 |
Kd vs. Vd |
2 |
38% |
24% |
54% |
– |
77 vs. 63 |
18.7 vs. 9.4 |
Dimopoulos, Lancet Oncol 2016 |
|
BOSTON fase3 |
Sel-Vd vs. Vd |
1 |
38% |
? |
76% |
– |
76 vs. 62 |
13.9 vs. 9.5 |
Grosicki, Lancet 2020 |
|
APOLLO Fase3 |
DPd vs. Pd |
2 (11-12% maar 1 lijn) |
79%-80% (62% en 59% lena refr als last LOT) |
47%-49% |
69 vs. 46 |
12.4 vs. 6.9 |
Dimopoulos, Lancet Oncol 2021 |
||
|
Icaria |
IsaPd vs. Pd vanaf derde lijn |
2 |
100% |
94%-92% |
100% |
77%-75% |
60 vs. 35 |
11.5 vs. 6,5 |
Attal , Lancet 2019 Terpos , 2022 |
|
ELOQUENT3 fase2 |
ELoPD vs Pd Vanaf derde lijn |
3 |
98-100% |
90-84% |
100% |
78-82% |
53 vs 26 |
10,3 vs 4,7 |
Dimopoulos, NEJM 2018 |
D=daratumumab, R=lenalidomide, d=dexamethason, V=bortezomib, I=ixazomib, Isa-isatuximab, K=carfilzomib, P=pomalidomide, E=elotuzumab
AANBEVELINGEN/CONCLUSIES
Uitgestelde eerste autologe transplantatie
Tweede autologe transplantatie
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur
Verschillende studies rapporteren over uitgestelde autologe stamceltransplantatie bij eerste recidief van de ziekte.1-4 Lange termijn follow-up van de HOVON 95 studie toonde langere PFS2 (PFS na recidiefbehandeling) bij patiënten die up front autoloog getransplanteerd waren in vergelijking met patiënten (in de VMP arm van de HOVON 95 studie) die bij hun eerste recidief alsnog autoloog getransplanteerde werden (mediane PFS2 85 versus 51 maanden, respectievelijk; HR 0.52, 95% CI 0.40-0.66).1 Palumbo et al. vonden dat slechts 62% van de patiënten in de recidief setting qua conditie nog in aanmerking kwam voor een autologe stamceltransplantatie (autologe stamceltransplantatie versus MPR en tweede randomisatie lenalidomide maintenance versus geen maintenance).2 De conclusies ten aanzien van autoloog transplanteren bij recidief MM volgens de IFM 2009 studie waren dat overall survival in beide armen van deze gerandomiseerde studie (autologe stamceltransplantatie versus (alleen) RVD kuren zonder transplantatie) geen verschil toonden mogelijk juist doordat patiënten bij eerste recidief alsnog werden getransplanteerd.3 De mediane PFS na eerstelijns behandeling was langer in de transplantatiearm van de studie (50 maanden versus 36 maanden in de RVD-groep). In de studiearm waarin patiënten uitsluitend 8 RVD kuren ondergingen werd bij 79% van de patiënten die in aanmerking kwamen voor een tweedelijns behandeling bij progressie, een autologe stamceltransplantatie toegepast.3
Met betrekking tot de toepassing van een tweede autologe stamceltransplantatie werd in het verleden een eerste remissieduur van ≥18-24 maanden gehanteerd als criterium voor een tweede autologe stamceltransplantatie. Dit berustte op de Myeloma X studie waarin een minimale remissieduur van 18 maanden werd gehanteerd en waaruit bleek dat een tweede autologe stamceltransplantatie in een significant betere PFS en OS resulteerde dan op dat moment standaard therapie met oraal cyclofosfamide, respectievelijk 19 versus 11 maanden en 67 maanden versus 52 maanden.4 Echter in tegenstelling tot cyclofosfamide oraal zijn nu vele nieuwe behandelmogelijkheden ter beschikking, waaronder meerdere drie-drug regimes met lenalidomide-, bortezomib-, carfilzomib- of pomalidomide gebaseerde combinaties, meestal in combinatie met een anti-CD38 monoklonale antistof.5-11 Van deze behandelingen is de mediane PFS duidelijk langer in de controle arm van de Myeloma X studie.4 Deze Myeloma X studie randomiseerde bij patiënten met een eerste recidief na eerdere autologe stamceltransplantatie tussen een tweede autologe transplantatie en cyclofosfamide na reïnductie met bortezomib-adriamycine-dexamethason (PAD)-kuren. De mediane gerapporteerde PFS in deze studie was 19 maanden versus 11 maanden (auSCT versus cyclofosfamide).4 Een andere gerandomiseerde studie onderzocht autologe stamceltransplantatie bij patiënten met 1e-3e recidief van ziekte, waarbij lenalidomide-dexamethason na drie kuren werd gevolgd door HDM en autologe stamceltransplantatie ofwel lenalidomide-dexamethason werd gecontinueerd.12 Bij 71% van de patiënten in de transplantatie-arm werd de behandeling ook daadwerkelijk uitgevoerd, 29% van de patiënten was voor die tijd progressief of viel af vanwege adverse events. De mediane OS was niet significant verschillend in beide armen op intention to treat basis. Indien wel een tweede autologe SCT volgde (per protocol analyse) was zowel de PFS (HR 0.74; 95% CI 0.52–1.04) als de OS (HR 0.56; 95% CI 0.32–0.99) beter.12 Een recente retrospectieve studie vergeleek behandeling met daratumumab-pomalidomide-dexamethason (DPd) gevolgd door HDM en een tweede autologe stamceltransplantatie vergeleken met DPd continu bij patiënten met mediaan 2 eerdere behandellijnen, waarbij de tweede autologe stamceltransplantatie een duidelijk voordeel gaf in PFS (42.2 versus 17.5 maanden; HR 0.37; 95% CI 0.18-0.77) en ook in OS (niet bereikt versus 38.1 maanden; HR 0,26; 95% CI 0.09-0.76). De patiënten in de DPd groep waren mediaan 34 maanden (0-182) in remissie na de eerste autologe stamceltransplantatie en in de DPd-ASCT groep mediaan 22 maanden (5-73).13
Overwegingen
Indien nog geen autologe stamceltransplantatie werd verricht in eerste lijn, en patiënt hier ten tijde van het recidief o.b.v. leeftijd en conditie wel voor in aanmerking komt, is het advies een autologe stamceltransplantatie te verrichten, aangezien acceptabele PFS2 kan worden bereikt en overall survival in een studie vergelijkbaar is aan de inzet van autologe stamceltransplantatie in de eerste lijn.3 Een belangrijke overweging voor een uitgestelde of tweede autologe SCT is om de patiënt opnieuw een therapievrij interval te bieden en hiermee de toxiciteit van langdurige behandeling te besparen, dit dient afgewogen te worden tegen de korte termijn toxiciteit van een tweede stamceltransplantatie.
Het is belangrijk te realiseren dat bij patiënten die niet lenalidomide- en daratumumab refractair zijn, een behandeling met daratumumab-lenalidomide-dexamethason met een mediane PFS van bijna 45 maanden en -indien in tweede lijn gegeven 53.3 maanden-, qua effectiviteit een uitstekend, en -afhankelijk van de duur van respons na de eerste autologe stamceltransplantatie- een beter alternatief kan zijn.8 Bij toepassing van isatuximab-carfilzomib-dexamethason bij patiënten die eerder een autologe stamceltransplantatie ondergingen werd na follow up van ruim 20 maanden een mediane PFS beschreven van ‘nog niet bereikt’ in IsaKd versus 19 maanden in de Kd arm (HR 0.60; 99% CI 0.31-1.16).14
De keuze hangt af van de respons op- en toxiciteit van eerdere behandeling voorafgaand aan de stamceltransplantatie, de ervaren toxiciteit van de eerdere stamceltransplantatie, de wensen van patiënt en ook van behandelingsmogelijkheden nadien.13
Indien de respons op voorgaande therapie bestaande uit inductietherapie en een autologe stamceltransplantatie van goede kwaliteit (VGPR of meer) was en de respons langdurig (tenminste 36 maanden, of 24 maanden indien geen lenalidomide onderhoud werd gegeven) was, wordt re-inductie met ten minste 4 kuren gevolgd door een tweede autologe stamceltransplantatie geadviseerd. In submodule 2 staan recidief-schema’s beschreven. Er is geen literatuur waarin verschillende recidiefschema’s als re-inductie voor tweede stamceltransplantatie worden vergeleken. Naast de beschreven recidief-schema’s kan ook daratumumab-VRD worden toegepast als reinductietherapie.
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de MWG.
REFERENTIES
Patiënten die progressieve ziekte ontwikkelen tijdens of <60 dagen na behandeling met een lenalidomide-bevattend regime, ongeacht de dosis van de lenalidomide, worden als lenalidomide-refractair beschouwd. Deze paragraaf is gericht op patiënten met recidief MM die niet aan deze voorwaarde voldoen en derhalve nog lenalidomide sensitief zijn.
Het al dan niet refractair zijn voor anti-CD38 monoklonale antistoftherapie bepaalt voorts de keuze van behandeling. Een patiënt wordt als anti-CD38 antistof therapie refractair beschouwd als het MM progressief is tijdens of <60 dagen na behandeling met een anti-CD38 monoklonale antistof.
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur met betrekking tot lenalidomide-gebaseerde schema’s
(de proteasoomremmer-gebaseerde regimes worden in submodule 2b toegelicht)
In de POLLUX studie werd daratumumab-lenalidomide-dexamethason vergeleken met lenalidomide-dexamethason bij patiënten met recidief MM na ≥1 eerdere behandellijn.
Effectiviteit: De mediane PFS was significant langer met daratumumab-lenalidomide-dexamethason; 44.5 versus 17.5 maanden (HR, 0.44; 95% CI 0.35- 0.54).1 Dit was ook het geval voor die patiënten die slechts 1 voorgaande lijn van therapie hadden ontvangen; 53.3 versus 19.6 maanden (HR, 0.42; 95% CI 0.31-0.58).4 Er was een overlevingsvoordeel met daratumumab-lenalidomide-dexamethason met een mediane OS van 67.6 versus 51.8 maanden, HR 0.73 (95% CI: 0.58-0.91). Bij patiënten met hoog cytogenetisch risico bleek daratumumab-lenalidomide-dexamethason tevens in een langere PFS te resulteren; 26.8 maanden versus 8.3 maanden (HR 0.34; 95% CI, 0.16–0.72). Het bleek echter niet de negatieve invloed van hoog risico teniet te doen. De PFS in de standaard risicogroep was namelijk niet bereikt, versus 18.6 maanden met lenalidomide-dexamethason (HR 0.43; 95% CI 0.32–0.57).1-4
Toxiciteit: Er was een 14% toename in graad 3-4 neutropenie bij daratumumab-lenalidomide-dexamethason ten opzichte van lenalidomide-dexamethason (55% versus 41%)1, dit leidde tot een groter aantal graad 3-4 infecties (28.3% versus 22.8% in de lenalidomide-dexamethason arm).2 De overige hematologische en niet-hematologische graad 3-4 toxiciteit was nagenoeg gelijk. De infusie-gerelateerde bijwerkingen waren mild (meestal graad 1-2, met 5.7% graad 3) en minder dan 1% moest vanwege infusie-gerelateerde bijwerkingen de therapie staken.2 In de Columba studie, waarin intraveneuze toediening werd vergeleken met subcutane injectie, werd 31% interruptie van de i.v.- toediening versus geen interruptie van de subcutane toediening beschreven en traden graad 3 infusie reacties op in 5% (iv) versus 2% (sc).5
In de ASPIRE studie werd carfilzomib-lenalidomide-dexamethason vergeleken met lenalidomide-dexamethason bij patiënten met recidief MM na 1-3 eerdere behandellijnen.6-7
Effectiviteit: De mediane PFS was significant langer met carfilzomib-lenalidomide-dexamethason; 26.3 versus 16.6 maanden (KRd versus Rd); HR0.69; 95% CI 0.57-0.83). 6 Bij patiënten met hoog cytogenetisch risico bleek carfilzomib-lenalidomide-dexamethason tevens in een langere PFS te resulteren; 23.1 maanden versus 13.9 maanden (HR 0.70; 95% CI 0.43-1.16).7De PFS in de standaard risico groep was 29.6, versus 19.5 maanden met lenalidomide-dexamethason (HR 0.66; 95% CI 0.48-0.90).7 De OS verbeterde met KRd versus Rd in standard risico cytogenetica-patiënten (mediaan 49.0 versus 41.4 maanden; HR 0.74; 95% CI 0.56-0.97), en was vergelijkbaar tussen de armen bij hoog risico cytogenetica-patiënten (KRd, n = 48; Rd, n = 52; mediaan 36.0 maanden in beide armen; HR 1.08; 95% CI 0.67-1.74).7 OS was wel beter voor die patiënten die slechts 1 voorgaande lijn van therapie hadden ontvangen; 47.3(KRd) versus 35.9(Rd) maanden (HR 0.81; 95% CI 0.62-1.06).8
Toxiciteit: De treatment-emergent adverse events (TEAE’s) waren in beide armen van de ASPIRE studie vergelijkbaar; graad >3 TEAE’s resp 87.0% (KRd) en 83.3% (Rd), en serious adverse events 65.3% (KRd) en 56.8% (Rd). Met betrekking tot cardiovasculaire bijwerkingen traden met name >3 graad hartfalen (4.3% versus 2.1%) en hypertensie (6.4% versus 2.3%) vaker op in de KRd arm ten opzichte van Rd. Ook werd vaker trombocytopenie gezien (20,2% versus 14,9%).8
In de TOURMALINE MM1 studie werd ixazomib-lenalidomide-dexamethason (ixaRd) vergeleken met lenalidomide-dexamethason bij patiënten met recidief MM na 1-3 eerdere behandellijnen (zie ook tabel 1).9
Effectiviteit: De mediane PFS was significant langer met ixazomib-lenalidomide-dexamethason; 20.6 versus 14.7 maanden (HR 0.74; 95% CI 0.59-0.94).9 Bij patiënten met hoog cytogenetisch risico bleek ixazomib-lenalidomide-dexamethason tevens in een langere PFS te resulteren; 21.4 maanden versus 9.7 maanden (HR 0.54; 95% CI0.32-0.92). De toevoeging van ixazomib bleek de negatieve invloed van hoog risico teniet te doen. De PFS in de standaard cytogenetisch risicogroep was namelijk 20.6, versus 15.6 maanden met lenalidomide-dexamethason (HR 0.64; 95% CI 0.46-0.89).10 Hierbij moet echter wel vermeld worden dat dit veroorzaakt kan worden door het afkappunt van de grootte van de kloon van del(17p). Indien 5% of 20% werd gebruikt als minimum voor aanwezigheid van del(17p) bleek de negatieve invloed van del(17p) volledig teniet gedaan te worden; mediane PFS 21.4 versus 20.6 in de gehele patiëntenpopulatie. Echter bij gebruik van 60% als afkappunt was de PFS slechts 15.6 maanden.10 De verschillen in PFS tussen de beide armen in de Tourmaline studie vertaalden zich niet in een overlevingsvoordeel, OS was gelijk in beide armen bij een mediane follow up van 85 maanden: 53.6 maanden bij ixaRd versus 51.6 maanden in de Rd arm (HR 0.939).11
Toxiciteit: In de ixaRD arm trad vaker trombocytopenie op (31%) vergeleken met de controlearm Rd (16%) en tevens werden meer gastro-intestinale klachten gemeld met ixazomib toevoeging, echter van voorbijgaande en milde aard.9
In de ELOQUENT-2 studie werd elotuzumab-lenalidomide-dexamethason (eloRd) vergeleken met lenalidomide-dexamethason bij patiënten met recidief MM na 1-3 eerdere behandellijnen. 12
Effectiviteit: De mediane PFS was significant langer met elotuzumab-lenalidomide-dexamethason: 19.4 versus 14.9 maanden (HR 0.70; 95% CI 0.57-0.85).12 Er was tevens een overlevingsvoordeel: 48.3 versus 39.6 maanden(HR 0.82; 95% CI 0.68-1.00).13 Het effect was het meest uitgesproken in die patiënten die 2-3 voorgaande lijnen van therapie ondergingen. Patiënten met cytogenetisch hoog risico hadden een OS van 29.8 maanden versus 24.8 met lenalidomide-dexamethason (HR 0.69; 95% CI 0.46–1.03). 13
Toxiciteit: Er was een lichte toename van lymfopenie in de eloRd arm ten opzichte van de controlearm van de studie (77% versus 49% graad 3-4) zonder melding van een toename van infectieuze complicaties; overige hematologische en niet-hematologische toxiciteit graad 3 en 4 waren vergelijkbaar zonder opvallende toxiciteitmeldingen.12
Overwegingen met betrekking tot de literatuur
Voor patiënten die niet-lenalidomide refractair zijn adviseert de MWG een regime met lenalidomide als backbone. De proteasoomremmer-gebaseerde regimes zijn geregistreerd vanaf de tweedelijns behandeling maar worden alleen geadviseerd indien de ziekte lenalidomide-refractair is of de patiënt intolerant voor lenalidomide en toegelicht in submodule 2B verder.
De MWG heeft op basis van bovenstaande gegevens een voorkeur voor daratumumab-lenalidomide-dexamethason gezien de effectiviteit en mede in het licht van het bijwerkingenprofiel dat gunstig is, hoewel meer neutropenie en infectieuze complicaties worden beschreven. Indien er sprake is anti-CD38 monoklonale antistoftherapie refractair (of –intolerant) zijn heeft, gezien de effectiviteit, behandeling met carfilzomib-lenalidomide-dexamethason de voorkeur. Bij de combinatie met carfilzomib moeten cardiovasculaire bijwerkingen in ogenschouw worden genomen, met name bij patiënten met preexistente hypertensie; streef naar normale bloeddruk teneinde toxiciteit te limiteren.
De combinaties van pomalidomide met bortezomib-dexamethason of van pomalidomide met daratumumab-dexamethason zijn geregistreerd vanaf tweedelijns therapie, maar bij patiënten die niet-refractair zijn voor lenalidomide heeft een lenalidomide-bevattend schema de voorkeur boven een pomalidomide-bevattend schema. Volgens de MWG is er voldoende evidence voor gebruik van pomalidomide na lenalidomide (OPTIMISMM), maar niet andersom.14 Om deze reden zijn de pomalidomide bevattende schema’s niet opgenomen in deze submodule maar in de submodule 2b (lenalidomide refractaire ziekte).
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de MWG.
REFERENTIES
Patiënten die progressieve ziekte ontwikkelen tijdens of <60 dagen na behandeling met een lenalidomide-bevattend regime, ongeacht de dosis van de lenalidomide, beschouwen we als lenalidomide-refractair. Deze paragraaf is gericht op patiënten met recidief MM die aan deze voorwaarde voldoen. Dit is ongeacht de lenalidomide dosering, dus inclusief onderhoudsbehandeling lenalidomide 10 mg/dag.
Het al dan niet refractair zijn voor anti-CD38 monoklonale antistoftherapie bepaalt voorts de keuze van behandeling. Een patiënt wordt als anti-CD38 antistof therapie refractair beschouwd als het MM progressief is tijdens of <60 dagen na behandeling met een anti-CD38 monoklonale antistof.
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING/LITERATUUROVERZICHT
Samenvatting literatuur
De twee verschillende drie-drug regimes met een carfilzomib backbone (daratumumab-carfilzomib-dexamethason en isatuximab-carfilzomib-dexamethason) zijn beide onderzocht in patiënten met een terugkeer van de ziekte na 1 tot 3 lijnen voorgaande therapie, en vergeleken met carfilzomib-dexamethason.
In de CANDOR-studie werd daratumumab-carfilzomib-dexamethason (DKd) vergeleken met carfilzomib-dexamethason (Kd).1-3
Effectiviteit: De mediane PFS was 28.4 maanden in de DKd arm versus 15.2 maanden met Kd (HR 0.64; 95% CI 0.49-0.83).3Ook bij lenalidomide-refractaire patiënten bleek daratumumab-carfilzomib-dexamethason superieur ten opzichte van carfilzomib-dexamethason met een mediane PFS 28.1 versus 11.1 maanden (HR 0.46; 95% CI 0.28-0.73).1 In een subgroep analyse in hoog cytogenetisch risico-patiënten was de mediane PFS 11.2 versus 7.4 maanden (HR 0.56; 95% CI 0.34-0.93).2Deze data ondersteunen de effectiviteit van daratumumab-carfilzomib-dexamethason ook in hoog risico RRMM patienten.1,2,3 Vermeld dient te worden dat 28% van de patiënten in de carfilzomib-arm bortezomib refractaire ziekte hadden. Na mediane follow up van 50 maanden werd geen significant overlevingsvoordeel gezien in de hele populatie (mediane OS was 50.8 maanden (95% CI 44.7–not estimable [NE]) in de DKd arm versus 43.6 (95% CI 35.3–NE) maanden in de Kd arm).3
Toxiciteit: Graad ≥3 (treatment emergent adverse events) TEAEs traden in resp. in 89% en 79% van de patiënten op (DKd) versus (Kd), meest voorkomende bijwerkingen waren: trombocytopenie, hypertensie, pneumonie en anemie in beide groepen. Fatale TEAE’s traden op bij 11% resp 6% (DKd versus Kd) van de patiënten (meest voorkomend infectie en cardiale ziekte). Grade ≥3 infecties werden gezien bij resp. 46% en 32% van de patiënten (DKd versus Kd) en vanwege TEAE’s staakten resp. 34% (DKd arm) en 27% (Kd arm) de therapie.3
In de IKEMA-studie werd isatuximab-carfilzomib-dexamethason (IsaKd) vergeleken met carfilzomib-dexamethason (Kd).4-7
Effectiviteit: De mediane PFS was 35.7 maanden in de IsaKd arm versus 19.2 maanden met Kd (HR 0.58; 95% CI 0.42–0.79).6 Ook bij lenalidomide-refractaire patiënten bleek IsaKd superieur ten opzichte van Kd (HR, 0.59; 95% CI 0.35–0.97), echter de absolute waarden voor de PFS zijn nog niet gerapporteerd.6 De gegevens van isatuximab-carfilzomib-dexamethason t.a.v. hoog risico cytogenetica zijn nog prematuur, de absolute PFS is ook in hoog cytogenetisch risico patiënten in de IKEMA studie nog niet bereikt in de IsaKd arm.5 De hazard ratio’s voor de PFS (IsaKd versus Kd) in de subanalyse bij patiënten met >1 hoog-risico cytogenetisch afwijking en patiënten zonder hoog –risico cytogenetica zijn respectievelijk 0.72 (95%CI 0.4-1.3) en 0.44 (95% CI 0.27-0.73).5 Een recente publicatie toonde PFS verschillen bij patiënten die een autologe stamceltransplantatie hadden ondergaan en patiënten zonder voorafgaande autoSCT.7 Na follow up van ruim 20 maanden was de mediane PFS in de groep patiënten na voorgaande autologe SCT nog niet bereikt in IsaKd versus 19 maanden in de Kd arm (HR 0.60; 99% CI 0.31-1.16) en in de groep die geen autologe SCT onderging was dit resp. nog niet bereikt (Isa-Kd) en 19 maanden (Kd) (HR 0.44; 99% CI 0.18-1.05).7
Toxiciteit: Treatment emergent adverse events (TEAEs) die leidden tot staken van studiemedicatie traden op in resp 12.4 versus 18% van de patienten en TEAE’s waren fataal bij 5.6% versus 4.9% (IsaKd versus Kd).6 Graad > 3 TEAE’s echter kwamen wel 10% vaker voor in de IsaKd arm ten opzichte van de Kd (83% versus73%). De meest voorkomende TEAE’s graad > 3 waren hypertensie (beide armen 23%) en pneumonie (18,6% versus 12,3%; IsaKd versus Kd). Hartfalen werd beschreven bij 4,5% en 4,1% van de patienten in de IsaKd resp. Kd arm.6
Er zijn diverse gerandomiseerde trials verricht met bortezomib-dexamethason als standaard arm.
De ENDEAVOR studie vergeleek carfilzomib-dexamethason (Kd) met bortezomib-dexamethason (Vd). 8-10
Effectiviteit: ENDEAVOR toonde een significante verbetering van de PFS (mediaan 18.7 versus 9.4 maanden (HR 0.53; 95%CI 0.44-0.65) en OS (mediaan 47.6 versus 40 maanden; HR 0.79; 95% CI 0.65-0.96).8,9 Voor lenalidomide refractaire patiënten was de mediane PFS 8.6 versus 6.6 maanden (HR 0·80; 95%CI 0·57–1·11) en de mediane OS 29.2 versus 21.4 maanden. Een separate analyse van de ENDEAVOR studie toonde dat ook in cytogenetisch hoog risico ziekte, gedefinieerd als del17p, t(4;14) en t(14;16) carfilzomib superieur was t.o.v. bortezomib met een mediane PFS van 8.8 versus 6.0 maanden (HR 0.65; 95% CI 0.453–0.921), echter het negatieve effect van hoog risico cytogenetische afwijkingen werden met Kd niet teniet gedaan, gezien de mediane PFS van 18.7 maanden in de gehele populatie.10
Toxiciteit: Serious adverse events (SAE’s) warden gerapporteerd in 59% versus 40% van de patiënten (Kd versus Vd) en de meest voorkomende graad > 3 adverse events waren: anemie (16% versus 10%), hypertensie (15% versus 3%) pneumonie (9% beide), dyspnoe (6% versus2%) (Kd versus Vd). Perifere neuropathie graad > 2werd gemeld bij respectievelijk 32% (Vd) en 6% (Kd) van de patiënten; rond de 15% van de patiënten in de Vd arm van de Endeavor studie kreeg bortezomib nog intraveneus toegediend, de overige patiënten subcutaan. 8
In de CASTOR studie werd daratumumab-bortezomib-dexamethason vergeleken met bortezomib-dexamethason.11-15
Effectiviteit: In de CASTOR studie gaf de toevoeging van daratumumab een significant langere PFS: 16.7 versus 7.1 maanden (HR 0.31; 95% CI 0.25-0.40).10-11 Voor lenalidomide-refractaire patiënten, ongeacht het aantal voorgaande lijnen van therapie, was dit 7.8 versus 4.9 maanden (HR 0.44; 95%CI 0.28-0.68).14 Daratumumab-bortezomib-dexamethason was superieur ten opzichte van bortezomib-dexamethason zowel in cytogenetisch standaard risico (PFS 16.6 versus 6.6 maanden; HR, 0.26; 95% CI 0.19-0.37) als hoog risico (PFS 12.6 versus 6.2 maanden; HR 0.41; 95% CI 0.21–0.83).13 Er werd een overlevingsvoordeel aangetoond voor de toevoeging van daratumumab met een mediane OS van 49.6 versus 38.5 maanden (HR 0.74; 95% CI 0.59- 0.92).15 Subgroep analyses toonden in de hoog cytogenetisch risico groep een OS van 38.4 maanden (DVd) versus 28.8 maanden (Vd) (HR 0.77 ; 95% CI 0.41 to 1.46) en in de standaard risico cytogenetica patiënten een OS van 55.8 maanden (DVd) versus 41.8 maanden (VD) (HR 0.71; 95% CI 0.52-0.98).15
Toxiciteit: De gerapporteerde (>10%) graad 3-4 TEAE’s in de CASTOR trial waren trombocytopenie (46% versus 33%), anemie (16% versus 16%), neutropenie (13.6% versus 4.6%), lymfopenie (10.3% versus 2.5%) en pneumonie (10.7% versus 10.1%) (DVd versus Vd).15
In de OPTIMISMM studie werd pomalidomide-bortezomib-dexamethason (PVd) vergeleken met bortezomib-dexamethason (Vd).16-18
Effectiviteit: De toevoeging van pomalidomide gaf een significant langere PFS van 11.2 versus 7.1 maanden (HR 0·61; 95% CI 0·49–0·77).16 De OS data zijn nog immatuur. Bijzonder in deze studie was dat 50-60% van de patiënten lenalidomide-refractair waren.18 Ook in die subgroep resulteerde pomalidomide-bortezomib-dexamethason in een betere PFS van 9.5 maanden versus 5.6 maanden met bortezomib-dexamethason. Lenalidomide-refractaire patiënten die slechts één voorgaande lijn van therapie hadden gekregen hadden een PFS van 17.8 maanden versus 9.5 maanden met bortezomib-dexamethason (HR 0.55; 95% CI 0.33–0.94].17 Bij niet-lenalidomide refractaire patiënten was de PFS na slechts één eerdere lijn 22.0 versus 12.0 maanden voor pomalidomide-bortezomib-dexamethason versus bortezomib-dexamethason (HR 0.54; 95%CI 0.29–1.01).17 In de OPTIMISMM studie werd aangetoond dat ook in hoog risico ziekte, gedefinieerd als del17p, t(4;14) en t(14;16) pomalidomide-bortezomib-dexamethason superieur was t.o.v. bortezomib-dexamethason met een mediane PFS van 8.4 versus 5.3 maanden, ten opzichte van de mediane PFS van 11.2 maanden in de gehele populatie. Bij toepassing van pomalidomide-bortezomib-dexamethason na één eerdere lijn van behandeling was de mediane PFS bij hoog-risico cytogenetica 14.7 versus 9.9 maanden (HR 0.39; 95% CI 0.13–1.17).18
Toxiciteit: In deze studie werd in de PVd arm vooral een toename gezien van neutropenie, gemeld als graad 3 of 4 TEAE bij respectievelijk 42% en 9% (Vd). Dit leidde tot een verschil in infecties (gr 3-4); 31% versus 18% (PVD versus Vd), waaronder pneumonie.16,18
In de APOLLO studie werden patiënten met RRMM, na ≥1 lijn therapie (mediaan 2 lijnen), waaronder lenalidomide en een PI, gerandomiseerd tussen behandeling met daratumumab-pomalidomide-dexamethason (DPd) of pomalidomide-dexamethason (Pd).19
Effectiviteit: 22% van de geïncludeerde patiënten had ISS stadium III ziekte; 35% had hoog risico cytogenetica en bijna 80% was lenalidomide refractair. Na een mediane follow up van 16.9 maanden was de PFS 12.4 maanden versus 6.9 maanden in de DPd resp. Pd behandelde groep (HR 0.63; 95% CI 0·47–0·85).19 De mediane PFS2 was eveneens in het voordeel van DPd: niet bereikt versus 17.6 maanden, HR 0.79; 95% CI 0.55-1.14). Ten tijde van de PFS- analyses waren de OS dat nog immatuur en follow up voor lange termijn overleving is nog gaande. 19
Toxiciteit: Graad 3-4 neutropenie werd vaker gezien in de DPd versus Pd behandelde groep (68% versus 51%), de incidentie van anemie en trombocytopenie was gelijk tussen beide groepen (17 versus 21 resp. 17 versus 18%). Pneumonie werd vaker gezien bij de DPd behandelde groep t.o.v. de Pd groep (15 versus 8%). Graad 3-4 infecties werden gezien bij 28 versus 23% in de DPd respectievelijk Pd behandelde groep.19
Pomalidomide monotherapie is bij uitgebreid voorbehandelde patiënten onderzocht en resulteerde in een respons in ongeveer 30-35% van de patiënten en een mediane PFS van 4 maanden.20-23 Er zijn voorts diverse gerandomiseerde trials verricht met pomalidomide-dexamethason als standaard arm.
In de ICARIA studie werden patiënten die mediaan 3 eerdere lijnen van behandeling hadden ondergaan, gerandomiseerd tussen isatuximab-pomalidomide-dexamethason (IsaPd) en pomalidomide-dexamethason (Pd). 24-25
Effectiviteit: De toevoeging van isatuximab resulteerde in een verbetering in de mediane PFS van 11.5 maanden versus 6.5 maanden (HR 0.60; 95% CI 0.44-0.81).24 Dit vertaalde zich bovendien in een OS voordeel: 24.6 maanden voor IsaPd versus 17.7 maanden voor de standaard arm met Pd (HR 0.76; 95% CI 0.57-1.01).25
Toxiciteit: De meest gerapporteerde graad >3 TEAE’s (naast infusie gerelateerde symptomen bij isatuximab) waren neutropenie (50% versus 35%), pneumonie (23% versus 21%) en trombocytopenie (13% versus 12%) IsaPd versus Pd). Ernstige TEAE’s kwamen voor in 70% van de IsaPd arm en 60% van de Pd arm in de studie.25
De ELOQUENT 3 studie vergeleek (in fase 2 design) elotuzumab-pomalidomide-dexamethason(EloPd) met pomalidomide-dexamethason(Pd).26-27
Effectiviteit: Door toevoeging van elotuzumab werd een verbetering in de mediane PFS van 10.3 maanden versus 4.7 maanden gezien (HR 0.54; 95% CI 0.34- 0.86.26 Ook van deze studie zijn de OS data inmiddels gepubliceerd en de toevoeging van elotuzumab gaf een OS voordeel: 29.8 maanden voor EloPd versus 17.4 maanden voor Pd (HR 0.59; 95% CI 0.37-0.93).27 In deze studie waren slechts 2% van de patiënten in de elotuzumab-arm eerder met daratumumab behandeld en een zeer groot percentage (tot 90%) van de patiënten had lenalidomide refractaire ziekte.26
Toxiciteit: Graad 3-4 adverse events (57% versus 60%) en serious adverse events (53% versus 55%) werden gerapporteerd in vergelijkbare percentages in de studie- en de controlearm (EloPd versus Pd).26 Neutropenie (18% versus 20%), hyperglycemie (18% versus 11%) en anemie (10% versus 15%) waren de meest voorkomende TEAE’s (EloPd versus Pd). Pneumonie werd gerapporteerd in 5% versus 9% in deze studie (EloPD versus Pd).26
In de REPEAT studie werd de toevoeging van 50 mg cyclofosfamide per dag aan lenalidomide 25 mg en prednison 20 mg per dag (REP) onderzocht bij lenalidomide-refractaire patiënten.28 Dit schema gaf een respons in 67% van de patiënten met een mediane PFS van 12.1 en een OS van 29.0 maanden.28 Deze studie includeerde echter geen patiënten met voorgaande behandeling met anti-CD38 monoklonale antistoffen, aangezien die behandelmodaliteit destijds nog niet beschikbaar was.
Naar analogie van deze studie is tevens de toevoeging cyclofosfamide aan pomalidomide-dexamethason onderzocht, in lenalidomide-refractaire patiënten.29-30 In de eerste studie (NCT01432600) werd cyclofosfamide niet metronomisch maar 1x per week gedoseerd (400 mg oraal op dag 1, 8, 15) en vergeleken met pomalidomide-dexamethason. De toevoeging van cyclofosfamide leidde tot een significant hogere respons (65% versus 39%) en een significant langere PFS (9.5 versus 4.4 maanden).29 In een tweede studie (NCT02176213) werd de cyclofosfamide metronoom gedoseerd, met 50 mg per dag zoals in het REP schema. Deze kleine studie (n=33) toonde een respons van 73% met een mediane PFS van 13.3 maanden en een mediane OS van 57.2 maanden.30
In een recente fase 2 studie werd de toevoeging van cyclofosfamide aan carfilzomib-dexamethason onderzocht bij patiënten na 1-3 eerdere lijnen van behandeling; 50% van de patiënten was lenalidomide refractair.31 De mediane PFS was 19.1 voor KCd versus 16.6 voor de Kd arm. In een post hoc analyse van de lenalidomide refractaire patiënten werd een PFS van 18.4 versus 11.3 maanden beschreven (HR 1.7; 95% CI 1.1-2.7; p=0.043).31
Samenvatting literatuur over behandelschema’s zonder specifieke aanbeveling
In de BOSTON studie werd selinexor-bortezomib-dexamethason vergeleken met bortezomib-dexamethason bij patiënten met recidief MM na 1-3 eerdere behandellijnen. De mediane PFS was 13.9 maanden voor selinexor-bortezomib-dexamethason versus 9.5 maanden voor bortezomib-dexamethason (HR 0·70, 95% CI 0·53-0·93). Er werd echter een toename in hematologische toxiciteit (m.n. trombocytopenie) en opvallend veel vermoeidheid (42% versus 18%) en misselijkheid (50% versus 10%) gezien bij de toevoeging van selinexor.32
Melflufen is goedgekeurd in de combinatie met dexamethason voor patiënten met refractair myeloom, die ten minste drie eerdere therapielijnen hebben gekregen en refractair zijn voor ten minste één PI, één IMiD, en één anti-CD38 monoklonaal antilichaam. Voor patiënten die eerder autologe stamceltransplantatie hebben ondergaan, moet de tijd tot progressie ten minste drie jaar na transplantatie zijn, om in aanmerking te komen voor melflufen. De goedkeuring is gebaseerd op gegevens uit de fase II HORIZON klinische studie en ondersteund door aanvullende data van de gerandomiseerde fase III OCEAN klinische studie.33,34 In de fase II HORIZON studie met hierin een grotendeels triple class refractaire patiëntenpopulatie was de ORR 29%, met een mediane PFS van 4.2 maanden, mediane duur van respons van 5.5 maanden en de mediane overleving was 11.6 maanden. Veel voorkomende bijwerkingen waren neutropenie (79%), trombopenie (76%) en anemie (43%). Pneumonie graad 3/4 was de meest frequente niet-hematologische AE (10%).33 De OCEAN-studie evalueerde melflufen-dexamethason versus pomalidomide-dexamethason. In patiënten refractair op lenalidomide en refractair op de laatste lijn van therapie was de mediane PFS 6.8 versus 4.9 maanden voor melflufen-dexamethason en pomalidomide-dexamethason, respectievelijk (HR 0.79; 95% CI 0.64-0.98).34 De mediane overleving was echter 19.8 maanden in de melflufen arm versus 25 maanden in de pomalidomide arm (HR 1.10).34 In een post-hoc subgroep analyse werd gevonden dat het negatief prognostische effect vooral gezien werd in de patiëntengroep die eerdere hoge dosis melfalan en autologe stamceltransplantatie had gehad, m.n. patiënten die niet eerder behandeld werden met HDM en autologe SCT zouden mogelijk voordeel kunnen hebben van behandeling met melflufen.34
Overwegingen met betrekking tot de literatuur
Voor patiënten die lenalidomide-refractair zijn adviseert de MWG een regime met een proteasoomremmer als backbone.
Gezien de vergelijkbare uitkomsten van de CANDOR en IKEMA studies hebben daratumumab-carfilzomib-dexamethason en isatuximab-carfilzomib-dexamethason de voorkeur van de MWG. Met deze combinaties wordt een duidelijk langere PFS gezien t.o.v. behandelschema’s met een bortezomib-backbone.
Indien bortezomib als backbone wordt gekozen zijn verschillende drie-drug regimes met een bortezomib backbone beschikbaar, die allen in patiënten met een terugkeer van de ziekte na 1 tot 3 lijnen voorgaande therapie zijn getest, echter niet head-to-head vergeleken. T.o.v. bortezomib-dexamethason geven toevoeging van pomalidomide en daratumumab respectievelijk een risico reductie in progressie van de ziekte van 39% en 61% (HR 0.61 en 0.39) met een mediane PFS van respectievelijk 11 en 17 maanden. Derhalve heeft de combinatie van bortezomib-dexamethason met daratumumab in deze situatie de voorkeur van de MWG.
Met betrekking tot hoog risico cytogenetica zijn de resultaten van de hierboven beschreven studies niet vergelijkbaar vanwege verschillend gebruikte criteria, verschillende percentages “missing data”, ontbreken van data over de cut-off waarde voor de kloon—omvang van del17p etc. De combinaties van daratumumab-carfilzomib-dexamethason en daratumumab-bortezomib-dexamethason lijken gedeeltelijk het ongunstige risico van hoog-risico cytogenetica teniet te doen.
Toxiciteit
Bijzondere aandacht voor: in geval van hartfalen, cave cardiale toxiciteit van carfilzomib, streef naar normale bloeddruk teneinde toxiciteit te limiteren. Carfilzomib-dexamethason gaf vaker graad 3-4 hypertensie dan bortezomib-dexamethason: 9 versus 3% en minder vaak graad 3-4 perifere neuropathie <1% versus 6% en diarree 3% versus 8%. De hematologische toxiciteit was niet verschillend.8 Daratumumab-bortezomib-dexamethason gaf nagenoeg geen additionele bijwerkingen ten opzichte van bortezomib-dexamethason. Er was alleen een 12% toename in graad 3-4 trombopenie ten opzichte van Vd (46 versus 33%) en neutropenie (13% versus 4%). De overige hematologische en niet-hematologische toxiciteit was gelijk.11 In patiënten die met daratumumab-carfilzomib-dexamethason werden behandeld werden meer infecties waargenomen t.o.v. carfilzomib-dexamethason, zowel luchtweginfecties als virale infecties, respectievelijk 29% versus 16% en 6% versus 2% voor graad 3 of hoger.1 In de IKEMA studie was het verschil in optreden van pneumonie tussen de IsaKd en de Kd arm minder groot, nl. 18.6 versus 12.3%.6 De hoge incidentie van pit onderstreept de noodzaak voor antibacteriële en antivirale profylactische therapie (zie module supportive care).
Overige overwegingen:
De toevoeging van cyclofosfamide aan lenalidomide of pomalidomide kan een goede overweging zijn indien er contra-indicaties bestaan voor het gebruik van proteasoomremmers.
Pomalidomide monotherapie heeft niet de voorkeur vanwege matige effectiviteit (bij uitgebreid voorbehandelde patiënten). Bij die patiënten die een respons verkregen was de mediane duur van de respons 8 maanden bij gebruik van pomalidomide en de time-to-response was kort.20-23
De combinatie elotuzumab-pomalidomide-dexamethason werd onderzocht in een populatie waarin slechts 2% van de patiënten daratumumab-voorbehandeld was, derhalve kan geen uitspraak gedaan worden over de effectiviteit van elotuzumab in deze combinatie nadat de patiënt behandeld is geweest met daratumumab of isatuximab.26
Selinexor-bortezomib-dexamethason wordt niet aanbevolen vanwege beperkte effectiviteit in vergelijking met andere combinaties met bortezomib als back-bone (daratumumab-bortezomib-dexamethason en pomalidomide-bortezomib-dexamethason) en de toxiciteit die bleek uit de BOSTON trial.32
De toepassing van melflufen na ten minste drie lijnen van behandeling wordt niet aanbevolen op grond van beperkte effectiviteit en de overwegingen hierboven benoemd.
Vanaf de derde- of vierdelijnsbehandeling zullen patiënten over het algemeen lenalidomide- en anti-CD38 monoklonale antistof- refractair zijn en meestal ook refractair zijn voor een proteasoomremmer. Gezien de slechte prognose zijn er geen duidelijke adviezen te geven over welk recidief schema dan het meest effectief zal zijn. Daarom adviseert de MWG voor deze categorie patiënten contact op te nemen met het consult-verlenend ziekenhuis ter beoordeling van participatie in studies. Voor een actueel overzicht van deze studies wordt verwezen naar de HOVON website (http://www.hovon.nl/werkgroepen/studiewerkgroepen/myeloma.html).
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de MWG.
REFERENTIES
CONCLUSIES
ONDERBOUWING/LITERATUUROVERZICHT
Samenvatting literatuur
De BCMA-gerichte bispecifieke antistof teclistamab is EMA geregistreerd en in de sluis geplaatst in afwachting van de prijsonderhandeling. De registratie berust op de data van de fase 1-2 MajesTEC-1 studie waarin uitgebreid voorbehandelde patiënten (minimaal 3 eerdere lijnen, mediaan 5 eerdere lijnen, 77.6% triple-refractair) behandeld werden met teclistamab monotherapie.1 Bij de standaard dosis van 1500 ug/kg sc. werd een overall response rate gezien van 63% met 39% CR/sCR, met een mediane duur van respons van 18.4 maanden en een mediane PFS van 11.3 maanden. Cytokine release syndroom (CRS) trad frequent op in 72% maar was vrijwel in alle gevallen graad 1-2. Immune effector cell-associated neurotoxicity (ICANS) trad slechts in 3% op en was in alle gevallen graad 1-2. Wel werden veel infecties gezien, 45% graad 3-4. Dit waren m.n. veel virale en bacteriële luchtweginfecties, maar ook gevallen van (lijn)sepsis, CMV reactivatie, PJP en invasieve schimmelinfecties.1
De GPRC5D-gerichte bispecifieke antistof talquetamab is eveneens geregistreerd. O.b.v. de data van de MonumenTAL-1 studie in een vergelijkbaar voorbehandelde patiëntengroep geeft dit middel als monotherapie een overall response rate van 73-74% met 58% ≥VGPR.2 De mediane PFS was 8-12 maanden, met een mediane duur van respons van 9-13 maanden voor alle responders en nog niet bereikt voor ≥CR. De toxiciteit was qua CRS (cytokine release syndrome) en ICANS vergelijkbaar met de BCMA-gerichte bispecifieke antistoffen, wel werd en meer huid-, nagel- en smaaktoxiciteit gezien maar beduidend minder ernstige infecties (ca 15% graad 3-4).2
De BCMA-gerichte bispecifieke antistof elranatamab is vooralsnog in studieverband beschikbaar. O.b.v. de eerste preliminaire data van de MagnetisMM-1 studie in eveneens uitgebreid voorbehandelde patiënten gaf dit middel als monotherapie een overall response rate van 64% met 38% CR/sCR, dus zeer vergelijkbaar met teclistamab. Ook de toxiciteit was vrijwel identiek qua CRS, ICANS en infecties.3 Data van de fase studie MagnetisMM-3 bij patiënten met een recidief MM na ten minste één proteasoomremmer, één IMID en een antiCD38 antistof behandeling leidden tot registratie van Elranatamab voor patiënten die minimaal drie eerdere lijnen van behandeling ondergingen.4 Elranatamab als monotherapie gaf een overall response rate van 61% met 56% > VGPR.4 De PFS 15 maanden werd geschat op 50.9% (95% CI; 40.9–60.0) en de OS op 15 maanden 56.7% (95% CI; 47.4-65.1).4 Cytokine release syndroom (CRS) trad op in 58% maar was in alle gevallen graad 1-2; infecties traden frequent op (70% waarvan 40% graad 3-4) evenals anemie en neutropenie (beide bij 50%).4
De BCMA-gerichte CAR-T-cel producten ide-cel en cilta-cel zijn beide geregistreerd, maar in afwachting van de vergoedingsstatus vooralsnog niet beschikbaar in Nederland. Ook deze middelen werden onderzocht in vergelijkbare patiëntengroepen na minimaal 3 eerdere lijnen van therapie met een groot aandeel van triple-refractaire patiënten. Ide-cel gaf in de KarMMa-1 studie bij doses van 150-450 x106 een overall response rate van 73% waarvan 33% CR/sCR, met een mediane PFS van 8.8 maanden.5 De CARTITUDE-1 studie toonde voor cilta-cel bij de target dosis van 0.75×106 cellen/kg zelfs een overall response rate van 97% waarvan 65% sCR met een nog niet bereikte PFS (54% PFS op 27 maanden).6-7Ook deze middelen geven zo’n 80% CRS, maar vrijwel allemaal graad 1-2 met slechts 4-5% graad 3-4 CRS. Voor ide-cel zijn recent ook data van de gerandomiseerde KarMMa-3 studie gepubliceerd, waarin patiënten na 2-4 eerdere behandellijnen gerandomiseerd werden tussen behandeling met ide-cel (150-450 x106 cellen) en ‘standaard care’. In deze standaard zorg arm konden patiënten worden behandeld met dara-pom-dex, dara-bor-dex, ixa-len-dex, carfilzomib-dex of elo-pom-dex. In deze studie gaf behandeling met ide-cel een overall response rate van 71% versus 42% in de standaard zorg arm. Dit vertaalde zich in een mediane PFS van 13.3 versus 4.4 maanden.8 Data van de fase 3 CARTITUDE-4 studie tonen na randomisatie tussen 1 dosis Cilta-cel versus standard-of care (pomalidomide-bortezomib-dexamethason of daratumumab-pomalidomide-dexamethason) bij lenalidomide-refractaire patiënten na 1-3 lijnen van behandeling gedurende de mediane follow up periode van 15,9 maanden een mediane PFS na 12 maanden van 76% (cilta-cel) versus 49% (standard-of-care arm) (HR 0.26).9
Opvallend is dat de CRS bij cilta-cel mediaan na 7 dagen optreedt bij latere in vivo piek expansie, terwijl dit bij ide-cel mediaan 1 dag na infusie is. ICANS trad op in 18% van de patiënten in de KarMMa-1 studie en 21% van de patiënten in de CARTITUDE-1 studie, waarvan respectievelijk 3% en 9% graad 3-4. Bij cilta-cel werd in enkele patiënten een opvallende vorm van late neurotoxiciteit met parkinsonisme gezien.6-8
In de DREAMM-2 studie werden 2 doses van belantamab-mafodotin een anti-BCMA antibody drug conjugate met monomethyl auristatine F als tubuline remmer onderzocht (2.5 of 3.4 mg/kg) in patiënten met mediaan 6-7 lijnen van voorgaande therapie en 65-100% was refractair voor een IMiD, proteasoom remmer en anti-CD38 mAb. De respons was respectievelijk 31 en 34%. De mediane PFS 2.8 en 4.9 maanden. Voor een uitspraak over OS is de follow up te beperkt. Er was specifieke cornea toxiciteit in 63% van de patiënten waarvan 27 en 21% graad 3-4.10-11 De registratie van Belantamab mafodotin is ingetrokken in september 2023.
Overwegingen met betrekking tot de literatuur
De in deze submodule besproken therapieën zijn nog in afwachting van registratie en/of vergoedingsstatus. Teclistamab en talquetamab zijn via compassionate use programma’s onder voorwaarden reeds beschikbaar. Behoudens congresverslagen van abstracts over de fase 3 studies met ide-cel en cilta-cel, zijn nog geen data gepubliceerd behoudens fase 1-2 studies van deze CAR-T cel producten. Echte aanbevelingen kunnen aangaande deze behandelingen nog niet worden gedaan.
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van de MWG.
REFERENTIES
De MWG is van mening dat bij iedere patiënt met multipel myeloom supportive care met betrekking tot botziekte (osteoporose en osteolytische laesies), preventie van trombose, preventie van infecties, anemie, neutropenie en diarree (in het bijzonder bij lenalidomide gebruik), een belangrijk onderdeel van de behandeling vormen. Naast de myeloom-werkgroepleden Inger Nijhof, Elizabeth de Kort, Ellen van der Spek en Esther de Waal, hebben Rolf Brouwer (internist hematoloog RdGG Delft), Karina Meijer(internist hematoloog gespecialiseerd in stollingsziekten, UMCG Groningen) en Femke Spoelstra (radiotherapeut-oncoloog, Amsterdam UMC, locatie VUMC) bijdrage geleverd aan de module supportive care.
1a Welke botafbraak-remmende medicatie wordt toegepast?
1b Wat is de dosis, frequentie en duur van de behandeling?
1c Welke aspecten zijn van belang m.b.t. hypocalciëmie, osteonecrose en nierinsufficiëntie?
AANBEVELINGEN/CONCLUSIES
1a. Botafbraak-remmende medicatie
1b. Dosis, frequentie en duur van de behandeling
1c. Monitor veiligheid t.a.v. nierinsufficiëntie, hypocalciëmie en osteonecrose
Tabel 1; dosisaanpassing zoledroninezuur en pamidronaat bij nierfunctiestoornissen (farmacotherapeutisch kompas)
|
|
Kreatineklaring |
||||
|
|
> 60 ml/min |
50–60 ml/min |
40–49 ml/min |
30–39 ml/min |
< 30 ml/min |
|
zoledroninezuur |
geen dosisaan-passing nodig |
3,5 mg (= 4,4 ml van de bereide oplossing 4 mg/5 ml óf 88 ml van de kant-en-klare infusievloeistof 4 mg/100 ml, aangevuld met 12 ml 0,9% NaCl- of 5% glucose-oplossing) als i.v.-infuus elke 3–4 weken |
3,3 mg (= 4,1 ml van de bereide oplossing 4 mg/5 ml óf 82 ml van de kant-en-klare infusievloeistof 4 mg/100 ml, aangevuld met 18 ml 0,9% NaCl- of 5% glucose-oplossing) |
3 mg (= 3,8 ml van de bereide oplossing 4 mg/5 ml óf 75 ml van de kant-en-klare infusievloeistof 4 mg/100 ml, aangevuld met 25 ml 0,9% NaCl- of 5% glucose-oplossing) 3 mg (= 3,8 ml van de bereide oplossing 4 mg/5 ml óf 75 ml van de kant-en-klare infusievloeistof 4 mg/100 ml, aangevuld met 25 ml 0,9% NaCl- of 5% glucose-oplossing) |
Gebruik niet aanbevolen, wegens onvoldoende gegevens
|
|
pamidroninezuur |
Infusiesnelheid maximaal 90 mg/4 uur = 20-22 mg/uur Bij verslechtering van de nierfunctie bij de behandeling van MM de toediening uitstellen totdat de nierfunctie is teruggekeerd tot 90% van de uitgangswaarde |
Niet gebruiken tenzij ernstige levensbedreigende hypercalciëmie |
|||
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur
Voor de meeste van de aanbevelingen voor ondersteunende therapie geldt dat er geen gerandomiseerde studies zijn en vaak berusten de aanbevelingen op consensus recommandaties die door de International Myeloma Working Group (IMWG) en de European Myeloma Network (EMN) zijn opgesteld. Deze internationale richtlijnen vormen de basis voor de aanbevelingen [1-6]. Daar waar specifieke studies toelichting behoeven, zijn deze hieronder beschreven.
Overwegingen met betrekking tot de literatuur
De werking van bisfosfonaten is gebaseerd op de inhibitie van geactiveerde osteoclasten.
Zowel van clodronaat, pamidronaat en zoledronaat is effectiviteit bewezen in de zin van reductie van skelet gerelateerde events en pijn.[6) De vergelijking tussen pamidronaat en zoledronaat toonde gelijke effectiviteit[5]. Een eventueel verschil in overleving was in de studies in de betreffende network meta-analyse geen eindpunt. De MRC IX studie toonde een superieure effectiviteit van zoledronaat, een progressievrij overlevingsvoordeel van 5.5 maanden en een overall survival voordeel van 2 maanden ten opzichte van clodronaat. Het is niet precies duidelijk wat de biologische verklaring is voor dit verschil in PFS en OS. De doodsoorzaken in de clodronaat arm waren met name met betrekking tot het optreden van infecties en nierfalen verschillend ten opzichte van de zoledronaat groep[7]. Een recente subanalyse leerde overigens dat het overlevingsvoordeel alleen aantoonbaar was in de patiënten met botziekte of skelet-gerelateerde complicaties [breuken, noodzaak tot operatie of bestraling, myelumcompressie of osteolytische bothaarden] en niet in de patiënten zonder botziekte [8].
De Nordic Myeloma Study Group (NMSG) onderzocht of 30 mg pamidronaat net zo effectief was als 90 mg pamidronaat. Er bleek geen verschil in gerapporteerde fysieke gezondheid en skelet-gerelateerde complicaties [9]. In 2017 werden de resultaten van een onderzoek gepubliceerd onder 1822 patiënten met maligne ziekten, waaronder 278 patiënten met MM, waarbij werd aangetoond dat het aantal skelet-gerelateerde events gelijk was onafhankelijk of zoledronaat eenmaal per 4 of 12 weken gedurende 2 jaar werd toegediend. De incidentie van bijwerkingen was identiek. Tevens vond een exploratieve analyse naar de bot turnover markers plaats. De bot turnover markers waren zelfs hoger bij patiënten die zoledronaat per 12 weken toegediend kregen [10].
In geval van toepassing van bisfosfonaten bij hypercalciëmie is er mogelijk een voordeel van zoledronaat boven pamidronaat, dit is echter bestudeerd bij hypercalciëmie bij verschillende maligniteiten waarbij slechts 8% van de onderzochte populatie een hematologische maligniteit had [11}.
Tijdens bisfosfonaat-therapie is extra voorzichtigheid geboden in geval van nierinsufficiëntie. Bij een klaring <30 ml/minuut dient geen zoledronaat te worden toegediend en bij voorkeur tevens geen pamidronaat. Indien toch pamidronaat gegeven moet worden in verband met hypercalciëmie, dan dient de dosis te worden gereduceerd (maximaal 30 mg in 4-6 uur toegediend) [12]. Echter in geval van hypercalciëmie en nierinsufficiëntie kan hypercalciëmie ook effectief bestreden worden met hyperhydratie, calcitonine, of denosumab. Denosumab is een RANK ligand inhibitor, die de vorming, werking en overleving van osteoclasten tegengaat. Het is geregistreerd voor de preventie van skelet gerelateerde morbiditeit. Het werd in de studies met multipel myeloom maandelijks toegediend in de dosering van 120mg sc en kan worden overwogen bij nierfunctiestoornissen [12-13].
Een internationale gerandomiseerde studie vergeleek maandelijks denosumab met maandelijks zoledronaat in MM, n=1718 patiënten [14]. Patiënten met ernstige nierfunctiestoornissen met een kreatinineklaring <30 ml/min waren niet geïncludeerd, vanwege de randomisatie 1:1 met zoledronaat. (NB in osteoporose studies is denosumab ook aan patiënten met een kreatinineklaring <30 ml/min toegediend [15-16]. Het betrof hier een non-inferiority design, met als primair eindpunt skelet gerelateerde events. Denosumab was niet-inferieur aan zoledronaat (HR=0.98; CI: 0.85-1.14, p = 0.01). Een ongeplande exploratieve analyse toonde een mogelijk PFS voordeel in de denosumab behandelde patiënten (HR=0.82; 95% CI: 0.68–0.99; P=0.036), geen OS voordeel. Bijwerkingenprofiel was vergelijkbaar behoudens voor nierfunctiestoornissen en hypocalciëmie: in patiënten met een kreatinineklaring <60ml/min, ontwikkelde 13% van de denosumab groep verslechtering nierfunctie versus 26% in de zoledronaatgroep (p<0.01). Daarentegen ontwikkelde 17% van de denosumab groep ernstige hypocalciëmie versus 12% in de zoledronaat groep (p=0.009) [15]. Het advies betreft dan ook op om bij starten denosumab, maar ook bij bisfosfonaten, calcium en vitamine D suppletie te starten, tenzij hypercalciëmie, en deze elektrolyten te controleren na opstarten [2]. De bisfosfonaat clodroninezuur is inferieur aan zoledroninezuur en pamidronaat t.a.v. voorkomen van skeletgerelateerde events en wordt niet standaard geadviseerd, maar kan bij nierfunctiestoornissen, als alternatief aan denosumab, overwogen worden, tot een klaring ≥ 12ml/min [2].
Bij toepassing van bisfosfonaten kan nefrotoxiciteit optreden, in verschillende cases-series en reviews wordt dit beschreven. Er lijkt vooral een associatie tussen pamidronaat en het optreden van focaal scleroserende glomerulosclerose (FSGS) en zolendonaat en acute tubulusnecrose (bij 8-10% van de patiënten), maar de incidenties zijn niet eenduidig [17].
Een ander aandachtspunt voor denosumab is het rebound fenomeen na staken van de denosumab: Al in de fase 2 studie bleek dat na het stoppen van behandeling met denosumab de botdichtheid in het eerste jaar weer snel afnam, tot een waarde van vóór de behandeling. Dit wordt toegeschreven aan het feit dat denosumab, anders dan bisfosfonaten, niet bindt aan het skelet waardoor na stoppen een versnelling van de botafbraak optreedt (“rebound effect”). Daarnaast zij er aanwijzingen dat dit rebound effect in het eerste jaar na stoppen gepaard kan gaan met multipele wervelfracturen. Alhoewel er onduidelijkheid is over de frequentie van optreden van ‘rebound’ wervelfracturen na het staken van denosumab, zijn er voldoende argumenten om deze behandeling niet zomaar te stoppen zonder een alternatieve behandeling te overwegen. Bij personen met een verhoogd fractuurrisico, gedefinieerd als T-score < -2.5, of < -2.0 met multipele eerdere wervelfracturen of andere belangrijke risicofactoren, valt het te overwegen om de behandeling met denosumab te continueren, de frequentie te verlengen naar 1x/6 maanden. Indien staken van denosumab, is het advies het effect te bestendigen met nog minimaal 1x een infuus met zoledroninezuur of met een oraal bisfosfonaat a 6 maanden [2, 18, 19].
Bij bisfosfonaten, en in mindere mate ook bij denosumab, is voorzichtigheid geboden bij tandheelkundige ingrepen in verband met verhoogde kans op osteonecrose van de kaak [5]. Daarom dient tandheelkundige sanering, zoals tand/kiesextractie, wortelkanaalbehandeling, het plaatsen van tandimplantaten of helen van trauma zoals drukplaatsen ontstaan bij een slecht zittende prothese, voor aanvang met bisfosfonaten plaats te vinden. Indien mogelijk wordt de bisfosfonaat-behandeling minimaal 3 maanden voor een invasieve tandheelkundige ingreep gestopt, en 3 maanden erna herstart [2].
Bij (biochemische) progressie of recidief van multipel myeloom wordt aanbevolen de behandeling met bisfosfonaten te hervatten in een frequentie van eenmaal per 3 maanden, met een maximale cumulatieve duur van 5 jaar bifosfonaat therapie [20].
Referenties
AANBEVELINGEN/CONCLUSIES
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur
Voor de aanbevelingen voor ondersteunende therapie geldt dat er geen gerandomiseerde studies zijn, op de aanbeveling voor kyfoplastiek na (zie onder). De aanbevelingen berusten voorts op consensus recommandaties die door de EHA, NCCN, International Myeloma Working Group en de European Myeloma Network in richtlijnen zijn samengevat. Deze internationale richtlijnen vormen de basis voor de aanbevelingen [1-4].
Daar waar specifieke studies zijn, zijn deze hieronder beschreven.
Overwegingen met betrekking tot de literatuur
De behandeling van het multipel myeloom is voornamelijk gebaseerd op systeemtherapie, radiotherapie heeft echter een belangrijke ondersteunende rol. Plasmacytomen zijn erg radiosensitief, en daarmee biedt radiotherapie vaak snelle en effectieve verlichting van klachten. Doordat systeemtherapie steeds effectiever is en er steeds meer middelen beschikbaar komen resulterend in een langere overleving, kan radiotherapie tevens een rol spelen in het kader van langdurige lokale controle van symptomatische laesies. Gezien het feit dat patiënten vaak meerdere lijnen systeem therapie nodig hebben, dient radiotherapie zoveel mogelijk beenmergsparend te zijn en op het juiste moment te worden ingezet.
Indicaties voor radiotherapie zijn:
Veel gebruikte fractionatie schema’s zijn:
Een hogere dosis/langer schema kan overwogen worden indien de wens bestaat tot langdurige lokale controle, bijvoorbeeld wanneer er sprake is van een plasmacytoom op een kritische plek of in patiënten met een beperkte ziekteload en een te verwachten langdurige overleving. Overweeg een conventioneel gefractioneerd schema in geval van re-irradiatie of een groot tumorvolume.
Gelijktijdig behandelen met systeemtherapie en radiotherapie kan mogelijk resulteren in radiosensitisatie met een toename in toxiciteit. De voordelen en risico’s hiervan dienen multidisciplinair tegen elkaar afgewogen te worden.
Solitair plasmacytoom
Ongeveer 5% van de plasmacytomen is solitair, zonder aanwijzingen voor een multipel myeloom. Solitaire plasmacytomen kunnen zowel uitgaan van het bot als zich extramedullair manifesteren. Plasmacytomen uitgaande van het bot hebben een hoge kans om te ontwikkelen naar een multipel myeloom, 65-84% na 10 jaar en bijna 100% na 15 jaar. Extramedullaire plasmacytomen ontwikkelen minder vaak naar een multipel myeloom (10-30%), maar hebben een iets hoger risico om lokaal te recidiveren. De standaardbehandeling van het solitaire plasmacytoom is in opzet curatieve radiotherapie. Radiotherapie resulteert in een lokale controle van 85-90%. In geval van een pathologische fractuur, dreigende instabiliteit of dreigende myelum compressie moet chirurgische stabilisatie of decompressie worden overwogen, gevolgd door radiotherapie [7].
De optimale dosis voor het solitair plasmacytoom is niet bekend. De NCCN guideline adviseert een dosis van 40-50 Gy in fracties van 1,8-2 Gy. De ILROG stelt dat voor botlaesies < 5cm 35-40 Gy acceptabel is, en adviseert 40-50 Gy voor laesies > 5cm en extramedullaire plasmacytomen [1].
Kyfoplastiek
Tot 80% van de patiënten met een multipel myeloom (MM) ontwikkelt wervelaantasting met kans op inzakkingen [2]. Deze vertebrale compressie fracturen (VCF’s) treden op bij ruim een kwart van de patiënten, wat tot veel pijn en daarnaast ook standsproblematiek van de wervelkolom kan leiden met een versterkte kyfose met impact op mobiliteit en kwaliteit van leven [8,9]. Kyfoplastiek wordt weinig toegepast bij multipel myeloom. Het valt te overwegen voor de behandeling van pijnlijke vertebrale compressiefracturen, onvoldoende reagerende op pijnstilling. Een grote fase III studie laat zien dat in deze specifieke groep multipel myeloom patiënten 80% van deze patiënten afname van pijn ervaart tgv kyfoplastiek [10]. Deze studie toonde klinisch belangrijke verbetering in lichamelijk functioneren, rugpijn, kwaliteit van leven, en ADL-zelfstandigheid t.o.v. controlegroep, deze voordelen bleven gedurende de gehele follow-up van de studie bestaan (12 maanden) [10]. De meest gebruikte vormen van kyfoplastiek zijn de zogenaamde percutane vertebroplastiek (PV) waarbij vloeibaar cement onder doorlichting wordt ingebracht en de ballon kyfoplastiek (BKP) waarbij een ballon wordt ingebracht en een holte creëert voor het inspuiten van cement [10, 11]. Een recente review van Onggo et al selecteerde 17 PV en 6 BKP studies en 3 vergelijkende studies. Hun conclusie was, ondanks dat er maar 1 gerandomiseerde studie was verricht, dat vertebrale augmentatie in de vorm van PV en BKP een veilige en effectieve procedure betreft met afname van pijn en een reductie van fractuur incidentie[12]. De IMWG heeft recent een richtlijn geschreven voor het gebruik van kyfoplastiek in MM waarin algoritmes zijn opgenomen voor de supportive care van patiënten met betrokkenheid van de wervelkolom bij (uitgebreide) osteolytische haarden met en zonder neurologische symptomen [13]. Op dit moment worden ballonplastiek en cement vertebroplastiek echter (nog) niet vergoed.
Orthopedische- en/of neurochirurgie:
Orthopedische chirurgie kan worden ingezet in de volgende situaties: ter preventie van pathologische fracturen indien er sprake is van een dreigende pathologische fractuur, ter fixatie van een pathologische fractuur in pijpbeenderen, ter stabilisatie van het axiale skelet in het geval van een instabiele axiale fractuur en in het geval van compressie op het myelum tgv botfragmenten [2,3].
LITERATUURVERANTWOORDING
Er is geen systematische literatuur-analyse verricht, maar gerichte analyse op basis van expertise van MWG en expert genoemd in de inleiding
REFERENTIES
Inleiding
Het risico op VTE (veneuze trombo-embolie) is verhoogd in alle patiënten met MM, en wordt hoger naarmate er meer patiënt- of therapie-gerelateerde risicofactoren zijn. Gebruik van immuunmodulerende middelen (thalidomide, lenalidomide; IMIDs) wordt gezien als de meest relevante risicofactor. Er is consensus dat patiënten met verhoogd risico een vorm van tromboseprofylaxe moeten krijgen, en ook dat patiënten met hoog risico tromboseprofylaxe middels antistolling moeten krijgen. De definitie van “hoog risico op trombose” is echter niet eenduidig. Hierbij speelt een rol dat de huidige behandelschema’s een minder hoog tromboserisico in zich dragen dan de schema’s in het verleden (met hoge doses dexamethason en anthracyclines).
HOOFDVRAGEN
3a Hoe wordt een risico-inschatting op trombose in MM-patiënten gemaakt?
3b Wanneer moet tromboseprofylaxe gegeven worden aan patiënten met multipel myeloom?
3c Welke tromboseprofylaxe wordt geadviseerd aan patiënten met multipel myeloom?
AANBEVELINGEN
CONCLUSIES
IMPEDE VTE score (naar: Sanfilippo et al. Am J Hematol. 2019;94(11):1176-1184)[8]
|
Voorspeller |
Acroniem |
Score |
|
Immunomodulatory drug (IMiD) |
I |
4 |
|
Body Mass index ³ 25 |
M |
1 |
|
Bekken (Pelvic), heup of femur fractuur |
P |
4 |
|
Erytropoëse stimulerend drug (EPO) |
E |
1 |
|
Doxorubicine |
|
3 |
|
Dexamethason (high dose, low dose) |
D |
|
|
HD³160mg per maand |
|
4 |
|
LD<160mg per maand |
|
2 |
|
Etniciteit = Aziatisch |
E |
-3 |
|
History of VTE |
V |
5 |
|
Tunneled line/central line |
T |
2 |
|
Existing tromboprofylaxis |
E |
|
|
Therapeutisch LMWH of VKA |
|
-4 |
|
Profylactic LMWH or aspirin |
|
-3 |
|
Laag risico scores ≤3;Intermediair risico scores of 4-7; Hoog risico scores ≥8 |
||
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur
Het risico op VTE in patiënten die in studieverband behandeld worden met lenalidomide wordt in een recente meta-analyse geschat op 6.2% [1]. Per 100 behandelcycli was het risico 0.2 bij combinatie van lenalidomide met lage dosis dexamethason, 0.0 in lenalidomide onderhoud en 1.3 in lenalidomide gecombineerd met lage dosis dexamethason plus een proteasoominhibitor. In observationele studies loopt het VTE-risico sterk uiteen, afhankelijk van patiëntpopulatie, myeloombehandeling en tromboseprofylaxe. Een aantal recente papers rapporteert een overall VTE-incidentie van resp. 5.3%, 7.3%, 4.8% en 10.6% in de eerste 6 maanden na diagnose van MM [2-5]. Kanttekening is dat de beschreven cohorten en studies niet recent zijn. In trials die daratumumab vergeleken met placebo (plus de standaardbehandeling in beide armen) was de VTE incidentie na 13-14 maanden 6.7% in patiënten die wel, en 8.2% in patiënten die geen daratumumab kregen [5]. In alle hier beschreven studies werd gebruikelijke tromboseprofylaxe toegepast. Twee grote studies rapporteerden het risico op VTE tijdens lenalidomide onderhoud, zij vonden 4.1 resp. 6% [6, 7] .
Recente, nog ongepubliceerde data uit het UMCG (Groningen) lieten zien, dat met de huidige behandelregimes en het huidige gebruik van tromboseprofylaxe, VTE optreedt bij 9,8% van patiënten in het eerste jaar na diagnose. Het grootste deel van deze tromboses traden op in de eerste 6 maanden.
Een recente review beschrijft drie risico scores voor VTE in MM: SAVED, IMPEDE VTE en PRISM [3]. Van de IMPEDE VTE score zijn meerdere externe validaties gedaan, die allemaal een goed onderscheidend vermogen laten zien (c-statistics tussen 0.64 en 0.68). Sanfilippo et al. voerden de ontwikkeling en validatie van de IMPEDE VTE score uit in 4446 patiënten die tussen 1999 en 2014 in VA databases (Veterans Administration Central Cancer Registry) werden opgenomen[8]. In dit cohort was het risico op VTE 3.3% (scores ≤3), vs. 8.3% (scores of 4-7), vs. 15.2% (scores ≥8) in laag resp. intermediair en hoog risico, zie tabel [5, 8]. In de vier studies die hierboven geciteerd worden over overall VTE risico, is het risico in laag vs. intermediate vs. hoog 1.1 vs. 5.7 vs. 11.8%, 5.9 vs. 9.4 vs. 16.7%, 2.9 vs. 4.7 vs. 33.3% en 5.0 vs. 12.6 vs. 24.1% [1]–[4]. Kanttekening is dat de score in de daratumumab studies wel goed onderscheid maakt in de niet-daratumumab armen, maar niet in de daratumumab armen (getallen niet gegeven)[9].
Er zijn nauwelijks gerandomiseerde studies uitgevoerd naar trombosepreventie in multipel myeloom. Een Cochrane review uit 2022 in patiënten die IMIDs gebruiken vat 4 beschikbare RCTs samen [10]. De ‘certainty’ van de vergelijkingen is steeds ‘low’ of ‘very low’. Drie studies vergelijken aspirine met LMWH. Twee daarvan vergelijken na 6 maanden: voor symptomatische DVT is voor aspirine het RR 1.23 (0.49-3.08) en voor longembolie 7.71 (0.97-61.44). Eén RCT vergelijkt na 2 jaar: symptomatische DVT 1.20 (0.53-2.72), longembolie 9.00 (0.49-166.17). Eén RCT vergeleek aspirine met DOAC, in deze studie traden geen symptomatische DVT of longembolie op.
Vijf niet-gerandomiseerde studies onderzoeken het effect van profylactische dosering Xa remmers. Storrar et al. beschrijven een retrospectief cohort van 70 patiënten op IMIDs die apixaban 2dd 2.5 mg kregen, zij zagen geen VTE gedurende 4-6 maanden follow-up [10]. Pegourie gaven apixaban 2dd 2.5 mg in een fase 2 ongecontroleerde studie in 104 patiënten op IMIDs, zij zagen twee VTEs (1.9%) [11]. Cornell gaven apixaban 2dd 2.5 mg in een fase 4 studie aan 50 patiënten op IMIDs, zij zagen geen VTE [12]. Piedra beschrijven een retrospectief cohort waarvan een deel van de patiënten rivaroxaban 1dd 10 mg kreeg. In deze 82 patiënten traden 4 VTEs op (4.8%) [13]. Sayar beschrijven een deels retro- en deels prospectief cohort, waarvan een deel apixaban 2dd 2.5 mg kreeg. In deze 82 patiënten trad geen VTE op [14].
Overwegingen met betrekking tot de literatuur
Ondanks het feit dat behandelaren zich bewust zijn van het risico op VTE bij MM, en ondanks volgen van de klassieke richtlijn van de International Myeloma Working Group sinds 2008 [15], is de incidentie van VTE in MM zowel in studies als in real life ongewenst hoog. De oplossing hiervoor wordt in de literatuur gezocht in een betere risicoclassificatie en dan laagdrempeliger gebruik van profylactisch LMWH in plaats van aspirine. Hiervoor is geen bewijs van hoge kwaliteit, wel volgen recente reviews en richtlijnen dit beleid [3, 16-18].
Er is geen benchmark bij welk absoluut risico vervolgens LMWH moet worden voorgeschreven in plaats van aspirine. Zo’n benchmark is er wel voor tromboseprofylaxe in de zwangerschap, waar ook sc LMWH wordt gegeven [19]. Daar wordt een afkapwaarde van een absolute risicoreductie van 3% aangehouden om gedurende 8-9 maanden LMWH te geven, waarbij uitgegaan wordt van 64% reductie van VTE risico met LMWH. Er vanuit gaande dat spuiten van LMWH in MM even effectief en even belastend is, zou een afkap van 4-5% VTE in de eerste 6 maanden na diagnose aangehouden kunnen worden om LMWH te adviseren. Dat komt overeen met een intermediair of hoog risico volgens de IMPEDE-VTE score (4 of meer punten). De richtlijnen die gebruik van de IMPEDE-VTE score adviseren, gebruiken ook deze afkap [16, 17]. LMWH wordt dus geadviseerd vanaf vier punten in de IMPEDE-VTE score (zie Figuur). Dit betekent dat vrijwel iedere patiënt die lenalidomide gebruikt, en niet om een andere reden al antistolling of een trombocytenaggregatieremmer (TAR) gebruikt, LMWH zou moet krijgen. Pre-existent gebruik van een TAR impliceert dat er een arteriële voorgeschiedenis is, en de TAR dus niet zonder risico’s gestopt kan worden. Dan geeft LMWH erbij additioneel bloedingsrisico, om die reden is het advies dan om door te gaan met alleen TAR. Bij veel bijkomende VTE- risicofactoren wordt de balans weer anders, en moet combinatie TAR+/profylactisch LMHW wel overwogen worden (rekenvoorbeeld: een MM patiënt die lenalidomide krijgt, met aspirine vanwege een voorgeschiedenis van coronairlijden zonder andere risicofactoren komt op +4 – 3 punten, dus 1 punt, dus door met alleen aspirine. Als diezelfde patiënt een eerdere DVT heeft gehad, komt die op +4 -3 +5, dus 6 punten, en wordt er dus LMWH geadviseerd bovenop de aspirine).
Omdat het risico over VTE af lijkt te nemen na 6 maanden, en wegende de belasting van gebruik van LMWH, lijkt het redelijk om op dat moment profylactische LWHM te vervangen door aspirine.
Het risico op VTE en de voors en tegens van LMWH moeten met de patiënt worden besproken: er is individueel verschil in de mate waarin patiënten risico’s en belasting wegen. Als spuiten van LMWH door de patiënt te belastend wordt gevonden, moet aspirine geadviseerd worden.
Alternatieve vormen van tromboseprofylaxe zijn vitamine K-antagonisten (VKA) en profylactische doseringen van Xa remmers. Profylactisch gebruik van VKA hebben we in deze richtlijn niet meegenomen omdat dat niet past binnen de Nederlandse gewoonten. Voor Xa remmers zijn beperkte data in MM beschikbaar, maar ze zijn een aantrekkelijk oraal alternatief voor LMWH als tromboseprofylaxe. In andere vormen van maligniteit zijn ze effectief gebleken [18]. De beperkte studies die tot nu toe beschikbaar zijn laten goede effectiviteit zien, zie boven. Pogingen om RCT’s te doen naar de veiligheid en effectiviteit van apixaban of rivaroxaban in MM zijn zowel in Nederland als elders mislukt [20]. Het lijkt dus onwaarschijnlijk dat er formeel bewijs komt. In de profylactische setting is het voor ons acceptabel om Xa remming in profylactische dosering (apixaban 2 dd 2,5 mg of rivaroxaban 1 dd 10 mg) voor te schrijven als alternatief voor LMWH. Wij pleiten er wel voor om in Nederland het effect van Xa remmers in nieuw-gediagnosticeerd MM systematisch te monitoren, door gebruik te maken van routinematig verzamelde klinische data.
Voor de behandeling van VTE bij MM wordt verwezen naar de richtlijn Antitrombotisch Beleid [19]. Er zijn geen gepubliceerde data die richting geven aan de duur van antistolling. Die wordt gebaseerd op het risico op recidief VTE (naast natuurlijk het bloedingsrisico). Daarbij moet overwogen worden dat patiënten zonder maligniteit met een niet-uitgelokte VTE tegenwoordig langdurige antistolling krijgen. We schatten in dat het risico op recidief VTE bij patiënten met MM niet láger is dan bij niet-uitgelokte VTE, in de context dat MM niet curatief behandeld wordt.
LITERATUURVERANTWOORDING:
Er werd een Pubmed search verricht, in eerste instantie gericht op recente guidelines en reviews. Hierbij werden goede en recente overzichtsartikelen geïdentificeerd. Relevante papers uit literatuurlijsten werden beoordeeld. Aanvullend werden searches gedaan gericht op recent origineel onderzoek naar DOACs en naar risicoscores. Er worden geen evidence tabellen gegeven omdat er geen systematische review is verricht. Daar waar specifieke studies zijn, zijn deze hieronder beschreven.
REFERENTIES:
Inleiding
Bacteriële infecties treden frequent op bij MM-patiënten, waarbij een verhoogde mortaliteit is waargenomen. Vooral in de eerste drie tot 12 maanden na diagnose is er een verhoogd infectierisico aanwezig, Bacteriële en virale infecties zijn in ruim 20% de oorzaak van overlijden bij MM-patiënten.
Primaire- en secundaire medicamenteuze infectiepreventie, vaccinatie en toediening van intraveneuze immunoglobulines worden in onderstaande toegelicht. Vaccinatie-advies voor patiënten met multipel myeloom wordt geadviseerd volgens de Nederlandse richtlijn ‘vaccinatie bij afweerstoornissen, RIVM-handleiding; vaccinatie bij hematologische aandoeningen’. (https://lci.rivm.nl/richtlijnen/vaccinatie-bij-hematologische-aandoeningen).
HOOFDVRAGEN
4a: Is er een indicatie voor infectie profylaxe bij patiënten die een behandeling krijgen voor MM?
4b: Is er een indicatie voor hervaccinatie of actieve immunisatie van patiënten met MM?
4c: Is er een indicatie voor immuunglobuline substitutie therapie (IVIG)?
AANBEVELINGEN/CONCLUSIES
a.Profylaxe
b. Vaccinaties
c. Intraveneuze Immunoglobulinen (IVIG) bij recidiverende infecties
ONDERBOUWING-LITERATUUROVERZICHT
Samenvatting literatuur
De aanbevelingen in de samenvatting berusten grotendeels op expert opinions volgens de internationaal geldende IMWG- en EMN-richtlijnen[1-3], en zijn in lijn met de Nederlandse richtlijn ‘vaccinatie bij afweerstoornissen, RIVM handleiding; vaccinatie bij hematologische aandoeningen’.
Daar waar specifieke studies zijn, zijn deze hieronder beschreven.
Overwegingen met betrekking tot de literatuur
Multipel myeloom (MM) en infectierisico
Bacteriële infecties treden frequent op bij MM-patiënten, waarbij een verhoogde mortaliteit is waargenomen. Vooral in de eerste drie tot 12 maanden na diagnose is er een verhoogd infectierisico aanwezig, bijv. ten gevolge van Streptococcus pneumoniae [4-7]. Bacteriële en virale infecties zijn in ruim 20% de oorzaak van overlijden bij MM patiënten [8]. Vaccinatie ter preventie van deze infecties is aan te bevelen, maar de effectiviteit van de vaccins zal verminderd zijn door de immuunstoornis bij MM patiënten en door (chemo)therapie [9].
Bij multipel myeloom is de hoogste incidentie van invasieve pneumokokkenziekte (IPD) bij hematologische aandoeningen gemeld: tot honderd keer verhoogd ten opzichte van de algemene bevolking in Scandinavië voordat daar begonnen werd met kindervaccinatie-programma’s tegen pneumokokkeninfecties [10, 11]. In Nederlands onderzoek naar risico op IPD werden patiënten met MM onder de hoog-risicogroep gerekend [12]. In deze groep was bij patiënten beneden de 65 jaar het risico op IPD 18 keer verhoogd ten opzichte van de normaal-risico populatie en 5 keer verhoogd in bij personen van 65 jaar of ouder.
Epidemiologische data over het risico op infectie met Pneumocystis jirovecii (PJP) in patiënten met multipel myeloom zijn niet eenduidig; er zijn rapportages over het optreden van PJP tijdens behandeling met bortezomib, echter de voornaamste risico factor is het gebruik van langdurig hoge doseringen dexamethason in therapieschema’s [13]. Algemene adviezen over gebruik van PJP profylaxe zijn gebaseerd op het corticosteroïdgebruik en in de literatuur vooral op “expert opinion” gestoeld. Cotrimoxazol 1 dd. 480 mg is (volgens de SWAB richtlijn, beschreven onder “profylaxe voor de immuungecompromitteerde gastheer”) het middel van eerste keuze, alternatieven: dapson 1dd 50 mg po + pyrimethamine 1x per wk 50 mg + folinezuur 1 x per wk 25 mg; pentamidine aërosol 1 x per mnd 300 mg; atovaquon 1 dd 1500 mg po; dapson 1 dd 100 mg po; dapson 1 x per wk 200 mg po + pyrimethamine 1 x per wk 75 mg + folinezuur 1 x per wk 25 mg [14].
Ook virale luchtweginfecties, waaronder influenza, komen vaker voor bij MM patiënten [15]. Tevens is er een verhoogd risico op Herpes Zoster wat door behandeling, zoals bortezomib en daratumumab, nog meer verhoogd wordt [16].
Herpes zoster-profylaxe is noodzakelijk tijdens inductietherapie met bortezomib, bestaande uit valaciclovir tweemaal daags 500 mg, tot 3 weken na het staken van bortezomib gezien het verhoogd voorkomen tot 10-15% [16]. Ook daratumumab geeft in de studies een verhoogde kans (2-5%) op herpes zoster. Valaciclovir profylaxe wordt geadviseerd [17, 18]
Het toevoegen van levofloxacine 500mg 1x daags profylactisch gedurende de eerste 12 weken na diagnose multipel myeloom reduceerde het aantal gramnegatieve infecties significant (HR 1.52, p=0.002) in de TEAMM studie [19]. Het aantal febriele episoden en overlijden werd significant verlaagd met het gebruik van profylactisch levofloxacine 500mg 1x daags gedurende de 1e 12 weken na diagnose (HR 1.47, p=0.009). De combinatie van cotrimoxazol profylaxe gecombineerd met levofloxacine gedurende 12 weken na diagnose myeloom liet een verdere verbetering van de overleving zien (HR 1.75, p=0.0008), dit is een additief effect. Deze studie toonde t.o.v. placebo geen verhoging van het aantal clostridiuminfecties, of dragerschap van resistente bacteriën [19].
Invasieve schimmel- en gistinfecties komen bij multipel myeloom patiënten niet frequent voor, geschat <0,5%-0,8% en na autologe SCT tot 2,5% [20,21]. Er wordt geen fluconazol of andere antifungale middelen standaard na autologe SCT geadviseerd [22]. Verschillende internationale richtlijnen adviseren wel profylaxe met fluconazol bij neutropenie na autologe SCT wanneer sprake is van mucositis [22]. Er is geen goed bewijs in welke fase van behandeling antifungale profylaxe zinvol is, maar het lijkt van belang patiënt-factoren in de overweging mee te nemen [23]. Bij recidiverende orofaryngeale candidiasis bij steroïden kan onderhoudsbehandeling met fluconazol 200mg 1x per week overwogen worden (volgens SWAB richtlijn: https://www.swab.nl/richtlijnen).
Hepatitis B screening, profylaxe en behandeling wordt geadviseerd volgens de hepatitis B richtlijn (https://www.hbvrichtsnoer.nl/immuunsuppressie-chemotherapie/).
Beperkte effectiviteitsdata vaccinaties
Onderzoek naar de klinische effectiviteit van vaccinatie, zoals tegen pneumokokken-, influenza- en Haemophilus influenzae b infectie bij patiënten met hematologische aandoeningen is beperkt vanwege de grote aantallen hematologische patiënten die nodig zijn om effect van vaccinatie bij zeldzame infecties te kunnen aantonen. Voor influenzavaccinatie is gerandomiseerd aangetoond dat het luchtweginfecties en ziekenhuisopnames vermindert bij volwassenen met multipel myeloom en bij kinderen met lymfoom of leukemie [24]. Gezien de bestaande internationale aanbevelingen voor vaccinatie tegen influenza- en pneumokokkeninfectie bij hematologische aandoeningen zullen er geen gerandomiseerde onderzoeken versus placebo gaan plaatsvinden, omdat dat niet ethisch wordt geacht. Wel zijn gegevens bekend bij meerdere hematologische aandoeningen over secundaire uitkomsten na vaccinatie, zoals de antistoftiters na vaccinatie. Meestal zijn die antistoftiters verlaagd ten opzichte van gezonde controles, waardoor de beschermingsgraad en/of de duur van bescherming door de vaccinatie verminderd kunnen zijn. Echter, zelfs een beperkte afname van de hoge infectie- en complicatierisico’s of van de kans op het voorkómen van onderbreking van de behandeling van de hematologische aandoening is al wenselijk. Dit, tezamen met het ontbreken van een veiligheidsrisico van het vaccin wordt vaccinatie met het influenza-, en pneumokokkenvaccin standaard aanbevolen.
NB Onderhoudstherapie met lenalidomide lijkt de vaccinatierespons niet extra negatief te beïnvloeden [25]. Ook behandeling met daratumumab lijkt de vaccinatierespons met pneumococcenvaccin niet negatief te beïnvloeden [26].
Influenzavaccinatie
Patiënten met MM komen in aanmerking voor jaarlijkse influenzavaccinatie vanwege leeftijd (indien > 60 jaar is dit een landelijk RIVM-advies), maar ook al beneden 60 jaar vanwege het verhoogde infectierisico bij deze patiëntengroep. Het bewijs voor het effect van influenzavaccinatie op reductie van ziekte en complicaties (zie meta-analyse) [24]. Serologisch onderzoek na influenzavaccinatie toont lagere antistoftiters bij patiënten dan bij gezonde controles [27-33].
Pneumokokkenvaccinatie
Het Gezondheidsraadadvies om iedereen van 60 jaar en ouder te vaccineren tegen pneumokokken geldt ook voor MM patiënten, waarbij bij MM patiënten echter de aanbeveling is om te vaccineren met PCV13 gevolgd na minimaal 2 maanden door PPV23 [34]. Ook bij MM-patiënten beneden 60 jaar wordt pneumokokkenvaccinatie met deze twee vaccins in de volgorde PCV13-PPV23 aanbevolen.
Het polysacharidevaccin PPV23 stimuleert B-cellen direct zonder T-cel hulp, maar daardoor ontstaat er geen immunologisch geheugen (B-memory cellen). Er is daarom geen boostereffect van PPSV23 mogelijk: er ontstaan na PPV23-toediening tijdelijk antistoftiters die na enkele jaren weer wegzakken, waarna er geen bescherming meer overblijft. Boosteren met PPV23 is bovendien gecompliceerd: bij korte intervallen tussen twee PPV23 doses of tussen een dosis PCV13 en PPV23 is er sprake van hyporesponsitiviteit: een afgenomen of afwezige respons op een (vaccin)antigeen als gevolg van eerdere expositie. Boosteren met conjugaatvaccins (PCV10, PCV13, PCV15, of PCV20 bijv.) is wel mogelijk en effectief, gezien dit zowel B- als T-cellen stimuleert en geheugencellen worden geactiveerd. PCV10 is een standaard onderdeel van het Rijks Vaccinatie Programma. Nu echter in vaccinatieprogramma’s grootschalig kinderen met PCV10 (of PCV13 voor medische risicogroepen) worden gevaccineerd, circuleren PCV10 en PCV13 vaccinserotypen steeds minder in de bevolking. Daarentegen neemt het aandeel van de 10 extra serotypen van PPV23 toe (zogeheten ‘serotype replacement’)[surveillance data RIVM sentinel labs 2004-2016]. Dat het noodzakelijk is in Nederland om ook PPV23 toe te dienen, blijkt uit serotypering van pneumokokkenisolaten die IPD veroorzaakten: 30% van deze isolaten bij kankerpatiënten waren serotypen die in PCV13 voorkomen, terwijl 74% van alle IPD-cases door serotypen in PPV23 werden veroorzaakt [34]. Er is dus reden om altijd na vaccinatie met PCV13 (of PCV15) tevens te vaccineren met PPV23. Geadviseerd wordt om minimaal 2 maanden te hanteren als interval tussen het conjugaat- en het polysacharidevaccin. Andersom (éérst PPV23 en dan PCV13) wordt een interval van minimaal 1 jaar tussen beide vaccins gehanteerd, omdat alleen dan voldoende antistoftiters worden bereikt, bleek uit vergelijkend onderzoek [35]. Bij patiënten in aanmerking komende voor HDM en autologe SCT geldt dat dit een korter interval is dan 1 jaar indien bij diagnose direct wordt gevaccineerd, en na HDM en autologe SCT wordt gehervaccineerd; hiermee betreft het advies voor patiënten in aanmerking komend voor HDM en auSCT: PCV13 (of PCV20) vóór auto-SCT en het volledige schema: PCV13 (Prevenar®) gevolgd door PPV23 (Pneumovax®), volgens het revaccinatieschema na auto-SCT (SORT B). Beide vaccins (PCV13 en PPV23) worden vergoed voor risicogroepen. Eigenlijk is dit een tijdelijke strategie tot de meervalente conjugaatvaccins (PCV20 en de nog niet-geregistreerde vaccins PCV21 en PCV24) beschikbaar en vergoed zijn. Dan zijn de meeste circulerende pneumokokkenserotypen gedekt met een eenmalig toe te dienen conjugaatvaccin (en eventueel te boosteren zn. bij immuungecompromitteerden).
Een verminderde mate van bescherming door het vaccin ten gevolge van de ziekte is aannemelijk, maar gezien het nog resterende beschermende effect, de sterk verhoogde gevoeligheid voor pneumokokkeninfecties en het ontbreken van een veiligheidsrisico van het vaccin wordt pneumococcenvaccinatie standaard aangeraden.
Gezien de periode waarin pneumokokkeninfecties het meest frequent voorkomen (in de eerste maanden na diagnose) is het te adviseren gelijk na vaststellen van diagnose te vaccineren tegen pneumokokkeninfecties, bij voorkeur minimaal 2 weken vóór start van chemotherapie [36].
Bepaling van anti-pneumokokken antistoftiters na vaccinatie kan verricht worden uit studieoogpunt, maar heeft geen consequenties omdat het verhogen van de titer door herhaaldelijk vaccineren niet onderzocht is.
Herpes zoster (HZ) vaccinatie met shingrix
Vaccinatie reduceert het risico op HZ additioneel aan de reductie die antivirale profylaxe al geeft. Met alleen antivirale profylaxe was het risico op HZ in de placebogroep: 52/1000 persoonsjaren. Het risico bij gevaccineerden zonder antivirale profylaxe was 32/1000 persoonsjaren. In deze studie werd in de meerderheid van de patiënten antivirale profylaxe minimaal 1 maand na de tweede vaccindosis gestaakt [36,37]. Er blijft echter ondanks vaccinatie een residueel risico op HZ na het staken van antivirale profylaxe, omdat de vaccineffectiviteit niet 100% is. Het is dus belangrijk alert te blijven op symptomen van herpes zoster, ook na vaccinatie. Een ander belangrijk effect van HZ vaccinatie is dat de combinatie antivirale profylaxe en vaccinatie significant minder kans op postherpetisch pijn na HZ gaf t.o.v. antivirale profylaxe alleen [37,38].
In de studies is de effectiviteit en humorale immunogeniciteit bij hematologische patiënten (mn MM en (non) Hodgkin lymfoom patiënten), alsmede na autologe SCT i.v.m. MM en B-cel NHL verlaagd t.o.v. immuuncompetente ouderen, maar blijken wel voldoende voor (partiële) protectie tegen HZ na het staken van antivirale profylaxe. Een effectiviteit van 68-87% kan worden bereikt. De bijdrage van de cellulaire immuniteit, die door dit geadjuveerde vaccin wordt gestimuleerd, lijkt hiervoor medeverantwoordelijk. Hoewel de incidentie van HZ significant verlaagd wordt tgv vaccinatie in hematologische MM patiënten, ligt de incidentie van HZ in de vaccingroep (32/1000 persoonsjaren) echter dus nog altijd hoger dan die gemeten was in een eerder onderzoek in een oudere populatie >70 jaar zonder hematologische aandoeningen (namelijk ca. 0.9/1000 in de vaccingroep) [37-39].
Het Europees Myeloom Netwerk beveelt “proactief gebruik” van Shingrix aan, vooral bij gebruik van proteasoominhibitors (o.a. bortezomib) en anti-CD38 antilichamen en na HDM en autologe SCT[17, 18].
Praktische aspecten:
Overige geïnactiveerde vaccins
Een afgenomen vaccinatierespons tegen andere geïnactiveerde vaccins is aannemelijk, maar niet onderzocht bij MM. Daarom moet bij een verwonding met tetanusrisico altijd tetanusimmuunglobulines (TIG) worden toegevoegd aan het herhalen van de tetanusvaccinatie (conform de LCI-richtlijn tetanus).
Levende verzwakte vaccins
Levend verzwakte vaccins, zoals het huidige vaccin tegen Herpes Zoster (Zostavax), zijn gecontra-indiceerd bij MM, op basis van het potentiële veiligheidsrisico van infectie met het vaccinvirus.
Vaccinatieschema na HDM en autologe SCT:
SCHEMATISCHE WEERGAVE VACCINATIEADVIES
|
Aantal maanden na SCT |
3 |
4 |
5 |
12 |
2j |
5j |
|
Vaccinaties |
|
|
|
|
|
|
|
Prevenar-13® (13-valent geconjugeerd pneumokokkenvaccin) |
X |
X |
X |
|||
|
Pneumovax-23® (23-valent pneumokokken polysaccharidevaccin) |
X |
X |
||||
|
Shingrix® (Varicella zoster) |
X1 |
X |
||||
|
Influenza |
X2 |
|||||
|
M-M-RVAXPRO® (Bof, Mazelen, Rode hond) |
|
|
|
|
X3 |
|
|
Ad.1Antivirale profylaxe moet worden gecontinueerd in elk geval tot 1 maand na de tweede dosis Ad.2 Afhankelijk van seizoen eventueel eerder en aan alle patiënten aan te bieden ongeacht termijn na transplantatie, jaarlijks herhalen. Ad.3 Alleen bij negatieve mazelen IgG. Eerder op indicatie, bijvoorbeeld bij een uitbraak |
||||||
Deze tabel is afkomstig uit LCI-richtlijn vaccineren in hematologische aandoeningen (https://lci.rivm.nl/richtlijnen/vaccinatie-bij-hematologische-aandoeningen).
COVID-19 vaccinatie
COVID-19 vaccinaties in MM worden geadviseerd volgens de LCI richtlijn covid-19 vaccinaties in immungecompromitteerde patiënten (COVID-19-vaccinatie van immuungecompromitteerde patiënten | LCI richtlijnen (rivm.nl)) en de communicatie via de NVVH, gezien dit vooralsnog een bewegend veld is.
IVIG
Er is slechts 1 studie verricht naar de waarde van IVIG in MM-patiënten en deze is van oudere datum en dus niet verricht ten tijde van de nieuwe middelen. In deze studie verminderde IVIG de frequentie en ernst van bacteriële infecties significant, met name in de groep patiënten met matige immuunrespons op pneumococcenvaccinatie. Er was geen overlevingsvoordeel [41].
Een review over toepassing van IVIG bij patiënten met secundaire immuundeficiënties waaronder plasmaceldyscrasie, toonde geen overlevingsvoordeel maar wel een aanzienlijke daling van het aantal ernstige infecties bij patiënten [42]. De MWG adviseert intraveneuze immuunglobuline suppletie te overwegen bij patiënten met recidiverende bacteriële infecties en bij patiënten met slechte respons op antibiotica bij recidiverende luchtweginfecties [43, 44]. De geadviseerde dosering is 200–400 mg/kg lichaamsgewicht elke 3–4 weken om een IgG dalspiegel te bereiken van ten minste 6 g/l. Verhoog eventueel de dosering bij aanhoudende infectie [45].
Referenties
AANBEVELINGEN
Anemie
Neutropenie
G-CSF kan ter ondersteuning worden gestart bij patiënten met lenalidomide of pomalidomide-geïnduceerde neutropenie CTC graad 4 (ANC<0.5 x10e9/L) of indien CTC graad 2-3 (neutrofielen 0.5-1.0 x10e9/L), gecompliceerd door koorts en/of infectie (SORT C).
Diarree bij lenalidomide gebruik
Bij lenalidomide-geïnduceerde diarree, die veroorzaakt kan zijn door galzuurmalabsorptie, adviseert de MWG vermindering van de intake van vet (tot 20% van de totale calorie-intake) en het starten van een galzuurbindend hars, zoals colestyramine (Questran©), maximaal 6 maal daags 4 g (= 1 sachet) >4 uur voor en na lenalidomide-inname. De dosering individualiseren op geleide van het effect; verlagen bij obstipatie en bij persisterende diarree, de dosering eventueel ophogen naar maximaal 24 g (= 6 sachets) per dag (SORT C). Alternatief voor colestyramine is colesevelam (Cholestagel©) tot maximaal 6 maal daags 625 mg >4 uur voor en na lenalidomide-inname, ingenomen samen met voeding.
REFERENTIES
De hieronder gegeven schema’s zijn gebaseerd op doseringen toegepast in de gerandomiseerde fase II en III studies/registratiestudies- en teksten zoals aan gerefereerd wordt in Modules 1-3. De schema’s die (experimenteel) alleen nog in trial worden toegepast worden niet weergegeven, er wordt verwezen naar desbetreffende trial.
Doseringen moeten meestal aangepast worden bij het optreden van hematologische of non-hematologische toxiciteit of comorbiditeit, waarvoor verwezen wordt naar huidige en voorgaande HOVON-protocollen en SMPC-teksten. Doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit bij kuurschema’s “tot progressie” in de loop van de behandeling moeten worden verminderd. Er is een praktische leidraad toegevoegd voor dosisaanpassingen bij de oudere patiënt met comorbiditeit, zie ‘Therapieschema’s’. Tevens worden separaat aanbevelingen gegeven voor verminderde renale klaring (lenalidomide) en voor polyneuropathie (bortezomib en thalidomide), alsmede dose-level reductiestappen voor carfilzomib en ixazomib.
Verder geldt voor het aantal cycli dat met name in de recidief setting de optimale duur van therapie niet altijd is vastgesteld. Dan is het advies gegeven zoals in de gerandomiseerde fase III studies is gebruikt.
In het algemeen geldt dat na 3 kuren een responsevaluatie moet worden gedaan om te beoordelen of continuering van de therapie zinvol is.
Voor algemene supportive care zie ‘Module 4’.
Specifieke maatregelen bij de therapieschema’s:
* Bij gebruik van daratumumab subcutaan zijn specifieke voorzorgsmaatregelen ter preventie van injectie- gerelateerde reacties noodzakelijk. Als orale premedicatie 1-3 uur voorafgaande aan daratumumab sc.:
Na de eerste injectie kan bij het ontbreken van injectie gerelateerde reacties de dosis van het corticosteroïd eventueel worden verlaagd. De dag na de daratumumab injectie kan toediening van 4 mg dexamethason (of 20 mg prednisolon) worden overwogen.
Voor patiënten met een voorgeschiedenis van chronische obstructieve longziekte kan worden overwogen om na de infusie geneesmiddelen zoals kort- en langwerkende bronchodilatatoren en inhalatiecorticosteroïden en montelukast po te gebruiken. Na de eerste vier infusies kan de arts besluiten het gebruik van deze inhalatiegeneesmiddelen te stoppen indien de patiënt geen ernstige IRR’s krijgt. Eventueel voor start chronische inhalatietherapie iom een behandelend longarts optimaliseren.
* Bij gebruik van isatuximab zijn specifieke voorzorgsmaatregelen ter preventie van infusie-gerelateerde reacties noodzakelijk. Als premedicatie 15-60 min voor Isatuximab infusie:
Indien de eerste 4 infusies géén infusiereactie is opgetreden mag de premedicatie worden gestaakt.
1-I INDUCTIE
|
Dara-VRD; Daratumumab – Bortezomib – Lenalidomide – Dexamethason (cyclusduur 28 dagen, totaal 6 kuren: 4 inductiekuren + 2 consolidatiekuren na autologe SCT) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Cyclus 1 -2; dag 1,8,15,22 Cyclus 3-6; dag 1,15 |
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 Alternatief: Dag 1,8,15,22 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1 t/m 21 (dosering aanpassen aan nierfunctie) |
|
Dexamethason |
20 mg |
p.o. |
Cyclus 1-2: Dag 1,2,8,9,15,16,22,23 Cyclus 3-6: Dag 1,8,15,22 |
|
Dara-VTD; Daratumumab- Bortezomib – Thalidomide – Dexamethason (cyclusduur 28 dagen, totaal 4 kuren + 2 consolidatiekuren na autologe SCT) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Cyclus 1 tm 2; dag 1,8,15,22 Cyclus 3 en 4; dag 1,15 |
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 |
|
Thalidomide |
100 mg |
p.o. |
Dag 1 t/m 21 of dag 1 t/m 28* |
|
Dexamethason |
40 mg# |
p.o |
Dag 1,2,8,9,15,16,22,23 |
|
* afhankelijk van het feit of de kuur 1 maal per 3 of 4 weken wordt gegeven # alternatief dosering dexamethason 20 mg |
|||
|
VCD; Bortezomib – Cyclofosfamide – Dexamethason (cyclusduur 28 dagen, totaal 4 kuren) |
|||
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 |
|
Cyclofosfamide |
500 mg/m2 * |
i.v |
Dag 1,8 |
|
Dexamethason |
40 mg# |
p.o |
Dag 1,2,4,5,8,9,11,12 |
|
* bij GFR 15-30 ml/minuut eerste cyclus 400 mg/m2; indien tijdens deze cyclus neutrofielen >1×109/l volgende cyclus 500 mg/m2 # alternatief dosering dexamethason 20 mg |
|||
1-II STAMCELMOBILISATIE
|
Cyclofosfamide 2000 mg/m2 gevolgd door stamcelmobilisatie |
|||
|
Cyclofosfamide |
2000 mg/m2 |
i.v. |
Dag 1 |
|
Mesna (uromitexan) |
3 dd 20 mg/kg* |
i.v. |
Dag 1 |
|
Mesna (uromitexan) |
1 dd 20mg/kg alternatief 1 dd 40 mg/kg |
i.v. p.o. |
Dag 2 |
|
G-CSF |
2 dd 5 µg/kg# |
s.c. |
Dag 5 t/m dag van laatste ferese |
|
* Toediening Mesna (mercapto-ethaansulfonzuur) en hydratieschema volgens lokaal ziekenhuis protocol (voorbeeld: start met Mesna in 30 minuten, vervolgens Cyclofosfamide in 1 uur, nadien het volgende schema; 500 ml NaCl 0,9% in 2 uur, Mesna in 30 min, 500ml NaCl 0,9% in 2 uur, Mesna in 30 minuten; dag 2 Mesna oraal eenmalig in de ochtend.) # G-CSF toediening volgens het lokale ziekenhuisprotocol waar stamceloogsting plaatsvindt. |
|||
1-III HOGE DOSIS MELFALAN VOOR STAMCELREINFUSIE
|
HDM Hoge dosis Melfalan |
|||
|
Melfalan |
200 mg/m2 |
i.v. |
Dag 1 |
|
bij eGFR < 40 ml/min 140 mg/m2 op dag 1, voor hydratieschema wordt verwezen naar lokale protocollen de dosering melfalan kan ook over 2 dagen verdeeld worden, dus 100 mg/m2 per dag gedurende 2 dagen |
|||
1-IV CONSOLIDATIETHERAPIE NA AUTOLOGE STAMCELTRANSPLANTATIE
|
Dara-VRD Daratumumab – Bortezomib – Lenalidomide – Dexamethason (cyclusduur 28 dagen, totaal 2 consolidatiekuren na autologe SCT; aanvangen 30-60 dagen post-autologe SCT) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Dag 1,15 |
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 Alternatief: Dag 1,8,15,22 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1 t/m 21 |
|
Dexamethason |
20 mg |
p.o. |
Dag 1,8,15,22 |
1-V ONDERHOUDSTHERAPIE NA AUTOLOGE STAMCELTRANSPLANTATIE/NA CONSOLIDATIETHERAPIE
|
Onderhoudstherapie Lenalidomide (na auSCT) (cyclusduur 28 dagen, starten bij (hematologisch) herstel (direct) na consolidatie of na autologe SCT) |
|||
|
Lenalidomide |
10 mg* |
p.o. |
Dag 1 t/m 21 of dag 1 t/m 28 |
|
*Volgens registratie: na 3 cycli dosis verhogen naar 1×/dag 15 mg indien goed verdragen. Behandeling niet starten als ANC ≤ 1,0 × 10 9/l en/of het aantal trombocyten < 75 × 10 9/l. |
|||
|
Dara-RD; Daratumumab-Lenalidomide-Dexamethason (cyclusduur 28 dagen, tot ziekte progressie) LET OP: FABULOUS STUDIE |
|||
|
Daratumumab |
1800 mg |
s.c. |
Cyclus 1 en 2; dag 1,8,15,22 Cyclus 3 t/m 6: dag 1, 15 Cyclus 7 ev: dag 1 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
Dara-MPV; Melfalan – Prednison – Bortezomib (cyclusduur 42 dagen, 9 cycli gevolgd door daratumumab monotherapie) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Cyclus 1: dag 1,8,15,22,29,36 Cyclus 2-9: dag 1,22 |
|
Melfalan |
9 mg/m2 |
p.o. |
Dag 1 t/m 4 |
|
Prednison |
60 mg/m2 |
p.o. |
Dag 1 t/m 4 |
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Cyclus 1: dag 1,4,8,11,22,25,29,32 Cyclus 2-9: dag 1,8,22,29 |
|
Gevolgd na 9 cycli door monotherapie daratumumab (cyclusduur 28 dagen) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Dag 1 |
|
Rd; Lenalidomide – Dexamethason (cyclusduur 28 dagen, gedurende 18 mnd of tot progressie) |
|||
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
MPV; Melfalan – Prednison – Bortezomib (cyclusduur 42 dagen, 9 cycli, volgens ALcyone studie) |
|||
|
Melfalan |
9 mg/m2 |
p.o. |
Dag 1 t/m 4 |
|
Prednison |
60 mg/m2 |
p.o. |
Dag 1 t/m 4 |
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Cyclus 1: dag 1,4,8,11,22,25,29,32 Cyclus 2-9: dag 1,8,22,29 |
|
VRD; Bortezomib – Lenalidomide – Dexamethason (cyclusduur 21 dagen, 8 cycli) volgens “SWOG”trial ref Module2, let op NIET vergoed schema |
|||
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-14 (aanpassen aan nierfunctie) |
|
Dexamethason |
20 mg |
p.o |
Dag 1,2,4,5,8,9,11,12 |
De onderstaande schema’s worden in volgorde van voorkomen in de tekst van Module 3 weergegeven.
|
DRd; Daratumumab sc -Lenalidomide-dexamethason (cyclusduur 28 dagen, tot ziekteprogressie) |
|||
|
Daratumumab |
1800 mg |
s.c.. |
Cyclus 1 en 2; dag 1,8,15,22 Cyclus 3 t/m 6: dag 1, 15 Cyclus 7 ev: dag 1 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (dosering aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
KRd; Carfilzomib-Lenalidomide-Dexamethason (cyclusduur 28 dagen, 12 cycli met 6 toedieningen carfilzomib, gevolgd door 6 cycli met 4 toedieningen carfilzomib, na 18 cycli gevolgd door len- dex zonder carfilzomib tot ziekte progressie) |
|||
|
Carfilzomib |
27 mg/m2 # |
i.v. |
Dag 1,2,8,9,15,16 #LET OP: dag 1,2 van cyclus 1: 20 mg/m2 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
Gevolgd na 12 cycli door 6 cycli met 4 toedieningen carfilzomib per cyclus |
|||
|
Carfilzomib |
27 mg/m2 |
i.v. |
Dag 1,2,15,16 (cyclus 13-18) |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
Gevolgd na totaal 18 cycli door lenalidomide-dexamethason tot ziekte progressie |
|||
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
IRd; Ixazomib-Lenalidomide-Dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Ixazomib |
4 mg |
p.o. |
Dag 1,8,15 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
ERd; Elotuzumab-Lenalidomide-Dexamethason (cyclusduur 28 dagen, tot ziekteprogressie) |
|||
|
Elotuzumab |
10 mg/kg |
i.v. |
Cyclus 1 en 2; dag 1,8,15,22 Cyclus 3 ev: dag 1, 15 |
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21(aanpassen aan nierfunctie) |
|
Dexamethason |
28 mg + 8 mg*
40 mg# |
p.o. i.v.
p.o. |
Cyclus 1 en 2: dag 1,8,15,22 Cyclus 3 ev : dag 1,15
Let op: bij cyclus 3 ev dexamethason 40 mg dag 8,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 (8 mg+ 8 mg) #aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
Rd; Lenalidomide – Dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Lenalidomide |
25 mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
DKd; Daratumumab-Carfilzomib – dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Carfilzomib |
56 mg/m2 |
i.v. |
Dag 1,2,8,9,15,16 *LET OP: dag 1,2 van cyclus 1: 20 mg/m2 |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 (of 20 mg dag 1,2,8,9,15,16,22,23) |
|
Daratumumab s.c. |
1800 mg |
s.c. |
Cyclus 1- 2; dag 1,8,15,22 Cyclus 3 t/m 6; dag 1,15 Vanaf cyclus 7: dag 1 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
IsaKd; Isatuximab-Carfilzomib– dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Carfilzomib |
56 mg/m2 |
i.v. |
Dag 1,2,8,9,15,16 *LET OP: dag 1,2 van cyclus 1: 20 mg/m2 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,8,9,15,16,22,23 |
|
Isatuximab |
10 mg/kg |
i.v. |
Cyclus 1: dag 1,8,15,22 Cyclus 2 ev: dag 1,15 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
DVd; Daratumumab- Bortezomib – Dexamethason (cyclusduur 21 dagen, totaal 8 cycli, gevolgd door daratumumab monotherapie tot ziekte progressie) |
|||
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,4,5,8,9,11,12 |
|
Daratumumab |
1800 mg |
s.c.. |
Cyclus 1 t/m 3; dag 1,8,15 Cyclus 4 t/m 8; dag 1 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
Gevolgd na 8 cycli door monotherapie daratumumab (cyclusduur 28 dagen) |
|||
|
Daratumumab |
1800 mg |
s.c. |
Dag 1 |
|
Kd; Carfilzomib-Dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Carfilzomib |
56 mg/m2 |
i.v. |
Dag 1,2,8,9,15,16 *LET OP: dag 1,2 van cyclus 1: 20 mg/m2 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,8,9,15,16,22,23 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
Vd; Bortezomib– Dexamethason (cyclusduur 21 dagen, 8 cycli of tot ziekte progressie) (studies: Castor, Endeavor; zie ref. module 3) |
|||
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Dag 1,4,8,11 |
|
Dexamethason |
20 mg |
p.o. |
Dag 1,2,4,5,8,9,11,12 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
PVd; Pomalidomide – bortezomib – dexamethason (cyclusduur 21 dagen, tot ziekte progressie) |
|||
|
Bortezomib |
1.3 mg/m2 |
s.c. |
Cyclus 1 t/m 8: dag 1,4,8,11 Cyclus 9 ev: dag 1,8 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,4,5,8,9,11,12 (Cyclus 9 ev: dag 1,2,8,9) |
|
Pomalidomide |
4 mg |
p.o.. |
Dag 1-14 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 10 mg of 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
DPd; Daratumumab -Pomalidomide-dexamethason (cyclusduur 28 dagen, tot ziekteprogressie) |
|||
|
Daratumumab |
1800 mg |
s.c.. |
Cyclus 1 en 2; dag 1,8,15,22 Cyclus 3 t/m 6: dag 1, 15 Cyclus 7 ev: dag 1 |
|
Pomalidomide |
4 mg |
p.o. |
Dag 1-21 |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
Pd; Pomalidomide-Dexamethason (cyclusduur 28 dagen, tot ziekteprogressie) |
|||
|
Pomalidomide |
4 mg |
p.o. |
Dag 1-21 |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
REP; Lenalidomide – cyclofosfamide – prednison (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Lenalidomide |
25mg |
p.o. |
Dag 1-21 (aanpassen aan nierfunctie) |
|
Cyclofosfamide |
50mg |
p.o. |
Dag 1-28 |
|
Prednison |
20 mg* |
p.o. |
Dag 1-28 *na 8 weken therapie dosering verlagen tot 1 dd 10 mg |
|
Pom-cyclo-dex; Pomalidomide-cyclofosfamide-dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Pomalidomide |
4 mg |
p.o. |
Dag 1-21 |
|
Cyclofosfamide of Cyclofosfamide |
400 mg fixed dose
50-100 mg |
p.o.
p.o |
Dag 1, 8, 15
Dag 1-21 |
|
Dexamethason |
40 mg* |
p.o. |
Dag 1,8,15,22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
EPd; Elotuzumab-Pomalidomide-dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Elotuzumab |
10 mg/kg 20 mg/kg* |
i.v. |
Cyclus 1 en 2; dag 1,8,15,22 *Cyclus 3 ev: dag 1 |
|
Pomalidomide |
4 mg |
p.o. |
Dag 1-21 |
|
Dexamethason |
28 mg# + 8 mg
40 mg$ |
p.o. i.v.
p.o. |
Cyclus 1 en 2: dag 1,8,15,22 en cyclus 3 ev : dag 1
Let op: bij cyclus 3 ev dexamethason 40 mg dag 8,15,22 |
|
#aanpassen dosering bij leeftijd >75 jr of BMI<18,5 (8 mg+ 8 mg) $aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
IsaPd; Isatuximab- Pomalidomide- dexamethason (cyclusduur 28 dagen, tot ziekte progressie) |
|||
|
Isatuximab |
10 mg/kg |
i.v. |
Cyclus 1: dag 1,8,15,22 Cyclus 2 ev: dag 1,15 |
|
Pomalidomide |
4 mg |
p.o. |
Dag 1-21 |
|
Dexamethason |
40 mg* |
i.v. of p.o. |
Dag 1,8,15 en 22 |
|
*aanpassen dosering bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
MPT; Melfalan – Prednison – Thalidomide (cyclusduur 28 dagen, totaal 9 cycli) |
|||
|
Melfalan |
0.18 mg/kg |
p.o. |
Dag 1 t/m 4 |
|
Prednison |
2 mg/kg |
p.o. |
Dag 1 t/m 4 |
|
Thalidomide |
200 mg |
p.o. |
Dag 1-28 |
|
MPR; Melfalan – Prednison – Lenalidomide (cyclusduur 28 dagen, totaal 9 cycli) |
|||
|
Melfalan |
0.18 mg/kg |
p.o. |
Dag 1 t/m 4 |
|
Prednison |
2 mg/kg |
p.o. |
Dag 1 t/m 4 |
|
Lenalidomide |
10 mg |
p.o. |
Dag 1-21 |
|
Gevolgd na totaal 9 cycli door lenalidomide 10 mg d1-21 van 28 daagse cyclus tot ziekteprogressie |
|||
|
Cyclo(-Dex) Cyclofosfamide monotherapie of in combinatie met dexamethason/ prednison (tot ziekte progressie) |
|||
|
Cyclofosfamide of Cyclofosfamide |
50-100 mg 300-500 mg |
p.o. p.o. |
dagelijks iedere week |
|
Dexamethason of Prednison |
20-40 mg 20 mg |
p.o. p.o. |
iedere week dagelijks |
|
KCd; Carfilzomib-cyclofosfamide-dexamethason (DIT IS EEN NIET GEREGISTREERDE WIJZE VAN TOEDIENEN) (cyclusduur 28 dagen, tot ziekte progressie; na 12 cycli om de week doseren) |
|||
|
Carfilzomib |
70 mg* |
i.v. |
Dag 1,8,15 LET OP: dag 1 van cyclus 1: 20 mg/m2 |
|
Cyclofosfamide of Cyclofosfamide of cyclofosfamide |
300 mg/m2 50-100 mg 300-500 mg |
i.v. p.o. p.o |
Dag 1, 8,15 Dag 1-21 Dag 1,8,15 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,8,9,15,16 |
|
*aanpassen dosering carfilzomib bij leeftijd >75 jr: 56 mg/m2 bij cyclus 1 en 2 en eventueel naar 70 mg/m2 als goed verdragen En aanpassen dosering dexamethason bij leeftijd >75 jr of BMI<18,5 naar 20 mg 1x per week; doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit in de loop van de behandeling moeten worden verminderd |
|||
|
gevolgd na 12 cycli door: (om de week toedieningen): |
|||
|
Carfilzomib |
70 mg* |
i.v. |
Dag 1,15 |
|
Cyclofosfamide of Cyclofosfamide of cyclofosfamide |
300 mg/m2 50-100 mg 300-500 mg |
i.v. p.o. p.o |
Dag 1,15 Dag 1-21 Dag 1,15 |
|
Dexamethason |
20 mg* |
p.o. |
Dag 1,2,15,16 |
|
*aanpassen dosering carfilzomib en dexamethason zie boven |
|||
Bron: Puertas B, et al.; Randomized phase II study of weekly carfilzomib 70 mg/m2 and dexamethasone with or without cyclophosphamide in relapsed and/or refractory multiple myeloma patients. Haematologica 2023;108(10):2753-2763
Tabel 1 Leeftijd en comorbiditeit aangepaste dosering
|
|
< 65 jaar |
65 – 75 jaar |
> 75 jaar of 65 – 75 jaar met co-morbiditeit |
|
Prednison |
2 mg/kg, dag 1-4 van een 4-6 weekse cyclus 60 mg/m2, dag 1-4 van een 6 weekse cyclus |
1 mg/kg, dag 1-4 van een 4-6 weekse cyclus 30 mg/m2, dag 1-4 van een 6 weekse cyclus |
1 mg/kg, dag 1-4 van een 4-6 weekse cyclus 10 mg/m2, dag 1-4 van een 6 weekse cyclus |
|
Dexamethason |
(dosering halveren op indicatie) |
dosering halveren |
|
|
doseringen dexamethason zullen op grond van bijwerkingen en toxiciteit bij kuurschema’s “tot progressie” in de loop van de behandeling worden verminderd |
|||
|
Melfalan |
0.25 mg/kg, dag 1-4 van een 4-6 weekse cyclus 9 mg/m2, dag 1-4 van een 6 weekse cyclus |
0.18 mg/kg, dag 1-4 van een 4-6 weekse cyclus 7.5 mg/m2, dag 1-4 van een 6 weekse cyclus |
0.13 mg/kg, dag 1-4 van een 4-6 weekse cyclus 5 mg/m2, dag 1-4 van een 6 weekse cyclus |
|
Thalidomide |
200 mg/dag |
100 – 200 mg/dag |
50 – 100 mg/dag |
|
Lenalidomide |
25 mg d1-21 |
15-25 mg d1-21 |
10-25 mg d1-21 |
|
Bortezomib |
1.3 mg/m2 2 x per week |
1.3 mg/m2 1-2 x per week |
1.3 mg/m2 1 x per week |
|
frequentie toediening bortezomib bij geringe tekenen neuropathie of risico daarop naar 1x per week |
|||
|
Carfilzomib |
Geen specifieke aanbevelingen voor aangepaste dosering bij leeftijdscategorieën, wel “dose level reductions” bij toxiciteit; in registratiestudie (KRD) geen patiënten met klaring <30 ml/min geïncludeerd (SMPC Kyprolis) tabel 4 |
||
|
Ixazomib |
Geen specifieke aanbevelingen voor aangepaste dosering bij leeftijdscategorieën, wel “dose level reductions” bij toxiciteit (SMPC Ixazomib) tabel 5 |
||
|
Pomalidomide |
Geen specifieke aanbevelingen voor aangepaste dosering bij leeftijdscategorieën, wel “dose level reductions” bij toxiciteit (SMPC Pomalidomide) |
||
Tabel 2A Dosisaanpassing Bortezomib bij PNP, ook autonome neuropathie
|
Ernst van de symptomen |
Dosisaanpassing en schema |
|
Graad 1 (tintelingen met of zonder verlies van reflexen, geen pijn of functiebeperking) |
Verminder toedieningsfrequentie van 2 naar 1 maal per week in dezelfde dosering of dosisreductie met 1 dosislevel* |
|
Graad 1 met pijn of graad 2 (geringe functiebeperking) |
Dosisreductie met 1 dosislevel*of verminder toedieningsfrequentie van 2 naar 1 maal per week in dezelfde dosering. Bij patiënten die bortezomib 1 maal per week kregen dosisreductie met 1 dosislevel of overwegen bortezomib tijdelijk te staken en bortezomib 1 dosislevel lager pas te hervatten na regressie PNP tot graad ≤1 |
|
Graad 2 met pijn of graad 3 (beperking in dagelijks functioneren) |
Staak bortezomib |
|
* dosislevels 1.3 mg/m2,1.0 mg/m2, 0.7 mg/m2 |
|
Tabel 2B Dosisaanpassing Thalidomide bij PNP
|
Ernst van de symptomen |
Dosisaanpassing en schema |
|
Graad 1 (tintelingen met of zonder verlies van reflexen, geen pijn of functiebeperking) |
geen actie of 50% dosis reductie |
|
Graad 1 met pijn of graad 2 (geringe functiebeperking) |
staak thalidomide. Als neuropathie herstelt tot graad 1 of volledig, overweeg herstarten behandeling met 50% dosis reductie, als benefit/ risk ratio gunstig is. |
|
Graad 2 met pijn of graad 3 (beperking in dagelijks functioneren) |
staak thalidomide |
Tabel 3 Dosisaanpassing Lenalidomide bij nierfunctiestoornis
|
Nierfunctie |
Dosisaanpassing |
|
kreatinineklaring ≥ 50 ml/min |
25 mg/dag (standaarddosering) |
|
kreatinineklaring 30-50 ml/min |
10 mg/dag* |
|
kreatinineklaring ≤ 30 ml/min |
15 mg/2 dagen^ |
|
Kreatinineklaring ≤ 15 ml/min of met dialyse |
5 mg/dag. Op dagen van dialyse na dialyse toedienen. |
|
* de dosis kan na 2 cycli worden verhoogd tot 15 mg/dag indien er geen toxiciteit is ^ de dosis kan worden verhoogd tot 10 mg/dag indien er geen toxiciteit is |
|
Tabel 4 Dosisaanpassing carfilzomib (Uit: SMPC Kyprolis)
|
Kuur |
Carfilzomib dosis |
Eerste dosisreductie |
Tweede dosisreductie |
Derde dosisreductie |
|
|
Carfilzomib, lenalidomide en dexamethason |
27 mg/m2 |
20 mg/m2 |
15 mg/m2 * |
— |
|
|
Carfilzomib en dexamethason + antiCD38 |
56 mg/m2 |
45 mg/m2 |
36 mg/m2 |
27 mg/m2 * |
|
|
* Indien de symptomen niet verdwijnen, discontinueer carfilzomib therapie |
|||||
Tabel 5 Dosisaanpassing ixazomib (Uit: SMPC Ixazomib)
|
Ixazomib start dosering |
Eerste ixazomib dosisreductie |
Tweede/derde ixazomib dosisreductie |
|
|
4 mg |
3 mg |
2,3 mg |
discontinueer |
Tabel registratie en vergoeding van therapieschema’s
Inductietherapie voor patiënten die een autologe stamceltransplantatie ondergaan
|
|
geregistreerd |
vergoed |
|
VTD |
+ |
+ |
|
Dara-VTD |
+ |
+ |
|
VRD |
– |
– |
|
Dara-VRD |
|
+ |
Inductietherapie voor patiënten die geen autologe stamceltransplantatie ondergaan
|
|
geregistreerd |
vergoed |
|
(Dara)-VMP |
+ |
+ |
|
Rd |
+ |
+ |
|
Dara-Rd |
+ |
+ |
|
VRd |
+ |
– |
RRMM
|
|
geregistreerd |
vergoed |
|
Dara-Vd |
+ |
+ |
|
Kd |
+ |
+ |
|
Vd |
+ |
+ |
|
Dara-Kd |
+ |
+ |
|
Isa-Kd |
+ |
+ |
|
Pom-Vd |
+ |
+ |
|
Pano-Vd |
+ |
+ |
|
Dara-Rd |
+ |
+ |
|
KRd |
+ |
+ |
|
Ixa-Rd |
+ |
+ |
|
Elo-Rd |
+ |
+ |
|
DaraPomd |
+ |
– |
|
REP |
– |
+ |
|
PEP |
– |
+ |
|
Elo-PomD |
+ |
+ |
|
Isa-PomD |
+ |
+ |
© 2022. Alle rechten voorbehouden
Autorisatiedatum en geldigheid:
Ieder jaar (vanaf 1 jaar na publicatie van de richtlijn 2024) bepaalt de HOVON Myeloom werkgroep of ieder van de modules waaruit de richtlijn is opgebouwd, nog actueel zijn. Stichting HOVON is als houder van deze richtlijn de eerstverantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied. De geldigheid van de richtlijn komt te vervallen indien nieuwe ontwikkelingen aanleiding zijn een (modulaire) herziening te ontwikkelen en te publiceren.