Terug naar het richtlijnenoverzicht
Deze multidisciplinaire richtlijn heeft als doel het stroomlijnen van de diagnostiek, stadiering, evaluatie en eenduidige behandeling van patiënten met nodaal T-cellymfoom (nTCL) binnen ziekenhuizen in Nederland en België die aangesloten zijn bij HOVON. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze betreffen een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een nTCL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, en tracht een betere uniformiteit van behandeling en daarmee een betere kwaliteit van zorg en uiteindelijk betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Op het moment van bespreken en starten van een behandeling zijn patiënten niet altijd in staat de mogelijke gevolgen hiervan te overzien. Men accepteert dat bestrijding van de ziekte nodig is en heeft het ‘noodzakelijk kwaad’ van de bijwerkingen te accepteren. Bijwerkingen op de langere termijn hebben grote invloed op de kwaliteit van leven. Het verdient daarom aanbeveling de patiënt bij de start van iedere behandeling te informeren over de meest voorkomende bijwerkingen en de mogelijkheid om bepaalde middelen niet of in mindere mate in te zetten, en de consequenties die dat zou kunnen hebben.
De volgende frequent voorkomende nodale, mature T-cellymfomen zullen worden besproken:
Aanvullend zullen meer zeldzamere T-cellymfomen en extranodale T-cellymfomen (bv. NK/T-cellymfoom, enteropathie-geassocieerd T-cellymfoom, monomorf epitheliotroop intestinaal T-cellymfoom, borst implant geassocieerde ALCL, NK/T-cellymfomen en primair cutane lymfomen) worden behandeld in aparte modules.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een nTCL, zoals internist-hematologen, pathologen, radiotherapeuten en cytologen.
Multidisciplinair overleg (MDO)
De diagnostiek en behandeling van een nTCL is bij uitstek multidisciplinair, waarbij de hematoloog, patholoog, radioloog, nucleair geneeskundige, radiotherapeut en klinisch moleculair bioloog in de pathologie (KMBP’er) een belangrijke rol spelen. De werkgroep beveelt aan om het behandelplan te formuleren in een multidisciplinair overleg (MDO).
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
Voor het ontwikkelen van de richtlijn is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met nodaal T-cellymfoom (nTCL). De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende bijna 3 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon.
Methode ontwikkeling
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht door de werkgroepleden. In veel gevallen is afgezien van een systematische search met als mogelijke redenen: het ontbreken van voldoende gepubliceerde studies of de beschikbaarheid van recente internationale evidence-based richtlijnen of systematische reviews.
Werkwijze
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline en Cochrane. Aanvullend werd gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Door de zeldzaamheid, en het gebrek aan gerandomiseerde studies, is een groot deel van de aanbevelingen en adviezen gebaseerd op consensus of expert opinion en wordt daarom aanbevolen behandelopties met patiënt goed te bespreken (shared decision making).
Kwaliteitsindicator diagnostisch proces
Kwaliteitsindicator behandeling
Strength-of-Recommendation Taxonomy (SORT)
|
Code |
Definition |
|
A |
Consistent, good-quality patient-oriented evidence * |
|
B |
Inconsistent or limited-quality patient-oriented evidence * |
|
C |
Consensus, disease-oriented evidence *, usual practice, expert opinion, or case series for studies of diagnosis, treatment, prevention, or screening |
* Patient-oriented evidence measures outcomes that matter to patients: morbidity, mortality, symptom improvement, cost reduction, and quality of life. Disease-oriented evidence measures immediate, physiologic, or surrogate end points that may or may not reflect improvements in patient outcomes (e.g. blood pressure, blood chemistry, physiologic function, pathologic findings).
Uiterlijk 2 jaar na verschijnen van deze richtlijn wordt door LWG werkgroep beoordeeld of deze richtlijn nog actueel is. De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen het nodig maken om eerder een herzieningstraject te starten.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in de praktijk en/ of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig wordt gemotiveerd afgeweken van deze richtlijn.
De conceptrichtlijn is op 19 februari 2025 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH), Nederlandse Vereniging voor Radiotherapie (NVRO), Nederlandse Vereniging voor Pathologie (NVVP), Belgische Vereniging voor Radiotherapie-Oncologie en de Nederlandse Vereniging voor Cytometrie. Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. De richtlijn is/wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast is/wordt er een toelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de website van NvVH.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon (Drs. T.S. de Vries).
De verschillende nodale T-cellymfomen (nTCL) worden gediagnosticeerd op basis van histologie met deels kenmerkende klinische verschijnselen. Bij voorkeur wordt de diagnose gesteld op een volledige klierexcisie. Wanneer een klierexcisie technisch niet haalbaar is, dan wordt een ruim incisiebiopt aanbevolen. Conform de meest recente WHO-classificatie is de diagnose gebaseerd op een combinatie van verschillende pijlers, waaronder (histo)morfologie, immuunhistochemie, clonaliteitsanalyse en verdere moleculaire diagnostiek. In samenhang met de klinische context dient de patholoog zorgvuldig te overwegen welk aanvullende (moleculair) onderzoek van belang is voor een zekere classificerende diagnose. Aangezien het om zeldzame diagnoses gaat en vanwege het belang van (geavanceerd) moleculair onderzoek dat niet in elk pathologielaboratorium verricht kan worden, kan laagdrempelige consultering in een centrum met meer ervaring in dit expertisegebied en/of meer (moleculair-)diagnostische mogelijkheden worden overwogen.
Aanbeveling A-1
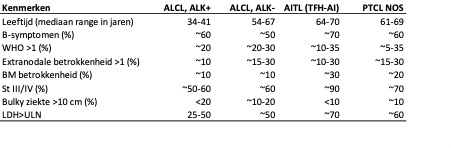
De meest frequent voorkomende nodale mature T-cellymfomen ALCL, nodaal TFH-lymfoom en PTCL-NOS omvatten circa 80% van alle nTCL diagnoses. Ze worden gekenmerkt bij het vaststellen van de diagnose door uitgebreide stadium, (extra)nodale ziekte (Ann Arbor stadium III/IV), B-symptomen, verhoogd LDH en een slechte prognose met 5-jaars mediane overleving van 28-43%. De ziekte uit zich met name bij de oudere volwassen leeftijdsgroep (mediaan 54-70 jaar). ALK-positief ALCL vormt hierbij een uitzondering met een betere langetermijnoverleving (70-86%) en presentatie van de ziekte bij jong volwassenen (mediaan 34-41 jaar). Nodaal TFH-lymfoom gaat soms gepaard met auto-immuunfenomenen, zoals auto-immuun hemolytische anemie, immuun-trombocytopenie, hypergammaglobulinemie. Met name PTCL-NOS kan soms een hemofagocytair syndroom induceren. Differentiaaldiagnostisch moet er naast andere lymfomen (m.n. klassiek Hodgkinlymfoom) gedacht worden aan reactieve beelden bij auto-immuunziektes en infecties. Naast standaard klinische work-up wordt daarom geadviseerd om EBV, HIV, CMV, HTLV1 (adult T-cell leukemie/lymfoom)-serologie, en bij positieve uitslag ook PCR te verrichten. De klinische kenmerken van nTCL entiteiten zijn samengevat in Tabel A1.
Onderbouwing A-1 (SORT C)
Tabel A1
Literatuur
Aanbeveling A-2
Voor diagnostische doeleinden is er een sterke voorkeur voor een excisie van een gehele aangedane lymfklier boven een ruim incisiebiopt en zeker boven een (CT-geleid) naaldbiopt. Bij een patiënt met lymfadenopathie heeft diagnostiek op lymfklierweefsel ook een sterke voorkeur boven classificerende diagnostiek op een beenmergbiopt om de architectuur van de afwijkende lymfklier – als diagnostisch criterium – te kunnen beoordelen. Soms kan een beenmergbiopt wel een goede aanvulling zijn op een lymfklierbiopt/-excisie als er nog getwijfeld wordt tussen een reactief beeld of een nTCL. Cytologisch onderzoek heeft geen plaats in de primaire diagnostiek van nTCL.
Onderbouwing A-2 (SORT B)
Het op basis van histologisch onderzoek diagnosticeren van nTCL gebeurt conform de WHO-classificatie op basis van een combinatie van (histo)morfologische beoordeling, immuunhistochemisch onderzoek, clonaliteitsanalyse en verdere moleculaire diagnostiek. In samenhang met de klinische context dient de patholoog zorgvuldig te overwegen welk aanvullende (moleculair) onderzoek van belang is voor een zekere classificerende diagnose. De histomorfologische beoordeling omvat onder andere de beoordeling van de architecturele opbouw van de aangedane lymfklier. In naaldbiopten komt die vaak niet goed tot zijn recht, maar is bij veel nTCL wel essentieel voor het stellen van de juiste diagnose. Aangezien voor de verschillende genoemde diagnostische technieken relatief veel weefsel nodig is, voldoen naaldbiopten qua grootte/hoeveelheid tumorweefsel ook vaak niet om deze allemaal te kunnen verrichten.
Indien een excisie(biopsie) klinisch of technisch niet mogelijk is, is de dikte van de naald bij naaldbiopsie relevant; ervaring leert dat op basis van 18G- of 20G-biopten veel minder vaak een classificerende diagnose gesteld kan worden dan op een 14G-biopt. Het nemen van meer dan twee biopten heeft hierbij geen toegevoegde waarde voor de beoordeelbaarheid van de weefselarchitectuur, maar levert wel meer mogelijkheden voor aanvullend (moleculair) onderzoek.
Indien bij een cytologische punctie de diagnose nTCL wordt gesuggereerd, moet dit altijd gevolgd worden door aanvullend histologisch onderzoek. Een cytologische punctie alleen is niet diagnostisch voor een nieuwe diagnose nTCL.
Op beenmergonderzoek alleen kan geen initiële nTCL-diagnose worden gesteld, en dient bij lymfadenopathie histologie van de klier te worden verkregen voor pathologische evaluatie. Soms kan een beenmergbiopt wel een goede aanvulling zijn op een lymfklierbiopt/-excisie als er nog getwijfeld wordt tussen een reactief beeld of een nTCL, dit geldt met name voor nTFHL.
Literatuur
Aanbeveling A-3
Voor het diagnosticeren en differentiëren tussen de verschillende nTCL worden immunohistochemische criteria ingezet conform de meest recente WHO-classificatie. Het wordt aanbevolen gestandaardiseerde immunohistochemische panels te gebruiken.
Onderbouwing A-3 (SORT C)
Het doel van het gebruik van gestandaardiseerde panels is om de kans op verkeerde diagnoses en het missen van diagnoses te verkleinen. Ieder PA-laboratorium zal de panels finetunen naar eigen mogelijkheden. In de panels wordt geadviseerd de markers op te nemen die volgens de WHO-classificatie essentieel zijn voor de verschillende diagnoses. In de WHO-classificatie worden daarnaast ook markers genoemd die bij die diagnoses gewenst zijn. In de Nederlandse setting lijkt het haalbaar ook deze markers te doen.
In het algemeen geldt dat pan-T-celmarkers worden verricht om T-celmarkerverlies te kunnen aantonen als potentiële aanwijzing voor maligniteit. Daarnaast kunnen verschillende markers een differentiatierichting van de T-celpopulatie aangeven (bv. T-follikelhelperceldifferentiatie of cytotoxische differentiatie) of meer specifiek een diagnose ondersteunen (zoals CD30 en ALK1 bij ALCL). Ter uitsluiting van andere maligne lymfomen of reactieve beelden kan het panel nog verder uitgebreid worden.
Literatuur
Aanbeveling A-4
Bij T-cellymfomen kan CD30 immuunhistochemie bepaald worden en beschreven in het pathologieverslag. Bij enige positiviteit (>1%) zijn zowel verdere kwantificering als subtypering (positiviteit in tumorcellen versus positiviteit in tumor microenvironment) niet wetenschappelijk relevant in de keuze om wel of niet met Brentuximab vedotin (BV) te behandelen.
Onderbouwing A-4 (SORT B)
CD30-expressie is lastig objectief te kwantificeren vanwege verschillen in kwantiteit/kwaliteit van het weefsel, de immuunhistochemische kleuring tussen verschillende PA-laboratoria en door interobservervariabiliteit bij pathologen. Met een beschrijving van de hoeveelheid en intensiteit van aankleuring kan een inschatting worden gegeven van de expressie van CD30 en of deze expressie aanwezig is in de neoplastische T-cellen, de secundair hieraan voorkomende B-celpopulatie of in reactieve lymfocyten/plasmacellen in de achtergrond. Het is echter van belang om goed in het achterhoofd te houden dat bij enige positiviteit (>1%) zowel verdere kwantificering als subtypering (positiviteit in tumorcellen versus positiviteit in tumor microenvironment) niet wetenschappelijk relevant is in de keuze om wel of niet met Brentuximab vedotin (BV) te behandelen.
Literatuur
Aanbeveling A-5
Het wordt aanbevolen om bij enige twijfel over een diagnose nTCL T-celreceptorgenherschikkingsanalyse te verrichten (EuroClonality/BIOMED-2; TCR-beta én TCR-gamma PCRs), ter ondersteuning van een vaak lastige diagnose.
Onderbouwing A-5 (SORT B)
T-celclonaliteitsanalyse kan essentieel zijn in het onderscheid tussen reactieve processen en nTCL, omdat histomorfologisch en immunohistochemisch dit onderscheid lastig kan zijn. Bij mogelijk nTFHL met secundaire B-cel/Hodgkinoïde proliferatie kan men ook B-celclonaliteitsanalyse verrichten ter evaluatie van eventuele secundaire (grootcellige) B-celmaligniteiten. Opgemerkt moet worden dat interpretatie lastig kan zijn en het is van groot belang kennis van de kliniek, histologie en immuunhistochemie te combineren met moleculaire expertise (technische aspecten, interpretatie). Hiervoor is samenwerking tussen patholoog en laboratoriumspecialist/KMBP’er essentieel. In sommige nTCL kan met T-celclonaliteitsanalyse geen monoclonaliteit aangetoond worden, bv. in een deel van de ALCL en in gevallen met een te laag tumorcelpercentage. En in sommige niet-neoplastische processen kan juist wel een kleine, reactief geëxpandeerde T-celpopulatie worden opgepikt.
Het gebruik van NGS-based T-cell clonality is in opkomst. Deze techniek is sensitiever dan conventionele klonaliteitsanalyse en klonale expansies in verschillende samples zijn beter met elkaar te vergelijken. Hoewel de binnen EuroClonality ontwikkelde NGS protocollen momenteel geleidelijk in de diagnostische work-up worden geïmplementeerd,
wordt over dit onderwerp nog geen advies gegeven in deze richtlijn.
Literatuur
Aanbeveling A-6
Onderbouwing A-6 (SORT B)
Voor duidelijke casus van ALK-positieve/negatieve ALCL heeft mutatie-analyse geen aanvullende waarde, omdat het in die gevallen niet nodig is om de diagnose te onderbouwen en er vrijwel geen voor dit subtype specifieke mutaties bekend zijn.
Er wordt geadviseerd om mutatie-analyse te overwegen voor alle andere nTCL. Mutaties in de genen TET2, DNMT2A, RHOA en IDH2 kunnen sterk ondersteunend zijn voor nTFHL (alhoewel interpretatie uitdagend kan zijn, omdat de mutaties deels ook geassocieerd zijn met clonale hematopoiese). In lastige casus kan mutatie-analyse – met aangetoonde en bekende pathogene mutaties – ook ondersteunend zijn voor een clonale/neoplastische origine van de T-celpopulatie, eventueel ook bij lastige casus van ALK-negatieve ALCL. Dit is tevens van belang bij casuïstiek met een negatieve TCR-clonaliteit en wel sterke verdenking op een T-cellymfoom, om een neoplastische origine van de cellen te kunnen onderbouwen. Het is belangrijk om goed na te denken over de juiste techniek voor mutatie-analyse. Meestal wordt next generation sequencing verricht, omdat hiermee makkelijk een groot aantal genen geanalyseerd kan worden. Bij lage tumorcelpercentages of relatief slechtere kwaliteit materiaal kan ook overwogen worden een sensitievere methode in te zetten, zoals digital droplet PCR. (hierbij kan met name de RHOA p.(G17V) informatief zijn omdat deze ook niet is geassocieerd met clonale hematopoiese).
Routinematig translocatie-onderzoek naar DUSP22 en TP63 (in situ hybridisatie dan wel fusionplex targeted RNA sequencing) in casus met verdenking/bevestigde ALK-negatief ALCL wordt niet standaard geadviseerd. Alhoewel er literatuur is die onderbouwt dat casus met DUSP22-translocatie een genetisch aparte prognostisch gunstige groep vormen, wordt er in de nieuwste WHO-classificatie nog niet gesubtypeerd op basis van deze translocaties. Dat is mede gebaseerd op het feit dat er op dit moment onvoldoende onderbouwing is dat deze subtypering zodanige prognostische waarde heeft dat de behandeling hierop aangepast moet worden. Wel kan het in diagnostisch lastige gevallen behulpzaam zijn translocatie-onderzoek te verrichten ter ondersteuning van de diagnose ALK-negatief ALCL.
Literatuur
Aanbeveling A-7
De histologische diagnose ALCL, PTCL-NOS of nTFHL moet altijd worden gesteld door een patholoog met als aandachtsgebied hematopathologie. Alle nieuwe patiënten dienen ten minste integraal besproken te worden in een locoregionaal MDO, waarin alle betrokken specialisten zijn vertegenwoordigd. Daarnaast kan worden overwogen nieuwe casus voor te leggen aan een regionaal hematopathologiepanel.
Onderbouwing A-7 (SORT C)
nTCL is een relatief weinig voorkomende diagnose en de PA-diagnostiek hiervan betreft daarmee geen hoog-volumediagnostiek. Bovendien is er een grote variatie in morfologie tussen individuele casus, ook binnen dezelfde entiteiten. Zodoende is het lastig veel PA-expertise in dit specifieke gebied op te bouwen. Het is van groot belang om voorkomende pitfalls (zoals klassiek Hodgkinlymfoom) goed te kunnen herkennen. Bovendien betreft het diagnostiek waarbij (geavanceerd) moleculair onderzoek een grote rol kan hebben dat niet in elk PA-laboratorium verricht kan worden. Er is literatuur die het belang van centrale pathologierevisie ondersteunt. In een locoregionaal MDO kunnen in aanwezigheid van alle betrokken specialisten alle parameters van de diagnose (klinisch beeld, beeldvorming, histologie, immuunhistochemie, moleculaire pathologie) geïntegreerd besproken worden.
Literatuur
Aanbeveling A-8
Onderbouwing A-8 (SORT C)
Pathologische diagnose wordt gesteld op een histologisch biopt. Flowcytometrie heeft naast immuunhistochemie een ondersteunende rol bij het stellen van de diagnose en stadiering van de ziekte wanneer alleen vocht (bloed, ascites, pleuravocht, liquor, of vers tumorweefsel) beschikbaar is en eventueel indien er beperkte hoeveelheid weefsel beschikbaar is. Het minimale flowcytometrie panel dat in Nederland geadviseerd wordt bij de diagnostiek van rijpe T-celmaligniteiten is: CD45, TdT, CyCD3, CD1, CD2, CD3, CD4, CD5, CD7, CD8, CD16, CD25, CD56, CD57, en additioneel: CD10, CD30, CD52, CD279 (PD-1), TCR alfa-beta, TCR gamma-delta (zie aanbevelingen op www.cytometrie.nl, minimale panels). Richtinggevende markers kunnen zijn in de verdere indeling van nTCL: CD30 (ALCL), CD279 (nTFHL).
Het wordt aanbevolen om lokaal te screenen op de aanwezigheid van afwijkende T-celpopulaties (bijvoorbeeld middels de EuroFlow Lymfocytose screening tube), en uitgebreidere typering uit te voeren in een expertcentrum. nTCL is een relatief weinig voorkomende diagnose en de flowcytometrische-diagnostiek hiervan betreft daarmee geen hoog-volumediagnostiek. Zodoende is het lastig veel flowcytometrische-expertise in dit specifieke gebied op te bouwen. Bovendien betreft het diagnostiek waarbij (geavanceerd) moleculair onderzoek (T-celreceptorgenherschikkingsonderzoek) moet worden gedaan dat niet in elk flowcytometrisch-laboratorium verricht kan worden.
Literatuur
Stadiëring vindt bij diagnose plaats middels 18F-FDG PET-CT. Voor de responsevaluatie kan afhankelijk van de initiële FDG-aviditeit ook gekozen worden voor enkel een CT-scan. Bij de eindevaluatie van de behandeling wordt de voorkeur gegeven aan een PET/CT indien het lymfoom bij diagnose PET-avide was. Bij het vermoeden op beenmergbetrokkenheid (bv. cytopenie) of indien beenmergbetrokkenheid behandelconsequenties (zoals bijvoorbeeld stadium I/II op basis van beeldvorming behandeling met 3x R-CHO(E)P + ISRT overwogen wordt), wordt een beenmergbiopt aanbevolen bij stadiering. Liquoronderzoek en het verrichten van een MRI-brein wordt geadviseerd bij klachten wijzend op CZS-betrokkenheid. Het prognostisch gebruik van de IPI-score wordt bij alle nTCL-subtypen aanbevolen. Bij EBV-positieve nTFHL heeft de EBV-load in het perifere bloed prognostische waarde en kan dit als tumormarker dienen.
Aanbeveling B-1
Onderbouwing B-1 (SORT B)
Het merendeel van de nTCL is FDG-avide (-90%). PET verandert t.o.v. CT zelden het stadium dusdanig dat de behandeling verandert, de meeste patiënten hebben een uitgebreid stadium (III/IV) bij diagnose. Een PET-CT voor aanvang van de behandeling helpt met name om residuale ziekte aan het eind van de behandeling te detecteren. T-cellymfomen kunnen vaker dan B-cellymfomen opeens verrassende nieuwe lokalisaties vertonen (ESMO guidelines, expert opinion). Interim PET voorspelt de outcome van CHOP/CHOP-like behandelde nTCL niet. Alleen PET-positiviteit na vierde CHOP/CHOEP op weg naar consolidatie met intensieve chemotherapie (BEAM) gevolgd door een autologe stamceltransplantatie (ASCT) is geassocieerd met slechtere 4-jaars EFS en OS.
Literatuur
Aanbeveling B-2
Onderbouwing B-2 (SORT C)
Sensitiviteit van PET/CT om biopt-bewezen beenmergbetrokkenheid aan te tonen is 18%. Het verdient aanbeveling bij klinische verdenking op betrokkenheid een beenmergbiopt te doen. In de responsevaluatie is niet standaard beenmergdiagnostiek nodig, echter indien er bij diagnose significante beenmergbetrokkenheid was, kan dit overwogen worden, zeker voor mobilisatie van stamcellen plaatsvindt, aangezien mobilisatie bij ernstig betrokken beenmerg minder succesvol is. In geval van stadium I ziekte of beperkt stadium II op basis van PET/CT wordt aanbevolen beenmergdiagnostiek te doen omdat dit tot upstaging kan leiden en derhalve behandelconsequenties kan hebben.
Literatuur
Aanbeveling B-3
Onderbouwing B-3 (SORT C)
Vanwege de lage incidentie van nTCL en CZS-betrokkenheid, is de literatuur relatief schaars en niet geheel consistent. Er zijn enkele kleine case series en case reports op basis waarvan conclusies getrokken kunnen worden omdat er overeenkomsten zijn. De incidentie van CZS-betrokkenheid bij het nTCL varieert sterk per subtype, tussen de 2-20% (in een eigen IKNL-analyse lag de incidentie op 4%, submitted manuscript). Subtypen met een hogere incidentie (>5%) zijn: PTCL-NOS en ALK-negatief ALCL. Voor de subtypen nTFHL en ALK-positief ALCL lijkt dit lager dan 5% te zijn.
De tijd tussen de eerste diagnose en het vaststellen van een recidief in het CZS is mediaan ongeveer 5 maanden (range 1-30 maanden), hetgeen suggereert dat het mogelijk bij diagnose al aanwezig was, maar in ieder geval een vroeg event is. De prognose van een recidief nTCL in het CZS is slecht, met een gemiddelde OS van enkele maanden. Er lijkt geen duidelijk verschil te zijn tussen de OS van een relapse met of zonder CZS-betrokkenheid; het hebben van een recidief op zich leidt al tot een zeer slechte prognose.
De risicofactoren voor het krijgen van een recidief in het CZS variëren per cohort en zijn vaak niet statistisch significant (mede door de kleine aantallen). Gelet op de beschikbare literatuur lijken er twee factoren die consequent genoemd worden en relevant zijn: het hebben van ≥2 extranodale sites (beenmerg meegerekend) en betrokkenheid van de darm (los van het aantal betrokken sites).
Een goede risicoscore voor CZS-betrokkenheid bestaat niet. Recent is er een risicoscore gepresenteerd (ASH 2022), echter is deze nog niet gepubliceerd of extern gevalideerd, en daarom te vroeg om toe te passen. Bovendien is het de vraag welke vorm van profylactische behandeling gegeven zou moeten worden als er sprake is van een hoog risico zonder aantoonbare CZS-betrokkenheid. Overigens zijn factoren hierin met de hoogste impact op het risico het subtype PTCL-NOS en het hebben van ≥2 extranodale sites, hetgeen overeenkomt met de literatuur en gevonden factoren in het verleden.
Literatuur
Aanbeveling B-4
Onderbouwing B-4 (SORT B)
Prognostische factoren
Naast leeftijd, Ann Arbor stadium III-IV en verhoogd LDH zijn het mannelijk geslacht (onafhankelijk van remissiestatus), B-symptomen, extranodale en/of bulky ziekte en gastro-intestinale betrokkenheid geassocieerd met een slechtere prognose. Van de meest voorkomende subtypen heeft ALK- ALCL de beste en PTCL-NOS de slechtste prognose.1-6 Bij refractaire of recidiefziekte is de mediane 3-jaarsoverleving < 10%.7 Bij ALCL en nTFHL zijn voorts β2-microglobuline en leverbetrokkenheid en bij nTFHL ook CRP geassocieerd met een slechtere overleving. 8-11 Bij nTFHL was in een kleine groep een positieve EBV viral load in perifeer bloed geassocieerd aan overleving.12 Bij nTFHL heeft 66-91% een EBV-positief CD20+ B-celinfiltraat in de tumor, zonder associatie met overleving.13
Risicoscores
De International Prognostic Index (IPI)-score kan voor nTCL worden gebruikt en discrimineert goed tussen groepen, maar de overleving is significant slechter dan bij DLBCL.14-17 De IPI-score is voor de zeldzame nTCL subtypes ongeschikt (welke hier niet verder worden gesproken).17
Er zijn meerdere andere risicoscores ontwikkeld, zoals de Prognostic Index for PTCL-U (PIT) score, de T-cell score en de AITL score.18, 19, 20 Doordat externe validatie voor deze risicoscores ontbreekt, is er vooralsnog onvoldoende bewijs deze scores in de klinische zorg te gebruiken. De IPI-score lijkt het best te correleren met de daadwerkelijke overleving, maar is voor nTFHL het minst betrouwbaar.
|
|
Risicoscore (punten) |
|
|
|
|
Prognostische factor |
IPI score |
PIT score |
T cell score |
AITL score |
|
Leeftijd> 60 jaar |
1 |
1 |
|
1 |
|
Ann Arbor stadium III/IV |
1 |
|
1 |
|
|
Extranodale betrokkenheid (> 1 lokalisatie) |
1 |
|
|
|
|
LDH > normaalwaarde |
1 |
1 |
|
|
|
WHO Performance score ≥ 2 |
1 |
1 |
1 |
1 |
|
Beenmergbetrokkenheid |
|
1 |
|
|
|
Serum albumine |
|
|
1 |
|
|
Neutrofielengetal |
|
|
1 |
|
|
Β2-microglobuline > normaalwaarde |
|
|
|
1 |
|
CRP > normaalwaarde |
|
|
|
1 |
|
|
Aantal punten en overleving |
|
|
|
|
|
|
Prognostische factor |
0 |
1 |
2 |
3 |
4 |
5 |
|
IPI score* (5-jaars OS) |
52% |
52% |
25% |
20% |
0% |
0% |
|
PIT score (5-jaars OS) |
62,3% |
52,9% |
32,9% |
18,3% |
18,3% |
nvt |
|
T cell score (3-jaars OS) |
76% |
43% |
43% |
11% |
11% |
nvt |
|
AITL score (5-jaars OS) |
63% |
63% |
54% |
21% |
21% |
nvt |
*volgens Gutierrez-Garcia et al22.
Literatuur
Aanbeveling B-5
Onderbouwing B-5 (SORT C)
De literatuur is beperkt en met name alleen in kleine case series is de rol van EBV-monitoring beschreven. Een hoge en aanhoudende positieve EBV-load in het perifere bloed is geassocieerd met een slechtere prognose. Het is daarom van belang om bij elke nTCL patiënt voorafgaande een EBV viral load in het perifere bloed te bepalen en indien positief deze te vervolgen als response-marker.
Literatuur
Aanbeveling B-6
Onderbouwing B-6 (SORT C)
Na de behandeling wordt geadviseerd de nTLC patiënt in eerste 2 jaar elke 3 maanden te vervolgen, en daarna elke 6 maanden voor een duur van in het totaal 5 jaar.
In het geval van radiotherapie adviseert de werkgroep om de follow-up te verlengen tot levenslang indien er sprake is van grote velden waarin vitale organen zoals het hart, longen, grote vaten en mammae zitten. De follow-up kan dan volgens het ‘BETER’ protocol worden verricht en begint 5 jaar na de behandeling.
Literatuur
De eerstelijnsbehandeling van nTCL bestaat in geval van stadium I(E) of beperkt stadium II(E) voor alle subtypes uit gecombineerde modaliteitsbehandeling met CHOP chemokuren en lokale radiotherapie. In geval van stadium II-IV ziekte bestaat de eerstelijnsbehandeling bij nTFHL, PTCL-NOS en ALK-negatief ALCL voor fitte patiënten uit CHOP chemokuren gevolgd door consolidatie met BEAM en autologe stamceltransplantatie. Bij ALK-positief ALCL kan voor de eerstelijnsbehandeling gekozen worden uit CHOEP of Bv-CHP kuren als gelijkwaardige opties, hierbij is geen indicatie voor consolidatiebehandeling. Voor niet-fitte stadium II-IV patiënten bestaat de eerstelijnsbehandeling uit CHOP kuren in geval van nTFHL en PTCL-NOS en uit Bv-CHP in geval van ALK-positief of ALK-negatief ALCL. Er is geen standaard indicatie voor het toevoegen van rituximab aan de eerstelijnsbehandeling, maar in geval van een hoge EBV-load in het perifere bloed en de aanwezigheid van een EBV-positieve B-cel kloon in het weefsel bij een patiënt met nTFHL kan dit worden overwogen.
Aanbeveling C-1
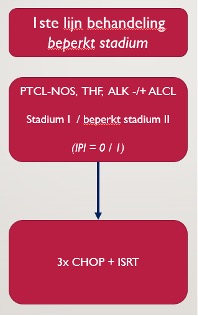
Onderbouwing C-1 (SORT C)
Er is geen universele definitie van beperkt stadium nTCL. In deze richtlijn wordt de definitie van stadium I(E) + (beperkt) stadium II aangehouden, waarbij de laesies redelijkerwijs in één bestralingsveld behandeld kunnen worden en aaneengesloten lymfeklierstations betreffen. Prospectieve, gerandomiseerde studies naar de beste behandeling bij beperkt stadium nTCL zijn niet verricht. In de dagelijkse praktijk wordt veelal gebruik gemaakt van de strategie zoals deze bij agressieve B-cellymfomen met beperkt stadium wordt gevolgd, te weten 3x CHOP gevolgd door radiotherapie – de zogenoemde gecombineerde modaliteitsbehandeling (CMT).1 In retrospectieve studies is behandeling met CMT geassocieerd met een significante verbetering van de overleving. In een recente Nederlandse studie (n=619) van patiënten met stadium I(E) ALCL, nTFHL en PTCL-NOS werd een 5-jaars overleving van 65% gezien bij behandeling middels CMT versus 50% bij chemo- of radiotherapie alleen. In deze studie werd slechts 28% van de patiënten behandeld middels CMT, echter was er wel een stijging te zien in de toepassing van deze strategie naar 36% in de laatste jaren.2 Een grote retrospectieve studie (n=3411) uit de Verenigde Staten liet eenzelfde beeld zien. Hierin waren de uitkomsten van patiënten met beperkt stadium nTCL die behandeld waren met CMT beter dan chemotherapie monotherapie, maar alleen bij ALK-negatief ALCL patiënten.3 Een andere retrospectieve Chinese studie (n=2678) liet eveneens zien dat de uitkomsten met CMT significant beter waren dan chemotherapie alleen voor patiënten met PTCL-NOS en een beperkt stadium ziekte, maar CMT was niet betere in een uitgebreid stadium.4
CMT lijkt de beste behandelstrategie voor beperkt stadium nTCL. Bij ALK-negatief ALCL patiënten waarbij bestraling risicovol is door bijkomende risicofactoren of een te groot bestralingsveld, kan men overwegen dit achterwege te laten en met 4x CHOP te behandelen.
Behoudens bij ALK-positief ALCL (met name met een uitgebreider ziektestadium), zijn er geen overtuigende data voor andere nTCL subtypen dat de toevoeging van etoposide aan CHOP bijdraagt aan betere uitkomsten.5,6,7 Gezien de beperkte data voor ALK-positief ALCL met een beperkt ziektestadium is de rol van het toevoegen van etoposide aan CHOP onduidelijk.
In de ECHELON-2 studie, waarbij brentuximab-CHP werd vergeleken met CHOP had slechts 4,6 % stadium I en 14,8% stadium II. Bij patiënten met beperkt stadium nTCL werd geen verschil in uitkomst gezien tussen brentuximab-CHP en CHOP. Er werd echter wel een significant betere uitkomst gezien voor patiënten met ALK-positief ALCL; of dit enkel patiënten met stadium III/IV betreft is onduidelijk.8 In ECHELON-2 studie werd geen CMT gegeven, waardoor de waarde van BV-CHP met radiotherapie niet bekend is.
Literatuur
Aanbeveling C-2
Onderbouwing C-2 (SORT B)
O.b.v. eerdere literatuur was de afgelopen jaren CHOEP inductiebehandeling de standaard voor fitte patiënten met nodaal T-cellymfoom (nTCL) in veel centra in Nederland, omdat de toevoeging van etoposide aan CHOP chemokuren hierin een verbeterde progressievrije overleving (PFS) bij patiënten tot 60 jaar suggereerde, zonder aangetoond voordeel op de overall survival (OS). In een meerderheid van de patiënten in deze studies werd echter geen standaard consolidatie met ASCT gegeven. Bovendien lijkt er een bias te zijn dat patiënten die met CHOEP behandeld werden vaker ook ASCT kregen en wellicht mede daardoor een gunstiger uitkomst lieten zien.
Een meta-analyse van 5 studies uit Azië toonde geen verschil in response rate (CR, PR en ORR) tussen CHOEP en CHOP, maar wel een toename in toxiciteit t.a.v. anemie en trombocytopenie ten nadele van CHOEP. Een recente retrospectieve analyse van 1427 patiënten met nTCL gediagnosticeerd in Nederland tussen 1989 en 2018 toont een hogere 5-jaarsoverleving voor patiënten na behandeling met CHOEP vs. CHOP (64% vs 44%, p<0.01), echter na correctie voor leeftijd, subtype en consolidatie met ASCT was de overleving gelijk voor CHOEP en CHOP. O.b.v. deze data is de werkgroep van mening dat er onvoldoende bewijs is dat de standaardtoevoeging van etoposide aan inductiebehandeling met CHOP voordeel geeft t.a.v. respons en overleving, terwijl dit wel aangetoond nadeel geeft t.a.v. hematologische toxiciteit. In enkele studies wordt een trend naar een betere event-free survival (EFS) of progression-free survival (PFS) gezien bij het toevoegen van etoposide aan CHOP (CHOEP) en soms worden betere response rates gemeld, maar niet in alle studies. Dit geldt met name voor jongere patiënten (< 60-65 jaar). Een betere OS wordt echter niet beschreven, met als uitzondering ALK-positief ALCL.4,5 CHOEP is wel significant toxischer dan CHOP.3 Derhalve is de behandeling met CHOEP alleen op zijn plaats is bij patiënten met ALK-positief ALCL.
Ook voor het toevoegen van rituximab aan CHOP zoals bij nTFHL in de praktijk wordt gedaan (zie C-5) is geen standaard indicatie.
Literatuur
Aanbevelingen C-3
Onderbouwing C-3 (SORT B)?
In de fase 3 gerandomiseerde, dubbel–blinde, placebo gecontroleerde ECHELON-2 studie werden patiënten met een CD30 positief (≥10%) perifeer T cel lymfoom gerandomiseerd tussen behandeling met brentuximab, cyclofosfamide, doxorubicine en prednisolon (BV-CHP) of CHOP. Patiënten met onder andere de volgende histologische entiteiten werden geïncludeerd: ALK-positief anaplastisch large cel lymfoom (ALCL), ALK-negatief ALCL, PTCL-NOS en nodaal TFH lymfoom (nTFHL). Er werd gestreefd naar inclusie van 75% ALCL. Patiënten kregen 6 of 8 cycli (ter beslissing van de behandeld arts) BV-CHP danwel CHOP à 21 dagen. Consolidatie met autologe stamceltransplantatie of radiotherapie was ter beslissing van de behandelend arts. 452 patiënten werden gerandomiseerd, waarbij het overgrote merendeel van de patiënten een ALCL had. Een minderheid van de patiënten kreeg ter consolidatie een autologe stamceltransplantatie. De 3-jaars PFS was 57% voor BV-CHP versus 44% voor CHOP, HR 0.71 (0.54-0.93, p=0.01). De 5-jaars PFS is 51% voor BV-CHP en 43% voor CHOP, HR 0.70 (0.53-0.91, p=0.007). Na 3-jaar is er voor overall survival (OS) HR van 0.66 (95% CI 0.46-0.95, p=0.02) in het voordeel van BV-CHP. Na 5 jaar is de HR voor overall survival 0.66 (0.43-1.01). Er werden meer complete remissies bereikt met BV-CHP (68%) versus CHOP (56%).
Uit multivariate analyse blijkt dat dit effect grotendeels was toe te schrijven aan ALCL patiënten en niet gold voor andere nTCL subtypes. Hoewel de ECHELON 2 studie een PFS en mogelijk OS (hoewel na 5 jaar follow up geen significant OS voordeel voor BV-CHP tov CHOP) voordeel laat zien ten faveure van BV-CHP, ontving in deze studie slechts een minderheid van de patiënten consolidatie met een autologe stamceltransplantatie en dit werd mogelijk vaker gegeven in de BV-CHP groep. Derhalve is niet duidelijk wat de toegevoegde waarde is van BV-CHP boven CHOP in geval van consolidatie met autologe stamceltransplantatie. Naast de ECHELON-2 studie zijn op dit moment geen andere data bekend over BV als eerste lijn behandeling voor nTCL. Brentuximab vedotin is daarom als eerste lijn behandeling alleen geregistreerd voor de behandeling van systemisch ALCL.
Met betrekking tot toxiciteit kwam diarree vaker voor bij BV-CHP (38%) dan bij CHOP (20%), grotendeels graad 1 en 2. Overige toxiciteit was niet verschillend tussen beide groepen, met name werd er geen verschil gezien in perifere sensorische neuropathie of neutropenie.
Tumorcellen met CD30-expressie wordt als positief gezien, ongeacht het percentage positieve cellen.
Literatuur
In de meerderheid (66-91%) van de patiënten met nTFHL is een EBV+ CD20+ B-celinfiltraat aanwezig.1,2,3,4,5,6,7,8 Derhalve was de hypothese dat het bestrijden van deze B-celkloon de uitkomsten bij nTFHL zou kunnen verbeteren. In een kleine studie van 25 patiënten liet de toevoeging van rituximab geen verbetering van de uitkomst zien.9 Echter, in een recente retrospectieve studie werd gezien dat in Nederland tussen 2014 en 2020 bij de patiënten (n=338) die meer dan één cyclus chemotherapie ondergingen, bij 44% rituximab werd toegevoegd aan CHOP; ook bij patiënten waarbij géén B-celinfiltraat werd aangetoond. Hoewel de ORR verbeterde, werd geen verbetering in PFS en OS gezien.10
De toevoeging van rituximab heeft dan ook géén aanvullende waarde. Indien er sprake is van een hoge virale load in perifeer bloed van EBV en EBV-positiviteit van CD20+ clonale B-cel in het weefsel, kan de toevoeging van rituximab worden overwogen.
Aanbeveling C-5
Onderbouwing C-5 (SORT B)
Ten aanzien van consolidatie met ASCT hebben enkele prospectieve niet-gerandomiseerde studies veelbelovende resultaten laten zien met 3- tot 5-jaars OS van 48-51% en 3- tot 5-jaars PFS van 36-44%, wat gunstiger uitkomsten waren dan historische data zonder ASCT. Ook een prospectieve niet-gerandomiseerde cohortstudie toonde een voordeel van ASCT t.a.v. zowel PFS als OS (hazard ratio voor survival 0.37, 95% confidence interval 0.15-0.89). En ook in de retrospectieve analyse van de Nederlandse Kanker Registratie werd een significant OS voordeel gezien voor de patiënten met vs. zonder ASCT (5-jaars overleving 84% vs. 31%, p<0.01).
Allogene stamceltransplantatie in de eerste lijn wordt niet aanbevolen, aangezien het potentiële voordeel dat dit heeft teniet wordt gedaan door transplantatie gerelateerde mortaliteit (TRM).
Literatuur
Aanbeveling C-6
Overweging C-6 (Sort C)
Ten aanzien van de behandeling en/of profylaxe is de literatuur zeer schaars. Opties die in de literatuur genoemd worden zijn hoge dosis methotrexaat (HD-MTX) intraveneus (i.v.), MTX intrathecaal (i.t.), cytarabine i.t., hoge dosis cytarabine, echter is er geen duidelijke voorkeur. Gezien de ervaring met andere lymfoomsubtypes met CZS-betrokkenheid lijkt voor nu HD-MTX een logische en verantwoorde keuze te zijn. Bij gelijktijdig systemische ziekte kan HD-MTX (3000mg/m2, in totaal 4 cycli) op dag 10 van CHOP worden gegeven naar analogie van de Richtlijn DLBCL. Indien met chemotherapie een goede remissie wordt bereikt en patiënt fit is kan consolidatie worden overwogen met BCNU/T/ASCT in plaats van BEAM/ASCT gezien de beperkte penetratie naar het brein van BEAM.
Literatuur

# Bij unfitte patiënten (niet-eligible voor BEAM/ASCT) kan mini-CHOP of CEOP worden overwogen.
& Gezien de slechte prognose kan bij ALK-positieve ALCL en een hoge IPI-score (4 of 5) kan consolidatie met BEAM/ASCT worden overwogen (expert opinion).
SAMENVATTING
Gezocht is naar literatuur op basis waarvan een uitspraak kan worden gedaan over de rol van radiotherapie bij deze ziekte. Met een incidentie in Nederland van ruim 200 per jaar verdeeld over alle subtypes en stadia (bron IKNL) is dit een zeldzame ziekte waarbij prospectief en/of gerandomiseerd onderzoek nauwelijks kan worden verricht. Er zijn dan ook geen prospectieve studies gevonden en een beperkte hoeveelheid gegevens met retrospectieve data, zie onderstaande tekst. Derhalve is het advies gebaseerd op de beschikbare literatuur, op expert opinion en deels gebaseerd op analogie redeneringen volgend uit de literatuur bij agressieve systemische B-cel non-Hodgkinlymfomen.
Aanbeveling D-1
Bij PTCL-NOS, nTFHL en ALCL stadium I en beperkt stadium II (redelijkerwijs binnen een of twee aaneengesloten lymfeklierstations) is het advies om een combinatie van chemotherapie gevolgd door radiotherapie toe te passen. Bij een complete metabole remissie is het advies 30 Gy involved-site radiotherapie te geven, en bij een partiele respons 30 Gy involved-site radiotherapie een boost tot 36 Gy op de PET-positieve restafwijking. De behandelmodaliteit (fotonen versus protonen) wordt bepaald op basis van de landelijke indicatieprotocollen maar zal gezien de te geven dosis en prognose van deze patiëntengroep meestal uit fotonen bestralingen bestaan. Achterwege laten van radiotherapie gaat gepaard met een lagere progressievrije overleving. Dit wordt derhalve niet standaard geadviseerd, maar kan worden overwogen indien op basis van de radiotherapievelden i.c.m. de leeftijd van patiënt er op voorhand onacceptabele toxiciteit wordt verwacht en wordt bij voorkeur op een MDO besproken en met patiënt zelf.
Onderbouwing D1 (SORT C)
Chen et al beschrijven 2786 patiënten met een PTCL-NOS welke tussen 2000 en 2016 in de SEER database zijn geregistreerd waarbij een propensity score matching is verricht om bij bestraalde patiënten (na chemotherapie, in alle gevallen combined modality treatment) matchende niet-bestraalde patiënten te identificeren. Daarnaast is een externe validatie verricht op een cohort dat in dezelfde periode in 2 Chinese centra werd behandeld. In het SEER cohort onderging 27.6% van de 844 patiënten met early stage disease radiotherapie. Er werd een voordeel gezien voor radiotherapie voor zowel OS als DFS zowel bij vergelijking van de totale groepen als na propensity matching als in het Chinese validatie cohort. De mediane survival in early stage patiënten is in bestraald patiënten meer dan 9 jaar versus krap 2 jaar in niet-bestraalde patiënten de vijfjaarsoverleving was 58% versus 35.1% in niet-bestraalde patiënten.
Rodriguez-Lopez et al deden een analyse op de Amerikaanse National Cancer Database waarin zij 3670 patiënten identificeerden met een st I-II nTCL behandeld tussen 1998 en 2012 met speciale aandacht voor de ALK-mutatiestatus. In de ALK-negatieve groep zitten patiënten met een PTCL-NOS als ook ALK- ALCL patiënten, patiënten met een primair cutaan lymfoom werden geëxcludeerd. De mediane dosis radiotherapie was 36 Gy (range 30.6-41.4) waarbij in de loop van de jaren de gegeven dosis afnam, in 1998 kreeg 45% > 36 Gy, in 2012 was dit nog 30%. Het gebruik van CMT nam af van 44% in 1998 tot 24% in 2012. In deze analyse was combined modality treatment met name van voordeel voor patiënten met een ALK-negatief nTCL maar veel minder voor patiënten met een ALK-positief lymfoom met een geschatte toename in 5-jaarsoverleving van 38% naar 56% voor ALK-negatief vs. 61% naar 72% voor ALK-positief.
Zhang beschrijft een kleine single centre groep van 34 patiënten met een st I/II PTCL-NOS behandeld tussen 2000 en 2010, 13 met chemotherapie alleen, 21 met CMT. De mediane bestralingsdosis was 48 Gy (range 22-56 Gy). Bij bulky disease werd nog een boost van 5-10 Gy gegeven. Patiënten met hogere IPI scores kregen CHOEP in plaats van CHOP maar de aantallen zijn klein. Ook in deze beperkte serie is er een voordeel voor het geven van CMT met een toename in de 3-jaars OS van 23.1% naar 49.7 %.
Aanbeveling D2
Bij PTCL-NOS, AITL en ALCL met bij diagnose bulky lokalisaties is het advies alleen te bestralen indien er een beperkte PET-positieve restafwijking aanwezig is (36 Gy). SORT C.
Onderbouwing D2 (SORT C)
Lee beschrijft een kleinere groep van 39 patiënten met stadium I en II T-cellymfoom behandeld tussen 1985 en 1998. Van hen ondergingen 24 CMT met doxorubicine gebaseerde chemotherapie en 15 werden alleen behandeld met chemotherapie. Twaalf van de 15 relapses bevonden zich in de initiële ziekte locatie, 7 van deze 12 waren ook bestraald, de andere 5 hadden alleen chemotherapie gekregen als initiële behandeling. Er was geen verschil in PFS en OS tussen beide groepen, in de CMT groep waren wel meer patiënten met bulky disease of een partiele respons. De radiotherapie compenseerde hier dus mogelijk voor negatieve kenmerken.
Aanbeveling D3
Bij uitgebreid st II en st III – IV is er geen standaard indicatie voor radiotherapie. De enige indicatie is een beperkte PET-positieve restafwijking bij presentatie. SORT C. Bij een beperkte rest van een initiële laesie is het niet nodig deze rest pathologisch te bevestigen. SORT C. Indien het een uitgebreide rest betreft is het advies de rest wel pathologisch te bevestigen alvorens te behandelen met 2de lijns therapie. SORT C (expert opinion). Advies is om alle patiënten met restlaesies in een multidisciplinair overleg te bespreken.
Onderbouwing D3 (SORT C)
Chen et al. beschrijven 2786 patiënten met een PTCL-NOS welke tussen 2000 en 2016 in de SEER database zijn geregisteerd waarbij een propensity score matching is verricht om bij bestraalde patiënten (na chemotherapie, in alle gevallen combined modality treatment) matchende niet-bestraalde patiënten te identificeren. Daarnaast is een externe validatie verricht op een cohort dat in dezelfde periode in 2 Chinese centra werd behandeld. In het SEER cohort onderging 6.8% van de 1924 patiënten met advanced stage radiotherapie. Er werd geen voordeel gezien voor radiotherapie voor OS of voor DFS.
Aanbeveling D4
Bij recidief ziekte of indien geen chemotherapie gegeven kan worden kan radiotherapie palliatief worden ingezet bij klachten gevende lokalisaties. Advies dosis en gebruikte fractionering is afhankelijk van het doelgebied en de geschatte prognose: bijvoorbeeld 5×4 Gy tot 10×3 Gy. SORT C.
Onderbouwing D4
Radiotherapie bij pijn bij kanker – Richtlijn – Richtlijnendatabase
Literatuur
Patiënten met een recidief of refractair nTCL na 1ste lijn hebben een sombere prognose met een mediane overleving van ongeveer 11.5 maanden. Recidief of residuele ziekte moet PA-bevestigd worden, inclusief CD30-kleuring. Bij fitte patiënten is de strategie curatief in opzet en bestaat uit re-inductie middels brentuximab-vedotin of platinum-gebaseerde chemotherapie, meestal gevolgd door consolidatie met auto- of allogene stamceltransplantatie. Er is geen standaardbehandeling voor niet-fitte patiënten die niet in aanmerking komen voor intensieve therapie.
Bij verdenking relapse excisiebiopt klier of betrokken weefsel met beoordeling door expert hematopatholoog, eventueel clonaal vergelijk met T-celclonaliteitsanalyse, herstadiëring middels PET-CT en eventueel beenmergbiopt op indicatie. Voor onderbouwing en literatuur zie modules A en B.
Aanbeveling E-2
Onderbouwing E-2 (SORT C)
De resultaten van stamceltransplantatie zijn beter bij chemogevoelige patiënten die een complete of partiele remissie bereiken.(2) Een vierde tot meer dan een derde van de patiënten gaan nooit over tot transplantatie wegens onvoldoende ziekte controle.(6) Bij geselecteerde fitte patiënten kan ook met (minimale) actieve ziekte een allogene stamceltransplantatie (alloSCT) overwogen worden. (2)
Er zijn geen prospectieve vergelijkende studies om de beste salvage chemotherapie te bepalen. Overall response rates zijn vaak onder de 50%, met zeldzame complete remissie en de duur van de response is meestal kort. (7,8) De Canadese studie Ly.12 toonde de non-inferiority van GDP in vergelijking met DHAP in een gerandomiseerde studie met 619 patiënten met agressieve lymfomen. (9) Een subgroepanalyse van deze studie betreft 59 recidiverende/refractaire nTCL van de drie subtypes. In dit cohort, was de ORR na 2 cycli salvage chemotherapie 36%, zonder verschil tussen DHAP (10/30, 33%) en GDP (11/29, 38%). (10) Een retrospectieve studie uit de British Columbia database analyseert de uitkomst van patiënten met R/R PTCL die een 2de lijnstherapie kregen met curatieve opzet. In dit uitgeselecteerde cohort van 114 patiënten kregen 83 patiënten GDP met een ORR van 61% (17% CR) en 12 patiënten kregen Brentuximab-vedotin. (11)
Brentuximab-vedotin monotherapie is effectief in R/R PTCL. In een fase II multicentrische studie gepubliceerd in 2014 met 35 patiënten met PTCL (waarvan 13 nTFH en 22 PTCL-NOS) was de ORR 41% (8 CR en 6 PR).(12) In de fase II studie met 58 patiënten met R/R ALCL, ORR met BV monotherapie was 86% en CR percentage was 57% (33 patiënten). Deze patiënten hadden geen BV gekregen in eerste lijn. (13) Vijf jaar follow-up van deze studie toont 79% OS en 57% PFS na 5 jaren. De mediane duur van respons was niet bereikt en een significant deel van de patiënten kregen een alloSCT ter consolidatie. (14)Een recente retrospectieve analyse van de IKNL-database toont zelfs een voordeel van BV over platinum-based chemotherapie in de 2de lijn (Nijland-groep, submitted). Het is belangrijk op te merken dat een subgroep van patiënten langdurig in remissie blijft met BV monotherapie. (12,15) Bij het bereiken van een CR (bijvoorbeeld na 3 cycli BV) valt te overwegen nog 2-3 cycli BV te geven ter consolidatie en bij aanhoudende CR verder een expectatief beleid te kiezen (expert opinion). De meerwaarde van langdurig behandelen met BV is onbekend en maximaal 16 cycli zijn beschreven, zeker gezien het frequent optreden van polyneuropathie bij hogere cumulatieve doses. Bij patiënten met een hoge HCT-CI is er dus een optie om af te zien van consolidatie middels allogene stamceltransplantatie na bereiken van complete remissie (CR).
Aanbeveling E-3
Onderbouwing E-3 (SORT C)
Voor patiënten in relapse na 1e lijns behandeling is consolidatie met een alloSCT een goede optie. Er lijkt geen verschil te zijn in uitkomst na alloSCT tussen nTCL sub-entiteiten. Graft versus T-cellymfoom werd aangetoond in verschillende studies op basis van het effect van DLI en het afbouwen van immuunsuppressie.(1) In een retrospectieve analyse van 1942 patiënten uit de EBMT en CIBMTR registers was er geen invloed van donorkeuze op de PFS, OS, relapse incidentie en non-relapse mortaliteit.(2)Significante voorspellers van inferieure OS en PFS bij multivariate analyse waren actieve ziektestatus bij transplantatie en verlaagde WHO performance status. CR bij transplantatie was geassocieerd met de beste uitkomst (3jaar PFS/OS: 57/68%), patiënten met een PR hadden bij transplantatie nog een PFS/OS van 47/58% en die getallen dalen tot 36/49% bij refractaire patiënten.(2) nTFHL (destijds AITL) was geassocieerd met een significant verminderd recidief risico en betere PFS in vergelijking met PTCL-NOS. (2) Een retrospectieve Franse studie toonde vergelijkbare resultaten in 147 patiënten met een alloSCT in de 2delijn, met een invloed van het aantal therapielijnen voor transplant.(3) Overige resultaten waren consistent met de EBMT/CIBMTR cohorten met name 3-jaar PFS rond 60% en 3-jaar OS van ongeveer 50%, relapse incidentie rond 20% (bijna uitsluitend in de eerste 2 jaren) en een 4-jaar non-relapse mortaliteit net onder de 30%.(2,3)
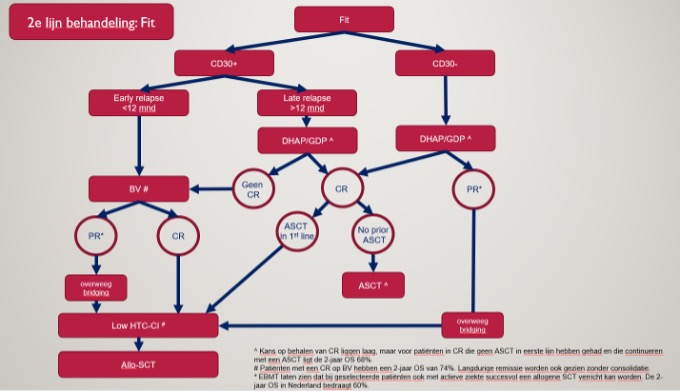

Aanbeveling E-4
Onderbouwing E-4 (SORT C)
Bij een niet-fitte patiënt met een CD30-positief PTCL en BV-naïef, valt BV te overwegen zoals beschreven is bij E2.
Bendamustine monotherapie werd geëvalueerd in een fase II studie met 60 R/R PTCL patiënten. In het intent-to-treat cohort, was de ORR 50%, met een CR van 28% en 22% had een PR.(16) Er zijn sindsdien geen opvolgende fase III studies uitgekomen. Er zijn geen data over het gebruik van bendamustine ter overbrugging naar een alloSCT.
In een fase II Franse studie werden 54 R/R PTCL patiënten behandeld met lenalidomide 25 mg 1x per dag 21 dagen per 28. Het totale responspercentage was 22% (12 van de 54), inclusief complete respons (CR) of onbevestigde CR (CRu) bij 11% van de patiënten; 31% van de patiënten met nTFHL (toen AITL) reageerde (CR/CRu bij 15% van de patiënten). De mediane PFS en de mediane responsduur waren respectievelijk 2,5 en 3,6 maanden bij de intent-to-treat-populatie en respectievelijk 4,6 en 3,5 maanden bij patiënten met nTFHL (toen AITL). (17) Er zijn geen data over het gebruik van lenalidomide ter overbrugging naar een alloSCT.
Gemcitabine monotherapie werd gegeven aan 20 patiënten met een recidief PTCL-NOS, met 30% CR en 25% PR. Bij de meerderheid van de patiënten die een CR bereikten was er sprake van lange ziektevrij interval (15 tot 120 maanden).(18)Gemox is ook een optie zoals gerapporteerd in 24 patiënten met nTCL (ORR 50.0% met 29.2% CR, 28% 2-jaar PFS en 49% 2-jaar OS). Ook in oudere/niet-fitte patiënten lijkt Gemox goed verdragen te zijn in de huidige beperkte literatuur. (19)
Voor nTFHL is cyclosporine een palliatieve optie gezien de onderliggende immunologische verschijnsels. Echter zijn er geen prospectieve data maar wel gepubliceerde casussen en expert opinies.(20) En voorbeeld schema is: 3-5 mg/kg PO bid voor 6-8 weken gevolgd door progressieve afbouw van 50 mg om de 1 à 3 weken, op geleide van de nierfunctie en/of de spiegels. (21)
Er is geen indicatie voor checkpointremmers wegens geen aangetoond effect en het risico op hyperprogressie. (22) Pralatrexate en epigenetische modulerende middelen zoals azacitidine, romidepsine en belinostat zijn goedgekeurd door de FDA maar niet door de EMA wegens onvoldoende bewijs van hun effect. (23) Er zijn geen gegevens om deze middelen aan te bevelen.
Literatuur
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie, Nederlandse Vereniging voor Radiotherapie en Oncologie, Nederlandse Vereniging voor Pathologie, Nederlandse Werkgroep voor Hematopathologie (inclusief vertegenwoordiging klinisch-moleculair biologen in de pathologie), Belgische Vereniging voor Radiotherapie-Oncologie, Nederlandse Vereniging voor Cytometrie
Nederlandse Werkgroep voor Hematopathologie (NWHP) namens de Nederlandse Vereniging voor Pathologie (NVVP), Nederlandse Vereniging voor Radiotherapie (NVRO), Belgische Vereniging voor Radiotherapie-Oncologie, Nederlandse Vereniging voor Cytometrie, patiëntenorganisatie Hematon