Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek en behandeling. Hierbij is beschreven wat de diagnostiek en behandelingsmogelijkheden zijn met hun effectiviteit en invloed op kwaliteit van leven. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie gehouden in het veld bij professionals en patiënten (vertegenwoordigers). De meest relevante knelpunten zijn uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostische, therapeutisch en follow-up beleid van patiënten met PNH. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht daarmee een betere uniformiteit van behandeling en daarmee een betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn geeft aanbevelingen over, of kan worden gebruikt bij, het geven van voorlichting aan patiënten. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met PNH, zoals internist-hematologen, internisten, maag-darm-leverartsen, nefrologen, neurologen, gynaecologen, chirurgen, urologen, transfusieartsen, radiologen, klinisch chemici en huisartsen.
Werkgroepleden richtlijn (landelijke werkgroep PNH / NVvH):
Met inbreng van:
De werkgroep die zich bezig heeft gehouden met de richtlijn ontwikkeling bestaat uit de leden van de Landelijke Werkgroep PNH, die sinds maart 2013 4 x per jaar bij elkaar komen voor overleg over de begeleiding van patiënten met PNH, het bespreken van wetenschappelijk onderzoek en het bevorderen van kennis over PNH bij de werkgroepleden onderling en collega’s uit elke regio. De werkgroep wordt voorgezeten door de internist-hematoloog van het Radboudumc Expertisecentrum PNH. De hoofden van de afdelingen hematologie van de UMC’s en het hoofd van de afdeling kinderhematologie van het UMCU hebben ieder een vast vertegenwoordigend staflid hematoloog als lid van de werkgroep aangewezen; twee vaste vertegenwoordigers van de Stichting AA & PNH contactgroep maken eveneens deel uit van de werkgroep. Vanuit deze werkgroep zijn overige specialisten benaderd, die vanuit hun aandachtgebied, zoals de immunologie en transfusiegeneeskunde inzicht hebben in specifieke aspecten van de diagnostiek en behandeling van PNH.
De werkgroep werkte gedurende 1 jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De werkgroepleden hebben inzicht gegeven in relaties en belangen van met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn (zie tabel hieronder).
|
Dr. Petra Muus |
Alexion Ra Pharma |
Sprekersfee, Consulting Consulting |
|
Dr. Saskia Langemeijer, |
– |
– |
|
Dr. Stijn Halkes |
– |
– |
|
Prof. dr. Sacha Zeerleder |
Alexion Viropharma |
Consulting Consulting |
|
Prof. dr. Harry Schouten |
Alexion |
Vergoeding voor bijwonen symposium, vergoeding lid personeel, fondsen voor onderzoek |
|
Dr. Peter te Boekhorst |
Alexion |
Sprekersfee |
|
Dr. Bart Span |
Alexion |
Vergoeding voor bijwonen symposium, sprekersfee, vergoeding voor organiseren onderwijs |
|
Dr. Moniek de Witte |
– |
– |
|
Dr. Marije Bartels |
– |
– |
|
Angeline Jansen |
– |
– |
|
Andrea Stiene |
– |
– |
|
Dr. Frank Preijers |
Alexion |
Sprekersfee, vergoeding organiseren onderwijs, fondsen voor onderzoek |
|
Dr. Lizzy van Pampus |
– |
– |
|
Drs. Dorothea Evers |
– |
– |
|
Dr. Marten Nijziel |
– |
– |
|
Dr. Britta Laros |
Alexion |
Vergoeding voor bijwonen symposium |
|
Dr. Olivier van der Heijden |
– |
– |
De schriftelijke belangenverklaringen kunt u bij het secretariaat van de Nederlandse Vereniging voor Hematologie inzien.
Methode ontwikkeling
Evidence based. Indien consensus based is dit is bij de uitgangsvraag weergegeven.
Werkwijze
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline, Pubmed, Cochrane en, zo nodig, Embase. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag. Daarnaast is gebruik gemaakt van internationale expertise op het gebied van PNH zoals neergelegd van bestaande richtlijnen op het gebied van PNH. Tevens zijn de Samenvatting van de productkenmerken (SMPC) van het registratiedossier van Eculizumab en de European Public Assessment Report (EPAR) en de extension of indication variation assessment report van de European Medicines Agency (EMA) gebruikt.
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast wordt er een toelichting op de richtlijn aangeboden aan het Nederlands tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de website van de NVvH.
In deze richtlijn worden de patiënten vertegenwoordigd door twee afgevaardigden van de Stichting AA & PNH contactgroep.
PNH is een zeldzame verworven beenmergziekte met een zeer variabel klinisch beeld. De belangrijkste kenmerken zijn intravasculaire hemolyse, een sterk verhoogde kans op trombose en cytopenieën (Brodsksy, Blood 2014). Naar schatting worden jaarlijks 1-2 per 1.000.000 mensen gediagnosticeerd met PNH. In de Nederlandse PNH registratie (onderdeel van de internationale PNH registratie) zijn tot op heden 125 patiënten geïncludeerd. Dit betreft een onderschatting van het totale aantal patiënten in Nederland. Patiënten met PNH kunnen klachten hebben van onder meer ernstige vermoeidheid, dyspnoe, buikpijn, erectiele dysfunctie, dysfagie, icterus en donkere verkleuring van de urine. De ziekte gaat samen met een wisselende mate van beenmergfalen. Soms is er bij diagnose een onderliggende beenmergziekte zoals aplastische anemie (AA) of myelodysplastisch syndroom (MDS). Soms ontwikkelt een AA, MDS of leukemie zich later in het beloop van de ziekte. Onbehandelde PNH patiënten hebben een verminderde kwaliteit van leven en een verkorte levensverwachting. Trombose is de meest voorkomende oorzaak van permanente morbiditeit en mortaliteit bij onbehandelde PNH patiënten. Belangrijke andere complicaties zijn nierfunctiestoornissen en pulmonale hypertensie. Chronische vermoeidheidsklachten komen vaak voor en beperken de patiënten in studie, werk en andere activiteiten. De diagnose PNH wordt vaak pas laat gesteld door het geleidelijke ontstaan, de presentatie met aspecifieke symptomen en de onbekendheid met het ziektebeeld. Patiënten hebben vaak al een traject achter de rug waarbij zij hun activiteiten geleidelijk hebben moeten aanpassen. Dit kan leiden tot veel onbegrip in de omgeving van patiënt en ongewenste vertraging van de behandeling. Behandeling dient er op gericht te zijn om de complicaties van PNH te voorkomen, de transfusieafhankelijkheid te verminderen, de kwaliteit van leven te verbeteren en de levensduur van de patiënten te verlengen.
PNH ontstaat door een verworven mutatie in het PIG-A gen in de hematopoietische stamcel. Door deze mutatie wordt de vorming van het glycosylphosphatidylinositol (GPI)-anker verstoord in alle cellen afkomstig van deze stamcel. Hierdoor komen GPI-verankerde eiwitten verminderd of helemaal niet meer tot expressie op de celmembraan van de bloedcellen. De afwezigheid van twee van deze eiwitten (CD55 en CD59) op de membraan van de erytrocyt leidt tot complement-gemedieerde hemolyse. Patiënten kunnen een kleine tot zeer grote kloon PNH cellen bij zich dragen. De grootte van de PNH kloon is een van de factoren die bijdraagt aan de variabiliteit van het klinische beeld. In de loop van de tijd kunnen zich binnen de patiënt veranderingen voordoen in de kloongrootte en ook in de mate van beenmergfalen. Daarmee veranderen dan ook de symptomen.
PNH is een zeldzame beenmergziekte met een incidentie van naar schatting 1-2:1.000.000 nieuwe patiënten per jaar. Sinds 2009 tot begin 2016 werden in de Internationale PNH registratiestudie (coördinatie in Nederland: Radboudumc Expertisecentrum PNH) 125 Nederlandse patiënten met een PNH kloon geïncludeerd. Dit geeft een onderschatting van de totale incidentie en prevalentie aangezien nog niet in heel Nederland deelname aan de registratiestudie wordt aangeboden.
De mediane leeftijd van patiënten bij diagnose is jong (30-45 jaar). PNH kan echter op alle leeftijden ontstaan. In de periode voor het beschikbaar komen van complementinhibitors was de mediane overleving van patiënten beperkt tot 10-23 jaar met trombose als belangrijkste oorzaak van overlijden (Ware et al NEJM 1991, Hillmen et al NEJM 1995, Socié et al Lancet 1996, Nishimura et al Medicine 2004, de Latour et al Blood 2008). Gezien de zeldzaamheid van de ziekte is er tot nu toe geen landelijke uniformiteit wat betreft de diagnostiek en behandeling van patiënten met PNH.
Het beschikbaar komen van de eerste complement C5 inhibitor (eculizumab/Soliris) heeft grote gevolgen voor de behandeling van patiënten met PNH. Gezien de aard van de behandeling (onder meer de levenslange behandelduur, 2-wekelijks infuus, infectierisico en het feit dat weer stoppen van de medicatie een extra verhoogd risico op trombose en mogelijk massale hemolyse induceert) en gezien de kosten van de behandeling, is de identificatie van patiënten die baat hebben bij deze behandeling van het grootste belang. Hierbij spelen een goede registratie van patiënten en centralisatie van de behandeling een belangrijke rol.
De geschetste knelpunten, de grote veranderingen in diagnostiek en behandeling, nieuwe ontwikkelingen en de betrokkenheid van diverse disciplines bij de behandeling maken een uniforme richtlijn, die door de verschillende beroepsgroepen gedragen wordt, noodzakelijk.
Bovengenoemde overwegingen waren voor de landelijke werkgroep PNH aanleiding een richtlijn te ontwikkelen voor het beleid bij PNH.
Diagnostiek
Behandeling
Het ziektebeeld PNH heeft vier pijlers: 1) hemolyse, 2) beenmergfalen, 3) tromboseneiging en 4) er kan een andere beenmergziekte zijn. Elk van deze 4 pijlers afzonderlijk dan wel gecombineerd kunnen bij individuele patiënten het klinisch beeld bepalen. Relatief vaak is er bij diagnose van een aplastische anemie een PNH kloon of ontstaat deze na een (behandelde) aplastische anemie. Ook bij een (met name hypoplastisch) myelodysplastisch syndroom komt een PNH kloon vaker voor.
De diagnose PNH moet op tijd worden gesteld, zodat het juiste beleid en follow-up kunnen worden bepaald, complicaties zo mogelijk kunnen worden voorkomen en patiënten op een juiste manier behandeld kunnen worden.
AanbevelingenDiagnostiek naar PNH dient verricht te worden bij patiënten met een van de volgende verschijnselen:
Diagnostiek naar PNH moet overwogen worden bij:
|
Onderbouwing:
Inleiding
Het stellen van de diagnose PNH wordt vaak bemoeilijkt door het geleidelijke ontstaan, de vaak aspecifieke symptomen en onbekendheid met het ziektebeeld. Dit kan leiden tot belangrijke vertraging van de behandeling.
Samenvatting literatuur
Er waren naar inschatting van de werkgroep weinig relevante klinische studies. Er werd gebruik gemaakt van andere recente en internationale richtlijnen, aangevuld met expert opinion en reviews
|
SORT Grade |
Conclusie |
|
C |
1 t/m 4 (donkere urine t/m trombose) (ref 2,3,6,9,10,11) |
|
A-B |
5 (aplastische anemie ) (ref 5,7) |
|
B |
6 (hypoplastisch myelodysplastisch syndroom) (ref 1, 2,6,9) |
|
C |
7-12 (onverklaarde klachten) t/m myeloproliferatief neoplasma) (ref 2 t/m 11) |
Literatuur
Het klinisch beeld van patiënten met PNH kan erg variëren. Een anemie is bij de meerderheid van de patiënten aanwezig bij diagnose. Veel voorkomende klachten zijn onder meer moeheid, buikpijn, dyspnoe, hoofdpijn, donkere verkleuring van de urine en erectiestoornissen. Bij kinderen moet ermee rekening gehouden worden dat het voorkomen en rapporteren (soort, ernst) van somatische verschijnselen afhankelijk is van de leeftijd en ontwikkelingsfase van het kind. Bij kinderen staan in het algemeen moeheid en buikpijn op de voorgrond.
Lastig is dat het veelal aspecifieke klachten betreft. Ook een meer specifieke klacht, zoals donkere verkleuring van de urine, treedt lang niet bij alle patiënten op en leidt ook niet altijd tot een diagnose PNH, onder meer door het intermitterende karakter. De patiënt meldt hierdoor de klacht niet of de donkere urine wordt geduid als hematurie in plaats van hemoglobinurie en er vindt geen verdere analyse plaats wanneer aanvullend onderzoek zoals een cystoscopie geen afwijkingen oplevert. De frequentie en mate waarmee de donkere urine optreedt, hangt onder meer af van de ernst van de hemolyse.
Ongeveer 50% van de patiënten met PNH ontwikkelt een trombose. Soms is een trombose de eerste uiting van de ziekte. Aangezien behandeling met eculizumab, indien prompt gestart bij een PNH-gerelateerde trombose, de uitbreiding van de trombose tot staan kan brengen en de schade mogelijk kan beperken, is een trombose (dwz een arteriële of veneuze trombose op ongebruikelijke plaats of trombose met tekenen van hemolyse of trombose met een onverklaarde cytopenie of trombose tijdens adequaat ingestelde antistolling) een spoedindicatie voor diagnostiek naar PNH.
Een PNH kloon wordt gedetecteerd bij ongeveer 50% van de patiënten met aplastische anemie. Dit kan een zeer kleine maar ook een zeer grote PNH kloon betreffen. Door de verminderde erytropoiese staat de hemolyse vaak niet op de voorgrond. De PNH kloongrootte kan gedurende de follow-up van patiënten met aplastische anemie veranderen. Bij patiënten met aplastische anemie moet dus altijd gekeken worden naar de aanwezigheid van een PNH kloon en moet dit onderzoek in de loop van de tijd worden herhaald, ook als er bij diagnose aplastische anemie geen PNH clone aangetoond kon worden (dit wordt uitgebreider besproken in de richtlijn aplastische anemie). Ook bij het myelodysplastisch syndroom, met name een hypoplastisch myelodysplastisch syndroom (bij kinderen een refractory cytopenia of childhood), wordt relatief vaak een PNH kloon gedetecteerd (tot 50% bij hypoplastische mds). Bij een aantal andere beenmergaandoeningen is ook beschreven dat deze samen kunnen gaan met een PNH kloon, maar dit komt minder frequent voor.
Er is geen onderzoek gedaan naar de incidentie van PNH onder zwangere vrouwen die lijden aan pre-eclampsie. Andersom zijn er wel case-reports en case-series van vrouwen met PNH die pre-eclamspie doormaken en soms wordt de diagnose PNH ook pas op dat moment gesteld.
Uitgangsvraag 2:
Hoe wordt de diagnose PNH bevestigd?
|
Aanbevelingen: Om de diagnose PNH te bevestigen moet het volgende onderzoek worden ingezet: Flowcytometrie op een vers perifeer bloedmonster waarbij afwezigheid (type III cellen) of verminderde aanwezigheid (type II cellen) van GPI- verankerde eiwitten op ten minste de granulocyten en monocyten wordt aangetoond. Hierbij maakt men gebruik van 1) met een fluorochroom gelabelde monoklonale antilichamen tegen meerdere GPI-verankerde eiwitten en 2) FLAER, een reagens (een niet-lyserend gemuteerd bacterieel product genaamd proaerolysine) dat direct bindt aan het GPI-anker en dat geconjugeerd is met het fluorochroom Alexa 488. Het totaal gemeten percentage granulocyten, waarop de GPI-verankerde eiwitten verminderd of niet aanwezig zijn, is bepalend voor de PNH kloongrootte. De percentages type II en type III cellen worden hiertoe bij elkaar opgeteld. Als het percentage PNH monocyten hoger is dan het percentage PNH granulocyten, is het percentage PNH monocyten bepalend voor de PNH kloongrootte. De kwantificering van de PNH kloon vereist expertise. Naast het uitvoeren van de juiste controles voor waarborging van een goede analyse, is het van belang deel te nemen aan een extern kwaliteitscontrole programma, waarin de eigen uitvoering van de meting en verkregen resultaten getoetst worden en vergeleken worden met die van andere deelnemende instituten. |
Onderbouwing:
Inleiding
Met de komst van de flowcytometrie zijn de sucrose hemolyse test en Acid Ham’s test bij de diagnostiek van PNH in onbruik geraakt. Een betrouwbare bepaling van de kloongrootte is belangrijk om te beoordelen in hoeverre op dat moment de PNH kloon bepalend is voor het ziektebeeld en om de ziekte te vervolgen.
Samenvatting literatuur
Recent is een aantal goede protocollen gepubliceerd, waarin aanbevelingen gedaan worden voor alle facetten van de flowcytometrische bepaling van zowel grote als kleine PNH celklonen. Deze protocollen zijn verwerkt in bovenstaande aanbevelingen, er is geen systematische literatuurstudie gedaan.
Conclusies
|
SORT Grade |
Aanbeveling |
|
A |
Diagnostiek door middel van flowcytometrie (ref 1-6) |
Literatuur
Overwegingen:
PNH is een verworven hematopoietische stamcelziekte die het gevolg is van een mutatie van het X-chromosoom gebonden PIG-A gen (phosphatidyl-inositol glycaan Klasse A). In gezonde personen codeert dit gen voor de productie van een enzym dat betrokken is bij de eerste stappen van de glycofosfatidyl-inositol (GPI) biosynthese. Het GPI is een geglycosyleerd ankereiwit, waarmee o.a. eiwitten die de cel beschermen tegen geactiveerd complement aan de celmembraan verankerd zijn. Door het ontbreken van ankers missen PNH cellen deze beschermende eiwitten en treedt complement gemedieerde hemolyse op. Deze verankerde eiwitten kunnen geïdentificeerd en gekwantificeerd worden met behulp van een flowcytometrische bepaling met fluorochroom-gelabelde monoklonale antilichamen (MoAbs) tegen deze eiwitten, bv CD59 en CD55. Daarnaast kan met behulp van FLAER, een fluorochroom (Alexa 488)-geconjugeerde versie van het gemuteerde bacterieproduct, aerolysine, direct de aan of afwezigheid van het GPI-anker worden onderzocht. FLAER heeft een grotere gevoeligheid voor de detectie van PNH granulocyten en monocyten. FLAER is niet bruikbaar voor de detectie van PNH erytrocyten. Men kan met flowcytometrie aldus de populatie granulocyten, monocyten of erytrocyten bepalen en meet per celtype het percentage cellen dat een normale dichtheid van verankerde eiwitten draagt. Voor de diagnose PNH is meting in ten minste de granulocyten en monocytenfractie nodig. Het percentage PNH erytrocyten wordt onder andere beïnvloed door 1) de mate van hemolyse, 2) recente erytrocyten transfusies en 3) aanmaakstoornis (beenmergfalen).
De bepaling van het percentage PNH cellen in verschillende cellijnen
Celbron: De bepaling dient uitgevoerd te worden in met EDTA of heparine ontstold perifeer bloed dat bij voorkeur vers is, maar in ieder geval niet ouder is dan 48 uur voor de bepaling van PNH celklonen in granulocyten en monocyten en 7 dagen in geval van de erytrocyten. Bloed dient bewaard te worden bij 4-8 graden Celsius. Beenmerg is minder geschikt als celbron omdat hierin immature celpopulaties voorkomen, die ook bij gezonde individuen een lagere dichtheid hebben van verschillende GPI-gebonden eiwitten en dus ten onrechte als PNH cellen zouden kunnen worden geïnterpreteerd.
Neutrofielen en monocyten
a: Selectie van neutrofielen en monocyten
Na lyseren van de erythrocyten worden sequentieel de neutrofielen en monocyten geselecteerd met behulp van cellijn-specifieke MoAbs gericht tegen niet-GPI-verankerde eiwitten.
b: Detectie en kwantificering van PNH neutrofielen en PNH monocyten
De PNH cellen binnen de geselecteerde neutrofielen en monocyten populaties dienen bepaald te worden met behulp van MoAbs gericht tegen de GPI-verankerde eiwitten op deze cellen (CD24 voor neutrofielen en CD 14 voor monocyten). Voor een hoge gevoeligheid van de bepaling dienen per celtype tenminste twee conjugaten gericht tegen GPI-verankerde eiwitten gebruikt te worden (neutrofielen CD24 in combinatie met FLAER; voor monocyten CD14 in combinatie met FLAER).
Tabel 1. Voorbeelden van kleuren-combinaties van MoAbs en FLAER voor de detectie en kwantificeren van een PNH kloon in neutrofielen en monocyten.
|
Conjugaat |
|||||||
|
|
Celpopulatie |
1 |
2 |
3 |
4 |
5 |
6 |
|
4-kleur |
Granulocyten |
FLAER |
CD24 |
CD15 |
CD45 |
|
|
|
|
Monocyten |
FLAER |
CD14 |
CD33 of CD64 |
CD45 |
|
|
|
5-kleur |
Gran + Mono |
FLAER |
CD157 |
CD15 |
CD33 of CD64 |
CD45 |
|
|
6-kleur |
Gran + Mono |
FLAER |
CD14 |
CD24 |
CD15 |
CD33 of CD64 |
CD45 |
Erytrocyten
a: Selectie van erytrocyten
Om de rijpe erytrocyten van de reticulocyten te kunnen scheiden wordt CD235a (anti-glycopherine A) geconjugeerd aan het fluorochroom FITC gebruikt, in een zo laag mogelijke concentratie om storende aggregatie van de erythrocyten te voorkomen.
b: Detectie en kwantificering PNH erytrocyten
CD235a kan gecombineerd worden met CD55-PE en/of CD59-PE. CD55 heeft echter minder onderscheidend vermogen dan CD59 voor de detectie van type II en type III cellen zodat CD59 de voorkeur heeft. FLAER kan niet gebruikt worden voor de detectie van PNH erytrocyten.
Uitgangsvraag 3:
Welke aanvullende onderzoeken moeten verricht worden als bij een patiënt voor het eerst een PNH kloon wordt geconstateerd?
|
Aanbevelingen: Aandachtpunten anamnese: Doorgemaakte trombose (arterieel, veneus) of embolie, klachten die kunnen passen bij een in gang zijnde trombose, eerder gediagnosticeerde beenmergziekte en behandeling, zwangerschappen/operaties en eventuele complicaties, tekenen van verhoogde infectiegevoeligheid en bloedingsneiging, PNH-gerelateerde klachten: moeheid (aantal uren slaap per dag), dyspnoe, kleur en helderheid van de urine (meegebracht urinemonster zelf zien), icterus, buikpijn, slikklachten, erectiestoornissen, verminderd concentratievermogen, functioneren school/werk/sociaal, factoren die aanleiding (kunnen) zijn tot verhoogde afbraak (bijvoorbeeld infectie). Aandachtspunten lichamelijk onderzoek: Bloeddruk, pols, icterus, dyspnoe, hart, vaten, lever -en milt-grootte, mogelijke tekenen van doorgemaakte trombose (zoals bijvoorbeeld unilateraal oedeem of neurologische uitvalsverschijnselen). Aandachtspunten laboratoriumonderzoek: Basis: Bloedgroep, bloedgroep antistoffen, Hb, Ht, erytrocyten, leukocyten, trombocyten, reticulocyten, MCV, microscopische differentiatie, directe antiglobuline test, elektrolyten, kreatinine, eGFR, urinezuur, ureum, bilirubine totaal en direct, AF, ASAT, ALAT, gGT, LDH, haptoglobine, CRP, , Fe, TIJBC of transferrineverzadiging, ferritine, virusserologie (parvovirus B19). Urine : onderzoek op eiwit en vrij hemoglobine. Te overwegen: virusserologie voor Hepatitis B, C, CMV, Toxoplasmose, HIV. ANA, erytropoietine, vitamine B12, indien laag: methylmalonzuur. Totaal eiwit en spectrum, M-proteine, TSH, zwangerschapstest, D-dimeer. Aandachtspunten aanvullend onderzoek: Basis: Beenmergaspiraat en beenmergbiopt . Ten behoeve van: morfologie, flowcytometrie en cytogenetica; uitsluiten van onderliggende beenmergziekte, beoordelen van cellulariteit, eventuele hyperplasie (vaak in de erytroide reeks) en hypoplasie (vaak in de myeloide en megakaryocytaire reeks), dysplasie, (zeer vaak in de rode, maar ook wel in myeloide en megakaryocytaire reeks, ijzervoorraad. Echo/CT abdomen (aanwijzingen voor doorgemaakte arteriële of veneuze trombose, collateraalvorming, galsteenlijden, miltgrootte), ECG, X-thorax. Te overwegen: Onderzoek bloed naar Fanconi (bij patiënten < 40 jaar en aanwijzingen voor beenmergfalen), onderzoek naar pulmonale hypertensie. |
Onderbouwing:
Inleiding
Het klinisch beeld van patiënten met PNH kan zeer variëren. Tot nu toe was er nog geen standaard advies met betrekking tot de te verrichten onderzoeken bij nieuwe patiënten met PNH.
Samenvatting literatuur
De aanbevelingen zijn gedaan op basis van bestaande richtlijnen, reviews en expert opinie. Er waren naar inschatting van de werkgroep weinig relevante klinische studies. Er werd gebruik gemaakt van andere recente en internationale) richtlijnen, aangevuld met expert opinion en reviews
Conclusie(s)
|
SORT Grade |
Aanbeveling |
|
C |
Aandachtspunten anamnese (ref 1, 5, 6) |
|
C |
Aandachtspunten lichamelijk onderzoek (ref 1, 2, 4-6) |
|
C |
Aandachtspunten laboratoriumonderzoek (ref 1, 2, 4, 5) |
|
B |
Aandachtspunten aanvullend onderzoek (ref 1-5) |
Literatuur
Overwegingen:
Bij elke nieuwe patiënt met een PNH kloon moet middels gerichte anamnese, lichamelijk onderzoek en aanvullend onderzoek informatie verkregen worden over welke van de 4 pijlers (hemolyse, beenmergfalen, trombose, andere beenmergziekte) op dat moment de kliniek bepaalt of bepalen. Daarnaast moet aandacht worden besteed aan de impact van de ziekte op het leven van de patiënt (lichamelijk, psychosociaal en maatschappelijk). Het is belangrijk patiënt te attenderen op het bestaan van de Stichting AA & PNH Contactgroep (website: www.aaenpnh.nl) .
Aandacht voor de medische voorgeschiedenis is onder meer belangrijk omdat PNH soms met aspecifieke klachten kan beginnen en vaak al langer aanwezig is dan aanvankelijk werd gedacht. Bij een in het verleden doorgemaakte trombose of embolie is het essentieel om zo goed mogelijk te bepalen of deze PNH-gerelateerd kan zijn. Een trombose die lang geleden optrad en waarbij bijvoorbeeld duidelijk andere uitlokkende factoren aanwezig waren, hoeft niet altijd direct het behandelbeleid met betrekking tot de PNH te beïnvloeden.
Niet iedere patiënt bij wie een PNH kloon gemeten wordt, hoeft hier ook direct voor behandeld te worden. Om te beoordelen of en welke behandeling van PNH geïndiceerd is, is het belangrijk te kijken naar de bij de diagnostiek genoemde pijlers, te weten: 1) de mate van hemolyse, 2) de mate van beenmergfalen, 3) de tromboseneiging en 4) de aanwezigheid van een andere beenmergziekte. De grootte van de PNH kloon speelt hierbij een belangrijke rol, maar is niet allesbepalend. Zo kan de ene patiënt met een kloongrootte van bijvoorbeeld 30% nauwelijks tekenen van hemolyse hebben, een vrijwel normaal bloedbeeld en geen trombose, terwijl een andere patiënt met een kloongrootte van 30% een vena porta trombose heeft doorgemaakt, wat wel om een specifieke behandeling vraagt. Het vervolgen van patiënten met een PNH kloon is belangrijk, omdat het aspect van het ziektebeeld in de loop van de tijd vaak verandert en dus aanpassing van de behandeling noodzakelijk kan maken (bespreking in uitgangsvraag 12).
Gezien de zeldzaamheid van het ziektebeeld en de hiermee samenhangende beperkte studies op het gebied van behandeling, wordt aanbevolen het behandelplan op te stellen en bij te stellen in overleg met een PNH expertisecentrum. Onderstaand schema geeft de behandelingsmogelijkheden aan per pijler en tevens bij welke uitgangsvraag de behandelingen besproken worden.
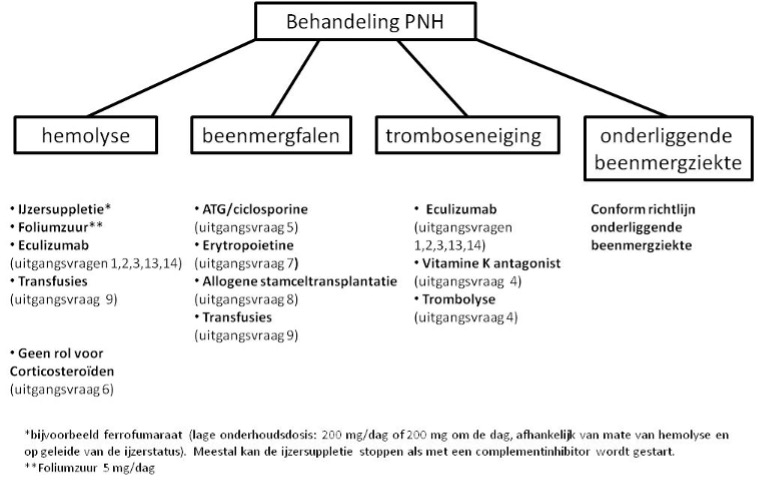
Naast de bovengenoemde pijlers van de behandeling van PNH is er een aantal bijzondere situaties waarin speciale maatregelen noodzakelijk zijn, te weten zwangerschap (bespreking in uitgangsvraag 10) en operaties (bespreking in uitgangsvraag 11). Daarnaast zijn er specifieke aandachtspunten bij kinderen (uitgangsvraag 15).
Het is verder van belang om patiënten te wijzen op het bestaan van de patiëntencontactgroep (website: www.aaenpnh.nl)
Uitgangsvraag 1:
Wat zijn de indicaties voor behandeling met eculizumab?
|
Aanbeveling PNH patiënten in een of meer van onderstaande categorieën hebben een indicatie voor behandeling met eculizumab.
|
Onderbouwing:
Inleiding
PNH patiënten hebben een verminderde kwaliteit van leven en een verkorte overlevingsduur (Ware et al. NEJM 1991, Hillmen et al. NEJM 1995, Socie et al. Lancet 1996, Nishimura et al. Medicin 2004, de Latour et al. Blood 2008). De meest voorkomende oorzaak van blijvende schade en overlijden bij onbehandelde PNH patiënten is trombose (Socie et al. Lancet 1996, Ziakas et al. J Thromb Hemost 2007). Belangrijke andere complicaties zijn onder meer nierfunctiestoornissen en pulmonale hypertensie. De vermoeidheidsklachten leiden bij veel patiënten , tot een verminderde kwaliteit van leven. Jonge mensen kunnen hierdoor bijvoorbeeld hun studie niet voltooien of het vinden en behouden van een baan levert problemen op. Zwangerschap bij patiënten met PNH werd tot voor kort afgeraden in verband met een groot risico op mortaliteit en morbiditeit voor moeder en kind (Ziakas et al. J Thromb Hemost 2007, de Guibert et al, Haematologica 2011).
Eculizumab (Soliris) is een gehumaniseerd monoklonaal (IgG1/2kappa) antilichaam en blokkeert de activatie van complement C5 naar C5a en C5b. Eculizumab is het eerste geregistreerde geneesmiddel om de complement-gemedieerde hemolyse bij PNH te behandelen.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
A |
PNH met ernstige hemolyse, leidend tot transfusie-afhankelijkheid (ref 1, 2, 4, 5, 8-15) |
|
A/B |
Een PNH-gerelateerde trombose (ref 6, 8-11, 13) |
|
B |
Hemolyse-geassocieerde complicaties; nierfalen en/of pulmonale hypertensie (ref 3, 7-10) |
|
B |
Zwangerschap (vanaf 2e trimester of eerder in geval van verergering van de hemolyse) (ref 12) |
|
B |
PNH met ernstige hemolyse en PNH-gerelateerde symptomen, die in grote mate interfereren met de kwaliteit van leven. (ref 1, 2, 4, 5, 9, 10, 14) |
|
C |
Uitzonderlijke gevallen, na overleg met tenminste 2 andere PNH-experts |
Samenvatting literatuur
Resultaten
In de eerste pilot studie met Eculizumab (Hillmen et al, NEJM 2004) en vervolgens de 1-jaar follow-up studie (Hill et al, Blood 2005), werden 11 patiënten behandeld met eculizumab. Alle patiënten waren transfusie-afhankelijk (minimaal 4 eenheden erytrocyten gedurende de 12 maanden voor start van de behandeling). Het LDH voor start was sterk verhoogd met een gemiddelde van 3111 U/L en daalde na start van de behandeling tot een gemiddelde van 594 U/L (bij 12 weken follow-up). De transfusiebehoefte daalde van 1,8 (mediaan) units erytrocyten per maand naar 0,3 units per maand bij evaluatie na 64 weken. Meting van de kwaliteit van leven in deze kleine pilot studie liet een significante verbetering zien op meerdere aspecten van de EORTC-QLQ-C30.
In de TRIUMPH studie (Hillmen, NEJM 2006) werden 87 transfusie-afhankelijke PNH patiënten geïncludeerd en gerandomiseerd tussen behandeling met eculizumab (n=43) en placebo (n=44). 22 patiënten in de eculizumab-groep werden transfusie-onafhankelijk gedurende de follow-up periode tegenover 0 patiënten in de placebogroep. De transfusiebehoefte daalde van 1,6 (mediaan) units per maand naar 0,5 units per maand in de eculizumab groep. In de placebogroep was er geen significant verschil. Opnieuw rapporteerden patiënten in de eculizumabgroep verbetering van de kwaliteit van leven, gemeten met de FACIT-FATIGUE en EORTC-QLQ-C30 vragenlijst.
Een aanvullende studie binnen de TRIUMPH populatie liet zien dat een aantal parameters die een indicatie kunnen zijn voor pulmonale hypertensie verbeterden na start van eculizumab (Hill et al, BJH 2010). Zo daalde het nt-proBNP met 50% bij patiënten met een verhoogde waarde bij baseline binnen 2 weken na start van de behandeling en verminderde de dyspnoeklachten. Dit effect hing niet samen met een verbetering in het hemoglobine gehalte van de patiënten.
De SHEPHERD study (Brodsky, Blood 2008) was een open-label non-placebo gecontroleerde fase 3 studie waaraan 97 patiënten deelnamen. Patiënten kwamen in aanmerking als ze tenminste 1 unit erytrocyten hadden ontvangen in verband met anemie of anemie-gerelateerde klachten in de 2 jaar voorafgaand aan inclusie of als ze door persoonlijke overtuiging geen erytrocytentransfusies wensten te ontvangen. In tegenstelling tot de TRIUMPH studie konden ook patiënten met trombopenie worden geincludeerd. De mediane transfusiebehoefte daalde van 8 units in het jaar voorafgaand aan inclusie naar 0 units in het jaar na start van eculizumab. Moeheidsklachten, gemeten met de FACIT-Fatigue score, verbeterden significant. De EORTC-QLQ-C30 liet onder meer een verbetering zien wat betreft moeheidsklachten en algeheel functioneren.
De langere termijn effectiviteit en veiligheid van eculizumab in patiënten die deelnamen aan de bovengenoemde studies is gepubliceerd in 2013 (Hillmen et al, BJH 2013). Resultaten werden geanalyseerd na een follow-upduur van 36 maanden. Zoals boven voor de afzonderlijke studies beschreven, daalde het aantal transfusies per maand significant en nam het aantal transfusie-onafhankelijke patiënten toe, een effect wat ook bij een follow-up van 36 maanden stand hield. Het risico op trombose verminderde significant van 11,1 per 100 patiëntjaren naar 2,1 per 100 patiëntjaren (zie ook Hillmen et al, Blood 2007). De nierfunctie was na 36 maanden verbeterd bij 44,8%, verslechterd bij 6,9% en stabiel bij 48,3% van de behandelde patiënten (zie ook: Hillmen et al, Am J Hematol 2010).
Kelly et al rapporteerden in 2011 de ervaringen met eculizumab behandeling in het PHN expertisecentrum in Leeds bij 79 patiënten (waarvan er 34 geïncludeerd waren in een van de bovengenoemde trials) (Kelly et al, Blood 2011). Redenen om te starten met eculizumab waren een significante PNH-gerelateerde complicatie (trombose, nierfalen), ernstige PNH-gerelateerde symptomen of transfusie-afhankelijkheid. De gemiddelde duur van de behandeling met eculizumab was 3,3 jaar (range 0-8 jaar). Het aantal tromboses daalde significant van 5,6 per 100 patiëntjaren voorafgaand aan behandeling naar 0,8 per 100 patiëntenjaren na start van eculizumab. Het gemiddelde aantal transfusies daalde van 19,3 units in de 12 maanden voor start van eculizumab tot 5,0 units in de 12 maanden erna. 66% van de patiënten werd transfusie-onafhankelijk. De overall overleving van de patiënten bleek vergelijkbaar met een voor leeftijd en geslacht gematchte populatie.
De AEGIS-trial uit Japan was een open-label fase II studie waarin PNH patiënten werden geïncludeerd die in de voorafgaande 2 jaar tenminste 1 erytrocytentransfusie hadden ontvangen (of volgens hun behandelend arts zouden moeten hebben ontvangen) (Kanakura, Int J Hematol 2011). Er werden 29 patiënten geïncludeerd, van wie 2 nooit een transfusie hadden gehad. Bij 12 weken follow-up werd een afname gezien van de transfusiebehoefte (van mediaan 2 units in de 12 weken voor start behandeling naar 0 in de 12 weken erna). Ook in de extensiestudie van 2 jaar werd een positief effect op de transfusiebehoefte gemeten (Kanakura, Int J hematol, 2013). Tijdens de studie en de extensie studie traden geen tromboses op. Bij metingen met de FACIT-Fatigue score en de EORTC-QLQ-C30 werd verbetering gezien van onder meer moeheidsklachten, algehele gezondheid en dyspnoeklachten. Bij 41% van de patiënten trad een verbetering van de nierfunctie op (verandering CKD stadium), bij 55% veranderde deze niet.
Recent werd nog een retrospectieve studie gepubliceerd (Loschi et al, Am J Hematol 2016), waarin patiënten met eculizumab (n =123) werden vergeleken met een historische controlegroep (n =191). De overall survival na 6 jaar bleek 92% versus 80% (HR 0,38 p 0,037). De incidentie van trombose bedroeg 4% vs 27%. In de eculizumab groep overleden 9 patiënten, waarvan 2 aan de gevolgen van trombose. In de controlegroep overleden 44 patiënten waarvan 13 ten gevolge van trombose.
Het gebruik van eculizumab bij zwangeren komt verder bij uitgangsvraag 10 aan bod.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 1)
Overwegingen:
Samenvattend laten bovengenoemde studies zien dat de transfusiebehoefte van PNH patiënten na start van de behandeling met eculizumab afneemt en het percentage transfusieonafhankelijke patiënten significant toeneemt. De anemie vermindert eveneens. De incidentie van trombose neemt significant af. Bij een ruime meerderheid van de patiënten stabiliseert of verbetert de nierfunctie. Er zijn aanwijzingen dat pulmonale hypertensie kan verbeteren door behandeling met eculizumab. Metingen van de kwaliteit van leven laten op meerdere vlakken verbetering zien. 75 Zwangerschappen verliepen bij 61 vrouwen met PNH tijdens eculizumab resulteerden in goede foetale overleving en een voor PNH opvallend lage incidentie van maternale complicaties. Deze resultaten hebben ertoe geleid dat zwangerschap niet langer zonder meer wordt afgeraden aan vrouwen met PNH.
Gezien de zeldzaamheid van PNH is het aantal studies en het aantal patiënten per studie beperkt. Er is 1 gerandomiseerde placebogecontroleerde studie over de effectiviteit en veiligheid van eculizumab beschikbaar. Gezien de inmiddels gepubliceerde effecten van eculizumab op onder meer transfusiebehoefte, anemie, incidentie van trombose, het optreden van complicaties tijdens de zwangerschap, de overall overleving en de kwaliteit van leven, zijn nieuwe placebogecontroleerde studies, tenzij voor een specifiek nieuw indicatie gebied, niet te verwachten. Door (inter)nationale registratie van PNH patiënten zullen nadere lange termijn gegevens over de effecten van behandeling met eculizumab bekend worden.
Richtlijnen voor PNH behandeling zijn in de wereld beperkt beschikbaar. De PNH National Service in het Verenigd Koninkrijk hanteert als indicaties elke van de volgende: transfusie-afhankelijkheid (≥ 4 transfusies/jaar), PNH-gerelateerde trombose, PNH-gerelateerd nierfalen/pulmonale hypertensie, zwangerschap en ten slotte hemolyse met naast significante symptomen tevens ofwel een anemie ofwel onderlinge consensus tussen behandelaren. Daarnaast wordt eculizumab voorgeschreven in uitzonderingsgevallen na consensus tussen behandelaren. De behandeling is in het Verenigd Koninkrijk geconcentreerd in 2 expertisecentra in Leeds en Londen, van waaruit de patiënten in outreach clinics worden gezien en begeleid. De Duits/Oostenrijks/Zwitserse Onkopedia richtlijn noemt transfusie-afhankelijkheid, trombose, nierinsufficientie, zwangerschap, buikpijnaanvallen en/of andere ernstige PNH-gerelateerde symptomen als reden om met eculizumab te starten. In Australië is eculizumab via het “Life Savings Drugs Programme” beschikbaar voor PNH patiënten met trombose, transfusie-afhankelijkheid, anemie (< 4,3 mmol/L of < 6,2 mmol/L met symptomen), pulmonale insufficiëntie (dyspnoe of pijn op de borst NYHA klasse III of aanwezigheid van pulmonale hypertensie), nierinsufficientie en recidiverende ernstige pijnklachten waarvoor ziekenhuisopname of morfine(-analogen) nodig zijn. De aanbevelingen in deze Nederlandse richtlijn zijn vergelijkbaar met deze internationale richtlijnen. Gezien het beperkte aantal PNH patiënten in Nederland die behandeld worden met eculizumab en de kosten van de behandeling, wordt aanbevolen de indicatie voor en coördinatie van de behandeling vanuit een PNH expertisecentrum te laten plaatsvinden, waarbij patiënten besproken worden in het landelijke overleg van de PNH werkgroep. Om de belasting voor patiënten te reduceren bestaat vanuit het Radboudumc de mogelijkheid om in het gehele land eculizumab thuis te laten toedienen.
Uitgangsvraag 2:
Wat zijn de belangrijkste bijwerkingen van eculizumab en hoe kunnen deze worden voorkomen/behandeld?
|
Aanbeveling Gezien het risico op een levensbedreigende infectie met N. meningitidis dient elke PNH patiënt op de dag van start van de eculizumab gevaccineerd te worden met een quadrivalent vaccin tegen meningokokken serotypes ACW135Y. Daarbij dient de patient de eerste 14 dagen beschermd te worden met antibiotica gericht tegen meningococcen. Aanbevolen wordt Ciprofloxcin 2dd 750 mg . De vaccinatie tegen meningococcen (quadrivalent vaccin) wordt elke 4 jaar herhaald. Wanneer een PNH patiënt, die met eculizumab behandeld wordt, klachten heeft die kunnen passen bij een infectie, dient direct gestart te worden met antibiotica, waarbij in ieder gevel de menignococcen meegedekt moeten worden en verdere diagnostiek te worden verricht. |
Onderbouwing:
Inleiding
Eculizumab werkt door het remmen van de activatie van complement C5 en ondermijnt hiermee de werking van het complementsysteem. Het complement systeem speelt een belangrijke rol bij de afweer tegen micro-organismen, in het bijzonder gekapselde en gram-negatieve verwekkers. Het is belangrijk om te weten wat de risico’s zijn van het remmen van het complement systeem middels eculizumab. Eculizumab is nog een relatief nieuw geneesmiddel en wordt toegepast in een kleine populatie van patiënten met PNH (en aHUS), waardoor de kennis van bijwerkingen nog beperkt is.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Gezien het risico op een ernstige infectie met N. meningitidis dient elke PNH patiënt op de dag van start van de eculizumab gevaccineerd te worden met een quadrivalent vaccin tegen meningokokken serotypes ACW135Y. De vaccinatie wordt elke 4 jaar herhaald. (ref 2, 4-6, 10,11) |
|
C |
Wanneer een PNH patiënt, die behandeld wordt met eculizumab, klachten heeft die kunnen passen bij een infectie, dient direct gestart te worden met antibiotica waarbij in ieder geval de meningococcen meegedekt moeten worden en verdere diagnostiek te worden verricht (ref 2-6, 9-11) |
Samenvatting literatuur
Resultaten
Onderstaande tabel 1 uit de “Summary of product characteristics” van eculizumab geeft een overzicht van de vaak, weinig en zelden beschreven bijwerkingen zoals gerapporteerd in klinische studies en post-marketing onderzoek. De beoordeling welke van deze bijwerkingen ook daadwerkelijk gerelateerd zijn aan het gebruik van eculizumab, wordt bemoeilijkt door het feit dat er slechts 1 placebo-gecontroleerd onderzoek is verricht (Hillmen et al. NEJM 2006). Een deel van de beschreven bijwerkingen kwam in dit onderzoek ook, en soms frequenter, voor in de placebogroep (tabel 2).
Tabel 1: gemelde adverse events tijdens eculizumabgebruik in 302 PNH patiënten (bron: Eculizumab Summary of Product Characteristics)
|
MedRA System Organ Class |
Zeer vaak (≥1/10) |
Vaak (≥1/100 tot <1/10) |
Zelden (≥1/1000 tot <1/100) |
|
Infecties en infestaties |
|
Meningokokken sepsis, aspergillusinfectie, bacteriële artritis, bovenste LWI, nasofaryngitis, bronchitis, orale herpes, UWI, virale infectie |
Meningokokken menigitis, sepsis, septische shock, pneumonie, lagere LWI, fungale infectie, H. influenzae infectie, abces, cellulitis, influenza, gastro-intestinale infectie, cystitis, gingivale infectie, infectie, sinusitis, impetigo, tandinfectie |
|
Neoplasmata benigne, maligne en ongespecificeerd |
|
|
Maligne melanoom, myelodysplastisch syndroom |
|
Aandoeningen bloed en lymfesysteem |
|
Trombocytopenie, leukopenie, hemolyse |
Coagulopathie, erytrocytenagglutinatie, abnormale stollingsfactor, anemie, lymfopenie |
|
Aandoeningen immuunsysteem |
|
Anafylactische reactie |
Hypersensitiviteit |
|
Endocriene aandoeningen |
|
|
Ziekte van Graves |
|
Aandoeningen metabolisme en nutritie |
|
Verminderde eetlust |
anorexie |
|
Pschiatrische aandoeningen |
|
|
Depressie, angst, insomnia, slaapstoornissen, abnormale dromen, stemmingswisselingen |
|
Aandoeningen zenuwstelsel |
Hoofdpijn |
Duizeligheid, dysgeusie |
Syncope, tremor, paresthesie |
|
Oogaandoeningen |
|
|
Wazige visus, irritatie conjunctiva |
|
Aandoeningen oor en labyrint |
|
|
Tinnitus, vertigo |
|
Cardiale aandoeningen |
|
|
Palpitatie |
|
Vasculaire aandoeningen |
|
Hypotensie |
Snelle verergering hypertensie, hypertensie, hematoom, opvliegers, aandoeningen venen |
|
Respiratoire, thoracale en mediastinale aandoeningen |
|
Dyspnoe, hoesten, neusverstopping, keelpijn, rinorrhoe |
Epistaxis, keelirritatie |
|
Gastro-intestinale aandoeningen |
|
Diarree, braken, nausea, buikpijn, obstipatie, dyspepsie |
Peritonitis, gastro-intestinale refluxziekte, opgeblazen buik, gigivapijn |
|
Hepatobiliaire aandoeningen |
|
|
icterus |
|
Aandoeningen van huid en onderhuids weefsel |
|
Rash, alopecia, pruritus |
Urticaria, dermatitis, erytheem, petechiën, depigmentatie, hyperhidrosis, droge huid |
|
Musculoskeletale en bindweefselaandoeningen |
|
Artralgie, myalgie, spierspasmen, botpijn, rugpijn, nekpijn, pijn in extremiteiten |
Trismus, gewrichtszwelling |
|
Nier- en urinewegaandoeningen |
|
|
Nierfunctiestoornissen, hematurie, dysurie |
|
Aandoening van voortplastingssysteem en mammae |
|
|
Spontane erectie, verstoorde menstruele cyclus |
|
Algemene aandoeningen en problemen bij toediening |
|
Oedeem, klachten borst, pyrexie, rillingen, moeheid, asthenie, influenza-achtig beeld |
Pijn op de borst, paresthesie infusieplaats, pijn infusieplaats, extravasatie, warm gevoel |
|
Onderzoek |
|
Positieve Coombs test |
Verhoging AF, ASAT, GGT. Daling Ht en hemoglobine |
|
Verwonding, vergiftiging en procedurele complicaties |
|
|
Infusie-gerelateerde reactie |
Tabel 2: Adverse events in placebo- versus eculizumabgroep (Hillmen et al, NEJM 2006)
|
Adverse event |
Placebo groep (n =44) |
Eculiuzmab groep (n =43) |
|
|
No (%) |
|
|
Totaal aantal serious adverse events |
9 (20) |
4 (9) |
|
Exacerbatie PNH |
3 (7) |
1 (2) |
|
Nierkoliek |
0 |
1 (2) |
|
Lumbale of sacrale diskusprolaps |
0 |
1 (2) |
|
α-hemolytische streptokokken bacteriëmie |
0 |
1 (2) |
|
Infecties centrale lijn en urinewegen |
1 (2) |
0 |
|
Bovenste luchtweginfectie |
1 (2) |
0 |
|
Probable virale infectie |
1 (2) |
0 |
|
Neutropenie |
1 (2) |
0 |
|
Cellulitis, folliculitis, en neutropenie |
1 (2) |
0 |
|
Anemie en pyrexie |
1 (2) |
0 |
|
Meest frequente adverse events (≥10%) |
|
|
|
Hoofdpijn |
12 (27) |
19 (44) |
|
Nasofaryngitis |
8 (18) |
10 (23) |
|
Bovenste luchtweginfectie |
10 (23) |
6 (14) |
|
Rugpijn |
4 (9) |
8 (19) |
|
Nausea |
5 911) |
7 (16) |
|
Hoesten |
4 (9) |
5 (12) |
|
Diarree |
5 (11) |
4 (9) |
|
Artralgie |
5 (11) |
3 (7) |
|
Buikpijn |
5 (11) |
2 (5) |
|
Duizeligheid |
5 (11) |
2 (5) |
|
Braken |
5 (11) |
2 (5) |
|
Moeheid |
1 (2) |
5 (12) |
|
Virale infectie |
5 (11) |
1 (2) |
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 2)
Overwegingen:
De mogelijke bijwerkingen van eculizumab die tot zover bekend zijn, zijn hierboven uitgebreid beschreven. De ervaring onder (inter)nationale PNH behandelaren is dat eculizumab in het algemeen goed wordt verdragen. De meest voorkomende bijwerking, namelijk hoofdpijn, verdwijnt vaak na de eerste toedieningen van eculizumab. Bij het vermoeden van een bijwerking of complicatie van behandeling met eculizumab dient nooit de eculizumab gestaakt te worden zonder overleg met een PNH expertisecentrum (in verband met het risico op massale hemolyse en trombose na staken).
De tot nu meest bedreigende bijwerking is een infectie met N. meningitidis. Een meningokokken infectie bij een PNH patiënt die met eculizumab behandeld wordt, kan fulminant als sepsis verlopen. Vaak ontbreken hierbij de klassieke verschijnselen van een meningitis. Dit heeft ertoe geleid dat alle patiënten die starten met eculizumab vooraf gevaccineerd worden met een quadrivalent vaccin tegen meningokokken ACW135Y. Deze vaccinatie vindt plaats op de dag van start van de eculizumab, waarbij patiënt gedurende 2 weken profylactisch met antibiotica behandeld wordt. Omdat er anekdotisch bewijs is dat een vaccinatie in de onbehandelde situatie soms kan leiden tot tijdelijke toename van hemolyse, wordt in Nederland alleen nog bij voorgenomen zwangerschap langer voor start met eculizumab (tenminste 2 weken) gevaccineerd. De vaccinatie wordt elke 4 jaar herhaald. Recent is ook een vaccinatie tegen meningokokken B beschikbaar gekomen. Hiermee is in Nederland bij PNH patiënten nog geen ervaring opgedaan. Vandaar dat dit nu nog niet in de aanbevelingen is opgenomen.
Indien een patiënt met PNH die behandeld wordt met eculizumab zich meldt met klachten die kunnen passen bij een infectie (zoals koorts, matig-ernstige hoofdpijn met misselijkheid/braken of met een stijve nek of rug, verwardheid, ernstige spierpijn in combinatie met griep-achtige verschijnselen en lichtschuwheid), dienen antibiotica gericht op meningokokken gestart te worden en verdere diagnostiek te worden verricht. Alle patiënten die behandeld worden met een complementremmer dienen altijd te beschikken over een standaard veiligheidskaartje dat instructies bevat voor de patiënt en de arts bij wie hij zich meldt (indien dit niet zijn eigen behandelaar is). Daarnaast heeft elke patiënt antibiotica (meestal ciprofloxacin 2 dd 750 mg) in huis om te starten bij een van bovengenoemde klachten.
Uitgangsvraag 3:
Hoe wordt eculizumab gedoseerd?
|
Aanbeveling Gedurende de eerste 4 weken wordt 1 x per 7 dagen 600 mg eculizumab i.v. toegediend. In de 5e week en vervolgens elke 14 dagen wordt 900 mg eculizumab i.v. toegediend. Bij uitzondering is het mogelijk om het interval naar 12-16 dagen aan te passen, mits het interval van opeenvolgende toedieningen gemiddeld 14 dagen blijft. In incidentele gevallen moet de dosering van eculizumab worden verhoogd of het interval tussen 2 toedieningen worden verkort (bespreking in uitgangsvraag 14). |
Onderbouwing:
Inleiding
Eculizumab (Soliris) is een gehumaniseerd monoklonaal antilichaam en blokkeert de activatie van complement C5 naar C5a en C5b. Het is het eerste geregistreerde geneesmiddel om de complement-gemedieerde hemolyse bij PNH te remmen. De indicaties voor eculizumab en de bijwerkingen worden besproken bij uitgangsvragen 1 en 2.
Conclusie(s)
|
SORT Grade |
Aanbeveling |
|
A |
Gedurende de eerste 4 weken wordt 1 x per 7 dagen 600 mg eculizumab i.v. toegediend. In de 5e week en vervolgens elke 14 dagen wordt 900 mg eculizumab i.v. toegediend. Bij uitzondering is het mogelijk het interval naar 12-16 dagen aan te passen, mits het interval van opeenvolgende toedieningen gemiddeld 14 dagen blijft. |
Samenvatting literatuur
Resultaten
Voor beantwoording van deze uitgangsvraag is gebruik gemaakt van de gegevens uit de fase II en III studies naar de effectiviteit en veiligheid van eculizumab bij patiënten bij PNH. Deze studies zijn beschreven bij uitgangsvragen 1 en 2. Daarnaast is gebruik gemaakt van de Summary of Product Characteristics.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 3)
Overwegingen:
Op basis van de verrichte klinische studies en conform het voorschrift in de Summary of Product Characteristics is het behandelschema van eculizumab bij volwassenen als volgt (met betrekking tot kinderen: zie uitgangsvraag 15):
|
Geneesmiddel |
Dosis |
Dag |
Toedieningswijze/ opgelost in |
Inlooptijd |
|
eculizumab |
600 mg |
Dag 1,8,15 en 22 |
Intraveneus in NaCl 0,9% |
30 minuten (mag in 25-45 minuten) |
|
eculizumab |
900 mg |
Vanaf dag 29 elke 14 dagen |
Intraveneus in NaCl 0,9% |
30 minuten (mag in 25-45 minuten) |
Dag 1:
|
Starttijd |
|
|
|
|
|
|
|
Medicatie |
Dosis |
Oplosmiddel (ml) |
Inlooptijd |
Bijzonderheden |
|
T =0 |
Vaccinatie meningokokken ACW135Y |
|
|
|
Herhaling 1 x per 4 jaar
|
|
T = 0 |
eculizumab |
600 mg |
120 ml naCl 0,9% |
30 minuten |
Toediening in 25 – 45 minuten |
|
T= 30 |
|
|
NaCl 0,9% |
|
Waakinfuus verwijderen 60 minuten na inlopen van de eculizumab |
Dag 8, 15 en 22:
|
Starttijd |
|
|
|
|
|
|
|
Medicatie |
Dosis |
Oplosmiddel (ml) |
Inlooptijd |
Bijzonderheden |
|
T =0 |
eculizumab |
600 mg |
120 ml NaCl 0,9% |
30 minuten |
Toediening in 25-45 minuten |
|
T = 30 |
|
|
NaCl 0,9% |
|
Waakinfuus verwijderen 60 minuten na inlopen van de eculizumab |
Vanaf dag 29 (elke 14 dagen):
|
Starttijd |
|
|
|
|
|
|
|
Medicatie |
Dosis |
Oplosmiddel (ml) |
Inlooptijd |
Bijzonderheden |
|
T =0 |
eculizumab |
900 mg |
180 ml NaCl 0,9% |
30 minuten |
Toediening in 25-45 minuten |
|
T = 30 |
|
|
NaCl 0,9% |
|
Waakinfuus verwijderen 60 minuten na inlopen van de eculizumab |
In uitzonderingsgevallen kan het nodig zijn om de dosering van eculizumab te verhogen of het interval tussen 2 toedieningen te verkorten. Dit wordt besproken bij uitgangsvraag 14. Het normale doseringsinterval van 14 dagen (bij uitzondering 12-16 dagen) dient strikt te worden gehanteerd. Wanneer het doseringsinterval langer is bestaat het risico op doorbraak hemolyse met een verhoogd risico op PNH-gerelateerde complicaties.
Uitgangsvraag 4:
Wanneer moet gestart worden met antistolling?
|
Aanbeveling Tenzij er sprake is van belangrijke contra-indicaties moet gestart worden met antistolling (vitamine K antagonist/LMWH) in geval van:
|
Onderbouwing:
Inleiding
Trombose is de belangrijkste oorzaak van mortaliteit en blijvende invaliditeit bij patiënten met een PNH en dient dan ook voorkómen of bij diagnose direct behandeld te worden.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Trombose (levenslang antistolling geïndiceerd) (ref 3, 4) |
|
C |
Bij een PNH kloongrootte >50% (in de fractie granulocyten of monocyten) (Ref 2) |
|
C |
Bij zwangerschap (geen vitamine K antagonisten) (Ref 5) |
Samenvatting literatuur
De aanbevelingen zijn gedaan op basis van bestaande richtlijnen, reviews en expert opinie en case-reports.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 4)
Overwegingen:
Behandeling van trombose: tenzij er sprake is van belangrijke contra-indicaties, dient bij diagnose van een trombose in een PNH patiënt direct gestart te worden met een therapeutische dosering laag moleculair gewicht heparine (LMWH). Tegelijkertijd dient de patiënt te worden ingesteld op een vitamine K antagonist met een streef INR tussen de 2.0 en 3.0. De LMWH dient tenminste 5 dagen én totdat de INR waarde bij 2 achtereenvolgende metingen > 2.0 is, te worden gecontinueerd. De antistolling dient levenslang te worden gecontinueerd.
NB Patient heeft een indicatie voor behandeling met eculizumab (zie uitgangsvraag 1).
Bij trombopenie en of bloedingscomplicaties dient antistolling heroverwogen te worden
Er zijn geen data beschikbaar over de behandeling van trombose bij PNH patiënten met de directe orale anticoagulantia (DOAC’s).
Er zijn aanwijzingen dat in geselecteerde gevallen trombolyse effectief kan zijn (case histories).
Onder therapeutische antistolling is optreden en uitbreiding van de trombose mogelijk. Een PNH patiënt met een arteriële of ernstige veneuze trombose in gang dient direct met eculizumab te starten. Wegens zeer hoge recidiefkans is een doorgemaakte trombose reden om met behandeling met eculizumab te starten. Indien trombose optreedt bij een met eculizumab behandelde patiënt kan onderdosering van de eculizumab de reden zijn en moet verhoging van de dosis worden overwogen.
Preventie van arterieel en veneuze trombose: bij patiënten met een PNH is preventie van trombose een belangrijk doel dat kan bijdragen aan reductie van de mortaliteit en blijvende invaliditeit.
Bij patiënten die niet worden behandeld met eculizumab dient primaire profylaxe met een vitamine K antagonist te worden gegeven bij een PNH kloongrootte > 50% (hoogste waarde in de fractie granulocyten of monocyten), mits er geen contra-indicaties zijn. Streef INR ligt tussen de 2.0 en 3.0.
Er zijn geen data beschikbaar over primaire of secundaire profylaxe met trombocytenaggregatieremmers. Gezien het onderliggende mechanisme van verhoogde tromboseneiging bij PNH patiënten is het echter onwaarschijnlijk dat deze effect zullen hebben.
Als bij patiënten een indicatie is voor start van eculizumab en zij worden wegens de PNH preventief behandeld met antistolling zonder doorgemaakte trombose, kan de antistolling 3 maanden na start van de eculizumab worden gestopt.
Bij patiënten in de zwangerschap wordt geadviseerd primaire tromboseprofylaxe met LMWH in therapeutische dosering te geven tot 3 maanden na de bevalling (mits geen contra-indicaties).
Voor kinderen in het algemeen geldt dat het risico op trombose toeneemt met het doormaken van de puberteit. Behandeling met vitamine K antagonisten is lastiger bij kinderen en dient per patiënt zorgvuldig te worden overwogen (zie ook uitgangsvraag 15).
Uitgangsvraag 5:
Wat is de rol van ATG en ciclosporine bij PNH?
|
Aanbeveling
|
Onderbouwing:
Inleiding
Behandeling met ciclosporine en/of ATG wordt toegepast bij patiënten met aplastische anemie. Bij een aanzienlijk deel (tot > 50%) van de patiënten met aplastische anemie kan een PNH-kloon worden aangetoond bij diagnose of in de loop van de tijd. Meestal gaat het om een kleine PNH kloon zonder tekenen van hemolyse en heeft dit geen directe consequenties voor de behandeling van de aplastische anemie. De kloongrootte moet wel worden vervolgd omdat het beeld in de loop van de tijd aan verandering onderhevig kan zijn. Soms is bij aplastische anemie echter sprake van een grotere PNH kloon en verhoogde hemolyseparameters. In andere gevallen is bij patiënten met een diagnose PNH sprake van een pancytopenie waarbij beenmergfalen een belangrijke rol lijkt te spelen, zonder dat wordt voldaan aan de criteria voor de diagnose aplastische anemie. De vraag is of bij deze patiëntengroep behandeling met ciclosporine en/of ATG ook zinvol kan zijn.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
Richtlijn aplastische anemie |
Bij patiënten met een aplastische anemie en een kleine PNH kloon zonder tekenen van hemolyse wordt behandeling van de aplastische anemie aanbevolen conform de richtlijn aplastische anemie (link). (Ref 2, 5, 8, 11) |
|
C |
Bij patiënten met een aplastische anemie en een grote PNH kloon met tekenen van hemolyse en/of trombose wordt behandeling van de aplastische anemie aanbevolen conform de richtlijn aplastische anemie. Daarnaast moet behandeling van de PNH overwogen worden. (Ref 2, 5,8, 11) |
|
C |
Er is nog onvoldoende bekend over de effectiviteit van immuunsuppressieve behandeling bij patiënten met PNH en tekenen van significant beenmergfalen, zonder duidelijke diagnose van aplastische anemie. Behandeling met ATG en/of ciclosporine kan worden overwogen. (Ref 1- 4, 6, 7, 9, 10) |
Samenvatting literatuur
Resultaten
Er zijn geen goede klinische studies naar het effect van behandeling met ciclosporine en/of ATG bij patiënten met belangrijk beenmergfalen in het kader van PNH. De best beschikbare gegevens komen uit studies naar de behandeling van patiënten met aplastische anemie, bij wie voor start van de behandeling een PNH kloon gemeten is. De grootste studies zijn van Kulagin et al (Br J Haematol 2014), Scheinberg et al (Haematologica 2010) en Sugimori et al (Blood, 2006). In de studie van Kulagin zijn 125 patiënten met aplastische anemie geïncludeerd, van wie 59% een detecteerbare PNH kloon had. Maar slechts 15% werd geclassificeerd als een AA met PNH op basis van een kloongrootte >1% en een verhoogd LDH. Een verhoogd LDH bij een zeer kleine kloongrootte is opvallend en de vraag is of het verhoogde LDH door hemolyse verklaard kan worden. In deze studie leek de aanwezigheid van een PNH kloon een positieve voorspellende waarde te hebben voor hematologische respons (definitie respons zie Camitta, Acta Haematologica 2000) op ATG en ciclosporine (OR 2,56) en failure-free survival. Er zijn echter weinig gegevens beschikbaar over de specifieke groep met een kloongrootte >1% en hemolyse voorafgaand aan de behandeling. In de studie van Scheinberg zijn 207 patiënten met een severe aplastische anemie beschreven van wie 40% een PNH kloongrootte >1% had (mediaan 9,7%, inter quartile range 3,5-29%). Er werd geen verschil in respons op ATG en ciclosporine gezien tussen de patiënten met en zonder PNH kloon. Bij de meerderheid nam de kloongrootte af na behandeling, bij 25% steeg de kloongrootte. Bij <5% van de patiënten werd tijdens follow-up na de ATG behandeling een specifieke behandeling voor PNH (zoals eculizumab) gegeven. In de studie van Sugimori et al werden 122 patiënten met aplastische anemie, die behandeling met ATG en ciclosporine ondergingen, vergeleken op basis van de aanwezigheid van een PNH kloon. Hierbij was in de groep met PNH kloon, de kloongrootte bij de meeste patiënten overigens zeer klein (bij 40% kleiner dan 0,1%). Bij de groep met PNH kloon trad vaker (bij 91%) een PR of CR op in vergelijking met de groep zonder PNH kloon (48%). Er is een aantal kleine case series en case-reports van behandeling van PNH patiënten met of zonder beenmerghypoplasie in het biopt met ciclosporine en/of ATG. Op basis van de beperkte gegevens lijken de cytopeniën bij een aantal patiënten te verbeteren na behandeling, maar is er geen effect op de hemolyseparameters.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 5)
Overwegingen:
Op basis van de beschikbare literatuur zijn er onvoldoende gegevens om een advies te geven over behandeling van patiënten met PNH en tekenen van beenmerghypoplasie (zonder diagnose aplastische anemie) met ciclosporine en/of ATG. De Best Practice guideline PNH van het British Medical Journal adviseert behandeling met cicloporine/ATG te overwegen bij beenmerghypoplasie in het kader van PNH, conform de behandeling van aplastische anemie. De Duits/Oostenrijks/Zwitserse Onkopedia richtlijn geeft geen concrete adviezen in dit geval.
Wanneer sprake is van een diagnose aplastische anemie wordt geadviseerd de patiënt te behandelen volgens de NVvH richtlijn aplastische anemie. Wanneer er bij een diagnose aplastische anemie sprake is van een grote PNH kloon met tekenen van hemolyse kan er een indicatie bestaan om voor start van behandeling van de aplastische anemie te starten met behandeling met eculizumab. Er dient rekening mee gehouden te worden dat gedurende de (behandeling van) aplastische anemie bij patiënten met een grote PNH kloon er PNH-gerelateerde complicaties kunnen ontstaan zoals trombose of een (tijdelijke) toename van hemolyse. Het vervolgen van de PNH kloon na behandeling van aplastische anemie komt aan bod in de NVvH richtlijn aplastische anemie.
Uitgangsvraag 6:
Is er een rol voor corticosteroïden?
|
Aanbeveling Er is geen aangetoonde meerwaarde van corticosteroïden bij de behandeling van PNH |
Onderbouwing:
Inleiding
Voor de ontwikkeling van complementinhibitors, werden corticosteroïden vaak voorgeschreven aan patiënten met PNH in een poging de duur van een hemolytische crisis te verkorten of ter preventie van hemolytische crises. De duur van behandeling en de hoogte van de dosering corticosteroiden variëerden hierbij sterk.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Er is geen aangetoonde meerwaarde van corticosteroïden bij de behandeling van PNH (Ref 1-6) |
Samenvatting literatuur
Resultaten
Er zijn geen goede prospectieve studies naar het gebruik van corticosteroïden bij PNH. De beschikbare gegevens in de literatuur bestaan, naast case-reports en expert opinies, uit 1 grotere retrospectieve studie uit China (Zhao et al, 2002) en 1 prospectieve studie waarin om de dag een hoge dosis corticosteroiden gegeven wordt (Issaragrisil et al, 1987). In de prospectieve studie van Issaragrisil kregen 19 patiënten met PNH om de dag een hoge dosering corticosteroïden en werd bij 8 patiënten een goede (stijging Hb en transfusie-onafhankelijkheid) en bij 3 patiënten een redelijke respons gezien. 2/8 patiënten met een goede respons waren al voor aanvang van de studie transfusie onafhankelijk. Langere termijn effecten zijn niet beschreven.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 6)
Overwegingen:
Er zijn nauwelijks studies naar het effect van corticosteroïden bij de behandeling van PNH. De meeste studies dateren uit de tijd voordat eculizumab beschikbaar was. In de beschikbare studies en case-reports wordt beschreven dat behandeling met een hoge dosis (0,25-1 mg/kg/dag) corticosteroïden bij een deel van de patiënten tot een respons leidt. Omdat de frequentie, ernst en de duur van een PNH crisis echter erg kan variëren, ook in een individuele patiënt in de loop van de tijd, is het effect van een behandeling op de duur van de crisis moeilijk betrouwbaar te meten. Hoewel kortdurende behandeling met corticosteroïden de duur van een hemolytische crisis mogelijk kan verkorten, is het effect op PNH-gerelateerde complicaties niet aangetoond. Het is niet duidelijk of corticosteroïden het tromboserisico kunnen verlagen of in potentie juist verhogen. Het mogelijke effect van corticosteroïden is bovendien slechts tijdelijk. Langdurige onderhoudsbehandeling met hoge dosis prednisolon wordt als andere behandeloptie genoemd. Exacerbaties van hemolyse treden echter ondanks onderhoudsbehandeling toch op en leiden vaak tot verdere ophoging van de dosering corticosteroïden. Het is niet onderzocht of langdurig gebruik van corticosteroïden enig effect heeft op belangrijke PNH-gerelateerde complicaties zoals trombose of nierinsufficiëntie of op kwaliteit van leven en overleving. De bijwerkingen van langdurig gebruik van corticosteroïden zijn aanzienlijk. Door internationale experts op het gebied van PNH wordt langdurige gebruik van corticosteroïden dan ook afgeraden. Kortdurend gebruik tijdens een ernstige hemolytische crisis wordt door sommigen toegepast (zie onder andere BMJ Best medical Practice en de Onkopedia richtlijn PNH). Gezien onvoldoende gegevens over de werkzaamheid en de mogelijke bijwerkingen, raadt de werkgroep het gebruik van corticosteroïden bij PNH af.
Uitgangsvraag 7:
Is er een rol voor erytropoietine?
|
Aanbeveling Er is onvoldoende bewijs voor een positief effect van erytropoietine bij de behandeling van PNH. |
Onderbouwing:
Inleiding
De hemolyse die bij PNH optreedt zou moeten leiden tot een compensatoire toename van de erytropoiese. De mate waarin dit gebeurt wisselt per patiënt. Mogelijk zou behandeling met erytropoietine bij patiënten de erytropoiese kunnen bevorderen.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Er is onvoldoende bewijs voor een positief effect van erytropoietine bij de behandeling van PNH. (Ref 1- 6) |
Samenvatting literatuur
Resultaten
In de literatuur wordt behandeling met erytropoietine alleen beschreven in een zeer kleine prospectieve studie met 3 PNH patiënten, een aantal case-reports en een retrospectieve studie in 6 patiënten met PNH. In deze laatste studie wordt bij 2 patiënten een positief effect beschreven. Er is op basis van de beschikbare gegevens geen duidelijke overeenkomst te vinden tussen de patiënten die met een Hb-stijging of vermindering van de transfusiebehoefte reageren op behandeling met erytropoietine. De gegevens over de patiënten zijn vaak beperkt. Het is bijvoorbeeld niet altijd duidelijk of het uitgangs-hemoglobine gemeten is tijdens opname voor een hemolytische crisis of in de periode tussen crisis in.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 7)
Overwegingen:
Er is in de literatuur slechts anekdotisch bewijs voor een positief effect van toediening van erytropoietine op het hemoglobine gehalte van patiënten met PNH. Er is geen bewijs dat toediening van erytropoietine de frequentie of ernst van hemolytische crises kan verminderen of PNH-gerelateerde complicaties kan voorkomen. Gebruik van erytropoietine wordt dan ook in het algemeen niet geadviseerd. Mogelijk draagt erytropoietine bij een subgroep van PNH patiënten bij aan verbetering van het hemoglobine gehalte, bijvoorbeeld bij nierfunctiestoornissen of bij een andere onderliggende aandoening zoals myelodysplastisch syndroom. Het gebruik van erytropoietine kan in dergelijke gevallen bij individuele patiënten worden overwogen.
Uitgangsvraag 8:
Wat is de rol van allogene stamceltransplantatie bij PNH?
|
Aanbeveling
|
Onderbouwing:
Inleiding
Een allogene stamceltransplantatie is vooralsnog de enige mogelijk genezende behandeling voor patiënten met PNH. Echter, deze behandeling gaat gepaard met een hoog risico op morbiditeit en mortaliteit. Sinds de beschikbaarheid van eculizumab wordt een allogene stamceltransplantatie bij PNH afgeraden gezien de effectiviteit en veiligheid van eculizumab en de hoge transplantatie gerelateerde mortaliteit bij PNH. Allogene stamceltransplantatie wordt dan ook alleen in uitzonderingssituaties toegepast.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
B |
Bij patiënten met een PNH kloon, bij wie een andere hematologische ziekte het klinisch beeld bepaalt, kan een allogene stamceltransplantatie conform de richtlijnen voor de desbetreffende ziekte worden overwogen. |
|
B |
Bij patiënten met PNH zonder andere onderliggende hematologische ziekte wordt een allogene stamceltransplantatie niet geadviseerd. Een allogene stamceltransplantatie kan in uitzonderingsgevallen worden overwogen, bij voorbeeld bij persisterende, levensbedreigende cytopenieën, wanneer andere behandelmogelijkheden niet effectief zijn. (Ref 1-17) |
|
C |
Er moet bij een allogene stamceltransplantatie rekening worden gehouden met een verhoogd risico op complicaties door aanwezigheid van de PNH kloon. Er kan overwogen worden om rond de transplantatie eculizumab te geven om de kans op deze complicaties te verkleinen. (Ref 1-17) |
|
C |
Er zijn onvoldoende gegevens om aanbevelingen te doen met betrekking tot de conditionering voor een allogene stamceltransplantatie bij PNH (Ref 1-17) |
|
C |
Omdat allogene stamceltransplantatie een curatieve behandeling is en de risico’s van deze behandeling bij andere indicaties bij kinderen in vergelijking met volwassenen kleiner zijn, kan dit in specifieke gevallen een reden zijn om bij kinderen met PNH te besluiten tot een behandeling met SCT. (zie uitgangsvraag 15) |
Samenvatting literatuur
Resultaten
De beschikbare literatuur over allogene stamceltransplantatie bij PNH betreft grotendeels kleine, retrospectieve studies, die verricht zijn voor het beschikbaar komen van eculizumab. De 3 grootste retrospectieve studies bevatten gegevens over respectievelijk 211 (Peffault de Latour R et al Haematologica 2012), 57 (Saso R et al Br J Haematol1999) en 26 patiënten met PNH (Santarone S et al, Haematologica. 2010). In de studie van Peffault de Latour et al had 45% van de getransplanteerde patiënten een “klassieke” PNH, de rest PNH met een andere onderliggende beenmergaandoening. Bij de meerderheid (65%) was een HLA-identieke donor beschikbaar. Conditionering bestond uit cyclosfosfamide met ofwel busulfan ofwel TBI ofwel ATG bij 70% en een fludarabine-bevattend schema bij bijna 30%. De mediane follow-up duur was 5 jaar. Acute en chronische GVHD kwamen voor bij 85 respectievelijk 24 patiënten. De 5–jaars OS was 68,3± 3%. Patiënten die een trombose hadden doorgemaakt voorafgaand aan de stamceltransplantatie, deden het relatief slecht (5-jaars OS bij eerdere trombose 54±7, 69±5 bij aplastische anemie zonder trombose en 86±6 bij recidiverende hemolyse zonder trombose of AA). De studie van Saso et al betreft grotendeels patiënten met PNH zonder aplastische anemie (39/57). Conditionering bestond merendeels uit een myelo-ablatief cyclofosfamide-bevattend schema. Van de patiënten met een HLA-identieke sibling (n=48) was de 2-jaars OS 56%. 1 van de 6 patiënten met een MUD was na 5 jaar nog in leven. De studie van Santarone et al beschrijft 26 patiënten met PNH van wie 15% een aplastische anemie heeft. Conditionering bestond ook in deze studie meestal uit een cyclofosfamide-bevattend schema. De 10-jaars ziekte-vrije overleving was 57%. De meeste patiënten overleden ten gevolge van de behandeling.
Prospectieve studies zijn nauwelijks verricht. In de grootste studie (Pantin J et al Biol Blood Marrow Transplant. 2014) zijn 17 patiënten geïncludeerd (mediane kloongrootte 81,6%). Inclusie-criteria waren PNH met transfusie-afhankelijkheid of trombose of recidiverende ernstige hemolytische crises. Patiënten kregen geen eculizumab in verband met beenmergfalen, of vanwege de eigen voorkeur of omdat eculizumab niet beschikbaar was. Alle patiënten werden getransplanteerd met een HLA-identieke donor na conditionering met cyclofosfamide, fludarabine ± ATG (dit laatste bij een hoge transfusielast voorafgaand aan stamceltransplantatie). De mediane follow-up was bijna 6 jaar met een OS van 87,8%. Acute en chronische GVHD traden op bij 8 resp 11 patiënten. In bovengenoemde studies trad zover bekend bij 1 patiënt een recidief van de PNH op.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 8)
Overwegingen:
Een allogene stamceltransplantatie is vooralsnog de enige mogelijk genezende behandeling voor patiënten met PNH. De kans op een recidief van de PNH na allogene stamceltransplantatie lijkt op basis van de beschikbare gegevens klein. Hier staan echter de grote transplantatie-gerelateerde morbiditeit en mortaliteit tegenover. In de 3 grootste retrospectieve studies wisselt de overall survival tussen 56% (na 2 jaar), 68% (na 5 jaar) en 57% (na 10 jaar). Een doorgemaakte trombose voorafgaand aan stamceltransplantatie en een MUD donor lijken in de studies een negatieve impact op overleving te hebben. De voornaamste doodsoorzaken bij de patiënten zijn behandelings-gerelateerd. Mogelijk is de overleving beter bij een minder intensief conditoneringsschema zoals toegepast in de studie van Pantin et al, maar deze studie bevat slechts 17 patiënten. Morbiditeit wordt met name bepaald door het optreden van graft-versus host ziekte.
Het aantal en de kwaliteit van de beschikbare studies naar de morbiditeit en mortaliteit van een allogene stamceltransplantatie is beperkt. De meeste studies zijn retrospectief en omvatten streng geselecteerde, kleine aantallen patiënten. De patiënten zijn meestal jong, in de 30 of 40, ten tijde van de transplantatie. De meeste studies zijn verricht voordat eculizumab beschikbaar was. Sinds het beschikbaar komen van eculizumab zijn de indicaties voor allogene stamceltransplantatie internationaal veranderd. De behandeling met eculizumab heeft de overleving bij PNH sterk verbeterd. Op grond van deze resultaten moet naar de mening van de werkgroep en conform internationale richtlijnen de indicatie voor stamceltransplantie bij PNH aangescherpt worden. Voor patiënten met een ”klassieke” PNH bij wie hemolyse en hemolyse-gerelateerde complicaties op de voorgrond staan, wordt allogene stamceltransplantatie gezien de hoge morbiditeit en mortaliteit niet aangeraden. Bij patiënten met PNH bij wie het beenmergfalen op de voorgrond staat en zo ernstig is dat het leidt tot levensbedreigende cytopenieën en bij wie andere behandelingen niet effectief of mogelijk zijn, kan een allogene stamceltransplantatie overwogen worden, met name wanneer een HLA-identieke sibling beschikbaar is. Wanneer bij een patiënt met PNH sprake is van een andere onderliggende beenmergziekte, wordt geadviseerd de patiënt te behandelen conform de richtlijnen voor deze onderliggende beenmergziekte. Omdat in een aantal studies beschreven is dat in de periode rondom stamceltransplantatie trombose of een hemolytische crisis op kan treden, moet bij patiënten die niet behandeld worden met eculizumab, overwogen worden dit rondom de periode van stamceltransplantatie wel toe te dienen. Hierover zijn geen verdere studies beschikbaar.
Uitgangsvraag 9:
Waar moet rekening mee worden gehouden bij transfusies?
|
Aanbeveling
|
Onderbouwing:
Inleiding
Bij transfusie van de patiënten met PNH en chronische hemolyse dient bij patiënten zonder en met eculizumab behandeling elke antigeen-antistof interactie inclusief ABO minor incompatibiliteit te worden vermeden teneinde complementactivatie te voorkomen.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
Zie CBO richtlijn bloedtransfuse |
De indicatiestelling voor een bloedtransfusie geschiedt conform de meest recente CBO richtlijn Bloedtransfusie. (Ref 3, 9) |
|
C |
Bij parvovirus B19-seronegatieve PNH patiënten dienen parvovirus B19-veilige bloedproducten te worden getransfundeerd. (Ref 1, 8, 10, 12, 14, 15) |
|
C |
Transfundeer PNH patiënten met transfusie-afhankelijkheid met als oorzaak chronische hemolyse met ABO identieke enD, CcEe en K (en zo mogelijk ook Jka) compatibele rode bloedcelproducten (Ref 3, 4). |
|
C |
Bij patiënten met transfusie-afhankelijkheid ondanks eculizumab behandeling dient men alert te zijn op het ontstaan van ijzerstapeling. (Ref 11) |
|
C |
Transfundeer PNH patiënten met ABO major compatibele trombocyten. Er wordt geadviseerd trombocyten in ieder geval bij ABO minor incompatibiliteit als geconcentreerd product toe te dienen. Indien transfusie van niet-geconcentreerde trombocyten onvermijdelijk is, hebben trombocyten in PAS of ander plasma-arm bewaarmedium de voorkeur (Ref, 6,7, 13). |
|
C |
Indien suppletie met stollingsfactoren is geïndiceerd, heeft gerichte suppletie d.m.v. stollingsfactor concentraten de voorkeur. Indien plasma toediening onvermijdelijk is, dient bij eculizumab behandelde patiënten zo spoedig mogelijk overlegd te worden met een PNH-expertise centrum ten aanzien van de noodzaak tot en dosis van additionele toediening van eculizumab. (Ref 7) |
Samenvatting literatuur
Er waren naar inschatting van de werkgroep weinig relevante klinische studies. Er werd gebruik gemaakt van andere recente en internationale richtlijnen, aangevuld met expert opinion en reviews
Literatuur
Overwegingen:
Episoden met toegenomen afbraak bij PNH kunnen gepaard gaan met een snelle en sterke Hb-daling waarvoor (tijdelijke) ondersteuning met een of meerdere bloedtransfusies nodig kan zijn. Voor de chronisch, stabiele situatie is er, conform de algemene patiëntenpopulatie, geen vaste drempelwaarde van het Hb-gehalte waarbij een bloedtransfusie gegeven dient te worden. De indicatiestelling voor een bloedtransfusie verschilt daarmee niet met overige aandoeningen van hemodynamisch stabiele patiënten met een chronische anemie (CBO richtlijn 2011, Kranenburg et al, NTVG 2015). Het transfusiebeleid dient derhalve per individuele patiënt bepaald te worden, waarbij anemie-gerelateerde klinische symptomen, de snelheid van Hb dalingen alsmede de mate waarin en snelheid waarmee patiënten zelf de afbraak kunnen compenseren moeten worden meegewogen conform de adviezen in de landelijke CBO richtlijn Bloedtransfusie 2011 (deze wordt momenteel herzien).
Een primo infectie met het ParvoB19 virus kan bij patiënten met chronisch hemolytische anemie leiden tot een aplastische crise met ernstige reticulopenie (Servant-Dalmas et al, Transfus Clin Biol 2016 en Abe et al, Acta Haematol 2006). Er zijn ook aanwijzingen voor een verhoogd risico op ernstige PNH gerelateerde trombose tijdens een Parvo B19 infectie (Schutgens et al, Thromb Haemost 2011 en Ottens et al, Br J Dermatol 2014). Het ParvoB19 virus wordt met name via de respiratoire route overgedragen, maar transmissie via bloedproducten is ook beschreven (Marano et al, Blood Transfus. 2015 en Kooistra et al, Vox Sang 2011). Een Nederlandse studie toonde aan dat tussen 2003 en 2009 0.006% van de Nederlandse donoren ten tijde van donatie een ParvoB19 infectie doormaakte met een virale load > 1 x 106 IU/ml (Marano et al, Blood Transfus. 2015). Alhoewel het risico op transmissie dus zeer gering is, wordt conform de huidige CBO richtlijn Bloedtransfusie 2011 vooralsnog geadviseerd patiënten met PNH zonder beschermende ParvoB19 IgG antistoffen te transfunderen met ParvoB19 veilige bloedproducten
In de literatuur zijn er geen vermeldingen van een ongunstig effect van transfusie van plasma-bevattende erytrocyten, mits deze leukocyten gereduceerd zijn (hetgeen in Nederland standaard procedure betreft) en ABO identiek (Sirchia et al, Transfusion 1990 en Fitzgerald et al, Transfusion Med 1994). Derhalve bestaat er geen indicatie tot het wassen van ABO identieke erytrocyten concentraten. Naar analogie van casuïstiek met hemolyse bij een patiënt met sikkelcelziekte na transfusie van een minor ABO incompatibel erytrocytenconcentraat valt echter te overwegen ook bij PNH patiënten met chronische hemolyse minor ABO incompatibe erytrocyten transfusies te vermijden.
Transfusie van plasma-bevattende trombocyten van een ABO minor gemismatchte donor (bv patiënt met bloedgroep AB, A, of B en donor met bloedgroep O) dient te worden vermeden. Enkele case reports vermelden een exacerbatie van PNH na transfusie van een (niet-leukogedepleteerd) trombocyten product met daarin complement-activerende ABO-antistoffen (Brecher et al, Transfusion 1989, Rosse, Transfusion 1989 en Jackson et al, J Clin Pathol 1992). Op basis hiervan wordt geadviseerd om bij minor ABO incompatibiliteit geconcentreerde trombocyten producten toe te dienen. Indien transfusie van niet-geconcentreerde trombocyten onvermijdelijk is, hebben trombocyten in PAS of ander plasma-arm bewaarmedium de voorkeur.
Vanwege het potentiële risico van complementactivatie geïnduceerd door een trombocyten product gerelateerde transfusiereactie bij zowel patiënten zonder en met eculizumab behandeling bestaat er ook in overige situaties (op theoretisch grond) een (relatieve) contra-indicatie tegen het toedienen van plasma-bevattende cellulaire bloedproducten. Hoewel hier geen studies naar verricht zijn, is op basis hiervan het beleid om PNH patiënten met chronische hemolyse geconcentreerde trombocyten te geven en toediening van plasma te vermijden. Een recente studie in 75 zwangerschappen bij 61 met eculizumab behandelde PNH vermeldde één trombose na plasmatransfusie vanwege een postpartum bloeding (Kelly et al, N Engl J Med 2015). De auteurs refereren aan deze casus ter ondersteuning van vigerend beleid voor het vermijden van transfusies van plasmarijke producten aan met eculizumab behandelde patiënten. Op basis van deze beperkte casuïstiek met de achterliggende theoretische overwegingen dat infusie van complement dan wel transfusie-gerelateerde inflammatie zouden kunnen leiden tot exacerbaties van PNH, heeft gerichte suppletie middels stollingsfactor concentraten de voorkeur in situaties waarin correctie van de secundaire hemostase is geïndiceerd.
In het onvermijdelijke geval van plasmatransfusie aan een met eculizumab behandelde patiënt, dient zo spoedig mogelijk overlegd te worden met het PNH-expertise centrum ten aanzien van noodzaak tot en dosis van additionele eculizumab toediening. In het expertise centrum heeft men tot nu toe het beleid gehanteerd om na 600 ml (2E) omniplasma zospoedig mogelijk (bij voorkeur binnen uren) een extra dosis van 300 mg en na 4E 600 mg eculizumab toe te dienen
PNH patiënten hebben in tegenstelling tot patiënten met andere aandoeningen met chronische hemolyse in het algemeen een ijzergebrek door de chronische intravasculaire hemolyse en de daarmee samengaande hemoglobinurie en hemosiderinurie (Olutogun, Blood Transfus 2015). Eculizumab blokkeert de vorming van het terminale complement complex (C5b-9) en de daaruit voortvloeiende complement-gemedieerde intravasculairehemolyse. Door een persisterende extravasculaire hemolyse veroorzaakt door rode bloedcel opsonisatie met C3 blijven enkele patiënten desondanks persisterend transfusie-afhankelijk. Omdat de hemolyse zich nu met name tot het extravasculaire compartiment beperkt en het overmatig ijzer niet renaal geklaard wordt, zijn deze patiënten at risk voor het ontwikkelen van ijzertoxiciteit. De ijzerstatus dient daarom regelmatig gecontroleerd te worden en zo nodig dient chelatie therapie gestart te worden.
Alhoewel hier geen studies naar zijn verricht, kan voor chronisch transfusie-afhankelijke PNH patiënten vanwege het cumulatief verhoogde risico op alloimmunisatie overwogen worden om naast standaard ABO identieke erytrocyten, tevens D, CcEe en K, en zo mogelijk ook Jka, compatibel bloed te geven. Het Jka antigen is hoog immunogeen (Evers et al, Lancet Haematol 2016) en anti-Jka is een complement activerende antistof.
Uitgangsvraag 10:
Hoe is de behandeling bij een zwangerschapswens?
|
Aanbeveling
|
Onderbouwing:
Inleiding
In het verleden werd patiënten met PNH ontraden om zwanger te worden in verband met het verhoogde risico op complicaties tijdens en kort na de zwangerschap, zoals verergering van hemolyse, toegenomen risico op infecties, bloedingen als gevolg van het ontstaan of verergeren van trombopenie, en levensbedreigende tromboembolieën, m.n. in de vena cava inferior, milt, lever, cerebrale venen en de placenta. Daarnaast geeft PNH een verhoogd risico op miskramen en prematuriteit. Hoewel zwangerschap bij PNH nog altijd risico’s met zich mee brengt, heeft de beschikbaarheid van eculizumab zwangerschap bij patiënten met PNH mogelijk gemaakt. De optimale behandelstrategie voor vrouwen met PNH tijdens de zwangerschap is nog niet uitgekristalliseerd.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Begeleiding van de zwangere PNH patiënt dient plaats te vinden in een PNH expertisecentrum met een nauwe samenwerking tussen hematoloog en gynaecoloog-perinatoloog. Patiënten met zwangerschapswens dienen verwezen te worden voor preconceptionele adviezen. (Ref 1-13) |
|
C |
Indien de zwangere vrouw nog niet met eculizumab werd behandeld, dient behandeling gestart te worden aan het begin van het 2e trimester en eerder bij aanwijzingen voor toegenomen hemolyse of andere belangrijke PNH-gerelateerde complicaties. (Ref 1-13) |
|
C |
Vaccinatie tegen meningokokken (ACW135Y) wordt indien mogelijk al voor de conceptie verricht. |
|
C |
Behandeling met laag-moleculair gewicht heparine in therapeutische dosering wordt aanbevolen tijdens de zwangerschap tot minimaal 3 maanden postpartum, mits er geen contra-indicaties zijn. (Ref 1-13) |
|
C |
Borstvoeding tijdens behandeling met eculizumab lijkt niet schadelijk voor het kind. (Ref 7) |
Samenvatting literatuur
Resultaten
Eculizumab tijdens de zwangerschap lijkt niet schadelijk te zijn voor moeder en kind. In alle case-reports beschreven in de literatuur zijn de kinderen gezond ter wereld gekomen en is de eculizumab niet te meten in de borstvoeding. In een recente internationale studie zijn 75 zwangerschappen bij 61 vrouwen met PNH tijdens behandeling met eculizumab geëvalueerd. Bij deze zwangerschappen werd 29% van de kinderen te vroeg geboren en waren er 3 foetale doden, en 6 miskramen in het 1e trimester. In deze studie kregen 25 baby’s borstvoeding en bij 10 van deze gevallen werd de borstvoeding geanalyseerd op de aanwezigheid van eculizumab en kon dit niet worden aangetoond.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 10)
Overwegingen:
Eculizumab vermindert de hemolyse en reduceert het risico op trombo-embolische complicaties buiten de zwangerschap. Tijdens de zwangerschap verandert de balans tussen pro- en anticoagulante systemen en fibrinolyse naar een hypercoagulabele situatie. In de onbehandelde situatie blijven veneuze tromboembolieën en longembolieën de belangrijkste oorzaken van maternale morbiditeit en mortaliteit. Het relatieve risico op tromboembolische events onder gezonder zwangere vrouwen of vrouwen in de postpartum periode is rond de 4.3. Bij zwangere patiënten met PNH is er een sterk verhoogd risico op overlijden (11.6%), waarbij de belangrijkste doodsoorzaak tromboembolieën zijn (60%). Om deze reden wordt aanbevolen om, indien de zwangere vrouw nog niet met eculizumab werd behandeld, behandeling te starten aan het begin van het 2e trimester en eerder bij aanwijzingen voor toegenomen hemolyse of andere belangrijke PNH-gerelateerde complicaties. Eculizumab biedt geen absolute bescherming tegen trombose in de zwangerschap, maar leidt wel tot een reductie in het aantal trombotische events. In de diverse case-reports werd slechts bij 1 vrouw postpartum een vena mesenterica trombose vastgesteld, en een 2 -tal postpartum longembolieën. In een recente internationale studie onder 61 vrouwen met PNH werden 2 tromboses gezien in de postpartum periode en 10 bloedingen. Het geven van antistolling bij zwangere vrouwen met PNH naast de eculizumab berust op expert opinion. Het wordt aanbevolen om patiënten te behandelen met laag-moleculair gewicht heparine in therapeutische dosering vanaf het moment dat de zwangerschap bekend is tot minmaal 3 maanden postpartum. Het risico op pre-eclampsie bij onbehandelde vrouwen met PNH is verhoogd. Pre-eclampsie kan ook optreden ondanks behandeling met eculizumab. Er werden in de literatuur geen gevallen van maternale sterfte beschreven bij vrouwen die behandeld werden met eculizumab. Doorbraakhemolyse kwam wel frequent voor tijdens de zwangerschap wat aanleiding is om de dosering van eculizumab of de frequentie van toediening te verhogen. In de grote internationale studie werd doorbraakhemolyse gezien bij 54% van de zwangerschappen.
Uitgangsvraag 11:
Welke maatregelen zijn nodig rondom een operatie?
|
Aanbeveling
|
Onderbouwing:
Inleiding
Chirurgische ingrepen kunnen leiden tot toename van complementproductie en activatie. Bij patiënten met PNH kan dit aanleiding geven tot toename van hemolyse, een verdere stijging van het tromboserisico en andere PNH-gerelateerde complicaties. Het is onduidelijk welke peri-operatieve maatregelen nodig zijn om de kans op complicaties zo klein mogelijk te maken.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Gezien de verhoogde kans op toegenomen hemolyse en trombose wordt geadviseerd om het beleid rondom een operatie bij een PNH patiënt af te stemmen met een PNH expert. (Ref 1-21) |
|
C |
Bij een patiënt die met eculizumab behandeld wordt, wordt aanbevolen om geplande ingrepen te verrichten binnen enkele dagen na de meest recente eculizumab toediening. Postoperatief moet dagelijks tot aan de geplande volgende dosis eculizumab gelet worden op tekenen van doorbraakhemolyse en trombotische complicaties. Zo nodig moet de volgende gift eculizumab vervroegd worden gegeven. (Ref 1,2,8,11, 16,17, 19) |
|
C |
Bij PNH patiënten die een abdominale trombose hebben doorgemaakt , moet bij operaties in het gebied van de eerdere trombose, rekening gehouden worden met (uitgebreide) collateraalvorming en peroperatieve bloedingscomplicaties. |
|
C |
Bij PNH patiënten die behandeld worden met vitamine K antagonisten, kan bridging plaatsvinden conform de richtlijn Diagnostiek, Preventie en Behandeling vanVeneuze Trombo-embolie en Secundaire Preventie Arteriële Trombose |
Samenvatting literatuur
Resultaten
Er zijn geen prospectieve of retrospectieve studies naar het effect van verschillende peri-operatieve maatregelen bij patiënten met PNH. De beschikbare literatuur over dit onderwerp bestaat uit case-reports. Hierin worden verscheidene maatregelen genoemd die de kans op PNH-gerelateerde complicaties zouden kunnen verminderen. Een aantal case-reports beschrijft een ongecompliceerd beloop van onder meer een open-hart operatie bij PNH patiënten die behandeld worden met eculizumab. In 1 case-report wordt eculizumab alleen in de periode rondom de operatie gegeven. Er zijn ook case-reports, met name uit de tijd voordat eculizumab beschikbaar kwam, waarbij een operatie ook zonder eculizumab ongecompliceerd verliep. Peri-operatieve maatregelen die genoemd worden zijn onder meer het toedienen van transfusies voorafgaand aan de operatie, profylactische antistolling met heparine of LMWH, profylactische toediening van antibiotica, het zorgen voor een ruime hydratie en terughoudendheid met toediening van trombocyten en FFPs.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 11)
Overwegingen:
Klinische studies op het gebied van peri-operatieve maatregelen bij patiënten met PNH ontbreken. De aanbevelingen berusten dus op gegevens uit case-reports en expert-opinie. Bij chirurgische ingrepen moet rekening gehouden worden met toename van hemolyse, trombose, infectierisico en bloedingen (bij trombopenie, gebruik antistolling of bijvoorbeeld bij uitgebreide collateraalvorming wanneer in een gebied geopereerd wordt waar eerder trombose is opgetreden). Complicaties lijken zich soms al bij relatief kleine ingrepen voor te kunnen doen, zoals na het inbrengen van een centraal veneuze katheter. Een goede samenwerking tussen chirurg en PNH behandelaar is belangrijk om een peri-operatief behandelplan op te stellen, aangepast aan de individuele patiënt en de aard van de geplande ingreep. Aspecten die hierbij aan de orde moeten komen zijn het transfusie-beleid, antistolling, profylactische antibiotica en het peri-operatief monitoren van de hemolyseparameters. Er is niet bekend of tijdelijke toediening van eculizumab rondom een operatie (bij patiënten die anderszins nog geen indicatie hiervoor hadden) de kans op complicaties kan verkleinen. Het weer staken van eculizumab kan op zichzelf ook aanleiding tot complicaties geven.
Bij patiënten die reeds met eculizumab behandeld worden, dient een geplande ingreep plaats te vinden in de eerste dagen na een eculizumabtoediening om de kans op doorbraakhemolyse te verkleinen. Afhankelijk van het per- en postoperatieve beloop (bijvoorbeeld de mate van bloedverlies, het verloop van de hemolyseparameters, het optreden van trombose) kan de volgende gift eculizumab al dan niet vervroegd worden gegeven. Er is geen bewijs dat profylactische antibiotica de kans op infecties rondom een operatie verkleinen bij patiënten die eculizumab gebruiken. De afweging om profylactisch antibiotica te geven hangt af van het type operatie en andere factoren (bijvoorbeeld een granulocytopenie) die bij kunnen dragen aan verhoogde infectiegevoeligheid van de patiënt.
Uitgangsvraag 12:
Hoe is de follow-up bij patiënten met PNH?
|
Aanbeveling Frequentie van poliklinische follow-up:
NB patiënt dient geïnstrueerd te worden over PNH gerelateerde klachten en veranderingen waarbij hij niet moet wachten tot de volgende afspraak maar direct contact moet opnemen met zijn specialist.
Aandachtspunten bij poliklinische follow-up: Anamnese: aanwijzingen voor (doorgemaakte) trombose en infecties, bloedingen, moeheid, dyspnoe, kleur van de urine, icterus, buikpijn, hoofdpijn, slikklachten, erectiestoornissen, verminderd concentratievermogen, functioneren school/werk/sociaal, zwangerschap(swens), transfusies, bijwerkingen medicatie en therapietrouw. Meest recente vaccinatie tegen meningokokken (bij eculizumab). Lichamelijk onderzoek: bloeddruk, pols, icterus, dyspnoe, hart en vaten, lever -en miltgrootte, mogelijke tekenen van doorgemaakte trombose, groei (bij kinderen) Laboratoriumonderzoek: Hb en Ht, leukocyten met differentiatie, trombocyten, reticulocyten, MCV, kreatinine/MDRD, bilirubine totaal en direct, AF, ASAT, ALAT, gGT, LDH, CRP, Fe, TIJBC en ijzerverzadiging, ferritine. PNH kloongrootte (minimaal 1 x per 6 maanden, bij veranderingen in kloongrootte minimaal 1 x per 3 maanden). Ter overweging: d-dimeer, nt-proBNP en erytrocytenkloon. Aanvullend onderzoek: Echo of CT abdomen (bij patiënten die geen eculizumab krijgen minimaal 1 x per 1-2 jaar), ECG (minimaal 1 x per jaar). Ter overweging: beenmergonderzoek, analyse naar pulmonale hypertensie. |
Onderbouwing:
Inleiding
Bij de follow-up van patiënten met PNH moet steeds opnieuw aandacht worden besteed aan (veranderingen in) de mate van hemolyse, beenmergfalen, tromboseneiging en (het ontstaan van) andere onderliggende beenmergaandoeningen, zoals myelodysplastisch syndroom of aplastische anemie. Belangrijk is om te bespreken hoe het klachtenbeloop is en in welke mate de kwaliteit van leven hierdoor wordt beïnvloed.
Conclusie(s)
|
SORT Grade |
Aanbeveling |
|
C |
Frequentie van follow-up |
|
C |
Aandachtspunten bij follow-up |
Samenvatting literatuur
Resultaten
Gezien het ontbreken van gerichte studies op dit gebied is er is geen systematische literatuuronderzoek gedaan naar aanbevelingen voor follow-up van patiënten met PNH, maar gebruik gemaakt van bestaande richtlijnen, reviews, expert-opinie en de mening van de werkgroepleden.
Literatuur
Overwegingen:
Bij follow-up moet steeds aandacht worden besteed aan veranderingen in het klinisch beeld van de PNH. De mate van hemolyse, beenmergfalen en tromboseneiging moeten worden geëvalueerd, evenals de impact van de klachten op het dagelijks leven van de patiënt. Daarnaast moet gelet worden op aanwijzingen voor een zich ontwikkelende andere beenmergziekte zoals een aplastische anemie. Vanzelfsprekend moeten patiënten geïnstrueerd worden om tussentijds klachten die kunnen wijzen op bijvoorbeeld toename van hemolyse of trombose te melden. Met name indien er aanwijzingen zijn voor trombose, moet direct contact worden opgenomen omdat dit met spoed starten van eculizumab noodzakelijk kan maken (eculizumab kan mogelijk verdere voortgang van de trombose remmen indien dit in de acute fase gestart wordt). Het effect van de PNH behandeling en de therapietrouw van patiënten moeten worden beoordeeld en bij patiënten die met eculizumab behandeld worden moet speciaal aandacht worden besteed aan de veiligheidsmaatregelen zoals het op voorraad hebben van antibiotica en de vaccinatiestatus van de patiënt (met betrekking tot de meningokokkenvaccinatie).
Uitgangsvraag 13:
Wanneer kan eculizumab gestaakt worden?
|
Aanbeveling In verband met de kans op het ontstaan van ernstige hemolyse en trombose na staken van eculizumab, is het advies om eculizumab alleen in uitzonderingsgevallen te staken:
In de eerste periode na staken van eculizumab (tenminste gedurende 8 weken) moet wekelijks gecontroleerd worden op eventuele toename van hemolyse of mogelijke andere PNH-gerelateerde complicaties. |
Onderbouwing:
Inleiding
PNH is een chronische ziekte. Behandeling met eculizumab geneest de PNH niet. Stamceltransplantatie is de enige mogelijk curatieve behandeling. Dit betekent dat als er een indicatie is voor behandeling met eculizumab, deze behandeling in principe levenslang geïndiceerd is. Bij een enkele patiënt neemt de PNH kloon in de loop van de tijd spontaan af in grootte.
Conclusie(s)
|
SORT Grade |
Aanbeveling |
|
C |
In verband met de kans op het ontstaan van ernstige hemolyse en trombose na staken van eculizumab, is het advies om eculizumab alleen in uitzonderingsgevallen te staken:
|
|
C |
In de eerste periode na staken van eculizumab (tenminste gedurende 8 weken) moet wekelijks gecontroleerd worden op eventuele toename van hemolyse of mogelijke andere PNH-gerelateerde complicaties . (Ref 3) |
Samenvatting literatuur
Resultaten
Eculizumab wordt zelden gestaakt, aangezien PNH een chronische ziekte betreft die door eculizumab niet te genezen is. Er zijn dan ook geen klinische studies naar het effect van het stoppen van eculizumab.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 13)
Overwegingen:
Aangezien PNH een chronische ziekte betreft die door eculizumab niet te genezen is, wordt eculizumab zelden gestaakt. Er is dan ook geen klinisch onderzoek verricht naar het effect van het staken. Door het staken van eculizumab vervalt de remming van complement en zal de hemolyse toenemen en de kans op trombose stijgen. In de literatuur wordt een aantal maal melding gemaakt van het optreden van trombose in de eerste dagen of weken na het staken van eculizumab. Ook onder (internationale) PNH behandelaren is casuïstiek hierover bekend. De werkgroep heeft een aantal situaties gedefinieerd waarin het staken van eculizumab verantwoord wordt geacht. In de eerste plaats wanneer eculizumab niet effectief is op basis van een polymorfisme in complement C5, waardoor eculizumab niet goed aan C5 kan binden. Een dergelijk polymorfisme is beschreven bij ongeveer 3,5% van de Japanse populatie. In Nederland is 1 patiënt bekend zonder Aziatische voorouders die een vergelijkbaar polymorfisme heeft en gestopt is met eculizumab. De patiënt wordt inmiddels in studieverband met een nieuwe complementinhibitor behandeld. In de tweede plaats kan eculizumab gestaakt worden wanneer de PNH kloongrootte daalt tot onder de 10% (bij herhaling gemeten). Deze grens is arbitrair. Een dergelijke afname van de PNH kloon komt zelden voor. In de derde plaats kan eculizumab gestaakt worden wanneer een PNH patiënt een allogene stamceltransplantatie ondergaat en de PNH kloon daarna niet meer detecteerbaar is. Er is internationaal geen consensus over de exacte duur van de eculizumab behandeling na transplantatie. De werkgroep adviseert de eculizumab te staken wanneer na repopulatie de PNH kloon bij herhaling niet meer detecteerbaar is. Ten slotte kan bij vrouwen die minimaal 3 maanden geleden bevallen zijn en voor de zwangerschap geen indicatie hadden voor behandeling met eculizumab worden overwogen om de behandeling met eculizumab te staken. De risico’s van staken van de behandeling (massale hemolyse, optreden trombose) dienen op individuele basis afgewogen te worden en met de betreffende vrouw te worden besproken. Wanneer besloten wordt de eculizumab te staken wordt geadviseerd om, vanaf 14 dagen na de laatste toediening, de eerste 8 weken ten minste wekelijks te controleren op toename van hemolyse of andere PNH-gerelateerde complicaties.
Aanvullende literatuur
Uitgangsvraag 14:
Wat te doen bij persisterende of tijdelijke toename van hemolyse tijdens eculizumab?
|
Aanbeveling In het geval van persisterende/tijdelijke toename van hemolyse wordt geadviseerd om te overleggen met een PNH expert. In geval van eenmalige tijdelijke toename hemolyse:
Bij terugkerende tijdelijke toename hemolyse zonder duidelijke oorzaak:
Bij continu persisterende hemolyse ondanks eculizumabgebruik:
|
Onderbouwing:
Inleiding
Normaal gesproken wordt na start van eculizumab een snelle daling gezien van de hemolyseparameters. Die daling zet al in na de eerste toediening van eculizumab. De hemolyseparameters normaliseren niet bij iedere patiënt volledig, ondanks een adequate dosering eculizumab. Zo is het LDH vaak nog licht verhoogd, evenals het bilirubine en het aantal reticulocyten. Het haptoglobine blijft bij bijna alle patiënten onmeetbaar. Deze waarnemingen betekenen niet dat de eculizumab onvoldoende werkt. Soms komt het echter voor dat er gedurende de behandeling met eculizumab opnieuw een duidelijke (tijdelijke) toename van hemolyse wordt gezien of (zelden) dat de hemolyseparameters niet dalen.
Conclusie(s)
|
SORT Grade |
Conclusie: |
|
C |
In het geval van persisterende/tijdelijke toename van hemolyse wordt geadviseerd om te overleggen met een PNH expert. In geval van eenmalige tijdelijke toename hemolyse (Ref 1,2, 4-6):
|
|
C |
Bij terugkerende tijdelijke toename hemolyse zonder duidelijke oorzaak (Ref 1,2, 4-6):
|
|
C |
Bij continu persisterende hemolyse ondanks eculizumabgebruik:
|
Samenvatting literatuur
Resultaten
Er zijn geen klinische studies verricht die zich specifiek bezig houden met het optreden van doorbraakhemolyse of persisterende hemolyse bij eculizumab. In verschillende studies naar het effect van eculizumab (zie met name uitgangsvraag 1) wordt wel melding van doorbraakhemolyse gemaakt. In de open label extensie studie van Hillmen et al (2013) wordt genoemd dat bij 21 van de 195 patiënten het standaard dosisinterval van 14 dagen 1 of meerdere malen is verkort. Kelly et al (2011) hebben in hun prospectieve studie bij 4 van de 21 patiënten die transfusie-afhankelijk bleven in verband met doorbraakhemolyse de dosis verhoogd naar 1200 mg per 14 dagen. In de Shepherd studie (Brodsky et al, 2008) werd bij 8/97 patiënten het doseringsinterval verkort naar 12 dagen in verband met een toename van complement-activiteit en hemolyse in de 1-2 dagen voor een geplande eculizumabtoediening. Bij zwangere patiënten die eculizumab gebruikten (Kelly et al, 2015) werd bij 54% de dosis verhoogd of het doseringsinterval aangepast in verband met doorbraakhemolyse.
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 14)
Overwegingen:
Normaal gesproken wordt na start van eculizumab een snelle daling van de hemolyseparameters (met name het LDH gezien). In de literatuur en in de ervaring van de werkgroep is een aantal situaties te onderscheiden waarin ondanks behandeling met eculizumab toch een tijdelijke of persisterende toename van hemolyse wordt gezien.
Eenmalige, tijdelijke toename van hemolyse: dit kan bijvoorbeeld optreden op het moment van een infectie. Door de toegenomen activiteit van complement is de complementremming op dat moment onvoldoende. Meestal verdwijnt de toegenomen hemolyse snel na adequate behandeling van de infectie. Daarom is de werkgroep van mening dat terughoudendheid gewenst is met het vervroegen van de volgende eculizumabdosering. Maar bij fors toegenomen en aanhoudende hemolyse kan dit worden overwogen in overleg met een PNH expertisecentrum.
Terugkerende, tijdelijke toename van hemolyse: hiermee wordt bedoeld dat juist voor de volgende dosis eculizumab de symptomen van de PNH terugkeren en de hemolyse parameters in het bloed stijgen. De eculizumabconcentratie is gedaald tot beneden het minimum om complement te kunnen remmen. Men kan dit vaststellen door bloedafname op dag 3-6, dag 7-11 en juist voor een nieuwe eculizumab toediening (en dat tijdens 2 cycli). Bij doorbraak hemolyse zijn de hemolyse parameters kort na de eculizumab toediening goed en stijgen ze korter of langer vóór de volgende toediening. Het meten van de complementactiviteit (CH50) en eculizumabdalspiegel (bepaling in het Radboudumc Expertisecentrum PNH) kan hierbij helpen. Bij terugkerende doorbraakhemolyse moet overwogen worden om de dosering eculizumab te verhogen naar 1200 mg per 14 dagen of het dosisinterval te verkorten.
Persisterende hemolyse tijdens gebruik van eculizumab: hierbij dalen de hemolyseparameters niet na start van de eculizumab of er treedt later tijdens de behandeling een persisterende stijging van de hemolyseparameters op. De laatste situatie zou in theorie kunnen ontstaan door vorming van humane antilichamen tegen eculizumab. Dit lijkt echter niet of nauwelijks op te treden en heeft, zover bekend, nooit geleid tot een toegenomen hemolyse tijdens behandeling. Bij ontbreken van een andere verklaring moet hieraan gedacht worden. Indien eculizumab vanaf de start niet effectief is in het reduceren van hemolyse, kan sprake zijn van een C5 polymofisme waardoor eculizumab niet goed aan C5 kan binden. Dit lijkt vaker voor te komen in de Japanse populatie. In Nederland is 1 patënt beschreven met een C5 polymorfisme. Deze patiënt wordt inmiddels in studieverband behandeld met een nieuwe generatie complementinhibitor (klinische studie Radboudumc).
het is van belang te beseffen dat tijdens eculizumabgebruik extravasculaire hemolyse kan optreden. Dit komt doordat eculizumab het complement C3 niet remt en dit door binding aan de celmembraan van de erytrocyt kan leiden tot afbraak in lever of milt. Er is geen goede behandeling hiervoor beschreven.
Uitgangsvraag 15:
Wat zijn specifieke aandachtspunten bij kinderen met PNH?
|
Aanbeveling
|
Onderbouwing:
Inleiding
Hoewel PNH zich met name presenteert bij volwassenen rond de 30-40 jaar, presenteert de ziekte zich ook op kinderleeftijd (mediane leeftijd 14 jaar). Door de zeldzaamheid zijn beschikbare gegevens hierover schaars.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Bij de anamnese moet ermee rekening gehouden worden dat het voorkomen en rapporteren (soort, ernst) van somatische verschijnselen afhankelijk is van de leeftijd en ontwikkelingsfase van het kind.(Ref 3, 6, 7, 9, 12, 15, 16) |
|
C |
Het risico op trombose bij PNH is kleiner dan bij volwassenen. Kinderen die postpuberaal zijn, dienen te worden beschouwd als volwassenen. Behandeling met vitamine K antagonisten is lastiger bij kinderen en er zijn geen studies naar het effect hiervan bij kinderen met PNH gedaan. De beslissing om profylactisch ontstollen dient per patiënt zorgvuldig te worden overwogen. (Ref 2,3, 8-10, 14, 15) |
|
C |
Het is niet onderzocht wat het juiste doseringsschema is van eculizumab bij kinderen met PNH. Bij kinderen vanaf 40 kg wordt vooralsnog geadviseerd om de dosering volgens het schema voor volwassenen aan te houden. Bij kinderen onder de 40 kg kan geen standaardoseringsschema worden geadviseerd. |
|
C |
Omdat allogene stamceltransplantatie een curatieve behandeling is en de risico’s van deze behandeling bij kinderen in vergelijking met volwassenen kleiner zijn, kan dit in specifieke gevallen een reden zijn om bij kinderen met PNH te besluiten tot een behandeling met SCT. (Ref 4, 5, 11) |
Samenvatting literatuur
Resultaten
De beschikbare gegevens over PNH bij kinderen komen uit case-reports, kleine case-series en recent uit de internationale PNH registry (PNHR). De meeste klinische data stammen uit de tijd voor het beschikbaar komen van eculiuzmab. De belangrijkste case-series beschrijven respectievelijk 26 patiënten (Ware et al.), 11 patiënten (van den Heuvel et al.), 18 patiënten (Naithani et al.) en 12 patiënten (Curran et al). In deze studies wordt in een meerderheid van de patiënten een onderliggende beenmergziekte (AA of MDS) aangetoond, variërend van 9/18 (Naithani et al.) tot 11/11 (van den Heuvel et al). De incidentie van trombose in deze studies varieert van 1/18 (Nathani et al.) tot 6/12 (Curran et al.). Meer recente prospectieve studies in pediatrische patienten met AA of MDS (met name refractory cytopenia of childhood RCC, “hypoplastische MDS”) rapporteren de aanwezigheid van significante PNH klonen in 21.4% en 53% (Yoshida et al., Timeus et al.) in AA en 41% (Aalbers et al.) in RCC. Klinische verschijnselen in kinderen met PNH komen grotendeels overeen met volwassen patiënten (Ware et al, Schrezenmeier et al). Recente data uit de PNHR m.b.t. 94 pediatrische PNH patiënten suggereren een lagere actuele incidentie van trombose (2.1% versus 8.7%) en een hogere incidentie van patiënten met AA en klachten van buikpijn (Urbano-Ispizua et al.). Tevens lijkt er op basis van de oude case series bij kinderen met PNH frequenter sprake van diagnostic delay (Ware et al, van den Heuvel et al).
De incidentie en het risico op het krijgen van trombose voor kinderen met PNH is grotendeels onbekend. In de oudere case series werd in 22/82 patiënten een thrombose is vastgesteld (gemiddeld 26.8%, spreiding 0-50%). Volgens de meest recente data uit de PNHR is de incidentie van trombose 2.1% (versus 8.7% bij volwassenen) gebaseerd op data van 94 pediatrische patienten, (Urbano-Ispizua et al.) inclusief patiënten die worden behandeld met eculizumab. Het is onbekend of er een indicatie is voor het profylactisch ontstollen van alle pediatrische patiënten met een grote PNH kloon (>50%). In het algemeen wordt aangenomen dat het risico op trombose toeneemt met de leeftijd van kinderen en met name het doormaken van de puberteit (Toulon, Ishola et al, Andrew et al.). Het (profylactisch) behandelen van kinderen met VKA is moeilijker dan bij volwassenen en vraagt een leeftijdsspecifieke strategie (Spoor et al.).
De ervaring met allogene SCT bij kinderen met klassieke PNH is minimaal De behandeling van AA en RCC (+/- kleine PNH kloon) op de kinderleeftijd middels (upfront) allogene stamceltransplantatie kent zeer goede resultaten, gekenmerkt door een zeer lage mortaliteit en acceptabele morbiditeit (Samarasinghe et al., Dufour et al.).
Zoeken en selecteren
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 15)
Overwegingen:
Door de zeldzaamheid van de ziekte zijn de gegevens over de presentatie, het beloop en de behandeling van PNH bij kinderen erg beperkt. In vergelijking met volwassenen lijkt bij presentatie het beenmergfalen meer op de voorgrond te staan dan de hemolyse. De manier waarop kinderen de klachten uiten is mede afhankelijk van hun leeftijd en ontwikkelingsfase. Hierdoor, maar ook door de (net als bij volwassenen) vaak aspecifieke symptomen en door de zeldzaamheid van de ziekte wordt de diagnose vaak pas laat gesteld. Trombose komt ook bij kinderen met PNH, die niet behandeld worden met eculizumab, vaak voor (bij 18-50%) en kan fataal verlopen. Er zijn geen studies verricht naar profylactische antistolling bij kinderen met PNH. Gezien de implicaties van deze behandeling bij kinderen en bijvoorbeeld problemen wat betreft therapietrouw, moet de afweging om profylactische antistolling te starten op individuele basis worden gemaakt. Bij kinderen met PNH wordt in vergelijking met volwassenen vaker gekozen voor behandeling met een stamcel/beenmergtransplantatie. Gezien het ontbreken van goede studies op dit gebied moet ook dit op individuele basis worden beoordeeld en afgewogen worden tegen een behandeling met eculizumab. De dosering van eculizumab is niet goed onderzocht bij kinderen van PNH. Er zijn wel doseringsschema’s die bijvoorbeeld ook in het kader van aHUS bij kinderen worden gebruikt. Bij kinderen die meer dan 40 kg wegen wordt vooralsnog geadviseerd om het volwassen doseringsschema aan te houden totdat er meer gegevens hierover bekend zijn.
Uitgangsvraag 1 – Wat zijn de indicaties voor behandeling met eculizumab?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
PICO 1
Relevante uitkomstmaten
Afname hemolyse, verandering hemoglobine, transfusie-behoefte, optreden van transfusie-onafhankelijkheid, incidentie trombose, overall survival, kwaliteit van leven, nierfunctie, uitkomst zwangerschap.
Zoeken en selecteren (methode)
In de database Pubmed is op 4-8-2016 met relevante zoektermen gezocht naar het antwoord op bovengenoemde uitgangsvraag
De resultaten staan onder vermeld:
15 onderzoeken zijn opgenomen in de literatuuranalyse.
De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“eculizumab” [Supplementary Concept]) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
4-8-2016 |
187 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 2 – Wat zijn de belangrijkste bijwerkingen van eculizumab en hoe kunnen deze worden voorkomen/behandeld?
Zoeken en selecteren:
Zie voor de systematische literatuuranalyse: bijlage 1 (uitgangsvraag 2)
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
PICO 1
Relevante uitkomstmaten
Bijwerkingen
Zoeken en selecteren (methode)
In de database Pubmed is op 7-8-2016 met relevante zoektermen gezocht naar het antwoord op bovengenoemde uitgangsvraag
De resultaten staan hieronder weergegeven
8 onderzoeken (overig 4 case-reports) zijn opgenomen in de literatuuranalyse.
De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Medline |
((“Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept]) AND “eculizumab” [Supplementary Concept]) AND ( “adverse effects” [Subheading] OR “Drug-Related Side Effects and Adverse Reactions”[Mesh] ) |
7-8-2016 |
51 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 3 – Hoe wordt eculizumab gedoseerd?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Zie uitgangsvragen 1 en 2
Relevante uitkomstmaten
Dosering
Zoeken en selecteren (methode)
Zie uitgangsvragen 1 en 2
Evidence:
geen evidence tabellen
Uitgangsvraag 4 – Wanneer moet gestart worden met antistolling?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Trombose
Zoeken en selecteren (methode)
In de databases Pubmed is met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder vermeld.
0 onderzoeken (alleen reviews, bestaande richtlijnen, expert opinion) zijn opgenomen in de literatuuranalyse.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
PNH patients, anticoagulans, thrombosis |
|
38 |
Evidence:
Geen evidence tabellen
Uitgangsvraag 5 – Wat is de rol van ATG/ciclosporine bij PNH?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Afname hemolyse, verandering hemoglobine, transfusie-behoefte, optreden van transfusie-onafhankelijkheid, incidentie trombose, overall survival, kwaliteit van leven, nierfunctie, uitkomst zwangerschap
Zoeken en selecteren (methode)
In de database Pubmed is op 7-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder vermeld:
7 onderzoeken (overig 6 case-reports/case-series) zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept]) AND (“Cyclosporine”[Mesh]OR “anti-thymocyte globulin” OR ATG) |
7-8-2016 |
54 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 6 – Is er een rol voor corticosteroïden?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Afname hemolyse, verandering hemoglobine, transfusie-behoefte, optreden van transfusie-onafhankelijkheid, incidentie trombose, overall survival, kwaliteit van leven, nierfunctie, uitkomst zwangerschap
Zoeken en selecteren (methode)
In de databases Pubmed is op 7-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder vermeld
2 onderzoeken (overig 2 case-reports/case-series en 3 reviews) zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“Prednisone”[Mesh] OR corticosteroid*) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
7-8-2016 |
51 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 7 – Is er een rol voor erytropoietine?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Hb, transfusie-afhankelijkheid
Zoeken en selecteren (methode)
In de databases Pubmed is op 20-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder vermeld
2 onderzoeken (overig 4 case-reports) is opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“Erythropoietin”[Mesh] OR “Epoetin Alfa”[Mesh] OR “Darbepoetin alfa”[Mesh]) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
20-8-2016 |
25 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 8 – Wat is de rol van stamceltransplantatie bij PNH?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Morbiditeit, mortaliteit
Zoeken en selecteren (methode)
In de databases Pubmed is op 17-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder:
11 onderzoeken (overig case-series/case-reports) zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn als bijlage toegevoegd.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept]) AND ( “Cord Blood Stem Cell Transplantation”[Mesh] OR “Stem Cell Transplantation”[Mesh] OR “Hematopoietic Stem Cell Transplantation”[Mesh] OR “Peripheral Blood Stem Cell Transplantation”[Mesh] ) |
17-8-2016 |
85 |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 10 – Hoe is de behandeling bij een zwangerschapswens?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
Zwangerschapsuitkomst
Zoeken en selecteren (methode)
In de databases Medline (OVID), Embase and Cochrane is op 28-7-2016 met relevante zoektermen gezocht naarhet antwoord op bovengenoemde uitgangsvraag.
De resultaten staan hieronder vermeld:
1 retrospectief onderzoek (overig case-reports, reviews) is opgenomen in de literatuuranalyse.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Medline |
PNH pregnancy eculizumab |
28 juli 2016 |
19 |
|
Embase |
PNH pregnancy eculizumab, full text human english |
28 juli 2016 |
18 |
|
Cochrane |
PNH pregnancy eculizumab |
28 juli 2016 |
– |
Evidence:
Evidencetabellen – zie bijlage 2
Uitgangsvraag 11 – Welke maatregelen zijn nodig rondom een operatie?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
peri-operatieve complicaties
Zoeken en selecteren (methode)
In de databases Pubmed is op 23-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande vraag
De resultaten staan hieronder vermeld.
0 onderzoeken (alleen case reports) zijn opgenomen in de literatuuranalyse.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“General Surgery”[Mesh] OR “Surgical Procedures, Operative”[Mesh] OR “surgery” [Subheading]) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
23-8-2016 |
331 |
Evidence:
Geen evidence tabellen
Uitgangsvraag 13 – Wanneer kan eculizumab gestaakt worden?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
morbiditeit, mortaliteit
Zoeken en selecteren (methode)
In de databases [Medline (OVID), Embase and Cochrane] is op 28-8-2016 met relevante zoektermen gezocht naarhet antwoord op bovenstaande vraag
0 onderzoeken zijn opgenomen in de literatuuranalyse.
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“eculizumab” [Supplementary Concept]) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
24-8-2016 |
188 |
Evidence:
Geen evidence tabellen
Uitgangsvraag 14 – Wat te doen bij persisterende of tijdelijke toename van hemolyse tijdens eculizumab?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
doorbraak hemolyse of persisterende hemolyse
Zoeken en selecteren (methode)
In de databases Pubmed is op 28-8-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande uitgangsvraag
De resultaten staan hieronder vemeld:
5 onderzoeken zijn opgenomen in de literatuuranalyse. De evidencetabellen hiervan en beoordeling van individuele studiekwaliteit zijn eerder besproken (uitgangsvraag 1, behandeling)
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“eculizumab” [Supplementary Concept]) AND ( “Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein” [Supplementary Concept] ) |
4-8-2016 |
187 |
|
Pubmed |
“breakthrough hemolysis” OR “persistent hemolysis” |
28-8-2016 |
25 |
Evidence:
Geen evidence tabellen
Uitgangsvraag 15 – Wat zijn specifieke aandachtspunten bij kinderen met PNH?
Zoeken en selecteren:
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
PICO 1
Relevante uitkomstmaten
morbiditeit, mortaliteit
Zoeken en selecteren (methode)
In de database Pubmed is op 14-9-2016 met relevante zoektermen gezocht naar het antwoord op bovenstaande vraag
De resultaten staan hieronder vermeld (inclusief aanvullende literatuurreferenties):
Zoekverantwoording:
|
Database |
zoektermen / zoekstrategie |
Datum |
Aantal hits |
|
Pubmed |
(“Hemoglobinuria, Paroxysmal”[Mesh] OR “phosphatidylinositol glycan-class A protein”[Supplementary Concept]) AND (“Pediatrics”[Mesh] OR childhood): 25 hits |
14-9-2016 |
25 |
Evidence:
Geen evidence tabellen
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie (NVvH)
Geldigheid: uiterlijk in 2019 bepaalt de werkgroep PNH of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. De landelijke werkgroep PNH is als houder van deze richtlijn de eerst verantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.