Terug naar het richtlijnenoverzicht
Primair centraal zenuwstelsel lymfoom (PCZSL) is een maligne lymfoom, gelokaliseerd in hersenen, ruggenmerg, liquor of oog. Per definitie is er geen systemische lokalisatie. Lymfoom van de dura behoort evenmin tot PCZSL (is buiten de bloed-hersenbarriere).
De grote meerderheid van PCZSL betreft een grootcellig B-cel lymfoom (DLBCL). Een laaggradig B-cel PCZSL of T-cel PCZSL komt slechts zelden voor en deze vallen buiten de scope van deze richtlijn.
PCZSL is een zeldzaam lymfoom; het betreft < 1% van de lymfomen, en ongeveer 4% van de hersentumoren. De incidentie in Nederland is 0,44/100.000, ongeveer 70 patiënten per jaar. (1) De mediane leeftijd is 65 jaar.
De presenterende klachten zijn vaak neurologisch van aard, en afhankelijk van de lokalisatie(s) van het lymfoom. Meest voorkomende symptomen zijn hemiparese, ataxie, cognitieve stoornissen, epilepsie en hoofdpijn. (2) Een speciale, zeldzame lokalisatie is het oog (glasvocht, retina), met als symptomen pijn in het oog of wazig zien. Dit kan voorkomen bij aanwezigheid van een intracerebrale lokalisatie, maar kan ook de enige lokalisatie zijn. In het laatste geval spreken we van een primair vitreoretinaal lymfoom (PVRL. Voorheen ook wel intraoculair lymfoom genoemd).
Een delay in diagnose komt vaak voor, door de zeldzaamheid en aspecifieke klachten. (3) Van belang is dat er snel histologische diagnostiek wordt verricht, en pas daarna gestart wordt met steroïden.
Referenties
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van het PCZSL bij volwassenen. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze betreffen een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met een PCZSL. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, en tracht een betere uniformiteit van behandeling en daarmee een betere kwaliteit van zorg en uiteindelijk betere overleving van deze patiënten in Nederland te bewerkstelligen. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Op het moment van bespreken en starten van een behandeling zijn patiënten niet altijd in staat de mogelijke gevolgen hiervan te overzien. Men accepteert dat bestrijding van de ziekte nodig is en heeft het ‘noodzakelijk kwaad’ van de bijwerkingen te accepteren. Bijwerkingen op de langere termijn hebben grote invloed op de kwaliteit van leven. Het verdient daarom aanbeveling de patiënt bij de start van iedere behandeling te informeren over de meest voorkomende bijwerkingen en de mogelijkheid om bepaalde middelen niet of in mindere mate in te zetten, en de consequenties die dat zou kunnen hebben.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een PCZSL, zoals internist-hematologen, neurologen, pathologen en radiotherapeuten.
Multidisciplinair overleg (MDO)
De diagnostiek en behandeling van een primair centraal zenuwstelsel lymfoom is bij uitstek multidisciplinair, waarbij de neuroloog, hematoloog en radiotherapeut een belangrijke rol spelen. De werkgroep beveelt aan om het behandelplan te formuleren in een multidisciplinair overleg (MDO), waarin deze disciplines vertegenwoordigd zijn.
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht door de werkgroepleden. In veel gevallen is afgezien van een systematische search met als mogelijke redenen: het ontbreken van voldoende gepubliceerde studies of de beschikbaarheid van recente internationale evidence-based richtlijnen of systematische reviews.
Werkwijze
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline en Cochrane. Aanvullend werd gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs.
Door de zeldzaamheid, en het gebrek aan gerandomiseerde studies, is een groot deel van de aanbevelingen en adviezen gebaseerd op consensus of expert opinion.
Kwaliteitsindicator diagnostisch proces
Bij diagnostiek van een PCZSL wordt een MRI met contrast verricht, en een histologisch biopt van de afwijking. Wanneer een histologisch biopt (technisch) niet mogelijk is, vormt de combinatie van karakteristiek MRI beeld en aantoonbare monoclonale B-cellen bij immunofenotypering op liquor een alternatief
Kwaliteitsindicator behandeling
De eerstelijnsbehandeling (met curatieve opzet) van het PCZSL bevat tenminste hoge dosis methotrexaat.
Strength-of-Recommendation Taxonomy (SORT)
|
Code |
Definition |
|
A |
Consistent, good-quality patient-oriented evidence * |
|
B |
Inconsistent or limited-quality patient-oriented evidence * |
|
C |
Consensus, disease-oriented evidence*, usual practice, expert opinion, or case series for studies of diagnosis, treatment, prevention, or screening |
* Patient-oriented evidence measures outcomes that matter to patients: morbidity, mortality, symptom improvement, cost reduction, and quality of life. Disease-oriented evidence measures immediate, physiologic, or surrogate end points that may or may not reflect improvements in patient outcomes (e.g. blood pressure, blood chemistry, physiologic function, pathologic findings).
De conceptrichtlijn is op 04 december 2023 voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH) en de Nederlandse vereniging voor Pathologie (NVVP). Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren.
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van Hematon (Drs. T.S. de Vries).
In de werkgroep zijn knelpunten geformuleerd, die hebben geleid tot uitgangsvragen.
Diagnostiek
Behandeling
Responsevaluatie en follow-up
Therapie schema’s
Aanbevelingen
De diagnose primair centraal zenuwstelsel lymfoom (PCZSL) wordt bij voorkeur gesteld op basis van een histologisch biopt volgens de meest recente WHO classificatie. Wanneer een histologisch biopt (technisch) niet mogelijk is, vormt de combinatie van karakteristieke MRI beeldvorming en aantoonbare monoclonale B-cellen bij immunofenotypering op liquor (met eventueel de aanwezigheid van MYD88 mutatie), een alternatief voor het stellen van de diagnose PCZSL.
In uitzonderlijke gevallen, wanneer biopt en LP niet mogelijk zijn, en er ook verdenking is op intravitreale betrokkenheid, kan een vitrectomie de diagnose bevestigen.
Het tempo van diagnostiek is belangrijk. Bij verdenking op een PCZSL dient de diagnose < 2 weken gesteld te worden. Bij ernstige symptomen waarvoor noodzaak om steroïden te starten, is er een indicatie om de diagnose nog sneller te stellen, < 1 week om ernstige hersenschade te voorkomen. Er is dan een spoedindicatie voor een stereotactisch hersenbiopt. (SORT A)
Onderbouwing
Het PCZSL kan zich afhankelijk van lokalisatie presenteren met verschillende symptomen zoals gedragsveranderingen, stoornissen in geheugen en taal, focale motorische stoornissen, tekenen van verhoogde intracraniële druk, uveitis, epilepsie en neuropsychiatrische symptomen. B-symptomen zijn zeldzaam.
De diagnose dient bij voorkeur te worden vastgesteld door beoordeling van een weefselbiopt door een (hemato- of neuro)patholoog. PCZSL is in de 4e editie World Health Organization Classification of Haematopoietic and Lymphoid tumours als aparte entiteit beschreven (2017). In de 5e editie uit 2022, is dit ziektebeeld ingedeeld onder de categorie ‘Primary Large B-cell lymphomas of immune-privileged sites’. (1) Indien een histologisch biopt technisch niet haalbaar is, dan kan de diagnose gesteld worden op een combinatie van typisch beeld op MRI, in combinatie met immunofenotypisch onderzoek, eventueel aangevuld met moleculair onderzoek van liquor.
Stereotactische biopsie wordt geadviseerd voor intracerebrale laesies. Een biopt heeft de voorkeur boven een resectie, omdat er geen klinisch voordeel is van een resectie.
Na een biopt wordt de diagnose bij >90% gesteld. In niet-recente literatuur wordt een risico op een bloeding t.g.v. van een (stereotactisch) biopt van een intracraniële tumor beschreven van ongeveer 1-10%. (3,4) Het risico op mortaliteit is hierbij zeer laag, maar er blijft een risico op morbiditeit, zoals blijvende neurologische uitval. Het risico op een infectie is < 1%. Veel studies over de risico’s van biopten zijn van voor 2000 en sindsdien is de techniek verbeterd, waardoor de risico’s waarschijnlijk nog lager liggen. Gezien de lage incidentie van PCZSL en het beperkte materiaal kan een tweede mening van een gespecialiseerde hematopatholoog of beoordeling in een regionaal panel gewenst zijn.
Cytologie en flowcytometrie van de liquor kan verkregen worden als biopsie niet mogelijk danwel gewenst is, of voor het vaststellen van leptomeningeale betrokkenheid. (5) Het aantonen van een MYD88 mutatie met moleculair onderzoek kan de diagnose verder ondersteunen maar is niet noodzakelijk om de diagnose te stellen. (6)
Het gebruik van corticosteroïden vóór afname van biopt of liquor dient vermeden te worden, omdat een PCZSL soms snel reageert (“vanishing” tumor), en er dan geen zekere diagnose gesteld kan worden. Bij vermoeden op een PCZSL dient het biopt daarom zonder delay verricht te worden.
Aanbevelingen
MRI-hersenen met minstens de volgende sequenties: T1 zonder en met contrast, T2W, CE-T2-FLAIR met contrast, DWI/ADC, zo mogelijk aangevuld met dynamisch susceptibility contrast (DSC) perfusie (relative cerebral blood volume (rCBV).
Er is geen rol voor een CT-hersenen in de diagnose, respons monitoring en follow-up. (SORT A)
Onderbouwing
Contrast-enhanced MRI is het beeldvormend onderzoek van keuze voor de diagnose en respons bepaling bij het PCZSL. (7,8) In een recent artikel betreffende een guideline statement van de ICPG wordt aanbevolen om een MRI-hersenen met minstens de volgende sequenties te verrichten:
Typische MRI-bevindingen:
NB MRI-totale wervelkolom is alleen geindiceerd indien er klinisch sprake is van myelopathie of radiculopathie.
Aanbevelingen
Volledige classificatie volgens de geldende WHO-classificatie op basis van histologisch onderzoek (biopt) van een cerebrale tumor is noodzakelijk voor het stellen van de diagnose PCZSL, mits technisch veilig een hersenbiopt kan worden uitgevoerd. Naast morfologisch onderzoek is immunohistochemie met een pan-B cel marker van belang voor het stellen van de diagnose. (SORT A)
Onderbouwing
PCZSL heeft een grootcellige morfologie. Immuunhistochemie toont vaak (~70%) een “activated B-cell-like” (ABC) expressieprofiel en “non-germinal center B-cell-like” (non-GCB) immunofenotype. Echter een GCB subtype (op basis van CD10 positiviteit) is niet uitgesloten (10-31%). (1,2) EBER is vrijwel altijd negatief in PCZSL. Indien positief, dan moet er aan een onderliggende immuundeficientie of dysregulatie (b.v. o.b.v. HIV, post transplantatie, iatrogeen) gedacht worden. (9-12)
Aanbeveling
Gezien het belang voor therapiekeuze, prognose en ziektemonitoring is het een vereiste om middels PET/CT vast te stellen of er sprake is van een primair of een secundaire lokalisatie van een primair systemisch diffuus grootcellig B-cel lymfoom (of ander agressief B-cel lymfoom). (SORT B)
Onderbouwing
Bij het vaststellen van een CZS lymfoom is het belangrijk te beoordelen of dit een primair of een secundaire CZS lokalisatie betreft. (13-15) Dit geldt zowel in de eerste lijn alsook in recidief setting gezien de therapeutische betekenis en prognostische consequenties. (16) De prevalentie van initiële systemische betrokkenheid wordt tussen 4-13% gerapporteerd. (13) PET-CT is het standaard onderzoek voor de stadiering en management van het eventueel aanwezige systemisch NHL. (17)
In vergelijking met contrast-CT is de opbrengst van PET-CT voor systemische lokalisatie van lymfoom hoger, en bedraagt ongeveer 8-10%.(18-21) Beenmergonderzoek heeft geen meerwaarde. (22)
Met betrekking tot de interpretatie van de cerebrale laesies op een PET-scan, is er op dit moment onvoldoende bewijs om een goede uitspraak te doen of de SUV-waarde van cerebrale laesies op een PET-scan prognostische waarde heeft, of kan differentiëren van andere hersentumoren. (23,24)
Aanbevelingen
Het uitgangspunt is om zonder delay tot een PA-bevestigde diagnose te komen bij klinische en radiologische verdenking op een PCZSL, om onherstelbare neurologische schade te voorkomen. Er is derhalve een indicatie om zo snel mogelijk een stereotactisch biopt te verrichten.
Wanneer een biopt technisch niet haalbaar is en een MRI-hersenen suspect is voor PCZSL, dan is het aantonen van monoclonale B-cellen in de liquor voldoende om de diagnose PCZSL te stellen, eventueel met verdere ondersteuning van het aantonen van een MYD88 mutatie met moleculair onderzoek.
Het verrichten van liquordiagnostiek dient de planning van een stereotactisch biopt niet te vertragen.
Als o.b.v. de liquorbevindingen twijfel blijft bestaan, dan dient alsnog een biopt plaats te vinden, mits technisch haalbaar. (SORT C)
Onderbouwing
De diagnose PCZSL wordt gesteld op basis van histopathologische bevindingen. (25,26)
Soms is een (stereotactisch) biopt (technisch) niet mogelijk of gewenst. Het aantonen van monoclonale B-cellen (flowcytometrie) in liquor (of glasvocht) bij patiënten met een klinische en radiologische verdenking op een PCZSL is dan voldoende en zou een stereotactisch biopt kunnen voorkomen. Het aantonen van een MYD88 mutatie met moleculair onderzoek kan eventueel verder ondersteunend zijn. MYD88 mutaties worden gevonden in 60-80% van de PCZSL patiënten. Bij ongeveer 7% van de patiënten met een klinische en radiologische verdenking op een PCZSL kan de diagnose middels een lumbaalpunctie worden gesteld. (27,28) Identificatie MYD88 mutatie kan bijdragen aan sensitiviteit. (29) Bij twijfel over de diagnose blijft een biopt altijd noodzakelijk. Belangrijk uitgangspunt is dat de diagnose zonder vertraging gesteld wordt, om onherstelbare neurologische schade te voorkomen.
Aanbevelingen
Indien histologie niet verkregen kan worden is liquordiagnostiek naast MRI-beeldvorming gewenst.
Bij een klinische en radiologische verdenking op PCZSL dient het volgende bepaald te worden: celaantal, eiwit, glucose, morfologie (3-7ml), flow-cytometrie (3-7ml). Dit kan eventueel worden uitgebreid afhankelijk van de differentiaal diagnose.
Aanwezigheid van MYD88 L265P mutatie en verhoogde IL-10 levels kunnen een PCZSL verder ondersteunen. (SORT C)
Onderbouwing
Tenminste 3-7 ml liquor dient voor onderzoek te worden ingestuurd. Minstens één van de routine bepalingen van de liquor is afwijkend bij 80% van de patiënten met een PCZSL. Celgetal is normaal (33-60%) of verhoogd. Totaal eiwit is normaal (33-55%) of verhoogd. Glucose kan verlaagd zijn. Al deze bepalingen zijn echter aspecifiek.
Sensitiviteit van alleen liquor morfologie is 2-32%. (30) De sensitiviteit neemt toe bij groter aangeleverd volume en bij herhaalde diagnostiek, maar neemt af bij vertraging van afhandeling en na het gebruik van corticosteroïden. Bij tot 80% van de patiënten met lymfoom en liquorbetrokkenheid, wordt bij de eerste lumbaalpunctie afwijkende flowcytometrie gevonden. Vals-positieve resultaten komen eigenlijk niet voor.
De gecombineerde bepaling van MYD88 L265P mutatie en interleukine-10 (IL-10) levels in de liquor van patiënten met een PCZSL resulteerde in een enkele studie in een sensitiviteit en specificiteit van 94% en 98%, respectievelijk. (29) Echter bij een aanzienlijk deel van de patiënten zal er geen MYD88 L265P mutatie kunnen worden aangetoond. Dit komt met name omdat lang niet altijd voldoende cel vrij DNA uit de liquor kan worden verzameld voor een betrouwbare analyse. Daarnaast bestaat er veel discussie over het cut-off point voor de hoogte van IL-10 titer, aangezien er in verschillende studies, verschillende waardes worden gebruikt.
Interleukine-6 (IL-6) en het IL-10/IL-6 ratio lijken geen rol te hebben in de diagnostiek in de liquor bij het PCZSL.
In het algemeen is een LP voldoende voor de diagnostiek. Alleen bij hoge verdenking op leptomeningeale lokalisatie kan een 2e LP alsnog positief zijn in ongeveer 10% van de patiënten.
Aanbevelingen
Oogheelkundig onderzoek middels fundoscopie is geïndiceerd voor de evaluatie van oogbetrokkenheid van het lymfoom. Wanneer er lymfoomlokalisatie is aangetoond, dient het oogheelkundig onderzoek herhaald te worden bij response-evaluatie. (SORT C)
Onderbouwing
In 15-25% van PCZSL patiënten is er ook sprake van oogbetrokkenheid. Derhalve is het van belang bij primaire diagnostiek de oogarts te consulteren voor de evaluatie van eventuele oogbetrokkenheid. Bij oogbetrokkenheid wordt met fundoscopie meestal een cellulair infiltraat gevonden in het glasvocht, welke ‘floaters’ klachten of wazig zicht kunnen geven. Bij de helft van de PCZSL patiënten met oogbetrokkenheid is dit asymptomatisch. In ~5% van alle PCZSL patiënten lijkt sprake van alleen oogbetrokkenheid van meestal beide ogen (ook wel primair vitreoretinaal lymfoom), maar zonder aantoonbare hersenlokalisatie. (31,32) Bij PCZSL lijkt oogbetrokkenheid de prognose niet te beïnvloeden en wordt de behandeling niet aangepast. Methotrexaat kan na i.v. toediening ook in de oogkamers worden aangetoond. (33) Op evaluatie momenten dient ook door de oogarts een response-evaluatie plaats te vinden. Voor lokale ziektecontrole (bij symptomen) kan naast systemische therapie intraoculaire MTX worden overwogen, of aanvullende lokale bestraling. (34) De indicatie hiervoor wordt door de oogarts gesteld. Bij een indicatie voor totale hersenbestraling dienen de ogen mee bestraald te worden bij eerdere bewezen oogbetrokkenheid.
Aanbevelingen
Voor een risico inschatting wordt het gebruik van MSKCC model, bestaand uit leeftijd en Karnofsky Performance Status (KPS) score aanbevolen. (SORT C)
Onderbouwing
In de literatuur zijn er twee modellen beschreven die overleving kunnen inschatten. Het International Extranodal Lymphoma Study Group (IELSG) model bestaat uit vijf individuele factoren: leeftijd > 60 jaar, verhoogd totaal eiwit in liquor, verhoogd LDH, ECOG WHO performance status >1, en betrokkenheid van diepere regionen van het brein (periventricular regionen, basale ganglia, hersenstam en/of cerebellum). Dit model onderscheidt drie risicogroepen. Dit model is niet gevalideerd in een onafhankelijke groep en vaak ontbreekt liquor diagnostiek. (35)
Een tweede model is het Memorial Sloan Kettering Cancer Center (MSKCC) model, welke bestaat uit twee onafhankelijke factoren, namelijk leeftijd en Karnofsky Performance Status (KPS) score. (36) Dit model beschrijft drie risicogroepen:
Anamnese
Lichamelijk onderzoek
Aanvullend onderzoek
Laboratorium:
Beeldvorming:
Lumbaalpunctie:
Cytologie: May-Grünwald-Giemsa
Histopathologie: H&E en IHC
Consulten
(1) Alaggio R, Amador C, Anagnostopoulos I, Attygalle AD, Araujo IBdO, Berti E, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia 2022 Jul;36(7):1720-1748.
(2) Campo E, Jaffe ES, Cook JR, Quintanilla-Martinez L, Swerdlow SH, Anderson KC, et al. The International Consensus Classification of Mature Lymphoid Neoplasms: a report from the Clinical Advisory Committee. Blood 2022 Sep 15;140(11):1229-1253.
(3) Mizobuchi Y, Nakajima K, Fujihara T, Matsuzaki K, Mure H, Nagahiro S, et al. The risk of hemorrhage in stereotactic biopsy for brain tumors. J Med Invest 2019;66(3.4):314-318.
(4) Malone H, Yang J, Hershman DL, Wright JD, Bruce JN, Neugut AI. Complications Following Stereotactic Needle Biopsy of Intracranial Tumors. World Neurosurg 2015 Oct;84(4):1084-1089.
(5) Morell AA, Shah AH, Cavallo C, Eichberg DG, Sarkiss CA, Benveniste R, et al. Diagnosis of primary central nervous system lymphoma: a systematic review of the utility of CSF screening and the role of early brain biopsy. Neurooncol Pract 2019 Dec;6(6):415-423.
(6) Ferreri AJM, Calimeri T, Lopedote P, Francaviglia I, Daverio R, Iacona C, et al. MYD88 L265P mutation and interleukin-10 detection in cerebrospinal fluid are highly specific discriminating markers in patients with primary central nervous system lymphoma: results from a prospective study. Br J Haematol 2021 May;193(3):497-505.
(7) Hoang-Xuan K, Bessell E, Bromberg J, Hottinger AF, Preusser M, Rudà R, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology. Lancet Oncol 2015 Jul;16(7):322.
(8) Barajas RF, Politi LS, Anzalone N, Schöder H, Fox CP, Boxerman JL, et al. Consensus recommendations for MRI and PET imaging of primary central nervous system lymphoma: guideline statement from the International Primary CNS Lymphoma Collaborative Group (IPCG). Neuro Oncol 2021 Jul 1;23(7):1056-1071.
(9) Radke J, Ishaque N, Koll R, Gu Z, Schumann E, Sieverling L, et al. The genomic and transcriptional landscape of primary central nervous system lymphoma. Nat Commun 2022 May 10;13(1):2558-y.
(10) Gandhi MK, Hoang T, Law SC, Brosda S, O’Rourke K, Tobin JWD, et al. EBV-associated primary CNS lymphoma occurring after immunosuppression is a distinct immunobiological entity. Blood 2021 Mar 18;137(11):1468-1477.
(11) Hernández-Verdin I, Kirasic E, Wienand K, Mokhtari K, Eimer S, Loiseau H, et al. Molecular and clinical diversity in primary central nervous system lymphoma. Ann Oncol 2023 Feb;34(2):186-199.
(12) Zhou J, Zuo M, Li L, Li F, Ke P, Zhou Y, et al. PIM1 and CD79B Mutation Status Impacts the Outcome of Primary Diffuse Large B-Cell Lymphoma of the CNS. Front Oncol 2022 Feb 9;12:824632.
(13) Abrey LE, Batchelor TT, Ferreri AJM, Gospodarowicz M, Pulczynski EJ, Zucca E, et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol 2005 Aug 1;23(22):5034-5043.
(14) Fox CP, Phillips EH, Smith J, Linton K, Gallop-Evans E, Hemmaway C, et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br J Haematol 2019 Feb;184(3):348-363.
(15) Barajas RF, Politi LS, Anzalone N, Schöder H, Fox CP, Boxerman JL, et al. Consensus recommendations for MRI and PET imaging of primary central nervous system lymphoma: guideline statement from the International Primary CNS Lymphoma Collaborative Group (IPCG). Neuro Oncol 2021 Jul 1;23(7):1056-1071.
(16) Ferreri AJM, Doorduijn JK, Re A, Cabras MG, Smith J, Ilariucci F, et al. MATRix-RICE therapy and autologous haematopoietic stem-cell transplantation in diffuse large B-cell lymphoma with secondary CNS involvement (MARIETTA): an international, single-arm, phase 2 trial. Lancet Haematol 2021 Feb;8(2):e110-e121.
(17) Younes A, Hilden P, Coiffier B, Hagenbeek A, Salles G, Wilson W, et al. International Working Group consensus response evaluation criteria in lymphoma (RECIL 2017). Ann Oncol 2017 Jul 1;28(7):1436-1447.
(18) Mohile NA, Deangelis LM, Abrey LE. The utility of body FDG PET in staging primary central nervous system lymphoma. Neuro Oncol 2008 Apr;10(2):223-228.
(19) Gupta M, Gupta T, Purandare N, Rangarajan V, Puranik A, Moiyadi A, et al. Utility of flouro-deoxy-glucose positron emission tomography/computed tomography in the diagnostic and staging evaluation of patients with primary CNS lymphoma. CNS Oncol 2019 Dec 1;8(4):CNS46-0016. Epub 2019 Nov 29.
(20) Bertaux M, Houillier C, Edeline V, Habert M, Mokhtari K, Giron A, et al. Use of FDG-PET/CT for systemic assessment of suspected primary central nervous system lymphoma: a LOC study. J Neurooncol 2020 Jun;148(2):343-352.
(21) Malani R, Bhatia A, Wolfe J, Grommes C. Staging identifies non-CNS malignancies in a large cohort with newly diagnosed lymphomatous brain lesions. Leuk Lymphoma 2019 Sep;60(9):2278-2282.
(22) Margold M, Seidel S, Kowalski T, Ladigan-Badura S, Baraniskin A, Schroers R, et al. The value of bone marrow biopsy for staging of patients with primary CNS lymphoma. Neuro Oncol 2021 Dec 1;23(12):2076-2084.
(23) Makino K, Hirai T, Nakamura H, Murakami R, Kitajima M, Shigematsu Y, et al. Does adding FDG-PET to MRI improve the differentiation between primary cerebral lymphoma and glioblastoma? Observer performance study. Ann Nucl Med 2011 Jul;25(6):432-438.
(24) Kawai N, Miyake K, Yamamoto Y, Nishiyama Y, Tamiya T. 18F-FDG PET in the diagnosis and treatment of primary central nervous system lymphoma. Biomed Res Int 2013;2013:247152.
(25) Hoang-Xuan K, Bessell E, Bromberg J, Hottinger AF, Preusser M, Rudà R, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology. Lancet Oncol 2015 Jul;16(7):322.
(26) Hoang-Xuan K, Deckert M, Ferreri AJM, Furtner J, Gallego Perez-Larraya J, Henriksson R, et al. European Association of Neuro-Oncology (EANO) guidelines for treatment of primary central nervous system lymphoma (PCNSL). Neuro Oncol 2023 Jan 5;25(1):37-53.
(27) Morell AA, Shah AH, Cavallo C, Eichberg DG, Sarkiss CA, Benveniste R, et al. Diagnosis of primary central nervous system lymphoma: a systematic review of the utility of CSF screening and the role of early brain biopsy. Neurooncol Pract 2019 Dec;6(6):415-423.
(28) Grommes C, Rubenstein JL, DeAngelis LM, Ferreri AJM, Batchelor TT. Comprehensive approach to diagnosis and treatment of newly diagnosed primary CNS lymphoma. Neuro Oncol 2019 Feb 19;21(3):296-305.
(29) Ferreri AJM, Calimeri T, Lopedote P, Francaviglia I, Daverio R, Iacona C, et al. MYD88 L265P mutation and interleukin-10 detection in cerebrospinal fluid are highly specific discriminating markers in patients with primary central nervous system lymphoma: results from a prospective study. Br J Haematol 2021 May;193(3):497-505.
(30) Scott BJ, Douglas VC, Tihan T, Rubenstein JL, Josephson SA. A systematic approach to the diagnosis of suspected central nervous system lymphoma. JAMA Neurol 2013 Mar 1;70(3):311-319.
(31) Chan C, Rubenstein JL, Coupland SE, Davis JL, Harbour JW, Johnston PB, et al. Primary vitreoretinal lymphoma: a report from an International Primary Central Nervous System Lymphoma Collaborative Group symposium. Oncologist 2011;16(11):1589-1599.
(32) Soussain C, Malaise D, Cassoux N. Primary vitreoretinal lymphoma: a diagnostic and management challenge. Blood 2021 Oct 28;138(17):1519-1534.
(33) Batchelor TT, Kolak G, Ciordia R, Foster CS, Henson JW. High-dose methotrexate for intraocular lymphoma. Clin Cancer Res 2003 Feb;9(2):711-715.
(34) Grimm SA, McCannel CA, Omuro AMP, Ferreri AJM, Blay J, Neuwelt EA, et al. Primary CNS lymphoma with intraocular involvement: International PCNSL Collaborative Group Report. Neurology 2008 Oct 21;71(17):1355-1360.
(35) Ferreri AJM, Blay J, Reni M, Pasini F, Spina M, Ambrosetti A, et al. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol 2003 Jan 15;21(2):266-272.
(36) Abrey LE, Ben-Porat L, Panageas KS, Yahalom J, Berkey B, Curran W, et al. Primary central nervous system lymphoma: the Memorial Sloan-Kettering Cancer Center prognostic model. J Clin Oncol 2006 Dec 20;24(36):5711-5715.
(37) Houillier C, Soussain C, Ghesquières H, Soubeyran P, Chinot O, Taillandier L, et al. Management and outcome of primary CNS lymphoma in the modern era: An LOC network study. Neurology 2020 Mar 10;94(10):e1027-e1039.
Aanbevelingen
Inductie chemotherapie bij fitte patiënten met primair CZS lymfoom bestaat uit combinatie chemotherapie met in ieder geval een HD-MTX en cytarabine bevattend regime (SORT A).
Er kan gekozen worden voor MBVP (2x) bij respons gevolgd door cytarabine (conform HOVON 105 studie) dan wel voor MATRIX (4x) (SORT B).
De inductiefase wordt gevolgd door autologe stamceltransplantatie of RT, zie hiervoor uitgangsvraag 3a
Bij fitte patiënten waarbij geen chemotherapie gegeven kan worden (op wens van patiënt of i.v.m. strikte medische contra-indicatie) kan – in opzet – curatieve radiotherapie overwogen worden. De uitkomsten hiermee zijn echter duidelijk inferieur en behandeling met chemotherapie als boven genoemd heeft indien mogelijk de sterke voorkeur (SORT A).
Onderbouwing
Hoge dosis methotrexaat (HD-MTX, dosering ≥ 3g/m2) kan de bloed-hersenbarrière passeren en vormt daarmee de basis voor de behandeling van primair CZS lymfoom. Hoewel single agent HD-MTX effectiviteit laat zien, is combinatie therapie effectiever. Verschillende studies hebben aangetoond dat toevoegen van hoge dosis cytarabine leidt tot meer complete remissies, een betere ORR en PFS en OS.(1-3)
De twee meest gebruikte schema’s in Nederland zijn 1) MBVP (2 kuren) bij respons gevolgd door consolidatie met ARA-C en 2) MATRIX (4 kuren).
In de gerandomiseerde fase 3 HOVON 105 studie werden 199 patiënten met primair CZS lymfoom van 18-70 jaar gerandomiseerd tussen MBVP (methotrexaat, teniposide, carmustine en prednisolon) versus Rituximab- MBVP (R-MBVP).(4) Bij persisterende liquorlokalisatie na kuur 1 werd aanvullend intrathecale chemotherapie gegeven. Patiënten met responsieve ziekte werden vervolgens behandeld met hoge dosis cytarabine en indien leeftijd ≤ 60 jaar radiotherapie (20 x 1.5 Gy whole brain radiotherapie, in geval van partiele respons tevens 20 x 0.5 Gy tumorboost / boost op de macroscopische restlaesie. Na inductie chemotherapie werd in beide groepen een ORR van 86% bereikt, waarbij geen verschil in aantal complete remissies gevonden werd. Er werd geen verschil gevonden in de event-free survival (49 vs 52% na 1 jaar), progressieve vrije overleving (58% vs 65% na 1 jaar) of overall survival (61% vs 58% na 3 jaar) voor de MBVP groep versus de R-MBVP groep. In een ongeplande post-hoc analyse werd een betere EFS gevonden bij patiënten ≤60 jaar in het voordeel van R-MBVP. Toevoeging van rituximab aan MBVP leidde niet tot toegenomen toxiciteit.
Opmerking: gezien het uit de handel zijn van teniposide, wordt dit sinds enige tijd in MBVP kuren vervangen door etoposide.
In de gerandomiseerde fase 2 IELSG32 studie werden patiënten met primair CNS lymfoom van 18-70 jaar gerandomiseerd tussen 4 cycli HD-MTX plus cytarabine (groep A), of dezelfde combinatie plus 2 dosis rituximab (groep B) of dezelfde MTX-cytarabine-rituximab bevattende combinatie plus thiotepa (MATRIX, groep C).(5) Patiënten met responsieve of stabiele ziekte werden vervolgens gerandomiseerd tussen whole-brain radiotherapie of autologe stam cel transplantatie. Met MATRIX werd een ORR bereikt van 65%, versus 51% in groep B en 40% in groep A, waarmee in de MATRIX groep significant meer responsen werden bereikt in vergelijking met de andere behandelarmen. De 2 jaars PFS was 36% voor groep A, 46% voor groep B en 61% voor groep C. In multivariate analyse was MATRIX (groep C) geassocieerd met een betere PFS en OS.
De werkgroep kan op basis van de huidige literatuur geen voorkeur uitspreken voor MBVP met cytarabine (HOVON 105 schema) dan wel MATRIX aangezien de uitkomsten overeenkomstig lijken te zijn en er geen direct vergelijkende studies zijn.
Fitte patiënten waarbij geen chemotherapie gegeven kan worden (op wens van patiënt of i.v.m. strikte medische contra-indicatie) komen in aanmerking voor – in opzet – curatieve radiotherapie. Aangezien het gehele brein bij primair CZS lymfoom in principe is aangedaan vindt bestraling van de gehele schedel-inhoud plaats (WBRT):
Ofschoon het PCZSL erg gevoelig is voor primaire radiotherapie en radiotherapie snelle remissies kan bewerkstelligen, is het effect niet langdurig en is er een grote kans op recidief. Met radiotherapie alleen wordt een mediane OS gerapporteerd van 10 – 20 maanden.(6-8) Deze behandeling gaat gepaard met frequent optreden van neurocognitieve stoornissen, die toenemen met de dosis en de leeftijd van de patiënt ten tijde van de WBRT.
Referenties
(1) Ferreri AJM, Reni M, Pasini F, Calderoni A, Tirelli U, Pivnik A, et al. A multicenter study of treatment of primary CNS lymphoma. Neurology 2002 May 28;58(10):1513-1520.
(2) Ferreri AJM, Reni M, Foppoli M, Martelli M, Pangalis GA, Frezzato M, et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet 2009 Oct 31;374(9700):1512-1520.
(3) Zheng X, Yang S, Chen F, Wu S, Li W. The Efficacy and Safety of Cytarabine on Newly Diagnosed Primary Central Nervous System Lymphoma: A Systematic Review and Meta-Analysis. Front Oncol 2020 Jul 31;10:1213.
(4) Bromberg JEC, Issa S, Bakunina K, Minnema MC, Seute T, Durian M, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 2019 Feb;20(2):216-228.
(5) Ferreri AJM, Cwynarski K, Pulczynski E, Ponzoni M, Deckert M, Politi LS, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol 2016 May;3(5):217.
(6) Kwak Y, Choi B, Choi KH, Lee JH, Sung SY, Lee YH. Radiotherapy as an alternative treatment option for primary central nervous system lymphoma patients who are noncandidates for chemotherapy. Oncotarget 2017 Nov 10;8(63):106858-106865.
(7) Shibamoto Y. Radiation therapy for primary central nervous system lymphoma. Oncol Rev 2013 Sep 3;7(1):e4.
(8) Milgrom SA, Yahalom J. The role of radiation therapy in the management of primary central nervous system lymphoma. Leuk Lymphoma 2015 May;56(5):1197-1204.
Aanbeveling
Bij behandeling van het PCZSL in de eerste lijn kan m.n. bij de jongere patiënt (60 jaar of jonger) het toevoegen van rituximab overwogen worden. (SORT B) O.b.v. de pathofysiologie is het advies om met name aan het begin van de behandeling dit dan “dose-dense” toe te dienen conform de huidige schema’s van de HOVON 105 interventie-arm of het MATRIX schema. (SORT C)
Onderbouwing
Er zijn slechts twee gerandomiseerde studies die het effect hebben bestudeerd van het toevoegen van rituximab aan inductietherapie bij PCZSL in eerste lijn.
In de IELSG-32 studie werden patiënten gerandomiseerd tussen inductie met HD-MTX en HD-cytarabine (arm A), hetzelfde schema met rituximab op dag -5 en 0 van elke cyclus (arm B) en het schema van arm B met toevoeging van thiotepa (arm C). Bij vergelijk van arm A met arm B werd bij toevoegen van rituximab meer CR gevonden dan zonder (30% vs 23%). Na het afronden van de inductie volgde een tweede randomisatie tussen consolidatie met WBRT vs. hoge dosis chemotherapie met autologe stamceltransplantatie. In arm A zonder rituximab was de PFS na een mediane follow-up van 30 maanden 57% vs. 71% in arm B (HR 0.52 (0.32-0.86) ten faveure van rituximab) met een statistisch significant verschil in 2-jaars OS (42% (CI 36-48) vs 56% (CI 50-62)).(1)
In de HOVON 105 studie werden patiënten gerandomiseerd tussen 2 cycli MBVP zonder of met rituximab. Er werd geen verschil in EFS, PFS of OS gevonden. Na het bereiken van PR of CR werden patiënten doorgeleid naar hoge dosis cytarabine en indien 60 jaar of jonger nog een tweede consolidatie middels WBRT. I.v.m. de verschillende consolidatieschema’s werd een ongeplande subgroep analyse verricht naar een mogelijk verschil in effect van rituximab in deze twee leeftijdsgroepen waarbij onverwacht rituximab in de jongere groep wel een verbetering in de EFS leek te geven (EFS 0.56 met p=0.054).(2)
Een systematische review en meta-analyse van deze twee RCT’s vond geen statistisch significant verschil in overall survival (HR 0.76; 95% CI 0.52-1.12) maar wel een significante verbetering van de PFS (HR 0.65, 0.45-0.95). (3) Gezien de uiteenlopende uitkomsten van de twee RCT’s kan ondanks eerder positieve bevindingen in retrospectieve data en ongecontroleerde fase 2 studies niet met harde bewijslast een advies worden gegeven omtrent het wel of niet toevoegen van rituximab aan de inductietherapie bij PCZSL.
In de gevonden studies werd geen toename van ernstige adverse events gerapporteerd van het toedienen van rituximab behoudens meer neutropenie in één enkele studie (4) en mogelijk meer witte stof afwijkingen bij rituximab gebruik in een andere studie. (5)
Een recent review beschrijft een incidentie van progressieve multifocale leuko-encefalopathie van 1.39 tot 1.87 per 10.000 patiënten behandeld met rituximab voor diverse ziektebeelden. (6)
Vooralsnog kan gezien een mogelijk effect in subgroepen het toevoegen van rituximab dus wel worden overwogen, met name bij de jongere patiënt (≤60 jaar) waarbij ook zaken als logistiek en kosten meegewogen kunnen worden. Er is gesuggereerd dat een dose-dense schema van rituximab in het begin van de therapie optimaal gebruik maakt van de minder goed functionerende bloed-hersenbarriere waarbij hogere concentraties rituximab in de liquor bereikt kunnen worden. Hierbij zou bij R-MBVP het schema van de HOVON 105 aangehouden kunnen worden met rituximab op dag 0,7,14 en 21 van de eerste cyclus en dag 0 en 14 van de tweede cyclus, danwel het MATRix schema.
Referenties
(1) Ferreri AJM, Cwynarski K, Pulczynski E, Ponzoni M, Deckert M, Politi LS, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol 2016 May;3(5):217.
(2) Bromberg JEC, Issa S, Bakunina K, Minnema MC, Seute T, Durian M, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 2019 Feb;20(2):216-228.
(3) Schmitt AM, Herbrand AK, Fox CP, Bakunina K, Bromberg JEC, Cwynarski K, et al. Rituximab in primary central nervous system lymphoma-A systematic review and meta-analysis. Hematol Oncol 2019 Dec;37(5):548-557.
(4) Shah GD, Yahalom J, Correa DD, Lai RK, Raizer JJ, Schiff D, et al. Combined immunochemotherapy with reduced whole-brain radiotherapy for newly diagnosed primary CNS lymphoma. J Clin Oncol 2007 Oct 20;25(30):4730-4735.
(5) Estephan F, Ye X, Dzaye O, Wagner-Johnston N, Swinnen L, Gladstone DE, et al. White matter changes in primary central nervous system lymphoma patients treated with high-dose methotrexate with or without rituximab. J Neurooncol 2019 Dec;145(3):461-466.
(6) Focosi D, Tuccori M, Maggi F. Progressive multifocal leukoencephalopathy and anti-CD20 monoclonal antibodies: What do we know after 20 years of rituximab. Rev Med Virol 2019 Nov;29(6):e2077.
Aanbeveling
Bij fitte patiënten tot 70 jaar met minimaal een partiële remissie na inductie met een HD- MTX en cytarabine-bevattend regime dient waar mogelijk consolidatie met intensieve chemotherapie gevolgd door autologe stamceltransplantatie (ASCT) gegeven te worden. (SORT B)
Conditionering dient alleen gestart te worden bij een WHO performance van ≤2 en ontbreken van ernstige cognitieve stoornissen. (SORT C)
Bij patiënten tot 60 jaar kan WBRT als alternatief overwogen worden in individuele gevallen met verhoogd risico op non-relapse mortality (NRM) bij ASCT. (SORT A)
Onderbouwing
Er zijn twee gerandomiseerde fase 2 studies waarin consolidatiebehandeling met ASCT en WBRT in de eerstelijnsbehandeling van PCZSL rechtstreeks vergeleken zijn, en er is 1 meta-analyse waarin de consolidatiebehandeling bij PCZSL onderzocht is.
In de IELSG-32 studie werden patiënten t/m 70 jaar met stabiele of responsieve ziekte na inductie met een HD-MTX en cytarabine-bevattend regime gerandomiseerd tussen consolidatie met WBRT (arm D, n=59) of intensieve chemotherapie met ASCT (arm E, n=59). WBRT bestond uit 36 Gy met aanvullend 9 Gy boost op de tumor als geen CR na inductie was bereikt. De conditionering voor ASCT bestond uit thiotepa-carmustine (TC).(1)
De PFS en OS waren in deze studie vergelijkbaar voor beide armen: 2-jaars PFS 80% bij WBRT en 69% bij ASCT (p=0.17) en 2-jaars OS 85% bij WBRT en 71% bij ASCT (p=0.12). De non-relapse mortality (NRM) was laag in beide groepen (3% bij ASCT). Ook na langere follow-up van mediaan 88 maanden werd geen significant verschil gezien in PFS en OS tussen de WBRT en ASCT groepen: de 7-jaars PFS was 55% vs. 50% en de 7-jaars OS 63% vs. 57%.(2)
T.a.v. het neurocognitief functioneren (m.n. concentratie en executieve functies) en kwaliteit-van-leven tot 2 jaar na de behandeling (t.o.v. direct na de behandeling) was er echter een statistisch significant verschil in het nadeel van de WBRT. Dit verschil werd bevestigd bij de langere follow-up. Of het verschil ook klinisch relevant is, is o.b.v. de gegeven data niet te beoordelen.
In de PRECIS studie werden patiënten t/m 60 jaar na inductie met R-MBVP + R-AraC gerandomiseerd tussen consolidatie met WBRT (arm A, n=66) of intensieve chemotherapie met ASCT (arm B, n=66). WBRT was 40 Gy, de conditionering voor ASCT bestond uit thiotepa-busulfan-cyclofosfamide (TBC).(3,4)
Ook in deze studie waren respons, PFS en OS vergelijkbaar tussen de 2 armen. De ORR was 76% in de WBRT arm vs. 64% in de ASCT arm, de 2-jaars PFS was daarentegen 58% in de WBRT arm en 70% in de ASCT arm, de 4-jaars PFS was 40% en 65% respectievelijk. De 2-jaars OS was 75% in de WBRT arm en 66% in de ASCT arm, de 4-jaars OS was 64% en 66%. In de ASCT groep was de NRM 11%, 5 patiënten overleden t.g.v. infecties tussen dag +15-220. In de WBRT groep werd een statistisch significante achteruitgang gezien in de resultaten van neurocognitieve tests (m.n. subcorticale subtype) gedurende 3 jaar na de behandeling t.o.v. de ASCT arm. Ook hier is het onduidelijk of het gevonden verschil ook klinisch relevant is. In de lange termijn follow-up van deze patiënten (mediane follow-up 98 maanden) blijft de OS in beide groepen vergelijkbaar: 8-jaars OS 69% voor ASCT en 65% voor WBRT. Recidief PCZSL kwam echter significant vaker voor na WBRT t.o.v. ASCT, met een 8-jaars EFS van 67% voor ASCT vs. 39% voor WBRT (p=0.03). Bovendien werd bij langere termijn follow-up een significant verschil gezien in neurocognitieve achteruitgang ten nadele van WBRT t.o.v. ASCT, m.n. in de executieve functies o.b.v. de MDRS score.(5)
In de meta-analyse van Yu werd de beschikbare literatuur m.b.t. consolidatie behandeling voor PCZSL systematisch geanalyseerd voor PFS en OS.(6) De PRECIS studie werd in deze meta-analyse overigens niet meegenomen vanwege de leeftijdsgrens van 60 jaar. In totaal werden 31 studies geanalyseerd, ook de publicatie van de HOVON105 studie werd hierin meegenomen. Deze meta-analyse suggereert een voordeel in zowel PFS als OS voor de ASCT groep, gevolgd door de WBRT + chemotherapie groep. Deze analyse wordt beperkt door de grote heterogeniteit tussen de studies en de vaak kleine sample sizes, waarbij het aannemelijk is dat de studies waarin ASCT onderzocht werd jongere en fittere patiënten includeerden dan de andere studies. Er werd in deze meta-analyse niet gekeken naar toxiciteit en kwaliteit-van-leven.
Het interpreteren en vergelijken van neurocognitief functioneren en kwaliteit van leven data word bemoeilijkt door de verschillende doses WBRT die zijn gebruikt en de verschillende methoden van meten en rapporteren. Echter wijzen alle data van grote studies wel in dezelfde richting: een verslechtering van neurocognitief functioneren en kwaliteit van leven in patiënten die zijn behandeld met WBRT t.o.v. hen die zijn behandeld met ASCT.
O.b.v. bovengenoemde data gaat de voorkeur van de werkgroep uit naar ASCT boven WBRT, aangezien dit minstens non-inferieur is t.a.v. OS en superieur t.a.v. lange termijn EFS en neurocognitieve toxiciteit en kwaliteit-van-leven.
Indien ASCT niet mogelijk is t.g.v. co-morbiditeit of niet gewenst door patiënt kan WBRT overwogen worden bij patiënten tot 60 jaar. Er is 1 gerandomiseerde studie die de rol van WBRT (30 x 1,5 Gy = 45 Gy) vergelijkt met een expectatief beleid na het bereiken van een complete remissie na MTX-bevattende chemotherapie.(7) In deze studie wordt geen statistisch significant OS of PFS voordeel aangetoond van consolidatie WBRT. Ofschoon het een grote studie betreft met 551 geïncludeerde patiënten wordt de uitkomst van de studie bekritiseerd omdat slechts 318 patiënten conform het protocol werden behandeld.
Aangezien het aannemelijk is dat de neurotoxiciteit van de WBRT toeneemt met een hogere bestralingsdosis en de kans op controle lager is bij een lagere bestralingsdosis, is in een aantal studies (waaronder een gerandomiseerde fase 2 studie) gekeken naar de effectiviteit en toxiciteit van een lagere bestralingsdosis.(8,9) Het betreft hier radiotherapie met curatieve intentie:
De toevoeging van een lage dosis WBRT levert een hoge PFS op. De PFS is significant langer wanneer chemotherapie gecombineerd wordt met lage dosis WBRT in vergelijking met chemotherapie alleen. De neurotoxiciteit lijkt vooralsnog in beide groepen gelijk, ofschoon het onderzoek hiernaar nog niet is afgerond. Ook de OS data zijn nog niet bekend.
Als geen consolidatie mogelijk is, en matige respons op MBVP, en wel verbetering van respons na 1e kuur ARA-C, dan valt 2e cytarabine kuur te overwegen. In de PRECIS studie kregen alle patienten een 2e ARA-C kuur.
Referenties
(1) Ferreri AJM, Cwynarski K, Pulczynski E, Fox CP, Schorb E, La Rosée P, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol 2017 Nov;4(11):e510-e523.
(2) Ferreri AJM, Cwynarski K, Pulczynski E, Fox CP, Schorb E, Celico C, et al. Long-term efficacy, safety and neurotolerability of MATRix regimen followed by autologous transplant in primary CNS lymphoma: 7-year results of the IELSG32 randomized trial. Leukemia 2022 Jul;36(7):1870-1878.
(3) Houillier C, Taillandier L, Dureau S, Lamy T, Laadhari M, Chinot O, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients 60 Years of Age and Younger: Results of the Intergroup ANOCEF-GOELAMS Randomized Phase II PRECIS Study. J Clin Oncol 2019 Apr 1;37(10):823-833.
(4) Gritsch D, Mrugala MM, Marks LA, Mangipudi K, Neal M, Wingerchuk DM, et al. Is Autologous Stem Cell Transplantation a Safe and Effective Alternative to Whole Brain Radiation as Consolidation Therapy in Patients With Primary Central Nervous System Lymphoma?: A Critically Appraised Topic. Neurologist 2021 Jul 6;26(4):137-142.
(5) Houillier C, Dureau S, Taillandier L, Houot R, Chinot O, Moluçon-Chabrot C, et al. Radiotherapy or Autologous Stem-Cell Transplantation for Primary CNS Lymphoma in Patients Age 60 Years and Younger: Long-Term Results of the Randomized Phase II PRECIS Study. J Clin Oncol 2022 Nov 10;40(32):3692-3698.
(6) Yu J, Du H, Ye X, Zhang L, Xiao H. High-dose methotrexate-based regimens and post-remission consolidation for treatment of newly diagnosed primary CNS lymphoma: meta-analysis of clinical trials. Sci Rep 2021 Jan 22;11(1):2125-0.
(7) Korfel A, Thiel E, Martus P, Möhle R, Griesinger F, Rauch M, et al. Randomized phase III study of whole-brain radiotherapy for primary CNS lymphoma. Neurology 2015 Mar 24;84(12):1242-1248.
(8) Omuro AMP, DeAngelis LM, Karrison T, Bovi JA, Rosenblum M, Corn BW, et al. Randomized phase II study of rituximab, methotrexate (MTX), procarbazine, vincristine, and cytarabine (R-MPV-A) with and without low-dose whole-brain radiotherapy (LD-WBRT) for newly diagnosed primary CNS lymphoma (PCNSL). JCO 2020;38(15):2501.
(9) Morris PG, Correa DD, Yahalom J, Raizer JJ, Schiff D, Grant B, et al. Rituximab, methotrexate, procarbazine, and vincristine followed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long-term outcome. J Clin Oncol 2013 Nov 1;31(31):3971-3979.
Aanbeveling
Conditionering met thiotepa-carmustine heeft de voorkeur o.b.v. effectiviteit en toxiciteit (SORT B).
Onderbouwing
Er is 1 retrospectieve studie waarin verschillende conditioneringsschema’s vergeleken zijn. De retrospectieve analyse van CIBMTR registry data heeft de uitkomsten van de 3 meest toegepaste conditioneringsschema’s voor ASCT bij PCZSL onderzocht: TBC (thiotepa-busulfan-cyclofosfamide), TC (thiotepa-carmustine) en BEAM (carmustine-etoposide-cytarabine-melfalan).(1) De data van 603 patiënten t/m 77 jaar die ASCT voor PCZSL hadden ondergaan in de periode 2010-2018 werden geanalyseerd: 263 patiënten kregen TBC, 275 TC en 65 BEAM. Conditionering met TC en TBC geven vergelijkbare resultaten qua 3-jaars-PFS en -OS (76% vs. 75% en 78% vs. 81% resp.), waarbij TBC echter een onacceptabel hoge 1-jaars NRM had van 11%. Conditionering met BEAM leidde tot inferieure uitkomsten (recidiefkans na 3 jaar 36%, 3-jaars PFS 58% en 3-jaars OS 69%). De voorkeur van de werkgroep gaat o.b.v. deze data en de ervaring binnen Nederland met dit schema uit naar TC conditionering.
Ook de TC conditionering is echter een intensief schema met langdurige beenmergsuppressie, ernstige en langdurige mucositis en frequent voorkomen van infecties. Hier dient rekening mee te worden gehouden bij selectie en voorlichting van patiënten.
Referentie
(1) Scordo M, Wang TP, Ahn KW, Chen Y, Ahmed S, Awan FT, et al. Outcomes Associated With Thiotepa-Based Conditioning in Patients With Primary Central Nervous System Lymphoma After Autologous Hematopoietic Cell Transplant. JAMA Oncol 2021 Jul 1;7(7):993-1003.
Aanbeveling
Intrathecale (it.) behandeling dient niet standaard toegevoegd te worden aan de behandeling voor PCZSL. Het kan echter overwogen worden om bij respons van parenchymlaesies maar met persisterende liquorlokalisatie na 1 MBVP kuur it. MTX toe te voegen, tweemaal per week tot bereiken van remissie. (SORT C)
Onderbouwing
In het kader van stagering dient een LP te gebeuren, om uitbreiding van de ziekte leptomeningeaal aan te tonen/uit te sluiten, tenzij dit niet mogelijk is (indien er bv risico is op inklemming). De toegevoegde waarde van intrathecaal MTX toegevoegd aan systemische chemotherapie is niet goed onderzocht, maar werd in het verleden frequent toegepast. Twee case-controlled retrospectieve cohortstudies toonden geen verschil in respons, PFS en OS voor het al dan niet toevoegen van intrathecaal MTX aan de behandeling met systemisch HD MTX.(1,2) Opeenvolgende fase II studies met het Bonn-protocol (HD MTX en cytarabine systemisch plus vinca-alkaloid, ifosfamide, cyclofosfamide en dexamethason met daarnaast MTX, cytarabine en prednison intraventriculair via Ommaya reservoir) suggereerden dat toevoeging van intraventriculaire chemotherapie de kans op vroege recidieven verlaagde (mediane tijd tot therapiefalen van 21 maanden vs 8 maanden). Hierbij traden wel tot 19% infecties van het Ommaya reservoir op. In deze studies werd geen consolidatiebehandeling gegeven en de resultaten zijn derhalve moeilijk te vergelijken met de huidige praktijk.(3)
Gezien de belasting van intrathecale behandeling voor patiënten en het risico op complicaties hiervan is de werkgroep van mening dat er geen plek is voor het standaard toevoegen van intrathecale therapie aan de inductie behandeling.
In de HOVON 105 studie werd na 1 MBVP kuur (dus 2 x high dose MTX) een LP geadviseerd indien dit bij start van de behandeling niet mogelijk was geweest, of indien de LP bij start van de behandeling lokalisatie toonde. O.b.v. ervaring in verschillende centra met het toevoegen van it. MTX aan de behandeling in geval van persisterende liquorlokalisatie na (minstens) 1 MBVP cyclus conform het HOVON 105 schema, lijkt dit mogelijk wel bij te dragen aan het bereiken van een respons van deze leptomeningeale lokalisaties. Het is onbekend wat het effect hiervan is op PFS en OS.
In geval van persisterende leptomeningeale lokalisatie bij behandeling met een HD MTX-bevattend schema, waarbij er wel respons optreedt van de parenchymlaesies, kan er voor gekozen worden om it MTX toe te voegen, tweemaal per week tot bereiken van negatieve liquor conform het HOVON 105 schema. Als de liquor 2 x negatief is, wordt de frequentie van intrathecale behandeling afgebouwd: 1x per week gedurende 2 weken, dan elke 2 weken, tot start van consolidatiebehandeling. Een intraveneuze MTX “telt” als een intrathecale toediening. Ten tijde van mucositis wordt geen it. MTX gegeven, vanwege het risico op verdere toename van de mucositis.
Referenties
(1) Khan RB, Shi W, Thaler HT, DeAngelis LM, Abrey LE. Is intrathecal methotrexate necessary in the treatment of primary CNS lymphoma? J Neurooncol 2002 Jun;58(2):175-178.
(2) Sierra Del Rio M, Ricard D, Houillier C, Navarro S, Gonzalez-Aguilar A, Idbaih A, et al. Prophylactic intrathecal chemotherapy in primary CNS lymphoma. J Neurooncol 2012 Jan;106(1):143-146.
(3) Pels H, Juergens A, Glasmacher A, Schulz H, Engert A, Linnebank M, et al. Early relapses in primary CNS lymphoma after response to polychemotherapy without intraventricular treatment: results of a phase II study. J Neurooncol 2009 Feb;91(3):299-305.
Aanbeveling
In geval van oculaire betrokkenheid bij PCZSL dient dezelfde behandelstrategie gevolgd te worden als bij PCZSL zonder oculaire betrokkenheid, met een voorkeur voor een HD MTX en cytarabine-bevattend inductieschema gevolgd door consolidatie met intensieve chemotherapie en ASCT. (SORT B)
Indien gekozen wordt voor consolidatie met WBRT dient hieraan bilaterale oculaire radiotherapie te worden toegevoegd. (SORT B)
Onderbouwing
In 15-20% van de PCZSL gevallen treedt oculaire betrokkenheid op. Er is beperkte literatuur beschikbaar over de optimale behandeling van deze patiënten. Zowel HD-MTX als cytarabine kunnen echter in relevante hoeveelheid het oogvocht penetreren, waarna ook oculaire responsen met langdurige remissies gezien worden.(1-3) Lokale behandeling met zowel intravitreale toediening van methotrexaat en/of rituximab als lokale radiotherapie zijn effectief in het bereiken van lokale ziektecontrole, maar lijken geen invloed te hebben op het risico op CZS recidief op de lange termijn.(1,4)
De toegevoegde waarde van gelijktijdige intravitreale behandeling (meestal MTX en rituximab) is onduidelijk. Gezien de frequent optredende oculaire toxiciteit van deze behandeling wordt dit niet standaard geadviseerd.(2)
T.a.v. de consolidatie behandeling lijken zowel radiotherapie (combinatie van WBRT met bilaterale oculaire RT) als intensieve chemotherapie met ASCT effectief met een potentieel voor langdurige remissie. Gezien de voorkeur voor consolidatie met intensieve chemotherapie en ASCT bij PCZSL blijft dit ook voor de groep patiënten met oculaire betrokkenheid gelden. Indien om andere reden toch gekozen wordt voor WBRT dan dient hieraan bilaterale oculaire radiotherapie te worden toegevoegd, met een dosis tot 36 Gy in fracties van 1.8-2 Gy.(2)
Het primaire vitreoretinale lymfoom (PVRL) zonder aanwijzingen voor CZS betrokkenheid valt buiten de scope van deze richtlijn. Hoewel ook in deze groep CZS recidief frequent optreedt (bij 56-90% binnen 30 maanden) wordt er gezien de leeftijd en comorbiditeit van het merendeel van deze patiënten vaak voor gekozen om in eerstelijn alleen lokaal te behandelen. Dit vindt plaats bij de oogarts.(4)
Referenties
(1) Soussain C, Malaise D, Cassoux N. Primary vitreoretinal lymphoma: a diagnostic and management challenge. Blood 2021 Oct 28;138(17):1519-1534.
(2) Fox CP, Phillips EH, Smith J, Linton K, Gallop-Evans E, Hemmaway C, et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br J Haematol 2019 Feb;184(3):348-363.
(3) Batchelor TT, Kolak G, Ciordia R, Foster CS, Henson JW. High-dose methotrexate for intraocular lymphoma. Clin Cancer Res 2003 Feb;9(2):711-715.
(4) Chan C, Rubenstein JL, Coupland SE, Davis JL, Harbour JW, Johnston PB, et al. Primary vitreoretinal lymphoma: a report from an International Primary Central Nervous System Lymphoma Collaborative Group symposium. Oncologist 2011;16(11):1589-1599.
Aanbevelingen
Hoge dosis MTX (HD-MTX) wordt tot op hoge leeftijd goed verdragen. Indien MBVP of MATRix kuren als te zwaar worden beoordeeld overweeg dan eerst een ander HD-MTX bevattend regime (SORT B)
Indien de patiënt ‘unfit’ is voor HD-MTX, overweeg dan totale schedelinhoudbestraling (WBRT, met 5 x 4 Gy) als behandeling, eventueel in combinatie met dexamethason, of best supportive care. Kwaliteit van leven is daarbij richtsnoer voor het maken van keuzes (SORT C).
Onderbouwing
Epidemiologie
De overleving van ouderen (gedefinieerd als >70 jaar) met een PCZSL is de afgelopen jaren niet verbeterd. Zij hebben een 5-jaars overleving van 6%, tegenover ca. 30% in patiënten ≤70 jaar.
Data van de Nederlandse kankerregistratie (NKR) van de periode 2014-2017 laten zien dat er 145 patiënten > 70 jaar met een PCZSL zijn gediagnosticeerd: 43% werd behandeld met chemotherapie, 20% met alleen radiotherapie en 37% ontving ‘best supportive care’. In de groep als geheel was de mediane totale overleving (mOS) 4,1 maand en de 2-jaars OS was 25%. Patiënten die behandeld werden met chemotherapie deden het significant beter (mOS 16,3 maanden), dan wanneer alleen radiotherapie (7,7 maanden) of ‘best supportive care’ (1,4 maand) gegeven werd. De 2-jaars OS was 45% in de groep die behandeld werd met chemotherapie, en bij alleen radiotherapie of ‘best supportive care’ was dit respectievelijk 19% en 4%. Kortom, zij die fit genoeg werden bevonden om behandeld te worden met HD-MTX hadden de beste prognose. (1) Ook een systematic review ondersteunt deze bevindingen. (2)
De uitdaging is om de patiënten te selecteren die de HD-MTX aankunnen, en om de voordelen en risico’s van intensieve chemotherapie af te wegen.
Prognostische score
De International Extranodal Lymphoma Study Group (IESLG) score wordt veel gebruikt maar is niet extern gevalideerd en weinig getest bij patiënten >70 jaar. De score is getest in 378 patiënten, waarvan slechts 14% >70 jaar was. Deze score is uitdrukkelijk niet bedoeld voor de besluitvorming over wel of niet behandelen met intensieve chemotherapie.
Er zijn geen specifieke prognostische modellen voor ouderen, maar gezien de lage kans op curatie is het belangrijk om de volgende aspecten mee te wegen: co-morbiditeit, ADL en iADL voor diagnose, steunsysteem, en WHO performance score (of Karnofsky). Voor behandeling dient een volledig neurologisch onderzoek te worden verricht, eventueel aangevuld met een Mini-Mental State Examinition (MMSE).
Speciale aandachtspunten bij ouderen, voor start van behandeling
De prognose van oudere patiënten is minder goed dan voor jongeren patiënten. Ook zullen zij vaker co-morbiditeit hebben bij aanvang van therapie, meer bijwerkingen door de therapie ervaren, en voor andere keuzes staan t.o.v. levensverwachting. Indien wel gestart wordt met intensieve chemotherapie is het belangrijk om osteoporose profylaxe in overweging te nemen en cardiale functie vooraf te bepalen i.v.m. de hyperhydratie bij HD-MTX. Het in consult vragen van geriater/internist ouderengeneeskunde kan bijdragen aan de beslissing wel of niet te starten met intensieve behandeling en bij het afsluiten van de behandeling kan de revalidatie arts een ondersteunend rol hebben.
Behandeling
Naast de registratie-studie van de NKR zijn er geen specifieke studies waarin het effect van MBVP bij ouderen is onderzocht. Wel is er in Nederland uitgebreide ervaring met het MBVP schema bij fitte patiënten op hogere leeftijd. Het MATRIx schema is ontwikkeld in de IELSG32 studie waarbij patiënten ouder dan 70 jaar werden uitgesloten. Het MATRix schema is daarna onderzocht in een retrospectief cohort, 21/156 patiënten waren >70 jaar.(3) Patiënten in dit cohort die niet voldeden aan de oorspronkelijke inclusiecriteria werden behandeld met lagere dosis intensiteit en hadden slechtere uitkomsten dan de patiënten die er wel aan voldeden. Ook bij patiënten >70 jaar moet daarom een behandeling met MBVP of MATRix overwogen worden. (4)
Indien de patiënt niet geschikt wordt geacht voor MATRix of MBVP kan een behandeling volgens de PRIMAIN studie tot op hoge leeftijd gegeven worden. In PRIMAIN werden 107 oudere, minder fitte, patiënten geïncludeerd. De mediane leeftijd was 73 jaar (66-85) en mediane Karnofsky score was 70 (30-100).(5) De combinatie Rituximab, HD-MTX, Procarbazine en Lomustine bleek te toxisch en Lomustine werd vervolgens uit het schema verwijderd. In totaal werden 38 patiënten behandeld met R-MP, en dit schema bevat in totaal 6 HD-MTX toedieningen elke 2 weken, aangevuld met oraal procarbazine. In deze studie was de 2 jaars PFS voor de hele R-MP groep 34,9% en indien een complete respons werd bereikt was dit 60%. Consolidatie voor patiënten met een PR of beter na 2 cycli (6 giften HD-MTX 3g/m2 en tweemaal procarbazine), bestaat uit procarbazine onderhoud gedurende 6 maanden. In de studie was het behandeling-gerelateerde overlijden (TRM) 8,4% gebaseerd op de originele 107 patiënten, en 81% ervaarde ernstige bijwerkingen (CTC AE graad 3 of hoger). Het R-MP schema geeft minder vaak ernstige bijwerkingen (71%) dan het R-MPL schema.
Verder wordt internationaal ook het Rituximab, HD-MTX, procarbazine en vincristine (R-MVP schema) toegepast tot op hogere leeftijd omdat dit specifiek onderzocht is voor patiënten > 60 jaar.(6) In Nederland is er minder ervaring met dit schema en het wordt daarom niet geadviseerd.
Radiotherapie
Indien bovenstaande opties niet mogelijk zijn, door co-morbiditeit of ernstige aangedane patiënten met een lage performance score, wordt geen andere systeemtherapie aanbevolen. Behandeling met radiotherapie, dat minder belastend en op korte termijn minder potentieel toxisch is, kan worden overwogen. Verwijs patiënten op tijd naar de radiotherapeut om te voorkomen dat de behandeling praktisch onuitvoerbaar blijkt door te slechte (neurologische) conditie.
Omdat PCZSL doorgaans een multifocale of diffuse ziekte is wordt de totale schedelinhoud bestraald, zogenaamde whole brain radiotherapie (WBRT). In de literatuur worden diverse schema’s aangeraden: 20-30 Gy (in 5 tot 15 fracties). Gezien de verwachte korte overleving is het advies om 20 Gy in 5 dagen te geven (5 x 4 Gy). De responskans is daarbij 90% en de mOS geschat 7 tot 8 maanden. Belangrijkste nadeel van radiotherapie is de late toxiciteit, met name bestralingsencefalopathie. Bestralings-encefalopathie kan optreden tot 80% bij patiënten >60 jaar die meer dan 1 jaar overleven na behandeling. Volgens de literatuur is er een brede range waarin dit kan ontstaan. In de praktijk kan dit al ontstaan 1 jaar na het einde van de behandeling.(7,8) Het doel van de WBRT is palliatief, met een beperkte verlenging van het leven. Echter, er kan een goede en langdurige response optreden, waarbij cognitieve stoornissen kunnen persisteren als gevolg van de schade door de tumor zelf maar ook verergeren door bestralingsencephalopathie.
Indien WBRT geen reële mogelijkheid is, wordt best supportive care met vaak toevoegen van dexamethason geadviseerd. Indien patiënten goed opknappen op dexamethason kan alsnog WBRT worden overwogen. Er is geen bewijs voor de beste dosering dexamethason. Het advies is om te starten met 1 dd 16 mg gedurende 1 week, en na een week af te bouwen, onafhankelijk van de respons.
Referenties
(1) van der Meulen M, Bromberg JEC, Nijland M, Visser O, Doorduijn JK, Dinmohamed AG. Primary therapy and survival in patients aged over 70-years-old with primary central nervous system lymphoma: a contemporary, nationwide, population-based study in the Netherlands. Haematologica 2021 Feb 1;106(2):597-600.
(2) Kasenda B, Ferreri AJM, Marturano E, Forst D, Bromberg J, Ghesquieres H, et al. First-line treatment and outcome of elderly patients with primary central nervous system lymphoma (PCNSL)–a systematic review and individual patient data meta-analysis. Ann Oncol 2015 Jul;26(7):1305-1313.
(3) Schorb E, Fox CP, Kasenda B, Linton K, Martinez-Calle N, Calimeri T, et al. Induction therapy with the MATRix regimen in patients with newly diagnosed primary diffuse large B-cell lymphoma of the central nervous system – an international study of feasibility and efficacy in routine clinical practice. Br J Haematol 2020 Jun;189(5):879-887.
(4) Martinez-Calle N, Isbell LK, Cwynarski K, Schorb E. Advances in treatment of elderly primary central nervous system lymphoma. Br J Haematol 2022 Feb;196(3):473-487.
(5) Fritsch K, Kasenda B, Schorb E, Hau P, Bloehdorn J, Möhle R, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia 2017 Apr;31(4):846-852.
(6) Omuro A, Chinot O, Taillandier L, Ghesquieres H, Soussain C, Delwail V, et al. Methotrexate and temozolomide versus methotrexate, procarbazine, vincristine, and cytarabine for primary CNS lymphoma in an elderly population: an intergroup ANOCEF-GOELAMS randomised phase 2 trial. Lancet Haematol 2015 Jun;2(6):251.
(7) Laperriere NJ, Cerezo L, Milosevic MF, Wong CS, Patterson B, Panzarella T. Primary lymphoma of brain: results of management of a modern cohort with radiation therapy. Radiother Oncol 1997 Jun;43(3):247-252.
(8) Doolittle ND, Korfel A, Lubow MA, Schorb E, Schlegel U, Rogowski S, et al. Long-term cognitive function, neuroimaging, and quality of life in primary CNS lymphoma. Neurology 2013 Jul 2;81(1):84-92.
Aanbevelingen
Bij de keuze voor behandeling van een refractair of recidief PCZSL moet geindividualiseerd worden obv fitheid en neurocognitieve functie, eerdere behandeling en respons daarop, en wens van de patient (SORT C)
Indien opnieuw gekozen wordt voor intensieve chemotherapeutisch behandeling, dan kan na lange remissie op 1elijnsbehandeling (> 1 jaar) overwogen worden behandeling met hoge dosis methotrexaat te herhalen. Bij kortere remissieduur een ifosfamide bevattend schema. Consolidatie kan dan bestaan uit autologe stamceltransplantatie of totale schedelbestraling, afhankelijk van wat nog niet eerder is gegeven. (SORT B)
Palliatief kan behandeling met small molecules overwogen worden (SORT B)
Indien intensieve behandeling niet mogelijk of gewenst is, kan palliatieve radiotherapie worden overwogen, of best supportive care (SORT B)
Onderbouwing
De kans op een recidief PCZSL na 1ste lijn behandeling is 35-65%. Het merendeel van de recidieven presenteert zich uitsluitend in het CZS (90%). Parenchymateuze recidieven worden vaker waargenomen dan leptomeningeale lokalisatie. De meeste recidieven presenteren zich binnen 2 jaar na behandeling (mediaan 10-16 maanden), alhoewel ook late recidieven (tot 10 jaar) voorkomen.
Patiënten met een refractair PCZSL of een recidief hebben een uitermate sombere prognose en zonder verdere behandeling een mediane overleving van 2 maanden. (1)
Bij de behandeling van een recidief PCZSL is een aantal zaken die van invloed op de keuze van therapie. (2)
De afwegingen om wel of niet een 2e lijns behandeling te starten dient in nauw overleg met de patient te geschieden, zeker als de kans op langdurige respons als laag wordt ingeschat.
Onderstaand schema biedt handvaten voor therapie keuze bij een refractair of recidief PCZSL. Het schema volgt in hoofdlijnen de NCCN en Britse richtlijnen. (3,4)
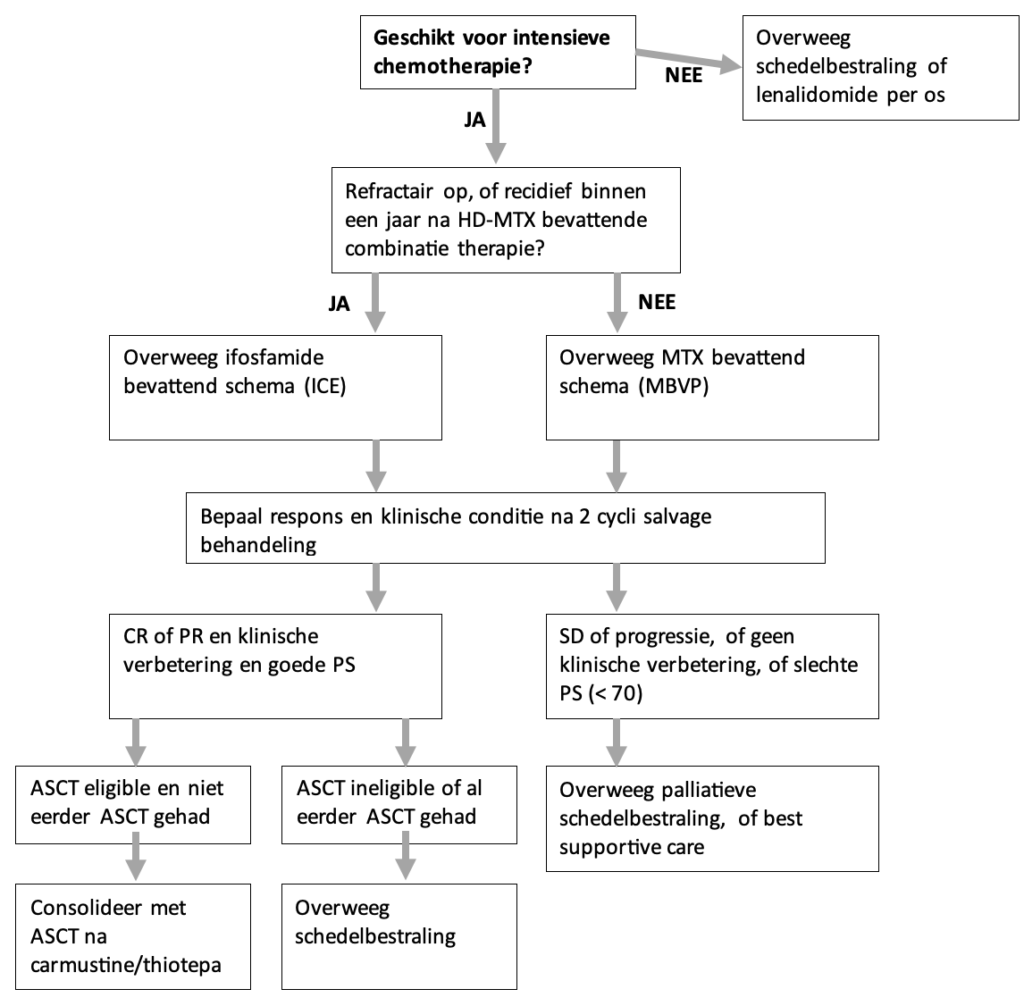
Keuze van re-inductie schema: MTX, ARA-C en ifosfamide
Er is geen ervaring met het herhalen van MATRix in de recidief setting. Er is in Nederland wel uitgebreide ervaring met het herhalen van MBVP.
Een re-inductie schema voor recidief PCZSL met als basis HD-ARA-C is beschreven door Soussain (n=39). (5) Re-inductie schema’s met als basis ifosfamide zijn beschreven door Mappa (n=22), Fox (n=27), en Choi (n=45). (6-8) In Nederland is de meeste ervaring met ICE.
Bij responsieve ziekte en goede conditie kan geconsolideerd worden met autologe stamceltransplantatie na conditionering met carmustine/thiotepa, indien dit nog niet eerder werd gegeven.
Nieuwe middelen
Op basis van de pathogenese zijn er verschillende aangrijpingspunten voor nieuwe therapie. Gezien de frequente mutaties in MYD88 en CD79B is er een biologische rationale voor interventie in de BCR signaling middels IMIDs en BTK inhibitie. (9-11) Lenalidomide (een IMID) wordt vergoed voor recidief lymfomen. De dosering is 25 mg, d1-21, volgende cyclus op d29 starten. De progressievrije overleving varieert van 1 tot 10 maanden. Ibrutinib heeft geen vergoeding voor recidief PCZSL. In de fase 2 studie van Soussain werd 560 mg ibrutinib gebruikt.
|
Drug |
Auteur |
N |
ORR |
PFS |
Mediane OS |
|
Lenalidomide |
Ghesquieres |
50 |
65 |
7.8 |
17.7 |
|
Ibrutinib |
Lewis |
23 |
58 |
3.1 |
10.2 |
|
|
Soussain |
52 |
52 |
4.8 |
19.2 |
Chimeric antigen receptor T-cel therapie
Data omtrent de effectiviteit van CAR-T cel therapie bij recidief PCZSL zijn uitermate beperkt omdat patiënten met recidief PCZL in de meeste studies zijn geexcludeerd, vooral uit angst voor ernstige neurologische toxiciteit. Behandeling van recidief PCZSL met CAR-T cel therapie is om die reden niet goedgekeurd. (12) De eerste resultaten van Fase-I studies bij zeer beperkte aantallen patiënten zijn echter redelijk hoopgevend. (13)
Referenties
(1) Langner-Lemercier S, Houillier C, Soussain C, Ghesquières H, Chinot O, Taillandier L, et al. Primary CNS lymphoma at first relapse/progression: characteristics, management, and outcome of 256 patients from the French LOC network. Neuro Oncol 2016 Sep;18(9):1297-1303.
(2) Mendez JS, Grommes C. Treatment of Primary Central Nervous System Lymphoma: From Chemotherapy to Small Molecules. Am Soc Clin Oncol Educ Book 2018 May 23;38:604-615.
(3) NCCN Guidelines Version 1.2022, Primary CNS Lymphoma.
(4) Fox CP, Phillips EH, Smith J, Linton K, Gallop-Evans E, Hemmaway C, et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br J Haematol 2019 Feb;184(3):348-363.
(5) Soussain C, Hoang-Xuan K, Taillandier L, Fourme E, Choquet S, Witz F, et al. Intensive chemotherapy followed by hematopoietic stem-cell rescue for refractory and recurrent primary CNS and intraocular lymphoma: Société Française de Greffe de Moëlle Osseuse-Thérapie Cellulaire. J Clin Oncol 2008 May 20;26(15):2512-2518.
(6) Mappa S, Marturano E, Licata G, Frezzato M, Frungillo N, Ilariucci F, et al. Salvage chemoimmunotherapy with rituximab, ifosfamide and etoposide (R-IE regimen) in patients with primary CNS lymphoma relapsed or refractory to high-dose methotrexate-based chemotherapy. Hematol Oncol 2013 Sep;31(3):143-150.
(7) Fox CP, Ali AS, McIlroy G, Thust S, Martinez-Calle N, Jackson AE, et al. A phase 1/2 study of thiotepa-based immunochemotherapy in relapsed/refractory primary CNS lymphoma: the TIER trial. Blood Adv 2021 Oct 26;5(20):4073-4082.
(8) Choi MK, Kang ES, Kim DW, Ko YH, Seok H, Park JH, et al. Treatment outcome of relapsed/refractory primary central nervous system diffuse large B-cell lymphoma: a single-center experience of autologous stem cell transplantation. Int J Hematol 2013 Sep;98(3):346-354.
(9) Ghesquieres H, Chevrier M, Laadhari M, Chinot O, Choquet S, Moluçon-Chabrot C, et al. Lenalidomide in combination with intravenous rituximab (REVRI) in relapsed/refractory primary CNS lymphoma or primary intraocular lymphoma: a multicenter prospective ‘proof of concept’ phase II study of the French Oculo-Cerebral lymphoma (LOC) Network and the Lymphoma Study Association (LYSA)†. Ann Oncol 2019 Apr 1;30(4):621-628.
(10) Lewis KL, Chin CK, Manos K, Casey J, Hamad N, Crawford J, et al. Ibrutinib for central nervous system lymphoma: the Australasian Lymphoma Alliance/MD Anderson Cancer Center experience. Br J Haematol 2021 Mar;192(6):1049-1053.
(11) Soussain C, Choquet S, Blonski M, Leclercq D, Houillier C, Rezai K, et al. Ibrutinib monotherapy for relapse or refractory primary CNS lymphoma and primary vitreoretinal lymphoma: Final analysis of the phase II ‘proof-of-concept’ iLOC study by the Lymphoma study association (LYSA) and the French oculo-cerebral lymphoma (LOC) network. Eur J Cancer 2019 Aug;117:121-130.
(12) Karschnia P, Blobner J, Teske N, Schöberl F, Fitzinger E, Dreyling M, et al. CAR T-Cells for CNS Lymphoma: Driving into New Terrain? Cancers (Basel) 2021 May 20;13(10):2503. doi: 10.3390/cancers13102503.
(13) Siddiqi T, Wang X, Blanchard MS, Wagner JR, Popplewell LL, Budde LE, et al. CD19-directed CAR T-cell therapy for treatment of primary CNS lymphoma. Blood Adv 2021 Oct 26;5(20):4059-4063.
Aanbevelingen
Respons evaluatie tijdens en na de behandeling gebeurt bij voorkeur door neuroloog en hematoloog samen. (SORT C)
Voor evaluatie na de behandeling dient een MRI te worden gemaakt, en indien eerder betrokken ook LP en/of oogonderzoek te worden gecontroleerd. (SORT A)
Onderbouwing
Respons evaluatie tijdens en na de behandeling gebeurt bij voorkeur door neuroloog en hematoloog samen. Het valt sterk te overwegen om de follow-up na behandeling over te dragen aan de neuroloog met kennis van neuro-oncologie, indien de acute toxiciteit van de systemische behandeling voorbij is. Dit mede gezien symptomen als gevolg van witte stofafwijkingen, cerebrale atrofie en cognitieve stoornissen die in de follow-up kunnen optreden.
Respons evaluatie tijdens eerstelijns behandeling
Bij patienten die behandeld worden met MBVP vindt de eerste respons plaats na de 2 kuren MBVP. Afhankelijk van kliniek en respons na 2 x MBVP kan na de consolidatie met ARA-C nogmaals responsbepaling worden gedaan.
Bij patienten die behandeld worden met MATRix wordt de eerste responsbepaling gedaan na 2 kuren. Afhankelijk van kliniek en respons na 2 kuren wordt na de 4e kuur nogmaals een responsbepaling verricht.
Respons evaluatie na eerstelijns behandeling
Evaluatie van respons wordt verricht met conventionele MRI hersenen. Bij de beoordeling door de neuro-radioloog is informatie over gebruik van corticosteroïden ten tijde van het MRI onderzoek van belang. Bij eerdere oculaire of meningeale betrokkenheid dienen deze lokalisaties ook geëvalueerd te worden na afronding van behandeling.
|
Respons |
MRI-hersenen |
Cortisteroïd gebruik |
Oog onderzoek |
Liquor |
|
CR |
Geen aankleuring |
Geen |
Normaal |
Negatief |
|
CRu |
Geen aankleuring |
Wel |
Normaal |
Negatief |
|
CRu |
Minimale aankleuring |
Wel |
Minimale afwijkingen* |
Negatief |
|
PR |
>50% afname in aankleuring van de tumor |
Irrelevant |
Minimale afwijkingen* |
Negatief |
|
PR |
Geen aankleuring |
Irrelevant |
Afname in cellen in het oogvocht |
Aanhoudend positief of verdacht |
|
SD |
<50% afname of <25% toename in aankleuring |
Irrelevant |
– |
– |
|
PD |
>25% toename in aankleuring |
Irrelevant |
Recidief of nieuwe ooglokalisatie |
Recidief of positief |
|
Relapse |
Nieuwe aankleuring, na eerdere CR of CRu |
Irrelevant |
Recidief |
Recidief |
CR = complete response, CRu = complete response onbevestigd, PR = partiële respons, SD = stabiele ziekte, PD = progressieve ziekte, *=minimale afwijkingen in het pigment van het retinaal epitheel. (1,2)
Aanbevelingen
Door wie en hoe (welk klinisch en aanvullend onderzoek) de follow-up bij patiënten met PCZSL moet plaatsvinden is niet goed onderzocht waardoor er meerdere follow up regimes mogelijk zijn.
Doel van follow up is:
Alle adviezen hieronder in dit hoofdstuk zijn expert opinion (SORT C)
Onderbouwing
Klinisch neurologisch onderzoek
Bij poliklinische follow-up dient te worden gevraagd naar neurologische klachten en dient neurologisch onderzoek plaats te vinden. Daarnaast is het belangrijk aandacht te hebben voor cognitief functioneren en kwaliteit van leven.
Frequentie: In de eerste 2 jaar na het einde van de behandeling wordt geadviseerd om patiënten elke 3-4 maanden te beoordelen. Daarna elke 6 maanden, tot 3 jaar na het einde van de behandeling. Daarna kan de follow-up in overleg met patiënt zo nodig worden gecontinueerd, ook afhankelijk van de bijkomende co-morbiditeit (bv epilepsie).
MRI-cerebrum
Bij alle patiënten met een PCZSL wordt geadviseerd om gedurende de eerste 2 jaar na beëindiging van de behandeling elke 3-4 maanden een MRI te maken, daarna elke 6 maanden tot 3 jaar na het einde van de behandeling. Dit om vroege, eventueel asymptomatische recidieven op te sporen en tijdig te kunnen starten met de behandeling indien hier mogelijkheden voor zijn, dan wel palliatieve therapie te bespreken. Daarna kan in overleg met de patiënt worden besloten de follow-up te beëindigen of alleen te volstaan met een klinische beoordeling.
Oogheelkundige beoordeling
In het geval van oculaire betrokkenheid van een cerebraal PCZSL wordt geadviseerd het spleetlamponderzoek en fundoscopie door de oogarts te laten verrichten met dezelfde frequentie als de neurologische controles
Liquor onderzoek
Standaard beoordeling van de liquor wordt niet aanbevolen in de follow up, alleen op indicatie.
Neuropsychologisch onderzoek
Bij persisterende cognitieve klachten of bij klachten in het dagelijks functioneren (thuis of op het werk) wordt geadviseerd een neuropsychologisch onderzoek te laten verrichten, gevolgd door gerichte cognitieve revalidatie of begeleiding.
Een neuropsychologisch onderzoek kan helpen bij de differentiaaldiagnose van cognitieve stoornissen, het kiezen of aanpassen van behandelingen op grond van cognitief functioneren en het evalueren van de effectiviteit van een behandeling.
Bij patiënten met gedocumenteerde neurologische aandoeningen kan het neuropsychologische onderzoek zowel de functionele beperkingen als ook de cognitieve reserves van de patiënt vaststellen. Op grond hiervan kan exacter worden bepaald welke vorm van cognitieve revalidatie en/of begeleiding zinvol kan zijn (bv verwijzing naar revalidatie-arts of psycholoog).
Veel voorkomende klachten van de patiënt of observaties door de omgeving die kunnen duiden op cognitieve schade zijn:
Daarnaast kan een neuropsychologische evaluatie worden overwogen indien er twijfel bestaat over de competentie van de patiënt rond belangrijke beslissingen. Hierbij kan het neuropsychologisch onderzoek uitsluitsel geven over het vermogen van een patiënt om doelgericht te handelen, rationeel te denken en effectief om te gaan met de omgeving.
Referenties
(1) Barajas RF, Politi LS, Anzalone N, Schöder H, Fox CP, Boxerman JL, et al. Consensus recommendations for MRI and PET imaging of primary central nervous system lymphoma: guideline statement from the International Primary CNS Lymphoma Collaborative Group (IPCG). Neuro Oncol 2021 Jul 1;23(7):1056-1071.
(2) Abrey LE, Batchelor TT, Ferreri AJM, Gospodarowicz M, Pulczynski EJ, Zucca E, et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma. J Clin Oncol 2005 Aug 1;23(22):5034-5043.
MBVP (1)
|
MBVP (2 cycli à 28 dagen) |
|||
|
MTX |
3 g/m2 |
intraveneus |
Dag 1, 15 |
|
Etoposide |
100 mg/m2 |
intraveneus |
Dag 2 |
|
Carmustine |
100 mg/m2 |
intraveneus |
Dag 3 |
|
Prednison |
60 mg/m2 |
intraveneus |
Dag 1-5 |
Indien rituximab wordt toegevoegd: 375 mg/m2, dag 0, 7, 14 en 22 tijdens cyclus 1, dag 0 en 14 tijdens cyclus 2. (2)
Consolidatie hoge dosis cytarabine (2)
|
Hoge dosis cytarabine (1 cyclus, 4-6 weken na laatste hoge dosis MTX, bij CR/CRu/PR na MBVP) |
|||
|
Cytarabine |
2 dd 2 g/m2 |
intraveneus |
Dag 1, 2 |
MATRix (3)
|
MATRix (4 cycli à 21 dagen) |
|||
|
Rituximab |
375 mg/m2 |
intraveneus |
Dag 1, 6 |
|
MTX |
3.5 g/m2 |
intraveneus |
Dag 2 |
|
Cytarabine |
2 dd 2 g/m2 |
intraveneus |
Dag 3, 4 |
|
Thiotepa |
30 mg/m2 |
intraveneus |
Dag 5 |
Conditioneringsschema carmustine/thiotepa (CT) (4)
|
Carmustine |
400 mg/m2 |
intraveneus |
Dag -6 |
|
Thiotepa |
2 dd 5 mg/kg |
intraveneus |
Dag -5 en -4 |
Rituximab/methotrexaat/procarbazine (R-MP) (5)
|
R-MP (2 cycli a 42 dagen) |
|||
|
Rituximab |
375 mg/m2 |
intraveneus |
Dag -6 *, 1, 15, 29 |
|
MTX |
3 g/m2 |
intraveneus |
Dag 2, 16, 30 |
|
Procarbazine |
60 mg/m2 |
per os |
Dag 2-11 |
|
Bij respons maintenance procarbazine, 6 cycli |
|||
|
Procarbazine |
100 mg |
per os |
Dag 1-5 |
*: dag -6 alleen bij kuur 1, dus alleen voor start van de behandeling.
ICE (6)
|
ICE (cycli a 3 weken) Formatting… |
|||
|
Ifosfamide |
5000 mg/m2 |
Intraveneus |
D 2 |
|
Carboplatin |
AUC 5 (max 800 mg) |
Intraveneus |
D 1 |
|
Etoposide |
100 mg/m2 |
Intraveneus |
D 1-3 |
Referenties
(1) Colombat P, Lemevel A, Bertrand P, Delwail V, Rachieru P, Brion A, et al. High-dose chemotherapy with autologous stem cell transplantation as first-line therapy for primary CNS lymphoma in patients younger than 60 years: a multicenter phase II study of the GOELAMS group. Bone Marrow Transplant 2006 Sep;38(6):417-420.
(2) Bromberg JEC, Issa S, Bakunina K, Minnema MC, Seute T, Durian M, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open-label, phase 3 intergroup study. Lancet Oncol 2019 Feb;20(2):216-228.
(3) Ferreri AJM, Cwynarski K, Pulczynski E, Ponzoni M, Deckert M, Politi LS, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group-32 (IELSG32) phase 2 trial. Lancet Haematol 2016 May;3(5):217.
(4) Ferreri AJM, Cwynarski K, Pulczynski E, Fox CP, Schorb E, La Rosée P, et al. Whole-brain radiotherapy or autologous stem-cell transplantation as consolidation strategies after high-dose methotrexate-based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study Group-32 phase 2 trial. Lancet Haematol 2017 Nov;4(11):e510-e523.
(5) Fritsch K, Kasenda B, Schorb E, Hau P, Bloehdorn J, Möhle R, et al. High-dose methotrexate-based immuno-chemotherapy for elderly primary CNS lymphoma patients (PRIMAIN study). Leukemia 2017 Apr;31(4):846-852.
(6) Choquet S, Grenier A, Houillier C, Soussain C, Moles MP, Gastinne T, et al. Very High Efficiency of ICE (Ifosfamide-Carboplatin-Etoposide) in Relapse/Refractory (R/R) Primary Central Nervous System (PCNSL) and Vitreo-Retinal (VRL) Non Hodgkin Lymphoma. a LOC Network Multicenter Retrospective Study on 58 Cases. Blood 2015;126(23):1524.
© 2022. Alle rechten voorbehouden