De Landelijke Werkgroep van Hemoglobinopathie Behandelaren heeft het initiatief genomen een ‘evidence-based’ richtlijn te ontwikkelen voor het beleid bij thalassemie.
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van thalassemie. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie verricht bij medisch specialisten en verpleegkundig specialisten werkzaam binnen het vakgebied als ook samen met patiënten (vertegenwoordigers). De meest relevante knelpunten zijn uitgewerkt tot uitgangsvragen. Dit betreft een aantal veelvoorkomende problemen in de dagelijkse praktijk rond het diagnostisch en therapeutisch beleid van patiënten met een thalassemie, zowel transfusie afhankelijk als transfusie onafhankelijk. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht een betere uniformiteit van behandeling van deze patiënten in Nederland te bewerkstelligen, met name ook op die gebieden waar bewijs ontbreekt. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek en behandeling van patiënten met een thalassemie.
De richtlijn is tot stand gekomen met medewerking van de volgende werkgroepleden die benoemd zijn en zitting hebben in de landelijke werkgroep hemoglobinopathie behandelaren (LWHB). De richtlijn is tot stand gekomen middels het raadplegen van de recente literatuur en het raadplegen van andere richtlijnen.
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin ze hun banden met de farmaceutische industrie aangeven.
In onderstaande tabel wordt een overzicht gegeven van de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
Bart Biemond, internist-hematoloog Amsterdam Medische Centra, Amsterdam |
Medisch adviseur patiëntenvereniging OSCAR Nederland
|
|
Harriët Heiboer, kinderhematoloog Emma Kinderziekenhuis, Amsterdam Medische Centra, Amsterdam |
– |
|
Jean-Louis Kerkhoffs, internist-hematoloog Haga Ziekenhuis, Den Haag |
– |
|
Anja Mäkelburg, internist-hematoloog Universitair Medisch Centrum Groningen, Groningen |
– |
|
Eva Rettenbacher, kinderhematoloog Emma Kinderziekenhuis, Amsterdam Medische Centra, Amsterdam |
– |
|
Anita Rijneveld, internist-hematoloog Erasmus Medisch Centrum, Rotterdam |
Adviescommissies bij Novartis |
|
Saskia Schols, internist-hematoloog Radboud universitair medisch centrum, Nijmegen |
– |
|
Frans Smiers, kinderhematoloog Leids Universitaire Medisch centrum, leiden |
Als deskundige door Bluebird betrokken geweest bij aanvraag vergoeding Zynteglo. Onbetaald. |
Voor het vinden van relevante informatie is gebruik gemaakt van pubmed en andere internationale richtlijnen.
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Pubmed. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en bestaande internationale richtlijnen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
De conceptrichtlijn is voor commentaar aangeboden aan de leden van de Nederlandse Vereniging voor Hematologie (NVvH) en OSCAR Nederland. Het commentaar geeft input vanuit het veld om de kwaliteit en de toepasbaarheid van de richtlijn te optimaliseren en landelijk draagvlak voor de richtlijn te genereren. Alle commentaren werden vervolgens beoordeeld en verwerkt door de werkgroep. De richtlijn werd op 23 juni 2022 door de LWHB inhoudelijk vastgesteld. Ten slotte is de richtlijn ter autorisatie gestuurd naar OSCAR Nederland en de Nederlandse Vereniging voor Hematologie.
In de verschillende fasen van de ontwikkeling van het concept van de richtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen.
Om het gebruik in de dagelijkse praktijk te bevorderen wordt deze richtlijn verspreid onder de professionals van de bij de totstandkoming van deze richtlijn betrokken organisatie(s):
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is/wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast is/wordt er een toelichting op de richtlijn aangeboden aan het tijdschrift voor Hematologie. Ook is de richtlijn te downloaden vanaf de website van de Nederlandse Vereniging voor Hematologie (NVvH): www.hematologienederland.nl .
In deze richtlijn worden de patiënten vertegenwoordigd door een afgevaardigde van OSCAR Nederland. (patiëntenorganisatie voor dragers en patiënten met sikkelcelziekte en thalassemie)
|
Diagnostiek en behandeling van thalassemie |
|
|
1. |
Diagnostiek van thalassemie |
|
2. |
Monitoren orgaanschade |
|
3. |
Bloedtransfusie |
|
4. |
IJzerstapeling en ontijzeringstherapie |
|
5. |
Endocriene complicaties en osteoporose |
|
6. |
Trombose |
|
7. |
Pulmonale hypertensie |
|
8. |
Ulcus cruris |
|
9. |
Fertiliteit, zwangerschap en counseling plaats |
|
10. |
Splenectomie |
|
11. |
Hydroxyurea bij thalassemie |
|
12. |
Stamceltransplantatie |
|
13. |
Nieuwe behandelmodaliteiten |
Aanbeveling
|
Conclusies |
SORT Grade |
|
De meest gangbare technieken om β-thalassemie vast te stellen zijn de HPLC en capillaire elektroforese (EC) methode. Met name ten behoeve van antenatale diagnostiek is aanvullende mutatie analyse geïndiceerd. |
A |
|
Voor de diagnostiek van α-thalassemie is altijd moleculaire diagnostiek aangewezen. In het algemeen kan volstaan worden met het bepalen van de 7 meest voorkomende deleties met GAP-PCR. |
A |
|
De belangrijkste algemene lab parameters bij de diagnostiek van β-thalassemie zijn: Een microcytaire (MCV > 50 en < 70 tot max 80 fL), hypochrome (verlaagd MCH) anemie, met een verhoogd aantal reticulocyten en in de perifere rode cel uitstrijk schietschijf cellen, diverse andere vormafwijkingen en erytroblasten, zonder dat sprake is van een verlaagde ijzerstatus. |
A |
|
De belangrijkste algemene lab parameters bij de diagnostiek van α-thalassemie zijn: Een microcytaire (MCV > 50 en < 70 tot max 80 fL), hypochrome (verlaagd MCH) anemie, met een verhoogd aantal reticulocyten. |
A |
Onderbouwing
Introductie
Er zijn diverse fysiologische vormen van hemoglobine. De aanwezigheid van deze vormen kan verschillen per leeftijd en per individu.
In de postnatale situatie zijn deze vormen: HbA (bestaande uit 2 α- en 2 β – ketens), HbA2 (2 α- en 2 δ-ketens) en HbF (2 α- en 2 γ- ketens).
In de fysiologische situatie bevatten de rode bloedcellen van een volwassene ongeveer 97-98% HbA, 2-3% HbA2 en een minimale hoeveelheid HbF en van een pasgeborene ongeveer 70 -95% HbF, 5-30% HbA en < 1% HbA2.
Gedurende het eerste levensjaar neemt de expressie van het HbF af en wordt in de fysiologische situatie geleidelijk aan vervangen door HbA expressie.
Thalassemie
Bij thalassemie is sprake van verminderde of afwezige globine keten productie.
Afhankelijk van de verminderde of afwezige productie van het soort keten, is bijvoorbeeld sprake van α-, β-, γ-, δ-thalassemie of combinaties hiervan.
De belangrijkste vormen van thalassemie zijn α- en β-thalassemie. Deze erven autosomaal recessief over en de ernst van het ziektebeeld kan uitgedrukt worden als klinisch beeld (fenotype) of als genotype (soort mutatie).
Mensen met een heterozygote genetische variant van α- of β-thalassemie zijn veelal asymptomatisch en behoeven geen behandeling.
Mensen met een homozygote of samengesteld heterozygote genetische thalassemie variant, vertonen in wisselende mate klinische expressie, waarvan bloedarmoede de belangrijkste is.
Tegenwoordig spreken we van TDT (transfusie afhankelijke thalassemie) en NTDT (niet- transfusie afhankelijke thalassemie) (zie Figuur 1).
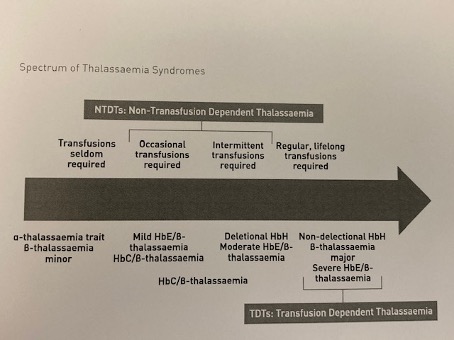
Figuur 1: Spectrum van de thalassemie syndromen.
Diagnostiek van β-thalassemie
Normaal gesproken heeft een individu één actief β-gen op elke kopie van chromosoom 11. Er zijn tot op heden meer dan 200 mutaties in het β-gen beschreven, aanleiding gevend tot variabele klinische expressie. Een β0-mutatie houdt in dat er geen enkele expressie door het betreffende gen plaatsvindt en dus geen β-globine productie. Een β+-mutatie houdt in dat er verminderde expressie door het betreffende gen plaatsvindt en dus verminderde β-globine productie (rond 10%). Bij β++-mutaties is de verminderde productie erg mild.
De belangrijkste algemene laboratorium bevindingen bij β-thalassemie zijn (zie ook Figuur 2): Een microcytaire (MCV > 50 en < 70 tot max 80 fL), hypochrome (verlaagd MCH) anemie, met een verhoogd aantal reticulocyten en in de perifere rode cel uitstrijk schietschijf cellen, diverse andere vormafwijkingen en erytroblasten, zonder dat sprake is van een verlaagde ijzerstatus.
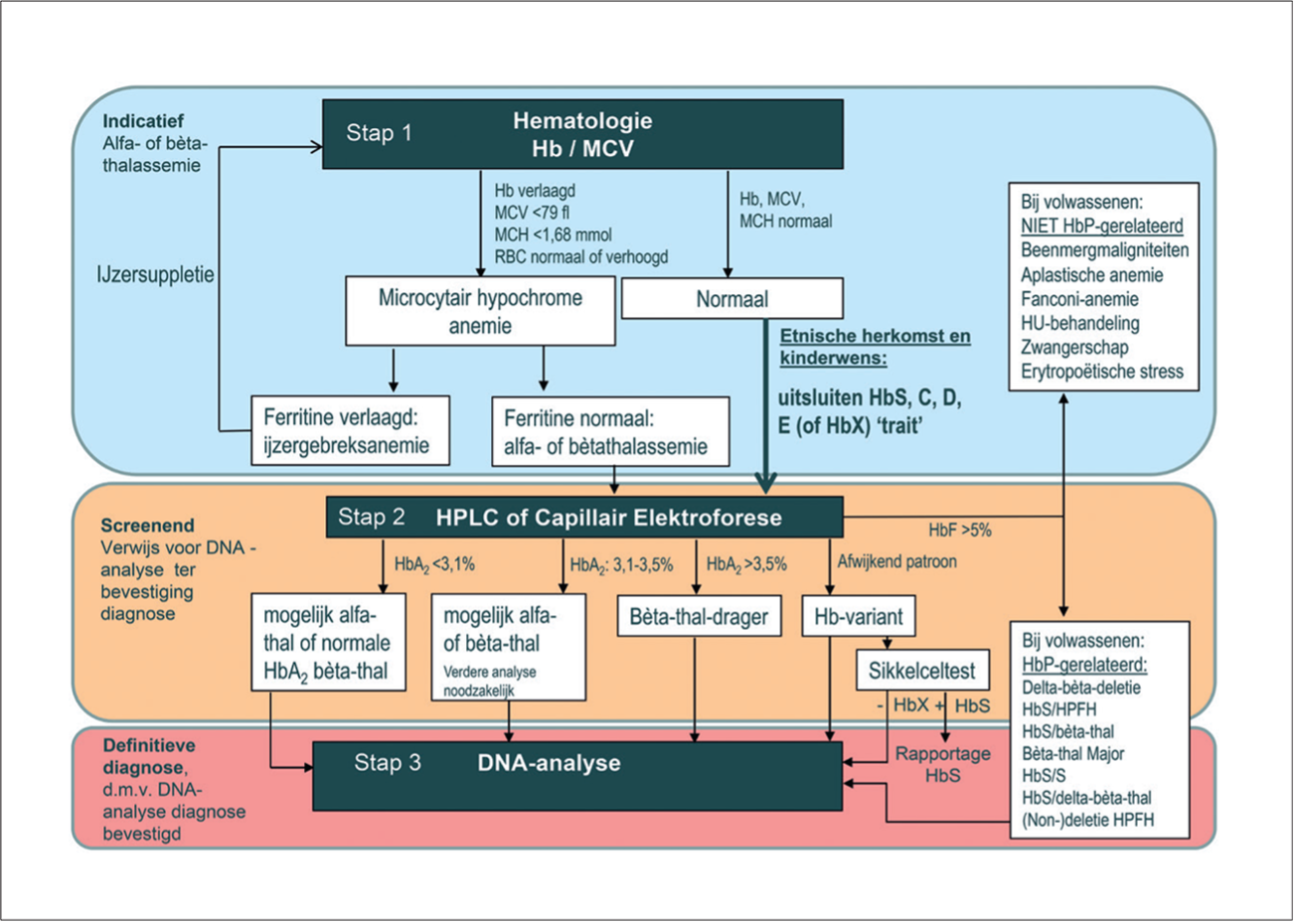
Figuur 2. Stroomdiagram diagnostisch proces voor hemoglobinopathie en dragerschap hiervan.
Hemoglobine analyse met kwantitatieve technieken dient ingezet te worden ter diagnostiek en bestaat uit:
Met deze kwantitatieve technieken wordt de hoeveelheid en type aanwezig hemoglobine bepaald.
Bij kinderen vanaf 1 jaar en volwassenen met homozygote β0-thalassemie is er geen aanwezigheid van HbA, een verhoogd gehalte HbA2 en sprake van een HbF gehalte tussen 92 en 95%.
Voor pasgeborenen met homozygote β0-thalassemie geldt: geen HbA, HbF > 95%, HbA2 < 2.5%.
Bij kinderen vanaf 1 jaar en volwassenen met homozygote β+-thalassemie of samengestelde β+/β0-mutaties, is het HbA gehalte tussen 10 en 30%, de HbA2 waarde verhoogd en de HbF waarde tussen 70 en 90%.
Voor pasgeborenen met deze intermedia vormen geldt: HbA < 5%, HbF > 95% en HbA2 < 2.5%.
Moleculaire analyse
Aanvullende moleculaire analyse is in het algemeen niet noodzakelijk voor het stellen van de juiste diagnose, maar kan in sommige gevallen zeker van diagnostische waarde zijn. In geval van prenatale diagnostiek is dit noodzakelijk om vast te kunnen stellen of het ongeboren kind al dan niet aangedaan is.
Veel voorkomende mutaties kunnen met PCR technieken vastgesteld worden. Als met deze gerichte mutatie analyse geen mutatie aangetoond kan worden, kan het aangewezen zijn om β-globine gen sequentie analyse uit te voeren.
Genotype-fenotype correlatie
De disbalans in globine ketens (α- versus β-ketens) vormt een belangrijke determinant van de ernst van het klinisch beeld van de β-thalassemie. Om deze reden zijn factoren die deze disbalans verminderen, mede bepalend voor het fenotype. Zo draagt een bijkomende α-thalassemie bij aan een vermindering van de ernst van de anemie. Ook mutaties (o.a. de HPFH mutatie) die aanleiding geven tot verhoogde productie van γ-ketens, hebben een dergelijk gunstig effect.
Aan de andere kant kan het fenotype in negatieve zin worden beïnvloed door de aanwezigheid van een toegenomen keten disbalans door toename van α-ketens als gevolg van een toegenomen aantal functionele α- globine genen (triplicatie of quadruplicatie).
Diagnostische workup β-thalassemie in samenvatting
Diagnostiek van α-thalassemie
Normaal gesproken heeft elk individu 4 α-genen ( 2 gedupliceerde α-genen op 2 loci) op de korte arm van chromosoom 16.
In tegenstelling tot β-thalassemie, wordt bij α-thalassemie de verminderde of afwezige synthese van de ketens veelal veroorzaakt door deleties, optredend in het α-globine gen cluster op chromosoom 16. Er zijn ruim 125 verschillende moleculaire defecten beschreven die α-thalassemie kunnen veroorzaken, die sterk in grootte verschillen. De meest voorkomende deleties zijn de South East Asian (-SEA) deletie, die 2 α-genen betreft en de 4.2 en 3.7 kb-deleties.
De verschillende α-thalassemie fenotypes zijn het gevolg van het ontbreken van één (α+-thalassemie) of beide (α0-thalassemie) α-globine genen op elk van de beide loci.
De belangrijkste algemene laboratorium bevindingen bij de klinisch belangrijke vormen van α-thalassemie (HbH ziekte) zijn (zie ook Figuur 2):
Moleculaire analyse
Voor het stellen van de diagnose α-thalassemie is moleculaire diagnostiek aangewezen. In veel laboratoria beperkt deze diagnostiek zich tot de 7 meest voorkomende deleties, die met behulp van GAP-PCR vastgesteld kunnen worden. Bij persisterende verdenking op α-thalassemie na uitsluiten van deze deleties, kan uitgebreidere moleculaire diagnostiek met α-gen sequencing of MLPA (multiplex ligation-dependent probe amplification) verricht worden in daartoe gespecialiseerde laboratoria. Ter opsporing van de non-deletionele vormen, die ook oorzaak kunnen zijn van instabiliteit van de α-ketens, wordt vaak de techniek van geautomatiseerde Direct-Sequencing technieken volgens Sanger gebruikt.
HbH ziekte is de klinisch belangrijkste vorm van α-thalassemie en kan het gevolg zijn van het ontbreken van 3 α-genen of van een combinatie van deletionele en non-deletionele mutaties, waarvan Hb Constant Spring de meest voorkomende is (zie Tabel 1). De non-deletionele vorm van HbH ziekte is geassocieerd met een ernstiger fenotype.
Ook kunnen extra α-genen een β-thalassemie intermedia fenotype veroorzaken bij dragers van β-thalassemie. Alfa-triplicatie (de anti alfa 3.7) kan via een PCR gebaseerde methode worden aangetoond of d.m.v. MLPA.
Tabel 1. Genotype-fenotype correlatie bij α-thalassemie
|
Fenotype |
Genotype |
Kliniek/bloedbeeld |
|
Silent carrier |
α0α/αα |
Asymptomatisch Geen hematologische afwijkingen |
|
Drager/minor |
α0α/α0α α0α0/αα |
Milde asymptomatische anemie Microcytose en hypochromie |
|
Deletionele HbH ziekte |
α0α0/α0α |
Milde tot matige anemie Niet-transfusie afhankelijk Kliniek varieert van minor tot major |
|
Non-deletionele HbH ziekte |
α0α0/αTα |
Matige tot ernstige anemie Kan incidentele of frequente transfusies nodig hebben |
|
Major (HbBart’s hydrops foetalis) |
α0α0/α0α0 |
De meesten ontwikkelen hydrops foetalis en overlijden intrauterien of kort post partum Indien overleving (antenatale transfusies), dan transfusie afhankelijk |
De ‘T’ staat voor een non-deletionele α keten mutatie, zoals Hb Constant Spring
Bij pasgeborenen kan HbH ziekte vermoed worden door het aantonen met Hb-typering (o.a. met HPLC) van HbBart’s. HbBart’s bestaat uit 4 γ-ketens en ontstaat in afwezigheid van voldoende α-ketens. Dit HbBart’s verdwijnt echter snel na de geboorte. HbBart’s van rond 25% bij een pasgeborene suggereert de aanwezigheid van HbH ziekte.
Op latere leeftijd kan bij Hb-typering HbH (4 β-ketens) aangetoond worden, echter dit is niet bij alle patiënten met α-thalassemie aanwezig.
HbBart’s hydrops foetalis wordt veroorzaakt door de deletie van alle 4 α-genen en is in principe niet met het leven verenigbaar (tenzij het kind antenataal en reeds vroeg in de zwangerschap bloedtransfusies ontvangt). Indien een kind met HbBart’s overleeft, dan zal het ook postnataal transfusie afhankelijk blijven.
Genotype-fenotype correlatie
De mate van anemie is verschillend voor de diverse vormen van HbH ziekte: bij de deletionele vorm variërend tussen 4.3 en 6.6 mmol/L; bij de non-deletionele vorm tussen 2.4 en 5.4 mmol/L.
Diagnostische workup α-thalassemie in samenvatting
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Welke onderzoeken zijn in welke frequentie nodig om orgaanschade bij patiënten te detecteren?
Aanbeveling
Het schema is een aanbeveling in welke frequentie screeningsonderzoeken moeten worden gedaan. Daarbij is een onderscheid gemaakt tussen het eerste consult en poliklinisch vervolgconsult. De frequentie van de onderzoeken kan aangepast worden indien sprake is van orgaanschade.
|
Basisdiagnostiek eerste consult |
|
Hb, MCV, leukocyten, trombocyten, reticulocyten Hb typering (HPLC), alfa-thalassemie onderzoek, DNA-diagnostiek |
|
Bilirubine (direct/totaal), LDH, kreatinine, ASAT, ALAT , AF en γGT, ferritine/transferrinesaturatie (TSAT) Indien verdenking ijzerstapeling: FT4, TSH, LH, FSH, IGF1, testosteron |
|
Parvovirus B19 virusserologie Hepatitis B, C HIV |
|
Indien verdenking ijzerstapeling: MRI T2*lever en hart, overweeg cortisol, OGTT/nuchtere glucose, HbA1c (zie ook endocriene complicaties) |
|
Genetische counseling (bij voorkeur verwijzing naar klinisch geneticus) |
|
Follow up monitoring |
Eerste keer op leeftijd van |
Frequentie |
|
Hb, MCV, leukocyten, trombocyten, reticulocyten |
6 maanden |
2x/jaar |
|
Uitgebreide bloedgroep typering |
Indien transfusieafhankelijk |
Eenmalig |
|
Bilirubine (direct/total), LDH, ferritine,transferrine verzadiging (TSAT) |
6 maanden |
2x/jaar |
|
Foliumzuur, vitamine B12 |
1 jaar |
1x/jaar |
|
ALAT, ASAT, AF, γGT, glucose |
1 jaar |
1x/jaar |
|
Kreatinine |
1 jaar |
2x/jaar |
|
Parvo B19 serologie |
5 jaar |
1x/5 jaar (indien negatief en polytransfusé) |
|
Bloeddruk |
5 jaar |
1x/jaar |
|
ECG |
Eenmalig op 15 jaar |
Op indicatie |
|
Echo cor (1) |
15 jaar |
1x/3 jaar, bij afwijkingen frequenter |
|
Echo abdomen |
Eenmalig op 15 jaar |
o.i. |
|
Urineportie op microalbumine, microalbumine/kreat ratio |
Vanaf 10 jaar |
1x/jaar |
|
botdensitometrie |
Vanaf 18 jaar of eerder op indicatie |
1x/2-3 jaar |
|
MRI T2* van hart en lever |
Voorkeur vanaf 6-8ste levensjaar, anders onder narcose |
1x/2 jaar |
|
HLA typering |
|
indien allogene stamceltransplantatie wordt overwogen |
|
zie ook monitoring endocriene parameters |
|
|
1 Echocardiografie (dimensies ventriculi en atria, diastolische functie, PAP druk, LV en RV ejectiefractie, pieksnelheid tricuspidalisklep (TRV) in verband met pulmonale hypertensie).
|
Extra monitoring bij chelatietherapie |
|
|
Bloedbeeld |
4x/jaar |
|
Ferritine |
4x/jaar |
|
Zink, calcium, geioniseerd calcium, magnesium, koper, fosfaat, glucose, vitamin D |
1x/jaar |
|
Kreatinine |
4x/jaar |
|
Urine; eiwit en microalbumine |
1x/jaar |
|
ASAT, ALAT, AF, γGT, bilirubine |
4x/jaar |
|
FT4, T3, TSH, IGF1, testosteron, PTH |
1x/ 2 jaar indien inadequate ontijzering |
|
Audiogram/ICC oogheelkunde |
1x/jaar |
|
MRI T2* |
Bij start ijzerchelatietherapie en indien afwijkend, 1x/2 jaar. NTDT jaarlijks MRI T2* |
Onderbouwing
De levensverwachting van patiënten met thalassemie (excl. dragers) is beperkt als gevolg van orgaanschade door met name ijzerstapeling. Door systematische screening kan orgaanschade in een vroeg stadium worden gediagnosticeerd en kunnen preventieve maatregelen worden genomen. Dit vormt de reden dat bij alle patiënten met thalassemie systematische screening op secundaire orgaanschade dient plaats te vinden.
Patiënten met niet transfusie afhankelijke thalassemie kunnen zowel osteoporose als ijzerstapeling ontwikkelen en screening middels ferritine en transferrine saturatie (TSAT) volstaat niet (Taher BJH 2010, Barcellini BJH 2019, Beers 2019). Om die reden is het advies ook bij deze patiënten regelmatig bloed- en beeldvormend onderzoek te doen naar orgaanschade (zie tabel). Vijftig procent van patiënten met TDT en NTDT ontwikkelt osteoporose (De-sanctis et al. 2018, Metabolism)). Met zelfs nog een hoger voorkomen bij mannen. Het fractuurrisico in TDT/NTDT lijkt zelfs 30-50% te zijn weliswaar betreft dit studies van oudere datum en mogelijk met inadequate ijzerchelatie (1985 A.Finsterbush et al., Clin Orthop).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen
Referenties
Aanbevelingen
|
Conclusie |
SORT Grade |
|
Start in patiënten met een bewezen thalassemie met chronische transfusiebehandeling bij een Hb <4.3 mmol/l op 2 opeenvolgende meetmomenten die >2 weken uit elkaar liggen in afwezigheid van andere mogelijk verklarende factoren voor de anemie (infectie, etc.) (Capellini 2014) |
C |
|
geef transfusie bij een Hb >4.3 mmol/l in combinatie met een of meerdere van de volgende symptomen: verandering van de ossale gezichts-structuren, groeiretardatie, fracturen, klinisch significante extramedullaire hematopoëse (Taher 2017) |
C |
|
Geef incidenteel transfusie bij een NTDT-patiënt bij verergering van de anemie in kader van infectie of trauma en profylactisch in kader van chirurgie of zwangerschap (Taher 2017) |
C |
|
Streef bij TDT-patiënten een pre-transfusie-Hb van 5.5 mmol/L (en bij cardiovasculaire comorbiditeit 6.5 mmol/l) na (Capellini 2014) |
C |
|
Bij getransfundeerde thalassemie patiënten wordt een verhoogde prevalentie van allo-antistoffen gericht tegen antigenen van het Rhesus- en Kell-systeem (Zaidi 2015, Franchini 2019) |
B |
|
Selecteer voor patiënten met thalassemie en frequente transfusiebehoefte Rh fenotype en K compatibel bloed ter voorkoming van de vorming van alloantistoffen. (Richtlijn Bloedtransfusie 2020) |
C |
|
Typeer transfusie-afhankelijke patiënten met thalassemie zo vroeg mogelijk voor de bloedgroepantigenen van het Rh, Kell, Duffy, Kidd en MNS-systeem (de S en s antigenen en eventueel voor het M antigeen typeren). (Richtlijn Bloedtransfusie 2020) |
C |
|
Bij parvo B19-IgG-negatieve thalassemie-patiënten bestaat de voorkeur voor het geven van Parvo B19-veilige bloedproducten. (Lefrere 1986) |
C |
De TIF-richtlijn beveelt aan om bij kinderen (uitgaande van een RBC-hematokriet van 60%, zoals bij de in NL verkrijgbare RBC’s) 10 ml/kg te transfunderen om het Hb 1,24 mmol/l te laten stijgen en 15 ml/kg om het Hb om 1,86 mmol/l te laten stijgen. Dat is lager dan de doorgaans bij kinderen geadviseerde 15-20 ml/kg.
Bij volwassenen wordt initieel van een stijging van het Hb om ca 0,5 mmol/l per RBC uitgegaan als geen eerdere transfusie-opbrengsten bekend zijn. Indien opbrengsten van eerdere transfusies bekend zijn wordt aanbevolen om hiermee rekening te houden, aangezien de opbrengst kan verschillen afhankelijk van het circulerend bloedvolume.
Onderbouwing
Door de ineffectieve hemoglobine-synthese bij patiënten met beta-thalassemie is er sprake van een verkorte overleving van erytrocyten door hemolyse en premature afbraak van erytocytaire voorlopers in het beenmerg (Weatherall 2001). De hierdoor ontstane chronische anemie kan onder andere beenmergexpansie, hepatosplenomegalie, groeiretardatie of hartfalen ten gevolg hebben (Capellini 2014, Taher 2017, Taher 2021). Erytrocytentransfusies corrigeren de anemie, voorkomen beenmerghyperplasie en hepatosplenomegalie, ondersteunen normale groei en dagelijkse activiteiten en verbeteren de kwaliteit van leven, indien deze transfusies op een chronische basis gegeven worden (Capellini 2014, UK Thalassemia Society 2016,Taher 2017, Taher 2021).
In de drie studies onder patiënten met thalassemie varieert de prevalentie van alloimmunisatie van 2 tot 11%, indien alleen ABO, RhD gematcht is (Lal 2018, Richtlijn Bloedtransfusie 2020). Het betreffen met name Rh en K-alloantistoffen. Het wordt aangenomen dat het immunisatierisico bij thalassemie-patiënten lager ligt dan bij de groep patiënten met sikkelcelziekte. De onderliggende ziekte, de leeftijd waarop gestart is met transfusie, de transfusiefrequentie, die per type thalassemie kan verschillen, of minder grote verschillen in bloedgroepantigeentyperingen tussen patiënten en donors kunnen een verklaring zijn voor de lagere prevalentie van alloimmunisatie bij deze groep patiënten met thalassemie. De Richtlijn bloedtransfusie 2020 adviseert dan ook om enkel voor Rhesus en Kell gematcht donorbloed te selecteren en niet preventief voor andere erytrocyten-antigenen te matchen (Richtlijn Bloedtransfusie 2020).
Naast het uittyperen voor de RhCcEe en K bloedgroepantigenen dienen transfusie-afhankelijke patiënten met thalassemie zo mogelijk, bij voorkeur voor de eerste transfusie, ook uitgetypeerd te worden voor de bloedgroepantigenen van het Duffy, Kidd en MNS-systeem (M, S en s antigenen) (Richtlijn Bloedtransfusie 2020).
Bij sommige groepen patiënten kan het Parvo B19 virus voor ernstige gezondheidsproblemen zorgen. Onder andere werd bij patiënten met thalassemie een aplastische crisis ten gevolge van een infectie met Parvo B19 beschreven (Lefrere 1986). Derhalve is het advies om o.a. patiënten met een thalassemie bij afwezigheid van Parvo B19 IgG-antistoffen Parvo B19 veilig bloed te geven (Gezondheidsraad, 2002). Als een patiënt IgG-antistoffen tegen dit virus heeft kan ervan uitgegaan worden dat er geen herinfectie kan optreden en hoeven er geen Parvo veilige transfusies meer gegeven te worden.
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
Behandeling ziet er als volgt uit:
Onderbouwing
Inleiding
Ijzerstapeling treedt op door een dysbalans tussen het ijzer dat het lichaam binnenkomt en weer wordt uitgescheiden of verbruikt. Het lichaam heeft van nature geen fysiologisch mechanisme om een overschot aan ijzer uit te scheiden. Een overschot aan ijzer in het lichaam leidt tot schade een veel organen, met als gevolg hartfalen, cirrose, groeiachterstand en meerdere endocrinopathieën (2014).
|
Conclusie |
SORT Grade |
|
1a. De meest accurate inschatting van de ijzerstatus wordt verricht door het meten van de liver iron content (LIC) afkomstig van een MRI scan.(Wood and Ghugre 2008) Bij alle patiënten met een NTDT >10 jaar dient de ijzerstatus frequent gemonitord te worden. (Taher, Musallam et al. 2010, Musallam, Cappellini et al. 2012) |
B |
|
1b. Het serum ferritine is een marker die een ruwe benadering geeft van de LIC waarde. (Olivieri, Nathan et al. 1994). Echter bij NTDT kan er een onderschatting van de mate van ijzerstapeling optreden door alleen het ferritine te bepalen (Taher, Vichinsky et al. 2013). |
B |
|
1c. IJzerstapeling in de lever treedt eerder op dan in het hart. De mate van ijzerstapeling in het hart kan worden ingeschat met behulp van de T2* bepaling van een MRI scan.(Porter and Davis 2002) |
B |
|
2a. Bij TDT patiënten wordt ontijzeringstherapie aanbevolen na een cumulatieve bloedtransfusie aantal van >20-25 eenheden of een LIC waarde >3 mg/g drooggewicht Fe. (Rachmilewitz and Giardina 2011) |
B |
|
2b. Ontijzeringstherapie bij NTDT patiënten >10 jaar wordt aanbevolen vanaf een LIC waarde >5 mg/g drooggewicht FE of en serum ferritine van >800 ng/ml. (Taher, Vichinsky et al. 2013) |
B |
|
3a. De eerste lijns medicamenteuze behandeling van ijzerstapeling bij TDT patiënten bestaat uit deferasirox, zowel voor kinderen als voor volwassenen (2014). De dosering van deferasirox is tussen 14-28 mg/kg per dag. |
A |
|
3b. Alternatieve behandeling van ijzerstapeling bij TDT patiënten na deferasirox is deferoxamine via een subcutane injectie met een pompje, in een dosering van 20-40mg/kg/dag gedurende een aantal uur achter elkaar. (2014) |
A |
|
3c. Deferipron heeft zijn ontijzeringswerking vooral bewezen in cardiale ijzerstapeling. (Rachmilewitz and Giardina 2011) |
A |
|
3d. Medicamenteuze behandeling van ijzerstapeling van NTDT patiënten bestaat alleen uit deferasirox. (Taher, Vichinsky et al. 2013) |
A |
|
3e. Combinatie therapie met deferipron en deferoxamine hebben een toegevoegde waarde om extra ijzer te cheleren. (Rachmilewitz and Giardina 2011) Andere combinatietherapieën waaronder deferarisox met deferipron zijn alleen in experimentele studies onderzocht en laten wisselende uitkomsten zien. (Galanello, Agus et al. 2010) |
B |
|
Het risico op hartfalen neemt toe naarmate de T2* waarde afneemt <10 ms. In het geval van acuut hartfalen (meestal bij een T2* waarde < 6 ms) wordt geadviseerd om continue 24 uurs deferoxamine infuus te starten, eventueel in combinatie met deferipron in een standaard dosering. Deze combinatietherapie is over een lange periode van maanden en jaren vaak noodzakelijk om een stijging in de T2* waarde te zien (Farmakis, 2022). |
B |
Onderbouwing
IJzerstapeling treedt op zodra de opname van ijzer gedurende een bepaalde periode verhoogd is. Dit gebeurt als gevolg van bloedtransfusies (bij TDT) of een toegenomen absorptie van ijzer door het gastro-intestinale kanaal (bij NTDT). Het lichaam heeft van nature geen fysiologisch mechanisme om een overschot aan ijzer uit te scheiden. Onbehandelde ijzerstapeling is uiteindelijk schadelijk voor alle organen en kan leiden tot hartfalen, cirrose met kans op de ontwikkeling van een hepatocellulair carcinoom, groeiachterstand en meerdere endocrinopathieën (Taher and Saliba 2017). Tijdens een bloedtransfusie komt er gemiddeld 200mg ijzer het lichaam binnen. Dit is equivalent met 0,32-0,64mg/kg ijzer per dag. Bij NTDT patiënten treedt ijzerstapeling trager op dan bij TDT patiënten, echter door het cumulatieve proces zijn er aanwijzingen dat in onbehandelde NTDT patiënten, de mate van ijzerstapeling na een leeftijd van 10 jaar al schadelijke gevolgen kan hebben (Taher, Musallam et al. 2010, Musallam, Cappellini et al. 2012).
De meest betrouwbare methode om op orgaanniveau de mate van ijzerstapeling te meten, is het vervaardigen van een MRI scan. Er zijn speciale meettechnieken die het mogelijk maken om ijzerinhoud in de lever, LIC waarde, of in het hart te bepalen, de T2* setting (Wood and Ghugre 2008) (Storey, Thompson et al. 2007). In de klinische praktijk zal na het bepalen van een LIC waarde of T2* waarde de ijzerstatus vooral worden verricht door het laagdrempelig aanvragen van een ijzerpanel in het bloed, bestaande uit een ferritine gehalte en ijzerverzadiging. Het ferritine is een acuut fase eiwit, waarbij de hoogte van de spiegel beïnvloed kan worden door meerdere factoren, waaronder een verhoogde inflammatie (Brittenham, Cohen et al. 1993). Over een langere periode gemeten is het ferritine gehalte wel van prognostische waarde bij ijzerstapeling (Borgna-Pignatti, Rugolotto et al. 2004), (Davis, O’Sullivan et al. 2004), (Olivieri, Nathan et al. 1994, Gabutti and Piga 1996). Tijdens chelatietherapie kan het voorkomen dat het serum ferritine gedurende een bepaalde tijd hoog blijft zonder een daling te laten zien. Dit wil echter niet zegen dat er op orgaanniveau geen ontijzering plaatsvindt. Bij hoge ijzerstapeling wordt eerst op orgaanniveau een afname van het ijzer gezien, vaak voordat het ferritine gehalte gaan dalen (LIC >30 mg/g drooggewicht Fe) (Adamkiewicz, Abboud et al. 2009).
Bij TDT patiënten wordt het aanbevolen vanaf een leeftijd van 2-3 jaar met ontijzeringstherapie te starten als regelmatige transfusies gegeven zijn, met een minimum van 20-25 eenheden, een ferritine gehalte >800 ng/ml en een LIC waarde > 3 mg/g drooggewicht ijzer (Rachmilewitz and Giardina 2011).
Er zijn momenteel drie medicamenteuze ijzerchelatoren op de markt: deferasirox, deferoxamine en deferipron. Het aantal studies met ervaring met deze middelen is het hoogst bij TDT patiënten. Gezien de beschikbaarheid van tabletten en de vele ervaring met deferasirox, is dit middel de eerste keus behandeling bij ijzerstapeling bij TDT patiënten (Cappellini, Bejaoui et al. 2007, Cappellini, Porter et al. 2010, Cappellini, Bejaoui et al. 2011). De dosering ligt tussen de 14 – 28 mg/kg per dag. Het gebonden ijzer-deferasirox complex wordt voor een groot deel via de ontlasting uitgescheiden. Belangrijkste nevenwerking is achteruitgang van de nierfunctie. Bij een verminderde nierfunctie wordt voorzichtigheid geboden bij het gebruik van deferasirox. Deferoxamine wordt via een subcutaan infuus met een pompje gedurende een aantal uur toegediend. Dit middel is uitgebreid bewezen effectief in het verlagen van ijzerstapeling, met name in de lever (2014). De gemiddelde dagdosering zit tussen de 20-40 mg/kg, en het ijzer-deferoxamine complex wordt zowel in de urine als de ontlasting uitgescheiden. De combinatie van vitamine C gebruik en deferoxamine verhoogde de excretie van ijzer. Het is echter aanbevolen om de dagelijkse inname van 2-3 mg/kg vitamine C niet te overschrijden, omdat het vrijgekomen ijzer door vitamine C schadelijk kan worden (2014). Deferipron wordt hoofdzakelijk gebruikt bij ijzerstapeling met cardiale betrokkenheid, in een dagelijkse dosering van 25mg/kg driemaal per dag. Het complex van ijzer-gebonden aan deferipron wordt via de urine uitgescheiden (2014). Let bij het gebruik van deferipron op de ernstige bijwerking agranylocytose.
Het gecombineerd gebruik van ijzerchelatoren is niet op grote schaal onderzocht, er wordt dan ook geadviseerd dit niet standaard te doen. De combinatie deferoxamine en deferasirox is nog het vaakst beschreven. Een studie met een beperkt aantal TDT patiënten liet gedurende continue therapie van 12 maanden een afname in LIC en T2* waarde zien (Lal, Porter et al. 2013). Een grote studie (Hyperion, n=60) liet een significante afname zien van ijzerstapeling zowel in lever als in het hart na 24 maanden combinatie behandeling van deferoxamine en deferasirox (Aydinok, Kattamis et al. 2015). De combinatie deferasirox en deferipron is zeer beperkt onderzocht. Met name case reports hebben het positieve effect op de ijzerstapeling laten zien (Farmaki, Tzoumari et al. 2010, Voskaridou, Christoulas et al. 2011).
Bij NTDT patiënten wordt geadviseerd bij ijzerstapeling te starten met deferasirox, daar met de andere ijzerchelatoren te weinig onderzoek bekend is. Voor elke ijzerchelator geldt, dat het maximale effect wordt bereikt als de chelator dagelijks gedurende maanden tot jaren wordt gebruikt. Het cheleren van ijzer is een tijdrovende exercitie.
Tijdens een zwangerschap wordt het gebruik van alle drie de chelatoren ontraden door het teratogene effect hebben. Alleen voor het gebruik van deferoxamine is in het derde trimester van de zwangerschap bij cardiale ijzerstapeling en een afname van de pompfunctie door ijzerstapeling een positief effect gezien (Piccioni, Capone et al. 2020).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
De volgende endocriene onderzoeken zijn geïndiceerd:
|
Monitoring endocriene parameters |
Eerste keer op leeftijd van |
Frequentie |
|
Gewicht, lengte, zithoogte |
vanaf diagnose |
1x/jaar tot eindlengte bereikt |
|
Evaluatie groeicurve |
vanaf diagnose |
1x/jaar |
|
TSH, vrij T4* |
Vanaf 5 jaar (TDT), 10 jaar (NTDT) |
1x/jaar |
|
Tanner stadia |
vanaf 10 jaar |
2x/jaar |
|
Anamnese menarche, menstruatiecyclus |
Vanaf 10 jaar |
1x/jaar |
|
Testosteron |
M, na puberteit |
1x/jaar |
|
Nuchter glucose |
Vanaf 10 jaar |
1x/jaar |
|
Orale glucose tolerantie test |
Vanaf puberteit |
1x/jaar |
|
Ochtend cortisol (om 8:00) |
Vanaf puberteit |
1x/jaar |
|
Vitamine D |
Vanaf 2 jaar |
1x/jaar |
|
Serum calcium, fosfaat |
Vanaf 10 jaar |
1x/jaar |
|
PTH |
Bij volwassenen |
1x/jaar |
|
Zink Koper, Selenium, Cerulopasmine, Vitamine A, C, E |
Bij TDT, chelatie |
1x/jaar |
|
Botdensitometrie (BMD lumbale wervelkolom en heup) |
Vanaf eind puberteit/voor transitie |
A 2 jaar
|
|
Op indicatie |
|
|
|
IGF1-1, IgF-BP3, X-hand, Verder conform consensus kleine lengte |
Indien groeivertraging |
|
|
Groeihormoonprovocatietest |
Bij groeivertraging (na behandelen van evt. hypothyreoïdie, deficiëntie voeding) |
|
|
Consult diëtiste |
Indien groeivertraging |
|
|
PTH |
Wanneer serum calcium verlaagd |
|
|
FSH, LH, oestradiol (V), testosteron (M), X-hand |
Indien vertraagde puberteit (nog niet gestart op leeftijd 13 jaar (V), 14 jaar (M)) |
|
* Een (secundaire) bijnierschors insufficiëntie dient uitgesloten te worden voor start suppletie van schildklierhormoon.
2.
3.
|
Bisfosfonaten |
Route toediening |
Dosis
|
|
Alenodroninezuur |
per os |
10 mg 1 dd of 70 mg 1x/week |
|
Pamidroninezuur |
parenteraal |
30 mg /maand |
|
Zoledroninezuur |
Parenteraal |
4 mg/ 3 maanden (TIF guideline) 5 mg/jaar (Farmacotherapeutisch Kompas) |
|
Neridroninezuur |
Parenteraal |
100 mg / 6 maanden |
Gebruik bisfosfonaten altijd in combinatie met Vit D en Calcium suppletie. Na een behandelingsduur van 12 maanden dient een BMD-meting verricht te worden, waarna de vervolgbehandeling wordt afgestemd. Zoledroninezuur en neridroninezuur zijn middelen van eerste keuze voor thalassemie geassocieerde osteoporose (Guisti A et al., 2016, Piga et al. 2017).
Intraveneuze toediening van zoledroninezuur schijnt effectiever te zijn dan orale bisfosfonaten.
De behandeling van osteoporose bij kinderen gebeurt altijd in overleg met een kinderendocrinoloog.
Onderbouwing
Inleiding
Verhoogde ijzerabsorptie door ineffectieve erytropoëse en chronische hemolytische anemie veroorzaken ijzerstapeling o.a. in de pancreas, hypofyse en bijschildklierklieren en kunnen leiden tot endocriene dysfunctie zoals diabetes mellitus, hypogonadisme, hypoparathyreoïdie en infertiliteit (zie hiervoor hoofdstuk zwangerschap en fertiliteit).
De behandeling met bloedtransfusies bij TDT leidt tot een onderdrukking van de ineffectieve erytropoëse, waardoor er verschil is in prevalentie van endocrinopathieën in TDT en NTDT. De prevalentie in NTDT is relatief lager, echter stijgt deze met toegenomen leeftijd.
Splenectomie, de mate van ineffectieve erytropoëse en een laag foetaal Hb gehalte worden geassocieerd met endocriene dysfuncties in NTDT. Het gebruik van Hydrea lijkt hierin een positieve rol te spelen. Bij diagnose van een hypofysaire hormoon deficiëntie is het belangrijk extra alert te zijn op mogelijke uitval van andere hypofyse-assen.
|
Conclusie |
SORT Grade |
|
1.Management van endocriene complicaties is complex. Bij afwijkende monitoring dient de (kinder-)endocrinoloog laagdrempelig te worden betrokken. |
C |
|
2.A. Start zo vroeg mogelijk met chronische transfusies en ijzerchelatie om beenmerghyperplasie en ijzertoxiciteit te voorkomen. Zie hiervoor de aanbevelingen hoofdstuk transfusie, ijzerstapeling en ontijzering. |
A |
|
2.B. Houd je aan het maximale doseeradvies van Deferoxamine bij kinderen (40 mg/kg/dag) |
B |
|
2.C. Let op een adequate inname van calcium (700-1000 mg per dag) |
B |
|
2.D. Streef Vitamine D spiegels van ~ 50 nmol/l na |
B |
|
2.E. Geef leefstijladviezen zoals voldoende lichamelijke activiteit, zonlicht exposure, vermijden van roken en vraag voor dieetadviezen laagdrempelig een diëtist in consult |
B |
|
2.F. Probeer diabetes mellitus vroegtijdig op te sporen |
B |
|
3.A. Overweeg bij volwassenen een behandeling met bisfosfonaten wanneer er sprake is van: a. een BMD Z-score < -2.0 (pre-menopauze, < 50 jr.), T-score < -2.5 (postmenopauze, > 50 jr.) of b. fragility fracturen en/of afname van de botdichtheid ondanks adequate Vitamine D-spiegel of c. bij het gebruik van hormoonbehandeling in het kader van hypogonadisme. |
B |
|
3.B. Gebruik bisfosfonaten altijd in combinatie met Vit D en Calcium suppletie. Na een behandelingsduur van 12 maanden dient een BMD meting verricht te worden, waarna de vervolgbehandeling wordt afgestemd. |
B |
|
3.C. Zoledroninezuur en neridroninezuur zijn middelen van eerste keuze voor thalassemie geassocieerde osteoporose (Guisti A et al., 2016, Piga 2017). Intraveneuze toediening van zoledroninezuur schijnt effectiever te zijn dan orale bisfosfonaten. Zie bvg tabel voor keuze en dosering bisfosfonaten. |
B |
|
3.D. Bij kinderen duiden vertebrale compressiefracturen ontstaan zonder hoogenergetisch trauma of lokale ziekte op osteoporose. In afwezigheid van vertebrale compressiefracturen wordt osteoporose bij kinderen gedefinieerd als:
N.B. Bij de interpretatie van de DXA-scan dient rekening gehouden te worden met eventuele kleine lengte en/of achterlopende skeletrijping (bv bij late puberteit). Een methode om de botdichtheid te corrigeren voor de kleine lengte is het berekenen van de Bone Mineral Apparent Density (Ward et al; Arch Dis Child. 2007 Jan;92(1):53-9. doi: 10.1136/adc.2006.097642). |
A,B |
|
3.E. De behandeling van osteoporose bij kinderen gebeurt altijd in overleg met een kinderendocrinoloog. |
C |
Samenvatting literatuur
Verhoogde ijzerabsorptie door ineffectieve erythropoiese en chronische hemolytische anemie veroorzaken ijzerstapeling o.a. in de pancreas, hypofyse en bijschildklierklieren, en kunnen leiden tot endocriene dysfunctie zoals diabetes mellitus, hypogonadisme, hypoparathyreoïdie en infertiliteit.
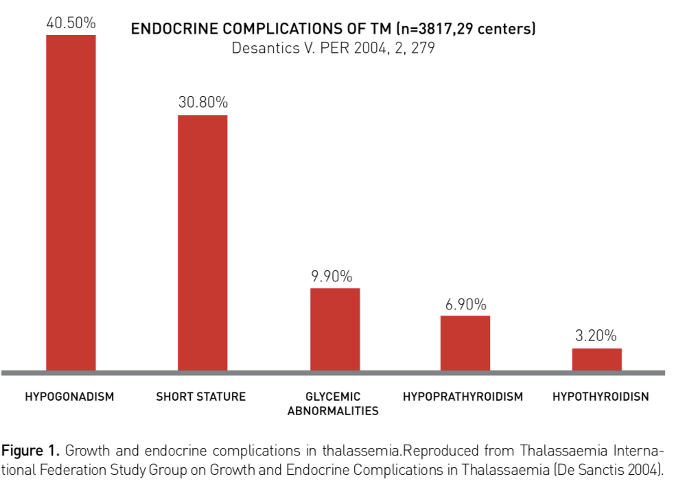
Late puberteit en hypogonadisme
Late puberteitsontwikkeling en hypogonadotroop hypogonadisme zijn de meest voorkomende klinische gevolgen van ijzerstapeling in de hypofyse. Gonadale ijzerstapeling komt veel minder vaak voor. Bij meisjes spreekt men van vertraagde puberteit bij ontbreken van borstontwikkeling op de leeftijd van 13 jaar, bij jongens als de testes op de leeftijd van 14 jaar nog < 4 ml zijn. Een stagnatie in de puberteitsontwikkeling is een relatief vaak voorkomende complicatie in patienten met TDT met matige tot ernstige ijzerstapeling. Hierbij is er gedurende een jaar geen progressie van puberteitsstadia en een afname van de groeisnelheid. Bij meisjes kan hypogonadotroop hypogonadisme zich verder uiten als primaire of secundaire amenorroe. Prevalentie van hypogonadisme in adolescenten en volwassenen met thalassemie major is 38% bij vrouwen en 43% bij mannen (guideline TDT, Cappelini et al.). Geadviseerde routineonderzoeken zijn een X-hand en BMD-meting, bepaling van LH, FSH en testosteron. Patiënten met thalassemie hebben doorgaans hypogonadotroop hypogonadisme gekenmerkt door lage gonadotrofinen en oestradiol/testosteron.
Behandeling (door kinderarts-endocrinoloog): Doel is het bewerkstelligen van ontwikkeling van puberteitskenmerken, optimaliseren van de lengtegroei en voorkomen van complicaties van hypogonadisme zoals osteoporose.
Bij late puberteit kan in eerste instantie gekozen worden voor een kortdurende behandeling van ongeveer 6 maanden en hierna de behandeling te evalueren via bloedcontrole van de hypothalamus-hypofyse-gonadale as.
Meisjes: Oestrogeenbehandeling per os of transdermaal. Afhankelijk van de leeftijd, lengtegroei en het spontaan bereikte puberteitsstadium zal de startdosis worden bepaald en een schema voor ophogen tot een volwassen onderhoudsdosis. Twee jaar na start puberteitsinductie wordt een progestageen toegevoegd.
Jongens: Testosteronbehandeling intramusculair of transdermaal. Afhankelijk van de leeftijd, lengtegroei en het spontaan bereikte puberteitsstadium zal de startdosis worden bepaald en een schema voor ophogen tot een volwassen onderhoudsdosis.
Hypothyroidie
Hypothyroidie als complicatie bij TDT is voornamelijk geassocieerd met ijzerstapeling en is ongebruikelijk in patienten met een optimaal chelatieregime. De frequentie van hypothyroïdie varieert van 4 – 29% en lijkt gerelateerd aan genotype, leeftijd, ethnische variatie en verschil in behandeling (transfusie frequentie en ontijzeringstherapie) (de Sanctis et al., 2019). Zowel primaire hypothyreoidie als centrale hypothyreoidie komen voor. Monitoring van schildklierfunctie (vrij T4 en TSH) wordt jaarlijks geadviseerd vanaf een leeftijd van 5 jaar bij TDT en 10 jaar bij NTDT. Zonodig zullen thyroid auto-antistoffen worden bepaald in combinatie met een echografie van de schildklier.
Gradatie van schildklier-dysfuncties:
Subklinische hypothyroidie is een combinatie van een hoog TSH met een normaal vrij T4. De combinatie van een hoog TSH met een laag vrij T4 kenmerkt klinische primaire hypothyroidie. De klassieke klinische presentatie van hypothyroidie in thalassemia major is lastig te herkennen omdat symptomen niet specifiek zijn en gerelateerd kunnen worden aan de anemie. Ernstige hypothyroïdie in TM kan zich uiten met een ernstige groeiachterstand met vertraagde puberteit, vertraagde botrijping, cardiaal falen en pericardeffusie (de Sanctis 2013). Centrale hypothyreoïdie wordt gekenmerkt door een verlaagd FT4 met een laag of inadequaat normaal (soms mild verhoogd) TSH.
De behandeling is afhankelijk van de ernst van de hypothyroidie. Een goede compliance van de ontijzeringstherapie kan hypothyroidie voorkomen danwel verbeteren in geval van milde subklinische hypothyroïdie (TSH 5 -10 mU/L). In het geval van manifeste hypothyreoïdie is de behandeling met L-thyroxine. Aandacht behoeft de patient met subklinische vorm van hypothyroidie en cardiomyopathie: behandeling met amiodaron (antiaritmica klasse III) kan leiden tot snelle verergering van de hypothyroidie, wat weer leidt tot achteruitgang van de cardiale functie (de Sanctis et al., 2019, Alexandrides 2000).
Afwijkende OGTT en diabetes mellitus (DM)
Een afwijkende OGTT en diabetes mellitus zijn een veel voorkomende complicatie in TM patienten zonder optimale ontijzeringsbehandeling. Echter kan diabetes ook voorkomen bij patienten met een regelmatig transfusie regime en goede adherence van chelatietherapie. Er spelen dus ook andere bijkomende factoren een rol zoals de individuele sensitiviteit tot ijzerstapeling, chronische anemie, zink deficientie en een verhoogde collageendepositie secundair aan de verhoogde activiteit van het enzym protocollageen proline hydroxylase, dat ijzer afhankelijk is en leidt tot een verstoorde microcirculatie in de pancreas.
DM bij TM is zeldzaam gedurende de eerste tien levensjaren. Vanaf de leeftijd van 10 jaar kan een afwijkende OGTT voorkomen. De combinatie van puberteit en thalassemie geassocieerde risicofactoren geven een gedeeltelijke verklaring voor de toename van insuline resistentie in adolescenten met thalassemie.
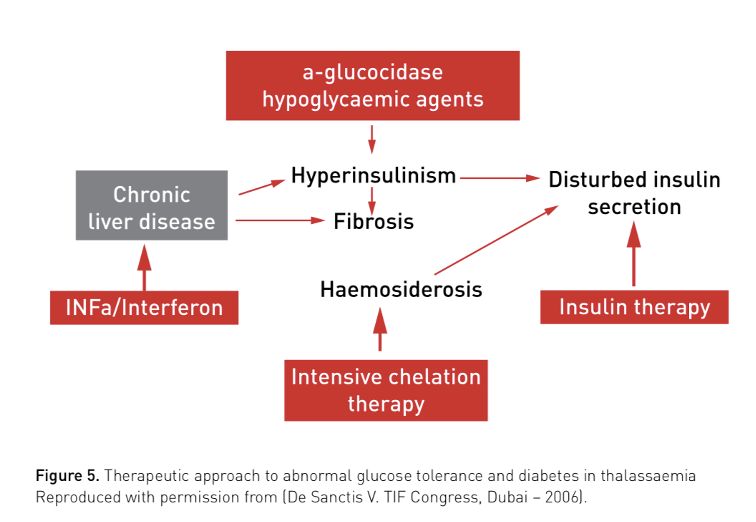
De etiologie van DM is multifactorieel (genetische factoren, insuline deficiëntie, insulineresistentie en leverdysfunctie secundair aan virale hepatitis). Ijzerstapeling door chronische transfusies geeft schade aan de pancreatische b-cellen met verminderde insulinesecretie als gevolg, zie fig. 3., TIF-guideline.
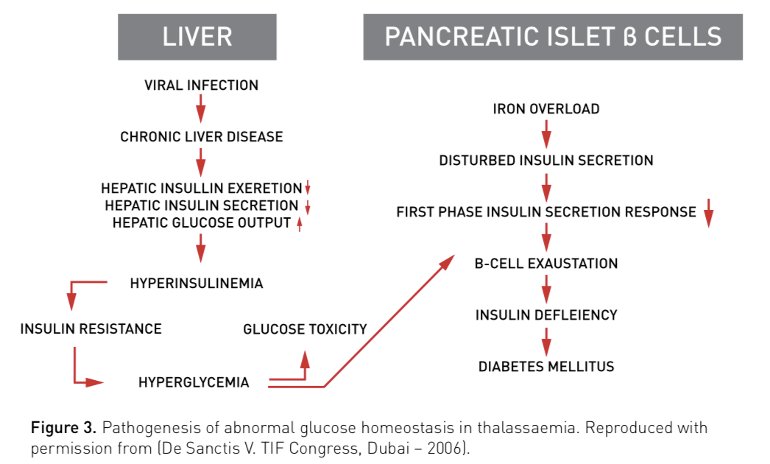
Wanneer nuchter serum glucose > 6.1 mmol/L bij jaarlijkse screening is ook een OGTT geïndiceerd. Screening door middel van een 2 h OGTT wordt geadviseerd vanaf puberteit (a 2 jaar).
Diagnostische criteria voor OGTT:
Ijzerdepositie in het pancreas is de sterkste predictor voor b-cel-toxiciteit. Pancreas T2* meting is, naast het bepalen van nuchter glucose, een mogelijke toegevoegde screeningsmethode. Verhoogde ijzerdepositie in het pancreas is een voorspeller voor een afwijkende OGTT en kan identificatie van mogelijke hoog risicopatiënten bevorderen voor dat irreversibele pancreatische schade ontstaat (Noetzli 2009, Pepe et al., 2020). Echter blijft de OGTT de gouden standaard voor evaluatie van de glucose homeostase. Screening op mogelijke hepatitis en een goede adherence chelatietherapie zijn belangrijke preventieve maatregelen.
In patienten met thalassemie en diabetes is de prevalentie van diabetische nefropathie 13-55% (Tzoulis et al. 2014, Loebstein et al. 1998) en 13-26% heeft diabetische retinopathie (Tzoulis et al., 2014, Incorvaia et al. 1998). Macrovasculaire complicaties zijn zeldzaam echter is het risico op cardiale complicaties, hartfalen, hyperkinetische arryhtmie en myocardiale fibrose bij patienten met thalassemie en diabetes significant verhoogd (Pepe et al. 2013).
Management van een afwijkende OGTT en DM zijn:
Monitoring van DM in thalassemie patiënten is niet anders dan bij de reguliere diabetes patiënt: Het HbA1c is echter niet betrouwbaar vanwege de verkorte levensduur van de erythrocyt, de ineffectieve erythropoiesis en de afhankelijkheid van chronische transfusies (de Sanctis 2013).
Hypoparathyreoïdie (HPT)
HPT is een typische complicatie in de 2e levensdecade van TDT patiënten en wordt toegeschreven aan ijzerstapeling in de bijschildklieren. De incidentie varieert van 1.2% tot 19% en verschilt per behandelcentrum. HPT lijkt vaker voor te komen bij mannen (man/vrouw ratio = 1.35) (TIF-guideline, TDT). De meerderheid van de patiënten laat een milde vorm van HPT zien met milde hypocalciemie en daardoor paresthesie. Ernstige symptomen zijn tetanie, convulsies of cardiaal falen (Skordis 2013).
Vanaf de leeftijd van 10 jaar (TDT-guideline adviseert 16 jaar?) wordt jaarlijks bepaling van serum calcium en serum fosfaat aanbevolen. Beoordeling in combinatie met Vitamine D-status en zonodig PTH.
Behandeling gebeurt in overleg met een kinderendocrinoloog en bestaat uit orale toediening van calcium en actief vitamine D om serum calcium spiegels te normaliseren. Soms zijn hiervoor hoge doses nodig, cave hypercalciemie bij overbehandeling (met risico op ontwikkeling van nefrolithiasis, nefrocalcinose). Calcitriol 0.25-1.0 ug 2 dd is meestal voldoende om calcium en fosfaat spiegels te normaliseren. Een calcium rijk en fosfaat arm dieet kan worden geadviseerd.
Bijnierinsufficiëntie
Prevalentie van biochemische centrale bijnierinsufficientie onder thalassemie patienten varieert van 0-45% (El Kholy 2013). Symptomen kunnen soms moeilijk worden herkend doordat spierzwakte, artralgie, gewichtsverlies regelmatig bij thalassemie patiënten voorkomen.
Het bepalen van ochtendcortisolspiegel (nuchter tussen 8-9 uur) wordt een a twee jaarlijks geadviseerd in patienten met een groeihormoondeficientie. Zonodig moet een ACTH test worden verricht.
Osteoporose (ook wel TBD ‘thalassemia bone disease’)
Osteoporose is een veel voorkomende oorzaak van morbiditeit in patienten met TDT danwel NTDT en komt voor in 40-50% van adequaat behandelde TDT-patiënten.
Gezien de ernstige toxiciteit van ijzerstapeling heeft een adequate ijzerchelatie hoogste prioriteit in de behandeling en preventie van osteoporose.
De pathogenese van osteoporose in thalassemie is complex en multifactorieel. Naast de ontwikkeling van botdistorsie door ineffectieve erythropoëse en progressieve beenmergexpansie zijn er een aantal genetische en verworven factoren, welke leiden tot een dysbalans in bot remodeling door inhibitie van osteoblasten activiteit en een toegenomen osteoclasten activiteit met als gevolg botdestructie. Veel patienten met thalassemie laten een verlaagde botmineraaldichtheid (BMD) zien, welke kan worden gemeten door middel van een DEXA-scan. Een evt verlate puberteit en hypogonadisme spelen hierin een oorzakelijke rol. Ook wordt een verhoogd fractuurrisico beschreven, waarbij de relatie tussen een lage BMD en het risico op fracturen niet geheel duidelijk is. Een verlaagde botdichtheid kan ook bij kinderen met thalassemie (< 10 jaar) worden gezien. Er is echter geen evidence voor behandeling van een lage BMD bij kinderen in de afwezigheid van klinisch significante fracturen, derhalve weinig onderbouwing om een BMD-meting te verrichten voor beëindiging van de puberteit. Bij kinderen bestaat management voornamelijk uit life style interventies zoals adequate calcium intake (suppletie van 700 – 1000mg/dag vanaf leeftijd 11 jaar), adequate Vit D-spiegels en voldoende lichamelijke activiteit.
Zonder Vitamine D-suppletie is vitamine D deficiëntie in thalassemie patiënten zeer gebruikelijk. Vitamine D is essentieel voor calcium homeostase en mineralisatie van het skelet. Vit D-spiegels laten een directe correlatie zien met de botdichtheid. Er wordt gestreefd naar Vit D-spiegels van – 50 nmol/l.
Risicofactoren voor thalassemia bone disease zijn oudere leeftijd, groeiretardatie, rugpijn, tekenen van zenuwcompressie, ernstige osteoporose, botbreuken. Een afname in lengte kan een aanwijzing zijn voor vertebrale fracturen.
Bij kinderen kan groeivertraging optreden door langdurig hoge doses deferoxamine (> 40 mg/kg/dag). Gezien het toenemend gebruik van deferasirox wordt dit nog maar zelden gezien.
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Is er plaats voor preventie van trombose bij patiënten met thalassemie?
Aanbevelingen
|
Conclusie |
Score |
|
Er is geen plaats voor primaire preventie van trombose bij thalassemie |
C3 |
|
Bij patiënten met NTDT, status na splenectomie en een niet uitgelokte trombose is het advies antistolling van onbeperkte duur te geven |
C3
|
Onderbouwing
Er is sprake van een verhoogde incidentie van veneuze en arteriële trombose bij zowel TDT als NTDT (Taher Blood 2018). Taher et al. (T en H 2006) toont een prevalentie aan van 1,65% onder alle thalassemie patiënten (TDT en NTDT, met en zonder splenectomie). Met name bij patiënten post-splenectomie is er een sterk verhoogd risico op trombose. De waarde van preventie met acetylsalicylzuur wordt beschreven in hoofdstuk splenectomie. Ook komt trombose in NTDT 4x vaker voor dan in TDT (3,9% versus 0.9%), wat waarschijnlijk verklaard wordt door onderdrukte hemolyse in transfusieafhankelijke patiënten. Circa 5-9% van de patiënten met NTDT krijgt een symptomatisch CVA (Taher T en H 2006).
In een cohort studie van 83 patiënten met NTDT en splenectomie was in 29% sprake van een trombose in 10 jaar tijd (Cappellini BJH 2000). Er zijn sporadische rapporten van verlaagde proteine C en antitrombine deficiëntie in kinderen met thalassemie ( (Abd El Mabood SA 2018). Risicofactoren voor het optreden van trombose bij thalassemie zijn: status na splenectomie, leeftijd > 35 jaar, Hb < 5,5 mmol/L, trombocyten >500×109/L. Ondanks een verhoogde kans op trombose na splenectomie bij deze patiëntengroep, gemiddeld na 8 jaar, zijn er geen klinische interventie studies gepubliceerd om primaire preventie van trombose voor deze patiëntengroep te adviseren (Taher, JTH 2010)
Er zijn geen data bekend over recidief trombose bij thalassemie patiënten. Ten aanzien van secundaire preventie van veneuze trombose bij NTDT zijn geen studies bekend. Derhalve wordt aanbevolen de Nederlandse NIV richtlijn antitrombotisch beleid te volgen ten aanzien van secundaire preventie bij erfelijke trombofilie. Kort gezegd betekent dit dat bij een niet uitgelokte veneuze trombose antistolling wordt geadviseerd van onbeperkte duur met een jaarlijkse afweging van bloeding-versus tromboserisico. Indien sprake is van een uitgelokte trombose dient de bovengenoemde richtlijn geraadpleegd te worden.
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
Algoritme voor de diagnostiek naar pulmonale hypertensie
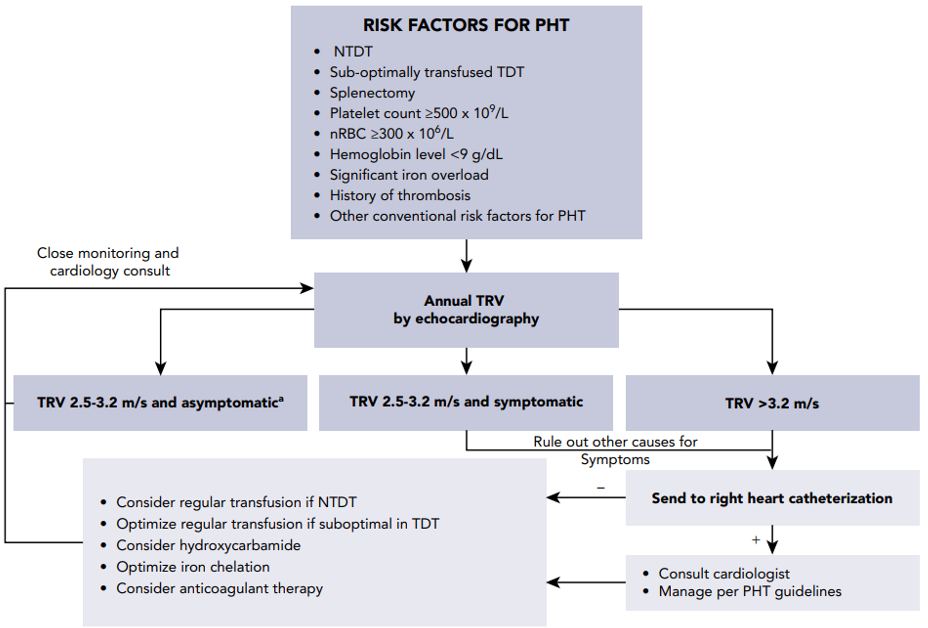
Figure 1. Beleid t.a.v. diagnose, preventie, and behandeling van PH in volwassenen met β-thalassemia. NB: Patienten met TRV < 2.5 m/s wordt echo cor na 3-5 jaar geadviseerd. nRBC, nucleated red blood cell count; PHT, pulmonary hypertension.
|
Conclusie |
score |
|
1x/3 jaar echocardiografie met TRV bepaling (vanaf 15 jaar oud, o.i eerder) |
B3 |
|
TRV 2,5 – 3,2 m/s, alleen katheterisatie bij klachten en anders echo jaarlijks herhalen |
B3 |
|
TRV ≥ 3,2 m/sec, optimalisatie transfusiebeleid en consulteer een longarts of cardioloog met PH expertise voor rechter hartkatheterisatie en overweeg behandeling |
C3 |
Onderbouwing
PH wordt gedefinieerd als een toename van de gemiddelde PAP druk > 25 mmHg gemeten met rechter hartkatheterisatie. PH bij thalassemie komt zeker voor met name bij NTDT (Vlados 2012 en Morris 2010). Studies die middels echocardiografie PH beoordelen, tonen bij 40-50% patiënten met NTDT en 10-75% bij TDT afwijkingen mogelijk passend bij PH aan (Fraidenburg ANN NYA SC 2016). . In deze studies werd ook aangetoond dat 33% van de patiënten met thalassemie een TRV 2,5-3,2 m/s heeft en 5% een TRV > 3m/s. Rechter hartcatheterisatie bevestigde bij 94% van de patiënten met een TRV > 3,2 m/s een PH, terwijl dit percentage onbekend is bij TRV tussen 2,5 en 3,2% (Derchi Circulation 2014).
Bekende voorspellende factoren voor PH bij NTDT en TDT zijn leeftijd, status na splenectomie, ernstige hemolyse, hepatitis C, verhoogde tromboseneiging of eerdere trombose en de mate van ijzerstapeling (Fraidenburg, Ann 2016). In de enige publicatie waarin rechter hartcatheterisatie de aanwezige PH bevestigde, werd geen associatie gevonden tussen de ferritine waarde en PH (derchi). In totaal betrof het hier 27 β-thalassemie patiënten.
Ook kan PH het gevolg zijn van arteriële hypertensie, veneuze hypertensie of PH van chronische longziekte of chronische trombo-embolische ziekte.
Er bestaan geen prospectieve placebo gecontroleerde trials voor de behandeling van PH bij thalassemie. Een positief effect werd gesuggereerd in NTDT van hydroxycarbamide, evt. in combinatie met L-carnitine (Fraidenburg, Amoozgar EJH 2011, Karimi EJH 2009 en EJH 2010), maar gerandomiseerde studies ontbreken. Beperkte case reports en case series zijn gemeld met sildenafil (Littera, Derchi, Correale, Morris) en prostacycline agonisten en endotheline antagonist (Anthi, Tam, Ussavarungsi en Burger).
Het valt te overwegen het transfusiebeleid aan te scherpen voor patiënten met een TRV > 2,5 m/s en symptomen passend bij PH en derhalve te streven naar volledige onderdrukking van de ineffectieve erytropoëse (Taher Blood 2010).
De waarde van NT-proBNP bij de diagnostiek van pulmonale hypertensie is niet bekend. Er is wel aangetoond dat een verhoog NT-proBNP een relatie heeft met diastolische dysfunctie (2010 D.T. Kremastinos, Cong Heartfailure, D.T Kremastinos, 2010, Am Heart J).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Welke behandeladviezen worden gegeven in het geval van een (persisterende) ulcus cruris?
Aanbevelingen
Onderbouwing
Inleiding
Ulcus cruris is een bekende complicatie van patiënten met een NTDT, en komt minder frequent voor bij TDT patiënten (Taher, Isma’eel et al. 2006, Taher, Musallam et al. 2010, Rivella 2012, Musallam, Rivella et al. 2013). Ulcus cruris zijn vaak erg pijnlijk en kunnen hardnekkig zijn zonder adequate benadering en behandeling.
|
Conclusie |
SORT Grade |
|
De huid van NTDT patiënten dient tijdens een controle polibezoek altijd gecontroleerd te worden op de aanwezigheid van ulceraties. (Taher, Musallam et al. 2010, Musallam, Rivella et al. 2013) |
C |
|
Patiënten met een ulcus cruris dienen verwezen te worden naar een dermatoloog of een plastisch chirurg.(Musallam, Rivella et al. 2013) |
C |
|
De beste behandeloptie om een (persisterende) ulcus cruris te behandelen zijn directe lokale wondverzorging en bloedtransfusies. (Taher, Musallam et al. 2010, Karimi, Cohan et al. 2014) |
B |
|
Andere behandelopties voor persisterende ulcus cruris zijn (geen klinische trials beschikbaar): * hydroxycarbamide (Gamberini, Fortini et al. 2004, Matta, Abbas et al. 2014) * hyperbare zuurstof (Karimi, Cohan et al. 2008) * huidtransplantatie (Karimi, Cohan et al. 2008) |
B |
Samenvatting literatuur
Ulcus cruris is een hardnekkige complicatie van met name NTDT patiënten waarbij de incidentie toeneemt bij gevorderde leeftijd (Wu, Shih et al. 1992, Taher, Musallam et al. 2010, Musallam, Rivella et al. 2013). Huidulceraties ontstaan als de oxygenatie van de huid vermindert waardoor het subcutane weefsel erg kwetsbaar wordt en deze barrière eenvoudig kapot kan gaan bij minimaal trauma. Risicofactoren voor het ontwikkelend van ulcus cruris zijn ernstige anemie met ineffectieve erytropoëse, status na splenectomie en hypercoagulabiliteit (Haidar, Mhaidli et al. 2010, Musallam, Taher et al. 2011, Musallam, Sankaran et al. 2012). Andere bijkomende factoren die een ulcus kunnen induceren zijn veneuze stase met een verhoogd druk op de erytrocytenmembraan waardoor plaatselijk erytrocyten kapot gaan en door een slechtere circulatie (ophoping afvalstoffen) kan er een defect van de huid optreden en minder snel genezen, rechtszijdig hartfalen en huidinfecties. IJzerstapeling is ook gemeld als belangrijke factor bij het optreden van een ulcus cruris, vooral bij lokale stapeling van ijzer (Ackerman 2011). De belangrijkste behandelopties naast een goede wondverzorging met specialistische kennis van een dermatoloog of plastische chirurg (Musallam, Rivella et al. 2013), zijn het geven van bloedtransfusies (Taher, Musallam et al. 2010, Karimi, Cohan et al. 2014). Het effect van hydroxycarbamide bestaat uit het ophogen van het foetale hemoglobine en hiermee vaak het verbeteren van de anemie maar ook de verbeterde deformabiliteit van de erytrocyten en het verminderen van de mate van hypercoagulabiliteit (Musallam, Taher et al. 2013). Het gebruik van hyperbare zuurstof heeft in enkele studies een positief effect laten zien in gevallen waarbij weefsel hypoxie de oorzakelijke factor was in het proces van ulcusvorming (Gimmon, Wexler et al. 1982). Huidtransplantatie is ingezet in de behandeling van persisterende ulcus cruris (Gimmon, Wexler et al. 1982).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
Onderbouwing
Inleiding
Patiënten met thalassemie major ontwikkelen vaak in de loop van hun leven een hypogonadale hypogonadisme op basis van ijzerstapeling door bloedtransfusies in de hypofyse (Skordis, Petrikkos et al. 2004). Ondanks dat de puberteit vaak wat later optreedt bij transfusie onafhankelijke thalassemie patiënten, komt onvruchtbaarheid door ijzerstapeling zelden voor (Origa, Piga et al. 2010). Een goede begeleiding vanaf het moment van de zwangerschapswens tot het volbrengen van de partus voorkomt complicaties bij de moeder en de baby.
|
Conclusie |
SORT Grade |
|
1a. Gezien het hoge risico op orgaancomplicaties die gepaard gaan met de diagnose transfusie (on)afhankelijke thalassemie wordt het aangeraden om uitgebreide counseling aan te bieden aan koppels die een kinderwens hebben en waarbij een kans bestaat op een ernstig aangedaan kindje (Taher, Vichinsky et al. 2013, 2014) |
C |
|
1b. Tijdens de counseling dient besproken te worden welke medicatie gedurende zwangerschap gestopt moet worden en welke gezondheidsrisico’s kunnen optreden tijdens de zwangerschap voor de zwangere vrouw met thalassemie (Taher, Vichinsky et al. 2013, 2014) |
C |
|
2a. Behandeling van fertiliteitsproblemen dient plaats te vinden in een centrum waar thalassemie patiënten worden behandeld door een ervaren hematoloog, in samenwerking met een internist-endocrinoloog en fertiliteitsartsen (Society 2016). Voor het behoud van fertiliteit dient een endocriene evaluatie plaats te vinden (Taher, Musallam et al. 2009, Belhoul, Bakir et al. 2012). |
C |
|
2b. De grootste gezondheidsrisico’s voor een zwangere vrouw met thalassemie worden bepaald door complicaties die kunnen optreden als gevolg van ijzerstapeling, cardiomyopathie, gestoorde botdensiteit, leverfunctiestoornissen, transmissie van virussen en allo-immunisatie (Taher, Vichinsky et al. 2013, 2014) |
B |
|
3a. De gezondheid van een pasgeboren baby van een moeder met thalassemie wordt het best gegarandeerd als een zwangere vrouw behandeld wordt in een multidisciplinaire setting (Aessopos, Karabatsos et al. 1999, Tuck 2005, Ansari, Azarkeivan et al. 2006) |
B |
|
3b. Tijdens de zwangerschap dient op regelmatige basis in alle trimesters de cardiale functie, de schildklier en de leverfunctie gecontroleerd te worden. De gynaecoloog controleert middels herhaalde echografie de groeivordering van het ongeboren kindje (Society 2016) |
C |
Samenvatting literatuur
Patiënten met een transfusie afhankelijke thalassemie die van jong af aan chronische bloedtransfusies krijgen met optimale controle van hun ijzerstatus, hebben de grootste kans hun fertiliteit te behouden en zwanger te worden. Het merendeel van de TDT patiënten zal echter in enigermate te maken krijgen van ijzerstapeling van de hypofyse met subfertiliteit tot gevolg (Skordis, Petrikkos et al. 2004). NTDT patiënten hebben vaak een later intredende puberteit, maar meestal een gepreserveerde vruchtbaarheid (Nassar, Usta et al. 2006, Nassar, Naja et al. 2008, Origa, Piga et al. 2010, Roumi, Moukhadder et al. 2017). Voordat een zwangerschap van een koppel die een risico hebben op een aangedaan kind met een TDT of NTDT tot stand komt, verdient het de voorkeur om een uitgebreide counseling te bieden. In deze counseling moet het zwaartepunt liggen op een drietal onderwerpen:
* de huidige gezondheid van vrouw met TDT of NTDT
* medicatie die niet meer gebruikt mag worden tijdens de zwangerschap. In het algemeen zijn dit de ijzerchelatoren, bisfofonaten, specifieke medicatie die gebruikt wordt in de behandeling van hepatitis C (interferon en ribavirine) en hydroxycarbamide (2014).
* de gezondheidsrisico’s die kunnen optreden voor de zwangere vrouw
Indien een koppel te maken krijgt met problemen rondom de fertiliteit, is het van belang dat het koppel voor aanvullende onderzoek (voor beide partners) worden doorverwezen naar een fertiliteitsarts binnen het hemoglobinopathie kenniscentrum (Society 2016). Voor de zwangerschap dient het aanbevolen te worden een goede inschatting te maken van de conditie van de vrouw (Society 2016). Aandachtspunten hierbij zijn: a. evaluatie van de hartfunctie waarbij een inschatting gemaakt wordt van de pompfunctie middels echocardiografie, b. glucose huishouding en schildklierfunctie, c. botdensiteitstatus gemeten met een Dexascan en een d. overzicht van de bloedgroepantigenen en mogelijk allo-antigenen.
Medicatie die tijdens een zwangerschap worden aangeraden zijn foliumzuur, calcium en vitamine D. De zwangere vrouw dient het beste in een multidisciplinair team gecontroleerd te worden tijdens haar zwangerschap waarbij er nauwe betrokkenheid is van de hematoloog, kinderhematoloog, gynaecoloog en verloskundige (Aessopos, Karabatsos et al. 1999, Tuck 2005, Ansari, Azarkeivan et al. 2006). Tijdens de zwangerschap dient de hematoloog in elk trimetser op de hoogte te zijn van mogelijke veranderingen in de functie van het hart middels het laagdrempelig vervaardigen van een echocardiografie, de lever functie en de schildklier (Leung and Lao 2012). Indien de pompfunctie verslechterd in het tweede of derde trimester door ijzerstapeling, kan overwogen worden om deferoxamine te starten. In onderzoek is een goed herstel van de pompfunctie bewezen met een succesvolle zwangerschap (Singer and Vichinsky 1999, Tsironi, Ladis et al. 2005, Bajoria and Chatterjee 2009).
In het kraambed kan gebruik van profylactische dosis LMWH worden aangeraden aan vrouwen met een verhoogd risico op een trombose. Bij deze overweging dienen de volgende punten meegewogen te worden; al dan niet hebben ondergaan van een splenectomie in de voorgeschiedenis, hoogte van de trombocyten in het kraambed, ondergaan van een chronisch transfusieschema, eerdere trombotische complicaties (Nassar, Usta et al. 2006).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
|
Conclusie |
Score |
|
toename transfusiebehoefte en inadequate ontijzeringsmogelijkheid |
B3
|
|
hypersplenisme met ernstige cytopenieen |
B3 |
|
symptomatische splenomegalie |
B3 |
|
Peri-operatieve trombose profylaxe tot volledige mobilisatie maar minimaal 4 weken postoperatief |
C3 |
Onderbouwing
Ernstige hemolyse bij TDT en NTDT leidt tot progressieve splenomegalie, die de anemie kan verergeren en daardoor de transfusiebehoefte doet toenemen. Door vanaf jonge leeftijd een strikt transfusiebeleid te voeren kan splenomegalie worden voorkomen.
Splenectomie is alleen geïndiceerd als sprake is van toename van transfusiebehoefte in combinatie met inadequate ontijzering (Cohen 1989, Graziano 1981, Casale 2013). Ook een ernstige splenomegalie met klachten of hypersplenisme met diepe cytopenieen rechtvaardigt een splenectomie. Voor deze indicaties is weinig onderbouwing in de literatuur. Een Cochrane review uit 2019 (Sharma 2019) was niet conclusief door onvoldoende studies.
De belangrijkste complicaties na splenectomie zijn sepsis, trombose en pulmonale hypertensie.
(Cappellini BJH 2000/2005, Borgna-Pignatti 1998, Taher Blood 2010, Taher T en H 2006 ). Het vaccinatie beleid en antibiotische profylaxe rondom splenectomie zijn te vinden in de LCI richtlijn asplenie).
Het risico op trombose na splenectomie komt naar voren in een multivariate analyse van trombotische complicaties bij thalassemie (Taher). Er zijn geen prospectieve data over de incidentie van trombose na splenectomie. In een retrospectieve analyse bleek de incidentie van trombotische complicaties 29% in patiënten met NTDT en status na splenectomie. Hierbij werden echter oppervlakkig tromboflebitis, ulcera en priapisme meegerekend. Wanneer we het beperken tot DVT en longembolieën was de prevalentie 7%. Post-operatieve trombose profylaxe wordt geadviseerd tot volledige mobilisatie, maar minimaal tot 4 weken postoperatief. Dit is gebaseerd op het verhoogde voorkomen (12%) van vena porta/lienalis trombose bij patiënten met een erfelijke hemolytische anemie (Lolascone et.al Haematologica, 2017). Prospectieve studies ontbreken.
Ondanks dat splenectomie frequent genoemd wordt als risicofactor voor het ontwikkelen van pulmonale hypertensie, zijn er geen retro- of prospectieve studies die deze relatie ondersteunen (Phrommintikul Heart 2006).
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
|
Conclusies |
Score |
|
Overweeg bij NTDT patiënten met symptomatische anemie te starten met hydrea 10 mg/kg en eventueel geleidelijk op te hogen tot max 20 mg/kg, waarbij in de meeste gevallen binnen 3 – 6 maanden respons verwacht mag worden. |
B
|
|
Hydrea kan ook overwogen worden bij patiënten met extramedullaire pseudotumoren, pulmonale hypertensie en chronische been ulcera. |
C |
|
Voor TDT patienten ontbreekt het aan bewijs om tot een aanbeveling wat betreft hydrea te komen |
|
Onderbouwing
Beide vragen zijn recentelijk belicht in een Cochrane meta-analyse (Ansari SH et al. 2019; Foong WC et al. 2016). Ten aanzien van TDT ontbreekt het aan studies om tot een concrete aanbeveling te komen (Ansari SH et al. 2019). Ten aanzien van de NTDT werd er wel één kleine RCT gevonden, welke 2 doseringen hydroxyurea (10 en 20 mg/kg) vergeleek bij patiënten met een HbE-β thalassemie (n = 61) (Foong WC et al. 2016; Bohara VV et al. 2014) 10 mg/kg hydrea deed het Hb stijgen bij meer dan 50% van de patiënten, hetgeen niet gebeurde bij de hogere dosering, welke wel geassocieerd was met meer myelosuppressie (Bohara VV et al. 2014). Zowel de NTDT als ook de TDT richtlijn aangaande hydrea berusten voor een groot deel op een review artikel van Musallam et al en een groot retrospectief geanalyseerd cohort van NTDT patiënten (Musallam KM et al. 2013; Taher AT et al. 2010). De proportie patiënten waarbij het Hb stijgt met 0.62 mmol/L is 40 – 70%, waarbij respons meestal al zichtbaar wordt na 3- 6 maanden, waarbij de meeste onderzoekers hydrea gebruikten in een dosering van 10 mg/kg. Er zijn langdurige responsen beschreven. Er zijn echter ook patiënten die na 12 maanden respons verlies hadden. Patiënten met Hb Lepore of δβ-thalassemie, evenals de aanwezigheid van het Xmn-1 polymorfisme lijken een betere respons te hebben (Musallam KM et al. 2013). Naast een effect op anemie en HbF lijkt het gebruik van hydrea geassocieerd met een kleinere kans op het ontstaan van extramedullaire pseudotumoren, pulmonale hypertensie, been ulcera, hypothyreoïdie en osteoporose (Taher AT et al. 2010). De belangrijkste toxiciteit van hydrea is dosis afhankelijke myelosuppressie, welke gerapporteerd wordt bij 2 – 30% van de patiënten.
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Aanbevelingen
|
Conclusie |
SORT Grade |
|
Elke transfusie afhankelijke α of β thalassemie (TBT) patiënt heeft een indicatie voor allogene stamceltransplantatie op de kinderleeftijd (Songdej et al. 2017, Angelucci et al. Haematologica 2014) |
C |
|
Bij patiënt met Hb Barts zal transplantatie bij voorkeur binnen 6-12 maanden post partum plaatsvinden in verband met de vaak zeer hoog frequente transfusiebehoefte. Bij patiënten met β thalassemia major is de voorkeursleeftijd voor transplantatie na het 1e levensjaar, bij voorkeur voor het 2elevensjaar en in ieder geval voor het 7elevensjaar. Voor patiënten met β thalassemia intermedia die pas op latere leeftijd transfusieafhankelijk worden, wordt bij voorkeur kort na start transfusieafhankelijkheid getransplanteerd voor zover jonger dan 18 jaar (Angelucci et al. 2014, Chunfu Li et al. 2019)
|
C |
|
Bij voorkeur wordt getransplanteerd met een HLA identieke donor (Angelucci et al. Haematologica 2014, Oostenbrink et al. 2020, Shaw et al. 2021) |
C |
Onderbouwing
Door de ineffectieve hemoglobine-synthese bij patiënten met β thalassemieën is er sprake van een verkorte overleving van erytrocyten door hemolyse en premature afbraak van erytocytaire voorlopers in het beenmerg (Weatherall 2001). De hierdoor ontstane chronische anemie kan onder andere beenmergexpansie, hepatosplenomegalie, groeiretardatie of hartfalen ten gevolg hebben (Capellini et al.2014, Taher et al. 2017, Taher et al. 2021).
Tot op heden is allogene stamceltransplantatie de enige curatieve therapie voor transfusieafhankelijke α en/of βthalassemie. Omdat transfusieafhankelijke α thalassemie en Hb Bart’s in het bijzonder uitzonderlijk zijn, zullen zij in het kader van deze aanbeveling niet nader worden besproken. Van belang is bij een aangedane foetus met Hb Bart’s indien gekozen wordt voor behoud van de zwangerschap, zo vroeg mogelijk te starten met intra uteriene transfusies (LUMC). Post partum dient een agressief transfusiebeleid gevoerd te worden en zodra klinisch mogelijk een allogene stamceltransplantatie te worden uitgevoerd (WAKZ-LUMC).(Songdej et al. 2017, King and Higgs et al.2018, Chmait et al. 2015, Zhang et al. 2021)
Allogene stamceltransplantatie wordt sinds 1990 uitgevoerd voor TDT. Aanvankelijk alleen met HLA identieke donoren, maar al snel ook met onverwante donoren. OS en EFS bleek afhankelijk van de mate van ijzerstapeling en daarmee gepaard gaande orgaanschade (leverfibrose). (Lucarelli et al. 1990). Met verbetering van transplantatietechnieken en vooral verbetering van de preventie en beheersing van Graft Versus Host zijn naast HLA identieke en Matched Unrelated donoren inmiddels de resultaten van mismatched en HAPLO identieke donoren vergelijkbaar (Oostenbrink et al. 2020, Angelucci et al. 2014). Introductie van post transplantatie cyclofosfamide en pre transplantatie intensieve immuunsuppressie heeft het gebruik van mismatched en HAPLO identieke donoren mogelijk gemaakt (Anurathapan et al. 2020, Shaw et al. 2021). Transplantatie resultaten zijn consistent en significant beter in kinderen dan in volwassenen. Het verdient daarom aanbeveling om de mogelijkheid van allogene stamceltransplantatie zo vroeg mogelijk in het leven te onderzoeken en zo mogelijk aan te bieden.(Li et al. 2019, Angelucci et al. 2014).
Dit is ook conform de aanbeveling in de UK thalassemie richtlijn 2016. (Standards for the Clinical Care of Children and Adults with Thalassemia in the UK, 3rd edition)
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
Wie komt in aanmerking voor luspatercept?
Aanbevelingen
|
Conclusie |
score |
|
Patiënten >4 eenheden erytrocytenconcentraten/8wk komen in aanmerking voor luspatercept |
A1 |
|
Patiënten met niet transfusieafhankelijke thalassemie en een Hb < 6,2 mmol/L komen in aanmerking voor behandeling met luspatercept |
A1 |
Onderbouwing
Er zijn twee nieuwe ontwikkelingen ten aanzien van de behandeling voor transfusie afhankelijke bèta-thalassemie. Voor behandelaren is het belangrijk dergelijke nieuwe en kostbare behandelopties voor de juiste patiënt beschikbaar te stellen. Gentherapie komt nog niet beschikbaar voor transfusie afhankelijke non-β0/β0 thalassemie van 12 jaar of ouder.
Voor luspatercept geldt dat dit beschikbaar komt voor alle β-TDT patiënten.
Voorwaarden voor patiënten die mogelijk in aanmerking komen voor behandeling met luspatercept
De volgende complicaties bij een patiënt met NTDT leiden tot transfusie afhankelijkheid en in een dergelijk geval kwalificeert een patiënt ook voor luspatercept:
Zoekverantwoording
Er is onder andere gebruikt gemaakt van bestaande richtlijnen.
Referenties
© 2022. Alle rechten voorbehouden
Landelijke Werkgroep van Hemoglobinopathie Behandelaren (LWHB)