Terug naar het richtlijnenoverzicht
Verworven aplastische anemie is een zeldzaam ziektebeeld dat gekenmerkt wordt door een hypocellulair beenmerg en pancytopenie. Door de lage incidentie van de ziekte (jaarlijks ongeveer 30 nieuwe patiënten in Nederland) is er een beperkt aantal gerandomiseerde studies gedaan naar de optimale behandeling van verworven aplastische anemie. Sinds het verschijnen van de laatste revisie van de richtlijn diagnostiek en behandeling van verworven aplastische anemie bij volwassenen in 2019, is een gerandomiseerde studie naar het toevoegen van Eltrombopag aan eerste lijn immunosuppressieve therapie afgerond en is er meer bekend over donor keuze en conditioneringsschema’s voor allogene stamceltransplantatie bij aplastische anemie. Dit was voor de NVvH en de sub-werkgroep AA/PNH reden voor een nieuwe revisie van de richtlijn.
Deze richtlijn heeft als doelstellingen:
De doelgroep betreft alle professionals die betrokken zijn bij diagnostiek, behandeling en begeleiding van volwassen patiënten met verworven aplastische anemie. Voor de diagnostiek en behandeling van aplastische anemie bij kinderen wordt verwezen naar de SKION behandelrichtlijn: https://www.skion.nl/richtlijn/behandelrichtlijn-aplastische-anemie.
Voor het ontwikkelen van de richtlijn is in 2023 een werkgroep ingesteld, De werkgroepleden zijn door de Nederlandse Vereniging voor Hematologie (NVvH) gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn en bestaat uit:
De richtlijn is mede gelezen en beoordeeld door vertegenwoordigers van de Stichting AA&PNH contactgroep:
|
Dr. J.M-L Tjon, internist-hematoloog, LUMC |
Geen |
|
Dr. L.G.M van Hussen-Daenen, internist-hematoloog, UMCU |
Prinses Maxima Centrum – Nul aanstelling – onbetaald |
|
Dr. E. Nur, internist-hematoloog, AUMC, Sanquin Research |
Novartis (Research Funding, Speakers Bureau) |
|
Dr. F.C.J.I. Heubel-Moenen, internist-hematoloog, MUMC |
Octopharma Maastricht University Translate 2 Clinical Fellowship, |
|
Dr. S.K. Klein, internist-hematoloog, UMCG |
Geen |
|
Drs. C.L.E. Hazenberg, internist-hematoloog, UMCG |
Geen |
|
Drs. T.J.F. Snijders, internist-hematoloog, MST |
Geen |
|
Dr. S.M. Langemeijer, internist-hematoloog, Radboud UMC |
Medisch adviseur contactgroep AA& PNH (patiënten organisatie, onbetaald) |
|
Dr. A.E.C. Broers, internist-hematoloog, ErasmusMC |
Geen |
|
Prof. Dr. M.H.G. Raaijmakers, internist-hematoloog, Erasmus MC |
Geen |
|
Dr. C.J.M. Halkes, internist-hematoloog, LUMC |
Amgen – bijdrage voor door Amgen georganiseerd onderwijs aan verpleegkundig specialisten, is betaald aan afdelingsfonds hematologie van het LUMC |
Wat is de plaats van moleculaire diagnostiek bij de diagnosestelling van aplastische anemie?
Bij welke patiënten is een allogene stamceltransplantatie de aanbevolen eerste lijn behandeling?
Welke conditionering en GVHD profylaxe wordt geadviseerd bij patiënten met aplastische anemie?
Wat is de preferente eerste lijn immunosuppressieve therapie?
Welk alternatief is er voor ciclosporine bij eerstelijns immunosuppressieve therapie indien er sprake is van een contra-indicatie, intolerantie of ernstige toxiciteit?
Wat te doen met ciclosporine bij patiënten die zes maanden na start van immunosuppressieve therapie responderen?
Is eerste lijn immunosuppressieve therapie effectief en veilig bij patiënten met verworven aplastische anemie ouder dan 60 jaar?
Wat is een geschikte behandeling in geval van refractaire ziekte of recidief ziekte na eerdere behandeling met ATGAM in combinatie met ciclosporine?
Welke andere immunosuppressieve therapieën kunnen overwogen worden?
Hoe dient te worden omgegaan met zwangerschapswens en zwangerschap bij vrouwelijke patiënten met verworven aplastische anemie na immunosuppressieve behandeling?
Hoe dient te worden omgegaan met actieve aplastische anemie tijdens de zwangerschap.
Hoe om te gaan met vaccinaties na behandeling met immunosuppressieve therapie?
Hoe om te gaan met de combinatie aplastische anemie en paroxismale nocturnale hemoglobinurie?
Hoe is de follow-up van patiënten met verworven aplastische anemie na immunosuppressieve therapie?
De leden van de NVvH sub-werkgroep AA/PNH en vertegenwoordigers van de AA&PNH contactgroep hebben in de ontwikkeling van deze richtlijn een aantal uitgangsvragen geformuleerd op basis van knelpunten op het gebied van diagnostisch, therapeutisch en follow-up beleid. Onderstaande uitgangsvragen vormen de basis van de verschillende modules in deze richtlijn. Er werd, waar mogelijk, gebruik gemaakt van de “Strength-of-Recommendation Taxonomy” (SORT) gradering om de kwaliteit van het gevonden bewijs per uitgangsvraag te graderen.
In tegenstelling tot congenitaal beenmergfalen waarbij een erfelijke mutatie ten grondslag ligt aan het beenmergfalen kan bij de meerderheid van de patiënten met verworven aplastische anemie geen directe oorzaak worden aangetoond voor het beenmergfalen. Immuungemedieerde afbraak van hematopoëtische voorlopercellen wordt verondersteld ten grondslag te liggen aan het beenmergfalen waarbij een rol voor onder andere oligoklonale CD8 positieve T cellen, CD4 positieve T cellen, afwijkende regulatoire T cellen en gamma delta T cellen gesuggereerd is. De uitlokkende factor voor de afbraak van hematopoëtische voorlopercellen is onbekend. Immunosuppressieve therapie leidt tot (gedeeltelijk) herstel van de hematopoëse in de meerderheid van de patiënten met aplastische anemie.
Bij een deel van de patiënten met verworven aplastische anemie zijn verkorte telomeren in bloedcellen aantoonbaar. Adequate telomeerlengte is nodig om genoominstabiliteit te waarborgen. Congenitale mutaties in genen die een rol spelen bij het in stand houden van adequate telomeerlengte kunnen aanleiding geven tot de entiteit omschreven als telomeerziekte. Klinische uitingen van telomeerziekte zijn onder andere levercirrose, longfibrose en beenmergfalen1. Daarnaast kunnen patiënten met telomeerziekte zich presenteren met typische uiterlijke kenmerken. In het geval van aplastische anemie kan in 5-10% van de gevallen een mutatie in een van de met telomeerziekte geassocieerde genen worden gevonden. Daarnaast wordt verondersteld dat verkorting van de telomeren in verworven aplastische anemie ontstaat door de verhoogde celvernieuwing om de hematopoëse in stand te houden2.
Bij een deel van de patiënten met verworven aplastische anemie is sprake van een relatieve toename van klonale cellen die het glycophosphatidylinositol (GPI) anker missen zonder dat er sprake is van de klinische manifestatie van het ziektebeeld paroxysmale nachtelijke hemoglobinurie (PNH)3,4.
Het diagnostisch onderzoek bij de verdenking op verworven aplastische anemie is gericht op het uitsluiten van een andere oorzaak van de beenmergaplasie en de bijbehorende cytopenie(n). Diagnoses die dienen te worden uitgesloten zijn: congenitaal beenmergfalen syndroom (waaronder Fanconi anemie en telomeerziekte), hypoplastische MDS/AML, voedingsdeficiënties, anorexia nervosa, T-cell large granular lymfocytic leukemia (T-LGL), hairy cell leukemie, en myelofibrose. Daarnaast wordt diagnostiek verricht naar oorzaken die geassocieerd zijn met het ontstaan van aplastische anemie zoals systemische lupus erythematosus (SLE), virale infecties (waaronder hepatitis), thymoom, lymfoom, eosinofiele fasciitis en expositie aan toxische middelen of specifieke medicatie.
Vanwege de lage incidentie van de ziekte wordt geadviseerd patiënten bij wie de verdenking op verworven aplastische anemie bestaat voor verdere diagnostiek te verwijzen naar een ziekenhuis dat ervaring heeft met de behandeling met anti-thymocytenglobuline (ATG) en/of allogene stamceltransplantatie (Alle Academische ziekenhuizen, Medisch Spectrum Twente).
Op basis van internationale richtlijnen en expert opinie van de leden van de werkgroep adviseert de werkgroep onderstaand diagnostisch onderzoek uit te voeren bij verdenking op verworven aplastische anemie.
Algemene anamnese in het kader van de gevolgen van cytopenie:
(Familie-) anamnese in het kader van een mogelijk congenitale oorzaak:
Anamnese in het kader van specifieke oorzaken van verworven aplastische anemie
Bloedonderzoek
Beenmergonderzoek
Radiologisch onderzoek
Op basis van de bevindingen bij bloed- en beenmerg-onderzoek kan de ernst van de aplastische anemie geclassificeerd worden (Tabel 1)
|
Tabel 1. Ziekteclassificatie |
|
|
niet-ernstige aplastische anemie |
hypocellulair beenmerg met perifere bloedwaarden die onder de normaalwaarden liggen maar die niet voldoen aan de criteria voor ernstige aplastische anemie |
|
ernstige aplastische anemie |
|
|
zeer ernstige aplastische anemie |
conform ernstige aplastische anemie met neutrofielen < 0.2 x 109/L |
Diagnostiek naar congenitaal beenmergfalen
In de diagnostiek naar verworven aplastische anemie is het belangrijk om eventueel onderliggend congenitaal beenmergfalen uit te sluiten. Met name omdat herstel na immunosuppressieve therapie (IST) in geval van congenitaal beenmergfalen onwaarschijnlijk wordt geacht en er gevolgen zijn voor de eerste lijn behandel keuze (IST versus allogene stamceltransplantatie (alloHSCT)). Vaak gaat congenitaal beenmergfalen gepaard met een positieve familie anamnese voor beenmergaandoeningen, anamnestische of lichamelijke kenmerken. Echter, als gevolg van incomplete penetrantie of de novo mutaties is dit zeker niet altijd het geval en kan er sprake zijn van congenitale aplastische anemie in de afwezigheid van een positieve familie-anamnese of syndroom-gerelateerde symptomatologie. Een recente studie van 732 patiënten die werden gediagnosticeerd met verworven aplastische anemie toonde in 6.6% van deze patiënten een variant in genen geassocieerd met congenitaal beenmergfalen aan. Een derde hiervan waren volwassenen14.
De werkgroep adviseert bij iedere patiënt met verdenking op aplastische anemie anamnese en lichamelijk onderzoek af te nemen met specifieke aandacht voor kenmerken passend bij congenitaal beenmergfalen. Ook wanneer patiënten niet reageren op IST kan hier mogelijk ook congenitaal beenmergfalen aan ten grondslag liggen en dient nadere diagnostiek te worden overwogen. Indien er aanwijzingen zijn voor een congenitaal beenmerg falen wordt aangeraden contact op te nemen met/te verwijzen naar een gespecialiseerd centrum.
Fanconi anemie dient in ieder geval te worden uitgesloten bij patiënten < 40 jaar omdat dit zich kan manifesteren met weinig of geen uiterlijke kenmerken. Bij Fanconi anemie ontstaat er meer DNA-schade na blootstelling aan DNA-toxische stoffen en cross-linking agentia als gevolg van mutaties in genen die onderdeel zijn van het DNA repair complex15. Belangrijke kenmerken zijn familiair voorkomen van gynaecologische of hoofd/hals maligniteiten op jong-volwassen leeftijd, beenmergfalen en/of MDS/AML. Als initiële test dient een mitomycine-C test te worden verricht (Amsterdam UMC, UMC Utrecht, Radboudumc), indien afwijkend dient deze gevolgd te worden door DNA-diagnostiek. Voor aanvraagformulieren: www.dnadiagnostiek.nl.
Bij verdenking op telomeerziekte (familieanamnese met idiopathische levercirrose, longfibrose, beenmergfalen, AML of MDS, al dan niet in combinatie met uiterlijke kenmerken) is het raadzaam de mogelijkheid tot genetische counseling in één van de academische ziekenhuizen te bespreken met de patiënt. Onderzoek naar de nu bekende mutaties in genen betrokken bij het in stand houden van telomeerlengte, is in 65% van de patiënten met sterk verkorte telomeren (<1e percentiel) positief. Onderzoek naar mutaties in deze genen kan worden verricht in het ErasmusMC, Radboud UMC of UMC Utrecht. Voor aanvraagformulieren: www.dnadiagnostiek.nl. Indien mutatieanalyse inconclusief is en er toch een hoge verdenking op telomeerziekte bestaat wordt aanbevolen onderzoek te laten verrichten naar telomeerlengte. Dit gebeurt middels flow-FISH via Repeat Diagnostics in Aken.
Indien er aanwijzingen zijn voor een congenitaal beenmergfalen van andere origine kan vervolgonderzoek via een uitgebreid beenmergfalen genpanel worden overwogen in een van de academische centra. Voor aanvraagformulieren: www.dnadiagnostiek.nl.
Moleculaire diagnostiek
Uitgangsvraag
Wat is de plaats van moleculaire diagnostiek bij de diagnosestelling van aplastische anemie
Aanbeveling
Moleculaire diagnostiek wordt niet aangeraden als standaard diagnostiek van verworven aplastische anemie omdat het geen goed onderscheid kan maken tussen verworven (immuun-gemedieerde) aplastische anemie, CCUS en hypoplastische MDS en het geen eenduidige voorspeller is van uitkomst na behandeling.
|
Conclusie |
SORT grade |
|
De aanwezigheid van somatische mutatie bij diagnose verworven aplastische anemie heeft geen invloed op respons na IST en op overall survival 16,17 |
C |
Samenvatting literatuur en overwegingen
Een uitgebreide analyse onder 439 aplastische anemie patiënten toonde aan dat 36% van de patiënten een somatische mutatie heeft bij diagnose. Meest voorkomend waren mutaties in de genen PIGA, DNMT3A, BCOR, en BCORL116. Daarnaast werden ook mutaties die geassocieerd worden met MDS gevonden, waaronder ASXL1, RUNX1 en TP5316. In de RACE studie, waarin het effect van toevoegen van Eltrombopag aan standaard IST bestaande uit ATGAM in combinatie met Ciclosporine op de hematologische respons werd onderzocht, had 30% van de patiënten een somatische mutatie voor start van therapie. 24 maanden na start van de therapie nam het aantal patiënten met mutaties toe tot 52% in de groep met Eltrombopag en 77% in de groep zonder Eltrombopag17. De plaats van moleculair onderzoek binnen de diagnostiek naar verworven aplastische anemie is derhalve onderwerp van discussie.
Door het overlappende spectrum aan mutaties is het moeilijk om op basis van moleculaire diagnostiek het onderscheid te maken tussen verworven aplastische anemie, klonale cytopenie van onbekende betekenis (CCUS) of een (hypoplastische) MDS. Bovendien lijkt uit de tot nu toe beschikbare studies de aanwezigheid van bovengenoemde somatische mutaties geen effect te hebben op hematologische respons na IST en op overall survival16,17.
Moleculaire diagnostiek kan behulpzaam zijn in het maken van onderscheid tussen reactieve/secundaire en primaire (klonale) oorzaken van cytopenie en heeft een toenemend belangrijke rol in de classificatie en prognostificatie van MDS. In het kader van verworven aplastische anemie is de werkgroep echter van mening dat de aanwezigheid van somatische mutaties geen invloed dienen te hebben op de behandelkeuze.
Transfusies
Met betrekking tot transfusies gelden de adviezen zoals deze geformuleerd staan in de Nederlandse CBO Richtlijn Bloedtransfusie. Daarnaast geldt bij het gebruik van Anti-Thymocyten Globuline (ATG) een transfusie grens voor trombocyten van 20 x 109/L. Dit streefaantal wordt in alle internationale richtlijnen genoemd aangezien ATG een directe daling van het aantal circulerende trombocyten kan geven. Indien er na trombocyten transfusie onvoldoende stijging in het trombocytenaantal optreedt (1-uurs corrected count increment (CCI_1uur) lager dan 7,5), is onderzoek naar antistoffen gericht tegen HLA en eventueel HPA geïndiceerd. Er bestaat een indicatie voor bestraalde bloedproducten, ter preventie van transfusie geassocieerde graft versus host ziekte als er behandeling plaatsvindt met ATG, alemtuzumab of alloHSCT. Zie de CBO richtlijn Bloedtransfusie voor de duur van de indicatie voor bestraalde bloedproducten.
Infectie profylaxe
Gerichte studies op dit vlak ontbreken en de internationale richtlijnen lopen uiteen in hun adviezen. Gezien het in de regel ontbreken van mucositis lijkt selectieve darmdecontaminatie niet noodzakelijk. Profylaxe ter voorkoming van Pneumocystis jirovecii infectie en valaciclovir ter preventie van herpesinfecties wordt geadviseerd gedurende de lymfopene periode na behandeling met ATG. Indien het CD4 getal na ATG behandeling gestegen is >200 x 106/L kunnen deze profylactische maatregelen worden gestaakt18.
Bij koorts wordt geadviseerd om snel tot gerichte diagnostiek en empirische behandeling over te gaan. Uit retrospectieve studies blijkt dat invasieve fungale infecties, met name aspergillus en candida, de belangrijkste oorzaak zijn van mortaliteit. Het optreden van een invasieve fungale infectie is met name gerelateerd aan de ernst en diepte van de neutropenie en monocytopenie. Daarom adviseren wij conform eerdere richtlijnen om bij patiënten met een zeer ernstige aplastische anemie te starten met aspergillus profylaxe en bij patiënten met een ernstige aplastische anemie het starten van aspergillus profylaxe te overwegen.
Chelatietherapie
Secundaire ijzerstapeling door multipele bloedtransfusies dient behandeld te worden door middel van chelatietherapie. Daarbij is het serum ferritine de meest gebruikte parameter. De hoogte van het ferritine is echter niet altijd direct gecorreleerd aan de mate van ijzerstapeling. Een MRI van hart en lever kan behulpzaam zijn bij het kwantificeren van ijzerstapeling in deze organen en het vaststellen van beschadiging van deze organen door ijzerstapeling, ofschoon studies bij patiënten met aplastische anemie ontbreken. Indien patiënten door geslaagde IST of alloHSCT geen anemie meer hebben, heeft flebotomie om het ijzergehalte te reduceren de voorkeur. Indien medicamenteuze chelatietherapie geïndiceerd is, dienen de potentiële bijwerkingen (kans op agranulocytose bij deferipron en nierfunctiestoornis bij deferasirox) van de verschillende middelen en de negatieve gevolgen van secundaire ijzerstapeling tegen elkaar te worden afgewogen. Zie voor de geadviseerde controles bij het gebruik van deze medicatie het farmacotherapeutisch kompas.
Granulocyte colony-stimulating factor (G-CSF)
Patiënten hebben door (soms langdurige) neutropenie een verhoogd risico op infectieuze complicaties. Er zijn drie gerandomiseerde studies die de toevoeging van G-CSF aan IST bij de behandeling van aplastische anemie onderzochten19-21. In de gerandomiseerde studie van Gluckman et.al.19werden 102 patiënten behandeld met paard-ATG of konijn-ATG in combinatie met ciclosporine, waarvan 53 met toevoeging van G-CSF. Bij patiënten met ernstige aplastische anemie werd een significant voordeel gezien bij het herstel van de neutropenie. Dit vertaalde zich echter niet in minder infecties, betere overall respons en/of betere overleving. In de meest recente gerandomiseerde studie van de EBMT werd onderzocht of het toevoegen van G-CSF aan standaard IST de neutropene fase kan verkorten en daarmee een gunstig effect op de overleving kan bewerkstelligen21. In deze studie werden 192 patiënten geanalyseerd waarvan 97 patiënten G-CSF ontvingen van dag 8 tot en met 240 na behandeling met paard-ATG en ciclosporine. Het toevoegen van G-CSF aan standaard IST bekort mogelijk de opnameduur in patiënten met een zeer ernstige aplastische anemie door reductie van infectieuze complicaties. Dit effect is niet duidelijk aantoonbaar voor patiënten met een ernstige aplastische anemie. Toevoegen van G-CSF heeft geen effect op de overall survival, mortaliteit, remissie en relapse21. Teramura et al. vergeleken de uitkomsten van behandeling met paard-ATG in combinatie met ciclosporine met/of zonder toevoeging van G-CSF in 101 patiënten (waarvan 51 met G-CSF behandeld). Hier werd na 6 maanden een hogere hematologische respons (77% vs 57%; p = 0.03) gezien in de met G-CSF behandelde groep. Na een jaar was dit voordeel niet meer aantoonbaar. Ten aanzien van overleving en infecties werden geen verschillen gezien tussen beide groepen20. De werkgroep ziet op basis van bovenstaande geen rol voor G-CSF als onderdeel van de standaardbehandeling van aplastische anemie.
Psychosociale en overige ondersteuning
AA is een complexe aandoening waarbij zowel de ziekte zelf als de behandelingen invloed kunnen hebben op zowel het lichamelijk als psychisch welbevinden van een patiënt. Ook jaren na succesvolle behandeling kunnen patiënten verminderde kwaliteit van leven ervaren22. Het is aan te raden patiënten psychosociale begeleiding aan te bieden. Dit kan in samenspraak met de patiënt in de vorm van psychologische ondersteuning en/of maatschappelijk werk. Daarnaast kunnen patiënten ter somatische ondersteuning baat hebben bij fysiotherapie en/of ergotherapie. Voor lotgenotencontact verwijzen we naar de AA&PNH Contactgroep (https://www.aaenpnh.nl/).
Behandel indicatie bij verworven aplastische anemie
(Zeer) ernstige aplastische anemie is altijd een indicatie tot behandeling23-25. Bij een niet-ernstige aplastische anemie is er een behandelindicatie indien de patiënt transfusie-afhankelijk is. Voor patiënten met een niet-ernstige aplastische anemie zonder transfusie-afhankelijkheid wordt geadviseerd een expectatief beleid te voeren. Wanneer een niet-ernstige aplastische anemie op basis van een dalend neutrofielen-aantal evolueert naar een ernstige aplastische anemie, dient de ziekte ook als zodanig behandeld te worden. Potentieel beenmerg-toxische medicatie dient direct gestaakt te worden. Indien het bloedbeeld tijdens de diagnosestelling (ongeveer 2-3 weken) niet spontaan verbetert, dient zo snel mogelijk gestart te worden met de behandeling. Eventueel aanwezige infecties dienen zo goed mogelijk behandeld te worden maar vormen geen reden om de noodzakelijke behandeling lang uit te stellen23-25. In verband met de sterk gestoorde immuniteit van patiënten met een (zeer) ernstige aplastische anemie dienen deze patiënten behandeld te worden in centra waar ervaring is met de zorg voor deze patiënten (Academische centra en Medisch Spectrum Twente).
Figuur 1. Leidraad voor behandeling
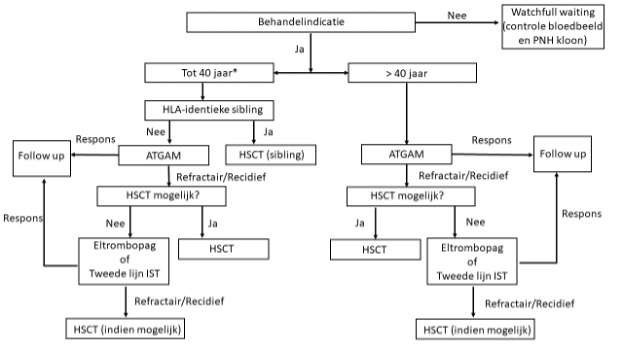
* Op individuele basis kan van deze leeftijdsgrenzen worden afgeweken
Uitgangsvraag
Bij welke patiënten is een allogene stamceltransplantatie de aanbevolen eerste lijn behandeling?
Aanbeveling
Bij jonge patiënten met een (zeer) ernstige aplastische anemie en een gematchte verwante donor is een alloHSCT de preferentiële eerste lijn behandeling. Dit geldt voor patiënten tot 40 jaar en kan overwogen worden bij patiënten in een goede conditie tot 50 jaar. Ook bij een patiënt met een diepe granulopenie en/of ernstige infecties voor wie op korte termijn een 10/10 onverwante donor beschikbaar is kan een alloHSCT als eerste lijn behandeling overwogen worden.
Onderbouwing
Indien er een behandel indicatie is, dient een keuze gemaakt te worden tussen IST of alloHSCT. Beide behandelingsmodaliteiten verschillen niet alleen in werkingsmechanisme maar ook in toxiciteit en effectiviteit. IST kent minder vroege bijwerkingen en de bijwerkingen zijn met name medicatie-gerelateerd. IST kan ook toegepast worden bij patiënten op oudere leeftijd of met co-morbiditeit26. Hier staat tegenover dat na IST de kans op recidief ziekte of clonale evolutie (AML/MDS) groter is. AlloHSCT is geschikt voor jongere patiënten zonder belangrijke co-morbiditeit maar gaat gepaard met een risico op transplantaat falen, graft-versus-host ziekte (GvHD) en transplantatie gerelateerde mortaliteit.
|
Conclusie |
SORT grade |
|
Bij jonge patiënten met een ernstige aplastische anemie en een gematchte sibling donor is een alloHSCT de preferentiële eerste lijn behandeling. Dit geldt voor patiënten tot 40 jaar en kan overwogen worden bij patiënten in een goede conditie tot 50 jaar. |
C |
|
Bij een jonge patiënt met ernstige aplastische anemie kan, ook in aanwezigheid van een gematchte sibling donor, overwogen worden om te starten met IST bestaande uit ATGAM in combinatie met ciclosporine. |
C |
|
Bij een patiënt met een diepe granulopenie en/of ernstige Infecties kan een alloHSCT als eerste lijn behandeling worden aangeboden als er een 10/10 onverwante donor beschikbaar is. |
C |
|
Bij de keuze voor een transplantatie- en conditioneringschema is het van belang de kans op het ontstaan van GVHD zo veel als mogelijk te beperken. |
C |
Samenvatting literatuur
Resultaten
Er zijn geen gerandomiseerde studies waarbij IST en alloHSCT direct met elkaar vergeleken worden. Er is in 2013 een Cochrane-review gepubliceerd waarbij een analyse van prospectieve studies werd verricht waarbij het donor versus no donor principe werd gehanteerd in de analyse27. Uiteindelijk voldeden maar 3 relatief kleine studies aan de criteria waarbij het van belang is te melden dat het oudere studies betrof en een groot aantal van de geïncludeerde patiënten kinderen waren. De auteurs van de Cochrane-review concluderen dat er onvoldoende bewijs is om op basis van de gepubliceerde onderzoeken aan te geven of IST dan wel alloHSCT de eerste keuze zou moeten zijn bij de behandeling van (zeer) ernstige aplastische anemie.
In een EBMT registry studie van Locasciulli van 2479 patienten met verworven ernstige aplastische anemie was de 10-jaars overleving 73% versus 68% na eerste lijn therapie met een alloHSCT versus IST28. Bias bij de keuze van de therapie zal een rol hebben gespeeld in het verschil in overleving aangezien de jongere fitte patiënt veelal een alloHSCT ontving. Het risico op overlijden was in het verleden hoger bij een onverwante dan bij een verwante donor, hoewel direct vergelijkende studies ontbreken en Locasciulli et al. laten zien dat de overall survival dichter bij elkaar komt in cohorten die recenter zijn getransplanteerd (38% versus 74% in het cohort 1991-1996 en 65 % versus 80 % in het cohort 1997-2002)28. In een EBMT registry studie van een cohort bestaande uit 1448 patiënten was het verschil in risico om te overlijden na een alloHSCT van een onverwante donor niet significant hoger dan na een alloHSCT van een verwante donor. Er bestaat nog wel een hoger risico op acute en chronische GvHD in geval van een onverwante donor29.
Zoekverantwoording
Er werd voor deze uitgangsvraag, vanwege het ontbreken van vergelijkende studies, geen systemisch literatuuronderzoek verricht. Er werd gebruik gemaakt van de richtlijn van de British Society of Hematology25 en van een Cochrane-review27.
Overwegingen
Onder optimale omstandigheden leidt alloHSCT tot een uitstekende overleving voor patiënten met (zeer) ernstige aplastische anemie. De lange termijn overleving ligt rond de 90% indien gebruik gemaakt wordt van een verwante donor, beenmerg als stamcel bron, conditionering bestaande uit hoge dosis cyclofosfamide en ATG en GvHD profylaxe bestaande uit ciclosporine en methotrexaat (MTX)30-32. De resultaten van alloHSCT bij oudere patiënten of patiënten met een onverwante donor zijn slechter. Hier dient rekening mee gehouden te worden bij het stellen van de indicatie tot alloHSCT in plaats van behandeling met IST. Het verschil in uitkomst na verwante versus onverwante donor alloHSCT is groter dan bij maligne ziektebeelden. Derhalve adviseert de werkgroep alleen jongere patiënten met een HLA-identieke verwante donor in de eerste lijn allogeen te transplanteren. Voor jongere patiënten die niet over een verwante donor beschikken en voor oudere patiënten geldt dat alloHSCT pas in de tweede lijn toegepast dient te worden. Hiermee conformeren wij ons aan de internationale richtlijnen zoals die van de EBMT en de British Committee for Standards in Haematology (BCSH) Haemato-Oncology Task Force25,33
Als leeftijdsgrens wordt in de verschillende richtlijnen 40 jaar gebruikt waarbij er ruimte is om bij patiënten tot 50 jaar zonder co-morbiditeit met een verwante donor een alloHSCT te overwegen. Met betrekking tot leeftijd is een exacte grens lastig aan te geven maar de kans op langdurige overleving neemt met elke decade af, tot ongeveer 50% boven de 50 jaar24. Hoewel alloHSCT ook op hogere leeftijd uitvoerbaar is, weegt in het geval van (zeer) ernstige aplastische anemie de winst van eerste lijn alloHSCT door de toenemende morbiditeit en mortaliteit in deze leeftijdscategorie niet op tegen de resultaten van IST.
Bij individuele patiënten kunnen gefundeerde redenen bestaan om van bovengenoemde richtlijnen af te wijken. Zo kan het voor patiënten met een zeer ernstige aplastische anemie en diepe neutropenie de voorkeur hebben in eerste lijn voor alloHSCT te kiezen, om de duur van neutropenie te beperken. Hierbij kan bijvoorbeeld overwogen worden een hogere leeftijd te accepteren of om een 10/10 gematchte onverwante donor te gebruiken. De aanwezigheid van een monosomie 7 kan, ook zonder dat er aanwijzingen zijn voor een MDS of een AML, een reden zijn om te kiezen voor een alloHSCT. Bij een patiënt met een ernstige aplastische anemie kan er, ook als er een gematchte sibling donor is, in overleg met de patiënt gestart worden met ATGAM als eerste lijn behandeling. De lagere toxiciteit van deze behandeling in vergelijking met een alloHSCT moet dan afgewogen worden tegen de lagere responskans en de langere granulopene periode met verhoogd infectierisico.
Uitgangsvraag
Welke conditionering en GVHD profylaxe wordt geadviseerd bij patiënten met aplastische anemie?
Aanbeveling
Bij jonge patiënten die als eerste lijn behandeling een alloHSCT krijgen van een 10/10 verwante donor, wordt geadviseerd beenmerg stamcellen te geven na conditionering met cyclofosfamide en ATG gevolgd door MTX met ciclosporine als GVHD profylaxe. Als alternatief kan gekozen worden voor perifeer geoogste stamcellen waarbij als GVHD profylaxe gebruikt gemaakt wordt van post-transplantatie Cyclofosfamide of alfa-beta T cel/ CD19 B cel depletie van het transplantaat. Bij oudere patiënten, bij een onverwante donor of indien de transplantatie een tweede lijn behandeling betreft kan ook gebruik worden gemaakt van de schema’s met post-transplantatie Cyclofosfamide of alfa-beta T cel/ CD19 B cel depletie. Indien er gebruik gemaakt wordt van een haplo-identieke donor dan wordt een schema met post-transplantatie Cyclofosfamide geadviseerd.
Onderbouwing
Specifieke aandachtspunten bij de keuze voor een transplantatie schema bij aplastische anemie zijn:
Van oudsher wordt op basis van deze overwegingen geadviseerd om bij jonge patiënten met een HLA-identieke verwante donor in de eerste lijn een stamceltransplantatie uit te voeren met beenmerg stamcellen. Inmeerdere studies is aangetoond dat het gebruik van beenmerg in plaats van perifeer bloed als stamcelbron leidt tot minder chronische GvHD, ook bij volwassenen34-37. De conditionering bestaat dan uit hoge dosis cyclofosfamide (50 mg/kg dag -5 tot en met -2) in combinatie met ATG (Thymoglobuline) (Tabel 2, schema 1). Over de dosering Thymoglobuline bestaat geen consensus, zowel 3x 2.5 mg/kg als 3x 3.75 mg/kg wordt gebruikt. Dit schema (Cy/ATG) is zeer immunosuppressief, ter voorkoming van transplantaat falen en GvHD. Belangrijk is de realisatie dat een gerandomiseerde trial geen expliciet voordeel van de toevoeging van ATG aan cyclofosfamide heeft laten zien. Weliswaar was de overleving in de beide behandelarmen in deze studie beter dan verwacht waardoor de studie onvoldoende power had om een significant verschil aan te tonen 38. Er bestaat internationaal geen consensus over de vraag tot op welke leeftijd Cy/ATG een geschikt schema is. Ook bij patiënten > 40 jaar wordt dit schema toegepast, mits de patiënt een goede (cardiale) conditie heeft en beenmerg als stamcelbron gebruikt wordt 39. Een standaardschema bij jongere patiënten die een alloHSCT van een onverwante donor krijgen, bestaat evenmin. Ter voorkomen van transplantaatfalen bij een onverwante donor is het toevoegen van 2 Gy TBI (of 2 x 2 Gy in geval van een gemismatchte onverwante donor) op dag –1 aan Cy/ATG 40 een goede optie.
GvHD-profylaxe
De studies vanuit het Fred Hutchinson Cancer Research Center in Seattle30-32, waar het regime van cyclofosfamide met ATG is ontwikkeld, zijn allemaal uitgevoerd in combinatie met een medicamenteuze GvHD profylaxe bestaande uit ciclosporine en methotrexaat (MTX). Hiermee is de kans op acute GvHD beperkt (10-20%) maar blijft het risico op chronische GvHD aanzienlijk (30-40%). Er is discussie over de vraag of er werkelijk een noodzaak is om MTX aan het regime toe te voegen. In een gerandomiseerde trial is aangetoond dat toevoeging van MTX niet zozeer leidt tot minder GvHD, maar wel tot een aanmerkelijke reductie van de transplantatie-gerelateerde mortaliteit41. Een kanttekening bij deze studie is dat er geen ATG werd toegepast, maar dat alleen cyclofosfamide werd gegeven.
Rekening houdend met bovenstaande adviseert de werkgroep het volgende:
ciclosporine 2 maal daags 3.5 mg/kg oraal vanaf dag –3 met een eenmalige oplaaddosis van 7mg/kg oraal in combinatie met MTX 15 mg/ m2 intraveneus op dag +1 (minimaal 24 uur na stamcelinfusie) gevolgd door MTX 10 mg/m2 intraveneus op dag + 3, + 6 en +11.
Alternatieve conditionering schema’s
Er ontstaat steeds meer ervaring met de combinatie van intensieve in-vivo of in-vitro T cel depletie en het gebruik van gemobiliseerde stamcellen uit perifeer bloed bij patiënten met aplastische anemie. Dit kan worden gedaan door op dag +3 en +4 post-transplantatie cyclofosfamide te geven (pTCy) of door het transplantaat te bewerken middels ex vivo alfa-beta T cel depletie. Het voordeel hiervan is de kortere tijd tot engraftment en de lage incidentie van GvHD42. Deze schema’s zijn ook geschikt voor oudere patiënten en kunnen gebruikt worden om een alloHSCT als tweede lijn behandeling uit te voeren (Tabel 2 schema 2 en 3).
AlloSCT met een haploidentieke donor
Haploidentieke alloHSCT (beenmerg als stamcelbron) wordt steeds vaker gebruikt als behandeling van benigne ziektes zoals (zeer) ernstige aplastische anemie43. Gezien een grotere kans op transplantaat falen en GvHD, wordt gebruik van haploidentieke alloHSCT in de eerste lijn afgeraden. Bij gebruik van haploidentieke donor in de tweede lijn (na eerder gebruik van immunosuppressiva) bestaat de conditionering uit ATG (2.5mg/kg), Fludarabine 150 mg/m2, cyclofosfamide 29 mg/m2 en 2 Gy TBI (Tabel 2 schema 4). Aangezien in de studie van DeZern et al. bij gebruik van deze conditionering in de eerste lijn (behandelingsnaïeve patiënten) meerdere rejecties optraden, werd de TBI dosis voor behandelingsnaïeve patiënten verhoogd naar 4 Gy in één fractie, met goed effect. Post-transplantatie immunosuppressie bestaat uit cyclofosfamide 100 mg/m2 (verdeeld over dag +3 en +4). Bij haploidentieke alloHSCT wordt dubbele lymfodepletie (pre-transplantatie ATG en post-transplantatie cyclofosfamide) gebruikt volgens het Johns Hopkins protocol voor haploidentieke beenmergtransplantaties bij benigne ziektes zoals aplastische anemie en hemoglobinopathieën. Terwijl ATG vooral dient tegen transplantaatfalen door rejectie, is post-transplantatie cyclofosfamide bedoeld als GvHD profylaxe. De immunosuppressie bestaat uit mycofenolaat mofetil van dag +5 tot +35 en tacrolimus van dag +5 tot +365 (Tabel 2 schema 4). Bij volledig donor chimerisme en geen aanwijzingen voor GvHD, kan tacrolimus in een keer gestopt worden. Bij twijfel kan afbouwen binnen enkele maanden overwogen worden
|
Tabel 2. Conditionering alloHSCT |
||
|
Schema 1 (jonge patiënt, eerste lijn, 10/10 verwante donor, beenmerg als stamcel bron) |
||
|
cyclofosfamide |
50 mg/kg/dag |
dag -5 tot en met -2 |
|
Thymoglobuline (konijn-ATG)* |
2.5-3.75 mg/kg/dag |
dag -5 tot en met -3 |
|
TBI** |
2 Gy |
dag -1 |
|
Stamcelinfusie |
dag 0 |
|
|
GvHD-profylaxe |
MTX 15 mg/m2, i.v. MTX 10 mg/m2, i.v.
Ciclosporine 2d3.5 mg/kg, oral |
Dag +1 Dag +3, +6, +11
Dag -3 tot en met dag 270, daarna afbouwen |
|
Schema 2: PTCy (stamcellen uit perifeer bloed, zowel eerste als tweede lijn, leeftijd tot ongeveer 70 jaar) |
||
|
cyclofosfamide |
14.5 mg/kg/dag |
dag -6 en -5 |
|
Fludarabine |
30 mg/m2/dag |
dag -6 tot en met -2 |
|
TBI |
2 Gy |
Dag -1 |
|
cyclofosfamide |
50 mg/kg/dag *** |
Dag +3 en +4 |
|
mycofenolaat |
3 dd 15 mg/kg |
Dag +5 tot en met +28 |
|
Tacrolimus |
2 dd 0.04 mg/kg p.o. |
Dag +5 tot en met +100, daarna afbouwen |
|
Schema 3: alfa-beta T cel / CD19 B cel depletie (stamcellen uit perifeer bloed, zowel eerste als tweede lijn, leeftijd tot ongeveer 70 jaar) |
||
|
Thymoglobuline (konijn-ATG)* |
1.5 mg/kg/dag |
dag -12 tot en met -9 |
|
Fludarabine |
40 mg/m2/dag |
dag -5 tot en met -2 |
|
Busulfan |
TDM, AUC 80-100 mg*h/L |
dag -5 tot en met -2 |
|
mycofenolaat |
3 dd 15 mg/kg p.o. (max 3000mg totaal) |
Dag 0 tot en met +28 |
|
Schema 4: Haploidentieke donor (beenmerg als stamcel bron, tweede lijn, leeftijd tot ongeveer 70 jaar) |
||
|
cyclofosfamide |
14.5 mg/kg/dag |
dag -6 en -5 |
|
fludarabine |
30 mg/m2/dag |
dag -6 tot en met -2 |
|
TBI |
4Gy eerste lijn: behandelingsnaïeve patiënten 2Gy tweede lijn: recidief/refractaire zieke |
Dag -1 |
|
cyclofosfamide |
50 mg/kg/dag *** |
Dag +3 en +4 |
|
mycofenolaat |
3 dd 15 mg/kg |
Dag +5 tot en met +35 |
|
Tacrolimus |
2 dd 0.04 mg/kg p.o. |
Dag +5 tot en met +365,eventueel afbouwen |
* over de dosering Thymoglobuline bestaat geen consensus
** alleen bij onverwante donor (bij gemismatchte onverwante donor: 2 x 2Gy)
*** bij oudere of kwetsbare patiënte kan overwogen worden om 40 mg/kg/dag te geven
Uitgangsvraag
Wat is de preferente eerste lijn immunosuppressieve therapie bij volwassen patiënten met verworven aplastische anemie?
Aanbeveling
Behandeling met ATGAM (Pfizer) in combinatie met ciclosporine vanaf dag 1 is de preferente eerste lijn behandeling voor aplastische anemie bij een volwassen patiënt wanneer deze niet in aanmerking komt voor een allogene stamceltransplantatie.
Onderbouwing
ATG is een polyklonale mix van antistoffen die verkregen wordt door immunisatie van een paard (ATGAM; Pfizer) of een konijn (Thymoglobuline; Genzyme en Grafalon; Fresenius) met humane thymocyten (ATGAM en Thymoglobuline) of een Jurkat T-cellijn (Grafalon). Van oudsher bestaat eerste lijn IST bij aplastische anemie uit ciclosporine in combinatie met ATG en kortdurend prednison om serumziekte als complicatie bij ATG tegen te gaan. De verschillende soorten ATG zijn niet onderling uitwisselbaar. Er is daarom literatuuronderzoek gedaan naar de effectiviteit van de verschillende soorten ATG in de eerste lijn behandeling van volwassen patiënten met verworven aplastische anemie.
|
Conclusie |
SORT Grade |
|
Eerste lijn behandeling met ATGAM (Pfizer) gedurende 4 dagen 40 mg/kg/dag in combinatie met ciclosporine vanaf dag 1 leidt bij 59-68% van de volwassen aplastische anemie patiënten na zes maanden tot een hematologische respons 17,26,44-46 |
A |
|
Eerste lijn behandeling met Thymoglobuline in combinatie met ciclosporine leidt na 6 maanden tot een hematologische respons in 33-45% van de patiënten45,47,48 |
A |
|
Toevoegen van Eltrombopag aan eerste-lijn behandeling met ATGAM en ciclosporine leidt tot eerder hematologisch herstel 17,49 Toevoegen van Eltrombopag in de beperkte observatieperiode van twee prospectieve studies geeft geen overlevingsvoordeel en verlaagt de recidief kans niet. |
B |
Samenvatting literatuur
Resultaten
De effectiviteit van ATGAM bij patiënten met aplastische anemie is gebleken uit één gerandomiseerde studie uit de jaren 80 waarin ATGAM werd vergeleken met best supportive care50. Drie prospectieve studies door de Amerikaanse National Institutes of Health (NIH) uitgevoerd tussen 1990 en 2010 waarin als eerste lijn behandeling de combinatie ATGAM met ciclosporine werd gegeven toonden een overall response rate (ORR) van 61-68% zes maanden na start van de behandeling. Een respons werd gedefinieerd als transfusie-onafhankelijkheid en bloedwaarden die niet meer voldoen aan de criteria voor ernstige aplastische anemie. Een deel van de in totaal 224 patiënten uit deze studies was niet volwassen44-46. In een prospectieve cohortstudie in Nederland van 23 patiënten van 60 jaar of ouder, bleek het responspercentage na zes maanden 59% te zijn26. Toevoegen van mTOR remmer Sirolimus aan de combinatie ATGAM en ciclosporine leverde geen verbetering van de respons op46. Een Amerikaanse prospectieve cohortstudie van 92 patiënten (mediane leeftijd 32 jaar) met een mediane follow-up periode van 23 maanden liet zien dat het toevoegen van de trombopoietine-receptor agonist Eltrombopag aan ATGAM en ciclosporine als eerste lijn behandeling leidde tot een responspercentage van 74% na 3 maanden en 80% na 6 maanden. Hierbij was het responspercentage het hoogst in het cohort patiënten dat vanaf dag 1 gedurende zes maanden werd behandeld met Eltrombopag (94% na zes maanden)49. In navolging van deze studie vond tussen 2015 en 2019 in Europa de door de EBMT geïnitieerde RACE-studie plaats waarin patiënten met een ernstige of zeer ernstige aplastische anemie werden gerandomiseerd tussen standaard IST bestaande uit ATGAM in combinatie met ciclosporine, of standaard IST in combinatie met Eltrombopag vanaf dag 14. Na 6 maanden was de ORR 41% in de standaardarm en 68% in de groep met Eltrombopag. Overall suvival (OS) na 2 jaar follow up was echter niet significant verschillend tussen beide groepen (85% in standaard-arm versus 90% in Eltrombopag-arm)17. Parallel hieraan werd een extensiestudie verricht van de Amerikaanse studie waarin nog een cohort werd behandeld met de combinatie ATGAM, ciclosporine en Eltrombopag vanaf dag 1. De overall response rate op 6 maanden in dit cohort (117 patiënten) is 80%, het recidief-percentage na 4 jaar is rond de 40%51. In deze studie werd in 18% van de patiënten graad 3 of 4 levertoxiciteit gerapporteerd. Een potentieel risico van het gebruik van Eltrombopag bij patiënten met een beenmergaandoening is de uitgroei van een (pre)maligne cel kloon, met name met monosomie 7, wat geassocieerd is met het ontstaan van MDS of AML52. In de beide Amerikaanse studies ontwikkelde 6-8% van de patiënten een nieuwe cytogenetische afwijking, bij de meerderheid een monosomie 749,51. Dit percentage is vergelijkbaar met het percentage in een historisch controle cohort. In de RACE-studie ontwikkelde 3 van de 197 patiënten een cytogenetische afwijking. Naast cytogenetische veranderingen onderzocht de RACE-studie ook de aanwezigheid van somatische mutaties zowel bij diagnose als na behandeling. Hierbij werden geen verschillen aangetoond tussen de beide behandelgroepen17. Opgemerkt dient te worden dat de mediane tijd tot aan clonale evolutie met het daarbij gepaard gaande risico op het ontwikkelen van een secundaire maligniteit na behandeling met IST mogelijk langer is dan de huidige follow-up periode in de beschreven studies.
Naar de effectiviteit van de combinatie van konijn-ATG (Thymoglobuline) en ciclosporine bij aplastische anemie zijn vier prospectieve studies gedaan met in totaal 139 patiënten. Drie van deze studies45,47,48 lieten een lager responspercentage na zes maanden zien (37-45%). In de studies van Marsh en Afable was de korte termijn mortaliteit respectievelijk 29% en 12%. In de studie van Scheinberg werd gerandomiseerd tussen ATGAM en Thymoglobuline en deze studie toonde superioriteit van ATGAM wat betreft responspercentage na zes maanden (68% versus 37%) en wat betreft overleving na drie jaar (96% versus 76%). De vierde prospectieve studie toonde een responspercentage na zes maanden van 64%53. Daarnaast tonen meerdere retrospectieve studies naar de effectiviteit van Thymoglobuline als eerste lijn behandeling responspercentages na zes maanden variërend van 24 tot 73%54-62. Een aanzienlijk deel van deze studies vond plaats in Azië en betrof grotendeels kinderen. Een retrospectieve studie van Bacigalupo63 bundelt de gegevens van meerdere Europese en Aziatische studies waarin 955 patiënten met Thymoglobuline in eerste lijn behandeld werden. De respons na 6 maanden was met 52% lager dan de respons gevonden bij studies met ATGAM. De korte termijn mortaliteit (90 dagen) was in deze studie met 4% duidelijk lager vergeleken met de studies van Marsh en Afable. Een mogelijke verklaring ligt in het verschil van patiënten aantallen (35 Marsh, 20 Afable, 955 Bacigalupo) tussen de studies.
Zoekverantwoording
|
Database |
Zoekterm |
Datum |
Aantal hits |
|
Pubmed |
“anemia, aplastic”[MeSH Terms] AND “antilymphocyte serum”[MeSH Terms] |
09-06-2023 |
1119 |
|
Pubmed |
(“anemia, aplastic”[MeSH Terms] AND “antilymphocyte serum”[MeSH Terms]) AND (clinicaltrial[Filter] OR randomizedcontrolledtrial[Filter]) |
09-06-2023 |
136 |
|
Pubmed |
(“anemia, aplastic”[MeSH Terms] AND “thymoglobulin”[All Fields]) OR “rabbit atg”[All Fields] |
09-06-2023 |
263 |
Overwegingen
De werkgroep adviseert om ATGAM met ciclosporine vanaf dag 1 (Tabel 3) te gebruiken als eerste lijn IST bij volwassen patiënten met verworven aplastische anemie, op basis van de uitkomsten van de drie prospectieve NIH-studies en de analyse door Tjon van het NVvH register aplastische anemie26. Voor de definitie van respons zie tabel 4. Daarnaast toont een retrospectieve analyse in een groot gebundeld cohort bestaande uit patiënten uit Azië en Europa een lager respons percentage na 6 maanden ten opzichte van behandelresultaten met ATGAM als eerste lijn IST63.
Een veelbelovende toevoeging aan de eerste lijn behandeling lijkt Eltrombopag te zijn. Bij meerdere prospectieve studies, waaronder de gerandomiseerde RACE trial, liggen de responspercentages na 6 maanden hoger dan met ATGAM en ciclosporine alleen. Daar staat tegenover dat er geen toegevoegde waarde op overall survival lijkt te bestaan17 en dat Eltrombopag de recidiefkans niet verlaagt51. Mogelijk is de follow-up van de meest recente studies met respectievelijk 2 en 4 jaar te beperkt om nadelige lange termijn effecten van het gebruik van Eltrombopag te beoordelen. De werkgroep adviseert op basis van bovenstaande om Eltrombopag niet standaard toe te voegen aan eerste lijn IST met ATGAM en ciclosporine. Hier kan uiteraard op individuele basis van worden afgeweken wanneer het gewenst is snel herstel van de bloedwaarden te verkrijgen, zoals bij een zeer ernstige aplastische anemie met een ernstige actieve infectie bij start van IST of bij hoog infectierisico of bloedingsrisico. Overwogen kan worden om in die gevallen Eltrombopag kort na start van ATGAM en ciclosporine toe te voegen.
|
Tabel 3. Behandelschema IST |
||
|
ATGAM (paard-ATG) |
40 mg/kg/dag i.v. |
dag 1-4 |
|
ciclosporine* |
5 mg/kg/dag p.o |
Dag 1 tot minimaal 6 maanden, te verlengen tot 12 maanden. Langzaam afbouwen na stabilisatie van respons |
|
Prednison |
1 mg/kg/dag i.v. |
dag 1-4 |
|
Prednison |
1 mg/kg/dag p.o |
dag 5-14, hierna afbouwen tot stop in 14 dagen |
* Streefwaarde serum dalspiegel: 200-300mg/L.
Bij patiënten 60 jaar en ouder streefwaarde serum dalspiegel: 150-200mg/L
|
Tabel 4. Definitie respons na IST |
|
|
Complete respons |
Normalisatie van het bloedbeeld |
|
Partiële respons |
Neutrofielen > 0.5 x 109/L en transfusie onafhankelijkheid |
Uitgangsvraag
Welk alternatief is er voor ciclosporine bij eerstelijns immunosuppressieve therapie indien er sprake is van een contra-indicatie, intolerantie of ernstige toxiciteit?
Aanbeveling
In geval van intolerantie kan tacrolimus gebruikt worden als alternatief voor ciclosporine
Onderbouwing
In 2021 werd een retrospectieve case studie gepubliceerd over 30 patiënten waarvan 20 werden behandeld met paard ATG in combinatie met ciclosporine en 10 met paard-ATG in combinatie met Tacrolimus64. Bij 16 patiënten werd Eltrombopag na 3 weken toegevoegd aan de behandeling, 8 (37%) in de ciclosporine groep en 8(82%) in de tacrolimus groep. Elf patiënten uit de ciclosporine groep werden overgezet op tacrolimus in verband met toxiciteit door ciclosporine. Toxiciteit betrof met name nefrotoxiciteit waarbij geen significant verschil tussen beide behandelingen. In 2009 werd een retrospectieve studie bij kinderen verricht waarbij de combinatie paard-ATG in combinatie met tacrolimus (8 patiënten) werd vergeleken met historische groep met paard-ATG in combinatie met ciclosporine (13 patienten). Overall response rate was gelijk in beide groepen (80%)65.
Op basis van deze kleine retrospectieve studies en expert opinion kan in geselecteerde gevallen tacrolimus worden gebruikt als alternatief voor ciclosporine. Er is geen consensus over de na te streven dalspiegel. Op basis van expert opinion is een dalspiegel tussen de 5 en 15 µg/L een leidraad. Bij persisterende nefrotoxiciteit onder tacrolimus, zou sirolimus of mycofenolaatmofetil overwogen kunnen worden (expert opinion op basis van anekdotische data).
Uitgangsvraag
Wat te doen met ciclosporine bij patiënten die zes maanden na start van immunosuppressieve therapieresponderen?
Aanbeveling
Indien de toxiciteit van de ciclosporine dit toe laat adviseert de werkgroep om de ciclosporine dosering bij een stabiele hematologische respons per maand af te bouwen met 25-50 mg.
Onderbouwing
Van oudsher wordt in de meeste Europese centra de ciclosporine na bereiken van een stabiele hematologische respons vanaf zes tot twaalf maanden geleidelijk afgebouwd met als doel recidief ziekte te voorkomen. Een deel van de patiënten lijkt een minimale hoeveelheid ciclosporine nodig te hebben voor een aanhoudende stabiele respons. In de Verenigde Staten werd tot recent de ciclosporine na zes maanden geheel gestaakt49. Indien tijdens het afbouwen of na staken van de ciclosporine een verslechtering van de bloedwaarden optreedt, wordt de ciclosporine weer hervat in de dosering waarmee de laatste respons werd bereikt.
|
Conclusie |
SORT grade |
|
Indien er na zes maanden een respons is op ATG en ciclosporine adviseert de werkgroep om de ciclosporine te continueren zolang er nog een stijging is van de bloedwaarden. Indien de respons stabiliseert (in ieder geval 2 maanden) kan gestart worden met het afbouwen van de ciclosporine met 25-50 mg per maand. Indien tijdens het afbouwen van de ciclosporine een verslechtering van de bloedwaarden optreedt, kan de dosering weer worden opgehoogd. |
C |
Samenvatting literatuur
Resultaten
Er zijn twee studies gepubliceerd over het afbouwen van ciclosporine. Een retrospectieve studie vergeleek binnen een cohort kinderen de kans op recidief bij snel of langzaam afbouwen van de ciclosporine66. Aangezien het niet duidelijk is op basis waarvan de beslissing werd genomen om snel dan wel langzaam af te bouwen is deze vergelijking niet goed te interpreteren. Wel blijkt dat uiteindelijk 18% van de patiënten voor een aanhoudende respons afhankelijk blijft van een lage dosis ciclosporine om adequate bloedwaarden te behouden66. Scheinberg publiceerde de uitkomsten van een prospectieve studie van de NIH waarin ciclosporine in 18 maanden werd afgebouwd en vergeleek de resultaten met een historisch controle cohort waarin de ciclosporine abrupt werd gestaakt na 6 maanden67. Het cumulatieve terugval-percentage was vergelijkbaar in de twee cohorten (33-36% op 5 jaar). Echter, de mediane tijd tot terugval in de bloedwaarden was korter in het historische controle cohort waarbij de ciclosporine abrupt werd gestaakt (1 jaar versus 2 jaar na start behandeling)67. Vergelijkbaar met de eerste studie, blijft in deze studie uiteindelijk 15% van de patiënten afhankelijk van ciclosporine. In de studie van de NIH waarin Eltrombopag werd toegevoegd aan eerste lijn IST, bleek dat wanneer na zes maanden de ciclosporine samen met de Eltrombopag werd gestaakt het terugval-percentage 54% bedroeg. Op basis hiervan werd het protocol tijdens de studie aangepast zodat de ciclosporine nog tot twee jaar in lagere dosis doorgegeven kon worden waarna het recidief percentage daalde naar 14% 49.
Zoekverantwoording
|
Database |
Zoektermen |
Datum |
Aantal hits |
|
Pubmed |
“anemia, aplastic”[MeSH Terms] AND “cyclosporine”[MeSH Terms] AND “dosage”[All Fields] |
17-04-2023 |
183 |
Overweging
Er zijn geen prospectieve vergelijkende studies gedaan in patiënten die responderen op ATG en ciclosporine waarin het abrupt stoppen van de ciclosporine vergeleken wordt met het geleidelijk afbouwen. De kans op een recidief lijkt op basis van de studie van Scheinberg niet toegenomen bij het abrupt staken. Bij beide strategieën lijkt uiteindelijk ongeveer 15% van de patiënten ciclosporine afhankelijk te blijven. In de Europese behandelprotocollen wordt van oudsher de ciclosporine geleidelijk afgebouwd. Uit gegevens van het Nederlandse AA register blijkt dat er bij een aantal patiënten nog een duidelijke verbetering van de hematologische respons optreedt wanneer de ciclosporine langer dan zes maanden wordt gecontinueerd. Daarom adviseert de werkgroep om de ciclosporine na het behalen van een stabiele respons deze nog minimaal 2 maanden in maximale dosis te continueren en daarna geleidelijk af te bouwen met 25-50 mg per maand. Mediaan zal dit betekenen dat afbouwen na 6 tot 12 maanden start. Hiermee volgen we ook de Britse richtlijnen25. Wanneer tijdens het afbouwen van de ciclosporine een verslechtering van de bloedwaarden optreedt, kan de dosering waaronder de bloedwaarden stabiel waren worden hervat. Indien er sprake is van ernstige ciclosporine toxiciteit kan dat reden zijn om de ciclosporine sneller af te bouwen of eerder te staken.
Uitgangsvraag
Is eerste lijn immunosuppressieve therapie effectief en veilig bij patiënten met verworven aplastische anemie ouder dan 60 jaar?
Aanbeveling
Behandeling met ATGAM in combinatie met ciclosporine vanaf dag 1 is ook voor patiënten met verworven aplastische anemie van 60 jaar of ouder de preferente eerste lijn behandeling.
Onderbouwing
De incidentie van aplastische anemie boven de leeftijd van 60 jaar neemt toe. Vanwege verhoogde kans op mortaliteit en morbiditeit is niet een alloHSCT 68 maar IST de preferente eerste lijn behandeling voor deze patiënten. Het aantal studies dat gericht kijkt naar de veiligheid en effectiviteit van IST met ATGAM voor patiënten met aplastische anemie van 60 jaar of ouder is echter beperkt.
|
Conclusie |
SORT grade |
|
Eerste lijn behandeling met ATGAM in combinatie met ciclosporine leidt bij 50-70% van de patiënten van 60 jaar of ouder tot een respons (transfusie onafhankelijkheid en granulocyten > 0.5 x 109/L) 3,26,69-71. |
B |
|
ciclosporine monotherapie kan tot een respons leiden bij patiënten met niet-ernstige aplastische anemie72. Indien wordt afgezien van behandeling met ATGAM kan ook bij ernstige aplastische anemie ciclosporine monotherapie worden overwogen. |
C |
Samenvatting literatuur
Resultaten
Er zijn slechts enkele studies beschikbaar die gericht de veiligheid en effectiviteit van IST met ATGAM of Lymphoglobulin bij patiënten van 60 jaar of ouder evalueren. De studies betreffen met name retrospectieve studies, of prospectieve cohortstudies waarbinnen een klein aantal patiënten 60 jaar of ouder zijn. Tevens is er veel variatie in samenstelling en dosering van de IST. De kans op respons 6 maanden na behandeling met paard-ATG (ATGAM of Lymphoglobulin) in combinatie met ciclosporine is bij patiënten van 60 jaar of ouder vergelijkbaar met de respons van volwassenen onder de 60 jaar; namelijk 50 tot 70% 3,26,69-71. ATGAM lijkt bij oudere patiënten vaker tot cardiale toxiciteit te leiden26,70,71. Hoewel een van deze kleine studies een associatie tussen hogere Charlson comorbidity index bij diagnose en mortaliteit suggereert71, is een duidelijke correlatie tussen het bestaan van co-morbiditeit voorafgaand aan de behandeling met ATGAM en het optreden van toxiciteit niet aantoonbaar. In de recente RACE-studie waarin het toevoegen van Eltrombopag aan eerste lijn IST bestaande uit ATGAM en Ciclosporine werd onderzocht waren 46 van de 197 patiënten ouder dan 6517. Deze studie toonde aan dat leeftijd <40 jaar geassocieerd is met een betere respons op IST. Er werd echter geen subanalyse verricht naar de patiënten > 65 jaar. Een prospectieve single-arm studie van 14 oudere patiënten uit drie centra in Engeland wees uit dat behandeling met laag-gedoseerd Lymphoglobulin als monotherapie goed werd verdragen. Echter, slechts 1 van de 14 patiënten bereikte een partiële respons na 6 maanden73. Een studie wees uit dat ATGAM in een lagere dosering (15mg/kg/dag dag1-5) mogelijk even effectief is in combinatie met ciclosporine als de standaarddosering ATGAM (40mg/kg/dag dag1-4)74. In een prospectieve gerandomiseerde studie van de EBMT waarin patiënten met niet-ernstige aplastische anemie worden behandeld met ATG (Lymphoglobulin) in combinatie met ciclosporine of met ciclosporine monotherapie, bereikt 46% van de patiënten een respons met ciclosporine monotherapie72. Momenteel onderzoekt de SOAR-studie (NCT02998645) de effectiviteit en veiligheid van de combinatie Ciclosporine en Eltrombopag als eerste-lijn behandeling voor patiënten die niet in aanmerking komen voor transplantatie en waarbij ATGAM ongewenst wordt geacht.
Zoekverantwoording
|
Database |
Zoektermen |
Datum |
Aantal hits |
|
Pubmed |
(“Anemia, Aplastic”[Mesh] AND “Antilymphocyte Serum”[Mesh]) AND “Aged”[Mesh] |
17-04-2023 |
229 |
Overweging
Op basis van de beschikbare gegevens in de literatuur, internationale richtlijnen en expert opinies, is de werkgroep van mening dat leeftijd geen absolute contra-indicatie is voor ATGAM in combinatie met ciclosporine bij oudere patiënten met aplastische anemie. Tevens is er onvoldoende bewijs dat ernstige bijwerkingen als gevolg van ATGAM gecorreleerd zijn aan pre-existente co-morbiditeit.
In verband met een hogere kans op ciclosporine-geassocieerde toxiciteit bij oudere patiënten kan overwogen worden een lagere ciclosporinespiegel (150-200 µg/L) na te streven. De werkgroep adviseert de behandelkeuze per individu af te wegen. Indien besloten wordt niet te behandelen met ATGAM, kan worden gekozen voor ciclosporine monotherapie omdat de verwachting is dat deze behandeling ook bij patiënten met een ernstige aplastische anemie tot een respons kan leiden. Over de combinatie Ciclosporine en Eltrombopag als eerste-lijn als alternatief voor ATGAM-bevattende IST zijn nog onvoldoende gegevens om tot een advies te komen.
Uitgangsvraag
Wat is een geschikte behandeling in geval van refractaire ziekte of recidief ziekte na eerdere behandeling met ATGAM in combinatie met ciclosporine?
Aanbevelingen
Onderbouwing
Inleiding
Indien een patiënt 6 maanden na IST bestaande uit ATGAM in combinatie met ciclosporine niet voldoet aan de criteria voor een respons (transfusie onafhankelijk en granulocyten aantal > 0.5 x 109/l) kunnen verschillende mogelijkheden worden overwogen. Als de transfusie-behoefte is afgenomen en het aantal granulocyten > 0.5 x 109/l is in afwezigheid van infectieuze complicaties, kan er besloten worden de ciclosporine te continueren en verder herstel van het bloedbeeld af te wachten. In geval van recidief ziekte na eerdere respons op ATGAM en ciclosporine wordt geadviseerd in eerste instantie de ciclosporine dosering te hervatten waaronder de bloedwaarden stabiel waren. Echter, bij patiënten met een (zeer) ernstige aplastische anemie en afwezige respons 6 maanden na start van de IST of bij recidief ziekte die onvoldoende reageert op her-introductie van ciclosporine is het van belang om zo snel mogelijk een passende tweede lijn behandeling te starten vanwege de aanzienlijke infectieuze mortaliteit in deze patiëntencategorie. Hierbij kan een keuze gemaakt worden tussen Eltrombopag (toegevoegd aan de ciclosporine of als monotherapie), IST op basis van Thymoglobuline (indien de eerste kuur ATGAM betrof) of een alloHSCT. Mogelijk is er ook een plaats voor danazol of alemtuzumab als tweede lijn behandeling.
|
Conclusie |
SORT grade |
|
Onder continueren van ciclosporine kan in sommige gevallen na een behandelduur langer dan 6 maanden alsnog transfusieonafhankelijkheid optreden (NVvH bestand, ongepubliceerde data) |
C |
|
Na tweede lijn behandeling met Eltrombopag treedt bij 40% van de patiënten verbetering op in minimaal 1 cellijn 52. |
B |
|
Respons na tweede lijn behandeling met konijn-ATG in geval van refractaire ziekte na eerste lijn behandeling met ATGAM is 30%. 75,76 |
B |
Samenvatting literatuur
Ciclosporine
Uit een analyse van gegevens in het NVvH register blijkt dat bij een deel van de patiënten alsnog transfusieonafhankelijkheid optrad na continueren van de ciclosporine langer dan 6 maanden. De reden om af te zien van tweede lijn IST was een lage transfusiefrequentie of slechte performancestatus. In geval van recidief ziekte na eerdere respons op ATGAM en ciclosporine wordt geadviseerd in eerste instantie de ciclosporine dosering te hervatten waaronder de bloedwaarden stabiel waren
Eltrombopag
In een prospectieve studie werden 43 patiënten met refractaire aplastische anemie na minimaal 1 lijn ATG-bevattende therapie behandeld met Eltrombopag52. De mediane tijd tussen de laatste lijn behandeling en de start van Eltrombopag was 9 maanden. 12 weken na het starten van de Eltrombopag trad een verbetering op in minimaal 1 cellijn bij 40% van de patiënten. Negen patiënten (21%) werden transfusie onafhankelijk en voldeden niet meer aan de criteria voor een ernstige aplastische anemie. Bij een deel van deze patiënten kon de Eltrombopag gestaakt worden met behoud van respons. Acht van de 43 patiënten ontwikkelden cytogenetische afwijkingen gedurende de behandeling met Eltrombopag52. In een vervolgstudie van 40 patiënten refractair na 1 of 2 lijnen behandeling trad in 50% van de patiënten na 6 maanden een respons op77. Er werd geen duidelijke relatie tussen Eltrombopag en het ontwikkelen van cytogenetische afwijkingen gevonden. Een lagere startdosering (25 mg per dag) is aanbevolen bij patiënten van Aziatische afkomst vanwege de grotere kans op toxiciteit als gevolg van tragere afbraak van Eltrombopag78.
Tweede kuur met ATG
In geval van refractaire ziekte na ATGAM kan behandeling met Thymoglobuline (konijn-ATG) in 30% van de gevallen alsnog tot een respons leiden75,76. Een derde behandeling met ATG is in geval van refractaire ziekte na twee eerdere cycli met ATG niet zinvol gebleken 79. Indien als tweede lijn konijn-ATG wordt gebruikt in geval van een recidief ziekte na eerdere respons op ATGAM is de kans op respons ongeveer 65%76. Er is niets bekend over de effectiviteit van een tweede ATGAM kuur indien er geen respons was na een eerste kuur. Bovendien kunnen er anti-paard antistoffen zijn ontstaan na een eerste behandeling met ATGAM, wat de uitkomsten negatief kan beïnvloeden.
Zoekverantwoording
|
Database |
Zoektermen |
Datum |
Aantal hits |
|
Pubmed |
“Anemia, Aplastic”[Mesh] AND refractory AND treatment |
14-02-2024
|
528 |
|
Pubmed |
“Anemia, Aplastic”[Mesh] AND “Salvage Therapy”[Mesh] |
14-02-2024 |
102 |
Overwegingen
Op basis van de beschikbare literatuur en expert opinies concludeert de werkgroep dat in geval van refractaire aplastische anemie 6 maanden na ATGAM in combinatie met ciclosporine een passende vervolg behandeling dient te worden gegeven. In geval van ernstige neutropenie of hoge transfusie behoefte is het advies om zonder vertraging te behandelen met een alloHSCT, Eltrombopag (toegevoegd aan ciclosporine of als monotherapie) of een kuur met konijn-ATG. Wanneer er geen of milde neutropenie bestaat en de transfusiefrequentie laag is, kan worden overwogen het beloop af te wachten onder continueren van de ciclosporine en eventueel in een later stadium Eltrombopag of tweede lijn behandeling met konijn-ATG te starten. Bij de keuze voor één van de behandelmogelijkheden dient altijd de performancestatus van de patiënt te worden meegewogen.
Er zijn geen studies bekend die continueren van de ciclosporine in geval van refractaire ziekte beschrijven. Op basis van de tot nu toe beschikbare gegevens in het NVvH register is de werkgroep van mening dat in geval van lage transfusiefrequentie of slechte performancestatus het continueren van de ciclosporine te overwegen is omdat dit in enkele gevallen alsnog tot transfusieonafhankelijkheid kan leiden (NVvH register voor aplastische anemie, ongepubliceerde data). Het is niet duidelijk of verbetering van het bloedbeeld lange tijd na start van de behandeling een causaal verband heeft met de gegeven ATG, of dat een dergelijke verbetering gezien moet worden in het kader van het natuurlijke beloop van de ziekte.
Eltrombopag is geregistreerd voor patiënten met aplastische anemie die refractair zijn op eerdere IST. Een punt van zorg is het beschreven risico op het ontwikkelen van cytogenetische afwijkingen tijdens het gebruik van Eltrombopag52. Het is echter onvoldoende duidelijk of de cytogenetische afwijkingen ontstonden als gevolg van de aplastische anemie of als gevolg van de Eltrombopag. Recente studies waarbij Eltrombopag werd toegevoegd aan eerste lijn behandeling met ATGAM en ciclosporine toonde gedurende de beschikbare follow-up duur van 2-4 jaar geen verhoogde incidentie van cytogenetische afwijkingen17,49,51. Vanwege de veelbelovende responspercentages zowel als monotherapie bij refractaire ziekte als in eerste lijn behandeling toegevoegd aan standaard IST adviseert de werkgroep om bij refractaire ziekte op 6 maanden eltrombpag te starten als monotherapie of toe te voegen aan de behandeling met ciclosporine.
Twee studies tonen een respons van ongeveer 30% na tweede lijn behandeling met Thymoglobuline (konijn-ATG) in combinatie met ciclosporine75,76. De werkgroep adviseert in geval van een tweede lijn behandeling met ATG te behandelen met Thymoglobuline vanwege mogelijke aanwezigheid van anti-paard-ATG antistoffen na eerder behandeling met ATGAM. Een nadeel van Thymoglobuline kan zijn dat er anti-konijn-ATG antistoffen kunnen ontstaan. De aanwezigheid van anti-konijn-ATG antistoffen vergroot de kans op serumziekte, acute graft-versus-host reactie en transplantaatfalen wanneer patiënten als volgende lijn behandeling een alloHSCT ondergaan met Thymoglobuline als onderdeel van het conditioneringsschema80. De werkgroep ziet om die reden alleen een plaats voor Thymoglobuline als een alloHSCT niet mogelijk of niet gewenst is.
Tenslotte is uit meerdere studies gebleken dat een derde lijn met immunosuppressieve therapie (paard-ATG, konijn-ATG, alemtuzumab) niet tot een additionele respons leidt75,79.
Overige immunosuppressieve behandeling
Uitgangsvraag
Welke andere immunosuppressieve therapieën kunnen overwogen worden?
Aanbevelingen
|
Conclusie |
SORT grade |
|
Respons na eerste lijn en tweede lijn behandeling met alemtuzumab is respectievelijk 19% en 37%75 |
B |
|
Androgenen kunnen in een minderheid van de refractaire patiënten leiden tot een respons81 |
C |
|
Behandeling met cyclofosfamide is geassocieerd met hogere incidentie van mortaliteit kort na behandeling en het optreden van ernstige fungale infecties82-84 |
B |
Samenvatting Literatuur
Alemtuzumab:
In een studie van de NIH werden onbehandelde patiënten gerandomiseerd voor behandeling met paard-ATG, Thymoglobuline of Alemtuzumab. Responspercentage in de alemtuzumab arm op 6 maanden was 19%75. Daarnaast werden patiënten met refractaire aplastische anemie na eerdere behandeling met paard-ATG in combinatie met ciclosporine gerandomiseerd voor behandeling met Thymoglobuline in combinatie met ciclosporine of voor behandeling met monotherapie alemtuzumab75. Het responspercentage 6 maanden na behandeling met alemtuzumab was 37% (n=27). De studie werd voortijdig beëindigd omdat er in een interim-analyse geen verschil was in het responspercentage tussen de Thymoglobuline-arm en de alemtuzumab-arm75. Bij patiënten die een relapse hadden na een eerdere respons na behandeling met paard-ATG trad bij 56% een respons op na tweede lijn behandeling met alemtuzumab75. In een studie van de EBMT werden 8 patiënten met refractaire ziekte behandeld met alemtuzumab in combinatie met ciclosporine. Bij 3 patiënten trad een partiële respons op85.
Androgenen
Er zijn diverse studies, die aantonen, dat androgenen van invloed zijn op telomeerlengte. Er wordt gesuggereerd dat bij patiënten met mutaties in genen die een rol spelen bij het in stand houden van adequate telomeerlengte behandeling met androgenen kan leiden tot een verhoging van telomerase activiteit86-88. In een fase 1-2 studie gepubliceerd in de NEJM in 2016 89 werd aangetoond, dat danazol bij patiënten met een telomeerziekte verlenging van de telomeren gaf. Bij de tussentijdse analyse van de eerste 12 patiënten werd een duidelijke afname van “telomeer-slijtage” waargenomen en werd verdere inclusie vroegtijdig gestaakt (op dat moment waren 27 patiënten geïncludeerd). Daarnaast laat een studie uit 201890 zien, dat danazol al dan niet in combinatie met IST, het aantal regulatoire T-cellen bij patiënten met aplastische anemie verhoogt waarbij een immuun-modulerende werking gesuggereerd wordt. Een Mexicaanse studie naar de effecten van behandeling met danazol (gemiddelde dagdosis 400 mg gedurende een periode van mediaan 1 jaar) bij 37 patiënten met een aplastische anemie voor wie geen donor of ATG beschikbaar was, toonde een responspercentage van 46%. De overleving na 5 jaar was 41%91. In een prospectieve studie in werden 13 patiënten die refractair waren of een recidief ontwikkelden na IST behandeld met 300 mg danazol gedurende 12 weken81. Alle patiënten voltooiden deze therapie zonder ernstige complicaties. Bij 3 van de 4 vrouwen en 2 van de 12 mannen was er een partiële respons.
Cyclofosfamide:
In een prospectieve cohortstudie werden 23 patiënten met refractaire aplastische anemie na ATG behandeling of na ciclosporine monotherapie behandeld met 50 mg/kg/dag cyclofosfamide gedurende 4 dagen82. Na een mediane duur van 11 maanden bereikte 48% een hematologische respons. Van de 23 patiënten ontwikkelden 10 een ernstige fungale infectie, waarvan 5 met fatale uitkomst82. Een gerandomiseerde studie voor eerste lijn behandeling van ernstige aplastische anemie waarin patiënten werden behandeld met cyclofosfamide in combinatie met ciclosporine of ATG in combinatie met ciclosporine werd vroegtijdig afgebroken vanwege onacceptabele toxiciteit in de cyclofosfamide-arm83.
Zoekverantwoording:
Er werd voor deze onderzoeksvraag gebruik gemaakt van de referenties van de vorige revisie van de richtlijn 2019 en expert opinion.
Overwegingen
Hoewel alemtuzumab niet wordt aanbevolen als eerste lijn behandeling vanwege het lage respons-percentage van 19%75, kan alemtuzumab wel worden overwogen als alternatieve IST bij refractaire aplastische anemie. Voor sommige patiënten kan een voordeel van behandeling met alemtuzumab zijn dat deze behandeling niet gecombineerd hoeft te worden met langdurig ciclosporine. Een nadeel is echter dat door langdurige lymfopenie de kans op infecties groter is. Behandeling van refractaire aplastische anemie met alemtuzumab dient op individuele basis te worden overwogen.
Er zijn aanwijzingen dat androgenen kunnen leiden tot verhoogde telomerase activiteit en daarmee verlenging van telomeren in patiënten met telomeerziekte89. Een kleine studie naar het gebruik van androgenen bij refractaire aplastische anemie leidde in slechts een minderheid van de gevallen tot transfusieonafhankelijkheid. Bovendien betrof het hier voornamelijk patiënten met niet-ernstige aplastische anemie81. De werkgroep adviseert behandeling met androgenen als eerste lijn behandeling alleen te overwegen bij patiënten die geen ATG of alloHSCT kunnen verdragen. Ook bij refractaire patiënten adviseert de werkgroep androgenen alleen te overwegen bij patiënten die andere tweede lijn behandeling niet verdragen of er onvoldoende op reageren.
Meerdere studies beschrijven een hogere incidentie van ernstige fungale infecties als gevolg van de langdurige neutropenie en meer vroege mortaliteit na behandeling met cyclofosfamide82-84. Om die reden raadt de werkgroep, ondanks het responspercentage van bijna 50%, het gebruik van cyclofosfamide in zowel eerste als tweede lijn behandeling af.
Aplastische anemie en zwangerschap
Uitgangsvraag
Hoe dient te worden omgegaan met zwangerschapswens en zwangerschap bij vrouwelijke patiënten met verworven aplastische anemie na immunosuppressieve behandeling?
Aanbevelingen
Onderbouwing
Bijzondere aandacht dient te worden besteed aan vrouwelijke patiënten met verworven aplastische anemie die na behandeling met IST een zwangerschapswens hebben. Zwangerschap na IST kan leiden tot een recidief van de aplastische anemie. Recidief aplastische anemie en/of PNH tijdens de zwangerschap is geassocieerd met negatieve maternale en neonatale uitkomsten.
|
Conclusie |
SORT Grade |
|
Vrouwelijke aplastische anemie patiënten die na IST zwanger worden hebben een kans op een recidief aplastische anemie tijdens de zwangerschap 92 |
C |
Samenvatting literatuur
Resultaten
Vrouwelijke aplastische anemie patiënten die na IST zwanger worden hebben een kans op een recidief aplastische anemie tijdens de zwangerschap. In een retrospectieve studie uit 2002 van de EBMT Severe Aplastic Anemia Working Party worden 36 zwangere vrouwen na IST beschreven92. Van deze patiënten ontwikkelden 7 een recidief. Voor de zwangerschap hadden 2/7 patiënten een complete response, 4 patiënten een partiele response en 1 patiënte PNH met trombopenie. Drie patiënten herstelden spontaan na de partus, vier patiënten kregen een tweede maal IST. Drie patiënten herstelden na een tweede maal IST. Een patiënte was refractair op de tweede lijn behandeling en overleed 1 jaar na de behandeling. Bij 5 andere patiënten was sprake van een geïsoleerde trombocytopenie waarvoor transfusie noodzakelijk was rondom de partus. Na de partus, trad spontaan herstel van de trombopenie op bij alle 5 patiënten. In het gehele cohort werden 5 kinderen 2-4 weken te vroeg geboren, bij een kind was er sprake van neonatale allo-immuun trombopenie. De postnatale ontwikkeling was normaal in alle kinderen. Bij patiënten met een ongecompliceerde zwangerschap was er voor aanvang van de zwangerschap sprake van een betere remissiestatus (cr 8 vs. 2, PR 11 vs. 8, PNH 0 vs. 4, p = 0.0248), een hoger trombocytengetal (99 vs 19 x 10^9/l, p < 0.001) en een hoge neutrofielen getal (4.6 vs. 2.4 g/l).
Zoekverantwoording
Er werd gebruik gemaakt van de literatuurreferenties uit de vorige versie van deze richtlijn (2019). Daarnaast werd een search gedaan in Pubmed voor de periode van de afgelopen 10 jaar. Deze is hieronder weergegeven. Case reports werden geexcludeerd. Uiteindelijk werden 8 retrospectieve studies (Chen et al.93, Shin et al.94, Bo et al.95, Tichelli et al.92, Ma et al.96 Kwon et al.97 Deka et al.98, Choudry et al.99) en 1 richtlijn (Kulasekararaj et al.25) geïncludeerd. Daarnaast werd er gebruik gemaakt van expert-opinie en de mening van de werkgroepleden.
Search: pregnancy aplastic anemia Filters: in the last 10 years
|
Database |
Zoektermen |
Aantal hits |
|
Pubmed |
((“pregnancy”[MeSH Terms] OR “pregnancy”[All Fields] OR “pregnancies”[All Fields] OR “pregnancy s”[All Fields]) AND (“aplastic anaemia”[All Fields] OR “anemia, aplastic”[MeSH Terms] OR (“anemia”[All Fields] AND “aplastic”[All Fields]) OR “aplastic anemia”[All Fields] OR (“aplastic”[All Fields] AND “anemia”[All Fields]))) AND ((y_10[Filter]) AND (2013:2023[pdat])) |
92 |
Overwegingen
Op basis van de verschillende studies, richtlijnen en expert opinies adviseert de werkgroep om vrouwelijke patiënten voor te lichten over de kans op recidief ziekte na behandeling met IST, tijdens zwangerschap en de daarbij behorende kans op maternale en neonatale complicaties gedurende de zwangerschap en partus. Bij zwangerschapswens adviseert de werkgroep om de aanwezigheid van een PNH kloon te bepalen omdat dit mogelijk consequenties heeft voor behandeling met antistolling en/of complementremming tijdens de zwangerschap. Voor de adviezen met betrekking tot PNH rondom de zwangerschap verwijzen we naar de PNH richtlijn. Tijdens de zwangerschap is frequente controle in deze patiëntengroep geïndiceerd.
Uitgangsvraag
Hoe dient te worden omgegaan met actieve aplastische anemie tijdens de zwangerschap.
Aanbevelingen
Onderbouwing
Aplastische anemie en/of PNH tijdens de zwangerschap is geassocieerd met negatieve maternale en neonatale uitkomsten.
|
Conclusie |
SORT Grade |
|
Aplastische anemie tijdens de zwangerschap is geassocieerd met negatieve maternale en neonatale uitkomsten 92,93,96 |
C |
|
Ernstige trombopenie (< 20 x 10^9/L) gedurende de zwangerschap is geassocieerd met meer obstetrische complicaties (OR 6.8, 95%CI: 2.1-22, p =0.001) zoals (pre-) eclampsie en vroegtijdige bevalling 94,95. |
C |
Samenvatting literatuur
Resultaten
Een studie uit 201695 beschreef 60 zwangere vrouwen met aplastische anemie (waarvan 32 de diagnose kregen tijdens de zwangerschap en 28 de diagnose voor de zwangerschap). Bij 17% was er sprake van een ernstige aplastische anemie, behandeling bestond uit transfusies in 77%. Bij 83% van de zwangerschappen was er sprake van complicaties waaronder: zwangerschapsdiabetes, vroegtijdige bevalling, pre-eclampsie, post-partum bloeding en infectie; 5 neonaten overleden, 27% was prematuur). Risicofactoren voor maternale en foetale complicaties waren anemie (< 4 mmol/L) en trombopenie (< 20×10^9/L). Een andere studie94toonde ook aan dat ernstige trombopenie (< 20 x 10^9/L) gedurende de zwangerschap geassocieerd is met meer transfusies (73 vs. 15%, p < 0.001) en meer obstetrische complicaties zoals (pre-) eclampsie en vroegtijdige bevalling (OR 6.8, 95%CI: 2.1-22, p =0.001).
Een retrospectieve studie uit 201793 beschreef de resultaten van 18 zwangerschappen in vrouwen met ernstige aplastische anemie met ondersteunende behandeling. Een zwangerschap werd met 22 weken afgebroken in verband met een ernstig oligohydramnion. Bij de overige 17 zwangerschappen was er sprake van vroeggeboorte in 41%, laag geboortegewicht in 12%, pre-eclampsie in 6% en vroegtijdig gebroken vliezen in 18%. Alle neonaten ontwikkelden zich zonder complicaties. Een gepoolde analyse van data in de literatuur 97-99 van 36 zwangerschappen toonde aan dat een laag trombocytengetal, een hypocellulair beenmerg en een diagnose laat in de zwangerschap, voorspellers waren van slechte maternale uitkomst (9/26 patiënten: geen response of overleden). Een recente studie uit 2023 96 beschreef 30 zwangere vrouwen met aplastische anemie en vergeleek de uitkomsten met 30 zwangere vrouwen zonder aplastische anemie. In de patiënten met aplastische anemie was er bij de neonaten sprake van meer vroeggeboortes (53% vs. 3,3%, p < 0.001), een lager geboortegewicht (2,7 kg vs. 3,3 kg, p < 0.001) en meer opnames op de NICU (53% vs. 17%, p = 0.003). Er waren significant meer sectio’s in de groep patiënten met aplastische anemie (100% vs. 43%, p < 0.001).
In de retrospectieve studie van de EBMT werden drie patiënten gedurende de zwangerschap behandeld met ciclosporine zonder nadelig effect op het kind, behoudens 1 vroeggeboorte 92. Een grote studie naar zwangere patiënten die chronisch ciclosporine gebruikten in verband met een orgaantransplantatie wees uit dat ciclosporine kan leiden tot groeivertraging in utero en mogelijk tot verstoorde ontwikkeling van het immuunsysteem 100. Ondersteunende behandeling met transfusies is de preferente behandeling in geval van aplastische anemie tijdens de zwangerschap25.
Zoekverantwoording
Er werd gebruik gemaakt van de literatuurreferenties uit de vorige versie van deze richtlijn (2019). Daarnaast werd een search gedaan in Pubmed voor de periode van de afgelopen 10 jaar. Deze is hieronder weergegeven. Case reports werden geexcludeerd. Uiteindelijk werden 8 retrospectieve studies (Chen et al.93, Shin et al.94, Bo et al.95, Tichelli et al.92, Ma et al.96 Kwon et al.97 Deka et al.98, Choudry et al.99) en 1 richtlijn (Kulasekararaj et al.25) geïncludeerd. Daarnaast werd er gebruik gemaakt van expert-opinie en de mening van de werkgroepleden.
Search: pregnancy aplastic anemia Filters: in the last 10 years
|
Database |
Zoektermen |
Aantal hits |
|
Pubmed |
((“pregnancy”[MeSH Terms] OR “pregnancy”[All Fields] OR “pregnancies”[All Fields] OR “pregnancy s”[All Fields]) AND (“aplastic anaemia”[All Fields] OR “anemia, aplastic”[MeSH Terms] OR (“anemia”[All Fields] AND “aplastic”[All Fields]) OR “aplastic anemia”[All Fields] OR (“aplastic”[All Fields] AND “anemia”[All Fields]))) AND ((y_10[Filter]) AND (2013:2023[pdat])) |
92 |
Overwegingen
Op basis van de verschillende studies, richtlijnen en expert opinies adviseert de werkgroep om vrouwelijke patiënten met een aplastische anemie tijdens de zwangerschap voor te lichten over de kans op maternale en neonatale complicaties gedurende de zwangerschap en partus. De werkgroep adviseert om de aanwezigheid van een PNH kloon te bepalen omdat dit mogelijk consequenties heeft voor behandeling met complementremming tijdens de zwangerschap. Hierbij verwijzen wij ook naar de richtlijn PNH. Tijdens de zwangerschap is frequente controle in deze patiëntengroep geïndiceerd. De werkgroep is van mening dat in geval van actieve aplastische anemie tijdens de zwangerschap ondersteunende behandeling met transfusies de voorkeur heeft, met een trombocytentransfusie grens van > 20 x 10^9/L. Behandeling met ciclosporine in de zwangerschap kan in individuele gevallen worden overwogen.
Vaccinaties
Uitgangsvraag
Hoe om te gaan met vaccinaties na behandeling met immunosuppressieve therapie?
Aanbeveling
Onderbouwing
Er is een theoretisch risico op recidief ziekte na vaccinatie in patiënten na succesvolle behandeling met IST.
|
Conclusie |
SORT Grade |
|
Er zijn geen studies gedaan naar het effect van vaccinatie, anders dan tegen COVID-19, op recidief aplastische anemie |
– |
|
Er is geen overtuigend bewijs dat vaccinatie tegen COVID 19 een verhoogd risico geeft op recidief aplastische anemie101,102 |
B |
Samenvatting literatuur
Resultaten
Het theoretisch risico op recidief ziekte na vaccinatie in patiënten na succesvolle behandeling met IST, is gebaseerd op case reports en op de theorie dat een virale infectie een belangrijke trigger kan zijn in de ontwikkeling van aplastische anemie 103 In de Britse richtlijn werd daarom het geven van vaccinaties in patiënten met aplastische anemie, behandeld met IST afgeraden25.
Ook na vaccinaties tegen COVID19 zijn de novo en recidief aplastische anemie beschreven104. Maar ook COVID19 infecties zelf kunnen leiden tot verergering van of recidief ziekte 105. Daarnaast kunnen COVID19 infecties ernstiger verlopen in patiënten met aplastische anemie106. Bij een grote studie naar COVID19 vaccinaties van de EBMT 101 bij 361 patiënten met aplastische anemie en/of PNH, waarin ook 139 AA patiënten actief werden behandeld met IST, ontwikkelden 9 patiënten een recidief. Bij 6/9 patiënten was dit op het moment van afbouwen van de IST en bij 1 patiënt bleek er sprake van MDS. De auteurs concludeerden dat vaccinatie tegen COVID 19 veilig gegeven kon worden, vanwege de lage kans op recidief op aplastische anemie. In een kleine studie Nederlandse studie toonden 17 van de 18 aplastische anemie patiënten mediaan 11 jaar na behandeling met paarden-ATG een humorale respons en SARS-CoV-2 specifieke T cel respons na vaccinatie vergelijkbaar met de respons van gezonde donoren102. Er trad geen recidief aplastische anemie op in dit cohort.
Zoekverantwoording
Er werd een search gedaan in Pubmed voor de periode van de afgelopen 10 jaar. Deze is hieronder weergegeven. Case reports werden geexcludeerd. Uiteindelijk werden er 2 grotere retrospectieve studies geselecteerd101,102
Search: ((vaccination) AND (aplastic anemia)) NOT (case report) Filters: in the last 10 years
|
Database |
Zoektermen |
Aantal hits |
|
Pubmed |
(((“vaccin”[Supplementary Concept] OR “vaccin”[All Fields] OR “vaccination”[MeSH Terms] OR “vaccination”[All Fields] OR “vaccinable”[All Fields] OR “vaccinal”[All Fields] OR “vaccinate”[All Fields] OR “vaccinated”[All Fields] OR “vaccinates”[All Fields] OR “vaccinating”[All Fields] OR “vaccinations”[All Fields] OR “vaccination s”[All Fields] OR “vaccinator”[All Fields] OR “vaccinators”[All Fields] OR “vaccine s”[All Fields] OR “vaccined”[All Fields] OR “vaccines”[MeSH Terms] OR “vaccines”[All Fields] OR “vaccine”[All Fields] OR “vaccins”[All Fields]) AND (“aplastic anaemia”[All Fields] OR “anemia, aplastic”[MeSH Terms] OR (“anemia”[All Fields] AND “aplastic”[All Fields]) OR “aplastic anemia”[All Fields] OR (“aplastic”[All Fields] AND “anemia”[All Fields]))) NOT (“case reports”[Publication Type] OR “case report”[All Fields])) AND (y_10[Filter]). |
32 |
Overwegingen
Gebaseerd op de recente resultaten met COVID 19 vaccinaties ziet de werkgroep geen directe contra-indicatie voor vaccinaties met name omdat deze patiënten door de aandoening of door de behandeling immuun gecompromitteerd kunnen zijn. Het is aan te bevelen de baten en eventuele risico’s van vaccinaties voor onder andere influenza, pneumokokken en herpes zoster op individuele basis af te wegen.
Aplastische anemie en paroxismale nocturnale hemoglobinurie
Uitgangsvraag
Hoe om te gaan met de combinatie aplastische anemie en paroxismale nocturnale hemoglobinurie?
Aanbevelingen
Onderbouwing
Bij een aanzienlijk deel (tot > 50%) van de patiënten met aplastische anemie kan een PNH kloon worden aangetoond bij diagnose of in de loop van de tijd. Meestal gaat het om een kleine PNH kloon zonder tekenen van hemolyse. Soms is bij aplastische anemie echter sprake van een grotere PNH kloon met verhoogde hemolyseparameters en een verhoogd tromboserisico.
|
Conclusie |
SORT Grade |
|
Bij elke patiënt met aplastische anemie moet onderzoek gedaan worden naar de aanwezigheid van een PNH kloon (voor bepaling PNH kloon: zie richtlijn PNH).25,107-110 |
A-B |
|
Indien geen PNH kloon aanwezig is, dient het onderzoek naar een PNH kloon de eerste 2 jaar elke 6 maanden herhaald te worden. Indien de kloon negatief blijft, daarna jaarlijks. Indien wel een PNH kloon aanwezig is, dient de kloongrootte de eerste 2 jaar elke 3 maanden vervolgd te worden. Daarna, bij gelijkblijvende kloongrootte, elke 6 maanden.4,108,111,112 |
C |
|
De aanwezigheid van een kleine PNH kloon zonder tekenen van hemolyse beïnvloedt de keuze voor de behandeling van de aplastische anemie niet.4,109,113-115 |
C |
|
De aanwezigheid van een grote PNH kloon al dan niet met tekenen van hemolyse beïnvloedt de behandeling van de aplastische anemie zelf niet. Echter, naast behandeling van de aplastische anemie moet tevens behandeling gericht op (het voorkomen van complicaties van) de PNH overwogen worden (conform de richtlijn PNH)4,109,113-115 |
C |
Samenvatting literatuur
Resultaten
Beschikbare studies naar de aanwezigheid van een PNH kloon bij aplastische anemie tonen aan dat een PNH kloon bij circa 40-50% voorkomt bij aplastische anemie (met een spreiding van 22-68% op basis van de gebruikte testmethode 4,25,107,109,110,115.
Gedurende het beloop van de aplastische anemie kan een PNH kloon ontstaan of in grootte veranderen. Dit kan ook gebeuren na succesvolle behandeling van de aplastische anemie met IST bestaande uit ATG en ciclosporine. Frickhofen et al. stelden met de HAM test (minder gevoelig dan de tegenwoordig gebruikte flowcytometrie) PNH vast bij 5 van de 84 patiënten die waren behandeld voor aplastische anemie108. Scheinberg et al. vonden in hun cohort patiënten, dat ATG en ciclosporine ontving, dat bij 25% de PNH kloon in grootte toenam na deze behandeling (bij 15% een kloongrootte tot >50%)4.
Zoekverantwoording
Er werd gebruik gemaakt van de literatuurreferenties uit de vorige versie van deze richtlijn (2019). Daarnaast werd een search gedaan in Pubmed voor de periode van de afgelopen 10 jaar. Er werd 1 artikel toegevoegd waarin de incidentie van PNH bij SAA werd beschreven gemeten met hoog sensitieve flowcytometer. Ook werd er gebruik gemaakt van bestaande richtlijnen, reviews, expert-opinie en de mening van de werkgroepleden.
Search: follow up PNH aplastic anemia Filters: in the last 10 years
|
Database |
Zoektermen |
Aantal hits |
|
Pubmed |
((“follow”[All Fields] OR “followed”[All Fields] OR “following”[All Fields] OR “followings”[All Fields] OR “follows”[All Fields]) AND “up”[All Fields] AND “PNH”[All Fields] AND (“aplastic anaemia”[All Fields] OR “anemia, aplastic”[MeSH Terms] OR (“anemia”[All Fields] AND “aplastic”[All Fields]) OR “aplastic anemia”[All Fields] OR (“aplastic”[All Fields] AND “anemia”[All Fields]))) AND (y_10[Filter]). |
48 |
Overwegingen
Op basis van de beschikbare gegevens in de literatuur en conform internationale reviews en expert opinies, is er naar mening van de werkgroep voldoende grond om te concluderen dat er bij patiënten met aplastische anemie zowel bij diagnose als tijdens follow-up onderzoek gedaan moet worden naar de aanwezigheid van een PNH kloon. De frequentie waarbij dit onderzoek herhaald moet worden is gebaseerd op expert opinie en in lijn met de Britse richtlijn25.
Hoewel er aanwijzingen zijn in de literatuur dat patiënten met aplastische anemie en een PNH kloon mogelijk beter reageren op behandeling met IST dan patiënten met aplastische anemie zonder PNH kloon, is er op dit moment naar mening van de werkgroep geen reden om deze patiëntengroepen anders te behandelen.
Lange termijn follow-up na immunosuppressieve therapie
Uitgangsvraag
Hoe is de follow-up van patiënten met verworven aplastische anemie na immunosuppressieve therapie?
Aanbevelingen
Onderbouwing
Na behandeling met IST is er kans op recidief van de ziekte, het ontwikkelen van paroxismale nocturnale hemoglobinurie (PNH) of progressie naar een myelodysplastisch syndroom (MDS) of een acute myeloïde leukemie (AML). Patiënten dienen derhalve voor onbepaalde tijd onder controle te blijven om veranderingen in klinisch beeld en/of het bloedbeeld tijdig te kunnen ondervangen.
|
Conclusie |
SORT Grade |
|
Na het bereiken van een respons na IST met ATGAM en ciclosporine en of Eltrombopag ontwikkelt 24-40% van de patiënten een recidief aplastische anemie44,116,117 |
B |
|
Ongeveer 15% van de responderende patiënten ontwikkelt een MDS of AML118 116,117 |
B |
|
Aanwezigheid van een GPI-deficiënte celkloon kan uiteindelijk leiden tot overte PNH119 |
B |
Samenvatting literatuur
Resultaten
Herstel van het bloedbeeld na ATGAM neemt gemiddeld 6 maanden in beslag. Vaak zijn de eerste verbeteringen al na 3-4 maanden te zien. Na het bereiken van een respons na IST met ATGAM en ciclosporine ontwikkelt ongeveer 24-40% van de patiënten een recidief aplastische anemie44. Na 10 jaar ontwikkelt ongeveer 15 van de responderende patiënten een MDS of AML21,108,118. Drexler et al.117bekeek retrospectief de uitkomsten van 226 patiënten behandeld met IST (van 1973-2017) en rapporteerde een relapse incidentie van 24%, 25 jaar na diagnose. Klonale evolutie naar MDS/AML was 16%, ijzerstapeling ontstond bij 18% en cardiovasculaire complicaties in 11% van de patiënten. Ook het risico op het ontwikkelen van solide tumoren is verhoogd, waarbij een percentage van 11% gegeven wordt in een Duitse studie108 en een standard incidence ratio of non-myeloid malignancies van 2.4 (95%CI 1.3-3.8) in een Nederlandse studie 120.
Beenmergonderzoek dient te worden verricht indien er 6 maanden na start van de behandeling geen respons is. Het is aan te raden om bij verslechtering van het bloedbeeld het beenmergonderzoek te herhalen om onderscheid te maken tussen een recidief aplastische anemie en een secundaire MDS of AML. Het risico op het ontwikkelen van een hemolytische PNH is 10%44. Er dient in ieder geval jaarlijks te worden gescreend op het ontstaan van een GPI-deficiënte celkloon (ook PNH kloon genoemd) aangezien deze kan uitgroeien en leiden tot overte PNH119. Indien een GPI-deficiënte celkloon is aangetoond dient dit onderzoek frequenter herhaald te worden om eventuele progressie te vervolgen (zie ook de uitgangsvraag “Hoe om te gaan met de combinatie aplastische anemie en paroxismale nocturnale hemoglobinurie” elders in deze richtlijn).
Zoekverantwoording
Er werd gebruik gemaakt van de literatuurreferenties uit de vorige versie van deze richtlijn (2019). Daarnaast werd een search gedaan in Pubmed voor de periode van de afgelopen 10 jaar. Uit de 18 hits werden twee studies geselecteerd die lange termijn resultaten rapporteerden van patiënten die behandeld waren met IST met of zonder EPAG116,117. Ook werd er gebruik gemaakt richtlijnen, expert-opinie en de mening van de werkgroepleden.
Search: long term follow up aplastic anemia IST Filters: in the last 10 years
|
Database |
Zoektermen |
Aantal hits |
|
Pubmed |
(“long”[All Fields] AND (“term birth”[MeSH Terms] OR (“term”[All Fields] AND “birth”[All Fields]) OR “term birth”[All Fields] OR “term”[All Fields]) AND (“follow”[All Fields] OR “followed”[All Fields] OR “following”[All Fields] OR “followings”[All Fields] OR “follows”[All Fields]) AND “up”[All Fields] AND (“aplastic anaemia”[All Fields] OR “anemia, aplastic”[MeSH Terms] OR (“anemia”[All Fields] AND “aplastic”[All Fields]) OR “aplastic anemia”[All Fields] OR (“aplastic”[All Fields] AND “anemia”[All Fields])) AND “IST”[All Fields]) AND (y_10[Filter]). |
18 |
Overwegingen
Op basis van de beschikbare literatuur, internationale richtlijnen en expert opinies is de werkgroep van mening dat patiënten met verworven aplastische anemie na behandeling met IST voor onbepaalde tijd onder controle dienen te blijven vanwege de kans op recidief aplastische anemie, het ontwikkelen van PNH of het ontstaan van een secundaire hematologische of solide maligniteit. In tabel 5 wordt een leidraad gegeven voor de verrichtingen en frequentie van follow-up. Op basis van de kliniek dient aanvullend onderzoek plaats te vinden buiten de geadviseerde meetmomenten.
De werkgroep adviseert om beenmergonderzoek te verrichten indien 6 maanden na start van de behandeling geen verbetering van het bloedbeeld is opgetreden of indien er sprake is van verlies van respons. De frequentie van het bepalen van een GPI-deficiënte cel-kloon is gebaseerd op expert opinie en komt overeen met het advies zoals beschreven onder de uitgangsvraag “Hoe om te gaan met de combinatie aplastische anemie en paroxismale nocturnale hemoglobinurie” elders in deze richtlijn. In de meerderheid van de patiënten zijn de lymfocyten subsets binnen 3 weken na ATGAM hersteld. De werkgroep adviseert om de lymfocyten subsets te controleren tot voldoende herstel van de T cellen waarbij het te overwegen is om bij een CD4 getal >200 x106/L de antibiotische en antivirale profylaxe te staken18. Zoals aangegeven onder het kopje “profylactische antibiotica” zijn er geen gerichte studies naar profylactische maatregelen bij aplastische anemie.
|
Tabel 5. Follow-up na IST |
|||
|
Onderzoek |
Jaar 1 |
Jaar 2 |
Jaar 3 e.v. |
|
Volledig bloedbeeld, reticulocyten en leukocytendifferentiatie* |
op geleide van de bloedwaarden, in ieder geval iedere 3 maanden |
Iedere 3-6 maanden |
Minimaal 1x per jaar |
|
Lymfocyten subsets (T, B en NK cellen)** |
Iedere 3 maanden, tot aan herstel van CD4+T cellen >200 |
Op indicatie |
Op indicatie |
|
Chemie: nier- en leverwaarden***, haptoglobine |
maand 1: wekelijks maand 2-6: maandelijks maand 6-12: 1x per 3 maanden |
Iedere 6 maanden |
Op indicatie |
|
PNH kloon |
Indien geen
Indien wel
|
Indien geen
Indien wel
|
Indien geen
Indien wel
|
|
Virale load EBV/CMV |
Op indicatie |
Op indicatie |
Op indicatie |
|
Ciclosporine dalspiegel |
Op geleide van streefwaarde: 200-300mg/L (ouderen 150-200mg/L) |
Op indicatie |
Op indicatie |
|
Beenmergafname****:
|
Maand 6 indien er onvoldoende herstel van het bloedbeeld is opgetreden |
Bij verslechtering van het bloedbeeld |
Bij verslechtering van het bloedbeeld |
* Bij voldoende herstel van de neutrofielen (> 0.5 x 109/L) kan de antifungale profylaxe worden gestaakt
** Bij voldoende herstel van de T cellen (CD4 getal >200 x106/L) kan overwogen worden de antibiotische en antivirale profylaxe te staken
*** In verband met ciclosporine gerelateerde toxiciteit
**** Ter onderscheiding van refractaire aplastische anemie, relaps of evolutie naar MDS/leukemie
© 2022. Alle rechten voorbehouden