Terug naar het richtlijnenoverzicht
Waldenström’s Macroglobulinemie (WM) werd voor het eerst beschreven door de Zweedse arts Jan Gösta Waldenström (1906-1996) in 19441. In de nieuwste classificatie van de Wereldgezondheidsorganisatie wordt WM gedefinieerd als lymfoplasmacytair lymfoom (LPL) met betrokkenheid van het beenmerg en een monoklonale gammopathie van het type Immunoglobuline M (IgM)”. 2 LPL wordt gedefinieerd als “een neoplasma van kleine B-lymfocyten, plasmacytoïde lymfocyten en plasmacellen, meestal met beenmergbetrokkenheid en soms van lymfeklieren en milt, die niet voldoet aan de criteria voor een van de andere kleincellige maligne B-cel lymfomen met plasmacytaire uitrijping”. LPL omvat dus WM plus de zeldzame gevallen (<5%) zonder het IgM-paraproteïne. De resterende 5% van de patiënten heeft een LPL met IgA of IgG paraproteïnemie. Een niet-secernerende of lichte keten LPL is amper beschreven.
WM is zeldzaam en betreft slechts ongeveer 2% van alle gevallen van B-cel Non-Hodgkin Lymfomen (NHL). In Nederland worden ongeveer 250 nieuwe LPL / WM-patiënten per jaar gediagnosticeerd. De 10-jaars prevalentie (het aantal mensen dat in de 10 jaar voorafgaand de ziekte heeft gekregen en op de peildatum nog in leven is) in 2018 was 1904 personen (gebaseerd op IKNL, www.cijfersoverkanker.nl). De diagnose IgM MGUS zal vele malen vaker gesteld worden, al is de exacte epidemiologie in Nederland hiervan onbekend. IgM MGUS betreft ongeveer 15% van alle MGUS, en heeft een prevalentie van 0.54% bij personen van 50 jaar of ouder.
De meest voorkomende klinische presentatie en behandelindicatie van WM is anemie. Echter, een van de opvallende aspecten van WM in vergelijking met andere maligne lymfomen is de zeer uiteenlopende symptomatologie waarbij bijna alle orgaansystemen betrokken kunnen zijn. Dit heeft vooral te maken met het circulerende IgM eiwit, dat via allerlei routes tot schade kan leiden (bijvoorbeeld het hyperviscositeitssyndroom, depositie ziektes zoals amyloidose, of auto-immuun activiteit zoals bij anti-MAG neuropathie). Belangrijk is dat ook IgM MGUS via deze routes tot problemen kan leiden en dus soms ook behandeld moet worden. Daarvoor wordt de term “IgM gerelateerde ziekten” voor gebruikt. De prevalentie van IgM gerelateerde ziekten is niet bekend.
De belangrijkste ontwikkelingen op het gebied van WM sinds de eerste Nederlandse richtlijn voor WM in 2012 verscheen zijn: de ontdekking van hoogfrequente somatische mutaties in de MYD88 en CXCR4 genen; en de introductie/opmars van nieuwe geneesmiddelen (proteasoomremmers, bendamustine, ibrutinib). Mede door de zeldzaamheid van de ziekte zijn er weinig prospectieve trials waarmee we de rol van de verschillende geneesmiddelen, en de rol van deze mutaties voor de klinische praktijk kunnen vaststellen. Prospectieve onderzoeken naar nieuwe behandelingen en de incorporatie van moleculaire data blijven dus van belang. In deze nieuwe Nederlandse richtlijn beschrijven we adviezen voor de Nederlandse praktijk zoveel mogelijk gebaseerd op de bekende studie resultaten.
De sectie over de behandeling van eerste lijn en recidief WM werd in het najaar van 2021 aangepast naar aanleiding van enkele nieuwe publicaties.
Het doel van de richtlijn is, middels aanbevelingen een betere uniformiteit van diagnostiek en behandeling, een betere kwaliteit van zorg en uiteindelijk betere overleving en kwaliteit van leven voor WM patiënten in Nederland te bewerkstelligen. Deze richtlijn richt zich op diagnostiek, behandeling en response evaluatie van WM in de dagelijkse praktijk. Op IgM gerelateerde ziekten wordt beperkt ingegaan. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. De richtlijn is dus niet bedoeld als volledig leerboek. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst. Patiëntenvertegenwoordigers hebben de conceptversie van de richtlijn gelezen en commentaar kunnen aanleveren.
De werkgroep beveelt aan om de initiële diagnostiek te bespreken en het behandelplan te formuleren in een multidisciplinair overleg (MDO), waarbij minimaal aanwezig: hematoloog/oncoloog en patholoog met hematologische expertise. De werkgroep is van mening dat de patiënt opnieuw besproken dient te worden op het moment dat er een (nieuwe) behandelindicatie ontstaat. Dit geldt zowel voor patiënten met WM als voor patiënten met (verdenking) op IgM gerelateerde ziekte.
Deze richtlijn is bestemd voor professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met een WM, en richt zich vooral op internist-hematologen.
Samenstelling HOVON richtlijnwerkgroep WM
(subwerkgroep van Hovon Lymfoomwerkgroep)
Samenstelling HOVON richtlijnwerkgroep t.t.v. revisie 1.2:
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Leden van de werkgroep mogen niet participeren in nationale adviesraden van farmaceutische bedrijven. De belangenverklaringen kunt u via het secretariaat van de Nederlandse Vereniging voor Hematologie opvragen.
In onderstaande tabel wordt een overzicht gegeven van de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
J.K. Doorduijn |
Eli Lilly: advisory board |
|
M.C. Minnema |
Honoraria; Medscape, Janssen, BMS, Gilead, Alnylam Hospitality; Celgene |
|
L. Nieuwenhuizen |
Geen |
|
A.M.P. Demandt |
Geen |
|
N. Verbeet |
Geen |
|
M.J.Kersten |
Celgene/BMS, Kite/Gilead, Novartis, Takeda, Roche, Miltenyi Biotech, MSD, Amgen: vergoeding voor advisory boards, presentaties of reiskosten congres. KWF/EU: research funding |
|
S.S. Kuipers |
Geen |
|
J.M.I. Vos |
Sanofi: advisory board & consultancy. Beigene: Research funding. Celgene: Hospitality |
|
M. Eefting |
Geen |
|
G. Velders |
Geen |
|
M.E.D. Chamuleau |
Reseach funding: BMS, GenMab, Gilead Advisory: AbbVie, Novartis |
|
Naam |
Belangen |
|
Dr. J.M.I. Vos, Amsterdam UMC, locatie AMC, voorzitter |
Celgene: reiskosten congres |
|
Prof. Dr. M.C. Minnema Internist hematoloog UMC Utrecht |
Celgene: Advisory Board en research funding, Gilead: Honoraria, Amgen, Takeda, Jansen Cilag, Servier, BMS : Advisory Board |
|
Prof. Dr. M.J. Kersten, Amsterdam UMC, locatie AMC |
Celgene/BMS, Kite/Gilead, Novartis, Takeda, Roche, Miltenyi Biotech, MSD, Amgen: vergoeding voor Advisory Boards, presentaties of reiskosten congres; KWF/EU: research funding |
|
Dr. M.E.D. Chamuleau, Amsterdam UMC locatie VUMC |
Geen |
|
Dr. L. Nieuwenhuizen, Maxima Medisch Centrum |
Geen |
|
Dr. R. F.J. Schop, Ijsselland Ziekenhuis |
Geen |
|
Dr. G.A. Velders, Ziekenhuis Gelderse Vallei |
Geen |
|
Dhr. H.P.J. Visser, Noord West Ziekenhuizen |
Nevenwerkzaamheden: Redacteur tijdschrift ‘De Internist’, blad van de Nederlandse Internisten Vereniging, onbetaald Werkgroep Chronische Lymfatische Leukemie, onbetaald |
|
Dhr. J.J. Wegman, Amsterdam UMC, locatie AMC |
Geen |
Voorafgaande aan de ontwikkeling van deze richtlijn zijn uitgangsvragen geformuleerd door de werkgroep. De meest relevante knelpunten werden uitgewerkt tot uitgangsvragen. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn. Verdere adviezen t.a.v. diagnostiek, prognosticering, behandeling, respons evaluatie en follow-up waarbij geen uitgangsvraag geformuleerd was zijn weergegeven in de betreffende paragrafen (dus zonder uitgangsvraag).
Kwaliteitsindicatoren
Bij elke nieuwe WM patient wordt de rIPSS-WM score (bij diagnose symptomatische WM met behandelindicatie) berekend.
Vincristine wordt vermeden bij de behandeling van WM
Hieronder vindt u een samenvatting van een deel van de richtlijn namelijk de aanbevelingen n.a.v. deuitgangsvragen per hoofdstuk. Verdere adviezen t.a.v. diagnostiek, prognosticering, behandeling, respons evaluatie en follow-up zijn niet n.a.v. uitgangsvragen en worden niet hieronder weergegeven maar in de betreffende hoofdstukken en paragrafen.
Uitgangsvraag: Wat is de rol van de vrije lichte ketens bepaling bij WM?
Aanbeveling(en)
Uitgangsvraag: wat is de rol van flowcytometrie van het beenmergaspiraat bij de diagnose van WM?
Aanbeveling(en)
Uitgangsvraag: wat is de rol van moleculair onderzoek naar MYD88 en CXCR4 mutaties en van conventionele cytogenetica?
Aanbeveling(en)
Uitgangsvraag: Wat is de rol van een 18F FDG-PET-CT (PET-CT) t.o.v. een conventionele CT- scan bij diagnostiek en follow-up van patiënten met M. Waldenstrom?
Aanbeveling(en)
Uitgangsvraag: Hoe wordt transformatie van een LPL/WM naar agressief lymfoom vastgesteld?
Aanbeveling(en)
Uitgangsvraag: Op welk moment moet behandeling gestart worden bij WM en tot welk moment is een expectatief beleid (‘watch and wait’) op zijn plaats?
Aanbeveling(en):
Uitgangsvraag: Wanneer is er een indicatie voor plasmaferese bij hyperviscositeits syndroom (HVS) bij patiënten met M. Waldenström?
Aanbeveling(en)
Uitgangsvraag: wat zijn de aanbevelingen voor behandeling van WM in de 1e lijn?
Aanbeveling(en)
* “add-on” aanvragen voor bendamustine en bortezomib in de 1e lijn zijn recent goedgekeurd
Uitgangsvraag: Is onderhoudsbehandeling met rituximab geindiceerd na inductiebehandeling met immunochemotherapie?
Aanbeveling(en)
Uitgangsvraag: Wat is de aanbeveling voor 2e (en verdere) lijnsbehandeling?
Aanbevelingen
*Zanubrutinib vergoeding wordt voorbereid
Uitgangsvraag: Hoe wordt een naar een agressief lymfoom getransformeerd WM/LPL behandeld?
Aanbeveling(en)
Uitgangsvraag: wat is de rol van autologe stamceltransplantatie bij WM?
Aanbevelingen
Uitgangsvraag: Wat is de rol van allogene stamceltransplantatie bij WM?
Aanbeveling(en)
Uitgangsvraag: Wat is het beleid bij patiënten met WM die intolerant zijn voor rituximab?
Aanbeveling(en)
Voor het stellen van de diagnose ‘M. Waldenström’ dienen minimaal een IgM paraproteïnemie en een lymfoplasmacytair lymfoom (LPL) gelokaliseerd in het beenmerg aanwezig te zijn. De primaire diagnostiek bestaat uit het onderzoek dat nodig is om de diagnose WM te stellen en andere lymfoproliferatieve ziekten uit te sluiten. De primaire diagnostiek bestaat dus tenminste uit beenmergonderzoek en bloedonderzoek naar het (IgM) paraproteine.
In de recente revisie van de WHO classificatie is de MYD88L265P mutatie toegevoegd bij WM, aangezien deze mutatie bij >90% van de WM patiënten aanwezig is.2 Het wordt sterk aanbevolen om bij de (overwogen) diagnose WM onderzoek naar de MYD88L265P mutatie in te zetten. Zie tevens desbetreffende uitgangsvraag voor de overwegingen. De moleculaire diagnostiek kan overigens vaak worden nabepaald op een reeds afgenomen cristabiopt (mits op formaline bewaard en op een DNA-sparende manier ontkalkt). Nieuw in de WHO revisie is tevens een expliciet onderscheid tussen IgM MGUS en non-IgM MGUS. De criteria voor IgM MGUS worden in de betreffende paragraaf uitgewerkt.
Beenmergonderzoek (in elk geval een botbiopt) is noodzakelijk voor het stellen van de diagnose LPL, aangezien dit lymfoom zich bij voorkeur, en vaak uitsluitend, in het beenmerg manifesteert. Kenmerkend is een infiltratie van kleine B-lymfocyten, plasmacytoïde lymfocyten en plasmacellen in het beenmerg. Karakteristieke kenmerken zijn expressie van B-celantigenen (CD19/CD20/CD79a) en membraangebonden IgM door de B-cel fractie en cytoplasmatisch IgM door de plasmacytoide cellen en plasmacellen. Daarnaast brengen de plasmacellen CD138 tot expressie. De tumorcellen zijn meestal CD5, CD23, en CD10 negatief. Cycline D1, IgD, BCL6 en CD103 zijn negatief.
De klinische verschijnselen van WM worden bepaald door directe tumorinfiltratie maar vooral ook door de chemische en immunologische eigenschappen van het monoclonale IgM eiwit. Hierin verschilt WM sterk van andere maligne lymfomen of het multipel myeloom. Het spectrum aan mogelijke ziekte-uitingen is hierdoor breed. Daarom is een uitgebreide anamnese essentieel, evenals een volledig lichamelijk onderzoek, met speciale aandacht voor lymfadenopathie,hepatosplenomegalie en ook voor neuropathie, auto-immuun fenomenen en verschijnselen van hyperviscositeit (voor een uitgebreid overzicht van mogelijke symptomatologie zie tabel 1). Uiteraard is het relevant zonodig multidisciplinaire samenwerking te zoeken voor een optimale diagnosestelling en behandeling (neurologie, nefrologie, dermatologie etcetera). Het te verrichten laboratoriumonderzoek en overig onderzoek bij diagnose hangt mede samen met de klinische presentatie. Onderstaand overzicht in tabel 2 kan als handvat gebruikt worden. Het advies is de vetgedrukte items standaard te verrichten.
Bij de diagnose WM bestaat er vaak een grote discrepantie tussen de hoogte van het IgM M-proteine en de hoogte van het totale IgM (tot tientallen g/L verschil waarbij de laatstgenoemde dan hoger is). Dit verschil wordt niet verklaart door de “fysiologische” hoeveelheid IgM gezien die maar enkele g/L bedraagt. Het totale IgM vertegenwoordigt dus grotendeel het IgM M-proteine, en de verklaring voor de discrepantie tussen beide bepalingen ligt op biochemisch gebied (en is niet geheel begrepen). Voor de diagnose WM is het uiteraard vereist het IgM M-proteine aan te tonen. Echter, in de internationale (zeker Amerikaanse) literatuur wordt in de verdere klinische praktijk veelal het totaal IgM gebruikt. Aanbevelingen rondom bijvoorbeeld hyperviscositeits syndroom en genoemde IgM waarden in klinische trials zijn dan ook vrijwel altijd gebaseerd op de totale IgM meting. Ook de internationale respons criteria zijn grotendeels gebaseerd op het totale IgM. In afwachting van de herziening van de richtlijn “Laboratoriumonderzoek bij monoclonale gammopathie; detectie van monoclonale immuunglobulinen” adviseert de werkgroep bij diagnose beide bepalingen te verrichten, en in de follow up tenminste het totaal IgM te volgen.
|
Verschijnsel |
Percentage aanwezig bij diagnose |
Mechanisme / letten op |
|
Vermoeidheid |
± 70% |
Anemie Constitutioneel |
|
Constitutionele symptomen (nachtzweten, afvallen) |
20-25% |
Constitutioneel Cave AL Amyloidose
|
|
Lymfadenopathie/ organomegalie |
15-30% |
Tumorinfiltratie Cave transformatie naar DLBCL of AL amyloidose |
|
Anemie |
40% |
Lokalisatie WM in het beenmerg/aanmaakstoornis Hemolyse (meestal koude agglutinines) IJzergebrek door bloedverlies uit tractus digestivus Verstoorde ijzeropname door hoog hepcidine |
|
Hyperviscositeit: Hoofdpijn, visusklachten, verwardheid, dyspnoe, bloedneuzen |
15% |
Direct doen: Fundoscopie Overweeg met spoed plasmaferese te verrichten Bepaal cryoglobulines |
|
Hemorragische diathese |
20-30% |
Trombopenie evt. ook door ITP (IgM gerelateerd) Verworven van Willebrand ziekte AL Amyloidose |
|
Neurologische klachten (vooral polyneuropathie) |
15-20% |
IgM gerelateerde PNP, oa anti- myelin-associated glycoprotein (MAG) antistoffen, danwel ganglioside M1 (GM1) of myopathie (antidecorine antistoffen) etc AL Amyloidose
|
|
Bing-Neel syndroom: neurologisch beeld met vaak lokalisatie MW in de liquor en afwijkende MRI hersenen. |
Zeldzaam |
Door tumorinfiltratie |
|
Raynaud fenomeen (11%), acrocyanose of perifere ulcera
|
Tot 20% heeft aantoonbare cryoglobulines, slechts <5% heeft klachten daarbij. ~5% koude agglutinatie |
Cryoglobulinaemie. Koude agglutinatie Let op: IgM ook meten onder warme omstandigheden |
|
Maag-darmklachten, vooral diarree, kolieken. |
Onbekend |
AL Amyloidose of IgM depositie Lokale tumorinfiltratie
|
|
Trombose |
Onbekend |
Antifosfolipiden syndroom o.b.v. IgM antifosfolipiden antistoffen |
|
Huidproblemen: urticaria, papuleuze of bulleuze dermatitis, vasculitis |
<5% |
Schnitzler syndroom (IgM paraproteïne en urticariele huidafwijkingen), tumor infiltratie, amyloidose, koude agglutinatie Cryoglobulinaemie Koude Agglutinines |
|
Nierinsufficiëntie / nefrotisch syndroom |
< 5% |
Diverse WM gerelateerde nefropathieën, overweeg nierbiopt. |
|
Osteolytische laesies |
In principe niet |
Bij aanwezigheid osteolytische laesies: multipel myeloom als diagnose overwegen! |
|
Recidiverende infecties |
Onbekend |
Door hypogammaglobulinemie, overweeg antibiotica profylaxe of suppletie met IVIG. |
|
Cardiale dysfunctie |
Onbekend |
AL Amyloidose, Light Chain Deposition Disease |
|
Test (vetgedrukt betekent standaard geadviseerd) |
Opmerkingen
|
|
Serum eiwit electroforese met kwantitatieve M-proteine bepaling; immunofixatie Immuunglobulines IgA, IgM, IgG |
Lichte ketens: in principe niet (zie betreffende toelichting) Let op: bij (verdenking) cryoglobulinemie ook afname van IgM onder warme omstandigheden |
|
Bloedbeeld, PT, APTT Leverenzymen, nierfunctie |
Evt. ijzerstatus bij verdenking ijzergebreksanemie |
|
Beenmergonderzoek (botbiopt) met morfologie MYD88 mutatieonderzoek: sterk aanbevolen
|
Zie tekst CXCR4 mutatieonderzoek: niet standaard Cytogenetica: bij verdenking op IgM multipel myeloom |
|
Urinesediment |
Ter overweging als screening voor WM gerelateerde nefropathie oa bij AL Amyloidose, cryogobulinemie |
|
CT hals/thorax/abdomen standaard ter stadiering voor start behandeling |
Wordt aanbevolen op indicatie (ook bij bijvoorbeeld differentiaal diagnose met andere B-NHL) standaard ter stadiering voor start behandeling. |
|
PET CT |
Alleen bij verdenking op transformatie naar hooggradig NHL |
|
Hemolyse parameters (LDH, haptoglobine, reticulocyten, eventueel gevolgd door Directe Antiglobuline Test |
Bij anemie, verdenking op hemolyse of koude agglutinine ziekte. |
|
B2-microglobuline en albumine, LDH |
Prognostische markers |
|
Consult oogarts Standaard bij IgM ≥ 60 g/L |
Bij klinische verdenking op hyperviscositeit Bij IgM ≥ 60 g/L standaard, laagdrempelig bij IgM ≥ 30 g/L (NB hyperviscositeit kan al bij lagere waarden ontstaan, zeker bij cryoglobulinemie) |
|
Urinesediment, troponine T, nt pro BNP, congoroodkleuring beenmerg, buikvetbiopt of gericht biopt |
Bij verdenking AL Amyloidose |
|
HIV, hepatitis B, hepatitis C Standaard voor start behandeling |
Voor start behandeling |
|
Cryoglobulines |
Laagdrempelig verrichten bij atypische klachten, aanwijzingen voor vasculitis, neuropathie, nefropathie of hyperviscositeit (kan vals verlaagd IgM veroorzaken indien niet warm bepaald). |
|
Von Willebrand factor |
Bij bloedingsneiging |
|
Consult neuroloog |
Bij aanwijzingen voor neuropathie (EMG, antistoffen inzetten o.b.v neurologisch beeld) of onbegrepen neurologische verschijnselen (Bing Neel syndroom?) |
In de huidige classificatie van de Wereldgezondheidsorganisatie (WHO) (de herziene 4e editie van 20172) wordt WM gedefinieerd als “lymfoplasmacytair lymfoom (LPL) met betrokkenheid van het beenmerg en een monoklonale gammopathie van het type Immunoglobulin M (IgM)”.
LPL wordt gedefinieerd als “een neoplasma van kleine B-lymfocyten, plasmacytoïde lymfocyten en plasmacellen, meestal met beenmergbetrokkenheid en soms van lymfeklieren en milt, die niet voldoet aan de criteria voor een van de andere kleincellige maligne B-cel lymfomen met plasmacytaire uitrijping”. LPL omvat dus WM plus die zeldzame gevallen (<5%) waarbij geen IgM-paraproteïne kan worden aangetoond. Een klein percentage (<5%) heeft een LPL met IgA of IgG paraproteïnemie. Een niet-secernerend LPL is zeer zeldzaam.
Asymptomatische of sluimerende WM wordt gedefinieerd als WM zonder ziektegerelateerde klinische verschijnselen. Symptomatische WM wordt gedefinieerd als WM met ziektegerelateerde klinische verschijnselen.
Ten aanzien van IgM MGUS bestaan er momenteel twee definities naast elkaar. In de WHO-classificatie 2017 is IgM MGUS een afzonderlijke entiteit geworden (en wordt daarmee onderscheiden van non-IgM MGUS). IgM MGUS wordt volgens WHO gedefinieerd als een IgM-paraproteïnemie <30 g/L, LPL infiltratie in het beenmerg van <10% en geen aanwijzingen voor bloedarmoede, constitutionele symptomen, hyperviscositeit, lymfadenopathie, hepatosplenomegalie of andere eindorgaanschade ten gevolge van de onderliggende lymfoproliferatieve aandoening. De International Workshop for Waldenstrom’s Macroglobulinemie (IWWM-2) daarentegen definieert IgM MGUS als IgM paraproteïnemie van elk niveau zonder evidente beenmerginfiltratie en zonder gerelateerde symptomen. Evidente beenmerginfiltratie wordt dan vaak geinterpreteerd als negatieve morfologie. De laatste definitie werd gebruikt in de Nederlandse nationale richtlijn voor WM van 2012. Bij de update van de richtlijn hebben we ervoor gekozen de hernieuwde WHO definitie de voorkeur te geven (zie tabel 3 voor diagnostische classificatie).
“IgM-gerelateerde aandoeningen” is de term die werd geintroduceerd door de IWWM-2 voor patiënten met IgM-MGUS en ziektegerelateerde symptomen (“symptomatische MGUS”). Voorbeelden zijn IgM-gerelateerde neuropathie, cryglobulinemie, IgM gerelateerde AL amyloidose en koude agglutinine ziekte.
|
|
IgM MGUS |
Asymptomatische M. Waldenström |
Symptomatische MW |
IgM gerelateerde ziekte |
|
IgM M-proteïne (serum) |
Ja, ≤ 30 g/L |
Ja |
Ja |
Ja, ≤ 30 g/L |
|
Lymfoplasmocytair infiltraat (Beenmerg) |
≤ 10% |
Ja |
Ja |
≤ 10% |
|
WM gerelateerdeklinische verschijnselen |
Nee |
Nee |
Ja |
Ja |
|
Beleid |
Follow up |
Wait and see |
Behandeling |
Mogelijk behandelen |
|
Kans op progressie naar MW |
1.5% per jaar |
50-60% na 5 jaar |
n.v.t. |
onbekend |
|
Beschikbare prognostische scores* |
|
AWM risk score |
IPSS-WM rIPSS-WM |
|
* Zie desbetreffende paragraaf
Aanbeveling(en)
Inleiding
Alhoewel uit een enquête bleek dat >40% van de hematologen in Nederland serum vrije lichte ketens liet bepalen bij diagnose van Waldenström patiënten, is dit geen routine bepaling.3 Deze test is nuttig gebleken bij gerelateerde ziektebeelden zoals lichte keten (AL) amyloïdose en ‘non-secretory’ multipel myeloom, maar het nut bij WM is nog onduidelijk.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Serum vrij lichte ketens zijn bij 80% van de WM patienten verhoogd, echter deze correleren met de al routinematig bepaalde tumormarkers en voegen daarom weinig toe aan diagnose en monitoring. (consensus, expert opinion) |
|
C |
Het bepalen van serum vrije lichte ketens kan nuttig zijn bij WM patiënten met nierfunctiestoornissen, cryoglobulinemie en/of (verdenking op) AL amyloïdose. (consensus, expert opinion) |
Samenvatting literatuur
Resultaten
M.b.v. van de Freelite™ test (The Binding Site Group Ltd., Birmingham, UK) wordt in ongeveer 80% een verhoging van de betrokken lichte keten waargenomen in WM.4 Enkele onderzoeken laten zien dat de serum vrije lichte ketens bepaling in WM correleert met serum eiwit elektroforese M-proteïne bepaling en bekende markers voor tumorlast en prognose, zoals hemoglobine, beta-2-microglobuline en albumine.5 Ook zou de lichte keten bepaling tijdens behandeling van nut kunnen zijn voor vroege detectie van respons en progressie.6 Tenslotte kan de lichte keten bepaling bijdragen aan respons monitoring indien cryoglobulinemie de M-proteïne bepaling verstoort.7 Ondanks bovenstaande onderzoeken wordt het bewijs van het nut van de ‘routine’ serum vrije lichte keten bepaling als te beperkt beschouwd en is derhalve niet opgenomen als standaard bepaling in internationale richtlijnen.8–10
De gemiddelde hoogte van de serum lichte keten waarde is bij WM ± 50-100 mg/L, dus een stuk lager dan bij multipel myeloom (>300 mg/L). Bij patiënten met WM gerelateerde nefropathie lagen de waarden hoger (gemiddeld 339 mg/L) waarschijnlijk omdat de verhoogde lichte keten hier (mede) de nierschade veroorzaakt.11 Een soortgelijke situatie kan worden verondersteld bij AL amyloidose.
Bewijskracht literatuur: Level 3, consistent.
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed, Cochrane en MEDLINE met de zoektermen “Waldenström”, “lymfoplasmacytair lymfoom” en “vrije lichte ketens”. Dit resulteerde in 58 publicaties. Na titel en abstract screening werden er 10 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden geexcludeerd op basis van het ontbreken van relevante informatie over de vraag of het volledig artikel was niet beschikbaar of de publicatie was niet in het Nederlands, Engels of Duits. Uiteindelijk bleken 7 publicaties geschikt. De referenties van deze artikelen werden tevens gecontroleerd op gemiste relevante artikelen. Dit leverde nog eens 2 bruikbare publicaties op. Tevens werd er gebruik gemaakt van een eerder gepubliceerde evidence-based richtlijn, aangevuld met bij de auteurs bekende relevante reviews.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed, Cochrane en MEDLINE. Publicaties werden gecontroleerd op relevantie (case reports, prospectieve, retrospectieve studie, meta-analyses en review artikelen).
Overwegingen
Het bepalen van serum lichte ketens lijkt op basis van bovenstaande niet nuttige in de routinematige diagnostiek en monitoring van WM. Echter, bij patienten met (onbegrepen) nierfunctiestoornissen/nefrotisch syndroom of verdenking op AL amyloidose kan het de diagnostiek mogelijk ondersteunen. Ook kan het een alternatief zijn als het IgM of paraproteine zich gedraagt als een cryoglobuline en daardoor niet goed bepaald kan worden. Er is dus een zeer beperkte rol voor de serum lichte keten bepaling bij WM.
Aanbeveling(en)
Inleiding:
Flowcytometrie van het beenmergaspiraat wordt in hematologische praktijken wisselend uitgevoerd bij de diagnose van of verdenking op WM. De vraag is wat de rol van flowcytometrie is bij de diagnose WM.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
C |
Flowcytometrie van het beenmergaspiraat is niet obligaat voor WM indien immuunhistochemie wordt verricht op het botbiopt (expert opinion/consensus) |
|
C |
Flowcytometrie van het beenmergaspiraat kan de diagnose WM ondersteunen en in sommige gevallen bijdragen aan de differentiaal diagnose ten opzichte van andere indolente B-cellymfomen (expert opinion, consensus) |
Samenvatting literatuur:
Resultaten
Recente internationale richtlijnen zijn wisselend in het advies ten aanzien van immunofenotypering middels flowcytometrie. Voor het stellen van de diagnose WM is beenmergonderzoek met immunofenotypering noodzakelijk. Over het algemeen is het advies dit allereerst te doen middels immunohistochemie op het beenmerg biopt.12 Immunofenotypering middels flowcytometrie van het beenmergaspiraat wordt in de meeste richtlijnen als optioneel/aanvullend gezien in aanwezigheid van een adequate immunohistochemie op het biopt. Wel wordt vaak genoemd dat het de diagnose WM kan ondersteunen en soms behulpzaam kan zijn bij differentiatie tussen verschillende typen indolente B-cel lymfomen.9,10,13,14
Het minimale flowcytometrie panel dat in Nederland geadviseerd wordt bij de diagnostiek van rijpe B-cel maligniteiten is: CD45, CD5, CD10, CD19, CD20, CD23, CD38, CD103 en SmIgkappa, SmIglambda,; en additioneel : FMC7, CD22, CD79b en CD43. Het minimale panel dat geadviseerd wordt bij plasmacel maligniteiten is: CD45, CD19, CD38, CD56, CD138(VS38c), CyIgkappa en CyIglambda; en additioneel CD20, CD117, SmIgK en SmIgL (zie richtlijnen op www.cytometrie.nl, minimale panels). Bij de verdenking WM kunnen beide panels additieve informatie geven. Bij de differentiaal diagnose met IgM MM is het van belang dat bij WM de plasmacellen vaak CD19+ zijn in tegenstelling tot bij een MM. In een recent overzichtsartikel uit de “How I treat” serie in Blood wordt een overzicht gegeven van het immunofenotype bij WM versus andere NHL/MM.15
Bewijskracht literatuur: Level 3 , consistent.
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed, Cochrane en MEDLINE met de zoektermen “Waldenström”, “lymfoplasmacytair lymfoom”, “fenotype” en “immunofenotype”. Dit resulteerde in 78 publicaties. Na titel en abstract screening werden er 11 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden geexcludeerd op basis van het ontbreken van relevante informatie over de vraag of als het volledig artikel niet beschikbaar was of de publicatie niet in het Nederlands, Engels of Duits geschreven was. Uiteindelijk bleken er 9 publicaties geschikt. De referenties van deze artikelen werden tevens gecontroleerd op gemiste relevante artikelen. Dit leverde geen bruikbare publicaties op. Verder werd gebruik gemaakt van de eerder gepubliceerde richtlijn, aangevuld met bij de auteurs bekende relevante reviews.
Overwegingen
De diagnose WM vereist allereerst een cristabiopt met adequate immunohistochemie. Flowcytometrie van het beenmergaspiraat kan zeker aanvullende waarde hebben vooral als er een lastige differentiaal diagnose bestaat met andere B-cel maligniteiten. In Nederland varieert de toepassing van flowcytometrie in deze setting behoorlijk. De werkgroep is van mening dat flowcytometrie van het beenmergaspiraat niet obligaat is voor het stellen van de diagnose WM als een botbiopt verricht is en dit biopt een eenduidig beeld laat zien. Echter in gevallen waarin de diagnose niet evident is en/of er een differentiaal diagnose blijft bestaan met andere B-cel maligniteiten kan flowcytometrie zeker toegevoegde waarde hebben. Het rijpe B-cel maligniteiten panel dat is opgesteld door de Nederlandse Vereniging voor Cytometrie kan in dat geval gebruikt worden. Het gebruik van het plasmacelpanel geeft aanvullende informatie maar is meestal niet noodzakelijk, behalve bij de differentiaal diagnose met IgM MM.
Aanbeveling(en)
Inleiding:
Het bestaan van hoogfrequente somatische mutaties in de MYD88 en CXCR4 genen werd in 2012 respectievelijk 2014 gepubliceerd16,17. De rol van deze mutaties en de klinische betekenis werd in de vorige richtlijn niet beschreven. In de dagelijkse Nederlandse praktijk wordt het bepalen van deze mutaties wisselend toegepast.
Conclusie(s):
|
SORT grade |
Conclusie |
|
A |
Een MYD88 L265P mutatie is aanwezig in het beenmerg bij > 90% van de WM patiënten. Slechts in zeldzame gevallen is er een andere pathogene MYD88 mutatie aanwezig, de overige gevallen zijn MYD88 wildtype. |
|
B |
CXCR4 mutaties zijn bij ongeveer 40% van de WM patiënten aanwezig in het beenmerg. Er zijn veel verschillende mutaties gevonden. De aan –of afwezigheid van de verschillende CXRC4 mutaties gaat gepaard met een iets andere klinische presentatie maar heeft op dit moment geen therapeutische consequenties. |
|
A |
De meest voorkomende cytogenetische afwijking bij WM is 6q- (±40%), echter het doen van cytogenetica heeft geen klinische consequenties, tenzij er een differentiaal diagnose is met IgM multipel myeloom. In dit laatste geval wordt vaak t(11;14) gevonden. |
Samenvatting literatuur:
Resultaten
MYD88 is een Toll-like receptor (TLR) signalerings eiwit; pathogene mutaties in MYD88 veroorzaken aberrante groei en survival signalering via met name NfkappaB. Bij >90% van de LPL/WM patiënten is een MYD88 L265P mutatie aanwezig in het beenmerg. Daarnaast wordt bij een klein deel van de MYD88 L265P mutatie negatieve patiënten een andere pathogene MYD88 mutatie gevonden. Mutaties in MYD88 zijn in lage frequentie gerapporteerd bij andere indolente B cel lymfomen; mogelijk berust dit voor een deel op ‘contaminatie’ van deze diagnose groepen met LPL/WM casus. MYD88 L265P wordt niet gevonden bij multipel myeloom.16,17,18,19
LPL/WM patiënten zonder MYD88 mutatie hebben een afwijkende moleculaire pathogenese en een minder gunstige prognose met mogelijk een verhoogde kans op transformatie naar een hooggradig NHL.20 Ook laten zij een minder goede respons op behandeling met ibrutinib zien. Alhoewel aanwezigheid van een MYD88 mutatie niet absoluut ‘disease defining’ is voor LPL/WM, moet bij ontbreken van MYD88 mutaties een alternatieve diagnose, waaronder vooral IgM multipel myeloom, marginale zone lymfoom (MZL), of CLL met plasmacytoide uitrijping kritisch worden overwogen. Andersom kan MYD88L265P ook aanwezig zijn bij andere B-cel maligniteiten zoals MZL of CLL.
CXCR4 is de belangrijkste receptor voor het chemokine CXCL12 en is cruciaal voor ‘homing’ van cellen naar het beenmerg. Bij ongeveer 40% van de LPL/WM patiënten is een activerende ‘WHIM-like mutatie’ in CXCR4 aanwezig.17 In tegenstelling tot MYD88 betreft het hier een aantal verschillende mutaties: > 30 verschillende mutaties zijn beschreven. Alle mutaties bevinden zich in het c-terminal domain. Binnen de mutaties zijn 2 grote groepen te onderscheiden, te weten nonsense mutaties en frameshift mutaties. De aanwezigheid van deze mutaties lijkt gepaard te gaan met een andere klinische presentatie: een hogere IgM waarde met meer kans op hyperviscositeitssyndroom en minder lymfadenopathie. Na behandeling met ibrutinib zijn tragere en minder diepe responsen beschreven. Recent bleek dat ook het type CXCR4 mutatie hierbij belangrijk is, waarbij het vooral de nonsense mutaties lijken te zijn die geassocieerd zijn met slechtere uitkomsten. De uitkomsten van de behandeling met proteasoomremmers wordt niet beinvloed door de aan –of afwezigheid van CXCR4 mutaties. Al met al is de klinische betekenis van de verschillende CXCR4 mutaties nog niet volledig uitgekristalliseerd.21,22,23
Bij WM zijn diverse cytogenetische afwijkingen beschreven. De meest frequent voorkomende afwijking is de 6q-deletie die bij 40-50% van de patiënten in het beenmerg voorkomt. Deze afwijking heeft echter geen prognostische of therapeutische consequenties. In verschillende reviews over cytogenetische diagnostiek bij WM wordt genoemd dat het bepalen van t(11;14) relevant kan zijn als IgM multipel myeloom in de differentiaal diagnose staat, aangezien deze translocatie vaak bij IgM MM voorkomt maar niet bij WM.24,25
Detectiemethoden: Voor detectie van de MYD88 L265P hotspot mutatie kan in principe gebruik worden gemaakt van ofwel een (goedkope) allel-specifieke PCR (aPCR), de meer quantitatieve digital-droplet (ddPCR), of van een next-generation sequencing platform (NGS). Bij een negatief resultaat bij aPCR of ddPCR wordt aanbevolen alsnog NGS te verrichten, teneinde non-L265P MYD88 mutaties te kunnen detecteren.26
Voor detectie van CXCR4 mutaties zijn aPCR en ddPCR ongeschikt, aangezien >40 verschillende nonsense, missense en frameshift mutaties in exon 2 van het CXCR4 gen zijn aangetroffen bij LPL/WM. Derhalve is NGS de aangewezen techniek. Een voordeel van het gebruik van NGS in de diagnostiek van LPL/WM is dat alle voorkomende mutaties in zowel MYD88 als CXCR4, alsmede mutaties in minder frequent gemuteerde genen zoals b.v. CD79, in één run gedetecteerd kunnen worden. Hierbij worden tevens quantitatieve data met betrekking tot tumorload verkregen.27,28,29
Bewijskracht literatuur: Level 3, consistent.
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed met de zoektermen “Waldenström” and/or “lymphoplasmacytic lymphoma” and “MYD88 mutation” and/or CXCR4 mutation’’. Dit resulteerde in 147 publicaties. Na titel en abstract screening werden er 20 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden geexcludeerd op basis van het ontbreken van relevante informatie over de vraag (geen originele data) of het volledig artikel was niet beschikbaar, of de publicatie was niet in het Engels. Uiteindelijk bleken 14 publicaties geschikt.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed. Publicaties werden gecontroleerd op relevantie (prospectieve, retrospectieve studie, meta-analyses en systematic reviews).
Overwegingen:
Gezien de sterke associatie van de diagnose WM met de MYD88 mutatie in het beenmerg wordt het bepalen van de MYD88 mutatie als een belangrijk onderdeel van de diagnosestelling bij WM beschouwd. Het ontbreken van de MYD88 mutatie dient een kritische heroverweging van de diagnose te triggeren, waarbij vooral de alternatieve diagnose IgM multipel myeloom relevant is. Patiënten zonder MYD88 mutatie lijken minder gevoelig te zijn voor de behandeling met ibrutinib monotherapie. Anderzijds zijn er momenteel geen harde klinische consequenties verbonden aan het bepalen van de mutatie aangezien deze de diagnose niet met zekerheid kan aantonen of uitsluiten. Onderzoek naar MYD88 wordt door de werkgroep derhalve sterk aanbevolen. Bij het overwegen van ibrutinib als behandeling geldt dit des te sterker. Wel dient de aanvrager zich bewust te zijn van de valkuilen bij het vaststellen van MYD88 wildtype zeker als deze uitslag betrokken wordt bij het maken van een behandelplan.
Somatische CXCR4 mutaties komen voor in het beenmerg van ~40% van de WM patiënten, de klinische betekenis van de verschillende varianten is nog niet volledig uitgekristalliseerd. Onderzoek naar CXCR4 mutaties kan de diagnose WM ondersteunen. Het onderzoek is technisch ingewikkelder. De werkgroep is van mening dat onderzoek naar CXCR4 mutaties bij de diagnose WM overwogen kan worden in specifieke situaties (bijvoorbeeld bij diagnostische twijfel) maar het wordt niet standaard aanbevolen.
Gezien het ontbreken van diagnostische en therapeutische consequenties wordt niet aanbevolen bij de diagnose WM standaard cytogenetisch onderzoek te verrichten. Een uitzondering is de situatie waarin er een differentiaal diagnose met IgM multipel myeloom bestaat (MM): dan is onderzoek naar t(11;14) nuttig omdat deze translocatiebeschreven is bij de meerderheid van de IgM MM patiënten maar niet wordt gevonden bij patienten met WM. Andersom pleit 6q- dan juist voor de diagnose WM.
Uitgangsvraag
Wat is de rol van een 18F FDG-PET-CT (PET-CT) tov een conventionele CT- scan bij diagnostiek en follow-up van patiënten met WM?
Aanbeveling(en)
Inleiding
PET-CT wordt steeds meer gebruikt bij de diagnose van indolente B-cel maligniteiten. WM is een vorm van NHL die vooral in het beenmerg gelokaliseerd is en minder vaak met extramedullaire lokalisaties gepaard gaat. De vraag is welke vorm van beeldvorming bij WM gepast is.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Bij diagnose worden met een PET-CT scan nauwelijks meer WM gerelateerde afwijkingen vastgesteld dan met een CT (77 vs 69%) en er is geen relatie tussen IgM respons en PET respons |
|
C |
De mediane SUV bij getransformeerd WM is 15 (t.o.v. max 7 bij niet getransformeerde WM) |
Samenvatting literatuur
Resultaten
Banwait heeft bij 35 patiënten met WM< (12 nieuw gediagnosticeerd, 23 recidief) die werden behandeld met een bortezomib en rituximab een PET-CT voor en na behandeling verricht.30 Bij 27 (77%) patiënten werden met PET afwijkingen gevonden en bij 24 patiënten (69%) met CT scan, dit is een klein verschil. PET was wel veel gevoeliger voor het aantonen van beenmerglokalisatie (43 vs 8%), maar dit heeft over het algemeen geen directe therapeutische consequenties omdat altijd een beenmergonderzoek verricht wordt. Er is geen goede relatie tussen de PET en de IgM respons; bijvoorbeeld 46% van de patiënten met een PR (n=8) qua IgM hebben een CR op de PET. Durot heeft retrospectief naar 77 patiënten met een bewezen getransformeerde WM gekeken.31 De mediane SUV bij de getransformeerd WM was 15 (tov max 7 bij niet getransformeerd WM) . Daarmee lijkt een PET-CT een onderzoek dat kan helpen om transformatie op te sporen. Er kan dan gericht een klierexcisie verricht worden of een biopt worden genomen.
Bewijskracht literatuur: Level 3, consistent.
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed, Cochrane en MEDLINE met de zoektermen “Waldenstrom”, “PET-CT” en “PET”. Dit resulteerde in 29 publicaties. Na titel en abstract screening werden 2 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden ge-excludeerd op basis van het ontbreken van relevante informatie over de vraag of een volledig artikel was niet beschikbaar of de publicatie was niet in het Nederlands, Engels of Duits geschreven/vertaald.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed, Cochrane en MEDLINE. Publicaties werden gecontroleerd op relevantie (case reports, prospectieve, retrospectieve studie, meta-analyses en review artikelen).
Overwegingen
Splenomegalie en lymfadenopathie komt slechts bij een minderheid (15-20%) van nieuwe gediagnosticeerde patiënten voor. In latere stadia komt extramedullaire ziekte bij 60% van de patiënten voor.32 Bij de diagnostiek en bij responsbepaling van WM wordt naar aanwezigheid van lymfadenopathie, hepato-splenomegalie en extra-medullaire ziekte gekeken mbv CT-scan8.
Er bestaan 3 gepubliceerde risico scores voor WM. Twee zijn gericht op het voorspellen van overleving bij WM patiënten. De derde is gericht op het voorspellen van het ontstaan van een behandelindicatie bij asymptomatische WM.
De International Prognostic Scoring System for WM (IPSS-WM)33 gebruikt leeftijd, β2-microglobuline, hemoglobin, trombocytenaantal en de hoogte van het serum IgM om de overleving te voorspellen. Er worden 3 risicogroepen onderscheiden. Recent werd de gereviseerde IPSS-WM gepubliceerd (rIPSS-WM)34 die gebaseerd is op leeftijd, β2-microglobuline, LDH en albumine, ook met als doel overleving te voorspellen. Deze score onderscheidt 5 risicogroepen. Deze beide scoresystemen worden hieronder samengevat in tabellen. De r-IPSS-WM lijkt een nauwkeurigere voorspellende waarden te hebben en deze score heeft dan ook de voorkeur van de werkgroep.
Recent werd ook een prognostische score gepubliceerd die voorspelt hoe lang het duurt voordat bij een smouldering WM een behandelindicatie ontstaat, gebaseerd op hoogte van het IgM, percentage beenmerginfiltratie, β2-microglobuline en albumine.35,36 Deze score onderscheidt 3 risicogroepen (met een mediane tijd tot progressie van 1,8, 4,8 en 9,3 jaar. Deze score is gebaseerd op continue variabelen en kan dus niet in tabelvorm worden weergegeven, maar wel worden berekend via de website: www.awmrisk.com. De gebruikte variabelen zijn percentage beenmerginfiltratie, hoogte van IgM, beta-2-microglobuline en albumine. Let op hier wordt het totaal IgM gebruikt (niet het M-proteine) in mg/dL, de meeste Nederlandse laboratoria gebruiken g/L. Voor het albumine wordt g/dL gebruikt, de meeste Nederlandse laboratoria gebruiken g/L. Het rapporteren van het (globale) percentage beenmerginfiltratie kan op basis van het botbiopt van de patholoog gevraagd worden.
Er zijn momenteel geen risicoclassificaties beschikbaar die moleculaire/genetische factoren meewegen. De prognostische scores zijn niet ontwikkeld om het therapeutisch beleid te sturen en daarvoor worden zij dan ook niet gebruikt. Wel wordt het gebruik van de prognostische scores aanbevolen door de werkgroep omdat zij een goed beeld van de prognose van een individuele patient geven. De scores zijn beschikbaar via de HematologyApp.
R-IPSS-WM:
|
Item |
Score |
|
Leeftijd 66-75 jaar |
1 |
|
Leeftijd >75 jaar |
2 |
|
β2-microglobuline >4 mg/l |
1 |
|
LDH > 250 IU/L |
1 |
|
Serum albumine < 35 gr/L |
1 |
|
Risicogroep |
Score |
% patienten |
3-jaars WM gerelateerde mortaliteit |
5-jaar OS |
10-jaar OS |
|
Very low |
0 |
13% |
0% |
95% |
84% |
|
Low |
1 |
33.5% |
10% |
86% |
59% |
|
Intermediate |
2 |
25.5% |
14% |
78% |
37% |
|
High |
3 |
16% |
38% |
47% |
19% |
|
Very high |
4–5 |
12% |
48% |
36% |
9% |
IPSS-WM:
|
Item |
Score |
|
Leeftijd >65 jaar |
1 |
|
Hb <7.2 mmol/l |
1 |
|
Trombocytengetal <100 x 109/l |
1 |
|
β2-microglobuline >3 mg/l |
1 |
|
IgM M-proteïne >70 g/l |
1 |
|
Risicogroep |
Score |
Mediane overleving (maanden) |
|
Low |
0-1 (m.u.v. leeftijd) |
143 |
|
Intermediate |
2, of leeftijd >65 jaar |
99 |
|
High |
≥3 |
44 |
Hyperviscositeits Syndroom (HVS) is een klinisch fenomeen dat optreedt bij 10-30% van de patiënten met WM en soms een eerste manifestatie van de ziekte.37,38 De symptomen bestaan uit huid- en mucosabloedingen, visusstoornissen door retinopathie, neurologische symptomen zoals hoofdpijn, duizeligheid, paresthesie, sufheid of coma en zelden hartfalen. Van belang bij de diagnose van HVS is het aantonen van specifieke retinale afwijkingen bij fundoscopie, maar bij een klinisch hoge verdenking kan de (waarschijnlijkheids)diagnose ook voorlopig gesteld worden zonder fundoscopie.
Typische fundoscopische afwijkingen zijn: uitgesproken veneuze stuwing (“sausages on a string” beed), retinale bloedingen en exsudaten, microaneurysmata, papiloedeem en in latere stadia een beeld dat lijkt op centrale occlusie van de vena retinalis39.
Met de viscositeitsmeting en/of de hoogte van het IgM is het HVS niet aan te tonen of uit te sluiten zodat deze niet leidend zijn bij het stellen van de diagnose. In het algemeen wordt bij een IgM waarde van onder de 30 g/L de kans op een HVS laag (maar niet uitgesloten) geacht. Echter als het IgM een cryoglobuline is, kan de uitslag vals verlaagd zijn (door neerslaan van het eiwit) als het bloedmonster niet warm afgenomen en bepaald is. Bij dergelijke patiënten kan dus ook bij veel lagere gemeten IgM waarden toch een HVS optreden. In die situatie is het advies laagdrempelig een cryoglobulinetest te verrichten.39
Aanbeveling(en)
Inleiding
Transformatie van een LPL naar een meer agressievere vorm, in de regel een diffuus grootcellig B-cellymfoom, dient tijdig te worden onderkend gezien de slechtere prognose welke deze patiënten hebben en de consequenties voor de behandeling. Daarom stelde de werkgroep zich de vraag hoe deze diagnose optimaal gesteld kan worden.
Conclusies
|
SORT Grade |
Conclusie |
|
B |
Transformatie van een lymfoplasmocytair lymfoom naar een agressief lymfoom is zeldzaam (0.2-0.3% per jaar), en kan optreden op elk moment van de behandeling. Mogelijke tekenen van transformatie zijn snelle klinische achteruitgang, stijging van het LDH, of het ontstaan van extranodale lokalisaties. Het serum IgM kan hierbij stabiel blijven. |
|
C |
Voor het vaststellen van de diagnose getransformeerd LPL is een histologisch biopt vereist, bij voorkeur een volledige lymfklier of extranodale afwijking óf een ruim incisie biopt van een PET-avide lymfklier of extranodale lokalisatie. |
|
C |
De mediane SUV van getransformeerde WM is 15 (tov max 7 bij niet getransformeerde). |
Samenvatting literatuur
Resultaten
Bij transformatie van WM gaat het voornamelijk om transformatie naar een diffuus grootcellig B-cellymfoom (DLBCL). Dit is relatief zeldzaam fenomeen met een geschatte incidentie van 0,2-0.3 % per jaar.40Transformatie kan op elk moment plaatsvinden, bij diagnose, voor start van behandeling, tijdens behandeling en zelfs jaren na behandeling. De mediane overleving bij getransformeerde WM is in de 2 grootste retrospectieve series 1,5 tot 2,5 jaar (met een spreiding van 6 maanden tot 9 jaar) en dus beduidend slechter dan bij WM zonder transformatie.40,41 Diverse studies beschrijven de factoren die geassocieerd zijn met transformatie.40–44 Bij transformatie is het merendeel van de patiënten 60 jaar of ouder (85%), heeft het merendeel een verhoogd LDH (67%), is er sprake van een stijging van de serum IgM concentratie van 25% of meer bij 50% van de patiënten, heeft het merendeel een verhoogde IPI score van 2 of meer (65%), heeft de minderheid nodale lokalisaties (25%) en het merendeel extranodale lokalisaties (84%) zonder een specifieke voorkeurslokalisatie. Eerdere behandeling van het LPL met de purinederivaten fludarabine en cladribine of afwezigheid van de MYD88 mutatie lijken geassocieerd met een verhoogde kans op transformatie, de literatuur hierover is echter niet eenduidig. 45,46 De mediane SUV bij getransformeerde WM is 15 (tov max 7 bij niet getransformeerd LPL).41
De Nederlandse ‘richtlijn voor diagnostiek en behandeling van de ziekte van Waldenström’ uit 2012 beschrijft niet hoe te handelen bij de verdenking op een getransformeerd LPL.47 De Europese ESMO ‘Waldenström macroglobulinaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up’ beschrijft de incidentie van transformatie bij LPL, maar niet hoe te handelen bij de verdenking op een getransformeerd LPL.10 De Britse richtlijn uit 2014 ‘Guidelines on the diagnosis and management of Waldenström’s macroglobulinaemia’ adviseert het verkrijgen van materiaal voor histologisch bewijs van transformatie bij patiënten met het vermoeden op transformatie met daarbij aanvullende analyse naar de EBV status.9 De meest recente “ How I treat” adviseert een biopt van de meest FDG-avide laesie bij de verdenking op transformatie.15
Bewijskracht literatuur: Level 3, consistent.
Zoeken en selecteren
Voor deze uitgangsvraag werd een literatuursearch verricht in Pubmed, Cochrane en MEDLINE met de zoektermen “Waldenstrom”, “lymfoplasmocytic lymphoma”, “transformation” en “aggressive lymphoma”. Dit resulteerde in 1050 publicaties. Na titel en abstract screening werden er 25 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden geexcludeerd op basis van het ontbreken van relevante informatie over de vraag of een volledig artikel is niet beschikbaar of de publicatie is niet in het Nederlands, Engels of Duits geschreven. Uiteindelijk bleken 13 publicaties geschikt. De referenties van deze artikelen werden tevens gecontroleerd op gemiste relevante artikelen. Dit leverde nog eens 5 bruikbare publicaties op. Tevens werd gebruik gemaakt van een eerder gepubliceerde evidence-based richtlijn, aangevuld met bij de auteurs bekende relevante reviews.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed, Cochrane en MEDLINE. Publicaties werden gecontroleerd op relevantie (case reports, prospectieve, retrospectieve studie, meta-analyses en review artikelen).
Overwegingen
Transformatie van WM naar een agressief lymfoom is zeldzaam maar kent een volledig andere prognose (en behandeling). Daarom is het belangrijk dat de diagnose op tijd overwogen en gesteld wordt. De diagnostiek en classificatie van maligne lymfomen, waaronder getransformeerde WM, vereisen een ruim histologisch biopt. Cytologische puncties of naaldbiopten zijn in nagenoeg alle gevallen onvoldoende representatief en informatief om een diagnose te kunnen stellen. PET CT kan helpen de optimale locatie van dit biopt te bepalen.
Aanbeveling(en):
Tabel 4: WM behandelindicaties
|
WM behandelindicaties* o.b.v consensus IWWM-2, met update in IWWM-8 |
|
Hemoglobine ≤6.2 mmol/L |
|
Trombocytengetal <100×109/L |
|
Koorts, nachtzweten, gewichtsverlies, vermoeidheid |
|
Hyperviscositeit |
|
Sympomatische en/of bulky lymfadenopathie (≥5cm maximale diameter) |
|
Symptomatische hepatomegalie en/of splenomegalie |
|
Symptomatische organomegalie en/of weefselinfiltratie |
|
Perifere neuropathie |
|
Symptomatische cryoglobulinemie |
|
Koude agglutinine gerelateerde anemie |
|
Auto-immuun hemolytische anemie en/of trombopenie |
|
Nefropathie gerelateerd aan WM |
|
Amyloidose gerelateerd aan WM |
*Mits WM gerelateerd
Inleiding
Bij WM bestaan al enige tijd op internationale consensus gebaseerde behandelindicaties. Echter recent verscheen een publicatie waarin gesuggereerd werd dat behandeld moet worden bij een IgM boven de 60 g/L. Dit is in Nederland en de meeste andere landen niet gebruikelijk. De vraag is of de hoogte van het IgM een behandelindicatie moet zijn.
Conclusie(s)
|
SORT grade |
Conclusie |
|
C |
De literatuur ten aanzien van het risico op hyperviscositeit bij een IgM ≥ 60 g/L is niet eenduidig. |
|
C |
Er zijn geen data dat het behandelen van asymptomatische WM zinvol is, internationaal wordt in deze situatie zonder uitzondering geadviseerd een afwachtend beleid te voeren |
|
C |
Er zijn op internationale consensus gebaseerde behandelindicaties beschikbaar. |
Samenvatting literatuur
Resultaten
Tot nog toe werd de hoogte van het IgM niet als reden voor het starten van behandeling beschouwd. Recent zijn er 2 publicaties verschenen die onderzoeken of er een bepaald afkappunt is waarboven de kans op hyperviscositeitssyndroom (HVS) sterk verhoogd wordt. HVS is een potentieel levensbedreigende complicatie. Gustine et al vonden in een cohort van 825 onbehandelde WM patienten dat 14% een hyperviscositeitssyndroom (HVS) ontwikkelde38. Zij beschrijven bij een IgM van 60 g/L of hoger een mediane tijd tot het ontwikkelen van HVS van 3 maanden en een incidentie van HVS van 67%, terwijl dat bij een IgM van 50-60 g/L 36 maanden respectievelijk 32% was. Bij nog lagere IgM waarden werd dit uiteraard steeds langer, respectievelijk minder vaak. Serumviscositeitsmetingen werden niet genoemd. Op grond van de sterke verhoging van het risico op HVS bij IgM waarden van 60 g/L of hoger was hun advies deze waarde te hanteren als afkapwaarde voor het ontstaan van een behandelindicatie. Abeykoon et al beschreven 997 WM patienten, waarvan 13% een HVS ontwikkelde.37 In deze serie ontwikkelde slechts 15% van de patiënten met een IgM van 60 g/L of hoger een HVS en was de mediane tijd tot start behandeling 6.9 jaar. Alleen de serum viscositeit was gecorreleerd aan het ontstaan van HVS. In beide series was er geen relatie tussen het ontstaan van HVS en overleving. Er is geen goede verklaring voor de discrepantie in de resultaten van beide artikelen. In de recente ESMO guideline is het IgM van 60 g/l of hoger opgenomen als behandelindicatie, echter in de meest recente Mayo Smart richtlijn, IWWM-8 consensus richtlijn en “How I Treat” niet, hoewel van belang is dat deze deels gepubliceerd zijn voor het verschijnen van bovengenoemde publicaties. 15,48–50
Bewijskracht literatuur: Level 3, consistent.
Zoeken en selecteren
Er zijn zeer weinig relevante studies over behandelindicaties bij WM, daarom is er gebruik gemaakt van recente internationale richtlijnen en consensus statements alsmede de beide genoemde artikelen over het risico op HVS.
Overwegingen:
Bij WM bestaat er internationale consensus over behandelindicaties.50,51 Deze staan samengevat in tabel 4. en kunnen gebruikt worden voor het stellen van de diagnose symptomatische WM. In afwezigheid van een behandelindicatie is een afwachtend beleid aanbevolen (‘wait & see’). Over een serum IgM ≥ 60 g/L als behandelindicatie bestaan conflicterende data. Gezien de literatuur niet eenduidig is dat een dergelijk hoog IgM gepaard gaat met een sterk verhoogd risico op HVS wordt vooralsnog niet geadviseerd zondermeer te behandelen bij een serum IgM ≥ 60 g/L. De werkgroep vindt dat in deze situatie heel kritisch gekeken dient te worden naar het bestaan van HVS, inclusief anamnese, lichamelijk onderzoek en oogheelkundig onderzoek (fundoscopie) en bij aanwijzingen voor HVS behandeling te starten. Indien niet direct behandeld wordt bij deze waarden dient de patiënt nauw gecontroleerd te worden, en hierbij dient het oogheelkundig onderzoek regelmatig (bijvoorbeeld elke 3-6 maanden mede afhankelijk van dynamiek IgM stijging) herhaald te worden.
Aanbeveling(en)
Inleiding
HVS is een klinisch syndroom dat optreedt bij 10-30% van de patiënten met M. Waldenström en soms een eerste manifestatie van de ziekte. De symptomen bestaan uit huid- en mucosabloedingen, visusstoornissen door retinopathie, neurologische symptomen zoals hoofdpijn, duizeligheid, paresthesie, sufheid of coma en zelden hartfalen. De diagnose wordt gesteld middels fundoscopie (zie betreffende kopje onder diagnostiek van HVS). Echter bij een hoge verdenking kan behandeling gestart worden zonder fundoscopie. De vraag is wat de rol van plasmaferese is bij patienten met WM en HVS.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Plasmaferese wordt aanbevolen bij alle patiënten met symptomatisch HVS, onafhankelijk van het IgM en de gemeten plasma viscositeit (PV). Tevens dient snel werkende behandeling zo snel mogelijk te worden gestart (expert opinion / internationale consensus). |
|
C |
Omdat rituximab een initiële stijging van het IgM m-proteïne kan geven, wordt aanbevolen om gedurende de periode van HVS geen rituximab te geven tot het HVS onder controle is en het IgM gedaald is met chemotherapie. (expert opinion /internationale consensus).
|
Samenvatting literatuur
Resultaten
In de richtlijn van de British Society for Haematology wordt aangegeven dat plasmaferese wordt aanbevolen bij symptomatisch HVS, onafhankelijk van de gemeten plasma viscositeit.9 In de richtlijn van de American Society of Apheresis wordt aangegeven dat plasmaferese de huidige standaard van zorg is bij HVS. Bij klinische symptomen kan een vroege diagnose d.m.v. fundoscopie verdere progressie van HVS voorkomen. Wanneer het IgM stijgt boven een waarde van 40 g/l is er een verhoogd risico op HVS. Er worden geen aanbevelingen gedaan om op HVS te screenen bij deze waarden. 52
In de aanbevelingen van de Eighth International Workshop on Waldenström’s Macroglobulinemia wordt aangeven dat rituximab een initiële stijging van het IgM M-proteïne kan geven. Dit kan bij hoge basale waarden van IgM leiden tot HVS. Aanbevolen wordt om bij een IgM van 40 g/l of hoger gedurende de eerste een of twee chemotherapie behandelingen geen rituximab te geven.50 In een retrospectieve studie van Gustine et al.38 bij 825 nieuw gediagnosticeerde patiënten met M. Waldenström ontwikkelde 14% symptomatische hyperviscositeit. Een IgM van >60 g/l was geassocieerd met een mediane tijd tot symptomatische hyperviscositeit van 3 maanden.
In een retrospectieve studie van Abeykoon et al.37 van 997 patiënten met M. Waldenström werd symptomatisch HVS vastgesteld in 13% van de patiënten. De hoogte van het IgM bij diagnose was geen onafhankelijke voorspeller voor het ontwikkelen van hyperviscositeits gerelateerde symptomen. In het artikel van Stone 39 wordt benoemd dat de effectiviteit van plasmapherese bij HVS gebaseerd is op de eerste publicaties van deze techniek in de jaren 50, waarbij met plasmaferese de retinale afwijkingen en andere symptomen reversibel waren. Geadviseerd wordt om te plasmafereren met albumine (in tegenstelling tot plasma) en dagelijks te fereren tot de HVS symptomen zijn verdwenen. In de praktijk zijn vaak enkele plasmafereses (2-3 sessies) in de eerste dagen / week nodig om het IgM voldoende naar beneden te krijgen. Daarna kan het vaak met wekelijkse plasmaferese stabiel gehouden worden totdat de gestartte (snelwerkende) WM-therapie effectief de productie remt.
Bewijskracht literatuur: Level 2, consistentie n.v.t.
Zoeken en selecteren
Er werd voor deze uitgangsvraag geen systematische review verricht, maar wel gebruikt gemaakt van de recente richtlijnen van de British Society for Haematology, de Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia en de Guidelines on the Use of Therapeutic Apheresis in Clinical Practice-Evidence-Based Approach from the Writing Committee of the American Society for Apheresis.
Overwegingen
Ondanks dat er geen gerandomiseerde studies zijn voor de behandeling van HVS is de effectiviteit van plasmaferese bij hyperviscositeit algemeen geaccepteerd. Plasmaferese wordt meestal goed verdragen. Het wordt beschouwd als een veilige behandeling. Het betreft hier in alle gevallen aanbevelingen o.b.v. internationale consensus met een beperkte bewijskracht in de literatuur. Toch is de werkgroep van mening dat er voldoende aanwijzingen zijn is dat plasmaferese bij HVS een zinvolle behandeling is ter voorkoming en behandeling van ernstige complicaties zoals (retinale) bloedingen.
In de literatuur wordt geadviseerd om te starten met profylactische plasmaferese bij asymptomatische patiënten met een IgM >40 g/l vooraf aan de behandeling met rituximab. De werkgroep is van mening dat het meestal een praktischer alternatief is om rituximab behandeling bij een IgM >40 g/l uit te stellen tot het IgM d.m.v. chemotherapie gedaald is en niet profylactisch te plasmafereren. Dit is meestal mogelijk na 1-2 cycli chemotherapie. Verder is de werkgroep van mening dat op basis van de klinische diagnose / hoge verdenking van HVS de plasmaferese indicatie gesteld moet worden, en niet alleen op basis van de hoogte van het IgM of een viscositeitsmeting.
Zoekverantwoording
N.v.t.
Evidence:
Geen evidence tabellen, want een systematische search werd niet verricht.
Onder “IgM flare” wordt verstaan een tijdelijke stijging van het serum IgM (of IgM M-proteine) na behandeling met rituximab (of een rituximab bevattend combinatieregime). Hoewel er internationale consensus is dat dit fenomeen bestaat is er weinig systematisch onderzoek naar gedaan. De getallen hieronder komen uit de grootste gepubliceerde serie.53 Bij monotherapie met rituximab komt bij ongeveer 25% van de patienten een ≥ 25% stijging van het IgM voor (en bij 54% enige stijging van het IgM). Bij rituximab in combinatie met chemotherapie is het risico kleiner. Deze flare kan leiden tot verergering van IgM gerelateerde complicaties zoals hyperviscositeit of symptomatische cryoglobulinemie.
Het is belangrijk dat een IgM flare niet verward wordt met progressie of refractaire ziekte . De IgM flare kan snel na start behandeling beginnen (< 1 maand) en soms maandenlang aanhouden. Vrijwel altijd daalt het IgM uiteindelijk weer tot onder de uitgangswaarde (meestal gebeurt dit binnen 4 maanden). Aanvullend onderzoek en klinische evaluatie (bijvoorbeeld een stijgend Hb of het verdwijnen van ziekte gerelateerde symptomen) wijzen dan op een flare reactie. Bij blijvende twijfel over ziekteprogressie kan een beenmergonderzoek worden verricht maar meestal is dit niet nodig.
In het algemeen wordt aangeraden bij patiënten met hoge IgM waarden bij start (bijvoorbeeld > 40 g/L) de rituximab toediening uit te stellen tot het IgM gedaald is met behulp van chemotherapie (vaak na 1-2 cycli); danwel preventief plamaferese toe te passen. Zie hiervoor tevens het kopje: behandeling hyperviscositeitssyndroom.
Aanbeveling(en)
* “add-on”s voor bendamustine en bortezomib in de 1e lijn zijn recent goedgekeurd
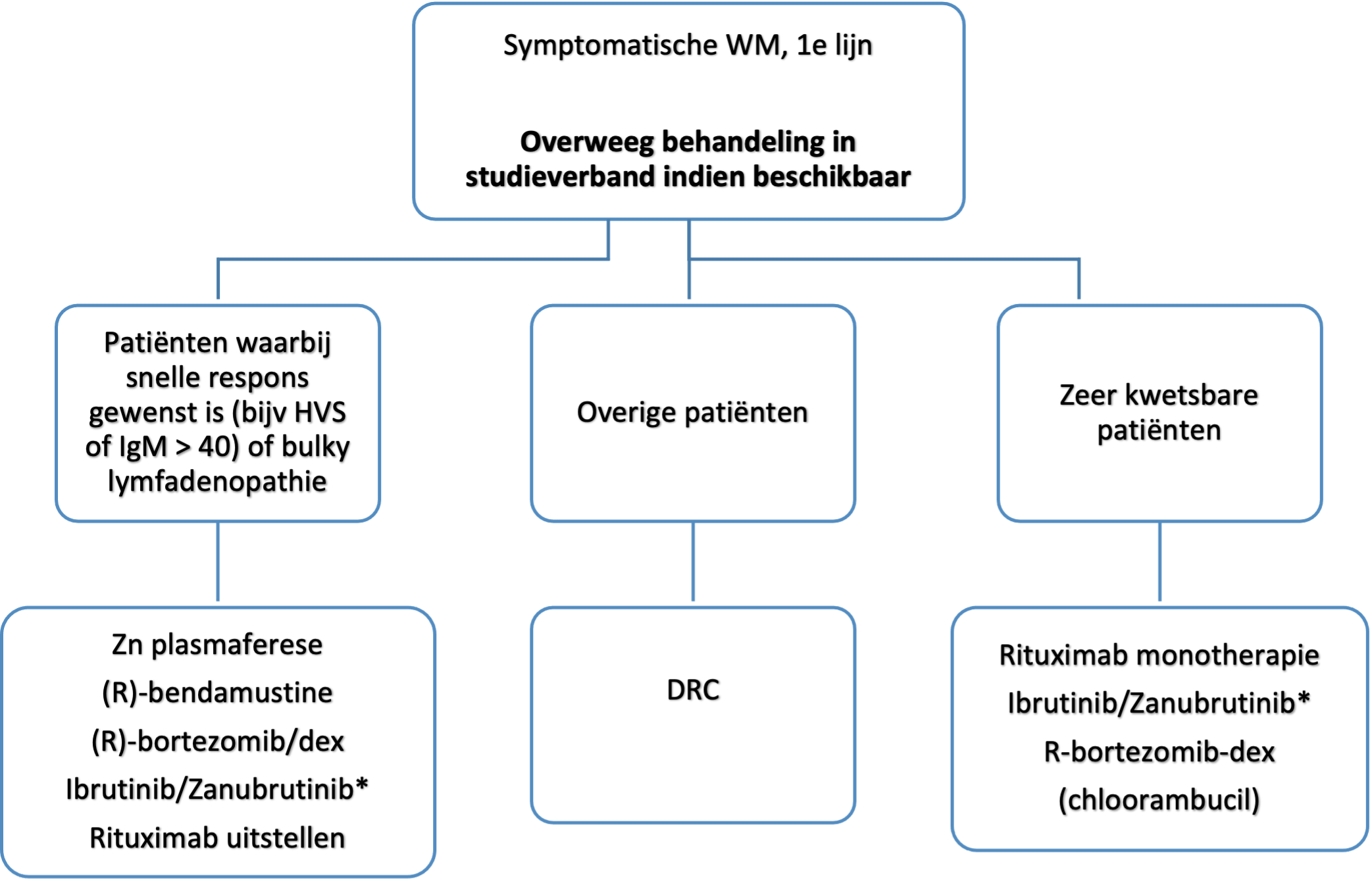
* Zanubrutinib vergoeding wordt voorbereid
Inleiding
Er zijn voor de behandeling van WM geen curatieve opties. Bij asymptomatische patiënten hoeft dan ook niet behandeld te worden. Het moment van start behandeling moet zorgvuldig gekozen worden, waarbij de eerdergenoemde behandelindicaties als leidraad dienen. Daarnaast is het belangrijk dat de gemiddelde leeftijd bij diagnose ongeveer 65 jaar is, en veel patiënten uiteindelijk niet aan de WM overlijden. Bij WM leidt een partiele respons vaak al tot een normalisatie van het hemoglobine een goede klinische verbetering. Kwaliteit van leven en progressievrije/ziekte gerelateerde overleving moeten dus naast de effectiviteit vooral bij de oudere patiënt worden meegewogen bij de behandelkeuze.
Gezien er geen duidelijkheid is over de beste eerstelijns behandeling, en verdere reductie van (late) toxiciteit van conventionele chemotherapie gewenst is, is het advies patiënten wanneer mogelijk in studieverband te behandelen. Voor een actueel overzicht van beschikbare studies wordt verwezen naar de HOVON website of kan overlegd worden met de leden van de HOVON WM subwerkgroep.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
B |
Rituximab-bevattende behandeling in de 1e lijn is bij WM geassocieerd met betere uitkomsten (response, PFS, overleving). |
|
B |
Het gebruiken van vincristine in de 1e lijn bij WM is geassocieerd met hoge kans op neuropathie en lijkt geen relevante bijdrage aan de effectiviteit te hebben |
|
B |
DRC is een effectief schema waarmee veel ervaring is, met een goede balans tussen toxiciteit en effectiviteit. Het wordt aanbevolen als behandeling voor WM patienten in de 1e lijn (expert opinion) |
|
B |
R-Bendamustine is effectiever (diepte van respons, PFS) ten opzichte van DRC maar kent wat meer toxiciteit. Het is een alternatieve 1e lijnsoptie bij wens tot snelle respons, diepe respons of uitgebreide lymfadenopathie, vooral bij wat fittere patiënten (expert opinion) |
|
B |
R-bortezomib-dexamethason is mogelijk effectiever dan DRC, maar gaat frequent gepaard met neuropathie |
|
B |
BTK remming middels Ibrutinib/Zanubrutinib is eveneens effectief in de 1e lijn bij WM, maar heeft specifieke eigen bijwerkingen en moet continu gebruikt worden |
Samenvatting literatuur
Resultaten
In tabel 4 is een samenvatting gemaakt van de schaarse gerandomiseerde studies. Dit zijn echter grotendeels gedateerde of kleine studies die niet aansluiten op wat algemeen als reguliere eerstelijnsbehandeling wordt gezien. In tabel 5 tm 7 wordt een samenvatting gegeven van de niet-gerandomiseerde prospectieve en retrospectieve data betreffende de meest gebruikte en geadviseerde behandelschema’s.
In de recente internationale richtlijnen van de IWWM, NCCN en ESMO worden Dexamethason-Rituximab-Cyclofosfamide (DRC), R-Bendamustine, en R-bortezomib-dexamethason (R-Bor-Dex) als geprefereerde eerstelijns opties genoemd.10,50,54 De data over deze 3 regimes zijn samengevat in tabel 5. De responsen zijn het diepst en langdurigst met R-bendamustine, gevolgd door R-Bor-Dex, gevolgd door DRC, al ontloopt het elkaar niet veel. Er lijkt geen verschil te zijn in overleving. Er zijn geen data die ondersteunen hoe op basis van patiëntenkarakteristieken voor een bepaald schema gekozen kan worden.
Het toevoegen van rituximab aan de behandelschema’s is gebaseerd op een subgroupanalyse binnen een “baskettrial” van de STiL groep waarbij bij WM R-CHOP superieur was aan CHOP zowel wat betreft response maar ook wat betreft “time to treatment failure”.55 Daarnaast laten retrospectieve data van diverse patientenregisters zien dat rituximab in de eerstelijn geassocieerd is met een langere overleving.56,57 Onder andere blijkt uit een grote Amerikaanse cohortstudie van 1310 WM patienten van 65 jaar of ouder dat een behandeling die rituximab bevatte geassocieerd was met een significant langere overleving en minder transfusiebehoefte.58
Rituximab monotherapie heeft enige effectiviteit, maar een beperkte “major response rate” (30-40%) en PFS (mediaan 20 maanden).59 Deze optie kan ingezet worden bij kwetsbare patiënten waarbij geen snelle of langdurige respons nodig is, en geen problemen verwacht worden van IgM flare. Ook kan het worden ingezet voor IgM gerelateerde ziekten (zie betreffende paragraaf).
Dexamethason-Rituximab-Cyclofosfamide (DRC) is een effectief schema waar inmiddels uitgebreide ervaring mee is, en dat goed getolereerd wordt. Het schema werd op basis van een prospectieve studie geïntroduceerd en vervolgens in diverse retrospectieve series geëvalueerd.60–62 In de praktijk blijkt dat patiënten veel misselijkheidsklachten ervaren bij de orale cyclofosfamide in de DRC kuur. Overwogen kan worden op dag 1 cyclofosfamide 1000 mg/m2 iv te geven in plaats van gedurende 5 dagen 2dd 100 mg/m2oraal zoals in het oorspronkelijke schema. Ook wordt wel 750 mg/m2 iv gegeven zoals in de R-CVP kuur. Op basis van klinische data en farmacologie is geen voorkeur te geven voor één van beide schema’s. De werkgroep heeft een voorkeur voor 1000 mg/m2 omdat dit het equivalent is van de orale dosis. Het advies is 6 cycli te geven, op basis van de oorspronkelijke trial.
Rituximab-bendamustine werd geintroduceerd bij WM op basis van een substudie in een grote gerandomiseerde “baskettrial” voor indolente lymfomen, waarbij het voor WM effectiever was dan R-CHOP.63 De effectiviteit van R-bendamustine werd daarna in een Franse prospectieve trial bevestigd, en in 2 retrospectieve series.62,64,65 Voor patiënten bij wie een snelle respons gewenst is, er een wens is tot een langere PFS of bij uitgebreide lymfadenopathie kan overwogen worden voor R-bendamustine te kiezen in de eerste lijn. Ook is het een optie bij IgM gerelateerde AL amyloidose (zie betreffende lemma). In de internationale praktijk blijkt dat vaak de dosis bendamustine gereduceerd wordt, zeker bij oudere patiënten. Dit kan dan gedaan worden door ofwel 4 in plaats van 6 cycli te geven, en/of door 70 mg/m2 ipv 90 mg/m2 te geven. De voor/nadelen hiervan ten aanzien van toxiciteit en effect zijn niet prospectief onderzocht. Wel blijkt dat in de in de eerder genoemde studies de volledige 6×90 mg/m2 vaak niet gehaald werd en dat dit geen belangrijk effect leek te hebben op de effectiviteit. Het advies is bij een snelle respons en/of veel toxiciteit de behandeling laagdrempelig te beperken tot 4 kuren, en al bij aanvang een gereduceerde dosis van 70 mg/m2 te overwegen bij oudere/kwetsbare patiënten.
Rituximab-Bortezomib-Dexamethason heeft in de 1e lijn goede resultaten op basis van 3 prospectieve studies, maar de hoge percentages neurotoxiciteit (ernstige perifere neuropathie komt vaker voor dan bij MM) maken het tot een minder aantrekkelijke optie.66–69 Wel geeft het een snelle respons dus het kan gebruikt worden bij patienten voor wie R-bendamustine als te zwaar ingeschat wordt maar bij wie wel een snelle repons gewenst is. Een alternatief in deze situatie is ibrutinib. Ook is behandeling met bortezomib een optie bij IgM gerelateerde AL amyloidose (zie betreffende lemma). De incidentie en ernst van bortezomib gerelateerde neuropathie kunnen sterk gereduceerd worden door het subcutaan en maximaal 1x/week toe te dienen. Een add on aanvraag voor bortezomib voor eerstelijnsbehandelig bij WM is inmiddels goedgekeurd.
Ibrutinib monotherapie is effectief in de eerste lijnsbehandeling van WM. Ibrutinib is het effectiefst bij patiënten die wel een MYD88 mutatie, maar geen CXCR4 mutatie hebben, gevolgd door patiënten bij wie beide genen gemuteerd zijn. De effectiviteit bij patiënten bij wie beide genen ongemuteerd zijn lijkt verminderd al is dat gebaseerd op nog weinig patienten.70 Nadeel is dat het middel doorgebruikt moet worden tot aan progressie. Bij zeer kwetsbare oudere patiënten is het goed te beseffen dat oudere leeftijd juist een risicofactor is voor ibrutinib toxiciteit.71 De voornaamste bijwerkingen zijn het risico op bloedingen (een voorgeschiedenis van ernstige bloedingen, of dubbele antistolling kunnen beschouwd worden als een contra-indicatie, en bij elke vorm van antistolling voor –en nadelen zorgvuldig afwegen), op atriumfibrilleren (bij patienten met leeftijd > 65 en eerder AF grootste risico) of hypertensie (bijvoorbeeld relevant als de patient al een slecht gereguleerde hypertensie heeft). Ibrutinib wordt momenteel in de 1e lijn alleen vergoed voor WM patienten die niet fit genoeg worden geacht voor behandeling met chemo-immunotherapie.
Zanubrutinib: voor een beschrijving van de resultaten met zanubrutinib zie onder kopje recidief setting, waar ook een lemma geweid is aan de vergelijking tussen beide middelen. Zanubrutinib wordt door de WM werkgroep beschouwd als een gelijkwaardig alternatief naast ibrutinib, de keuze kan geindividualiseerd gemaakt worden. Zanubrutinib vergoeding wordt voorbereid.
Rituximab-ibrutinib: In de gerandomiseerde “Innovate trial”73 werd rituximab monotherapie vergeleken met R-ibrutinib. Ongeveer 45% van de patienten werd in 1e lijn behandeld. De PFS na 2 jaar in deze groep bedroeg 84% met R-ibrutinib en 58% met rituximab monotherapie. De overall survival was niet verschillend (92-94% na 30 maanden). In de gehele trial (1e lijn + relapse) was de ORR 92% vs 47% en major response 72% vs 32%. Op basis van deze trial is er onvoldoende bewijs dat R-ibrutinib in de 1e lijn moet worden toegepast, zeker gezien de meerwaarde en toxiciteit ten opzichte van ibrutinib monotherapie niet bekend is.
Chloorambucil monotherapie is in 3 prospectieve en 1 grote retrospectieve serie onderzocht. In de grootste prospectieve serie 43 viel op dat bij 19% van de patienten een neutropenie graad 3 of hoger werd beschreven en een hoog percentage (20%) secundaire maligniteiten optrad. De ORR is ongeveer 50% en de PFS 27 maanden. Al met al lijkt chlorambucil vooral door de balans tussen werkzaamheid en toxiciteit geen aantrekkelijke optie in de eerste lijn, zeker niet bij kwetsbare patienten. Over de behandeling met rituximab gecombineerd met chloorambucil zijn geen data bekend bij WM.
Purine analoga (fludarabine, cladribine) zijn zeer effectief bij WM maar worden geassocieerd met veel toxiciteit op korte termijn (cytopenieen/infecties) en lange termijn (secundaire maligniteiten en transformatie) en worden daarom niet geadviseerd als eerstelijns behandeling.
Het toevoegen van vincristine (zoals in R-CVP of R-CHOP) leidt bij WM patiënten veel vaker tot neuropathie dan bij andere behandelindicaties: tot 50-70% bij R-CHOP of CVP. De behaalde responsen van de vincristine bevattende schema’s versus de schema’s zonder vincristine zijn vergelijkbaar. Dit is beschreven in een grote retrospectieve serie72 R-CHOP is bovendien inferieur gebleken ten opzichte van R-bendamustine in een subset analyse van een prospectieve gerandomiseerde trial. 63 Het gebruik van vincristine dient daarom vermeden te worden bij WM patienten.
Rituximab-ixazomib-dexamethason: Castillo et al. 74 pasten ixazomib gecombineerd met rituximab en dexamethason toe in een prospectieve trial bij 26 patiënten met WM in de eerste lijn, waarbij 6 inductiecycli (elke 4 weken) werden gevolgd door 6 onderhoudscycli (elke 8 weken). Hierbij werd een ORR van 96% bereikt en met en mediane follow up van 22 maanden was de mediane PFS niet bereikt. Ixazomib is momenteel niet geregistreerd voor de behandeling van WM.
Rituximab-carfilzomib-dexamethason: In 2014 werd een prospectieve studie van “R-car-dex” in de 1e lijn bij 31 WM patienten gepubliceerd waarvan 91% eerstelijns behandelin betrof. De overall en major response rate waren respectievelijk 87% en 67%, de PFS na 15 maanden was 64%. 75 Carfilzomib is momenteel niet geregistreerd voor de behandeling van WM.
Tabel 5: Samenvatting literatuur
Bewijskracht literatuur: Level 2
Zoeken en selecteren
Er werd voor deze uitgangsvraag geen systematische review verricht. Er werd gebruikt gemaakt van de recente richtlijnen van de British Society for Haematology, de Treatment recommendations from the Eighth International Workshop on Waldenström’s Macroglobulinemia, de ESMO guidelines, de mSMART guideline, en zeer recente review “ How I treat Waldenström’s Macroglobulinemia “ .9,10,15,50 De referenties uit deze artikelen werden indien van toepassing opnieuw beoordeeld.
Aanvullend werden in pubmed searches gedaan naar de verschillende middelen in combinatie met de termen WM of Waldenström’s of Waldenström of Waldenstrom of Waldenstroms.
Overwegingen
Internationaal is er geen consensus over een geprefereerde eerstelijnsbehandeling. Wel wordt in het algemeen gecombineerde immunochemotherapie als voorkeursbehandeling in de eerste lijn genoemd, maar ook ibrutinib monotherapie of rituximab monotherapie worden genoemd. Gebaseerd op de beschrevenresultaten uit klinische studies en de internationale richtlijnen is de werkgroep van mening dat DRC voor de meeste WM patienten een geschikte 1e lijns behandeling blijft gezien de effectiviteit, het milde bijwerkingenprofiel en de ruime (inter)nationle ervaring met dit schema. Overwogen kan worden de cyclofosfamide intraveneus toe te dienen. De ervaring is dat hiermee minder misselijkheid en braken optreedt vergeleken met 5 dagen orale toediening.
Sinds het verschijnen van de vorige richtlijn zijn diverse prospectieve en retrospectieve studies gepubliceerd over R-bendamustine als 1e lijnsbehandeling bij WM. Het lijkt effectiever (diepere responsen/langere PFS) ten opzichte van DRC, maar ook wat toxischer (cytopenieen, soms langdurig, kans op infecties) alhoewel dit laatste moeilijk te vergelijken is o.b.v. de literatuur. Vaak wordt geadviseerd een gereduceerde dosis (70 mg/m2) of een beperkt aantal cycli (4 i.p.v. 6) toe te passen. Uit de gepubliceerde studies blijkt ook dat een mediaan aantal cycli van 4 a 5 gegeven is. De lange termijn toxiciteit (secundaire maligniteiten) ten opzichte van bijvoorbeeld DRC is onduidelijk. Hetzelfde geldt voor de stamceltoxiciteit en de mogelijkheid van het oogsten van stamcellen na behandeling met bendamustine. Hoewel hier weinig gepubliceerde ervaring mee is, lijkt dit laatste geen groot probleem. Internationaal wordt het als een valide eerstelijns optie beschouwd bij wens tot snelle respons, en bij veel extramedullaire lokalisaties.
R-bortezomib-dexamethason is tot slot eveneens een vrij effectief schema waarmee enkele prospectieve studies zijn verricht in de 1e lijn. Het gaat wel gepaard met neurotoxiciteit, en dit lijkt bij WM een groter probleem dan bij MM alhoewel in de 1e studies bij patienten met WM bortezomib vaak 2x/ week intraveneus werd toegediend . Het optreden van neurotoxiciteit kan waarschijnlijk grotendeels voorkomen worden door subcutane toediening maximaal 1x/week aan te houden. Internationaal wordt het als een valide eerstelijns optie beschouwd.
Behandeling met purine analoga wordt ontraden in de 1e lijn, alhoewel deze middelen effectief zijn bij WM gaan ze gepaard met relatief veel korte termijn toxiciteit (cytopenieen, infecties). Verder zijn er zorgen over de lange termijn toxiciteit (secundaire maligniteiten) alhoewel over dit laatste harde data ontbreken. Internationaal wordt het niet als een geprefereerde eerstelijns optie beschouwd.
De ervaring is dat DRC, R-Bendamustine in aangepaste dosis en R-bortezomib-dexamethason tot op hoge(re) leeftijd kunnen worden toegepast. Voor patienten die desondanks te kwetsbaar zijn voor deze behandelingen kan bij beperkte ziektelast rituximab monotherapie worden overwogen. Alternatief is ibrutinib monotherapie, alhoewel juist bij oudere patiënten de kans op de genoemde bijwerkingen verhoogd is. Chloorambucil monotherapie kent een relatief lage effectiviteit en (mede afhankelijk van dosering) toch nog veel toxiciteit, het lijkt voor deze groep daarmee niet een geprefereerde optie.
De werkgroep ziet geen rol voor ibrutinib/zanubrutinib in de 1e lijn buiten bovengenoemde situatie, aangezien langdurige behandeling nodig is (tot aan progressie of toxiciteit, na het staken van BTK-remmers treedt over het algemeen snel een flare van de ziekte op) en over de lange termijn bijwerkingen en effectiviteit in deze setting nog vrij weinig bekend is. Hetzelfde geldt voor de combinatie van rituximab en ibrutinib.
Ten aanzien van de overige genoemde behandelingen (combinaties met carfilzomib, ixazomib) geldt, dat er nog te weinig data zijn om deze in de eerste lijn aan te bevelen.
Aanbeveling(en)
Inleiding
Toevoeging van rituximab aan de chemotherapeutische behandeling van WM heeft de progressievrije overleving van patienten verbeterd. Er is geen curatieve behandeling van WM en nagenoeg alle patienten krijgen op den duur een recidief. De plaats van onderhoudsbehandeling met rituximab na inductiebehandeling is onduidelijk, in tegenstelling tot bij folliculair lymfoom, waar onderhoudsbehandeling is aanbevolen.
Conclusies
|
SORT Grade |
Conclusie |
|
B |
Er is geen bewijs dat rituximab onderhoud leidt tot een langere PFS of overlevingsvoordeel. |
Samenvatting literatuur
Resultaten
Naar analogie met de onderhoudsbehandeling van het folliculair lymfoom 107, is in verschillende centra rond 2000 begonnen met het geven van een onderhoudsbehandeling met rituximab (anti CD-20). Hierbij werden alleen de patiënten die respondeerden op een rituximab bevattend schema geselecteerd voor onderhoudsbehandeling.108,109 Er zijn geen prospectieve of gerandomiseerde studies. De enige vergelijkende retrospectieve studie werd gepubliceerd in 2011: uitkomsten werden gemeten bij 248 rituximab naieve patiënten die hadden gerespondeerd op een rituximab bevattend schema. Van deze 248 patiënten kregen 86 patienten onderhoudsbehandeling met rituximab (R-onderhoud). In de groep behandeld met R-onderhoud was niet alleen de progressievrije overleving langer (56,3 versus 18,6 maanden), maar ook de totale overleving (niet bereikt versus 116 maanden). De IgM respons was beter en de hematocriet was hoger in de maintenance groep. In de maintenance groep was het aantal infecties hoger, maar het grootste deel hiervan was ≤ graad 2.110 Het was onduidelijk op welke criteria werd besloten of een patiënt wel of niet onderhoudsbehandeling zou krijgen.
In een retrospectieve studie74 werden verschillende schema’s vergeleken (CDR, Benda-R en bortezomib-dexamethasone-rituximab (BDR)) met of zonder Rituximab onderhoud. Van 182 patienten kregen 57 (31%) benda-R; 87 (48%) BDR en 38 (21%) CDR; 116 patienten werden behandeld met Rituximab onderhoud. Rituximab onderhoudsbehandeling ging gepaard met betere “major response rates” (97% versus 68%), betere PFS (6,8 jaar versus 2,8 jaar) en een betere 10 jaar “overall survival rate” (84% versus 66 %). In verschillende recente internationale guidelines (SMART,ESMO). wordt onderhoudsbehandeling met rituximab bij Waldenström niet geadviseerd.10,49 Momenteel loopt in Duitsland een prospectieve gerandomiseerde studie naar de waarde van rituximab onderhoudsbehandeling na inductie met R-bendamustine bij patienten met NHL waaronder WM (NCT00877214; [MAINTAIN]). Hierbij werden alle patienten die respondeerden op de R-bendamustine gerandomiseerd tussen 2 jaar rituximab onderhoud of een expectatief beleid. De definitieve resultaten van deze studie zijn nog niet gepubliceerd. Uit een abstract met de eerste resultaten blijkt dat er na een mediane follow-upduur van 5,9 jaar geen voordeel m.b.t. PFS of OS gevonden werd van 2 jaar rituximab onderhoudsbehandeling (na R-bendamustine inductie).
Zoektermen literatuuranalyse: rituximab maintenance Waldenström
Overwegingen
Er zijn geen gepubliceerde gerandomiseerde of prospectieve studies naar de voordelen van rituximab onderhoud. De enige publicaties betreffen retrospectief onderzoek. Hoewel de baseline karakteristieken van de groepen uit de vergelijkende retrospectieve studie ongeveer hetzelfde zijn, zijn er factoren zoals tolerantie van rituximab, socio-economische status en andere maligniteiten in voorgeschiedenis, die het deelnemen aan onderhoudsbehandeling kunnen beinvloeden. Er kan daarnaast een bias ontstaan doordat vooral patienten die goed respondeerden op R-chemotherapie de onderhoudsbehandeling kregen. Dit is een groep patienten met inherent een betere prognose. De eerste resultaten, alhoewel alleen als abstract gepubliceerd, van een prospectieve gerandomiseerde studie naar R-onderhoud na R-bendamustine inductie laten na 6 jaar follow up geen voordeel zien. Er zijn geen data bekend over de respons op behandeling van patiënten die langdurig met rituximab onderhoud zijn behandeld. Op theoretische gronden zou de CD20 expressie kunnen afnemen en en daarmee de gevoeligheid voor rituximab. Ook kan chronisch rituximab gebruik leiden tot toxiciteit (immunosuppressie/infecties). Op grond van de bestaande literatuur kan geen aanbeveling voor het geven van onderhoudsbehandeling met rituximab worden afgegeven.
Aanbevelingen
*Zanubrutinib vergoeding wordt voorbereid
Inleiding
Voor behandeling van recidief WM bestaan diverse mogelijkheden. Er is een gebrek aan vergelijkende prospectieve studies in deze setting en ook internationaal is er geen consensus over de geprefereerde recidiefbehandeling. Nieuw ten opzichte van de vorige richtlijn zijn de beschikbaarheid van ibrutinib en van data met langere follow up over combinaties met bortezomib en bendamustine. Op basis van de beschikbare literatuur en internationale richtlijnen wordt hieronder een leidraad geformuleerd bij het maken van een keuze.
Samenvatting literatuur
Resultaten
Rituximab-refractaire patiënten: Rituximab refractoriteit in eerste lijn is zeldzaam bij WM. Er is een kleine prospectieve studie verricht specifiek voor deze groep patiënten. In de Innovate trial werden 31 patiënten met rituximab refractaire ziekte geïncludeerd.76 De patiënten hadden eerder mediaan 2 lijnen van therapie gehad en bereikten met Ibrutunib monotherapie een mediane follow up (FU) van 18 maanden een ORR (overall response rate; gedefinieerd als CR+VGPR+PR+MR) van 90% , een MRR (major response rate; gedefinieerd als CR+VGPR+PR) van 71% en een 18 mnd PFS van 86%.
BTK remmers
Ibrutinib: In de prospectieve studie van Treon et al. werden 63 recidief patiënten behandeld waarvan 40% refractair was op de laatste behandeling.75 De ORR was 90.5% (95% CI 80.4 – 96.4) en de MRR 73.0% (95% CI, 60.3 – 83.4). De mediane tijd tot minor respons was 4 weken en de respons was onafhankelijk van eerdere lijnen van therapie of refractaire ziekte. Bij 24 maanden FU was de geschatte PFS 69.1% (95% CI, 53.2 – 80.5). In een recente publicatie met langere follow-up duur van mediaan 59 maanden was de ORR gelijk en de MRR gestegen naar 79.4%. De mediane 5 jaars PFS was niet bereikt en was 70% voor MYD88mut/CXRC4wt en 38% voor MYD88mut/CXRC4mut, de mediane PFS was 0.4 jaar voor MY88wt patienten. De 5 jaars OS was 87%.105 . Belangrijkste bijwerkingen CTC graad 2 of hoger waren neutropenie (22%), trombocytopenie (14%), post procedurele bloeding (3%) en boezemfibrilleren (AF) (5%). Bij WM patiënten met MYD88 WT is de effectiviteit van Ibrutinib minder dan bij patiënten met MYD88 L265P of non-L265P mutaties. Echter, dit is gebaseerd op slechts 7 patiënten en moet verder onderzocht worden.
Zanubrutinib: Er zijn inmiddels 4 prospectieve klinische trials met zanubrutinib behandeling voor WM gepubliceerd.In een fase II studie werd bij 77 (24 onbehandeld, 53 recidief) patienten een ORR van 97% bereikt, met een relatief hoog percentage diepe responsen (44% VGPR, 1 CR).97 De mediane PFS na 2 jaar was niet bereikt.
Inmiddels is een fase III studie afgerond waarin zanubrutinib gerandomiseerd werd vergeleken met ibrutinib.98 Hierin werden 201 patienten gerandomiseerd (164 recidief/refractair, 37 onbehandeld) tussen ibrutinib en zanubrutinib. De ORR/Major response rate was gelijk: 93%/78% (ibrutinib) versus 94%/77% (zanubrutinib). Wel was het aantal diepe response hoger bij zanubrutinib (28% VGPR) dan ibrutinib (19%). Er werd in beide groepen geen CR bereikt. De medianse PFS was niet bereikt na 18 maanden follow up. De toxiciteit was significant verschillend wat betreft atriumfibrilleren/flutter wat meer voorkwam bij ibrutinib (15,3% versus 2%) en neutropenie wat meer voorkwam bij zanubrutinib (29.7% versus 13,3%). Het aantal infecties was gelijk in beide groepen (~67%).
Binnen de Aspen studie was er een separaat niet-gerandomiseerd cohort waarin enkel MYD88 wildtype WM patienten werden behandeld met zanubrutinib.99 Hierin werden 28 patienten (23 recidief/refractair, 5 onbehandeld) geincludeerd, de ORR was 81% en de major response rate 50%, de PFS na 18 maanden was 68%.
In China werd tevens een fase II studie verricht bij 44 recidief WM patienten, hierbij werd een ORR van 77% behaald, en een 70% major response rate.96 De mediane PFS was niet bereikt na 33 maanden. De meest voorkomende ≥3 AE was hypertensie (11%). (ref A Phase II Trial of the Bruton Tyrosine-Kinase Inhibitor Zanubrutinib (BGB-3111) in Patients with Relapsed/Refractory Waldenström Macroglobulinemia | Clinical Cancer Research (aacrjournals.org)) Het is niet duidelijk waar de lagere effectiviteit in deze studie door verklaard wordt.
Zanubrutinib is inmiddels door de EMA goedgekeurd voor de indicatie WM (recidief of eerstelijn en unfit voor chemotherapie), vergoeding wordt voorbereid.
Bendamustine: In de gepubliceerde studies met bendamustine als recidiefbehandeling wordt niet specifiek vermeld of patiënten rituximab refractair waren. Paludo et al analyseerden 160 opeenvolgende patiënten die werden behandeld met DRC (100 pt) of R-bendamustine (60 pt) waarvan er respectivelijk 50 en 43 recidief ziekte hadden.65 Een trend voor langere PFS werd gezien met R-bendamustine met gelijke bijwerkingen. MYD88 status had geen effect op therapie effect. In een retrospectieve analyse van 30 recidief WM patiënten met mediaan 5 eerdere lijnen van therapie werd bendamustine 90 mg/m2 dag 1 en 2, al dan niet gecombineerd met rituximab (BR), ofatumumab of als monotherapie , en werd een MRR bereikt van 83.3% en een mediane PFS van 13,2 maanden. Mediaan aantal cycli was 5.77 In een grotere Italiaanse studie met 71 patiënten, mediaan 2 eerdere lijnen van therapie, werden patiënten behandeld met BR waarbij de bendamustine gedoseerd werd tussen de 40 en 90 mg/m2 op dag 1 en 2.78 Maximaal en ook mediaan werden 6 cycli gegeven waarbij de hogere doseringen geassocieerd waren met een betere respons. Na een mediane FU van 19 mnd (3-54) was de mediane PFS niet bereikt en de 4 jaars overleving 72%.
Bortezomib: Er zijn 4 multicenter studies beschreven met gebruik van bortezomib in recidief patiënten maar ook in deze studies is niet duidelijk is of de patiënten rituximab refractair waren. Echter omdat in 3 van de 4 studies bortezomib zonder rituximab wordt gegeven worden ze hier besproken. Rituximab-bortezomib is onderzocht in een prospectieve studie met 37 patiënten met recidief ziekte.79 De bortezomib dosis was 1.6 mg/m2 iv op dag 1,8,15 per 28 dg, totaal 6 cycli, de rituximab werd gegeven op dag 1,8,15,22 van cyclus 1 en 4. De totale behandeling met 6 cycli werd door 78% van de patiënten afgerond. De ORR was 81%, de mediane PFS was 15.6 mnd. Belangrijkste bijwerkingen waren graad 1-2 hematologisch, moeheid, neuropathie en diarree, in respectievelijk 81%, 68%, 41% en 37% van de patiënten. Acht patiënten (22%) ontwikkelde een tijdelijke stijging in IgM meting na de eerste cyclus.
Bortezomib monotherapie is onderzocht in de WMCTG Trial 03-248 studie. 80 In deze multicenter studie werden 27 recidief patiënten behandeld met maximaal 8 cycli bortezomib iv, 1.3 mg/m2,, dag 1, 4, 8, 11 per 21 dagen. Vijftien patiënten waren refractair op hun voorgaande behandeling 3 patiënten hadden symptomatisch HVS. De respons was snel met mediaan 1.4 mnd. Opvallend was dat een plotselinge stijging werd gezien in M proteine (> 10%) na staken in 13 patiënten die bij sommige spontaan weer daalde. De ORR was 85%, CTC graad 3/4 bijwerkingen waren sensorische neuropathie (22.2%), leukopenie (18.5%), neutropenie (14.8%), duizeligheid (11.1%), en trombocytopenie (7.4%). Mediaan werden 6 cycli gegeven (range 3-8), en 33.3% van de patiënten heeft 8 cycli ontvangen. De mediane TTP was 6.6 maanden (range, 2.9-21.4+) en met een mediane FU van 18.2 maanden waren 17 van de 23 responderende patiënten progressief. In een Canadese fase II studie werden 27 patiënten geïncludeerd waarvan 56% eerder was behandeld.81 Bortezomib werd gegeven zoals in de WMCTG studie, de ORR was 78% en er was geen verschil tussen de novo en recidief patienten. Mediane PFS was 16.3 maanden en 27 patiënten (74%) ontwikkelden neuropathie of hadden toename van bestaande neuropathie.
Overige (niet-rituximab refractaire) patienten met recidief WM: Het gebruik van bendamustine en bortezomib is hierboven beschreven, zowel in combinatie met rituximab als zonder.
Alkyleerders: DRC is geanalyseerd en dubbel gepubliceerd door Paludo et al in de recidief setting. 61,65Indien gebruikt als 2de lijns therapie of verder (range 2-8) voltooiden 71% van de patiënten de 6 cycli, de mediane tijd tot respons was 6.8 mnd (mediaan 0.5-28). De ORR was 87% waaronder 4% VGPR, 64% PR en 19% MR. Ook is cyclosfosfamide (750 mg/m2) in combinatie met doxorubicine (25 mg/m2) en prednison (40 mg/m2), dag 1-5, onderzocht in een gerandomiseerde studie met matige responsen en dit betreft een combinatie die in Nederland niet gebruikt wordt. 82
Purine analogen: De purine analogen zijn effectieve therapieën, echter geassocieerd met toegenomen toxiciteit zoals langdurige cytopenieen. In een prospectieve studie met 29 patiënten werden 4 cycli rituximab-cladibrine gegeven in zowel de novo als recidief patiënten. De ORR was 9.6% en er was geen verschil tussen de 2 groepen. Met een mediane FU van 43 maanden werd er geen transformatie vastgesteld, de mediane PFS was niet bereikt, deze werd geschat met als laagste 95% CI level op 60 mnd.83 Fludarabine (25 mg/m2 dag 1-5) monotherapie, 6 cycli, is onderzocht in een prospectieve, multicenter, gerandomiseerde studie vs CAP (cyclophosphamide, doxorubicin, prednisone). De MRR van fludarabine was 30% en de mediane duur van respons 19 maanden, de toxiciteit was voornamelijk hematologisch.82 Er zijn 2 retrospectieve studies waarbij fludarabine is gecombineerd met rituximab en cyclofosfamide (FCR) in 82 (met 57 recidief patiënten) en 40 patiënten.84,85 De ORR was tussen de 82-85.4%, de PFS bij 36 maanden 73% en mediaan 77 maanden. Mediaan werden 5 tot 6 cycli gegeven waarbij 1/3 van de patiënten minder dan 6 cycli kregen. Voortdurende responsen werden na staken therapie gezien. Een kleine prospectieve fase 2 studie met 12 recidief patiënten met ofatumumab (niet beschikbaar) en dag 1-3 fludarabine (25 mg/m2) cyclofosfamide (250 mg/m2) iv per 28 dg voor 4 cycli gegeven. Vier patiënten waren refractair voor Rituximab. De ORR was 92% en mediane tijd tot response 2.2 mnd. Mediane FU was 23 mnd en 75% was nog in remissie.86
Nieuwe middelen/combinaties (op dit moment nog geen van allen geregistreerd/vergoed voor patiënten met WM)
Rituximab + Ibrutinib: In de Innovate studie werd in totaal in 150 patiënten (zowel eerstelijns als recidief) rituximab + placebo vergeleken met rituximab-ibrutinib. R-placebo werd gegeven met ibrutinib in de standaard dosering van 1 dd 420 mg en Rituximab werd gegeven in een dosis van 375 mg/m2 wekelijks in week 1-4 en week 17-20.
In de rituximab-ibrutinib arm waren de CTC gr 3 bijwerkingen die meer voorkwamen vs rituximab; AF (12% vs. 1%) en hypertensie (13% vs. 4%), het aantal klinisch belangrijke bloedingen was gelijk (4%). Ongeveer 55% van de patiënten was eerder behandeld en de 24 mnd PFS voor deze recidief patiënten was 80%.
Nieuwe proteasoomremmers
Ixazomib citraat: In de recent gesloten HOVON 124 studie zijn in totaal 60 patiënten met recidief WMgeïncludeerd en behandeld met de orale proteasoom remmer ixazomib in combinatie met rituximab en dexamethason. Patiënten mochten geen recidief hebben binnen 6 mnd na einde rituximab therapie. De finale analyse op het primaire eindpunt met een mediane FU van 24 maanden) toonde dat 71% van de patiënten tenminste een minor response bereikte na 8 cycli (19%≥VGPR, 52%≥PR, 71%≥MR), en de beste ORR on protocol was 88% (2% CR, 22% VGPR, 44% PR, 20% MR). De mediane duur van de respons en mediane PFS waren nog niet bereikt.Ixazomib is momenteel niet geregistreerd voor de indicatie WM.
Carfilzomib: Behoudens de enkele recidief patienten in de onder het kopje 1e lijn genoemde carfilzomib studie, is er geen prospectief onderzoek naar carfilzomib in de recidief setting. Er is een serie met 7 recidief WM patienten (mediaan 2 eerdere lijnen, 2 patienten waren bortezomib refractair) gepubliceerd. De PFS was gemiddeld 15 maanden.106 Carfilzomib is niet geregistreerd voor deze indicatie.
Oprozomib: In een fase 1-2 studie bij 31 R/R WM patienten werd een ORR van 47-71% beschreven met een mediane PFS van 17-21 maanden. Voornaamste graad 3-4 AE’s waren diarrhee (26%) en misselijkheid/braken (25%). Oprozomib is geen geregistreerd geneesmiddel.
Nieuwe BTK remmers: Recent werden resultaten gepresenteerd van de eerste studies met de nieuwe BTK remmers acalabrutinib en zanubrutinib bij WM.
Het gebruik van acalabrutinib in WM patiënten is recent beschreven door Owen et al.88 Honderd en zes patiënten werden behandeld met 2 dd 100 mg acalabrutinib, waarvan 92 recidief patiënten en 33 patiënten refractair op hun laatste therapie. De ORR voor de recidief groep was 93% (IQR 86–98 ) en de MRR 78% (IQR 68–86 ). Ook hier bleek dat in de MYD88 WT groep de responsen lager waren met een ORR van 79% en MRR 64% maar duidelijk beter dan eerder gerapporteerd in de eerder genoemde ibrutinib studie. De 24 mnd PFS voor de recidief groep was 82%. De mediane tijd tot beste response was 4.6 maanden (IQR 1.9-9.2). Bijwerkingen waren vooral hoofdpijn, diarree, duizeligheid, moeheid, misselijkheid, gewrichtspijn en bovenste luchtweg infecties. De meest voorkomende graad 3-4 bijwerkingen waren neutropenie (16%) en pneumonie (7%) . Acalabrutinib is niet geregistreerd voor WM en kan momenteel niet worden voorgeschreven.
Er verscheen een kleine fase II studie met de BTK remmer Tirabrutinib bij 27 WM patienten (18 onbehandeld, 9 recidief/refractair) waarbij de ORR 94-100% was. Voornaamste bijwerking was een rash bij 44% en neutropenie bij 26%. Gezien dit slechts 1 enkele kleine studie betreft ziet de werkgroep momenteel geen rol voor het middel bij de behandeling van WM. 103 Tirabrutinib is niet geregistreerd voor deze indicatie.
Venetoclax: Er is 1 fase II studie gepubliceerd waarin 32 recidief WM patienten behandeld werden met maximaal 800 mg 1dd venetoclax gedurende 2 jaar. De mediane follow up was 33 maanden. De ORR was 84%, 81% major response en 19% VGPR. . De mediane PFS was 30 maanden. Er was slechts 1 graad ≥ 3 behandeling-geassocieerde SAE (neutropene koorts). Er was een tumorlyse in het lab zonder klinische consequenties bij 1 patient. 50% van de patienten werd eerder met een BTK-i behandeld, 38% was refractair op de vorige behandellijn. Venetoclax is niet geregistreerd voor deze indicatie.
Idelalisib: Een fase II studie met idelalisib bij recidief WM patienten werd vroegtijdig afgebroken vanwege levertoxiciteit. In een prospectieve studie met obinutuzumab+ idelalisib werden 48 recidief WM patienten behandeld met 6 cycli van de combinatie en 2 jaar idelalisib onderhoud. De ORR was 71% met 65% major response rate, een mediane PFS van 25,4 maanden. De toxiciteit was hoog: 87% had een graad 3-4AE. O.a. 9,4% neutropenie, 8,6% diarrhee, 9,3% levertoxiciteit en 2 CMV reactivaties 13/53 moesten stoppen met de behandeling ivm toxiciteit. De werkgroep beoordeelt deze combinatie gezien de balans tussen effect en bijwerkingen als niet aantrekkelijk voor WM behandeling vooral gezien de beschikbare alternatieven. 101, 102
IMIDs: Lenalidomide 25 mg 1dd gecombineerd met rituximab werd onderzocht in een prospectieve studie met 16 patienten waarvan 4 met recidief ziekte. Bij 13 van de 16 patienten ontstond een onverwacht ernstige anemie, ook bij lagere doseringen, zonder hemolyse of andere cytopenieen. De ORR was 50% met 25% majeure responsen.90 Door deze ernstige bijwerking is het middel voor de behandeling van WM daarna grotendeels verlaten. Er verscheen enige jaren later een prospectieve dose-escalation studie waarin bij 17 recidief WM patienten de maximal tolerated dose 15 mg bleek (dag 1-21/28, behandeling gedurende 1 jaar )te zijn. De mediane tijd tot progressie was 16 maanden (95% CI 5.5-26), en de meest voorkomende AE ≥ grade 3 waren 14% anemie and 43% neutropenie. 91
Daratumumab: De prospectieve studie naar daratumumab bij R/R WM werd vervroegd afgebroken wegens een te beperkte respons: de ORR was 23% bij de 13 geincludeerde patienten, major response rate 15% en een mediane PFS van 2 maanden. 100
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed, “Waldenstrom Macroglobulinemia”, “clinical trial”, met of zonder “relapse”. Dit resulteerde in 117 publicaties. Na titel en abstract screening werden er 15 publicaties geselecteerd en in zijn geheel bestudeerd. De referenties van deze artikelen werden tevens gecontroleerd op gemiste relevante artikelen. Daarnaast werden bij de werkgroep bekende recente internationale richtlijnen en reviews geraadpleegd (zie referenties onder zoekstrategie 1e lijnsbehandeling).
Naar aanleiding van een herhaling van de search in september 2021 werd de literatuur geupdate.
Tabel 6: Samenvatting relevantste literatuur
Overwegingen
Eerste recidief, algemeen
Net zoals bij eerstelijns therapie, wordt therapie in de recidief setting pas gestart als er een behandelindicatie ontstaat (symptomatische WM, zie desbetreffende criteria). Bij alleen een asymptomatisch biochemisch recidief zal dus eerst een wait and see beleid gevolgd worden.
Het advies is patiënten met refractair of recidief WM indien mogelijk in studieverband te behandelen. Voor een actueel overzicht van beschikbare studies wordt verwezen naar de HOVON website (lymfoomwerkgroep, studies of LLPC werkgroep, studies) of kan overlegd worden met de leden van de HOVON WM subwerkgroep.
Gezien het gebrek aan robuuste (vergelijkende) data uit prospectieve studies bij deze zeldzame aandoening is er niet een voorkeursbehandeling vast te stellen. De keuze uit de mogelijke behandelingen is zal dus altijd gebaseerd zijn op een weging van ziekte –en patiënt karakteristieken en voorkeuren van de patiënt. Het is belangrijk mee te nemen wat de diepte en de duur van de respons van de eerdere behandeling is geweest, samen met de mogelijke (persisterende) toxiciteit van de eerdere behandeling. Bij het opstellen van onderstaande adviezen is behalve op de genoemde data uit behandelstudies ook gekeken naar de adviezen uit recente internationale richtlijnen.10,15
Eerste recidief: Vroeg recidief na immuno-chemotherapie, rituximab refractaire patienten
Er zijn weinig data op basis waarvan de optimale behandeling voor deze patientengroep kan worden vastgesteld. Bij rituximab refractaire patiënten (refractair of recidief < 6 maanden na rituximab bevattende immunochemotherapie) betreft de enige prospectieve studie ibrutinib monotherapie en dit lijkt in deze setting de meest effectieve optie.
Bij een contraindicatie voor ibrutinib zou in deze setting ook bendamustine of bortezomib (s.c., wekelijks) met dexamethason kunnen worden overwogen aangezien dit behandelingen zijn die ook zonder rituximab in de recidief setting effectief zijn, alhoewel er amper data over de effectiviteit zijn specifiek in de rituximab refractaire populatie. Voor de indicaties voor autologe en allogene stamceltransplantatie bij WM wordt verwezen naar de desbetreffende hoofdstukken.
Eerste recidief 1-3 jaar na rituximab bevattende therapie
In deze groep kan zowel Ibrutinib of Zanubrutinib monotherapie als een ander rituximab bevattend combinatieregime dan in de eerste lijn gekozen worden. Voor patiënten die eerder met DRC zijn behandeld hebben kan R-bendamustine of R-bortezomib-dexamethason worden overwogen danwel ibrutinib/zanubrutinib. Bortezomib lijkt een wat lagere major respons en PFS duur te hebben dan bendamustine en is vaker geassocieerd met chemotherapie geïnduceerde PNP (alhoewel dit met 1x/week subcutane toediening vaak vermeden kan worden). Bendamustine daarentegen kent meer myelosuppressieve bijwerkingen en een hogere kans op infecties. Gezien de toxiciteit worden purine-analoga bij het eerste recidief niet als voorkeursoptie beschouwd.
Recidieven >3 jaar
Bij deze groep patienten zijn er veel mogelijkheden, inclusief herhalen van de eerstelijnsbehandeling. Alle hierboven genoemde opties kunnen worden overwogen.
Nieuwe middelen/combinaties
De werkgroep ziet vooralsnog geen plaats voor de combinatie ibrutinib-rituximab in de standaardbehandeling van WM aangezien de meerwaarde en de toxiciteit van het toevoegen van rituximab aan ibrutinib monotherapie op dit moment niet duidelijk is. Er zou een zeer beperkte rol kunnen zijn voor patiënten bij wie de dosis van ibrutinib gereduceerd moet worden i.v.m. toxiciteit en daardoor de respons onvoldoende is en er geen goede alternatieven zijn, of bij patiënten bij wie met ibrutinib monotherapie de respons onvoldoende diep is en er geen goede alternatieven zijn. In die situatie zou gepoogd kunnen worden met toevoeging van rituximab de respons te verdiepen. Er zijn echter geen systematische data die deze benadering ondersteunen.
Dexamethason-rituximab-ixazomib was bij recidief WM redelijk effectief met een acceptabel toxiciteitsprofiel. Ixazomib is echter voor de indicatie WM (nog) niet geregistreerd. Venetoclax is eveneens effectief in de recidief setting met een acceptabel toxiciteitsprofiel (alhoewel op 1 studie waarin slechts 33 patienten werden behandeld). Venetoclax is voor de indicatie WM (nog) niet geregistreerd.
Voor de overige beschreven nieuwe middelen geldt dat de finale resultaten van de studies nog niet gepubliceerd zijn en/of er slechts zeer weinig data zijn, en de werkgroep ziet dus voor deze middelen evenmin een plaats in de standaardbehandeling.
Overwegingen bij het gebruik van Ibrutinib
Voor het starten van ibrutinib behandeling wordt geadviseerd de MYD88 mutatiestatus te bepalen. Bij MYD88WT is ibrutinib minder effectief, echter dit is op basis van kleine aantallen patiënten. Ibrutinib wordt niet ontraden bij MYD88WT, maar het is belangrijk dit mee te wegen bij het maken van een keuze ten opzichte van andere behandelopties. Als de MYD88 status wordt meegewogen bij het wel of niet kiezen voor ibrutinib dan dient bij het ontbreken van MYD88L265P volledige sequencing van het gen te geschieden om non-L265P mutaties uit te sluiten (zie paragraaf over moleculaire diagnostiek). Ibrutinib 1 dd 420 mg wordt gegeven tot aan progressie of ernstige toxiciteit. De belangrijkste contraindicaties voor behandeling met ibrutinib zijn gelijktijdige behandeling met vitamine K antagonisten of dubbele plaatjesremming, of ongecontroleerd boezemfibrilleren. Voor management van btk-in gerelateerde bijwerkingen wordt verwezen naar een recent artikel van de Weerdt et al en een recente review.93Dosis reducties kunnen ook worden toegepast. Op ASH 2018 presenteerde Castillo et al retrospectieve data van 217 patiënten die startten met 420 mg. Na een minimale FU van 2 jaar bleek dat 27% van de patiënten een dosisreductie nodig had ivm toxiciteit. Redenen voor dosisreductie waren cytopenieën (27%), aritmieën (17%), spierklachten (15), constitutionele symptomen (11%) en huiduitslag (4%). 78% van de patiënten had een dosis reductie naar 280 mg, 21% naar 140 mg en 2% naar 140 mg om de dag. De PFS van de patiënten met en zonder dosisreductie was gelijk in deze analyse.94
Een bijzonder fenomeen na het (tijdelijk) staken van Ibrutinib is een onthoudingssyndroom dat in 20% van de patiënten gezien kan worden. 95Klachten kwamen na mediaan 2 dg (range 0-5). Klachten kunnen bestaan uit koorts, spierpijnen, gewrichtspijn, nachtzweten, rillingen, hoofdpijn en moeheid. De klachten verdwijnen bij herstart van ibrutinib en verminderen ook bij gebruik van prednison 2 dd 10 mg.
Zanubrutinib* versus Ibrutinib
Ten aanzien van de keuze voor ibrutinib of zanubrutinib beoordeelt de werkgroep dat de werkzaamheid tenminste vergelijkbaar is, beide zijn zeer effectieve middelen voor de indicatie WM zowel in 1ste lijn als recidief setting. De effectiviteit bij beiden is het hoogst bij WM patienten met MYD88 mutatie zonder CXCR4 mutatie, gevolgd door MYD88 mutatie met CXCR mutatie en het laagst bij patienten zonder MYD88 mutatie. Alhoewel in het algemeen het aantal VGPR’s wat hoger lijkt bij zanubrutinib t.o.v. ibrutinib is dit verschil niet significant en is ook de vraag of dit verschil klinisch relevant zou zijn. Op basis van 1 niet-gerandomiseerde studie lijkt zanubrutinib mogelijk effectiever voor MYD88 WT ziekte maar ook dit is op basis van de huidige data niet met zekerheid te zeggen. Het bijwerkingenprofiel is anders voor beide middelen qua soort bijwerkingen (zanubrutinib geeft minder atriumfibrilleren, hypertensie, bloedingsneiging, diarrhee en spierklachten maar meer neutropenie vergeleken met ibrutinib). Er zijn dus duidelijke verschillen in het type bijwerkingen maar het aantal bijwerkingen was grosso modo vergelijkbaar. Details zijn na te lezen in de gerandomiseerde Aspen studie.98 Dit leidt wat betreft de werkgroep niet tot een voorkeur voor het ene of andere middel. Wel zijn er aanwijzingen dat bij intolerantie voor ibrutinib of acalabrutinib een switch naar zanubrutinib soelaas kan bieden (studie bij diverse indicaties,n=44, ~80% positief effect van de switch) echter deze data zijn nog niet full paper gepubliceerd. 107 Op grond van de huidige data beschouwt de werkgroep het als gelijkwaardige middelen voor de behandeling van WM waarbij een geïndividualiseerde keuze gemaakt kan worden.
*Zanubrutinib vergoeding wordt voorbereid
Aanbeveling(en)
Inleiding
Transformatie van een WM/LPL naar een meer agressieve vorm, in de regel een diffuus grootcellig B-cellymfoom, kent zijn eigen behandeling waarbij uitgegaan wordt van de behandelingsprincipes zoals die worden toegepast bij DLBCL.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Een getransformeerd WM/LPL wordt behandeld met 6x R-CHOP-21 en 2x R (expert opinion, internationale richtlijnen) |
|
C |
Consolidatie met een autologe stamceltransplantatie wordt aanbevolen bij chemosensitieve patiënten met getransformeerde WM die in het verleden al voorbehandeling voor het LPL/WM hebben gehad (expert opinion, internationale richtlijnen) |
|
C |
Consolidatie met een autologe stamceltransplantatie kan worden overwogen bij chemosensitieve patiënten met getransformeerde WM die in het verleden geen voorbehandeling voor het LPL/WM hebben gehad (expert opinion, internationale richtlijnen) |
|
C |
Consolidatie met autologe stamceltransplantatie kan in de tweede lijn van getransformeerd LPL worden toegepast indien dit in de eerste lijn niet gebeurd was (expert opinion; conform DLBCL richtlijnen) |
|
C |
Een allogene stamceltransplantatie kan worden overwogen op individuele patiënt basis bij een recidief na een eerdere autologe stamceltransplantatie zoals bij getransformeerd FL, echter in de setting van getransformeerde WM zijn hier geen data over (expert opinion) |
Samenvatting literatuur
Resultaten
Er zijn geen gerandomiseerde studies verricht naar de beste behandeling voor het getransformeerde WM/LPL. In de literatuur zijn diverse behandelschema’s gebruikt, waaronder CHOP, CVP en DHAP al dan niet gecombineerd met rituximab. Gerapporteerde overall response rates zijn tot 61% met een complete response tot 48% van de patiënten. De meeste ervaring is er met behandeling met R-CHOP.31 De literatuur is beperkt over de rol van een autologe of allogene stamceltransplantatie in de behandeling van het getransformeerde lymfoplasmocytair lymfoom. De belangrijkste voorspeller voor respons lijkt chemosensitiviteit. Consolidatie met autologe stamceltransplantatie wordt in de diverse internationale richtlijnen als optie benoemd bij transformatie, altijd op basis van expert opinion.9,10,49,96 Er is 1 retrospectieve analyse gedaan naar autologe SCT in deze setting, waaruit bij patiënten die een CR bereikten op R-CHOP consolidatie met autoSCT geassocieerd was met een betere prognose, echter deze is alleen als abstract gepubliceerd.124 Over allogene SCT zijn geen data in deze setting.
Bewijskracht literatuur: Level 3
Zoeken en selecteren
Er werd voor deze uitgangsvraag een literatuursearch verricht in Pubmed, Cochrane en MEDLINE met de zoektermen “Waldenstrom”, “lymfoplasmocytair lymfoom”, “transformatie”, en “behandeling” Dit resulteerde in 35 publicaties. Na titel en abstract screening werden er 5 publicaties geselecteerd en in zijn geheel bestudeerd. De overige publicaties werden geexcludeerd op basis van het ontbreken van relevante informatie over de vraag of geen volledig artikel beschikbaar of publicatie niet in het Nederlands, Engels of Duits. Uiteindelijk bleken er 5 publicaties geschikt. De referenties van deze artikelen werden tevens gecontroleerd op gemiste relevante artikelen. Dit leverde geen extra bruikbare publicaties op. Tevens werd er gebruik gemaakt van bij de auteurs bekende relevante reviews.
Zoekverantwoording
De literatuursearch werd verricht in Pubmed, Cochrane en MEDLINE. Publicaties werden gecontroleerd op relevantie (case reports, prospectieve, retrospectieve studie, meta-analyses en review artikelen).
Overwegingen
Ad aanbeveling 1
Behandeling met 6x R-CHOP-21 en 2x R wordt geadviseerd op basis van meeste ervaring in de literatuur met dit behandelschema in deze setting.
Ad aanbeveling 2
De overweging om te consolideren met een autologe stamceltransplantatie dient op individuele patiënt basis plaats te vinden. Er zijn over deze behandelingen weinig data en in de internationale richtlijnen worden geen richtinggevende uitspraken gedaan ten aanzien van precieze indicaties. Op basis van internationale expert opinion kan autologe SCT overwogen worden als consolidatiebehandeling bij chemosensitieve getransformeerde WM. Analoog aan de aanbevelingen bij hooggradige transformatie van folliculair lymfoom adviseren wij autoSCT sterk te overwegen indien er eerdere behandeling voor de WM heeft plaatsgevonden ten tijde van de transformatie. Indien dit niet zo is kan consolidatie met autoSCT overwogen worden maar is de plaatsbepaling van deze behandeling nog moeilijker.
Over allogene stamceltransplantatie in deze specifieke setting is nog minder bekend. Analoog aan de aanbevelingen bij hooggradige transformatie van folliculair lymfoom adviseren wij alloSCT te overwegen bij recidief na autologe SCT.
Aanbevelingen
Inleiding
Voor WM is een toenemend aantal behandelingen beschikbaar. De patiënten zijn gemiddeld 65 jaar of ouder en de ziekte kan een mild beloop hebben. Dat maakt dat de toepassing van een relatief toxische behandeling zoals autologe stamceltransplantatie (SCT) zorgvuldig overwogen moet worden. De vraag is wat de rol van autologe SCT is bij de behandeling van WM.
Conclusie(s)
|
SORT Grade |
Conclusie |
|
B |
Autologe stamceltransplantatie is effectief bij recidief WM met name indien er ten tijde van de transplantatie sprake is van chemosensitieve ziekte en maximaal 3 eerdere lijnen van therapie gegeven zijn (dus maximaal 2e recidief). De mediane PFS na autologe SCT is ongeveer 4 jaar. |
|
B |
Er is internationaal geen consensus over de exacte indicatie voor autologe SCT bij WM; wel is er consensus dat: dit een effectieve optie kan zijn voor jongere fitte patiënten met een relatief agressief ziektebeloop; en dat deze behandeling alleen in de recidief setting overwogen dient te worden en niet als consolidatie na eerstelijns behandeling |
Samenvatting literatuur
De onderstaande tabel geeft de gevonden studies weer naar autologe SCT bij WM. Het betreft één grote retrospectieve studie en een aantal kleine studies, die allemaal retrospectief zijn. Het zijn veelal oudere studies die gedaan zijn voor de grootschalige introductie van rituximab. De studies staan samengevat in onderstaande tabel 7. Uit deze gegevens blijkt dat vooral jongere WM patiënten een transplantatie ondergingen (mediane leeftijd rond de 50 jaar). De gebruikte conditioneringsregimes waren wisselend, het meest gebruikt werd BEAM gevolgd door hoge dosis Melfalan of TBI-based conditionering.
De meeste gegevens over autologe SCT bij WM zijn afkomstig uit één grotere retrospectieve studie waarvoor de data van 158 patiënten uit de EBMT registratie gebruikt zijn. Deze data werden verzameld tussen 1991 en 2005 en komen dus uit de periode van voor de grootschalige introductie van rituximab.97 De conditionering die gebruikt werd was zeer wisselend, het meest gebruikt werd BEAM. Het aantal behandelingen dat voorafgaand aan de transplantatie was gegeven varieerde van 1 tot > 3. De ‘non relapse mortality’ na 1 jaar bedroeg 3,8%, de progressie vrije overleving na 3 en 5 jaar bedroegen respectievelijk 62% en 40%, en de overall survival 78% en 69%. Na autologe SCT bereikte 22% van de patiënten een CR. Na 5 jaar werd bij 8,6% van de patiënten een 2e maligniteit gezien, overigens vooral bij patiënten die eerder behandeld waren met nucleoside analoga. De multivariate analyse van de data liet zien dat chemorefractaire ziekte ten tijde van de transplantatie, meer dan 3 lijnen van therapie voorafgaand aan de transplantatie, leeftijd boven de 50 jaar en het mannelijk geslacht allen geassocieerd waren met een slechtere overall survival. Kyriakou et al hebben in 2014 nog een nieuwe analyse verricht met gegevens van 615 patiënten uit dezelfde EBMT data base. De gegevens waren verzameld tussen 1995 en 2011. Zij komen tot ongeveer dezelfde conclusies. Deze gegevens zijn echter nog niet als “full paper” gepubliceerd.98
Naast de retrospectieve series zijn ook recente internationale richtlijnen voor de behandeling van WM geraadpleegd. De adviezen daaruit staan in onderstaande tabel 8 samengevat. Ook hieruit blijkt dat over de exacte indicatie voor autologe SCT bij WM geen consensus is. Samengevat wordt aangeraden de toepassing van autologe SCT te overwegen bij recidief WM, chemosensitivieit, en een “aggressief ziektebeloop” bij relatief fitte en jonge patiënten. Wat een “agressief ziektebeloop”is, wordt hierbij niet gedefinieerd.
Tot slot is er een abstract verschenen waarin min of meer een internationale consensus over SCT bij WM beschreven wordt. 99 Daarin werd consensus bereikt over de volgende items:
Tabel 7: Samenvatting literatuur autologe SCT bij WM
Tabel 8: Samenvatting aanbevelingen internationale richtlijnen t.a.v. autologe SCT bij WM
Bewijskracht literatuur: Level 3, grade B (grade of recommendation)
Zoeken en selecteren
Voor de uitgangsvraag werd een literatuur search verricht in Pubmed en in de Cochrane data base. De zoektermen Waldenström, lymfoplasmacellulair lymfoom en autologe stamceltransplantatie werden gebruikt. Dit resulteerde in 67 hits. Hiervan werden de in de referenties genoemde artikelen geselecteerd. De overige verschenen artikelen leverden geen aanvullende informatie op. In vrijwel alle artikelen betrof het reviews en werd teruggegrepen op het artikel van Kyriakou et al.104 uit de JCO van 2010. Naast de retrospectieve series zijn ook recente internationale richtlijnen voor de behandeling van WM geraadpleegd.
Overwegingen
Consolidatie met hoge dosis chemotherapie en autologe SCT is een effectieve behandeloptie voor patiënten met recidief WM, mits de patiënt er qua leeftijd en conditie voor in aanmerking komt (relatief jonge en fitte patiënten) en hij of zij een chemosensitieve ziekte heeft bij reinductie behandeling. De optimale effectiviteit wordt behaald bij het 1e tot en met 2e recidief (maximaal 3 behandellijnen t.t.v. transplantatie). De afweging autologe SCT toe te passen zal mede afhangen van de alternatieve behandelopties en van de dynamiek van de ziekte (responsduur na eerdere behandeling) alsmede de conditie van de patiënt. Dit zal op individueel niveau afgewogen dienen te worden.
Aanbeveling(en)
Inleiding
Er zijn voor WM steeds meer behandelingen beschikbaar, ook bij recidief van de ziekte. Daarom moet het toepassen van een toxische behandeling zoals een allogene stamceltransplantatie (SCT) zeer zorgvuldig overwogen worden. De vraag is wanneer een allogene SCT bij WM aan de orde is.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Allogene SCT kan effectief zijn bij WM, echter ten koste van aanzienlijke mortaliteit en morbiditeit vergeleken met andere behandelingen. Internationaal is er geen consensus over de precieze indicatie voor een allogene SCT bij WM. Wel worden een aantal algemene adviezen gegeven ter overweging.9,10,49,105 (expert opinion, consensus) |
|
C |
Op basis van 2 retrospectieve series is de overall survival na 5 jaar 52-64%,met een PFS van 46-56% en een NRM van 23-33%. |
Samenvatting literatuur
Resultaten
Er is geen prospectief onderzoek gedaan naar de effecten van een allogene SCT bij WM. Twee retrospectieve series beschrijven het effect van allogene stamceltransplantatie bij WM. De Amerikaanse serie beschrijft 144 patiënten met een overall survival (OS) na 1 jaar van 74% en na 5 jaar van 52%, met bijbehorende PFS van respectievelijk 68% en 46% en een non-relapse mortality (NRM) van 15% en 30%.106Uit de EBMT database worden vergelijkbare uitkomsten gerapporteerd op basis van gegevens van 86 patiënten: zij vonden na 5 jaar een OS van 62% , een PFS van 56% en een NRM van 33% bij myeloablatieve conditionering, en een OS van 64%, een PFS van 49% en een NRM van 23% bij “reduced intensity” conditionering.104
Hierbij was chronische GVHD geassocieerd met een lagere kans op recidief, ten koste van hogere NRM, resulterend in een betere PFS. Tezamen met enkele responsen na DLI pleit dit voor een graft versus WM effect. In beide series was de gemiddelde leeftijd rond de 50 jaar, dus een stuk lager dan van de leeftijd van de gemiddelde WM-patiënt. Ongeveer de helft van de patiënten had meer dan 3 eerdere behandellijnen gehad.
In internationale richtlijnen wordt benadrukt dat een allogene stamceltransplantatie slechts bij uitzondering moet worden toegepast.9,10,49 De meeste WM-patiënten hebben een indolent beloop en bij hen is er geen noodzaak voor een allogene SCT met transplantatie-gerelateerde mortaliteit en morbiditeit. Ook komen WM-patiënten gezien de gemiddeld hoge leeftijd bij diagnose vaak niet in aanmerking voor deze behandeling. In deze richtlijnen wordt niet duidelijk beschreven bij welke patiënten het wel geadviseerd wordt, maar vaak wordt eerdere behandeling met tenminste immunochemotherapie en een BTK-inhibitor wel als voorwaarde genoemd.
De precieze plaatsbepaling van alloSCT is ook internationaal niet eenduidig. Ten aanzien van de indicatiestelling bereikte een internationaal EBMT-consortium consensus over het volgende:
Echter, dit is alleen gepubliceerd als abstract en over veel zaken werd door het EBMT consortium ook geen consensus bereikt.105
In onderstaande tabel wordt een samenvatting gegeven van de uitspraken over de rol van allo-SCT in recente internationale richtlijnen en consensusartikelen.
Tabel 9: Samenvatting aanbevelingen internationale richtlijnen t.a.v. allogene SCT bij WM
|
mSmart 2016 Mayo Stratification, 201749 |
8th International Workshop for WM, 201650 |
British Society of Haematology 20149 |
ESMO, 201810 |
How I Treat, 201915 |
|
Despite graft-vs-lymphoma effect and high complete response rates (62%–66%), the associated toxic effects and the prohibitively high 1-year treatment related mortality rates of upto 44%limit the use of allogeneic transplantation . |
Allogeneic SCT, when appropriate, should preferably be considered in the context of clinical trials. |
Allogeneic SCT may be considered in selected younger patients with relapsed WM and an aggressive clinical course (short PFS, histological transformation) (Grade B2). 3 Autologous and allogeneic SCT should only be performed in the setting of chemosensitive disease with at least a partial response to reinduction therapy (Grade A1). |
The role of allogeneic stem cell transplantation (alloSCT) is limited outside clinical trials and should be considered only in highly selected young patients with aggressive disease, who have failed or are resistant to BTK inhibitors [IV, C] |
The role of allogeneic transplantation remains limited and could be considered only in carefully selected patients failing BTK inhibitors |
Zoeken en selecteren
Er zijn zeer weinig studies over allogene SCT bij WM, daarom is er gebruik gemaakt van recente internationale richtlijnen, en expert opinion welke is gebaseerd op de 2 grote retrospectieve series, zonder aanvullende systematische literatuuranalyse.
Overwegingen
Er zijn voor WM steeds meer behandelingen beschikbaar, ook bij recidief van de ziekte. De verwachting is dat daar steeds meer middelen bij zullen komen. Daarom moet het toepassen van een toxische behandeling als allogene stamceltransplantatie (SCT) zeer zorgvuldig overwogen worden en wordt de rol daarvan steeds kleiner. Anderzijds zijn er wel aanwijzingen voor “graft-versus-WM effect” en zijn er geen andere potentieel curatieve opties voor WM. Er zijn momenteel geen biomarkers om bij deze afweging te sturen. De keuze hangt af van patiëntkarakteristieken en klinisch beloop, en moet op individuele basis gemaakt worden. Allogene SCT kan, tegen de prijs van ‘non-relapse mortality’ (NRM) en morbiditeit, leiden tot langdurige ziektevrije overleving bij patiënten met recidief WM. De uitkomsten zijn het best bij chemosensitieve ziekte. Na allogene SCT wordt een plateau gezien wat betreft de PFS en OS curves. Dit laatste, in combinatie met de lagere recidiefkans bij patiënten met chronische GVHD en response na DLI pleit voor het bestaan van een “graft versus WM” effect. Gezien de gemiddelde leeftijd van WM-patiënten heeft over het algemeen ‘reduced intensity” conditionering’ (RIST) de voorkeur. Myeloablatieve conditionering is wel geassocieerd met minder recidieven, maar ook met meer toxiciteit dus geeft netto in beide retrospectieve series geen voordeel wat betreft de overleving. Dit zou op individuele basis alleen bij heel jonge WM-patiënten met een lage transplantatie-risico score en agressieve ziektekenmerken overwogen kunnen worden. De optimale timing van allogene consolidatie is moeilijk te bepalen zeker in het licht van de komst van steeds meer nieuwe middelen en de toxiciteit van de behandeling. De werkgroep is van mening dat een allogene SCT een zeer beperkte rol heeft bij de behandeling van WM. Het kan bij een ‘transplant-eligible’ patiënt worden overwogen in de setting van: herhaaldelijk (in het algemeen derde of meer) snel recidief na eerdere behandelingen waarbij tenminste immunochemotherapie en een BTK-remmer gebruikt zijn. De afweging is sterk hangt af van patiëntkarakteristieken en klinisch beloop, en moet op individuele basis worden gemaakt.
Aanbeveling(en)
Inleiding
In het algemeen worden bij behandeling met rituximab infusie-gerelateerde reacties vooral gezien tijdens de eerste toediening. Bij patiënten met WM wordt echter bij ongeveer 7-10% van de patiënten een in de tijd toenemende intolerantie voor rituximab waargenomen, zich vooral uitend in anafylactische reacties, koorts en rillingen, urticaria, hypotensie en dyspnoe. In de meeste gevallen leidt dit tot discontinueren van rituximab. Een deel van deze patiënten kon vervolgens wel behandeling met de gehumaniseerde CD20 antistof ofatumumab verdragen. Deze antistof is in Nederland echter niet meer verkrijgbaar.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Rituximab intolerantie komt voor bij ongeveer 7-10% van de patiënten met WM, hetgeen vaker is dan bij andere B-NHL wordt gezien. |
|
C |
Rituximab intolerantie leidt meestal tot discontinueren van de rituximab behandeling |
Samenvatting literatuur
Incidentie rituximab intolerantie
Er is 1 retrospectieve analyse gedaan naar de incidentie van rituximab intolerantie bij WM. In het WM cohort van 1466 patiënten gezien in het Dana Farber Cancer Institute werden 85 patiënten geïdentificeerd bij wie rituximab moest worden gediscontinueerd vanwege intolerantie (7%).112 De mediane tijd tussen 1erituximab toediening en intolerantie was 1 jaar (range 0-12 jaar). 34% ontwikkelde intolerantie tijdens de eerstelijnsbehandeling. Intolerantie ontstond zowel tijdens rituximab monotherapie als tijdens immunochemotherapie. Deze vorm van intolerantie wordt slechts zelden (<1%) beschreven bij patiënten met andere vormen van B-NHL (FL of CLL). 113
Beleid in geval van rituximab intolerantie
Rituximab intolerantie uit zich meestal in anafylactische reacties, koorts en rillingen, urticaria, hypotensie en dyspnoe. In tegenstelling tot de situatie bij de meeste andere B-NHL/CLL kan er sprake zijn van in de tijd steeds ernstiger wordende reacties, waardoor dan de behandeling met rituximab soms moet worden gediscontinueerd. Dit is echter ongewenst gezien het feit dat behandeling met een CD20 antistof een belangrijke component is van de behandeling van WM. Castillo et al. onderzochten in hun database van 1466 patiënten wat het beleid is geweest bij deze patiënten en vonden dat een deel van de patiënten behandeld kon worden met de gehumaniseerde antistof ofatumumab. 112 Op dit moment is deze antistof in Nederland echter niet meer verkrijgbaar. Er zijn geen gepubliceerde data over het gebruik van obinatuzumab bij WM.
Een alternatieve benadering is de patiënt onder gecontroleerde omstandigheden te rechallengen met rituximab met gebruikmaking van maximale maatregelen om een reactie te voorkomen (H1 en H2 receptor blocking, steroïden, leukotrieën antagonist en langzame infusie van de antistof).114
Tot slot is er beperkte ervaring met rituximab desensitisatie protocollen bij rituximab intolerantie in het algemeen. Er is geen gepubliceerde of anekdotische ervaring bij WM patiënten. Deze optie dient te worden overlegd met een allergoloog.115
Zoekverantwoording
De literatuursearch werd verricht in Pubmed. Publicaties werden gecontroleerd op relevantie (case reports, prospectieve studies, retrospectieve studies, meta-analyses en review artikelen).
Zoeken en selecteren
Er werd voor deze uitgangsvraag geen systematische literatuursearch verricht, aangezien er weinig literatuur is over dit onderwerp. Wel werd in Pubmed gezocht met de zoektermen Waldenstrom’s Macroglobulinemia, rituximab intolerance, rituximab hypersensitivity, rituximab desensitization.
Overwegingen
Ad aanbeveling 1
Er zijn geen prospectieve studies gedaan naar het beleid bij rituximab intolerantie. Gezien het belang van behandeling met een CD20 antistof kan, na informatie van de patiënt over de risico’s en met diens toestemming een poging worden gedaan om onder maximale profylactische maatregelen rituximab onder gecontroleerde omstandigheden toe te dienen. Hierbij kunnen op basis van ervaringen van leden van de werkgroep de volgende maatregelen worden geadviseerd:
Ad aanbeveling 2
Als ofatumumab beschikbaar is kunnen patiënten behandeld worden met de gehumaniseerde antistof ofatumumab. Op dit moment is deze antistof in Nederland echter niet meer verkrijgbaar. Bij behandeling met ofatumumab worden dezelfde profylactische maatregelen geadviseerd om een reactie te voorkomen (zie hierboven onder aanbeveling 1).
Ad aanbeveling 3
Er is beperkte ervaring met rituximab desensitisatie. Een desensitisatie-protocol, waarbij rituximab in een geleidelijk opkimmende dosering wordt toegediend, te beginnen met een zeer lage dosis onder gecontroleerde omstandigheden, dient te worden uitgevoerd door een ervaren allergoloog op een afdeling waar acute opvang geborgd is. Deze benadering lijkt vooral effectief als er sprake is van type I reacties (IgE gemedieerd). Er is voor zover bekend geen ervaring mee bij WM patiënten met rituximab intolerantie.
Responscriteria van WM zijn beschikbaar op basis van internationale consensus, welke in 2013 gereviseerd werd.8 Deze responscriteria worden hieronder in tabelvorm weergegeven. Deze responscriteria maken voor de kwantitatieve evaluatie van de respons dus gebruik van de veranderingen in het totaal serum IgM naast het wel of niet aanwezig zijn van het M-proteine.
Opvallend bij WM is de vaak trage respons: het IgM daalt vaak traag, maar kan soms 1 tot meerdere jaren na het afronden van de behandeling nog blijven dalen.
Tabel 10: Responsecriteria WM
|
Respons |
Criteria |
|
Complete Remissie (CR) |
Verdwijnen van M-proteïne (immunofixatie); Normale serum IgM waarde#; morfologisch normaal beenmergaspiraat; verdwijnen van lymfadenopathie en splenomegalie indien dit bij aanvang aanwezig was. |
|
Very good partial response (VGPR) |
Aantoonbaar M-proteïne; ≥ 90% reductie van het serum IgM* ten opzichte van uitgangswaarde; verdwijnen van extramedullaire ziekte, bijvoorbeeld lymfadenopathie en splenomegalie indien dit bij aanvang aanwezig was. Geen nieuwe symptomen of uitingen van actieve ziekte. |
|
Partiële Respons (PR) |
Aantoonbaar M-proteïne; ≥ 50% maar < 90% reductie van het van het serum IgM* ten opzichte van uitgangswaarde; Reductie van extramedullaire ziekte, bijvoorbeeld lymfadenopathie en splenomegalie indien dit bij aanvang aanwezig was. Geen nieuwe symptomen of uitingen van actieve ziekte. |
|
Minor Respons (MR) |
Aantoonbaar M-proteïne; ≥25% maar < 50% afname van het serum IgM* ten opzichte van uitgangswaarde. Geen nieuwe symptomen of uitingen van actieve ziekte. |
|
Stable Disease (SD) |
Aantoonbaar M-proteïne; < 25% reductie en <25% stijging van het van het serum IgM* ten opzichte van uitgangswaarde. Geen toename van extramedullaire ziekte, bijvoorbeeld lymfadenopathie en splenomegalie. Geen nieuwe symptomen of uitingen van actieve ziekte. |
|
Progressive Disease (PD) |
≥25% stijging# van het van het serum IgM* ten opzichte van het laagste punt en/ofprogressie van klinische verschijnselen horend bij de ziekte. |
#IgM responsen en progressie dienen door een 2e meting bevestigd te worden.
*totaal serum IgM mag door middel van densitometrie of nefelometrie bepaald worden.
Zoals eerder genoemd kunnen WM en IgM MGUS gepaard gaan met zeer diverse symptomatologie. Voor de zeldzame uitingen van WM is er voor gekozen geen uitgangsvragen met zoekstrategieën op te stellen gezien de zeer beperkte evidence voor de behandelingen. In plaats daarvan wordt hieronder voor enkele zeldzame ziekte-uitingen een samenvatting van een recent (inter)nationaal consensusartikel of review gegeven. Dit is uiteraard geen uitputtende lijst. Bij (verdenking op) een zeldzame ziektevariant wordt verder geadviseerd opnieuw de literatuur te bekijken en/of te overleggen met een expertise centrum.
De klinische presentatie en afwegingen rondom de behandeling van IgM-gerelateerde AL amyloïdose werden samengevat in 2019116 in een artikel in het Nederlands Tijdschrift voor Hematologie, deels gebaseerd op een review van Milani & Merlini uit 2016.117 Naar deze artikelen wordt verwezen voor een uitgebreide samenvatting van de (beperkte)literatuur en onderbouwing van de therapeutische overwegingen. Hier volgt een korte samenvatting. IgM-M-proteïne gerelateerde AL-amyloïdose is een zeldzame variant van AL-amyloïdose (slechts 5-7% van de gevallen). Hoewel de presentatie lijkt op die van non-IgM-gerelateerde AL-amyloïdose zijn er enkele subtiele verschillen (iets minder vaak cardiale betrokkenheid, vaker lymfadenopathie). Belangrijk is dat niet een multipel myeloom, maar meestal M. Waldenström of een ander indolent B-cellymfoom danwel IgM MGUS de onderliggende clonale aandoening is. De prognose is desondanks gelijk aan die van non-IgM-gerelateerde AL-amyloïdose. Ook bij IgM-gerelateerde AL-amyloïdose is een diepe remissie geassocieerd met een langere overleving. Een diepe hematologische respons (CR of VGPR) is dan ook een belangrijk behandeldoel (in tegenstelling tot bij de behandeling van WM zonder AL amyloidose). Deze diepe remissies worden echter vaak niet bereikt. Door de zeldzaamheid van het ziektebeeld is er weinig bekend over de optimale behandeling. Deze zal meestal bestaan uit immunochemotherapie die dus aggressiever moet zijn dan bij WM alleen. Verschillende schema’s worden gesuggereerd: combinaties van rituximab/steroïden en cyclofosfamide, bendamustine, bortezomib of melfalan (dit laatste wordt vooral aanbevolen als er overheersend plasmacellen in het beenmerg worden gevonden). Consolidatie met autologe stamceltransplantatie dient overwogen te worden bij patiënten die hiervoor conditioneel in aanmerking komen, ook in de 1e lijn conform het beleid bij non-IgM AL amyloidse. Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en/of te overleggen met een expertise centrum.
De klinische presentatie, diagnostiek en afwegingen rondom de behandeling van centraal zenuwstelsel (CZS) lokalisatie van WM, oftewel het Bing Neel Syndroom (BNS), werden samengevat in een recente internationale richtlijn gebaseerd op consensus van het IWWM-8 panel.118 Naar dit artikel wordt verwezen voor een uitgebreide samenvatting van de (beperkte)literatuur en onderbouwing van de therapeutische overwegingen. Hier volgt een korte samenvatting van het artikel. BNS is een zeldzame manifestatie van WM die het gevolg is van infiltratie van het centrale zenuwstelsel door kwaadaardige lymfoplasmacytaire cellen. De presentatie van BNS kan zeer divers zijn en omvat hoofdpijn, cognitieve stoornissen, neurologische uitvalsverschijnselen en psychiatrische symptomen. Het kan ontstaan bij patiënten met bekende WM, zelfs bij afwezigheid van systemische progressie, maar ook bij eerder niet-gediagnosticeerde patiënten als eerste ziektepresentatie. Diagnostische workup moet liquoronderzoek inclusief flowcytometrie bevatten om B-celklonaliteit aan te tonen, eiwitelektroforese en immunofixatie voor de detectie en classificatie van een monoklonaal eiwit, evenals moleculaire diagnostiek voor herschikking van immunoglobulinegenen en gemuteerde MYD88. MRI met contrast van de hersenen en de spinale as is ook essentieel. Over de optimale behandeling van BNS is geen consensus, genoemd worden rituximab gecombineerd met fludarabine, cladribine, bendamustine, hoge dosis methotrexaat of cytarabine, en ibrutinib.118,119Gezien het toxiciteitsprofiel van de verschillende opties wordt over het algemeen niet aangeraden hoge dosis methotrexaat of cytarabine in de 1e lijnsbehandeling in te zetten. Het is twijfelachtig of rituximab bijdraagt aan de behandeling van de CZS lokalisatie maar gezien de meeste patienten ook een systemische WM hebben wordt over het algemeen geadviseerd dit wel te geven conform reguliere WM behandeling. Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en te overleggen met een expertise centrum.
Perifere neuropathie is een veel voorkomend probleem bij patienten met WM of IgM MGUS. De klinische presentatie en afwegingen rondom de diagnostiek en behandeling van IgM paraproteine gerelateerde perifere polyneuropathie (PNP) werden samengevat in een recente internationale richtlijn gebaseerd op consensus van het IWWM-8 panel, gepubliceerd in British Journal of Haematology.120 Naar dit artikel wordt verwezen voor een uitgebreide samenvatting van de (beperkte)literatuur en onderbouwing van de diagnostiek en de therapeutische overwegingen. Het belangrijkste is zeer zorgvuldige diagnostiek in samenwerking met een neuroloog die voldoende expertise heeft op dit gebied. Enerzijds komen PNP en MGUS in de oudere populatie relatief vaak voor, dus is er niet altijd een causaal verband tussen beiden. Anderzijds zijn er voor sommige varianten van IgM paraproteine gerelateerde PNP behandelingen beschikbaar (bijvoorbeeld rituximab voor ernstige of progressieve anti-MAG neuropathie) en zijn er enkele zeldzame varianten (bijvoorbeeld amyloidose en cryoglobulinemische vasculitis of het CANOMAD syndroom) die juist weer om een andere specifieke aanpak vragen. Vaak betreft het milde chronische neuropathieen die geen behandeling behoeven, echter kan soms het beloop ook aggressief en/of invaliderend zijn. Zowel rondom de diagnosestelling als de beslissing om te behandelen en keuze van therapie zijn er dus specifieke afwegingen te maken waarbij ook de input van de neuroloog cruciaal is. Hoe complex die afwegingen (kunnen) zijn wordt inzichtelijk in stroomschema zoals dit is opgenomen in internationale richtlijn (Figuur 1; zie link: https://onlinelibrary.wiley.com/doi/full/10.1111/bjh.14492 )
Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en/ of te overleggen met een expertise centrum.
De klinische presentatie en afwegingen rondom de diagnostiek en behandeling van cryoglublinemie werden samengevat in een recente review uit 2017 in Blood.121 Zowel type 1 (monoclonaal) als type 2 (“mixed”) cryoglobulinemie kunnen voorkomen bij patiënten met WM of IgM MGUS. Deze kunnen tot verschillende uitingsvormen van vasculitis leiden, variërend van de bekende perifere purpera met soms huidulcera, tot glomerulonefritis, perifere neuropathie en gewrichtsklachten maar ook nog een waaier aan zeldzamere uitingen. Bij symptomatische type 1 (monoclonale) cryoglobulinemie wordt geadviseerd het onderliggende lymfoproliferatieve beeld te behandelen en is er dus een behandelindicatie voor de WM. Indien er een type 1 cryoglobulinemie is bij IgM MGUS kan overwogen worden voor een minder intensief schema te kiezen bijvoorbeeld prednison en/of rituximab. Heptatis-C negatieve type 2 (“mixed”) cryoglobulinemie is zeldzaam en er is geen consensus over de optimale behandeling.
In het algemeen is het belangrijk bij het toepassen van rituximab rekening te houden met een flare van het IgM en dus ook de cryoglobulinemie. Verder is in het algemeen de presentatie en ernst van het klinisch beeld belangrijk bij het maken van een keuze. Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en/ of te overleggen met een expertise centrum.
Chronische koude agglutinine ziekte uit zich in complement gemedieerde auto-immuun hemolytische anemie en/of koude geassocieerde acrocyanose, en gaat vaak gepaard met een IgM kappa paraproteine. Het lijkt een aparte entiteit te zijn ten opzichte van WM/IgM MGUS gezien de specifieke morfologische, immunohistochemische en moleculaire opmaak van de B cel cloon in het beenmerg. De klinische presentatie en afwegingen rondom de diagnostiek en behandeling van chronische koude agglutinine ziekte werden samengevat in een recente review door Sigbjørn Berentsen gepubliceerd in British Journal of Haematology122. Naar dit artikel wordt verwezen voor een uitgebreide samenvatting van de (beperkte)literatuur en onderbouwing van de diagnostiek therapeutische overwegingen. Belangrijk om te noemen is dat behandeling niet altijd nodig is en dat steroiden en splenectomie niet geindiceerd zijn. Als behandelopties worden naast “keep warm” advies rituximab monotherapie en R-bendamustine genoemd, danwel combinaties van rituximab met fludarabine of bortezomib. Verder zijn er ontwikkelingen op het gebied van nieuwe complementremmers, die momenteel (ook in Nederland) in klinische trials onderzocht worden. Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en/ of te overleggen met een expertise centrum.
WM kan bij tot 5% van de patiënten geassocieerd zijn met nefropathie, zich uitend in anderszins onbegrepen nierinsufficientie en/of nefrotisch syndroom.11,123 Er zijn diverse nefropathieen geassocieerd met WM (o.a. AL amyloidose, light chain depositions, cast nefropathie, cryoglobulinemie, IgM deposities, etc).11,123Enerzijds komt nefropathie in de oudere populatie relatief vaak voor, dus is er niet altijd een causaal verband met de WM. Anderzijds vormt WM gerelateerde nefropathie een behandelindicatie. Bij twijfel wordt dus geadviseerd een nierbiopt te verrichten met WM/IgM gerelateerde nefropathie in de vraagstelling. De behandeling en verdere workup zal afhangen van het type nefropathie dat wordt vastgesteld. Geadviseerd wordt in voorkomende gevallen opnieuw de literatuur te bekijken en/ of te overleggen met een expertise centrum.
. 2016;31(3):149-162. doi:10.1002/jca.21470
. 2004;101(11):2593-2598
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie