Terug naar het richtlijnenoverzicht
De ziekte van Von Willebrand (VWD) is de meest voorkomende erfelijke bloedingsziekte met een prevalentie tussen de 1 op 100 op basis van populatiestudies en 1 op 10.000 op basis van verwijzing naar gespecialiseerde centra en wordt gekenmerkt door een tekort aan werkzaam von Willebrand factor (VWF). VWF bevordert enerzijds de adhesie van bloedplaatjes, en anderzijds dient het als dragereiwit voor stollingsfactor VIII. De bloedingsneiging bij VWD uit zich vooral door bloedingen in huid en slijmvliezen en bloedingen na trauma of operatie. Bij ernstigere vormen van VWD komen ook bloedingen in spieren en gewrichten voor.
VWD wordt onderverdeeld in drie verschillende vormen. Bij type 1 is er een mild verlaagde plasmaconcentratie van VWF, bij type 2 is het VWF afwijkend van structuur en/of functie, en bij type 3 is er (nagenoeg) geen VWF in het plasma aantoonbaar. Op basis van specifieke fenotypische kenmerken wordt type 2 onderverdeeld in types 2A, 2B, 2M en 2N. VWD heeft een autosomaal overervingspatroon. Meestal is er sprake van autosomaal dominante overerving (type 1, 2A, 2B, 2M), maar sommige vormen erven recessief over (type 2N, 3, en een enkele vorm van 2A).
De behandeling van VWD bestaat uit het verhogen van de hoeveelheid circulerend VWF door ofwel stimulatie van secretie van endogeen VWF via toediening van desmopressine (DDAVP), ofwel door infusie van exogeen VWF. Er zijn zowel uit plasma verkregen als recombinante VWF concentraten beschikbaar die al of geen factor VIII bevatten. In de afgelopen jaren zijn er nieuwe VWF concentraten op de markt gekomen met verschillende verhoudingen in VWF en factor VIII. Ook zijn de beschikbare diagnostische bepalingen voor meting van de VWF activiteit uitgebreid, en zijn er nieuwe inzichten gepubliceerd aangaande diagnostische criteria, aard en ernst van de bloedingsneiging.
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van VWD bij kinderen en volwassenen. Voorafgaande aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. Deze vragen volgen uit een knelpuntinventarisatie verricht onder medisch specialisten, verpleegkundig specialisten en paramedici werkzaam binnen het vakgebied in samenspraak met patiënten (vertegenwoordigers). De meest relevante knelpunten zijn uitgewerkt tot uitgangsvragen. Dit betreft een beperkt aantal problemen in de dagelijkse praktijk rond het diagnostisch, therapeutisch en follow-up beleid van patiënten met VWD. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven, daar waar in de dagelijkse praktijk de belangrijkste knelpunten bestaan en tracht uniformiteit van behandeling van VWD patiënten in Nederland te bewerkstelligen, met name ook op die gebieden waar bewijs ontbreekt. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijke onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met VWD, zoals internisten (hematologen en vasculair geneeskundigen), kinderartsen, hemofilie verpleegkundigen/verpleegkundig specialisten, fysiotherapeuten en gynaecologen.
Voor het ontwikkelen van de richtlijn is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van von Willebrand en vertegenwoordigers van de patiënten (zie hiervoor de samenstelling van de werkgroep). De werkgroep leden zijn door hun (beroeps)verenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 2 jaar aan de totstandkoming van deze richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn en bestond uit:
Daarnaast zijn de volgende werkgroepleden medeverantwoordelijk voor de module zwangerschap:
Met ondersteuning van:
De werkgroep leden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. In onderstaande tabel wordt een overzicht gegeven met de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
H.C.J. Eikenboom |
Onderzoekbeurs: CSL Behring, Landsteiner Stichting Bloedtransfusie Research (LSBR), Trombosestichting Nederland (TSN), NWO (NWA 1160.18.038; TTW 18712) Sprekersgeld: Roche, Celgene Reisbeurs: Roche Editor: HemaSphere |
|
E.A.M. Beckers |
Onderzoekbeurs: Bayer |
|
M.H. Cnossen |
Onderzoek-, onderwijs- en reisbeurzen: Pfizer, Baxter/Baxalta/Shire/Takeda, Bayer Schering Pharma, CSL Behring, Sobi Biogen, Novo Nordisk, Novartis, Nordic Pharma, NWO (NWA 1160.18.038), ZonMw, Dutch “Innovatiefonds Zorgverzekeraars” Steering board: Roche, Bayer, Novartis |
|
F.C.J.I. Heubel-Moenen |
geen |
|
K.P.M. van Galen |
Onderzoekbeurs: CSL Behring, OctaPharma, Bayer |
|
I.C.L. Kremer Hovinga |
Partner werkzaam bij Bristol Meyers Squibb (geen producten relevant voor deze richtlijn) |
|
M.J.H.A. Kruip |
Onderzoekbeurs: Pfizer, Sobi, Boehringer Ingelheim, Daiichi Sankyo, Bayer |
|
D.E. Fransen van de Putte |
geen |
|
M.F.C.M. Knapen |
geen |
|
F.W.G. Leebeek |
Onderzoekbeurs: CSL Behring, Takeda, Stichting Haemophilia, uniQure, Sobi, NWO-TTW (18712) Consultant: uniQure, BioMarin, Takeda, CSL Behring Lid DSMB: Roche |
|
K. Meijer |
Onderzoekbeurs: Bayer, Baxter, Pfizer, Sanquin, Sprekersgeld: Bayer, Sanquin, Boehringer Ingelheim, BMS, Aspen Reisbeurs: Bayer Consultant: uniQure Adviseur: College ter Beoordeling van Geneesmiddelen |
|
S.L.A. Meijer |
Geen |
|
A. Plat |
Geen |
|
L.F.D. van Vulpen |
Onderzoekbeurs: NovoNordisk |
Voor de uitgangsvragen is waar mogelijk een systematische literatuursearch verricht. Voor meerdere uitgangsvragen is afgezien van een systematische search vanwege het ontbreken van voldoende gepubliceerde studies of vanwege de beschikbaarheid van internationale evidence-based richtlijnen of systematische reviews. Dit is in de richtlijn per uitgangsvraag aangegeven.
Werkwijze
Er werd voor afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische database van Medline en waar relevant ook in databases van CENTRAL, Cochrane library, EMBASE, CINAHL. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden bij de desbetreffende uitgangsvragen.
Veel gebruikte afkortingen in de richtlijn
|
Naam |
Afkorting |
|
Factor VIII activiteit |
FVIII:C |
|
Ristocetine geinduceerde plaatjes agglutinatie |
RIPA |
|
Von Willebrand factor |
VWF |
|
Von Willebrand factor antigeen |
VWF:Ag |
|
Von Willebrand factor plaatjesbindende activiteit |
VWF:Act |
|
Von Willebrand factor propeptide |
VWFpp |
|
Von Willebrand factor ristocetine cofactor activiteit |
VWF:RCo |
|
Von Willebrand factor Glycoproteine Ib bindingsactiviteit (met ristocetine) |
VWF:GPIbR |
|
Von Willebrand factor Glycoproteine Ib bindingsactiviteit (met mutant GPIb) |
VWF:GPIbM |
|
Von Willebrand factor-collageen bindingsactiviteit |
VWF:CB |
|
Von Willebrand factor-Factor VIII bindingsactiviteit |
VWF:FVIIIB |
|
Ziekte van Von Willebrand |
VWD |
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is/wordt digitaal verspreid onder alle relevante beroepsgroepen. Daarnaast wordt er een toelichting op de richtlijn aangeboden aan het Nederlands Tijdschrift voor Hematologie. Ook is de richtlijn in te zien op de website van de Nederlandse Vereniging voor Hematologie en zal een link naar de richtlijn geplaatst worden op de website van de Nederlandse Vereniging voor Kindergeneeskunde.
In deze richtlijn worden de patiënten vertegenwoordigd door afgevaardigden van de Nederlandse Vereniging van Hemofilie-Patiënten (NVHP).
De introductie van nieuwe stollingsfactorconcentraten, de veranderde inzichten in de behandeling van VWD en de lange tijd verstreken sinds de vorige richtlijn, gepubliceerd in 2009, maakt de herziening van de richtlijn Diagnostiek en Behandeling van de ziekte van Von Willebrand noodzakelijk. Beoogd is uniformiteit in behandeling te creëren met een richtlijn die door de verschillende specialismen en beroepsgroepen gedragen wordt.
De Nederlandse Vereniging van Hemofiliebehandelaars heeft daarom het initiatief genomen een multidisciplinaire, ‘evidence-based’ richtlijn te ontwikkelen voor het beleid bij VWD.
|
Diagnostiek |
||
|
1 |
In welke gevallen moet laboratoriumdiagnostiek worden ingezet naar de ziekte van Von Willebrand? |
|
|
2 |
Hoe wordt de ziekte van Von Willebrand gediagnosticeerd en getypeerd? |
|
|
3 |
Wat is de plaats van genetische diagnostiek bij de ziekte van Von Willebrand? |
|
|
Behandeling |
||
|
4 |
Wat zijn de indicaties en contra-indicaties voor het gebruik van DDAVP bij de ziekte van Von Willebrand? |
|
|
5 |
Hoe is de behandeling bij een bloeding bij de ziekte van Von Willebrand? |
Tabel 5.4 |
|
6 |
Hoe is de behandeling rondom een ingreep of operatie? |
Tabel 6.3 |
|
7 |
Wanneer en hoe wordt profylactische behandeling met stollingsfactor concentraat gegeven bij de ziekte van Von Willebrand? |
|
|
8 |
Hoe is de prenatale diagnostiek en het beleid in de zwangerschap en bij de partus van vrouwen met de ziekte van Von Willebrand? |
Tabel 8.1 |
|
9 |
Hoe is de diagnostiek en het beleid bij hevig menstrueel bloedverlies (HMB) bij (jonge) vrouwen met de ziekte van Von Willebrand? |
|
|
10 |
Onder welke omstandigheden kunnen trombocytenaggregatieremmers en/of antistolling veilig worden gegeven bij patiënten met de ziekte van Von Willebrand? |
Tabel 10.1 |
|
10.1 |
Onder welke omstandigheden kunnen antitrombotica veilig worden gegeven bij de behandeling van acuut coronair syndroom in patiënten met VWD? |
|
|
10.2 |
Onder welke omstandigheden kunnen trombocytenaggregatieremmers veilig worden gegeven in het kader van secundaire preventie van coronaire events bij patiënten met VWD? |
|
|
10.3 |
Wanneer is medicamenteuze preventie van veneuze trombose aangewezen? |
|
|
10.4 |
Onder welke omstandigheden kunnen anticoagulantia veilig worden gegeven bij de therapeutische behandeling van reeds opgetreden trombose in patiënten met VWD? |
|
|
10.5 |
Wanneer zijn anticoagulantia aangewezen ter voorkoming van herseninfarct bij boezemfibrilleren bij patiënten met VWD? |
|
In welke gevallen moet laboratoriumdiagnostiek worden ingezet naar de ziekte van Von Willebrand?
Aanbevelingen
Verricht bij individuen met een eerste graads familielid met VWD diagnostiek naar VWD ongeacht de uitslag van de gestandaardiseerde ‘bleeding assessment tool’.
Onderbouwing
Inleiding
Deze vraag beschrijft bij welke patiëntcategorieën in welke klinische context onderzoek naar VWD ingezet dient te worden en welke rol een gestandaardiseerde ‘bleeding assessment tool’ daarbij speelt.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Bij patiënten met een verhoogde bloedingsneiging is onderzoek naar VWD geïndiceerd. (expert opinion/consensus) |
|
C |
‘Bleeding assessment tools’ zijn van beperkte diagnostische waarde bij de analyse van een bloedingsneiging. (Moenen, 2018) |
|
C |
De sensitiviteit van gestandaardiseerde ‘bleeding assessment tools’ voor de diagnose VWD is 0,75 (95% CI, 0,66-0,83). (James, 2021; Kalot, 2021) |
|
C |
De specificiteit van gestandaardiseerde ‘bleeding assessment tools’ voor de diagnose VWD is 0,54 (95% CI, 0,29-0,77). (James, 2021; Kalot, 2021) |
|
C |
De waarde van gestandaardiseerde ‘bleeding assessment tools’ is afhankelijk van de prevalentie van VWD in de patiënten populatie waarin deze wordt toegepast. (James, 2021) |
Samenvatting literatuur
Resultaten
De diagnostische waarde van ‘bleeding assessment tools’ werd beschreven in een sytematische review door Moenen et al. (Moenen, 2018). Er is een grote spreiding in sensitiviteit en specificiteit tussen de diverse studies. In studies met een case-control opzet werd de diagnostische waarde te optimistisch beoordeeld. Met name in de methologisch betere studies bleek de waarde van de ‘bleeding assessment tool’ teleurstellend.
In de internationale (ASH, ISTH, NHF, WFH) richtlijn over de diagnose van VWD zijn de aanbevelingen over het gebruik van ‘bleeding assessment tools’ (BAT) gestratificeerd naar drie prevalenties van VWD om rekening te houden met de verschillende frequenties van aangedane patiënten in verschillende populaties c.q. klinische setting (James, 2021). Voor de aanbevelingen zijn in de internationale richtlijn 7 cohort studies beoordeeld met betrekking tot sensitiviteit en specificiteit van gestandaardiseerde ‘bleeding assessment tools’ (BAT) voor VWD (Bidlingmaier, 2012; Bowman, 2009; Bowman, 2008; Deforest, 2015; Malec, 2016; Marcus, 2011; Philipp, 2008). In deze 7 cohort studies was de algehele sensitiviteit van de BAT in 112 patiënten met VWD 0,75 (95% confidentie interval [CI], 0,66-0,83) (James, 2021; Kalot, 2021). De sensitiviteit was het hoogst voor volwassen vrouwen. De specificiteit onder 863 patiënten was 0,54 (95% CI, 0,29-0,77) (James, 2021; Kalot, 2021). De studies onderzochten het gebruik van een gevalideerde BAT versus het niet-gebruiken van een gevalideerde BAT (dus niet ongestandaardiseerd testen). In een populatie met een lage voorafkans van 3% op VWD (zoals in de eerste lijn) heeft 2,3% een juist positieve BAT, 44,7% een fout positieve BAT, 52,3% een juist negatieve BAT, en 0,7% fout negatieve BAT (positief voorspellende waarde 5%, negatief voorspellende waarde 99%). In een populatie met een intermediaire voorafkans van 20% op VWD (zoals na verwijzing naar bijvoorbeeld hematoloog in verband met bloedingsneiging) heeft 15% een juist positieve BAT, 36,9% fout positieve BAT, 43,1% een juist negatieve BAT, en 5% een fout negatieve BAT (positief voorspellende waarde 29%, negatief voorpsellende waarde 90%). In een populatie met een hoge voorafkans van 50% op VWD (zoals in de situatie met aangedane eerste graads familieleden) heeft 37,6% een juist positieve BAT, 23% een fout positieve BAT, 27% een juist negatieve BAT, en 12,4% een fout negatieve BAT (positief voorspellende waarde 62%, negatief voorspellende waarde 69%). Een interactieve samenvatting van de resultaten is te vinden op https://gdt.gradepro.org/presentations/#/isof/isof_c5b33e22-a646-4654-9f09-b820aff36c5c-1569520689536?_k=eump67. Een compedium van gevalideerde BATs is te vinden op https://elearning.wfh.org/resource/compendium-of-assessment-tools/#bleeding_assessment_tools1a42-60ce78a1-2573f205-9a34.
Referenties
Bewijskracht literatuur
Level 2, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van een systematisch review (Moenen, 2018), de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (James, 2021), en van de systematische review waarop bovengenoemde richtlijn is gebaseerd (Kalot, 2021).
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (James, 2021).
Evidence tabellen
De evidence tabellen zijn opgenomen in supplement 5 van de gebruikte richtlijn (James, 2021). De uitgewerkte analyses van het bewijs voor de aanbevelingen is te vinden op:
Overwegingen
Het voordeel van een gestandaardiseerde ‘bleeding assessment tool’ is het identificeren van patiënten die VWD hebben en die gemist zouden worden zonder de toepassing daarvan. Het nadeel van een gestandaardiseerde ‘bleeding assessment tool’ is het missen van patiënten die nog geen bloedingssymptomen hebben gehad, zoals bijvoorbeeld mannen en kinderen of aangedane familieleden. Met name in een hogere prevalentiesetting speelt het risico op het missen van patiënten. Het is belangrijk om aangedane patiënten niet te missen en anderzijds ook om niet onnodig bloedonderzoeken in te zetten. In een populatie met een lage prevalentie is er mogelijk nog wel een netto voordeel van de ‘bleeding assessment tools’, ondanks veel vals positieven. Maar bij een hogere prevalentie moet een ‘bleeding assessment tool’ niet als enige screeningsinstrument gebruikt worden om te bepalen bij wie je wel of niet aanvullend bloedonderzoek inzet. De ‘bleeding assessment tool’ kan wel gebruikt worden voor het vastleggen van de ernst van bloedingsneiging in aanvulling op laboratoriumonderzoek.
Hoe wordt de ziekte van Von Willebrand gediagnosticeerd en getypeerd?
Aanbevelingen
Onderbouwing
Inleiding
Deze vraag beschrijft welke specifieke testen ingezet kunnen worden voor de diagnose en (sub)typering van VWD. Daarnaast worden afkapwaardes beschreven die gebruikt worden voor het stellen van de diagnose en bij de typering. Juiste typering is van belang voor keuze van behandeling en counseling van de patiënt.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
De juistheid van VWF:GPIbM, VWF:GPIbR en VWF:RCo zijn vergelijkbaar, maar de nieuwere bepalingen VWF:GPIbM en VWF:GPIbR hebben een kleinere variatie coefficient en betere reproduceerbeid dan de VWF:RCo. (James, 2021; Kalot, 2022b) |
|
C |
Bij patiënten met VWD type 1 met VWF:Ag < 30 IE/dL worden VWF mutaties gevonden bij 75% tot 82% van de patiënten en bij patiënten met VWF:Ag tussen 30 en 50 IE/dL worden VWF mutaties gevonden bij 44% tot 60% van de patiënten. (James, 2021; Kalot, 2022a) |
|
C |
Versnelde klaring als oorzaak van VWD kan herkend worden met een DDAVP proefbehandeling of een verhoogde ratio VWFpp/VWF:Ag. Er zijn geen data betreffende de nauwkeurigheid van beide testen. (James, 2021; Kalot, 2022b) |
|
C |
De sensitiviteit van een VWF activiteit/VWF:Ag ratio van <0,7 voor het detecteren van VWD type 2 is 0,90 (95% CI, 0,83-0,94) met een specificiteit van 0,91 (95% CI, 0,76-0,97). De sensitiviteit van een VWF activiteit/VWF:Ag ratio van <0,5 voor het detecteren van VWD type 2 is 0,58 tot 0,79. (James, 2021; Kalot, 2022a) |
|
C |
De sensitiviteit en specificiteit van de VWF multimeren analyse en de VWF:CB/VWF:Ag ratio voor de diagnose VWD type 2A en 2B zijn vergelijkbaar. (James, 2021; Kalot, 2022b) |
|
C |
De sensitiviteit van genetisch onderzoek voor de identificatie van VWD type 2B is 1,00 (CI95%, 1,00-1,00) en voor de RIPA test 0,99 (CI95%, 0,60-1,00). Data voor specificiteit ontbreken. Er is groot risico op bias in de studies door ontbreken van een externe referentie standaard. (James, 2021; Kalot, 2022b) |
|
C |
De sensitiviteit van zowel genetisch onderzoek als de VWF:FVIIIB test voor de diagnose VWD type 2N wordt gerapporteerd als 1,00 (CI95%, 1,00-1,00), echter beiden werden als referentie gebruikt dus ernstige bias. Data voor specificiteit ontbreken. (James, 2021; Kalot, 2022b) |
|
C |
In ongeveer 43% van de patiënten met VWD type 1 normaliseren de VWF waardes met het stijgen van de leeftijd. Er zijn echter geen longitudinale data met betrekking tot het bloedingsfenotype in die patiënten. (James, 2021; Kalot, 2022a) |
Samenvatting literatuur
Resultaten
De nieuwere VWF plaatjesbindende activiteitsassays
De nieuwere bepalingen voor de VWF plaatjesbindende activiteit zijn beoordeeld qua sensitiviteit en specificiteit (James, 2021; Kalot, 2022b). Hierbij zijn bepalingen die gebaseerd zijn op de binding van een monoclonaal antilichaam gericht tegen een epitoop in het VWF A1 domein buiten beschouwing gelaten, omdat die bepalingen geen daadwerkelijke plaatjesbindende activiteit meten (Bodó, 2015). De range van sensitiviteit en specificiteit voor VWF:RCo loopt van 0,83 tot 1,00, respectievelijk 0,87 tot 0,95 (Boender, 2018; Costa-Pint, 2014; Sagheer, 2016; Vangenechten, 2018). Voor VWF:GPIbR was de range van sensitiviteit 0,80 tot 1,00 en van specificiteit 0,81 tot 0.97 (Boender, 2018; Costa-Pint, 2014; Sagheer, 2016; Vangenechten, 2018). Voor GPIbM was dit in twee studies 0,62 tot 0,82 (sensitiviteit) en 0,90 tot 0,97 (specificiteit) (Boender, 2018; Vangenechten, 2018). De juistheid van de testen komt dus globaal met elkaar overeen. Door de case-controle opzet van de studies is er wel groot risico op bias.
De VWF afkapwaarde voor de diagnose VWD
Bij patiënten met een VWF waarde (VWF:Ag en/of VWF:Act) <30 IE/dL worden in 75-82% van de gevallen mutaties in het VWF gen gevonden (Flood, 2016; James, 2007a; James, 2021). Wanneer bij patiënten het VWF niveau tussen de 30 en 50 IE/dL ligt dan worden in 44-60% van de gevallen mutaties in VWF gen gedetecteerd (Flood, 2016; James, 2007a; James, 2021; Lavin, 2017). De likelihood ratio voor VWD is oneindig bij VWF waardes van 30 tot 40 IE/dL, 0,73 (0,41-1,30) bij VWF waardes tussen 41 en 50 IE/dL en 0,33 (0,18-0,62) bij VWF waardes van 51 tot 60 IE/dL (Bucciarelli, 2015). Er zijn verschillen tussen laboratoria en indien de ondergrens van het normale gebied lager ligt dan 50 IE/dL dan dient die grens van het eigen laboratorium te worden gehanteerd (James, 2021).
Het vaststellen van versnelde VWF klaring (VWD type 1C)
Versnelde klaring van VWF is een bekend pathofysiologisch mechanisme bij VWD type 1 en is verantwoordelijk voor ongeveer 15-20% van de gevallen (Haberichter, 2006; Sadler, 2006). Versnelde klaring van VWF uit de circulatie kan worden herkend op basis van een verhoogde VWFpp/VWF:Ag ratio (Sztukowska, 2008), maar ook op basis van een DDAVP proefbehandeling met een 4-uurs tijdpunt na infusie (Haberichter, 2008). Bij gebrek aan een geaccepteerde referentietest voor type 1C zijn er geen gegevens voor juistheid van beide testen (James, 2021).
Afkapwaarde van de VWF:Act/VWF:Ag ratio voor het stellen van de diagnose VWD type 2
Zes observationele studies rapporteerden de VWF:Act/VWF:Ag ratio in VWD type 2 (Adcock, 2006; Caron, 2006; Chen, 2011; de Maistre, 2014; James, 2007b; Vangenechten, 2018). De gepoolde sensitiviteit van een VWF:Act/VWF:Ag ratio van <0,7 voor het detecteren van VWD type 2 is 0,90 (95% CI, 0,83-0,94) met een specificiteit van 0,91 (95% CI, 0,76-0,97) (James, 2021; Kalot, 2022a). De gepoolde sensitiviteit van een VWF activiteit/VWF:Ag ratio van <0,5 voor het detecteren van VWD type 2 is 0,58 tot 0,79 (James, 2021; Kalot, 2022a).
VWF multimeren analyse versus VWF:CB voor de subtypering van VWD type 2
De gepoolde sensitiviteit en specificiteit van de VWF multimeren analyse voor de diagnose type 2A/2B is 0,94 (95% CI, 0,90-0,99) en 0,97 (95% CI, 0,94-0,99), respectivelijk, en voor de VWF:CB/VWF:Ag ratio is dit respectievelijk 0,90 (95% CI, 0,78-0,96) en 0,95 (95% CI, 0,89-0.98) (James, 2021; Kalot, 2022b). Voor de diagnose VWD type 2M is de gepoolde sensitiviteit en specificiteit van de VWF multimeren analyse respectievelijk 0,86 (95% CI, 0,73-0,98) en 0,97 (95% CI, 0,94-0,99), en voor de VWF:CB/VWF:Ag ratio is dit respectievelijk 0,98 (95%CI, 0,96-1,00) en 0,99 (95% CI, 0,98-1,00) (James, 2021; Kalot, 2022b). In de studies waarop deze data gebaseerd zijn werd een combinatie van platelet function analyser, RIPA, VWF:Ag, FVIII:C, VWF:RCo, VWF:GPIbR, VWF:GPIbM, en DNA diagnostiek gebruikt als referentie standaard voor de diagnose.
RIPA versus genetische diagnostiek voor de diagnose VWD type 2B
In de ASH ISTH NHF WFH 2021 VWD richtlijn (James, 2021) zijn 9 studies geanalyseerd waarin genotype-fenotype correlaties werden gerapporteerd. De sensitiviteit van genetisch onderzoek voor de identificatie van VWD type 2B is 1,00 (CI95%, 1,00-1,00) en voor de RIPA test 0,99 (CI95%, 0,60-1,00) (James, 2021; Kalot, 2022b). De data zijn echter sterk gebiast door cirkelredenering aangezien de ‘type 2B mutaties’ eerder juist op basis van RIPA waren geduid als ‘type 2B mutaties’. Er is feitelijk geen externe referentie standaard.
VWF:FVIIIB versus genetische diagnostiek voor de diagnose VWD type 2N
VWD type 2N wordt gekenmerkt door een verminderde bindingsaffiniteit van VWF voor factor VIII. Deze binding kan gemeten worden met de VWF:FVIIIB assay. In de ASH ISTH NHF WFH 2021 VWD richtlijn (James, 2021) zijn meerdere studies meegewogen waarin VWF:FVIIIB of VWF mutatie analyse werden gerapporteerd. Hoewel de gepoolde sensitiviteit van zowel genetisch onderzoek als de VWF:FVIIIB test voor de diagnose VWD type 2N berekend is als 1,00 (CI95%, 1,00-1,00), was er in deze studies ernstige bias doordat beide testen ook als referentie gebruikt werden (James, 2021; Kalot, 2022b).
Normalisatie van VWF waardes bij een historische diagnose VWD type 1
In meerdere studies is beschreven, dat bij patiënten met een historische diagnose VWD type 1 de VWF waardes in de tijd gestegen kunnen zijn tot normale waardes (Abou-Ismail, 2018; Borghi, 2017; Lavin , 2017; Nummi, 2018; Rydz, 2015; Sanders, 2014). In ongeveer 43% van de patiënten met VWD type 1 normaliseren de VWF waardes met het stijgen van de leeftijd (Abou-Ismail, 2018; Borghi, 2017; Nummi, 2018; Rydz, 2015). Er zijn echter geen studies die longitudinaal onderzocht hebben of de bloedingsneiging verminderde met het stijgen van de VWF waardes (James, 2021; Kalot, 2022a).
Referenties
Bewijskracht literatuur
Level 2, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (James, 2021) en van de systematische reviews waarop bovengenoemde richtlijn is gebaseerd (Kalot, 2022a; Kalot, 2022b).
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (James, 2021).
Evidence tabellen
De evidence tabellen zijn opgenomen in supplement 5 van de gebruikte richtlijn (James, 2021). De uitgewerkte analyses van het bewijs voor de aanbevelingen is te vinden op:
https://guidelines.ash.gradepro.org/profile/JHcpxNiXNGU (aanbeveling 8)
Overwegingen
Ad aanbeveling 1:
De bepalingen voor VWF plaatjesbindende activiteit (VWF:RCo, VWF:GPIbM en VWF:GPIbR) zijn qua sensitiviteit en specificiteit met elkaar vergelijkbaar. De nieuwere testen hebben een klein voordeel boven de VWF:RCo vanwege kleinere variatie coëfficient en betere reproduceerbaarheid. Daarnaast komt de VWF:RCo test foutief lager uit bij dragers van de genetische VWF variant D1472H en heeft daarmee kans op overdiagnostiek (Flood, 2010; Flood, 2013). Op grond van deze overwegingen wordt er, afhankelijk van beschikbaarheid, een lichte voorkeur gegeven aan de VWF:GPIbM en VWF:GPIbR bepalingen.
Ad aanbeveling 2:
Bij VWF waardes lager dan 30 IE/dL is de diagnose VWD zeer waarschijnlijk op basis van de likelihood ratio en het hoge percentage VWF mutaties in deze categorie patiënten. Bij waardes van VWF tussen 30-50 IE/dL is er iets meer onzekerheid, maar nog steeds is de likelihood ratio op de diagnose VWD hoog en is ook het percentage mutaties dat gevonden wordt hoog. Wel is er meer incomplete penetrantie en variabele expressie bij patiënten met VWF in de range van 30-50 IE/dL.
VWF is een acute fase eiwit dat toeneemt in reactie op verscheidene stimuli zoals bloeding, trauma, inspanning, stress en zwangerschap. Testen op VWD moet dan ook alleen verricht worden als patiënten ontspannen zijn en in hun basis gezondheidstoestand. Bij een hoge klinische verdenking en normale waarden dienen de omstandigheden van de afname nagegaan te worden en de diagnostiek zo nodig herhaald te worden.
Ad aanbeveling 3:
Het herkennen van patiënten met een versnelde VWF klaring is van belang voor de behandeling, aangezien die patiënten mogelijk VWF concentraat behoeven in plaats van DDAVP bij bloedingen of ingrepen die op dezelfde dag een langdurige respons nodig hebben. Aangezien een DDAVP proefbehandeling sowieso belangrijke informatie geeft over de toepasbaarheid van DDAVP bij een patiënt wordt hieraan de voorkeur gegeven als test om versnelde klaring van VWF te identificeren.
Ad aanbeveling 4:
Bij een afkapwaarde voor VWF:Act/VWF:Ag <0,7 zijn er mogelijk meer vals positieve uitslagen dan bij lagere afkapwaardes, maar bij type 2 VWD wordt altijd aanvullend onderzoek gedaan, zodat de juiste typering alsnog volgt. Bij een afkapwaarde VWF:Act/VWF:Ag van <0,5 is de specificiteit voor VWD type 2 weliswaar hoger, maar is er grotere kans op vals negatieven en misclassificatie als type 1 VWD.
Ad aanbeveling 5:
Qua sensitiviteit en specificiteit blijken de VWF multimeren analyse en VWF:CB/VWF:Ag ratio ongeveer vergelijkbaar. De VWF:CB assay is niet overal beschikbaar en er zijn verschillen tussen de bepalingen qua collageen type dat gebruikt wordt. Daarnaast wordt VWD type 2M specifiek gekenmerkt door een normaal VWF multimeren patroon, zodat voor de diagnose VWD type 2M sowieso VWF multimeren noodzakelijk zijn. Derhalve is er een voorkeur voor het gebruik van de VWF multimeren analyse.
Ad aanbeveling 6:
Het is van belang om de diagnose VWD type 2B juist te stellen en te onderscheiden van type 2A, zowel vanwege het ernstiger bloedingsfenotype als het risico op trombocytopenie bij type 2B (Federici, 2009) als ook de contra-indicatie voor het gebruik van DDAVP bij de behandeling van VWD type 2B. Zowel gerichte genetische diagnostiek als ook de RIPA kan gebruikt worden voor het identificeren van VWD type 2B en het onderscheid met type 2A. De keuze qua diagnostiek zal deels afhankelijk zijn van de beschikbaarheid van de desbetreffende bepalingsmethode.
Ad aanbeveling 7:
Het is van belang om de diagnose VWD type 2N juist te stellen. VWD type 2N moet onderscheiden worden van milde hemofilie A in verband met de andere overerving (autosomaal recessief versus X-gebonden recessief) en andere behandeling (VWF concentraat versus factor VIII concentraat). Niet alle VWF mutaties die VWD type 2N veroorzaken zijn bekend of uitgebreid onderzocht, waardoor een genetische uitslag niet altijd eenduidig kan zijn. Aangezien VWD type 2N zowel het gevolg kan zijn van homozygotie voor type 2N mutaties, als ook van compound heterozygotie voor een 2N mutatie en een null-allel, is alleen een VWF:FVIIIB assay voor de counseling niet voldoende. Er zal in de praktijk dus vaak eerst een VWF:FVIIIB assay worden verricht en bij afwijking een bevestiging met genetische diagnostiek.
Ad aanbeveling 8:
Met het stijgen van de leeftijd stijgt de VWF, maar het is nog onvoldoende duidelijk of daarmee ook het bloedingsrisico vermindert. In de Willebrand in Nederland (WiN) studie werd bij type 1 VWD patiënten boven de 65 jaar geen vermindering van het aantal bloedingen gezien, gemeten in het jaar voorafgaand aan inclusie in de studie in vergelijking met patiënten <65 jaar, ondanks de hogere VWF:Act gemeten in de oudere versus de jongere groep patiënten. Er zijn nog geen data beschikbaar van longitudinale studies in patiënten die in de tijd vervolgd zijn en is onderzocht of de bloedingsneiging afneemt met de stijging van de leeftijd en daarme van VWF spiegels. Het is daarom niet verantwoord om zondermeer de diagnose bij genormaliseerde VWF waardes te verwerpen. Wel kan de diagnose heroverwogen worden, waarbij eventueel aanvullend onderzoek gedaan kan worden naar andere oorzaken van de vermeende bloedingsneiging. Afhankelijk van de mate van stijging/normalisatie kan eventueel het beleid bij toekomstige bloedingen en/of ingrepen worden aangepast, maar hierin is terughoudend en inachtneming van het bloedingsfenotype wel vereist.
Wat is de plaats van genetische diagnostiek bij de ziekte van Von Willebrand?
Aanbevelingen
Onderbouwing
Inleiding
Deze vraag beschrijft wanneer het doen van genetische diagnostiek bij VWD zinnig is en bijdraagt aan een juiste diagnose en typering van VWD. Zie voor genetische diagnostiek in de context van eventuele prenatale diagnostiek de aanbevelingen bij uitgangsvraag over beleid in kader zwangerschap bij VWD. Zie ook de uitgangsvraag over de diagnostiek ter bevestiging van VWD voor de relatie tussen genetische diagnostiek en overige diagnostische testen bij VWD.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Bij patiënten met VWD type 1 met VWF:Ag < 30 IE/dL worden VWF mutaties gevonden bij 75% tot 82% van de patiënten en bij patiënten met VWF:Ag tussen 30 en 50 IE/dL worden VWF mutaties gevonden bij 44% tot 60% van de patiënten. (James, 2021; Kalot, 2022a) |
|
C |
De VWF concentratie wordt medebepaald door genetische ‘modifiers’ buiten het VWF gen (Leebeek,2016; Sharma, 2017). |
|
C |
De sensitiviteit van genetisch onderzoek voor de identificatie van VWD type 2B is 1,00 (CI95%, 1,00-1,00) en voor de RIPA test 0,99 (CI95%, 0,60-1,00). Data voor specificiteit ontbreken. Er is groot risico op bias in de studies door ontbreken externe referentie standaard. (James, 2021; Kalot, 2022b) |
|
C |
De meeste VWD type 2B mutaties zijn gelokaliseerd in het VWF A1-domein. (de Jong, 2017; Keeney, 2008; Leebeek, 2016; Swystun, 2017) |
|
C |
De sensitiviteit van zowel genetisch onderzoek als de VWF:FVIIIB test voor de diagnose VWD type 2N wordt gerapporteerd als 1,00 (CI95%, 1,00-1,00), echter beiden werden als referentie gebruikt dus ernstige bias. Data voor specificiteit ontbreken. (James, 2021; Kalot, 2022b) |
|
C |
De meeste VWD type 2N mutaties zijn gelokaliseerd in het VWF D’D3-domein. (Keeney, 2008; Leebeek, 2016; Swystun, 2017) |
|
C |
In ~90% van de VWD type 3 patiënten kan de VWF mutatie op beide allelen worden geïdentificeerd. (Baronciani, 2021) |
Samenvatting literatuur
Resultaten
Genetische diagnostiek bij VWD type 1
In meerdere studies is gerapporteerd dat bij patiënten met VWD type 1 slechts in ongeveer 65% van de gevallen een VWF gen mutatie kan worden vastgesteld (James, 2021; de Jong, 2017; Kalot, 2022a; Sharma, 2017; Sharma,2019; Swystun,2017). Er zijn meerdere genetische ‘modifiers’ beschreven buiten het VWF gen die mede bepalend zijn voor de concentratie van VWF in het bloed (Leebeek,2016; Sharma, 2017).
Genetische diagnostiek bij VWD type 2B
VWD type 2B wordt gekenmerkt door een toegenomen affiniteit van VWF voor GPIb (den Exter, 2021; Leebeek, 2016; Sadler, 2006). In de ASH ISTH NHF WFH 2021 VWD richtlijn (James, 2021) zijn 9 studies geanalyseerd waarin genotype-fenotype correlaties werden gerapporteerd. De sensitiviteit van genetisch onderzoek voor de identificatie van VWD type 2B is 1,00 (CI95%, 1,00-1,00) en voor de RIPA test 0,99 (CI95%, 0,60-1,00) (James, 2021; Kalot, 2022b). De data zijn echter sterk gebiast door cirkelredenering aangezien de ‘type 2B mutaties’ eerder juist op basis van RIPA waren geduid als ‘type 2B mutaties’. Er is feitelijk geen externe referentie standaard. De RIPA-test is niet in staat om betrouwbaar onderscheid te maken tussen VWD type 2B en ‘platelet-type’ VWD (de Jong, 2017). Het aantal verschillende ‘gain-of-function’ mutaties dat verantwoordelijk is voor de meeste VWD type 2B is relatief beperkt en de mutaties zijn vrijwel allemaal gelokaliseerd in het VWF A1-domein (de Jong, 2017; Keeney, 2008; Leebeek, 2016; Swystun, 2017).
Genetische diagnostiek bij VWD type 2N
VWD type 2N wordt gekenmerkt door een verminderde bindingsaffiniteit van VWF voor factor VIII (den Exter, 2021; Leebeek, 2016; Sadler, 2006). Deze binding kan gemeten worden met de VWF:FVIIIB assay. In de ASH ISTH NHF WFH 2021 VWD richtlijn (James, 2021) zijn meerdere studies meegewogen waarin VWF:FVIIIB of VWF mutatie analyse werden gerapporteerd. Hoewel de gepoolde sensitiviteit van zowel genetisch onderzoek als de VWF:FVIIIB test voor de diagnose VWD type 2N berekend is als 1,00 (CI95%, 1,00-1,00), was er in deze studies ernstige bias doordat beide testen ook als referentie gebruikt werden (James, 2021; Kalot, 2022b). Het aantal verschillende mutaties dat verantwoordelijk is voor de meeste VWD type 2N is relatief beperkt en de mutaties zijn vrijwel allemaal gelokaliseerd in het VWF D’D3-domein met een enkele mutatie in D2-domein (Keeney, 2008; Leebeek, 2016; Swystun, 2017).
Genetische diagnostiek bij VWD type 3
Patiënten met VWD type 3 worden gekenmerkt door (nagenoeg) onmeetbaar laag VWF:Ag (Leebeek, 2016; Sadler, 2006). VWD type 3 is autosomaal recessief en de patiënten zijn homozygoot of compound heterozygoot voor VWF gen mutaties. In het overgrote deel (~80%) van de gevallen betreft dit zogenaamde ‘null-allelen’. In een recent gepubliceerd zeer groot VWD type 3 cohort kon in 90% van de patiënten de VWF mutatie op beide allelen worden geïdentificeerd; in slechts 5% van de patiënten werd geen mutatie in het VWF gen gevonden en in 5% slechts een mutatie op 1 van de VWF allelen (Baronciani, 2021).
Referenties
Bewijskracht literatuur
Level 2-3, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (James, 2021) en van de systematische reviews waarop bovengenoemde richtlijn is gebaseerd (Kalot, 2022a; Kalot, 2022b). Daarnaast werd gebruik gemaakt van de richtlijn voor genetische diagnostiek bij VWD van de UK Haemophilia Centre Doctors’ Organisation (Keeny, 2008) en enkele andere recente overzichtsartikelen.
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (James, 2021).
Evidence tabellen
Alleen voor de aanbevelingen 2 en 3 zijn er evidence tabellen, die zijn opgenomen in supplement 5 van de gebruikte richtlijn (James, 2021). De uitgewerkte analyses van het bewijs voor de aanbevelingen is te vinden op:
Overwegingen
Ad aanbeveling 1:
Hoewel een zekere diagnose bij VWD type 1 vaak lastig is door de slechts mild verlaagde VWF waardes, is genetische diagnostiek niet de oplossing voor dit probleem. Bij veel patiënten met licht verlaagde waardes worden geen mutaties in het VWF gen gevonden. De afwezigheid van een VWF mutatie sluit de diagnose echter niet uit. Ook andere genetische ‘modifiers’van VWF beïnvloeden de plasmaspiegels. Omgekeerd is de aanwezigheid van een VWF mutatie ook geen bewijs voor ziekte. Zogenaamde null-allelen kunnen gepaard gaan met sterk verlaagde tot volledig normale VWF spiegels. Tot slot zijn de vele nieuwe varianten die worden vastgesteld niet eenduidig als pathogeen aan te merken. De diagnose VWD type 1 is daarom gebaseerd op klinisch- en laboratorium fenotype.
Ad aanbeveling 2:
Wanneer de diagnose VWD type 2B wordt vermoed op basis de diverse VWF parameters en de uitslag van de RIPA test dan is het advies om de diagnose te bevestigen met genetische diagnostiek van het VWF gen. Het is van belang om de diagnose zeker te weten in verband met het risico op trombocytopenie bij VWD type 2B en de contraindicatie voor DDAVP. Daarnaast is de RIPA-test niet in staat om betrouwbaar onderscheid te maken tussen VWD type 2B en ‘platelet-type’ VWD. De genetische diagnostiek naar VWD type 2B kan relatief eenvoudig aangezien de meeste mutaties vrijwel allemaal gelokaliseerd zijn in het VWF A1-domein en slechts een klein aantal mutaties verantwoordelijk is voor het overgrote deel van de patiënten. Indien de diagnose in de familie reeds op genetisch niveau is bevestigd, is het niet nodig dit in elk individu te herhalen. Zie voor eventuele toepassing van VWD type 2B mutatieonderzoek in de primaire diagnostiek van VWD de uitgangsvraag over de diagnostiek ter bevestiging van VWD.
Ad aanbeveling 3:
Wanneer de diagnose VWD type 2N wordt vermoed op basis de diverse VWF parameters en de uitslag van de VWF:FVIIIB assay dan is het te overwegen om de diagnose te bevestigen met genetische diagnostiek van het VWF gen. Het is van belang om de diagnose VWD type 2N met zekerheid vast te stellen en te onderscheiden van milde hemofilie A in verband met de andere overerving (autosomaal recessief versus X-gebonden recessief) en andere behandeling (VWF concentraat versus factor VIII concentraat). De genetische diagnostiek naar VWD type 2N kan relatief eenvoudig aangezien de meeste mutaties gelokaliseerd zijn in het VWF D’D3-domein en het aantal verschillende mutaties relatief beperkt is. Echter niet alle mutaties zijn bekend, dus een mutatie zal niet altijd met zekerheid zijn aan te merken als pathogeen. Zie voor eventuele toepassing van VWD type 2N mutatieonderzoek in de primaire diagnostiek van VWD de uitgangsvraag over de diagnostiek ter bevestiging van VWD.
Ad aanbeveling 4 en 5:
Het fenotype van VWD type 3 is dermate uitgesproken en de VWF en factor VIII parameters zijn meestal zo sterk verlaagd, dat de diagnose eenvoudig is te stellen op klinisch – en laboratorium fenotype en derhalve wordt geen genetische diagnostiek geadviseerd. Soms kan het onderscheid tussen VWD type 3 en een ernstige vorm van type 1 lastig zijn. Met name bij type 1 met een zeer snelle klaring van VWF kan de basale VWF waarde erg laag zijn, maar merendeels nog wel hoger dan bij de meeste VWD type 3. De overerving in de familie verschilt (type 3: autosomaal recessief, type 1: autosomaal dominant) waardoor het door die informatie meestal al duidelijk wordt wat de diagnose is. Bij ernstige VWD kan genetische diagnostiek wel worden overwogen ten behoeve van erfelijke en preconceptionele counselling. Zie voor toepassing van VWF mutatieonderzoek in de context van preconceptionele counselling de uitgangsvraag over prenatale diagnostiek en beleid in de zwangerschap.
Wat zijn de indicaties en contra-indicaties voor het gebruik van DDAVP bij de ziekte van Von Willebrand?
Aanbevelingen
Onderbouwing
Inleiding
Deze vraag beschrijft bij welke patiënten met von Willebrand ziekte (VWD) DDAVP kan worden gebruikt als behandeling bij bloedingen of bij ingrepen/operaties.
DDAVP (1-deamino-8-D-arginine-vasopressine; desmopressine) maakt opgeslagen VWF en factor VIII vrij uit het endotheel en verhoogt VWF en factor VIII in de circulatie. Sinds de eerste beschrijving van het effect van DDAVP op de bloedstolling is het middel gebruikt bij de behandeling van VWD ziekte en niet-ernstige hemofilie A (Mannucci, 1977). De respons op DDAVP is afhankelijk van meerdere factoren, waaronder type VWD en hoogte van de VWF activiteit. Bij een zelfde persoon is het effect van DDAVP consistent in de tijd, al worden op de kinderleeftijd minder hoge responses op DDVAP gezien. Er zijn inmiddels meerdere studies die aantonen dat de respons op DDAVP ook sterk afhankelijk is van de onderliggende VWF mutatie, wat betekent dat in families de respons op DDAVP in de verschillende familieleden meestal vergelijkbaar is (Castaman, 2008; Atiq, 2022). De vraag beschrijft het gebruik van een proefbehandeling om het effect van DDAVP vast te stellen en de therapeutische toepassing van DDAVP bij bloedingen en interventies bij patiënten met VWD. Ook worden praktische aandachtspunten benoemd voor een effectief en veilig gebruik van DDAVP.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Bij patiënten met VWD type 1 en 2 is de respons op DDAVP zeer variabel en is een proefbehandeling met DDAVP noodzakelijk om de respons te beoordelen (Connell, 2021) |
|
C |
DDAVP kan bij patiënten met VWD type 2B leiden tot een (verergering van de ) trombocytopenie en is daarom gecontra-indiceerd (Federici, 2009) |
|
C |
VWD type 1 patiënten met VWF:Ag en VWF:Act >30 IE/dL reageren goed op DDAVP en het is daarom niet nodig een DDAVP proefbehandeling uit te voeren (Connell, 2021; Kalot 2022, Heijdra 2022) |
|
C |
Bij patiënten met VWD type 1 en 2 kunnen chirurgische interventies veilig worden uitgevoerd onder DDAVP, mits de respons adequaat is voor de uit te voeren ingreep (Connell, 2021) |
|
C |
Bij patiënten met VWD type 1 en 2 kunnen bloedingen worden behandeld met DDAVP, mits de respons adequaat is voor de ernst van de bloeding (Connell, 2021) |
|
C |
Het hemostatisch effect van intraveneus en subcutaan toegediende DDAVP is vergelijkbaar (Sreeraman, 2022) |
|
C |
DDAVP toediening kan leiden tot waterretentie en hyponatriemie. De kans hierop kan worden verlaagd door vochtrestrictie van 1500 mL per 24 uur na toediening DDAVP (Bertholini, 2000; Connell, 2021) |
|
C |
Herhaalde toediening van DDAVP leidt tot vermindering van de respons (tachyfylaxie) door een geringere stijging van factor VIII en VWF (Mannucci, 1997). Tevens verhoogt herhaalde toediening de kans op hyponatriemie (Chin, 2022) |
Samenvatting literatuur
Resultaten
Door de grote inter-individuele variatie in respons op DDAVP wordt een proefbehandeling gegeven voordat DDAVP als behandeling gebruikt wordt. Een piekeffect van stijging van factor VIII en VWF wordt na 30-60 minuten bereikt indien DDAVP intraveneus wordt toegediend. (Mannucci, 1977) Het piekeffect wordt na 60-90 minuten bereikt indien DDAVP subcutaan of intranasaal wordt toegediend. Intraveneus, subcutaan of intranasaal toegediend DDAVP kan de plasmaspiegel van factor VIII en VWF:Act na 1 uur ongeveer twee- tot zesvoudig verhogen. Er zijn verschillende definities voor een voldoende of goede respons op DDAVP. De huidige, meest gebruikte respons definitie is als volgt: Een partiele respons is gedefinieerd als VWF:Act en FVIII:C stijging van tenminste 2 tot 3-voudig en een plasma activiteit tussen de 30-50 IE/dL na 1 uur. Een complete respons is gedefinieerd als VWF en FVIII:C > 50 IE/dL. (Castaman, 2008; Sanchez-Luceros, 2010; Loomans 2018; Connell 2021; Heijdra 2022) VWF:Act en FVIII:C dient ook gemeten te worden na 4 uur, om te onderzoeken of er een snelle klaring is, zoals bij een VWD type 1C ofwel VWD Vicenza. (Connell, 2021) Hierbij is er een goede initiële respons na 1 uur, maar de waarden op 4 uur zijn al weer verlaagd. Recent zijn er enkele studies verricht die aantonen dat patiënten met een Type 1 VWD en een VWF:Act ≥30 IE/dL nagenoeg altijd een goede respons hebben op DDAVP. (Heijdra, 2022) Daarom wordt bij deze patiëntengroep geen DDAVP proefbehandeling geadviseerd. Wel is het raadzaam om bij de eerste therapeutische toediening de respons te bepalen. (Connell, 2021)
Behandeling met DDAVP
De bruikbaarheid van DDAVP is mede afhankelijk van de aard van de voorgenomen ingreep of de ernst van de bloeding. Bij een kleine ingreep of een niet-ernstige bloeding volstaat DDAVP indien er een goede respons is op de testdosis.(Nichols, 2008; Laffan, 2014) In een systematic review uitgevoerd in het kader van de recente ASH/ISTH/WFH/NHF richtlijn voor VWD werd bij 95% van de interventies en 97% van de bloedingen de hemostatische effectiviteit van DDAVP als excellent, goed of effectief gescoord. (Connell, 2021, suppl 5) Bij een grote ingreep met een hoog bloedingsrisico wordt DDAVP niet als enige behandeling geadviseerd en dient gebruik te worden gemaakt van VWF(/factor VIII) concentraat om langdurig adequate VWF en factor VIII spiegels te kunnen bereiken. (Nitu-Whalley 2011; Nichols, 2008; Laffan, 2014). Indien bij een patiënt langdurige correctie van factor VIII en VWF noodzakelijk is kan de patiënt gedurende enkele dagen worden behandeld met VWF(/factor VIII) concentraat in de daaropvolgende dagen gevolgd door DDAVP. (Seaman, 2019)
Wanneer DDAVP binnen korte tijd herhaald wordt (na 12-24 uur), neemt het effect af (tachyfylaxie) doordat de voorraad VWF in de endotheelcellen uitput. Bij herhaalde toediening dient het effect dagelijks te worden geëvalueerd door bepaling van de VWF:Act en FVIII:C. DDAVP wordt maximaal drie dagen achtereen toegediend. (Connell, 2021)
Gebruik van DDAVP tijdens zwangerschap en rondom de bevalling
Hiervoor wordt verwezen naar specifieke uitgangsvraag “Beleid in kader zwangerschap bij ziekte van Von Willebrand” in deze richtlijn.
Praktische richtlijn
Indicaties
Ter behandeling van lichte tot matig-ernstige bloedingen of ter preventie van bloedingen bij kleine/ middelgrote ingrepen bij patiënten met VWD type 1 (indien adequate respons), VWD type 2A en 2M (indien adequate respons). Tevens bij de VWD type 2N, waarbij rekening moet worden gehouden met een korte halfwaardetijd van factor VIII.
Contra-indicaties
Als contra-indicaties (onafhankelijk van leeftijd) voor het gebruik van DDAVP worden in het
Farmacotherapeutisch Kompas vermeld:
Dosering
DDAVP is verkrijgbaar in de volgende toedieningsvormen:
Volwassenen
Intraveneuze dosering en oplossing: 0,3 µg/kg opgelost in 50 ml NaCl 0,9% in 30 minuten op geleide van pols en tensie. Bij ingrepen minimaal 30 minuten voor de ingreep toedienen. Boven de 100 kg kan een dosering van 30 µg worden toegediend (Heijdra, 2022).
Intranasale toediening: 300 µg (1 puf van 150 µg in ieder neusgat). Bij ingrepen 60-90 minuten voor de ingreep toedienen.
Subcutane toediening: 0,3 µg/kg. Bij ingrepen 60-90 minuten voor de ingreep toedienen.
Kinderen
Intraveneuze dosering en oplossing: 0,3 µg/kg opgelost in 50 ml NaCl 0,9% in 30 minuten op geleide van pols en tensie.
Intranasale toediening: bij gewicht 20-40 kg: 150 µg (1 puf in één neusgat). Bij gewicht > 40 kg: 300 µg (1 puf van 150 mg in ieder neusgat). <20 kg uitsluitend intraveneus geven.
Subcutane toediening: 0,3 µg/kg. Bij ingrepen 60-90 minuten voor de ingreep toedienen.
Bijwerkingen
Hoofdpijn, tachycardie, hypotensie, roodheid van het gelaat, buikpijn, tremor en transpireren tijdens of kort na toediening. Vochtretentie. Ernstige hyponatriëmie, met als gevolg convulsies en coma.
Zelden (< 0,1%) worden duizeligheid, conjunctivitis en oedeem rondom het oog vermeld. Er zijn sporadisch gevallen van trombose (ischemisch CVA, myocardinfarct) beschreven kort na DDAVP toediening. (Leissinger, 2001, Stoof 2016)
De verschijnselen van vasodilatatie (flushes, tachycardie) kunnen worden verminderd door de vloeistof tweemaal zo langzaam in te laten lopen. Overmatige vochtinname (per os of intraveneus) dient te worden vermeden gedurende de eerste 8-12 uur na toediening in verband met het antidiuretische effect van DDAVP (maximaal 1-1,5 L per 24 uur). Bij toediening van DDAVP gedurende meerdere dagen aan volwassenen dient het serumnatrium te worden gecontroleerd. Bij gelijktijdig gebruik van middelen die de afgifte van ADH verstoren, zoals tricyclische antidepressiva, SSRI’s, chloorpromazine, loperamide en carbamazepine, is het risico op waterintoxicatie verhoogd. Ook bij gelijktijdig gebruik van NSAID’s kan er hyponatriëmie optreden.
Vooral bij jonge kinderen (<3 jaar en <20 kg) kan waterintoxicatie en hyponatriemie optreden en geldt gedurende 12 uur na DDAVP-gebruik een strikte vochtbeperking van maximaal 100 ml. Bij grotere kinderen wordt een vochtbeperking van de helft van normaal onderhoudsvocht voor de leeftijd aangehouden, conform volwassen beleid. Gezien het risico op ernstige bijwerkingen (convulsies, coma ten gevolge van hyponatriëmie) verdient het aanbeveling bij toediening van DDAVP aan jonge kinderen met een gewicht < 20 kg de kinderen klinisch te observeren met controle van het serumnatrium tot 24 uur na toediening. Ook bij herhaalde toediening moet men bedacht zijn op het ontstaan van hyponatriëmie (Chin, 2022). Hierom wordt DDAVP maximaal 3 dagen achtereen gegeven.
Voorlichting aan patiënten
Patiënten dienen goed te worden voorgelicht over het gebruik van DDAVP, met name over het (kleine) risico van hyponatriëmie bij teveel vocht inname, bij voorkeur zowel mondeling als schriftelijk. Daarom wordt een maximale vochtinname van 1500 ml in de 24 uur na DDAVP geadviseerd aan volwassen patiënten. Bij jonge kinderen is de vochtbeperking nog strikter. Bij klachten van erge hoofdpijn of misselijkheid of andere neurologische klachten, moeten patiënten direct contact opnemen met hun behandelaar. Ook dient het serum natrium te worden gecontroleerd.
Uiteraard is het gebruik van DDAVP ook afhankelijk van de voorkeur van de patiënt. Sommige patiënten hebben bij eerdere toedieningen van DDAVP bijwerkingen ervaren, zoals tachycardie, flushes en hypotensie, en geven er de voorkeur aan om niet met DDAVP behandeld te worden. Een alternatief is dan tranexaminezuur of VWF(/factor VIII) concentraat, afhankelijk van de aard van de ingreep en de VWF:Act en FVIII:C.
Referenties
Bewijskracht literatuur
Level 2-3, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (Connell, 2021) en van de systematische reviews waarop bovengenoemde richtlijn is gebaseerd (supplement 5). Daarnaast werd gebruik gemaakt een recent systematic review (Sreeraman, 2022) en een Britse VWD richtlijn van de UKHCCDO (Laffan, 2014)
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (Connell, 2021).
Evidence tabellen
Voor de huidige richtlijn is gebruik gemaakt van de evidence tabellen in supplement 5 van de gebruikte richtlijn (Connell, 2021). Tevens van het gepubliceerde systematic review van Kalot, 2022. (https://guidelines.ash.gradepro.org/profile/fnGuafOe504)
Tevens werd gebruik gemaakt van de evidence tabellen bij uitgangsvraag 11.4 van de richtlijn diagnostiek en behandeling van hemofilie (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/#62d0292c27bc6)
Overwegingen
Ad aanbeveling 1:
Een proefbehandeling met DDAVP maakt het mogelijk om de respons van een patiënt op DDAVP te bepalen. Indien er een goede respons wordt gemeten, dan kan een patiënt in het vervolg ook met DDAVP worden behandeld. De respons blijft hetzelfde over de tijd. Het advies is om eenmalig een DDAVP proefbehandeling te verrichten, met bepalingen van FVIII:C, VWF:Ag en VWF:Act voor, 1 en 4 uur na toediening. Bij patiënten met een snelle klaring (bijv type 1C), wordt na 1 uur een goede respons gezien, maar wordt na 4 uur alweer een daling gevonden van VWF:Act. Dit maakt DDAVP dan minder geschikt voor deze patiënt.
Ad aanbeveling 2:
De meeste patiënten met VWD kunnen goed worden behandeld met DDAVP, waardoor behandeling met VWF bevattende stollingsfactor concentraten niet nodig is. Soms moet gedurende langere tijd stollingscorrectie plaatsvinden, bijvoorbeeld bij een ernstige bloeding of een grote chirurgische ingreep. De hemostatische behandeling kan dan worden gestart met VWF(/factor VIII) concentraat, waarna de patiënt enkele dagen later, als lagere streefspiegels nodig zijn, kan worden uitbehandeld met DDAVP eenmaal daags. VWD patiënten bij wie de proefbehandeling een goede respons toont worden bij voorkeur behandeld met DDAVP. Dit is mede afhankelijk van het bloedingsrisico van de ingreep of de ernst en plaats van de bloeding en de mogelijkheid tot het veilig uitvoeren van een vochtrestictie.
Ad aanbeveling 3:
Patiënten die een grote chirurgische ingreep ondergaan waarbij een kleine bloeding al ernstige gevolgen kan hebben kunnen niet worden behandeld met DDAVP alleen. De voorkeur gaat bij deze patiënten uit naar initiële behandeling met VWF(/factor VIII) concentraat. Voorbeelden zijn een centraal zenuwstelsel ingreep of een intra-oculaire interventie.
Ad aanbeveling 4:
VWD type 2B is een aandoening die wordt gekenmerkt door een “gain of function” mutatie in het A1 domein van het VWF gen. Hierdoor ontstaat een verhoogde affiniteit tot de GPIb receptor op bloedplaatjes. Hierdoor bindt het afwijkende VWF molecuul aan bloedplaatjes in de bloedbaan wat kan leiden tot een trombocytopenie. Stijging van VWF, bijvoorbeeld door toediening van DDAVP kan een trombocytopenie verergeren of induceren. Daarom is bij patiënten met VWD type 2B DDAVP gecontra-indiceerd. DDAVP is bij patiënten met type 3 niet werkzaam omdat er geen VWF wordt aangemaakt en toediening dus ook niet kan leiden tot een toegenomen secretie van VWF.
Ad aanbeveling 5:
Omdat de respons op DDAVP sterk wisselend is voor individuen met VWD is het noodzakelijk om een testdosis te geven en de respons te bepalen. Voor VWD type 1 patiënten met VWF:Ag en/of VWF:Act <30 IE/dL en VWD type 2 patiënten bij wie geen DDAVP proefbehandeling is uitgevoerd is daarom het advies om geen DDAVP behandeling te geven. Behandeling zou dan kunnen bestaan uit VWF(/factor VIII) concentraat, waarmee zeker adequate spiegels kunnen worden bereikt.
Ad aanbeveling 6:
Zoals eerder aangegeven is de respons op DDAVP voor patiënten met VWD verschillend. Bij VWD type 1 patiënten met VWF:Ag en VWF:Act >30 IE/dL kan er van worden uitgegaan dat zij goed reageren op DDAVP. Meerdere studies tonen aan dat deze patiënten allen een complete respons hebben op DDAVP (VWF en factor VIII stijging naar >50 IE/dL). Daarom kunnen zij worden behandeld met DDAVP zonder voorafgaande proefbehandeling.
Toch kan de mate van respons op DDAVP ook in deze VWD patiënten categorie nog sterk verschillen (2 tot 6-voudig). Dit kan consequenties hebben voor een eventuele herhaalde toediening. Daarom wordt geadviseerd om bij VWD type 1 patiënten met VWF:Ag en VWF:Act >30 IE/dL die geen DDAVP proefbehandeling hebben ondergaan, voor en 1 uur na de eerste therapeutische toediening van DDAVP de VWF en factor VIII respons te bepalen.
Ad aanbeveling 7:
Bij herhaalde toediening van DDAVP neemt de stijging van VWF en factor VIII af na iedere volgende toediening (tachyfylaxie). De uitstoot van VWF en factor VIII uit het endotheel wordt minder. Daarom wordt geadviseerd om maximaal 3 dagen achtereen DDAVP te geven. Ook dient het effect dagelijks te worden geëvalueerd door bepaling van de VWF en factor VIII activiteit. Bij onvoldoende stijging van factor VIII en VWF kan dan alsnog VWF(/factor VIII) concentraat worden toegediend.
Hoe is de behandeling bij een bloeding bij de ziekte van Von Willebrand?
Aanbevelingen
Onderbouwing
Inleiding
De ziekte van von Willebrand is de meest voorkomende erfelijke hemostasestoornis en wordt gekenmerkt door een tekort aan werkzaam Von Willebrand Factor (VWF). VWF heeft een dubbele rol in het bloedstollingsproces. Enerzijds bevordert het de adhesie van bloedplaatjes, anderzijds dient het als dragereiwit voor stollingsfactor VIII. Bloedingen in de huid en slijmvliezen, ten gevolge van stoornissen in de bloedplaatjesadhesie, zijn het belangrijkste klinisch kenmerk bij patiënten met VWD. Meest voorkomende bloedingen zijn menorragie (85%), hematomen (77%), nabloeden uit kleine wondjes (77%) en mondbloedingen (62%). Bij de ernstige vorm van de ziekte van von Willebrand is de factor VIII concentratie zo sterk verlaagd, dat ook bloedingen in met name spieren (20%) en gewrichten (25%) kunnen optreden. Centraal zenuwstelsel bloedingen komen niet frequent voor (2%), gastro-intestinale bloedingen daarentegen weer vaker (15%) (de Wee, 2012). Het aantal bloedingen en de ernst ervan is dus afhankelijk van de ernst van de ziekte en kan sterk variëren per individu.
Behandeling van bloedingen gebeurt, afhankelijk van de restactiviteit van VWF, door stollingsfactor correctie. Er kan gebruik gemaakt worden van VWF(/factor VIII) concentraten (plasma-derived of recombinant), of van een synthetisch preparaat, DDAVP (1-deamino-8-D-arginine-vasopressine: Minrin, intraveneus; Octostim, neusspray/subcutaan), dat tijdelijk de plasmaconcentratie van VWF/factor VIII verhoogt door een release van VWF uit de endotheelcellen te bewerkstelligen. Daarnaast wordt gebruik gemaakt van antifibrinolytica (tranexaminezuur). Voor welke behandeling en preparaat gekozen wordt, is afhankelijk van de ernst van de bloeding, het type VWD en patiënt afhankelijke factoren (zoals respons op DDAVP en eventuele contra-indicaties). Ook is het van belang dat er, indien mogelijk, lokale hemostase wordt nagestreefd.
Onder kleine bloedingen worden bijvoorbeeld verstaan: beginnende hemartros, neus- en tandvleesbloedingen, milde hematurie en bloeding na gering trauma. Ernstige bloedingen zijn bijvoorbeeld: voortgeschreden of ernstige gewrichtsbloedingen, spierbloedingen in boven- en onderarmen, kuit en musculus iliopsoas en ernstige traumata zonder manifeste bloeding. Onder levensbedreigende bloedingen worden verstaan bijvoorbeeld: schedeltrauma, tractus digestivus bloedingen, buiktrauma en bloedingen met bedreiging van de luchtweg (NVHB, 2020).
Conclusies
|
SORT Grade |
Conclusie |
|
B |
Bloedingen in de huid en slijmvliezen zijn het belangrijkste klinische kenmerk bij patiënten met VWD. (de Wee, 2012) |
|
B |
Angiodysplasieën komen met name voor bij patiënten met VWD type 2 (2%) en VWD type 3 (4.5%). (Fressinaud, 1993) |
|
C |
Gebruik van stollingsfactorconcentraat met een ratio VWF:Act/factor VIII > 10, bij patiënten met een laag factor VIII gehalte, geeft pas een stijging van het endogene factor VIII na 6-8 uur. (Borel-Derlon, 2007; Mannucci, 2013) |
Samenvatting literatuur
Resultaten
Algemeen
Factor VIII is de belangrijkste speler in chirurgische en weefselbloedingen, plaatjes afhankelijk VWF activiteit lijkt de belangrijkste speler in mucosale bloedingen (Mannucci, 2019). Behandeling van bloedingen bij patiënten met VWD bestaat dan ook uit correctie van VWF en factor VIII. Er is weinig bekend over welke waarde van VWF kritisch is voor het stoppen van een mucosale of chirurgische bloeding. De data die de aanbevelingen voor deze uitgangsvraag ondersteunen komen voort uit klinische ervaring, consensus van expert opinion en observationele studies. Voor welke behandeling en preparaat gekozen wordt, de dosering en de duur van de behandeling is afhankelijk van de ernst en locatie van de bloeding, het VWD subtype, de VWF en factor VIII restactiviteit en specifieke patiënt karakteristieken.
Tranexaminezuur
Tranexaminezuur kan oraal en intraveneus toegediend worden. Bij kinderen is de dosering tranexaminezuur oraal 25-50 mg/kg per 24 uur, verdeeld over drie giften; intraveneus 25 mg/kg in 3xdd. Bij volwassenen is de dosering tranexaminezuur oraal 1g 3-4x per dag. Lokale tranexaminezuur kan toepast worden in de vorm van mondspoeling 5%: 4x/dag 2 minuten spoelen met 10ml of bijten op een gaasje gedrenkt in tranexaminezuur.
Desmopressine
DDAVP kan intraveneus (Minrin®) of subcutaan (Octostim®) toegediend worden in een dosering van 0,3 mcg/kg of als neusspray (Octostim® spray 150 microgram/dosis, 1 puff in ieder neusgat bij volwassenen en kinderen > 40 kg en 1 puff in een neusgat bij kinderen tussen de 20-40 kg als de streefspiegels daarmee gehaald worden en er geen contra-indicaties voor DDAVP zijn. Houd hierbij rekening met de tachyfylaxie van DDAVP (Mannucci, 1992).
Stollingsfactorconcentraten
Er zijn 3 groepen stollingsfactorconcentraten te onderscheiden op basis van de verhouding VWF en factor VIII:
Omdat de factor VIII productie en secretie normaal is in patiënten met VWD kan infusie van exogeen VWF, leidend tot stabilisatie en stijging van endogeen factor VIII, samen met exogeen factor VIII leiden tot ongewenst hoge factor VIII spiegels. Gebruik van stollingsfactorconcentraat met een ratio VWF/factor VIII > 10, bij patiënten met een laag factor VIII gehalte, geeft pas een stijging van het endogene factor VIII na 6-8 uur (Borel-Derlon, 2007; Mannucci, 2013). In het geval van een bloeding dient daarom bij deze patiënten gelijktijdig factor VIII toegediend te worden. Daarnaast dient rekening gehouden te worden met de half waarde tijd van de verschillende producten en de ampulgrootte (in het geval van behandeling van jonge kinderen).
Naast het verschil in VWF/factor VIII ratio verschilt ook de in vivo recovery tussen verschillende stollingsfactorconcentraten (Kessler, 2011).
Streefspiegels VWF en factor VIII bij bloedingen
Er zijn geen gerandomiseerde studies naar de effectiviteit en veiligheid van verschillende doseringen en streefspiegels van VWF en/of factor VIII voor de behandeling van bloedingen. Het huidige advies is gebaseerd op enkele prospectieve studies en retrospectieve case series van VWD patiënten die behandeld werden voor bloedingen met VWF(/factor VIII) concentraat omdat ze niet (voldoende) responsief waren op DDAVP of er een contra-indicatie voor hadden. Daarnaast is er gebruik gemaakt van verschillende consensus richtlijnen en de bijbehorende literatuurlijsten (Nichols, 2008; NVHB, 2009; Lassila, 2011; Laffan, 2014; Connell, 2021) en enkele overzichtsartikelen (Mannucci, 2004; Leebeek, 2016).
Prospectieve studies
Mannucci et al. (Mannucci, 2002) omschreven een prospectieve multicenter studie waarin 81 VWD patiënten werden geïncludeerd. Er werden 87 bloedingen behandeld in 14 VWD patiënten (3 VWD type 1, 7 VWD type 2, 4 VWD type 3) met het VWF/factor VIII concentraat Alphanate (VWF/factor VIII ratio 1.6). Van de bloedingen waren er 73% gastro-intestinaal, 15% nasofaryngeaal, 9% muskuloskeletaal en 4% urogenitaal. In het vooraf opgestelde behandelprotocol werd een oplaaddosis gegeven van 40 IE/kg (50 IE/kg in pediatrische patiënten) VWF, met als streefspiegel een VWF van 100 IE/dL. Vervolgdoseringen werden niet gestandaardiseerd. Alle bloedingen kwamen onder controle met deze behandeling. Er was sprake van frequentere en hogere vervolgdoseringen in patiënten met VWD type 3 in vergelijking met patiënten met VWD type 2A of VWD type 1 (aantal doseringen: 3 vs. 1 vs. 1; dosering per infusie 60 vs. 40 vs. 50 IE/kg).
Gill et al. (Gill, 2003) voerden een prospectieve studie uit waarbij 33 VWD patiënten (27% VWD type 1, 24% VWD type 2, 36% VWD type 3 en 12% niet geclassificeerd), behandeld werden met Haemate-P voor 53 ernstige bloedingen. Het behandelprotocol was als volgt: een oplaaddosis van 60-80 IE/kg VWF gevolgd door een onderhoudsdosering van 40-60 IE/kg iedere 8-12 uur voor 3 dagen, eventueel gevolgd door een dagelijkse dosering van 40-60 IE/kg voor een totaal van 7 dagen. In de eerste 3 dagen was de streef VWF > 50 IE/dL. De gemiddelde oplaaddosis was 67 IE/kg, de gemiddelde onderhoudsdosering was 74 IE/kg/dag met een gemiddeld aantal infusies van 2 en een gemiddelde behandelduur van 3 dagen.
Borel-Derlon et al. (Borel-Derlon, 2007) rapporteerden een serie van 50 patiënten vanuit een prospectieve Europese en een prospectieve Franse studie die behandeld werden met Wilfactin (VWF/factor VIII ratio > 10). In 26 patiënten (waarvan 58% VWD type 3) werden 139 bloedingen behandeld. Hiervan was 32% musculoskeletaal, 38% oraal-nasofaryngeaal, 21% urogenitaal en 8% gastro-intestinaal. In de Franse studie werd er een oplaaddosis gegeven van 50 IE/kg en werd er gelijktijdig een oplaaddosis factor VIII van 30-40 IE/kg geadviseerd in patiënten met een ernstige bloeding en patiënten die een eigen factor VIII gehalte < 20 IE/dL hadden. Nadien werd er iedere 12-24 uur een dosering van 30-50 IE/kg gegeven zolang klinisch noodzakelijk was. In de Europese studie werd een oplaaddosis van 60 IE/kg gegeven. Bij spier- of gewrichtsbloedingen werd daarnaast een factor VIII concentraat geadviseerd met een streefspiegel van 80 IE/dL factor VIII. Als vervolg dosering werden 2 dagelijkse infusies van 60 IE/kg geadviseerd voor 48 uur, gevolgd door dagelijkse of om de dag toedieningen met een VWF en factor VIII streefspiegel van 30 IE/kg, zolang klinisch noodzakelijk was. De gemiddelde dosering Wilfactin was 42 IE/kg met gemiddeld 3 infusies verdeeld over 3 dagen. In 38% van de bloedingen werd tranexaminezuur voorgeschreven. Opvallend was dat 13 van de 18 ernstige bloedingen (opname noodzakelijk) ontstonden bij patiënten met een factor VIII gehalte < 20 IE/dL. Slechts de helft van deze patiënten kreeg de geadviseerde factor VIII bolus toegediend. Ook in 47% van de patiënten met een niet ernstige bloeding en een eigen factor VIII < 20% werd geen extra factor VIII concentraat toegediend. Toch werd in > 87% van deze patiënten een ‘goede’ tot ‘excellente’ klinische response op de behandeling beschreven.
Berntorp et al. (Berntorp, 2009) beschreven de effectiviteit van het VWF/factor VIII concentraat Wilate (VWF/factor VIII ratio 1) in 44 patiënten met VWD (55% met VWD type 3). Het behandelprotocol voor bloedingen bestond uit een oplaaddosis van 20-50 IE/kg. De daadwerkelijke dosering en duur van behandeling werd overgelaten aan de behandelaar. In totaal werden 1095 spontane of post-traumatische bloedingen behandeld (565 gewrichtsbloedingen, 94 epistaxis, 145 gastro-intestinale bloedingen, 34 mondbloedingen, 62 menorragie, 195 overige bloedingen). Hiervan trad 92% op in patiënten met VWD type 3. Er was een gemiddelde dosering van 29 IE/kg/dag nodig en gemiddeld 1.9 behandeldagen om de bloeding te stoppen. Opvallend was dat voor het behandelen van gastro-intestinale bloedingen meer Wilate werd gegeven (gemiddeld 44 IE/kg/dag) en dat de behandeling langer duurde (gemiddeld 4 dagen). In 96% van de bloedingen was er sprake van een ‘goede’ tot ‘ excellente’ klinische response op de behandeling.
Dunkley et al. 2010 (Dunkley, 2010) beschreven een kleine prospectieve studie van 23 VWD patiënten (7 VWD type 1, 9 VWD type 2, 7 VWD type 3) waarbij 5 patiënten werden behandeld voor 9 niet-chirurgische bloedingen (5 mucosale bloedingen en 4 niet mucosale bloedingen). Patiënten werden behandeld met een VWF/factor VIII concentraat (ratio > 1), volgens het volgende behandelprotocol: voor kleine bloedingen 1 tot 2 doses VWF van 40-50 IE/kg voor alle patiënten. Voor grote bloedingen bij patiënten met VWD type 1 werd een oplaaddosis van 40 IE/kg geadviseerd, gevolgd door 40-50 IE/kg iedere 8-12 uur met een VWF streefspiegel van 50 IE/dL voor 3 dagen, gevolgd door 40-50 IE/kg dagelijks voor een totaal van 7 dagen. Bij patiënten met VWD type 2 en 3 werd bij grote bloedingen een oplaaddosis van 50-60 IE/kg geadviseerd, gevolg door 40-60 IE/kg iedere 8-12 uur met een VWF streefspiegel van 50 IE/dL voor 3 dagen, gevolgd door 40-60 IE/kg dagelijks voor een totaal van 7 dagen. De gemiddelde dagelijkse dosering was 27 IE/kg factor VIII, met gemiddeld 2 infusies en een gemiddeld behandelduur van 2 dagen. De klinische effectiviteit van de behandeling werd beoordeeld als ‘goed’ tot ‘excellent’.
Nowak-Göttl et al. (Nowak-Göttl, 2013) rapporteerde het effect van Wilate in 15 kinderen < 6 jaar met VWD (5 VWD type 1, 4 VWD type 2, 6 VWD type 3). Het behandeladvies voor spontane en traumatische bloedingen was 20-50 IE/kg. In totaal werden 68 bloedingen (46 kleine, 18 milde en 8 ernstige bloedingen) behandeld in 11 patiënten. In 82% van de bloedingen was 1 dag behandeling voldoende. Kleine bloedingen werden behandeld met een gemiddelde dosering van 30 IE/kg, milde bloedingen met een gemiddelde dosering van 38 IE/kg en ernstige bloedingen met een gemiddelde dosering van 70 IE/kg. De klinische effectiviteit van de behandeling werd in alle bloedingen beoordeeld als ‘goed’ tot ‘excellent’.
Retrospectieve case series
Lillicrap et al. (Lillicrap, 2002) rapporteerden een serie van 97 VWD patiënten, die tussen 1991 en 1996 werden behandeld voor in totaal 344 bloedingen (32 bloedingen in patiënten met VWD type 1, 17 bloedingen in VWD type 2A, 60 bloedingen in VWD type 2B, 208 bloedingen in VWD type 3 en 27 bloedingen in ‘overige’). Ze werden behandeld met VWF/factor VIII concentraat Haemate-P (VWF/factor VIII ratio > 1). De gemiddelde dosering voor het behandelen van een bloeding in de gehele groep was 55 IE/kg. Voor patiënten met VWD type 1, 2B en 3 was dit 45-55 IE/kg en waren er 1,5-3 infusies nodig. Voor patiënten met type 2A was dit 70 IE/kg met gemiddeld 1,5 infusies. Ongeveer 35% van de patiënten hadden extra behandeling nodig na de 1e behandeldag. In 93-100% van de bloedingen was er sprake van een ‘goed’ tot ‘uitstekend’ klinisch resultaat van de behandeling.
Federici et al. (Federici, 2007) beschreef een serie van 100 VWD patiënten die behandeld werden met Haemate-P. Hiervan hadden 23 patiënten VWD type 1, 40 patiënten VWD type 2 en 37 patiënten VWD type 3. Er werden 59 patiënten (54% VWD type 3 waarvan 80% VWF < 10 IE/dL) behandeld voor in totaal 280 bloedingen (5 tandvlees, 17 menorragie, 48 hemartrose, 13 hematomen, 81 gastro-intestinaal, 22 post-traumatisch, 70 epistaxis, 18 multipele, 6 overige). Er werden geen streefspiegels benoemd. De gemiddelde dosering Haemate-P, op basis van VWF- act, was 72 IE/kg/dag. In deze groep waren 11 patiënten met een ernstige bloedingsfenotype, deze patiënten waren verantwoordelijk voor 64% van de bloedingen en 72% van het product gebruik, met een gemiddeld gebruik van 101 IE/kg/dag. Voor de behandeling van gastro-intestinale bloedingen en hemartrose werd het meeste Haemate-P gebruikt (42% resp. 21% van de totale hoeveelheid). In 95% van de patiënten was er sprake van een ‘goede’ of ‘excellente’ klinische response op de behandeling.
Federici et al. (Federici, 2010) bekeken in 2010 ook nog een groep van 120 VWD patiënten die tussen 2002 en 2006 behandeld werden met het VWF/factor VIII concentraat Alphanate of Fanhdi (VWF/factor VIII ratio 1.6). Er werden 55 patiënten (22 VWD type 1, 36 VWD type 2, 7 VWD type 3) behandeld voor 114 bloedingen. De meest voorkomende bloedingen waren hematomen (24%), epistaxis (19%) en gastro-intestinale bloedingen (17%). Er werden geen streefspiegels geadviseerd. Wel werd verwezen naar de ACIE richtlijn van de Italian Association of Hemophilia Centers uit 2002 (Federici, 2002). In deze richtlijn wordt een enkele dosis VWF(/factor VIII) concentraat van 20 IE/kg geadviseerd bij spontane of post-traumatische bloedingen met een factor VIII streefspiegel > 30 IE/dL. De gemiddelde dosering, op basis van VWF, was 40 IE/kg/dag. In 97% van de bloedingen was er sprake van een ‘goede’ tot ‘ excellente’ klinische response op de behandeling.
Khair et al. (Khair, 2015) onderzochten het gebruik van Wilate (VWF/factor VIII ratio 1) in 47 kinderen met VWD. Er werden 44 bloedingen beschreven in 15 kinderen (7 VWD type 1, 2 VWD type 2, 6 VWD type 3). De geadviseerde dosering Wilate voor de behandeling van bloedingen was 20-50 IE/kg. Van de 29 kleine bloedingen (epistaxis, menorragie, gewrichtsbloeding) was er in 86% sprake van een ‘excellente’ klinische response op een enkele dosis Wilate van gemiddeld 58 IE/kg. De 15 grote bloedingen (menorragie en intra-abdominaal) werden behandeld met een gemiddelde oplaaddosis van 51 IE/kg, waarna in 93% ten minste 1 vervolg dosering nodig was.
Overzichtsartikelen
In een review van Michiels et al. (Michiels, 2007) werd het volgende behandelprotocol beschreven: bij een ernstige bloeding: een oplaaddosis van 60-80 IE/kg VWF, gevolgd door 40 IE/kg iedere 12 uur gevolgd door 30 IE/kg iedere 24 uur met als streefspiegel een VWF > 60 IE/dL voor 4-7 dagen. Voor een mucocutane bloeding eenmalig 40-60 IE/kg VWF om een adequate VWF activiteit te krijgen > 12 uur. Voor een musculoskeletale bloeding bij patiënten met VWD type 3: een oplaaddosis van 60 IE/kg VWF gevolgd door 40-60 IE/kg/dag voor 3 dagen, om factor VIII en VWF act> 40 IE/dl te houden voor enkele dagen.
In 2004 verscheen een overzichtsartikel van Mannucci et al. (Mannucci, 2004) met het volgende behandeladvies voor spontane bloedingen bij patiënten met ernstige VWD (VWF < 10IE/dL): een dosering van 25 IE/kg (+20% bij kinderen) met als streefspiegel een factor VIII level > 30 IE/dL, totdat de bloeding stopt (meestal 2-4 dagen).
In twee overzichtsartikelen van Leebeek et al. (Leebeek, 2016; Leebeek, 2019) wordt voor kleine tot milde bloedingen een oplaaddosis van 20-40 IE/kg VWF geadviseerd met een streef VWF piekspiegel > 50-80 IE/dL op dag 1, gevolgd door een VWF dalspiegel > 30 IE/dL voor 1-3 dagen. Bij een ernstige bloeding wordt een oplaaddosis van 50 IE/kg VWF geadviseerd met een streef VWF piekspiegel > 100 IE/dL op dag 1, gevolgd een VWF dalspiegel van > 50 IE/dL voor 3-10 dagen.
In een overzichtsartikel van Lavin en Donell (Lavin, 2016) wordt bij kleine bloedingen een VWF streefspiegel > 30 IE/dL geadviseerd door middel van DDAVP of VWF concentraten met of zonder tranexaminezuur. Bij grote bloedingen wordt een VWF streefspiegel van ≈ 100 IE/dL geadviseerd door middel van VWF concentraten in combinatie met tranexaminezuur. Bij een persisterende bloeding kan een trombocytenconcentraat gegeven worden.
Castaman (Castaman, 2020) adviseert een enkele of dagelijkse dosis voor 2-3 dagen (afhankelijk van de ernst van de bloeding) van 20-60 IE/kg VWF voor spontane bloedingen in patiënten met een VWF < 10 IE/dL.
Adviezen in consensus richtlijnen
De recent gepubliceerde ASH ISTH NHF WHF 2021 VWD richtlijn (Connell, 2021) doet geen uitspraken over de behandeling van bloedingen bij de ziekte van von Willebrand.
In de Britse VWD richtlijn geschreven door de UKHCDO in 2014 (Laffan, 2014) en gebaseerd op literatuur vanaf 2002, wordt geadviseerd om kleine bloedingen te behandelen met DDAVP en tranexaminezuur. Als de patiënt niet responsief is op DDAVP of in geval van een acute of ernstige bloeding moet behandeld worden met VWF(/factor VIII) concentraat of een combinatie van een puur VWF en een puur factor VIII product. Er worden geen streefspiegels geadviseerd.
De VWD richtlijn van de Nordic Haemophilia Council (Lassila, 2011) adviseert bij mucosale bloedingen in patiënten met milde von Willebrand ziekte, oraal of lokaal tranexaminezuur. Als dat niet voldoende is, of als er sprake is van een ernstige bloeding, wordt behandeling met eenmalig DDAVP of een VWF(/factor VIII) concentraat geadviseerd, gedoseerd op basis van de VWF restactiviteit. Bij patiënten met een lage VWF wordt een dosering van 50 IE/kg VWF geadviseerd. Er worden geen streefspiegels gegeven.
In de Nederlandse richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de NVHB uit 2009 (NVHB, 2009) worden het volgende behandelprotocol beschreven: bij milde mucosale bloedingen (epistaxis/tandvlees) een oplaaddosis Haemate-P van 20 IE/kg factor VIII, meestal eenmalig. Bij spontane of traumatische bloedingen een oplaaddosis Haemate-P van 20-40 IE/kg factor VIII, meestal eenmalig. Daarnaast wordt in de richtlijn tranexaminezuur aanbevolen bij bloedingen in weefsels met een hoge fibrinolytische activiteit, zoals de slijmvliezen. Tranexaminezuur is onvoldoende effectief bij spier- of gewrichtsbloedingen. Er worden de volgende aanbevelingen gedaan: (I) tranexaminezuur is vaak afdoende bij mucosale bloedingen of kan anders gecombineerd worden met DDAVP of VWF(/factor VIII) concentraat. (II) Tranexaminezuur is effectief bij menorragie. (III) Tranexaminezuur is gecontra-indiceerd bij hematurie in verband met risico op kolieken en obstructie. Ook wordt er geadviseerd om extreem hoge factor VIII spiegels (> 200 IE/dL) te vermijden in verband met het risico op trombose.
De Amerikaanse VWD richtlijn van het ‘National Heart, Lung, and Blood Institute (NHLBI)’ gepubliceerd in 2008 (Nichols, 2008) adviseert de volgende behandeling en streefspiegels op basis van gepubliceerde case series en consensus expert opinie: voor grote bloedingen een oplaaddosis VWF concentraat van 40-60 IE/kg, met een streefspiegel VWF en factor VIII > 100 IE/dl, gevolgd door een onderhoudsdosering iedere 8-24 uur van 20-40 IE/kg, met een VWF / factor VIII streefspiegel van > 50 IE/dL voor ten minste 7-10 dagen. Voor kleine bloedingen wordt een oplaaddosis van 30-60 IE/kg, gevolgd door een onderhoudsdosering iedere 8-24 uur geadviseerd, met een VWF / factor VIII van > 50 IE/dL voor ten minste 1-5 dagen geadviseerd. Daarnaast wordt geadviseerd om factor VIII niet boven 250-300 IE/dL en VWF niet boven 200 IE/dL te laten stijgen in verband met het risico op trombose (Makris, 2002; Mannucci, 2002).
Adviezen voor specifieke bloedingen
In een aantal richtlijnen en artikelen wordt aandacht besteed aan maatregelen bij specifieke bloedingen. Deze staan hieronder weergegeven.
Mucosale bloedingen
De VWD richtlijn van de Nordic Haemophilia Council (Lassila, 2011) adviseert voor mucosale bloedingen in patiënten met milde von Willebrand ziekte, oraal of lokaal tranexaminezuur. Als dat niet voldoende is, of als er sprake is van een ernstige bloeding, wordt behandeling met eenmalig DDAVP of een VWF(/factor VIII) concentraat geadviseerd. In de Nederlandse richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de NVHB uit 2009 (NVHB, 2009) worden ook de volgende aan de volgende aanbevelingen gedaan ten aanzien van de behandeling van mucosale bloedingen: tranexaminezuur is vaak afdoende bij mucosale bloedingen of kan anders gecombineerd worden met DDAVP of VWF(/factor VIII) concentraat; tranexaminezuur is effectief bij menorragie; tranexaminezuur is gecontra-indiceerd bij hematurie in verband met risico op kolieken en obstructie.
Hematurie
De adviezen rondom de behandeling van hematurie bij patiënten met de ziekte van von Willebrand zijn gelijk aan de adviezen die gegeven worden bij de behandeling van hematurie bij patiënten met hemofilie (NVHB, 2020). DDAVP is gecontra-indiceerd bij hematurie vanwege het advies om bij hematurie geen vochtrestrictie aan te houden maar juist een krachtig hydratie na te streven. Gelijktijdig gebruik van DDAVP kan leiden tot een ernstige hyponatriëmie (De la Corte-Rodriguez, 2020). Antifibrinolytica bij bloedingen uit de bovenste urinewegen mogen niet toegepast worden in verband met de kans op retentie van stolsels in de ureteren en urineblaas (Mannucci, 1998) hetgeen kan resulteren in mogelijke urinewegobstructie (Pitts, 1986).
Gastro-intestinale bloedingen
Gastro-intestinale bloedingen bij patiënten met de VWD kunnen verschillende oorzaken hebben. Een belangrijke oorzaak van gastro-intestinale bloedingen is het ontstaan van angiodysplasieën ten gevolge van dysfunctionele primaire hemostase, met name bij patiënten van middelbare en oudere leeftijd (prevalentie 1,1-6,5%, bij leeftijd > 50 jaar tot 10%) (Lassila, 2011). In een internationale survey onder 4503 VWD patiënten werden angiodysplasieën met name gerapporteerd bij patiënten met VWD type 2 (2%) en VWD type 3 (4.5%), bij oudere patiënten met VWD type 2 en 3 zou dit percentage zelfs oplopen tot 11.5% (Fressinaud, 1993). Een van de hypothesen voor het ontstaan van angiodysplasieën in deze VWD patiënten is dat de afwezigheid van met name de hoge moleculair gewicht VWF multimeren, via een negatieve modulatie van VEGFR-2, leidt tot verhoogde endotheel cel proliferatie en neovascularisatie (Starke, 2011). In een overzichtsartikel van Franchini et al. (Franchini, 2014) wordt een overzicht gegeven van de verschillende behandelopties. Voor behandeling van acute bloedingen wordt VWF(/factor VIII) concentraat (40-60 IE/dag) in combinatie met tranexaminezuur geadviseerd, maar ook zijn lokale invasieve behandelingen zoals endoscopische thermocoagulatie en operatief ingrijpen soms noodzakelijk. Ook behandeling met recombinant FVIIa (Meijer, 2001) en trombocytenconcentraat (Castillo, 1991) is beschreven. Opvallend is dat er gemiddeld meer VWF(/factor VIII) concentraat nodig is voor de behandeling van gastro-intestinale bloedingen dan voor andere acute bloedingen (Federici, 2007; Berntorp, 2009). Secundaire profylaxe is soms noodzakelijk om recidiverende gastro-intestinale bloedingen te voorkomen, maar ook dit lijkt minder effectief dan bij bijvoorbeeld recidiverende gewrichtsbloedingen. Een dosering VWF van 40-60 IE/kg, 2-3x per week leidde in een studie van Abshire et al. (Abshire, 2013) tot een daling van de jaarlijkse annual gastro-intestinal bleeding rate van 8,4 naar 6, ten opzichte van een daling van 15,6 naar 1,3 bij gewrichtsbloedingen. Een suggestie die gegeven wordt in de literatuur is het geven van Vonicog alfa, een puur recombinant VWF product, bij behandeling van gastro-intestinale bloedingen, omdat dit middel ultra grote VWF multimeren bevat (Leebeek, 2017; Mannucci, 2019). Enkele case reports beschrijven succesvolle behandeling van patiënten met de angiogenese remmer thalidomide (50-100mg per dag) of atorvastatine (tot 80 mg per dag) (Nomikou, 2009; Alikhan, 2010). In 2014 werd ook een retrospectieve studie gepubliceerd waarin gekeken werd naar het natuurlijk beloop van angiodysplasieën in VWD. Patiënten met congenitale VWD werden geïncludeerd als ze tenminste één episode van gastro-intestinaal bloedverlies hadden waarbij er geen duidelijke oorzaak te vinden was, of wanneer dit te gevolge van angiodysplasieën was. Er werden 48 patiënten geïncludeerd, waarvan 37,5% patiënten met VWD type 3, 22,9% patiënten met VWD type 2A maar ook 18,7% met VWD type 1. Acute bloedingen werden in 95% van de patiënten succesvol behandeld. Profylaxe was in 85% van de patiënten effectief in het voorkomen van recidieven. Thalidomide was niet succesvol in de 5 patiënten waarin dit werd voorgeschreven.
Platelet type VWD
Bij platelet type VWD is er sprake van een afwijkend GPIb op de bloedplaatjes, waardoor er verhoogde affiniteit voor VWF ontstaat. Door deze spontane binding aan GPIb is er bij platelet type VWD vaak een trombopenie, die nog verder kan toenemen bij het geven van DDAVP of VWF/factor VIII concentraat. In 2020 publiceerde de Platelet Physiology Subcommittee van de ISTH een richtlijn voor de diagnostiek en management van platelet type VWD (Othman, 2020). Voor de behandeling van een grote bloeding wordt VWF concentraat in combinatie met 1 HLA gematched trombocytenconcentraat geadviseerd. Als er sprake is van een refractaire bloeding kan recombinant factor VII overwogen worden in een dosering van 90 microgram/kg, iedere 2 uur indien nodig. Kleine bloedingen kunnen behandeld worden met tranexaminezuur 10-30 mg/kg iedere 8 uur, en eventueel DDAVP, als hier geen contra-indicaties voor zijn en het niet leidt tot toename van de trombopenie.
Tromboserisico
In meerdere richtlijnen wordt geadviseerd om extreem hoge factor VIII spiegels te vermijden (> 150-300 IE/dL). In de studie van Koster et al. (Koster, 1995) bleek een factor VIII waarde > 150 IE/dL een onafhankelijke risicofactor te zijn voor het ontwikkelen van een diep veneuze trombose met een odds ratio (OR) van 4,8 (95%CI: 2,3-10,0). Een systematische review uit 2012 (Coppola, 2012) bekeek trombotische complicaties gerelateerd aan factor substitutie in patiënten met hemofilie en VWD in prospectieve studies over een periode van 20 jaar, en het bleek dat tromboembolische complicaties zeldzaam waren en voornamelijk oppervlakkige tromboflebitis betroffen.
Referenties
Bewijskracht literatuur
Level 2-3, consistent
Zoeken en selecteren
Er werd voor de algemene uitgangsvraag geen systematisch literatuuronderzoek verricht. Er werd voor deze uitgangsvraag gebruik gemaakt van de in 2021 door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn en de bijbehorende referentielijst; de Britse richtlijn voor diagnostiek en management van VWD van de United Kindom Haemophilia Centre Doctors Organisation (UKHCDO) uit 2014; de Nordic Haemophilia Council’s guideline uit 2011; de richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de Nederland Vereniging van Hemofiliebehandelaars (NVHB) uit 2009 en de VWD richtlijn van de Amerikaanse National Heart, Lung, and Blood Institute (NHLBI) uit 2008.
Voor advies rondom specifieke bloedingen werd het volgende systemische literatuuronderzoek verricht:
Gastro-intestinale bloedingen
Er werd voor deze vraag een systematische review verricht met de volgende zoektermen: “willebrand” and “angiodysplasia” not “acquired” . Dit resulteerde in 104 publicaties. Na titel en abstract screening resulteerde dat in 28 relevante publicaties, waaronder veel case reports en reviews.
Zoekverantwoording
De zoekverantwoording is opgenomen in diverse richtlijnen en bijbehorende (online) supplementen (Nichols, 2008; NVHB, 2009; Lassila, 2011; Laffan, 2014; Connell, 2021)
Evidence tabellen
De evidence tabellen van de gebruikte richtlijnen zijn weergegeven in het EtD raamwerk van de ASH ISTH NHF WFH richtlijn (Connell, 2021), online beschikbaar; op de website van de British Committee for Standards in Haematology (Laffan, 2014); op de website van de Nordic Haemophilia Counsil (Lassila, 2011); op de website van de NHLBI richtlijn (Nichols, 2008).
De in de studies gerapporteerde streefspiegels voor VWF en factor VIII bij de behandeling van een bloeding bij VWD zijn weergegeven in de tabellen 5.1 (geen onderscheid in grote/kleine bloedingen), 5.2 (grote bloedingen) en 5.3 (kleine bloedingen).
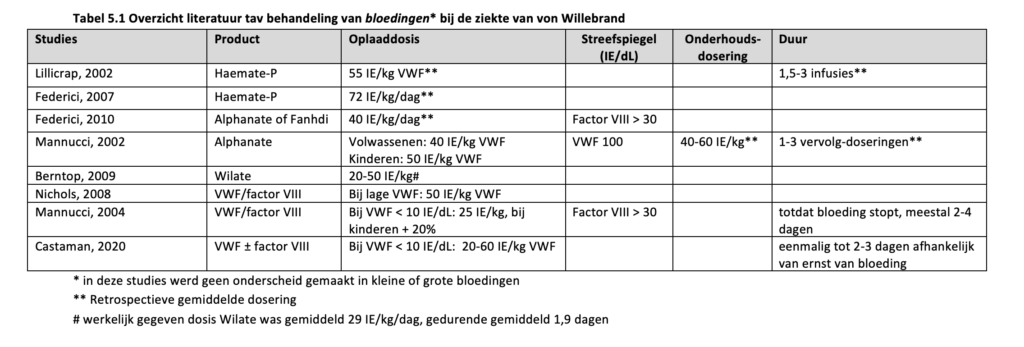
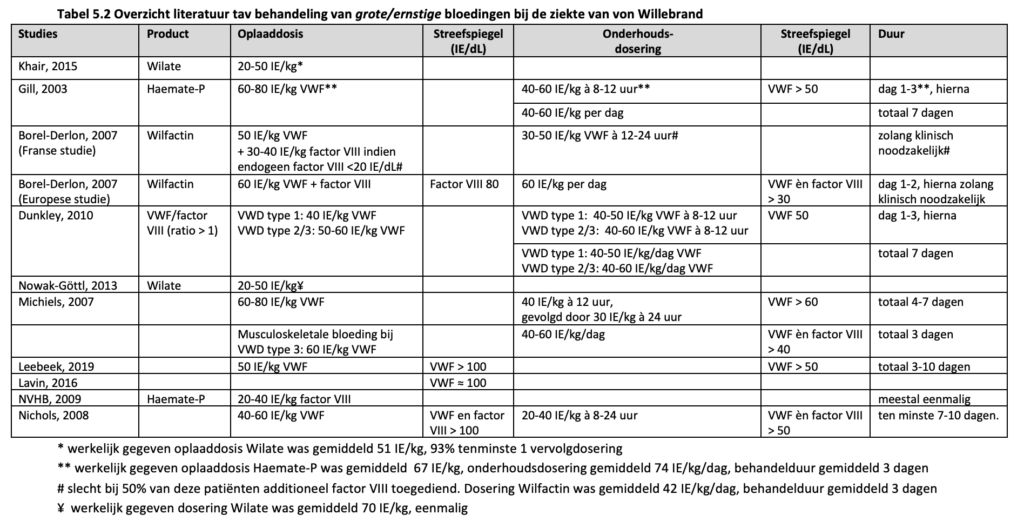
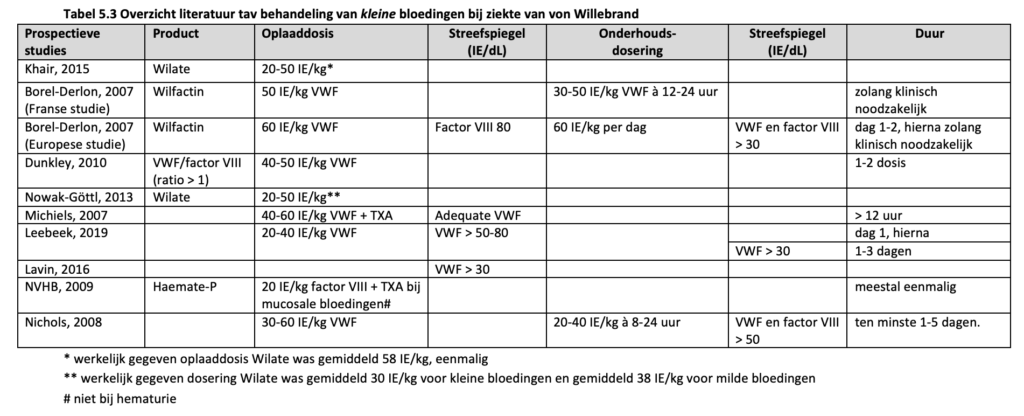
Overwegingen
Streefspiegels VWF en factor VIII bij bloedingen
Er is veel variatie in de behandeling van bloedingen en de streefspiegels voor VWF en factor VIII in studies, reviews en richtlijnen. In de verschillende consensus richtlijnen wordt een onderscheidt gemaakt in grote en kleine bloedingen. Daarnaast worden er ook adviezen gegeven voor specifieke bloedingen. Over het algemeen wordt een bloeding behandeld door het geven van een oplaaddosis VWF(/factor VIII) concentraat. De dosering hiervan varieert bij kleine bloedingen tussen de 20-60 IE/kg VWF/factor VIII, bij grote bloedingen varieert deze dosering tussen de 20-70 IE/kg VWF/factor VIII, waarbij er meestal gekozen wordt voor een dosering van ongeveer 50 IE/kg. Ook het beleid rondom vervolgdoseringen is variabel. Bij kleine bloedingen wisselt dit van een eenmalige dosis tot 5 dagen behandeling en bij grote bloedingen varieert dit van 3 tot 7 dagen behandeling, afhankelijk van het klinisch beloop. De gerapporteerde streefspiegels VWF en factor VIII bij de behandeling van een bloeding variëren voor kleine bloedingen tussen > 30-80 IE/dL VWF en/of factor VIII na de oplaaddosis, tot > 30-50 IE/dL voor de dagen daarna. Voor grote bloedingen is dit > 80-100 IE/dL VWF en/of factor VIII na de oplaaddosis en > 30-50 IE/dL voor de dagen daarna (tabellen 5.1-5.3). In de studies werd de klinische effectiviteit van deze behandelingen voor het overgrote deel beoordeeld als ‘goed’ tot ‘excellent’.
Omdat het geven van een ‘oplaaddosis’ afhankelijk is van de nog aanwezige eigen restactiviteit VWF en factor VIII en het concentraat dat gegeven wordt, heeft het de voorkeur dat op basis van de restactiviteit van VWF en factor VIII van de patiënt berekend wordt hoeveel stollingsfactorconcentraat nodig is om een bepaalde streefwaarde te bereiken. De hoeveelheid stollingsfactorconcentraat kan berekend worden op basis van zowel de VWF concentratie en de factor VIII concentratie. Hierbij kan gebruik gemaakt worden van de onderstaande berekeningen.
Doordat de diverse VWF/factor VIII concentraten een verschillende verhouding VWF en factor VIII bevatten, dient er bij het doseren rekening te worden gehouden met wat de te verwachten stijging van zowel VWF activiteit als factor VIIII activiteit zal zijn op basis van de toegediende aantal eenheden per factor. Daarnaast dient men zich goed te realiseren dat het gebruik van een stollingsfactorconcentraat met een ratio VWF/factor VIII > 10, bij patiënten met een laag factor VIII gehalte, pas een stijging van het endogene factor VIII geeft na 6-8 uur. In het geval van een bloeding dient daarom bij deze patiënten gelijktijdig factor VIII toegediend te worden.
Adviezen voor specifieke bloedingen
Bij mucosale bloedingen kan in het geval van een milde bloeding of bij patiënten met milde VWD in eerste instantie behandeling met alleen tranexaminezuur overwogen worden. Er zijn geen studies die gerandomiseerd uitgezocht hebben, maar dit is in overeenkomst met de aanbeveling om alleen tranexaminezuur te geven bij patiënten met type 1 VWD met spiegels > 30IE/dL en een mild bloedingsfenotype die kleine mucosale ingrepen moeten ondergaan (Walsh, 1971; Forbes, 1972).
Bij hematurie is tranexaminezuur gecontra-indiceerd, net als DDAVP in verband met het risico op ernstige hyponatriëmie (De la Corte-Rodriguez, 2020) en de kans op retentie van stolsels in de ureteren en urineblaas met het risico op urinewegobstructie (Mannuci, 1998, Pitts, 1986). Gastro-intestinaal bloedverlies uit angiodysplasieën lijkt met name voor te komen bij patiënten met VWD type 2 en 3, maar komt ook voor bij VWD type 1. Hoewel behandeling van een acute bloeding met VWF/factor VIII concentraat en tranexaminezuur in de meeste patiënten werkt, is deze behandeling minder effectief dan bij andere acute bloedingen. Om recidiverende gastro-intestinale bloedingen te voorkomen is het soms noodzakelijk om profylaxe te starten. Ook hier is het effect kleiner dan het effect van profylaxe op bijvoorbeeld recidiverende gewrichtsbloedingen. Mogelijk dat het gebruik van een puur recombinant VWF product, waarbij de ultra grote VWD multimeren aanwezig zijn, effectiever is in de behandeling van acute bloedingen en het voorkomen van recidieven. Andere behandelopties zoals thalidomide of atorvastatine zijn beschreven, met wisselende resultaten.
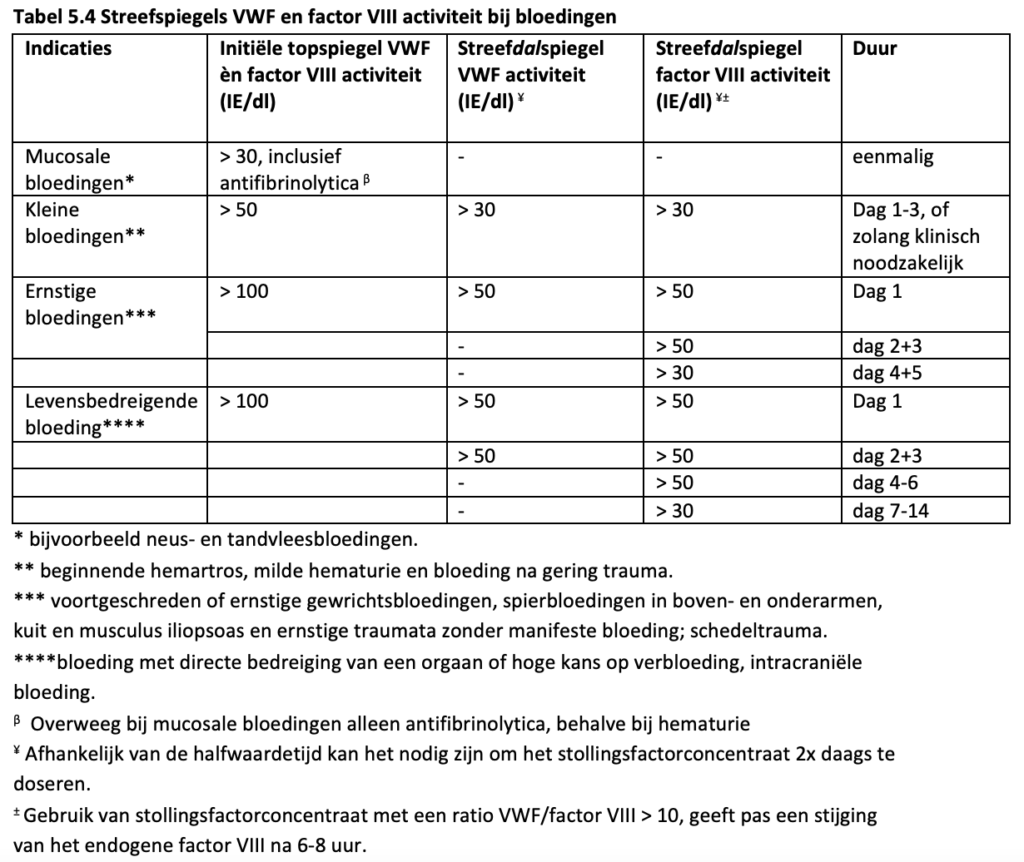
Hoe is de behandeling rondom een ingreep of operatie?
Aanbevelingen
Onderbouwing
Inleiding
Operaties en ingrepen bij patiënten met VWD moeten, afhankelijk van de restactiviteit van VWF, onder stollingsfactorcorrectie plaatsvinden om bloedingscomplicaties te voorkomen. Er kan gebruik gemaakt worden van VWF(/factor VIII) concentraten (plasma-derived of recombinant), of van een synthetisch preparaat, DDAVP (1-deamino-8-D-arginine-vasopressine: Minrin, intraveneus; Octostim, neusspray/subcutaan), dat tijdelijk de plasmaconcentratie van VWF/factor VIII verhoogt door een release van VWF uit de endotheelcellen te bewerkstelligen. Daarnaast wordt gebruik gemaakt van antifibrinolytica (tranexaminezuur, Cyklokapron). De keuze van het preparaat is afhankelijk van het type VWD en de ingreep en patiënt afhankelijke factoren (zoals respons op DDAVP, bloedingsneiging en eventuele contra-indicaties). Het is voor iedere ingreep belangrijk dat maximale lokale hemostase wordt nagestreefd.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Hoewel gedacht wordt dat factor VIII cruciaal is in het voorkomen van chirurgische bloedingen, zal het alleen suppleren van factor VIII concentraat met name in patiënten met type 2 en type 3 VWD niet leiden tot adequate hemostase tijdens operaties. (Castaman, 2011; Connell, 2021) |
|
C |
Lokale beschikbaarheid van snelle bepalingen van VWF en factor VIII is noodzakelijk voor goede perioperatieve begeleiding van VWD patiënten. (Connell, 2021) |
|
C |
Het doseren van het stollingsfactorconcentraat Haemate-P (factor VIII:VWF 1:2,4) op basis van alleen factor VIII leidt voor VWF in meer dan 50% en voor factor VIII in meer dan 70% tot een stijging van ≥ 20 IE/dL boven de streefspiegel. (Hazendonk, 2018) |
|
C |
Het bevorderen van lokale hemostase tijdens een ingreep met gelatinesponzen, fibrinelijm en/of lokale tranexaminezuur applicatie is zinvol. (Federici, 2000; De Padua, 2020) |
|
C |
Het gebruik van alleen factorconcentraten of DDAVP met een VWF streefspiegel van > 50 IE/dL, is bij kleine ingrepen geassocieerd met een significant hoger risico op postoperatieve bloeding in vergelijking met de combinatie tranexaminezuur met een van beide behandelingen (n=59; RR, 6,29; 95% CI: 2,12-18,65). (Walsh, 1971; Forbes, 1972; Connell, 2021) |
Samenvatting literatuur
Resultaten
Algemeen
De perioperatieve behandeling van VWD is ingewikkeld, als gevolg van de verschillende typen VWD, de inter-patiënt variatie in residuaal endogeen VWF, VWF secretie en klaring, en de verschillende stollingsfactorconcentraten met wisselende VWF/factor VIII concentraties. Er zijn geen gerandomiseerde studies verricht naar de effectiviteit en veiligheid van verschillende doseringen en streefspiegels van VWF/factor VIII voor de verschillende ingrepen bij patiënten met VWD. De data die deze aanbevelingen ondersteunen komen voort uit klinische ervaring, consensus van expert opinion en observationele studies. Er wordt onderscheid gemaakt tussen kleine en grote ingrepen waarbij met name de minimale behandelduur varieert. De productkeuze, dosering en duur van behandeling is afhankelijk van het klinische scenario (type ingreep, bloedingsrisico), VWD subtype en VWF en factor VIII gehalte van de patiënt en de voorkeur van een HBC.
Tranexaminezuur
Tranexaminezuur kan oraal en intraveneus toegediend worden. Bij kinderen is de dosering tranexaminezuur oraal 25-50 mg/kg per 24 uur, verdeeld over drie giften; intraveneus 25 mg/kg in 3xdd. Bij volwassenen is de dosering tranexaminezuur 1g 3-4x per dag. Lokale tranexaminezuur kan toepast worden in de vorm van mondspoeling 5%: 4x/dag 2 minuten spoelen met 10ml of bijten op een gaasje gedrenkt in tranexaminezuur.
Desmopressine
DDAVP kan intraveneus (Minrin®) of subcutaan (Octostim®) toegediend worden in een dosering van 0,3 mcg/kg of als neusspray (Octostim® spray 150 microgram/dosis, 1 puff in ieder neusgat bij volwassenen en kinderen > 40 kg en 1 puff in een neusgat bij kinderen tussen de 20-40 kg), minimaal 30 minuten voor de ingreep, als de streefspiegels daarmee gehaald worden en er geen contra-indicaties voor DDAVP zijn. Houd hierbij rekening met de tachyfylaxie van DDAVP (Mannucci, 1992).
Stollingsfactorconcentraten
Er zijn 3 groepen stollingsfactorconcentraten te onderscheiden op basis van de verhouding VWF en factor VIII:
Omdat de factor VIII productie en secretie normaal is in patiënten met VWD kan infusie van exogeen VWF, leidend tot stabilisatie en stijging van endogeen factor VIII, samen met exogeen factor VIII leiden tot ongewenst hoge factor VIII spiegels. Gebruik van een stollingsfactorconcentraat met een ratio VWF/factor VIII > 10, bij patiënten met een laag factor VIII gehalte, geeft pas een stijging van het endogene factor VIII na 6-8 uur (Borel-Derlon, 2007; Mannucci, 2013) en moet daarom 6-8 uur voor de ingreep toegediend worden. Er kan ook gekozen worden om bij de eerste gift, gelijktijdig factor VIII toe te dienen. Daarnaast dient rekening gehouden te worden met de halfwaarde tijd van de verschillende producten en de ampulgrootte (in het geval van behandeling van jonge kinderen).
Streefspiegels VWF en factor VIII bij grote en kleine ingrepen
Er zijn geen studies naar de effectiviteit en veiligheid van verschillende doseringen en streefspiegels van VWF en/of factor VIII voor ingrepen. Het huidige advies is gebaseerd op enkele prospectieve studies en retrospectieve case series van VWD patiënten die verschillende grote operaties ondergingen, waarbij zowel de behaalde factor VIII als VWF spiegels ≥ 3 dagen postoperatief gerapporteerd werden (Connell, 2021). Daarnaast is er gebruik gemaakt van verschillende consensus richtlijnen (Nichols, 2008; NVHB, 2009; Lassila, 2011; Laffan, 2014).
Prospectieve studies
Borel-Derlon et al. (Borel-Derlon, 2007) rapporteerden een serie van 50 patiënten vanuit een Europese en een Franse studie (5 VWD type 1, 27 type 2 en 18 type 3; 72% met VWF < 10 IE/dL). Deze patiënten ondergingen in totaal 65 grote operaties (14 orthopedische, 10 gynaecologische, 7 algemene, 14 tandheelkundige en 20 gastro-intestinale ingrepen) en 43 invasieve procedures (o.a. endoscopieën, hysteroscopieën, coronair angiografie, intramusculaire en intra-articulaire injecties). Ze werden behandeld met Wilfactin (VWF/factor VIII ratio > 10). Er werd een preoperatieve oplaaddosis gegeven van 50 IE/kg VWF in de Franse studie en van 60 IE/kg VWF in de Europese studie. Bij een endogeen factor VIII gehalte van < 60 IE/dL werd er ook een bolus 12 uur voorafgaand aan de ingreep gegeven. Er werden geen preoperatieve streefspiegels vastgesteld. Postoperatieve streefspiegels waren een VWF spiegel van ten minste 60 IE/dL en een factor VIII spiegel van ten minste 40 IE/dL, tot complete genezing was bereikt in de Franse studie, of een VWF en factor VIII spiegel van ten minste 50 IE/dL tot verwijderen van de hechtingen na 7-10 dagen in de Europese studie. Preoperatieve VWF spiegels varieerden van 60-266 IE/dL. De behaalde postoperatieve VWF spiegels varieerden van 74-114 IE/dL en de factor VIII spiegels varieerden van 120-164 IE/dL. Peri-operatieve hemostase werd beoordeeld als ‘uitstekend’ in 54 operaties en ‘goed’ in 11 operaties. Er waren geen abnormale bloedingen na de invasieve procedures.
Dunkley et al. (Dunkley, 2010) beschreven een serie van 23 VWD patiënten (7 VWD type 1, 9 type 2, 7 type 3) waarbij 10 grote ingrepen en 19 kleine ingrepen plaatsvonden. Patiënten werden behandeld met een VWF/factor VIII concentraat (ratio > 1). Er werden geen specifieke pre- of postoperatieve streefspiegels gegeven, maar achteraf gekeken of de waarden binnen de normaal waarden vielen (VWF en factor VIII beide 50-200 IE/dL). De gemiddelde dosering (gebaseerd op factor VIII) voor grote ingrepen was 73 IE/kg en voor kleine ingrepen 35 IE/kg. Bij grote ingrepen werd bij 90% de streefspiegel van VWF > 50 IE/dL behaald, bij kleine ingrepen was dit 50% (voor factor VIII was dit 100% resp. 90%). De mediane factor VIII spiegel was 115 IE/dL, de mediane VWF spiegel was 85 IE/dL. Peri-operatieve hemostase werd beoordeeld als ‘uitstekend’ en ‘goed’ voor alle ingrepen. In twee patiënten steeg de factor VIII spiegel boven de 200 IE/dL. Er waren geen trombo-embolische complicaties.
Retrospectieve case series
Khair et al. (Khair, 2015) onderzochten het gebruik van Wilate (VWF/factor VIII ratio 1) in 47 kinderen met VWD (7 VWD type 1, 9 type 2, 7 type 3). Er werden 41 operaties uitgevoerd in 34 kinderen: 9 kleine ingrepen, 7 tandheelkundige en 25 grote ingrepen. De streefspiegel was een factor VIII > 50 IE/dL voor kleine ingrepen en > 100 IE/dL voor grote ingrepen, voor 3-5 dagen. De gemiddelde dosering Wilate was eenmalig 70 IE/kg voor kleine ingrepen, eenmalig 45 IE/kg voor de tandheelkundige ingrepen en gemiddeld 4 giften van 43 IE/kg voor grote ingrepen. Peri-operatieve hemostase werd beoordeeld als ‘goed’ of ‘uitstekend’ in 94% van de ingrepen. De gemiddelde maximale factor VIII spiegels waren 135 IE/dL, dit was 92 IE/dL voor VWF. Er waren geen adverse events.
Hazendonk et al. (Hazendonk, 2018) analyseerden het perioperatieve beleid met VWF/factor VIII concentraat Haemate-P (VWF/factor VIII ratio > 1) van patiënten met VWD die tussen 2000 en 2015 geopereerd werden. In totaal werden 103 patiënten met VWD (54 VWD type 1, 43 VWD type 2, 6 VWD type 3) geïncludeerd. Er werden 148 operaties uitgevoerd, waarbij er sprake was van 38 kleine ingrepen en 110 grote ingrepen. Hierbij werd de Nederlandse richtlijn gevolgd waarbij preoperatief tot 36 uur postoperatief een VWF en factor VIII streefspiegel van > 80 IE/dL werd aangehouden, met daarna voor grote ingrepen een factor VIII spiegel van > 50 IE/dL voor 7-10 dagen en bij kleine ingrepen een factor VIII > 50 IE/dL voor 3 dagen, met daarna een factor VIII > 30 IE/dL voor 4-7 dagen. Haemate-P werd gedoseerd op basis van factor VIII. Er werd een preoperatieve oplaaddosering gegeven van 50 IE/kg factor VIII voor grote ingrepen en 30-50 IE/kg factor VIII voor kleine ingrepen. In meer dan de 50% van de patiënten steeg de VWF tot ≥ 20 IE/dL boven de vastgestelde streefspiegel en in meer dan 70% was dit het geval voor factor VIII. Ook werd er stapeling van factor VIII gezien na herhaalde doseringen Haemate-P. In 8% van de patiënten steeg de factor VIII > 270 IE/dL. Er werden geen bloedingscomplicaties en geen trombo-embolische complicaties gezien.
Rugeri et al. (Rugeri, 2016) evalueerden het beloop van 12 VWD patiënten (6 type 1 VWD, 6 type 2 VWD) die in totaal 19 grote operaties ondergingen (12 totale knie protheses, 7 totale heup protheses). De streefspiegels voor VWF en factor VIII waren preoperatief tot 3 dagen postoperatief 100 IE/dL en daarna 60-80 IE/dL gedurende de rest van de ziekenhuisopname. Vier patiënten werden behandeld met DDAVP waarbij de VWF steeg naar gemiddeld 196 IE/dL. De overige 8 patiënten werden behandeld met VWF concentraten met een gemiddelde dosering van 52 IE/kg resulterend in een stijging van VWF naar gemiddeld 161 IE/dL en factor VIII naar gemiddeld 174 IE/dL. Hemostatische controle was ’uitstekend’ in 74% en ‘goed’ in 11% van de procedures. 1 VWD patiënt voldeed aan de criteria voor major bleeding, bij een adequate VWF spiegel.
Srivastava et al. (Srivastava, 2017) beschreven 28 patiënten (21 VWD type 3) die 30 ingrepen (21 grote, 9 kleine) ondergingen met Wilate (VWF/factor VIII ratio 1). Er werd een oplaaddosis gegeven van 40-60 IE/kg VWF bij grote ingrepen en 30-60 IE/kg bij kleine ingrepen. Voor grote ingrepen was de preoperatieve streefspiegel voor VWF 100 IE/dL en postoperatief > 50 IE/dL voor ten minste 6 dagen. Voor kleine ingrepen was de VWF streefspiegel preoperatief > 50 IE/dL en postoperatief > 30 IE/dL voor ten minste 2 dagen. Perioperatieve hemostase werd beoordeeld als ‘succesvol’ in 100% van de kleine ingrepen en in 95% van de grote ingrepen. De gemiddelde VWF spiegel was 41 IE/dL, voor factor VIII was dit 92 IE/dL. In 6 patiënten steeg factor VIII tot > 250 IE/dL. Er waren geen trombo-embolische complicaties.
Windyga et al. (Windyga, 2011) beschreven de effectiviteit van het VWF/factor VIII concentraat Wilate (VWF/factor VIII ratio 1) in de ‘European Wilate study’ bij 57 operaties (27 grote en 30 kleine) in 32 VWD patiënten (19 type 3 VWD, 9 type 2 VWD, 4 type 1 VWD). De streefspiegel bij grote ingrepen was een factor VIII > 50 IE/dL, preoperatief tot complete wondgenezing; bij kleine ingrepen een factor VIII > 30 IE/dL, preoperatief tot complete wondgenezing, of een totaal van 6 uur bij tandheelkundige ingrepen. De gemiddelde oplaaddosering voor grote ingrepen was 49 IE/kg, voor kleine ingrepen was dit 39 IE/kg. Voor grote ingrepen was de gemiddelde onderhoudsdosering 21 IE/kg, met gemiddeld 11 infusies in totaal. Voor kleine ingrepen was dit 22 IE/kg met gemiddeld 1,5 infusies in totaal. Er waren meer patiënten met VWD type 3 die een kleine ingreep ondergingen. De hemostatische controle werd beoordeeld als ‘uitstekend’ of ‘goed’ in 96% van de ingrepen.
Adviezen in consensus richtlijnen
Op basis van bovenstaande literatuur wordt in de ASH ISTH NHF WHF 2021 VWD richtlijn (Connell, 2021) gesuggereerd om, indien mogelijk, bij grote ingrepen een streefspiegel van zowel VWF als factor VIII ≥ 50 IE/dL aan te houden gedurende ten minste drie dagen. Het gebruik van alleen een factor VIII streefspiegel wordt afgeraden. Specifieke streefspiegels en duur van behandeling moeten individueel vastgesteld worden op basis van patiëntkarakteristieken, bloedingsfenotype, type ingreep, en laboratorium mogelijkheden. Voor kleine ingrepen wordt gesuggereerd om tranexaminezuur toe te voegen, naast het eenmalig verhogen van de VWF ≥ 50 IE/dL. Het verhogen van VWF ≥ 50 IE/dL zonder de toevoeging van tranexaminezuur wordt afgeraden. Daarnaast suggereren ze bij patiënten met een VWF activiteit van > 30 IE/dL en een mild bloedingsfenotype die een mucosale operatie ondergaan, om alleen tranexaminezuur te gebruiken. Bij tandheelkundige ingrepen moeten producten die lokale hemostase bevorderen overwogen worden. In deze richtlijn wordt ook aangegeven dat het wenselijk is om het langdurig stijgen van zowel VWF als factor VIII > 150 IE/dL en langdurig gebruik van tranexaminezuur te voorkomen. Er wordt geen advies gegeven over preoperatieve streefspiegels.
De Britse VWD richtlijn geschreven door de UKHCDO in 2014 (Laffan, 2014) en gebaseerd op literatuur vanaf 2002, adviseert voor grote ingrepen een preoperatieve factor VIII streefspiegel van ≥ 100 IE/dL, gevolgd door een factor VIII > 50 IE/dL tot 7-10 dagen postoperatief. Voor de VWF adviseren ze een spiegel van > 50 IE/dL perioperatief. Bij kleine ingrepen is een VWF en factor VIII van > 50 IE/dL voldoende.
De VWD richtlijn van de Nordic Haemophilia Council (Lassila, 2011) adviseert voor grote ingrepen een oplaad dosis van 50-60 IE/kg VWF, gevolgd door een onderhoudsdosering van 25-40 IE/kg VWF iedere 12-24 uur. De geadviseerde postoperatieve streefspiegels zijn een VWF en factor VIII van 60-80 IE/dL voor dag 1-3, 40-60 IE/dL voor dag 4-6 en 30-50 IE/dL voor dag 7-14. Hoge factor VIII spiegels (> 150 IE/dL) moeten voorkomen worden. Kleine ingrepen kunnen onder DDAVP verricht worden. Tranexaminezuur 15-20 mg/kg kan toegevoegd worden, zeker bij mucosale ingrepen.
In de Nederlandse richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de NVHB uit 2009 (NVHB, 2009) worden het volgende advies gegeven: een preoperatieve oplaad dosis van 50 IE/kg factor VIII voor grote ingrepen en 30-50 IE/kg factor VIII voor kleine ingrepen. Daarna een dosering van 25 IE/kg tweemaal daags bij grote ingrepen en 15-25 IE/kg tweemaal daags bij kleine ingrepen, op geleide van de factor VIII concentratie. Er worden de volgende streefspiegels geadviseerd: preoperatief en de eerste 36 uur postoperatief een factor VIII en een VWF > 80 IE/dL. Bij grote ingrepen wordt daarna een factor VIII > 50 IE/dL aangehouden gedurende 7-10 dagen. Bij kleine ingrepen is dit een factor VIII > 50 IE/dL gedurende 3 dagen, gevolgd door een factor VIII > 30 IE/dL gedurende 4-7 dagen. Ook wordt er geadviseerd om extreem hoge factor VIII spiegels (> 200 IE/dL) te vermijden. Dit beleid is in de eerder beschreven studie van Hazendonk et al. geëvalueerd (Hazendonk, 2018).
De Amerikaanse VWD richtlijn van het ‘National Heart, Lung, and Blood Institute (NHLBI)’ gepubliceerd in 2008 (Nichols, 2008) adviseert de volgende streefspiegels op basis van gepubliceerde case series en consensus expert opinie: voor grote ingrepen een preoperatieve VWF / factor VIII spiegel van > 100 IE/dL, met nadien voor beide een streefspiegel van > 50 IE/dL voor ten minste 7-10 dagen. Voor kleine ingrepen wordt preoperatief een VWF / factor VIII van ten minste > 50 IE/dL voor ten minste 1-5 dagen geadviseerd. Daarnaast wordt geadviseerd om factor VIII niet boven 250-300 IE/dL en VWF niet boven 200 IE/dL te laten stijgen in verband met het risico op trombose (Makris, 2002; Mannucci, 2002).
Tranexaminezuur bij kleine ingrepen
Er zijn 8 case series beschreven waarin bij kleine ingrepen alleen suppletie therapie werd gegeven, zonder tranexaminezuur en 4 case series waarin patiënten alleen tranexaminezuur kregen bij het ondergaan van kleine ingrepen (tandextracties, circumcisies, leverbiopten, endoscopie met biopten) (Connell, 2021). In de case series met alleen suppletie therapie (streefspiegel van VWF > 50 IE/dL) zonder additioneel tranexaminezuur werd in 11% van de 281 ingrepen (95% CI, 6-19%) (Franchi, 1995; Venkataramani, 2000; Shin, 2005; Viswabandya, 2008; Rodriguez, 2010; Mansouritorghabeh, 2013) een bloeding beschreven. Hemostase werd beoordeeld als voldoende in 98% van de behandelingen (95% CI, 91-99%) (Scharrer, 1994; Rivard, 2008; Viswabandya, 2008). In een observationele studie met 13 patiënten was in 54% van de patiënten suppletie therapie postoperatief noodzakelijk (Venkataramani, 2000). Er werden geen trombotische events beschreven in de 3 studies (94 operaties) die deze uitkomstmaat bekeken (Franchi, 1995; Rivard, 2008; Viswabandya, 2008). In de case series waarbij alleen tranexaminezuur werd gegeven was er sprake van een bloeding in 14% van de ingrepen (95% CI, 9-20%) (Tavenner, 1972; Hewson, 2011; Davis, 2013; Lewandowski, 2018). Er werden geen significante adverse events beschreven.
Platelet type VWD en VWD type 2B
Bij platelet type VWD is er sprake van een afwijkend GPIb op de bloedplaatjes, waardoor er verhoogde affiniteit voor VWF ontstaat. Door deze spontane binding aan GPIb is er bij platelet type VWD vaak een trombocytopenie, die nog verder kan toenemen bij het geven van DDAVP of VWF/factor VIII concentraat. In 2020 publiceerde de Platelet Physiology Subcommittee van de ISTH een richtlijn voor de diagnostiek en management van platelet type VWD (Othman, 2020). Behandeling met VWF concentraat in combinatie met 1 HLA gematched trombocytenconcentraat wordt geadviseerd. Voor grote ingrepen wordt een VWF streefspiegel van 50-60 IE/dL geadviseerd en voor kleine ingrepen een VWF spiegel van 30-50 IE/dL.
Bij VWD type 2B kan er een trombocytopenie ontstaan door de verhooge affiniteit voor de GPIb receptor. Eventuele trombocytentransfusie in aanvulling op VWF(/FVIII) concentraat moet worden overwogen op basis van het trombocytenaantal. Voor de hoogte van de streeftrombocyten wordt verwezen naar de Bloedtransfusierichtlijn: Trombocytenwaarde voor profylactische trombocytentransfusie – Richtlijn – Richtlijnendatabase
Tromboserisico
In meerdere richtlijnen wordt geadviseerd om extreem hoge factor VIII spiegels te vermijden (> 150-300 IE/dL). In de studie van Koster et al. (Koster, 1995) bleek een factor VIII waarde > 150 IE/dL een onafhankelijke risicofactor te zijn voor het ontwikkelen van een diep veneuze trombose met een odds ratio (OR) van 4.8 (95%CI: 2.3-10.0). Een systematische review uit 2012 (Coppola, 2012) bekeek trombotische complicaties gerelateerd aan factor substitutie in patiënten met hemofilie en VWD in prospectieve studies. Er werden 71 studies geïncludeerd met in totaal 5528 patiënten met hemofilie A, hemofilie B en VWD. In totaal werden er 20 trombotische adverse events gerapporteerd (2 hemofilie A, 11 hemofilie B, 7 VWD). In de groep VWD patiënten werd, naast 5 oppervlakkige tromboflebitiden, 1 diep veneuze trombose (DVT) en 1 longembolie beschreven bij patiënten die langdurig VWF(/factor VIII) concentraat kregen in verband met een operatie en waarbij er sprake was van zeer hoge factor VIII waarden (patiënt met DVT: factor VIII 248 IE/dL, patiënt met longembolie: factor VIII 450 IE/dL).
Referenties
Bewijskracht literatuur
Level 2-3, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van in 2021 door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn; de Britse richtlijn voor diagnostiek en management van VWD van de United Kindom Haemophilia Centre Doctors Organisation (UKHCDO) uit 2014; de Nordic Haemophilia Council’s guideline uit 2011; de richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de Nederland Vereniging van Hemofiliebehandelaars (NVHB) uit 2009 en de VWD richtlijn van de Amerikaanse National Heart, Lung, and Blood Institute (NHLBI) uit 2008.
Zoekverantwoording
De zoekverantwoording is opgenomen in diverse richtlijnen en bijbehorende (online) supplementen (Nichols, 2008; NVHB, 2009; Lassila, 2011; Laffan, 2014; Connell, 2021)
Evidence tabellen
De evidence tabellen van de gebruikte richtlijnen zijn weergegeven in het EtD raamwerk van de ASH ISTH NHF WFH richtlijn (Connell, 2021), online beschikbaar; op de website van de British Committee for Standards in Haematology (Laffan, 2014); op de website van de Nordic Haemophilia Counsil (Lassila, 2011); op de website van de NHLBI richtlijn (Nichols, 2008).
De in de studies gerapporteerde streefspiegels voor VWF en factor VIII rondom ingrepen bij VWD zijn weergegeven in de tabellen 6.1 (grote ingrepen) en 6.2 (kleine ingrepen).
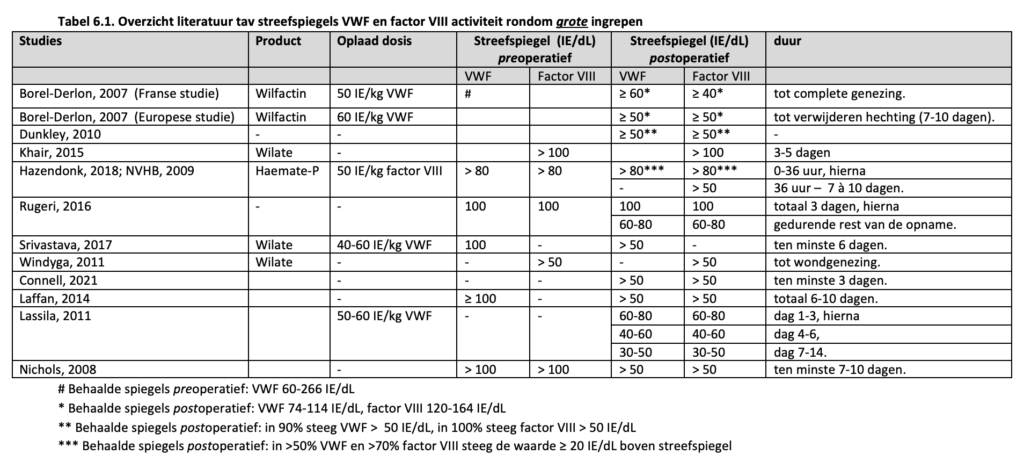
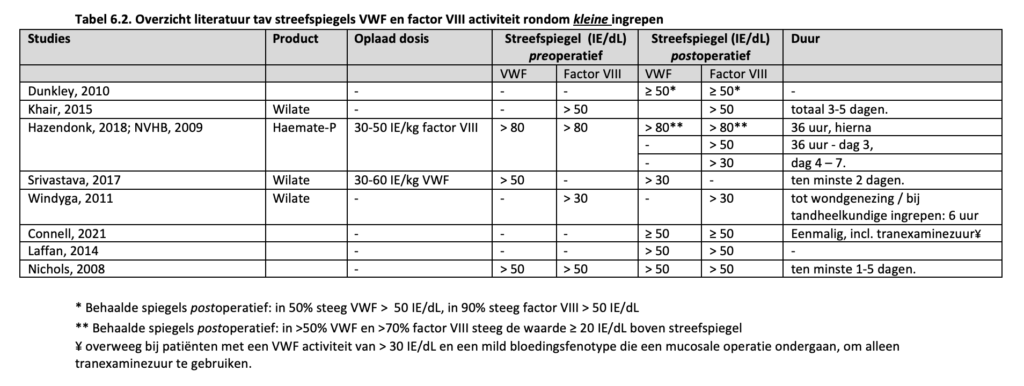
Overwegingen
Streefspiegels VWF en factor VIII bij grote en kleine ingrepen
Er is veel variatie in de pre- en postoperatieve streefspiegels voor VWF en factor VIII en de duur van behandeling in de beschreven case series en richtlijnen. Over het algemeen werd bij grote ingrepen bijna altijd gekozen voor een preoperatieve VWF en/of factor VIII streefspiegel van 80-100 IE/dL en bij kleine ingrepen van > 50-80 IE/dL. De postoperatieve streefspiegels en duur van behandeling zijn zeer variabel. Bij grote ingrepen variërend van 50-100 IE/dL VWF en/of factor VIII in de eerste 7-10 dagen postoperatief, waarbij in de Noorse richtlijn ook nog op dag 7-14 een streefspiegel > 30 IE/dL geadviseerd werd (tabel 6.1). Voor kleine ingrepen varieerden de post operatieve streefspiegels van 30-50 IE/dL gedurende 1-7 dagen (tabel 6.2). In de studies werd hiermee in het overgrote deel van de ingrepen goede tot uitstekende hemostase bereikt. Er werden geen significante adverse events gerapporteerd. Wel werd duidelijk dat het doseren op basis van factor VIII leidde tot onnodig hoge VWF en factor VIII waarden.
Met het steeds meer beschikbaar komen van snelle VWF bepalingen, is het mogelijk om zowel de VWF als factor VIII peroperatief te meten en op basis van VWF en factor VIII streefspiegels een behandelplan te maken. De hoeveelheid stollingsfactorconcentraat kan berekend worden op basis van zowel de VWF concentratie en de factor VIII concentratie. Hierbij kan gebruik gemaakt worden van de onderstaande berekeningen.
Doordat de diverse VWF/factor VIII concentraten een verschillende verhouding VWF en factor VIII bevatten, dient er bij het doseren rekening te worden gehouden met wat de te verwachten stijging van zowel VWF activiteit als factor VIIII activiteit zal zijn op basis van de toegediende aantal eenheden per factor.
Tranexaminezuur bij kleine ingrepen
De case series lieten zien dat de synergistische werking van VWF en tranexaminezuur het risico op postoperatieve bloeding verlaagd. De aanbeveling om alleen tranexaminezuur te geven bij patiënten met type 1 VWD met spiegels > 30IE/dL en een mild bloedingsfenotype die kleine mucosale ingrepen moeten ondergaan, is met name gebaseerd op de angst op overbehandeling van deze patiënten en op de haalbaarheid van het voorschrijven van tranexaminezuur in een scenario waarin de kans op bloedingscomplicaties laag is en het vermijden van de last en de kosten van het toedienen van factorconcentraat bij deze patiënten. Daarnaast heeft tranexaminezuur een minimaal bijwerkingenprofiel.
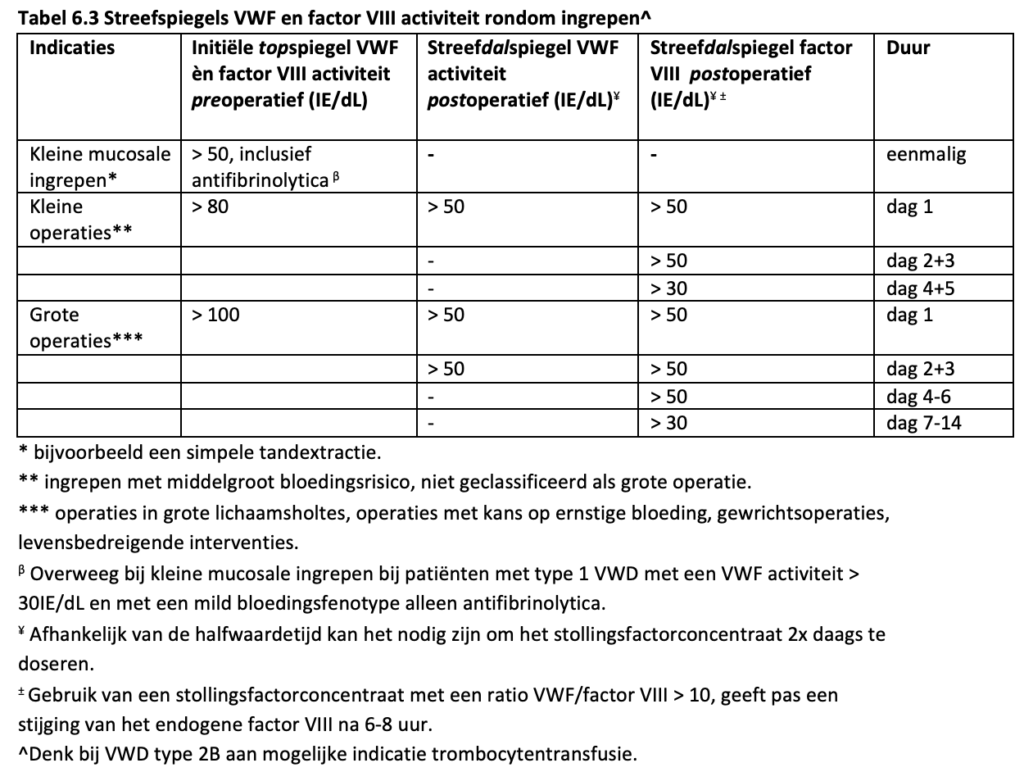
Wanneer en hoe wordt profylactische behandeling met stollingsfactor concentraat gegeven bij de ziekte van Von Willebrand?
Aanbevelingen
Onderbouwing
Inleiding
Deze vraag beschrijft of lange-termijn profylaxe (1-3 maal per week intraveneuze toediening) met VWF(/factor VIII) concentraat dient te worden toegepast bij VWD patiënten met ernstige en frequente bloedingen. De meerderheid van VWD patiënten hebben milde bloedingsverschijnselen en hebben weinig ernstige spontane bloedingen (Leebeek & Eikenboom, 2016). Dit maakt dat VWD patiënten, in tegenstelling tot patiënten met ernstige hemofilie, zelden met lange-termijn profylaxe behandeld hoeven te worden. Dit is uiteraard afhankelijk van het type VWD en de VWF en factor VIII activiteit in het bloed. (Sadler, 2006) Patiënten met type 3 VWD, die per definitie ook een laag factor VIII hebben, presenteren zich vaak met gewrichtsbloedingen, ernstige neusbloedingen en toegenomen menstrueel bloedverlies (Tosetto, 2020; van Galen, 2015). Dit kan echter ook voorkomen bij patiënten met type 1 en type 2 VWD (de Wee, 2011; Xu 2017). Daarnaast kunnen patiënten met zowel type 1,2 en 3 VWD ook recidiverend gastro-intestinaal bloedverlies hebben, mede veroorzaakt door de aanwezigheid van angiodysplasien in de tractus digestivus (Biguzzi, 2020). In de WiN studie is aangetoond dat de kwaliteit van leven bij VWD patiënten door bloedingen is verminderd en dat bij type 3 VWD dit vergelijkbaar is met patiënten met ernstige hemofilie A (de Wee, 2010). Het merendeel van de patiënten dat profylaxe gebruikt zijn de type 3 VWD patiënten, maar ook aan patiënten met type 2A, 2B, en type 1 met sterk verlaagd VWF en factor VIII wordt profylaxe voorgeschreven. De belangrijkste indicaties zijn: neusbloedingen (met name bij kinderen), gewrichtsbloedingen, gastro-intestinale bloedingen (met name bij ouderen) en menorragie (Berntorp, 2005). De doseringen die worden gebruikt verschillen in de diverse internationale richtlijnen. Zowel puur VWF als VWF/factor VIII concentraat kan worden gebruikt voor profylaxe, omdat door de regelmatige infusie van VWF, en de normale endogene factor VIII productie, factor VIII in het bloed zal stijgen. In dit hoofdstuk wordt voor de onderbouwing van het advies voornamelijk gebruik gemaakt van de recent ASH-ISTH-WFH-NHF VWD guideline, die in 2021 is gepubliceerd (Connell, 2021).
Conclusies
|
SORT Grade |
Conclusie |
|
B |
Er lijkt een voordeel te zijn van lange termijn profylaxe bij VWD patiënten die ernstige en frequente bloedingen hebben (Holm E, 2015; Peyvandi F, 2019; El Alayli, 2022) |
|
B |
Lange-termijn profylaxe lijkt het risico op herhaalde bloedingen, zoals neusbloedingen, spontane bloedingen en gewrichtsbloedingen te verlagen (El Alayli A, 2022; Leebeek, 2022) |
|
C |
Lange termijn profylaxe lijkt het aantal ziekenhuisopnames ivm bloedingen bij patiënten met VWD te verminderen (Holm E, 2018; El Alayli, 2022) |
|
C |
Er zijn gerandomiseerde klinische studies nodig om zekerheid te verkrijgen over de voordelen van profylaxe (Connell, 2021) |
Samenvatting literatuur
Resultaten
Er zijn weinig studies uitgevoerd naar het gebruik van profylaxe bij patiënten met VWD. In het kader van de ontwikkeling van de nieuwste ASH-ISTH-WFH-NHF VWD richtlijn is recent een systematisch review verricht waarbij drie soorten van bewijs over het gebruik van profylaxe zijn geidentificeerd: één gerandomiseerde studie, waarbij profylaxe vergeleken is met placebo; vijf pre-post studies met een expliciete vergelijking tussen wel of geen profylaxe gedurende een vastgestelde periode en acht pre-post studies met een impliciete vergelijking tussen een periode met en zonder profylaxe (El Alayli, 2022) (zie tabel 7.1). Het effect van profylaxe werd vastgesteld voor een aantal uitkomsten: spontane bloedingen (aantal per patient), bloedingen (aantal per maand per patiënt), tijd tot eerste bloeding in dagen, bloedingen die langer duren dan 2 dagen, ernstige bijwerkingen, neusbloedingen, gastro-intestinale bloedingen en gewrichtsbloedingen. Ernstige bloedingen werden gedefinieerd als zijnde: opname in het ziekenhuis ivm bloeding, noodzaak van chirurgische interventie, bloedtransfusie, daling van Hb ≥2 g/dL (= 1.25 mmol/L), of bloedingen in vitale organen (intracranieel, intraspinaal, intraoculair, retroperitoneaal, intraarticulair, pericardiaal, of intramusculair met compartiment syndroom). Profylaxe was gedefinieerd als een periode van tenminste 6 maanden behandeling met VWF(/factor VIII)-concentraat tenminste 1 maal per week (Connell, 2021).
In een gerandomiseerde studie met 19 patiënten met ernstige VWD werd een reductie van het aantal bloedingen gezien (RR 0,24; 95% betrouwbaarheidsinterval 0,17-0,35). Ook was de tijd tot eerste bloeding langer en het aantal neusbloedingen. Het aantal spontane bloedingen en gewrichtsbloedingen werden mogelijk verlaagd, maar dit was niet significant (RR 0,62;0,37-1,04 en RR 0,50:0,06-4,50). Profylaxe ging gepaard met meer bloedingen die langer duurden dan twee dagen en er werden onder profylaxe ook meer gastro-intestinale bloedingen gezien (RR 45,69;11,09-188,21 en 13,97;1.84-104,46). Deze bloedingen traden echter op in één patient, wat kan leiden tot overschatting (Peyvandi, 2019).
In de vijf observationele studies met expliciete vergelijkingsdata was het risico op bloedingen sterk gereduceerd (RR 0,34;0,25-0,46), er werden minder patiënten in het ziekenhuis opgenomen (RR 0,64; 0,44-0,93) en waren er minder episodes van hevig menstrueel bloedverlies (El Alayli, 2022) (zie tabel 7.1).
In de observationele studies zonder expliciete vergelijkingsdata voor start van profylaxe was het totaal aantal bloedingen tijdens de periode van profylaxe 3,2 per jaar (1,96-5,24). De hemostatische effectiviteit van profylaxe werd door de onderzoekers omschreven als exellent of goed in 100 % in 3 van de 4 studies en 99.7% in de andere studie (El Alayli, 2022) (zie tabel 7.1).
Er werden geen bijwerkingen van profylaxe gerapporteerd in de observationele studies. Trombose, allergische reacties of ontwikkeling van een remmer tegen VWF werden niet beschreven.
In een recente studie uitgevoerd na het systematic review is profylaxe voor patiënten met ernstige VWD en frequente bloedingen met recombinant VWF onderzocht. In deze studie werden zowel patiënten geincludeerd die al profylaxe kregen met plasma VWF(/factor VIII) concentraat, als patiënten die voorheen alleen werden behandeld bij een bloeding (on-demand). Bij de patiënten die een switch maakten van plasma naar recombinant VWF concentraat in dezelfde dosering bleef het aantal bloedingen vergelijkbaar laag (afname aantal bloedingen met 45%, n.s.) en bij de patiënten die met profylaxe starten in een dosering van 50IE VWF/kg 2 maal per week daalde het aantal bloedingen met 91,5%. In de respectievelijke groepen werden in 85% en 70% van de patiënten geen bloedingen gezien tijdens profylaxe (Leebeek, 2022).
Andere richtlijnen
In de vorige Nederlandse richtlijn uit 2009 (Leebeek & Mauser-Bunschoten E, 2009) werd profylactische toediening van VWF(/factor VIII) concentraat ter voorkoming van bloedingen niet besproken en werd er ook geen advies over gegeven.
De Nordic Haemophilia Council VWD richtlijn (Lassila, 2011) adviseert om profylaxe te starten met een VWF(/factor VIII) concentraat in een dosering van 25-50 IE VWF/kg IV 2-3 x per week bij patiënten met ernstige VWD en herhaalde bloedingen. Profylaxe wordt geadviseerd voor gewrichtsbloedingen, ernstige neusbloedingen, menorragie, of gastro-intestinale bloedingen leidend tot anemie en beperkte kwaliteit van leven.
In de Britse richtlijn uit 2014 is het advies (graad 1a) dat profylaxe dient te worden overwogen bij recidiverende bloedingen in alle types VWD. In kinderen met type 3 is het advies om profylaxe 2-3x per week te overwegen in een dosering van 30-50 IE VWF/kg als bloedingen in gewrichten optreden. Zowel VWF/factor VIII als VWF concentraten kunnen worden gebruikt voor profylaxe (Laffan, 2014).
Referenties
Bewijskracht literatuur
Level 2-3, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (Connell, 2021). Ook werd gebruik gemaakt van de uitgebreidere beschrijving van de systematic review verricht ter beantwoording van de uitgangsvraag of profylaxe met VWF(/fator VIII) concentraat zinvol is bij patiënten met VWD (El Alayli, 2022). Daarnaast werden de Britse richtlijn voor diagnostiek en management van VWD van de United Kindom Haemophilia Centre Doctors Organisation (UKHCDO) uit 2014; de Nordic Haemophilia Council’s guideline uit 2011; de richtlijn Diagnostiek en behandeling van hemofilie en aanverwante hemostasestoornissen van de Nederland Vereniging van Hemofiliebehandelaars (NVHB) uit 2009 geraadpleegd.
Zoekverantwoording
De zoekverantwoording is opgenomen in diverse richtlijnen en bijbehorende (online) supplementen (Connell 2021, Laffan 2014, Lassila 2011, Leebeek en Mauser-Bunschoten, NVHB 2009).
Evidence tabellen
Tabel 7.1: Overzicht van de studies opgenomen waarop de bewijslast voor de ASH-ISTH-WFH-NHF richtlijn is gebaseerd.
|
Citation |
Country |
N |
Prophylaxis Agent |
|
Randomized controlled trial |
|||
|
Peyvandi, 2019 |
Italy |
19 |
Fanhdi, Alphanate |
|
Before and after studies with comparative data |
|||
|
Berntorp, 2005 |
Sweden |
35 |
Fraction1-0, Haemate/ Humate |
|
Berntorp, 2009 |
Europe |
15 |
Wilate |
|
Borel-Derlon, 2007 |
Europe |
4 |
Wilfactin |
|
Federici, 2010 |
Italy |
15 |
Fanhdi, Alphanate |
|
Holm, 2015 |
North America and Europe |
105 |
Not reported |
|
Before and after studies without comparative data |
|||
|
Berntorp, 2009
|
Europe |
15 |
Wilate |
|
Castaman, 2013 |
Italy |
31 |
Haemate |
|
Dunkley, 2010 |
Australia |
4 |
Biostate |
|
Federici, 2007 |
Italy |
12 |
Haemate |
|
Federici, 2010 |
Italy |
15 |
Fanhdi |
|
Khair, 2015 |
England |
4 |
Wilate |
|
Lillicrap, 2002 |
Canada |
20 |
Haemate/Humate |
|
Nowak-Gottl, 2013 |
Germany |
15 |
Wilate |
Tabel 7.2: Samenvatting van de evidence tabellen uit het recente review van de ASH-ISTH-WFH-NHF guideline for VWD. Voor de volledige tabellen wordt verwezen naar het systematic review.(El Alayli, 2022)
|
|
Uitkomst RCT |
Uitkomst observationele studies met vergelijking pre-post |
Uitkomst observationele studies zonder vergelijking pre-post |
|
Spontane bloedingen |
RR .62 (.37–1.04) |
n.v. |
n.v. |
|
Bloedingen |
Rate ratio .24 (.17–.35) |
Rate ratio .34 (.25– .46) 462 fewer per 1000 patient(s) per months (from 525 tot 378 minder) |
The pooled rate of bleeding episodes per patient per year when they were receiving prophylaxis was 3.20 (95% CI, 1.96–5.24 |
|
Tijd tot eerste bloeding |
Mediaan 31.4 days higher (8.44 higher to 54.36 higher) |
n.v. |
n.v. |
|
SAE |
RR 2.73 (.12– 59.57)d |
n.v. |
n.v. |
|
Neusbloeding |
Rate ratio .38 (.21–.67 |
n.v. |
n.v. |
|
Gewrichtsbloeding |
Rate ratio .50 (.06–4.50) 1 fewer per 1000 p |
n.v. |
|
|
Ziekenhuisopname |
n.v. |
Rate ratio .64 (.44– .93) |
n.v. |
|
Bloedtransfusie |
n.v. |
RR .4 (.1– 1.6) |
n.v. |
|
Menorragie |
n.v. |
The median rate per patient per year decreased by 9 episodes (median change [IQR], -9 [-9.3 to -6.0]). The median rate was 9.6 before prophylaxis and 0 after prophylaxis. |
n.v. |
n.v. = niet vermeld
Overwegingen
De bewijsvoering voor het gebruik van profylaxe bij VWD is zeer beperkt. Er is slechts één gerandomiseerde studie verricht en gepubliceerd met een beperkt aantal van 19 patiënten. De overige studies vergeleken het aantal bloedingen gedurende een periode voor start met profylaxe met een periode na start van profylaxe of werd de uitkomst na start profylaxe gerapporteerd.
In het systematic review van de ASH-ISTH-WFH-NHF richtlijn werd de GRADE (Grading of Recommendations Assessment, Development and Evaluation) aanpak gebruikt om de sterkte van het bewijs voor iedere uitkomst vast te stellen. Bewijs van RCTs begint bij sterk bewijs (high certainty), en wordt naarmate de bewijslast lager wordt verlaagd tot matig (moderate), laag (low) , of zeer laag (very low) op basis van onder andere risico op bias, inconsistentie, indirect bewijs, of publicatiebias. Bewijs van observationele studies start als laag en kan afhankelijk van verschillende factoren zowel naar sterker of minder sterk bewijs worden aangepast.
Op basis van deze beperkte bewijsvoering wordt in een recent uitgevoerde systematic review toch een mogelijk voordeel gezien van het starten van profylaxe bij patiënten die ernstige en frequente bloedingen hadden (El Alayli, 2022). Matig tot zeer laag bewijs van de RCT en de observationele studies suggereren dat profylaxe het risico op bloedingen, ziekenhuisopname, menorragie en neusbloedingen verlaagt en de tijd tot de eerstvolgende bloeding verlengt. Profylaxe kan ook het aantal spontane bloedingen en gewrichtsbloedingen verlagen.
Dit heeft geleid tot een voorlopige (“conditional”) aanbeveling om profylaxe te adviseren aan VWD patiënten met ernstige en frequente bloedingen.
In de ASH-ISTH guideline wordt geen advies gegeven over de dosering en frequentie van toedienen van VWF(/factor VIII) concentraat als er wordt gestart met profylaxe. Op basis van de literatuur en en eerdere richtlijnen is het advies om te starten met 2 x per week 40-50 IE VWF/kg intraveneus (Franchini, 2021). Bij onvoldoende resultaat kan de dosis worden verhoogd of de frequentie van doseren worden opgehoogd naar 3 maal per week. Het is van groot belang om samen met de patient de profylaxe periodiek te evalueren (bijvoorbeeld 2 x per jaar) om de voor-en nadelen van profylaxe af te wegen. Dit wordt mede geadviseerd omdat in tegenstelling tot bij ernstige hemofilie het bloedingspatroon bij VWD patiënten variabel is over de tijd (Connell, 2021).
Het is van belang om voor start van de profylactische behandeling de voor-en nadelen van lange termijn profylaxe met de patient te bespreken. Voor patiënten is het één of meerdere keren per week intraveneus toedienen van stollingsfactoren een forse belasting. Patiënten of de ouders moeten leren hoe zij de stollingsfactorconcentraten intraveneus moeten toedienen, zoals dat ook wordt gedaan door patiënten met ernstige hemofilie bij wie profylaxe een standaard behandeling is. Profylaxe is kostbaar door het frequent toedienen van dure VWF concentraten. In de verrichte studies en in het systematic review is geen kosten-effectiviteits analyse uitgevoerd om daarmee de gezondheidswinst in kaart te brengen. Theoretisch zou het regelmatig toedienen van VWF(/factor VIII) concentraat kunnen leiden tot een hogere kans op ontwikkelen van remmende antistoffen tegen VWF. Dit is een zeldzame complicatie van behandeling met VWF(/factor VIII) concentraat, die moeilijk te behandelen is en die kan leiden tot een anafylaxie. In de verrichte studies is dit zelden gerapporteerd.
Hoe is de prenatale diagnostiek en het beleid in de zwangerschap en bij de partus van vrouwen met de ziekte van Von Willebrand?
Aanbevelingen
Aanbevelingen m.b.t. de moeder met de ziekte van Von Willebrand (VWD)
Aanbevelingen m.b.t. prenatale diagnostiek
Aanbevelingen betreffende de neonaat met (mogelijk) VWD
Onderbouwing
Inleiding
Bij vrouwen zonder stollingsstoornis treedt een fysiologische stijging op van VWF en factor VIII tijdens de zwangerschap. Ten tijde van de bevalling pieken de waardes van factor VIII en vWF naar gemiddeld 270 IE/dL en 330 IE/dL (Huq, 2012; Szecsi, 2010). Vrouwen met VWD bereiken deze piekwaardes niet. Bovendien zakt de VWF en factor VIII activiteit binnen week na de bevalling weer terug tot bijna baseline, wat het risico op een late postpartum bloeding vergroot (Hawke, 2016; James, 2015; Sood, 2016). Een toenemend aantal retrospectieve klinische studies laat zien dat het risico op postpartum bloedingen bij vrouwen met VWD in de eerste 24 uur na de bevalling én het risico op late postpartum bloedingen sterk verhoogd is, ondanks behandeling. De kans op maternale sterfte is mogelijk 10x hoger t.o.v. de gezonde populatie. Uit een groot retrospectief Nederlands onderzoek bleek dat, ondanks het advies in de vorige landelijke richtlijn om de stolling te corrigeren bij een VWF:Act of FVIII:C <50 IE/dL rond de 30e zwangerschapsweek, in 38% van de bevallingen een postpartum bloeding (≥500 ml) optrad, zo’n 2x vaker in vergelijking met de algemene Nederlandse populatie (Bais, 2004; Leebeek, 2009; Stoof, 2015).
Conclusies
|
SORT grade |
Conclusie |
|
C |
Voor zwangere vrouwen met een verlaagde VWF / factor VIII activiteit is bevallen in een hemofiliebehandelcentrum sterk gewenst (expert opinion/consensus) |
|
C |
Een piekspiegel van VWF / factor VIII van 150 IE/dL ten tijde van de bevalling is meer fysiologisch dan 100 IE/dL en zou het aantal postpartum bloedingen mogelijk kunnen verminderen (expert opinion/consensus) |
|
C |
Een minimale duur van de stollingscorrectie met streefdalspiegels VWF en factor VIII activiteit ≥ 50 IE/dL van 3 dagen na een spontane vaginale bevalling en 5 dagen na een keizersnede is noodzakelijk (expert opinion/consensus) |
|
C |
Het gebruik van tranexaminezuur wordt sterk aanbevolen om de kans op zowel een directe als late postpartum bloeding te verminderen (expert opinion/consensus) |
|
C |
Er is geen contra-indicatie voor het uitvoeren van spinale of epidurale anesthesie mits de VWF / factor VIII activiteit ≥ 50 IE/dL bedragen rondom de procedure, maar overweeg af te zien van neuraxiale anesthesie bij type 3 VWD en houd bij type 2 VWD rekening met een (theoretisch) verhoogd bloedingsrisico (expert opinion/consensus; Pavord, 2017) |
|
C |
Bij een neonaat met (mogelijk) ernstige of matig ernstige VWD is een atraumatische partus noodzakelijk om de kans op perinatale bloedingen te verminderen (expert opinion/consensus) |
|
C |
Prenatale diagnostiek wordt aanbevolen bij een foetus mogelijk aangedaan met ernstige VWD (expert opinion/consensus) |
Samenvatting literatuur
Resultaten
Incidentie postpartumbloedingen bij de ziekte van Von Willebrand
In een groot retrospectief Nederlands cohort onderzoek naar 71 partussen van 61 vrouwen met type 1 en 2 VWD bleek dat in 38% van de bevallingen een postpartum bloeding (≥500 ml) optrad, ondanks profylactische behandeling bij een VWF:Act of FVIII:C <50 IE/dL rond de 30e zwangerschapsweek (Stoof, 2015). In een Zweedse retrospectieve observationele studie naar 34 vrouwen met 59 bevallingen was de incidentie van primaire postpartumbloedingen 44% en van secundaire postpartumbloedingen 12%. Patiënten met type 3 VWD liepen het grootste risico (mediane hoeveelheid bloedverlies type 1 VWD 450ml, n=39; type 2 VWD 425ml, n=14 en type 3 VWD 1374ml, n=4 bevallingen)(Govorov, 2017).
In een Amerikaanse studie gebaseerd op US Nationwide Inpatient Sample data tussen 2000-2003 hadden vrouwen met VWD (n=4067) een hogere kans op een postpartumbloeding (OR 1.5, 95%CI 1.1-2.0), bloedtranfusie (OR 4.7, 95%CI 3.2-7.0) en 10x hoger risico maternale sterfte geassocieerd met bloedtranfusie, in vergelijking met vrouwen zonder VWD (James, 2007). Malec et al. beschreven een PPH incidentie van 5.5% bij 506 vrouwen met VWD gebaseerd op ICD-9 codes in Pennsylvania (Malec, 2015). Het Centers for Disease Control and Prevention Universal Data Collection suveillance systeem in de USA heeft in 2009 een speciale vrouwen module ingebouwd voor de hemofiliebehandelcentra. Hierin werd bij 38% van 119 vrouwen met een stollingsstoornis en tenminste één zwangerschap (de meerderheid had VWD) een postpartum bloeding gerapporteerd (Byams, 2011). In een Noorse populatie registratiestudie hadden 3501 vrouwen een ernstige postpartum bloeding (1,1% > 1,5ltr) tussen 1999 en 2004 waarbij een duidelijke associatie werd gezien met VWD (ernstige postpartum bloeding bij 4,6% van 65 vrouwen met VWD: OR 3.31, 95%CI 1.01-10.9) (Al-Zirqi, 2008).
In een prospectieve observationele cohort studie, beschrijven James et al. (USA) geen excessief bloedverlies postpartum bij 35 zwangerschappen van 32 vrouwen met VWD. Wel zagen zij gemiddeld meer bloedverlies bij de bevalling van de vrouwen die behandeld waren met VWF(/factor VIII) concentraat (n=15) of DDAVP (n=2) in vergelijking met 24 type 1 VWD vrouwen die geen stollingsfactorcorrectie kregen (mediaan bloedverlies 615 vs. 448ml). Tranexaminezuur werd niet gegeven. Bloedverlies in het kraambed, geschat m.b.v. een aangepaste menstruatie scorekaart en Hb/Ht daling, was de eerste drie weken na de bevalling niet significant verschillend t.o.v. 40 gezonde controles, maar nadien wel significant meer tot 6 weken postpartum (James, 2015). In een andere prospectieve Amerikaanse studie was de mediane hoeveelheid bloedverlies 528ml bij 12 vrouwen met type 1 VWD, waarvan 1 vrouw een ernstige bloeding had bij uterusatonie en een andere vrouw een late postpartumbloeding had na 48u waarvoor DDAVP neusspray nodig was. Drie vrouwen waren behandeld met VWF(/factor VIII) concentraat bij de bevalling en in het kraambed en drie vrouwen rapporteerden een voorgeschiedenis van een postpartumbloeding (Sood, 2016).
Behandeling rondom de bevalling en prenatale diagnostiek bij vrouwen met VWD
Stollingsfactorcorrectie
Er zijn geen gerandomiseerde of observationele studies verricht naar de meest optimale target levels voor VWF/factor VIII rondom de bevalling bij vrouwen met VWD. Zoals hierboven beschreven blijkt echter de prevalentie van zowel primaire als late postpartum bloedingen hoog bij vrouwen met VWD, ondanks suppletie van stollingsfactoren met in internationale richtlijnen geadviseerde streefspiegel van 100 IE/dL ten tijde van de bevalling en dalspiegels > 50 IE/dL gedurende 3-5 dagen in het kraambed (Nichols, 2008; Pavord, 2017).
DDAVP
Er zijn geen gerandomiseerde studies gedaan naar het gebruik van DDAVP ter preventie van of behandeling van bloedingen bij zwangere vrouwen met een aangeboren stollingsstoornis (Karanth, 2015). Er is ervaring opgedaan met het gebruik van DDAVP tijdens de zwangerschap en bij de bevalling van vrouwen met VWD, waarbij een stijging van het factor VIII en VWF werd waargenomen en waarbij het middel veilig lijkt te kunnen worden gebruikt (Mannucci, 2005; Trigg, 2012). De meest recente UK richtlijn adviseert mede o.b.v. farmacologische overwegingen om als eerste keus DDAVP 0,3microgram/kg iv. te gebruiken om de VWF:Act en het factorVIII te corrigeren >50 IE/dL bij een bekende respons (Pavord, 2017).
Trombocytentransfusie
Bij patiënten met VWD type 2B met een verhoogde affiniteit van VWF voor GPIb is bekend dat het trombocytenaantal daalt tijdens de zwangerschap door de spontane stijging van het dysfunctionele VWF. Bij deze categorie patiënten is bij ongeveer de helft van de patiënten trombocytentransfusie rondom tenminste één bevalling gegeven (n=17 beschreven cases), meestal naast VWF suppletie (Biguzzi, 2015).
Tranexaminezuur
Tranexaminezuur leidt bij vrouwen zonder stollingsstoornis tot een significante afname van postpartum bloedingen en is bovendien geassocieerd met een afname van maternale mortaliteit wanneer een postpartumbloed ing optreedt (Li, 2017; Shakur, 2017). In het kraambed daalt de VWF activiteit binnen een week naar bijna baseline. Na drie weken is de waarde hetzelfde als voor de zwangerschap (James, 2015; Sood, 2016). Daarnaast neemt de fibrinolyse postpartum toe, door de verminderde synthese van placentair plasminogeen activator inhibitor-2 en een gelijktijdige stijging van tissue plasminogeen activator (Kouides, 2016). In een retrospectief statusonderzoek naar de uitkomst van 62 zwangerschappen bij 33 vrouwen met aangeboren stollingsstoornissen, waarvan 47 bij vrouwen met VWD, bleek dat de kans op een ernstige late bloeding in het kraambed significant lager was als tranexaminezuur na ontslag door gebruikt werd, zonder dat dit leidde tot trombose (Hawke, 2016). Er werd geen trombogeen effect gezien van tranexaminezuur in een grote retrospectieve analyse van 256 zwangere vrouwen met een stollingsstoornis, waarvan 168 een keizersnede ondergingen.
Neuraxiale anesthesie
Choi et al. vonden in de literatuur gegevens over 72 vrouwen met VWD waarbij epidurale en spinale anesthesie rondom de bevalling ongecompliceerd is verlopen, met in 10 gevallen vooraf stollingscorrectie, waaronder enkele type 3 VWD patiënten (Choi, 2009). Chi et al. rapporteerden 14 ruggenprikken rondom de partus (epiduraal, spinaal of beide) bij 13 VWD patiënten, zonder bloedingscomplicaties en waarbij vooraf geen stollingscorrectie nodig was (Chi, 2009). Sood rapporteert 7x epidurale anesthesie bij type 1 VWD zonder complicaties (Sood, 2016). Het risico op ernstige complicaties na neuraxiale anesthesie, zoals een spinaal/epiduraal hematoom, is erg klein, in de orde van 0.85 per 100.000 procedures (95%CI 0-1.8 per 100.000), waarbij de kans iets hoger is na epidurale t.o.v. spinale anesthesie. Vanwege deze lage incidentie is niet te kwantificeren in welke mate dit risico verhoogd is bij VWD patiënten rondom de bevalling, maar waarschijnlijk is het risico klein (Choi, 2009; Harrop-Griffiths, 2013; Moen, 2008). De meest recente UK richtlijn adviseert de VWF:Act en FVIII:C waarde te corrigeren >50 IE/dL vooraf insertie en verwijdering van een epidurale catheter en voor spinale anesthesie. Centrale neuraxiale anesthesie wordt in deze richtlijn afgeraden bij type 3 VWD en extra voorzichtigheid bij type 2 VWD geadviseerd, omdat in theorie de bijkomende trombocytendysfunctie niet goed zou kunnen worden gecorrigeerd met stollingsfactor suppletie (Pavord, 2017).
Neonatale uitkomsten
Er zijn geen cohort studies verricht naar het voorkomen van intracraniële bloedingen bij pasgeborenen met VWD. Echter neonaten met type 3 VWD hebben waarschijnlijk wel een verhoogd risico o.b.v. een sterk verlaagd VWF en factor VIII. Er is één case report beschreven van een pasgeborene met type 3 VWD en een hersenbloeding, mogelijk secundair aan een sinustrombose. Deze auteurs hebben in een database van zeer groot Deens geboortecohort laten nakijken of VWD was vastgesteld bij neonaten met een intracraniële bloeding na de geboorte, maar dit bleek niet het geval terwijl wel routinematig stollingsonderzoek werd verricht in voorkomende gevallen (Wetzstein, 2006). De meest recente UK richtlijn adviseert een atraumatische partus voor neonaten met (mogelijk) type 2 of type 3 VWD (Pavord, 2017).
Referenties
Bewijskracht literatuur
Level 3, consistent
Zoeken en selecteren
Er werd voor deze uitgangsvraag een brede systematische review verricht met de volgende zoektermen: “Inherited Bleeding Disorders”, “Hemophilia”, “Von Willebrand Disease”, “Pregnancy” and “Postpartum Hemorrhage”, zonder restricties. Dit resulteerde in 6788 publicaties waarvan er 5468 overbleven na ontdubbelen. Na titel en abstract screening werden 446 publicaties geselecteerd voor selectie o.b.v. de volledige tekst. Dit resulteerde in 81 relevante publicaties met originele patiënten data t.a.v. beleid rondom de bevalling (59 specifiek over VWD, 19 specifiek over hemofilie en 4 over beiden) en 213 andere relevante publicaties, waaronder reviews en richtlijnen. De overige publicaties werden geëxcludeerd op basis van het ontbreken van originele patiënt data (n=48) of full tekst niet beschikbaar (n=103).
Zoekverantwoording
De literatuursearch werd verricht in de volgende elektronische databases: CENTRAL, Cochrane library, MEDLINE, EMBASE, CINAHL. Na ontdubbelen zijn referentielijsten van geselecteerde artikelen en relevante reviews gecontroleerd op mogelijk relevante studies die gemist konden zijn bij de initiële search. Studies met originele patiëntendata, zowel observationeel (inclusief case series, case reports, cohort studies) als interventie studies (gerandomiseerd/quasi gerandomiseerd) werden geïncludeerd. Artikelen in een andere taal dan Nederlands, Engels of Duits en reviews zijn geëxcludeerd. Eén reviewer heeft titels en abstracts gescreend op mogelijke relevantie. Twee reviewers hebben onafhankelijk van elkaar alle beschikbare volledige teksten van mogelijk relevante artikelen gescreend op de in- en exclusie criteria.
Datum laatste literatuur search: 16-2-2018
Evidence tabellen
Geen
Overwegingen
Ad aanbeveling 1:
De meeste vormen van VWD tonen een autosomaal dominant patroon van overerving, waarbij de kans 1 : 2 is dat een kind van een vader óf moeder met VWD is aangedaan. Gezien de relatief hoge prevalentie van VWD is het bovendien aan te raden dat de partner van een VWD patiënt gescreend wordt d.m.v. hematologisch laboratorium onderzoek op VWD bij een verhoogde bloedingsneiging. Dit omdat een dubbele mutatie kan leiden tot een ernstiger fenotype met consequenties voor de partus. Wanneer de partner aangedaan is met VWD kan DNA-onderzoek uiteraard verricht worden, met de kanttekening dat niet altijd een mutatie wordt geidentificeerd en soms sprake is van een variant van onbekende betekenis (VUS). Overigens is bij type 1 VWD is de klinische penetrantie zeker geen 100% en kan bovendien in lang niet alle gevallen een oorzakelijke mutatie worden aangetoond (Goodeve, 2007). Wanneer de moeder VWD heeft, loopt zijzelf een verhoogd risico op een postpartum bloeding, met de nodige consequenties, zoals beschreven in deze richtlijn. Het is dan ook belangrijk dat aspirant ouderparen met VWD vooraf goed geïnformeerd zijn en eventuele DNA-diagnostiek tijdig laten inzetten. Type 3 VWD erft autosomaal recessief over (Goodeve, 1993). Het is daarom wenselijk dat liefst nog vóór de zwangerschap, of in elk geval ruim voor de partus, is onderzocht of de partner eveneens VWD (dragerschap) kan hebben: er is een verhoogde kans op een aangedaan kind indien de partner consanguin is, danwel familieleden heeft met VWD of zelf evidente bloedingssymptomen (zie ook Ad aanbeveling 6). Bij preconceptionele counseling is bij voorkeur een hemofilie behandelaar, klinisch geneticus en gynaecoloog (obstetricus) betrokken. Daarnaast zijn tijdens de zwangerschap bij counseling en het opstellen van een partusplan ook de anesthesist en kinderhematoloog betrokken.
Ad aanbeveling 2:
Het advies om de bevalling in een hemofiliebehandelcentrum te laten plaatsvinden is gebaseerd op de aanwezige expertise voor moeder en kind, vergoeding van stollingsfactoren en 24u beschikbaarheid van laboratoriumfaciliteiten om minimaal de FVIII:C te monitoren rondom de bevalling. Ruim voor de uitgerekende datum dient een partusplan te zijn opgesteld i.o.m. de hemofilie behandelaar, gynaecoloog, anesthesioloog en kinderarts. Het advies is om bij uiterlijk 24 weken zwangerschap een voorlopig partusplan klaar te hebben en dit zo nodig bij te stellen o.b.v. bereikte stollingswaarden in het 3e trimester. Dit plan wordt gedocumenteerd en besproken. In dit partusplan staat minimaal beschreven wat de diagnose is, het stollingsbeleid afhankelijk van de modus partus, het beleid ten aanzien van het kind, het beleid voor de anesthesioloog en eventuele noodzakelijke stollingscorrectie in het kraambed (Expert opinion/SORT Level 3C).
Voor vrouwen met milde vormen van VWD waarbij in het derde trimester van de zwangerschap de VWF:Act en FVIII:C gestegen zijn tot > 80 IE/dL en waarbij de neonaat geen (mogelijk) ernstige VWD heeft, hangt de locatie van de bevalling af van het individuele bloedingsfenotype van de vrouw en dient de locatie van de bevalling in het multidisciplinaire overleg te worden vastgesteld. Deze vrouwen mogen bij een minimale, persoonlijke bloedingsanamnese eventueel ook in de eerste lijn bevallen.
Ad aanbeveling 3:
Bij vrouwen zonder stollingsstoornis pieken de waardes van FVIII:C en VWF naar gemiddeld 270 IE/dL en 330 IE/dL ten tijde van de bevalling (Huq, 2012; Szecsi, 2010). Zwangere vrouwen met VWD bereiken deze fysiologische piekwaarden niet, wat een mogelijke verklaring vormt voor het verhoogde risico op postpartum bloedingen (Chi, 2008; James, 2015; Stoof, 2015). Vooral een ernstige postpartum bloeding vanaf 1000ml bloedverlies in de eerste 24uur na de bevalling is sterk geassocieerd met een verhoogde kans op maternale sterfte (Dahlke, 2015). Daarom is in de huidige richtlijn besloten om een hogere, meer fysiologische piekspiegel VWF:Act en factor VIII aan te houden ten tijde van de bevalling van 150 IE/dL. Dit beleid wordt in de prospectieve Prides studie geevalueerd.
De intensiteit van de stollingsmedicatie rondom de bevalling is afhankelijk van het stolfactor percentage in het derde trimester van de zwangerschap, waarbij het doseringsadvies uit de onderstaande tabel 8.1 als leidraad kan worden gebruikt. Er is bewust voor gekozen om DDAVP pas te gebruiken ná het afklemmen van de navelstreng, i.v.m. de beperkte ervaring tijdens de zwangerschap en mogelijke bijwerkingen voor de neonaat.
Tabel 8.1: Peripartum stollingscorrectie bij VWD
|
Stolfactorgehalte derde trimester |
In partu*¥ |
Na afklemmen navelstreng¥ |
Bij fluxus ≥500ml¥ † |
Kraambed¥ |
|
VWF ≥ 80 IE/dL en factor VIII ≥ 80 IE/dL |
– |
TXA |
DDAVP |
TXA zo nodig |
|
VWF en/of factor VIII < 80 IE/dL |
VWF(/factor VIII) concentraat |
TXA |
Overweeg extra stolfactor concentraat of DDAVP |
TXA en VWF(/factor VIII) concentraat indien VWF/factor VIII < 50 IE/dL zakt |
|
Type 2B VWD trombocyten aantal (naast stolfactor o.b.v.bovenstaande streefwaarden) |
Trombocyten concentraat indien trombocyten aantal <50 x 109/l |
TXA |
Overweeg extra trombocyten concentraat afh. trombocytenaantal |
TXA en VWF(/factor VIII) concentraat indien VWF/factor VIII < 50 IE/dL zakt |
Legenda: TXA= Tranexaminezuur; VWF= Von Willebrandfactor activiteit; DDAVP= desmopressine (Minrin®); *In partu: verwachtte uitdrijving < 2uur; ¥ Zie tekst hieronder voor Streefwaarden en Dosering; †daarnaast behandeling volgens lokale fluxus protocol.
Streefwaarden
Indien de VWF activiteit niet cito beschikbaar is: varen op de cito factor VIII uitslagen.
Doseringen
LET OP vochtbeperking gedurende 24 uur na DDAVP: vochtinname = maximaal de vochtoutput (inclusief bloedverlies) + 1 ltr. Contra-indicatie: hyponatriemie en (relatief) pre-eclampsie/HELLP syndroom i.v.m. het risico op vochtretentie en hyponatriemie.
LET OP: Haemate P bevat 2400 E VWF:Act per 1000 E FVIII:C. Wilate bevat 500 E VWF:Act per 500 E FVIII:C. Wilfactin bevat per 1000 E VWF:Act nauwelijks FVIII:C. Veyvondi bevat alleen VWF en slechts sporen FVIII.
NB Er is geen contra-indicatie voor profylactisch LMWH in het kraambed zolang de stolling volledig gecorrigeerd/genormaliseerd is. Het gebruik van DDAVP, tranexaminezuur en/of stollingsfactor vormt géén contra-indicatie voor het geven van borstvoeding (https://www.lareb.nl/teratologie-nl/borstvoeding/).
Ad aanbeveling 4:
Het is aan te raden 1000mg tranexaminezuur intraveneus te geven bij de bevalling, na het afklemmen van de navelstreng, omdat dit ook bij vrouwen zonder stollingsstoornis leidt tot een significante afname van postpartum bloedingen en bovendien geassocieerd is met een afname van maternale mortaliteit indien een postpartumbloeding optreedt (Li, 2017; Shakur, 2017). Daarnaast neemt de fibrinolyse postpartum toe, door de verminderde synthese van placentair plasminogeen activator inhibitor-2 en een gelijktijdige stijging van tissue plasminogeen activator (Kouides, 2016) In de literatuur is beschreven dat het aantal late nabloedingen in het kraambed verminderde als tranexaminezuur langer door gebruikt werd, zonder dat dit leidde tot trombose (Hawke, 2016) Het is onbekend hoe lang Tranexaminezuur dient te worden voorgezet na de bevalling. In de studie van Hawke et al. varieerde de behandelduur van 5 dagen tot 6 weken postpartum (mediaan 3 weken, n=36). Het lijkt raadzaam om de behandeling met Tranexaminezuur in elk geval te continueren zolang de noodzakelijke frequentie van het verschonen van kraamverbanden nog hoog is (bijvoorbeeld vaker dan elke 3 uur). Het gebruik van Tranexaminezuur vormt géén contra-indicatie voor het geven van borstvoeding. Het middel gaat in kleine hoeveelheid wel over in de moedermelk, maar hiervan zijn geen schadelijke effecten bekend (https://www.lareb.nl/teratologie-nl/borstvoeding/).
Ad aanbeveling 5:
Het risico op ernstige complicaties na neuraxiale anesthesie, zoals een spinaal/epiduraal hematoom wordt bij VWD na spontane normalisatie o.b.v. stollingsfactorsuppletie in de literatuur als zodanig laag ingeschat dat dit in elk geval niet opweegt tegen het toegenomen risico van algehele anesthesie bij een keizersnee. Ook voor het ontraden van epidurale anesthesie t.b.v. pijnstilling tijdens de bevalling zijn de bloedingsrisico’s te laag. Wel is aan te raden, met het oog op de spaarzame literatuurgegevens voor deze categorie patiënten, om ook alternatieve mogelijkheden voor pijnstilling te bepreken. In overeenstemming met internationale richtlijnen is er geen contra-indicatie voor neuraxiale anesthesie na normalisatie van de stollingswaarden bij VWD: VWF:Act en FVIII:C >50 IE/dL L. LET OP deze streefwaarden gelden ook bij het verwijderen van een eventueel epiduraal katheter (Choi, 2009; Harrop-Griffiths, 2013; Moen, 2008). Overigens ontraadt de meest recente UK richtlijn centrale neuraxiale anesthesie bij type 3 VWD en wordt extra voorzichtigheid bij type 2 VWD geadviseerd, omdat in theorie de bijkomende trombocytendysfunctie niet goed kan worden gecorrigeerd met stollingsfactor suppletie (Pavord, 2017). Volg ten aanzien van trombocytopenie de aanbevelingen van de NVA-richtlijn neuraxisblokkade. In elk geval dienen alle zwangere vrouwen met VWD de mogelijkheid te krijgen om de voor- en nadelen van de verschillende opties voor pijnstilling tijdens de bevalling vooraf te bespreken met een ervaren anesthesioloog.
Ad aanbeveling 6:
Zwangeren met een verhoogd risico op een kind met een ernstig type VWD horen gezien te worden vroeg in het eerste trimester in een hemofiliebehandelcentrum. Het advies is hen tevens te verwijzen naar een de klinisch geneticus. De klinisch geneticus kan aan de hand van de familieanamnese nazoeken of de oorzakelijke mutatie bij patiënte of in de familie reeds bekend is ofwel genetisch onderzoek verrichten (bij voorkeur echter preconceptioneel, zie Ad 1). Dit geldt dus ook als de aanstaande vader een autosomaal dominante vorm van ernstige type 1 of type 2 VWD heeft. Type 3 VWD erft autosomaal recessief over.
Als de zwangere of haar partner is aangedaan met een ernstige vorm van VWD type 3 met autosomaal recessieve overerving, zijn de risico’s voor het kind op het hebben van VWD afhankelijk van de kans op dragerschap bij de partner. Ga na of de partner een verhoogde kans heeft om ook een drager of draagster te zijn. Bijvoorbeeld als er sprake is van een consanguine relatie of bij een positieve familieanamnese.
Het tijdstip van invasieve, prenatale diagnostiek hangt samen met de keuze van de zwangere en haar partner in overleg met de klinisch geneticus. Indien het paar kiest voor beëindiging van de zwangerschap als de foetus een ernstige vorm van VWD heeft, dan wordt verwezen naar de gang van zaken zoals beschreven in de richtlijn hemofilie. Dit is zelden het geval. Indien het paar kiest voor een vruchtwaterpunctie om de diagnose van een ernstige vorm van VWD vast te stellen ten behoeve van het obstetrisch beleid, wordt dit rond 32-34 weken zwangerschap verricht. Er is waarschijnlijk geen verhoogde kans op een vroeggeboorte of foetale complicatie bij een vruchtwaterpunctie in het derde trimester. Direct voorafgaande aan een eventuele vlokkentest of vruchtwaterpunctie dient wel zo nodig aan de moeder stollingsfactorcorrectie te worden gegeven m.b.v. VWF(/factor VIII) concentraat met eenmalig een beoogde piekspiegel FVIII:C en VWF:Act ≥ 50 IE/dL.
Het doel van de late vruchtwaterpunctie is het aanpassen van het beleid durante partu indien de foetus een ernstige vorm van VWD heeft, aangezien dan een atraumatische partus dient te worden nagestreefd. Als er sprake is van een ernstige vorm van VWD, dan bestaat er naast een atraumatische partus ook een indicatie voor een bevalling in een ziekenhuis met een hemofiliebehandelcentrum. Bij een neonaat met (mogelijk) ernstige VWD, d.w.z. ernstige type 1, type 2 en type 3 VWD is het advies de bevalling zo atraumatisch mogelijk te laten verlopen, conform de richtlijn bij hemofilie. Als niet bekend is of de foetus mogelijk is aangedaan met mogelijk ernstige VWD, is er ook een indicatie voor een bevalling in een ziekenhuis met een hemofiliebehandelcentrum. Bij een ‘atraumatische partus’ zijn het plaatsen van een schedelelektrode, het doen van microbloedonderzoek, een vaginale stuitbevalling en met name een vaginale kunstverlossing (vacuüm- en forcipale extractie) alsook intramusculaire injecties bij de neonaat gecontra-indiceerd.
Omdat het advies ‘atraumatische partus’ bij een foetus met een ernstige vorm van VWD er in de praktijk toe leidt dat sneller wordt overgegaan tot een keizersnede met daarbij behorende hogere maternale risico’s, is het belangrijk om in het geval van een verhoogde kans op een foetus met ernstige vorm van VWD expliciet de mogelijkheid van prenatale diagnostiek ten behoeve van het obstetrische beleid, in het bijzonder m.b.t. het beleid gericht op de foetus, met het paar te bespreken. De maternale risico’s van een keizersnede zijn niet alleen geldend voor de index zwangerschap maar ook voor de zwangerschappen daarna.
Ad aanbeveling 7:
Intracraniële bloedingen zijn zelden beschreven bij neonaten met VWD, slechts een enkele casus. Een keizersnede dient daarom alleen te worden verricht op obstetrische indicaties. Op theoretische gronden is het advies de bevalling zo atraumatisch mogelijk te laten verlopen bij een neonaat met (mogelijk) ernstige VWD, d.w.z. type 1 met onvoldoende respons op DDAVP, type 2 en type 3 VWD, conform de richtlijn bij hemofilie. In noodsituaties waarbij conversie naar een sectio meer risico’s oplevert dan een kunstverlossing, heeft een forcipale extractie de voorkeur boven een vacuümextractie. Bij een instrumentele bevalling dient altijd de kinderarts geconsulteerd te worden om een intracraniële bloeding uit te sluiten en zo nodig met spoed bloedstollingsdiagnostiek in te zetten.
Bij neonaten met (mogelijk) niet-ernstige type 1 VWD is het bloedingsrisico rondom de partus dermate laag door spontane stijging van VWF en factor VIII rondom de partus, dat dit niet opweegt tegen de hogere maternale risico’s bij een atraumatische partus. Type 1 VWD wordt als niet-ernstig beschouwd als de aangedane ouder een goede respons heeft op DDVAP, danwel spontane normalisatie van VWF:Act en FVIII:C in de loop van de zwangerschap (stijging VWF:Act en FVIII:C ≥80 IE/dL) (Kadir, 1998; Lak, 2000; Nichols, 2008; Wetzstein, 2006).
Hoe is de diagnostiek en het beleid bij hevig menstrueel bloedverlies (HMB) bij (jonge) vrouwen met de ziekte van Von Willebrand?
Aanbevelingen
Onderbouwing
Inleiding
Menstruaties vormen een belangrijke uitdaging voor (jonge) vrouwen met VWD. Hevig menstrueel bloedverlies (HMB) heeft effect op vele aspecten van de kwaliteit van leven, zowel fysiek als mentaal. Het kan leiden tot ijzergebreksanemie, verzuim van school en werk, problemen met de (seksuele) relatie en sociale problemen (Govorov, 2016).
Het is bekend dat de subjectieve klacht ‘hevig menstrueren’ in vrouwen zonder stollingsstoornis slecht correleert met de objectief gemeten hoeveelheid bloedverlies. Door een groep internationale experts is met behulp van een Delphi-procedure overeenstemming bereikt over wat beschouwd mag worden als een ‘normale’ menstruatie: cyclusduur 24 tot 38 dagen, variatie 2 tot 20 dagen (tussen de langste en de kortste cyclus gedurende een jaar), menstruatieduur 4,5 tot 8 dagen en hoeveelheid bloedverlies 5 tot 80 ml per menstruatie.
De menarche treedt gemiddeld op rond de leeftijd van 12,5 jaar. De eerste jaren hebben de menstruaties in het algemeen vaak een wisselend beloop. Er zijn geen heldere parameters gedefinieerd voor normale perimenarchale menstruaties. De NICE richtlijn definieert HMB bij adolescenten dan ook niet kwantitatief, maar als overmatig menstrueel bloedverlies dat interfereert met de fysieke, emotionele, sociale en materiele kwaliteit van leven van de adolescente, welke alleen of in combinatie met andere symptomen kan optreden (Munro, 2018). Anovulatie wordt regelmatig gezien in adolescenten in combinatie met ovulatoire dysfunctie, waardoor, als gevolg van de afwezigheid van een functioneel corpus luteum, er te weinig progestagenen zijn en er een relatief overschot is van oestrogenen die effect hebben op het endometrium. Door deze disbalans kan hevig menstrueel bloedverlies ontstaan. Longitudinale studies hebben aangetoond dat bij de meeste adolescenten de cyclus binnen de “normale” en voorspelbare menstruatie grenzen valt na 3 jaar (Flug, 1984; Slap, 2003).
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Er zit een grote discrepantie tussen de gerapporteerde prevalentie van HMB onder vrouwen met VWD en de prevalentie van besproken problemen (De Wee, 2011; van Galen, 2020). |
|
C |
De prevalentie van ijzergebrek bij vrouwen met HMB is hoog (Wang, 2013). |
|
C |
Aanvullend onderzoek wegens HMB is niet geïndiceerd bij vrouwen <45 jaar zonder onregelmatig of intermenstrueel bloedverlies en contactbloedingen, tenzij eerstelijns behandeling faalt (NVOG, 2020). |
|
B |
DDAVP heeft mogelijk iets minder effect op HMB dan tranexaminezuur (Kouides, 2009) |
|
C |
Het effect van orale anticonceptie op menstruele problemen bij VWD is wisselend (Foster, 1995; Kouides, 2000) |
|
B |
Orale anticonceptie lijkt minstens even effectief als DDAVP in verminderen van het menstrueel bloedverlies (Amesse, 2005) |
|
B |
Een levonorgestrel-bevattend intrauterien device kan effectief zijn in vrouwen met VWD die falen op orale anticonceptie, met mogelijk een iets hogere kans op expulsie of malpositie (Chi, 2011; Huguelet, 2021) |
Samenvatting literatuur
Resultaten
Diagnostiek
Menstruatiescorekaart
Menstruatieproblemen worden gerapporteerd door 60-90 procent van de vrouwen met VWD (Byams, 2011; De Wee, 2011; Lavin, 2018; Ragni, 2016). Echter, behandelaren van vrouwen met stollingsstoornissen geven aan dat slechts een klein deel (0-25%) van hun patiënten medisch advies zoekt voor HMB (van Galen, 2020). Tevens is het belangrijk te realiseren dat ook ongeveer 10-35% van de vrouwen zonder stollingsstoornis aangeeft HMB te hebben, hoewel slechts 40-50% van deze vrouwen meer bloedverlies heeft dan 80 ml (Chimbira, 1980; Fraser, 1984).
Kwantificeren van de hoeveelheid bloedverlies wordt in wetenschappelijke studies veelal gedaan met behulp van de menstruatiescorekaart, in de internationale literatuur aangeduid met PBAC (pictorial blood loss assessment chart) waarbij een waarde >100 wordt beschouwd als HMB (Higham, 1990). De PBAC wordt ook gebruikt om het effect van interventies op HMB te evalueren.
Objectieve aanwezigheid van HMB (PBAC >100) werd gezien in 73% van de patiënten met VWD met een trend naar hogere PBAC scores bij een vWF:Act <30 IE/dL (p=0.07) (Kadir, 1999).
In de evaluatie van adolescenten met HMB wordt geadviseerd om ook kwaliteit van leven mee te nemen. Adolescenten met HMB missen meer dagen op school per menstruatie, hebben verminderde sportparticipatie en zeggen vaker afspraken met betrekking tot hun hobby’s of sociale contacten af dan adolescenten zonder hevig menstrueel bloedverlies (Wang 2013).
Overig onderzoek
HMB kan leiden tot ijzergebrek en/of (ijzergebreks)anemie. In een studie onder adolescente vrouwen met HMB had 87,5% een serum ferritine <40µg/L en 29,2% <15µg/L (Wang, 2013). Studies die naar de prevalentie hiervan bij vrouwen met HMB en VWD hebben gekeken, ontbreken (VanderMeulen, 2018). Ijzergebrek(sanemie) kan gepaard gaan met vermoeidheidsklachten die de kwaliteit van leven kunnen verminderen. Laagdrempelig controle van de ijzerstatus en het bloedbeeld en laagdrempelig suppletie kan dit voorkomen (Johnson, 2016).
Gynaecologisch onderzoek
In de NVOG richtlijn ‘Hevig menstrueel bloedverlies (HMB)’ uit 2020 wordt gemeld dat standaard speculumonderzoek bij HMB niet wordt ondersteund door literatuur (NVOG, 2020). Er is ook geen literatuur over de vraag of cervixcytologie en Chlamydia onderzoek een rol heeft in de evaluatie van HMB. Er wordt één studie beschreven waarin gekeken is naar endometriumpathologie en HMB, waarin dit alleen bij vrouwen ouder dan 45 jaar endometriumdiagnostiek zinvol lijkt. In deze groep is de sensitiviteit voor atypie 69% en specificiteit 63%, voor carcinoom 70% en 63% (Iram, 2010). Ook in de NICE richtlijn wordt geadviseerd alleen endometriumdiagnostiek te verrichten bij HMB bij vrouwen ouder dan 45 jaar of indien ingezette therapie ineffectief is of faalt (NICE, 2007).
Als er naast HMB sprake is van onregelmatig of intermenstrueel bloedverlies dan wel contactbloedingen is er mogelijk wel een plaats voor speculumonderzoek om een mogelijke cervixpoliep of ectropion op te sporen, of cervix cytologie en/of PCR Chlamydia af te nemen (NVOG, 2020).
Behandeling
Er zijn verschillende behandelopties voor HMB bij VWD. Een surveillance in de Verenigde Staten onder 319 meisjes en vrouwen met stollingsstoornissen waarvan 283 met VWD liet zien dat 165 van de 217 (76%) menstruerende participanten HMB meldde (Byams, 2011). De meest gebruikte behandeling was orale anticonceptie (54,5%), gevolgd door desmopressine (DDAVP) (33,9%) en antifibrinolytica (24,2%).
Tranexaminezuur en DDAVP
In een cohortstudie van 37 vrouwen met een stollingsstoornis-gerelateerd HMB was tranexaminezuur succesvol in 40% (PBAC <100) (Kadir, 2005). Dezelfde groep verrichtte ook een dubbelblinde placebo gecontroleerde cross-over studie naar het effect van intranasaal DDAVP in 39 vrouwen waarvan 22 met VWD (Kadir, 2002). In beide groepen was de PBAC significant lager in de tweede behandelperiode dan in de eerste. Na correctie hiervoor was er slechts een minimaal lagere PBAC score in de vrouwen die DDAVP kregen dan placebo (verschil 8; 95% CI -15,5 tot 31,6).
Er is één studie die het effect van intranasaal DDAVP heeft vergeleken met tranexaminezuur gedurende twee menstruatie cycli in 116 patiënten met een PBAC >100, negatieve gynaecologische evaluatie en een stollingsstoornis (Kouides, 2009). De studie had een cross-over design waarbij de twee volgende cycli het andere medicament werd gegeven. Slechts 8 van deze patiënten hadden VWD, het overgrote merendeel had een trombocytenaggregatiestoornis. DDAVP leidde tot een verlaging van de PBAC van -64,1 (95%CI = -88,0; -40,3) versus -105,7 (95%CI -130,5; -81,0) voor tranexaminezuur (p=0,0002). Zowel DDAVP als tranexaminezuur leidden tot een verbetering van kwaliteit van leven en er was geen duidelijk verschil in bijwerkingen hoewel het slechts een korte follow up betrof.
Orale anticonceptiva
Het effect van orale anticonceptiva op HMB in (jonge) vrouwen met VWD wordt wisselend beschreven. In een enquête onder vrouwen met VWD niet responsief op DDAVP was orale anticonceptie effectief in 22 van de 25 (88%) vrouwen (Foster, 1995). Anderzijds beschrijven Kouides et al een effectiviteit van slechts 24% in vrouwen met VWD type 1 behandeld met standaard doseringen orale anticonceptie en 37% bij hoge dosering (Kouides, 2000).
Oestrogenen hebben invloed op de groei van kinderen. Lage doseringen versterken de groei en hoge doseringen remmen de groei en stimuleren de fusie van de epifyse (Eastell, 2005). Gedurende de puberteit neemt de oestrogeen productie langzaam toe. Oestrogenen spelen dus een belangrijke rol in de groeispurt, maar ook in het eindigen van de groei en sluiting van de groeischijven in de puberteit. Op het moment van de menarche is 95% van de lengtegroei van adolescenten voltooid (Venkateswaran, 2013). De exogene toediening van hoge doseringen oestrogenen bij jonge meisjes die nog recent hun menarche hebben gehad, heeft dus weinig effect op de totale lengtegroei. Combinatie preparaten met ultra lage doseringen oestrogenen (10 microgram) verhogen het risico op doorbraakbloedingen (Altshuler, 2014) en worden daarom niet aangeraden.
DDAVP versus orale anticonceptiva
Er is één retrospectieve cohortstudie waarin het effect van intranasale DDAVP werd vergeleken met orale anticonceptiva (Amesse, 2005). Het effect op de PBAC score werd bepaald in 36 adolescenten met VWD type 1 met een follow up duur van minimaal zes maanden, mediaan 30 maanden. Veertien patiënten werden behandeld met OAC, met een effectiviteit van 86% (12/14). Er werden geen bijwerkingen gemeld. De twee meisjes die geen effect hadden werden nadien behandeld met hoge dosis oestrogenen. In de DDAVP groep was de effectiviteit 77% (17/22). In 23% (5/22) waren er bijwerkingen (milde tot matige hoofdpijn en flushing). Er werden geen ernstige bijwerkingen gerapporteerd.
Levonorgestrel-bevattend intra-uterien device (IUD)
Er zijn enkele case series die het effect van levonorgestrel-bevattende IUDs bij vrouwen met VWD beschrijven. Huguelet et al rapporteren een verbetering van menstruele bloedingen in 27/33 meisjes en vrouwen waaronder 16 met VWD die bijna allemaal minimaal één ander hormonaal prepraat hadden geprobeerd voor IUD (Huguelet, 2021). In 3 gevallen (één met VWD) was er sprake van expulsie ondanks stollingscorrectie voor insertie. In een andere retrospectieve studie met 13 patiënten (11 met VWD) die faalden op andere hormonale therapie (n=13) of hemostatische behandeling (antifibrinolytica, DDAVP, n=8) verbeterde de HMB in alle patiënten na IUD plaatsing (Adeyemi-Fowode, 2017). Chi et al beschrijven langdurig effect in 13 vrouwen met VWD met een mediane follow-up van 33 maanden (Chi, 2011).
Rimmer et al onderzochten of de kans op malpositie en expulsie verhoogd is bij vrouwen met een stollingsstoornis (n=20, waarvan 13 met VWD) (Rimmer, 2013). Dit trad op in 25% van de gevallen en in nog eens 25% van de vrouwen werd het device verwijderd wegens onvoldoende effect. Dit komt mogelijk door de hevigere bloedingen in de eerste 30 dagen na insertie. De expulsie frequentie is echter laag en was in twee andere studies met 8% en 9% vergelijkbaar met de algehele populatie (Adeyemi-Fowode, 2017; Huguelet, 2021). Er is geen bewijs dat stollingscorrectie rondom plaatsing het risico op expulsie kan verlagen.
Stollingsfactorcorrectie
VWF(/factor VIII) concentraat wordt over het algemeen pas als derdelijns therapie voorgeschreven. In patiënten met ernstige hemofilie is het een belangrijke reden om profylaxe te starten (Abshire, 2013). Er zijn geen observationele of gerandomiseerde studies verricht naar de target levels voor VWF/factor VIII. Uit een rondgang langs 20 hemofilie behandelcentra bleek dat meestal 50 IE/kg VWF(/factor VIII) concentraat voor 5 dagen wordt gegeven, maar met een brede range in dosis en frequentie (33-100 IE/kg over 1-6 dagen) (Ragni, 2016). Er wordt een goed effect van VWF(/factor VIII) concentraat op HMB gemeld met weinig bijwerkingen.
Multidisciplinaire begeleiding
Multidisciplinaire begeleiding van (jonge) vrouwen met HMB leidt tot snellere diagnose, controle van de bloeding en het meest efficiënt gebruik van medische mogelijkheden. Daarnaast leidt een multidisciplinaire benadering tot tevredenheid bij patiënten met HMB (Lee, 2006). Idealiter bestaat een multidisciplinair team in de diagnose en behandeling van HMB uit een (kinder)hemofiliebehandelaar, een (kinder)gynaecoloog, een verpleegkundige en een maatschappelijk werker (Borzutzky, 2020).
Referenties
Bewijskracht literatuur
Level 3, consistent.
Zoeken en selecteren
Er werd voor deze uitgangsvraag geen systematisch literatuuronderzoek verricht. Er werd gebruik gemaakt van de recente richtlijn van de ASH/ISTH/NHF/WFH 2021 over de behandeling van VWD (Connell, 2021) en bijbehorend artikel met de literatuuronderbouwing (Brignardello-Petersen, 2022), de richtlijn ‘Hevig menstrueel bloedverlies (HMB)’ van de NVOG, aangevuld met bij de auteurs bekende relevante recente studies.
Zoekverantwoording
Niet van toepassing.
Evidence tabellen
Voor evidence tabellen aangaande de vergelijking DDAVP versus tranexaminezuur en DDAVP versus hormonale behandeling bij vrouwen met VWD en HMB verwijzen we naar het recente artikel van Brignardello-Petersen.
Overwegingen
In de behandeling van (jonge) vrouwen met VWD en HMB is het belangrijk te beseffen dat VWD een erfelijke ziekte is en er daardoor misvattingen zijn over wat ‘normaal’ is. Bovendien kan er nog steeds een barrière gevoeld worden om te praten over menstruatieproblemen. Als zorgverlener is het van belang deze barrière weg te nemen en het onderwerp proactief bespreekbaar te maken.
Naast medicamenteuze opties is het ook van belang niet-medicamenteuze mogelijkheden bespreekbaar te maken. Er zijn vele verschillende sanitaire mogelijkheden waar (jonge) vrouwen uit kunnen kiezen. Een gestructureerd consult met een verpleegkundige met affiniteit voor dit onderwerp kan hierin bijdragen.
Bij het voorschrijven van orale anticonceptie is het van belang na te gaan of er een mogelijk verhoogd risico is op bijwerkingen, in het bijzonder op trombose (veneuze trombo-embolie in het verleden of bij een eerste-graadsfamilielid, trombofilie) of endometriale hyperplasie/maligniteiten (vrouwen >35 jaar) en cardiovasculaire complicaties (polycysteuze ovaria, hoge body mass index, en co-morbiditeiten zoals diabetes en hypertensie).
Bij adolescenten is het van belang het effect van oestrogenen op de lengtegroei mee te wegen. Voor meisjes met een relatief kleine eindlengte kan het wenselijk zijn om oestrogeen suppletie uit te stellen tot de lengtegroei is voltooid. Tranexaminezuur is dan een logische eerste keus, eventueel in combinatie met DDAVP. Maar er kan ook gekozen worden voor progestageen-only hormonale therapie zoals de desogestrel of lynestrenol. Hierbij dient wel opgemerkt te worden dat deze niet allemaal geregistreerd zijn als anticonceptivum.
Ook voor adolescenten is de levonorgestel-bevattend IUD veilig en effectief. Hoewel studies laten zien dat het plaatsen van deze IUDs met goede begeleiding zonder anesthesie ook mogelijk is bij adolescenten die nog niet seksueel actief zijn en nullipari (Borzutzky, 2020), zijn er ook veel opties in Nederland om dit in deze groep onder anesthesie te doen. Verwijzing naar een (kinder)gynaecoloog voor het bespreken van de opties en goede begeleiding hierin dient dan ook sterk overwogen te worden.
In de keuze voor behandeling van HMB bij VWD is shared decision making van belang. Bij patiënten kunnen persoonlijke waarden en gevoelens meespelen ten aanzien van hormonale therapie evenals ervaren bijwerkingen op DDAVP (Connell, 2021).
Onder welke omstandigheden kunnen trombocytenaggregatieremmers en/of antistolling veilig worden gegeven bij patiënten met de ziekte van Von Willebrand?
Bij het starten van behandeling met anticoagulantia en trombocytenaggregatieremmers bij patiënten met VWD dient de afweging gemaakt te worden tussen risico op trombose en het risico op bloedingen. De kans op bloedingen bij gebruik van deze middelen is hoger bij VWD patiënten dan in de algemene populatie. Of patiënten met VWD preventief of therapeutisch dienen te worden behandeld ter voorkoming of bij het optreden van trombose is in deze uitgangsvraag uitgewerkt. Daarbij zijn vijf klinisch relevante subuitgangsvragen uitgewerkt.
In deze uitgangsvraag wordt de volgende terminologie aangehouden:
Onder welke omstandigheden kunnen antitrombotica veilig worden gegeven bij de behandeling van acuut coronair syndroom in patiënten met VWD?
Aanbevelingen
Onderbouwing
Inleiding
Deze uitgangsvraag beschrijft of aan patiënten met VWD en cardiovasculaire ziekten, voor wie behandeling nodig is met trombocytenaggregatieremmers of anticoagulantia, deze behandeling moet worden gegeven.
Voor de behandeling van arteriële of veneuze trombose zijn trombocytenaggregatieremmers of antistolling de hoeksteen van behandeling en preventie. Aspirine reduceert de kans op coronaire hartziekte en herseninfarct en reduceert de mortaliteit met 10% (Visseren, 2021). Bij patiënten die recent een coronaire stent plaatsing hebben ondergaan of patiënten met een hoog recidief risico op coronair lijden is dubbele (duale) trombocytenaggregatieremming geïndiceerd. Individuen met atriumfibrilleren hebben, afhankelijk van de risicoscore, grote kans op het ontwikkelen van cerebrale ischemie. Deze patiënten worden daarom behandeld met anticoagulantia, zoals directe werkende orale anticoagulantia (DOAC) of vitamine K antagonisten (VKA). De belangrijkste bijwerking van trombocytenaggregatieremmers en antistollingsmiddelen is het optreden van bloedingen. Het risico op bloedingen zal hoger zijn bij patiënten die een erfelijke stollingsstoornis hebben, zoals hemofilie of VWD (Schutgens, 2009, Martin 2016). Daarom is van groot belang om af te wegen of bij VWD patiënten trombocytenaggregatieremmers of antistollingsmedicatie veilig kunnen worden gegeven.
Patiënten met VWD hebben een lager risico op het ontwikkelen van arteriële trombose, zoals herseninfarct of acuut coronair syndroom (Sanders 2013, Seaman 2015). Dit lijkt met name veroorzaakt te worden door verminderde trombus vorming (hypocoagulabiliteit), want in verschillende studies is aangetoond dat de mate van atherosclerose vergelijkbaar is in patiënten met VWD ten opzichte van de controle populatie (Sramek,2004; Biere-Rafi, 2010; Zwiers, 2013). Toch presenteren zich in de dagelijkse praktijk steeds meer VWD patiënten met een trombotisch event waarvoor trombocytenaggregatieremmers of anticoagulantia noodzakelijk zijn. Dit wordt onder andere veroorzaakt door een stijging van de levensverwachting, waardoor de kans op veneuze en arteriële trombose toeneemt. Dit is ook bevestigt in de EUHASS database, waarin sinds 2008 355 arteriële en veneuze trombotische complicaties zijn gerapporteerd in patiënten met VWD (www.euhass.org). Bij de overweging om antitrombotica voor te schrijven bij patiënten met VWD worden de volgende vier factoren meegewogen: bloedingsfenotype van de patiënt, de eigenschappen van antitrombotica, de intensiteit van de antistolling, en duur van de behandeling (Martin, 2016).
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Patiënten met VWD hebben een lager risico op het ontwikkelen van ischemische cardiovasculaire aandoeningen (Sanders, 2013; Seaman 2015) |
|
C |
Behandeling van een acuut coronair syndroom met percutane coronair interventie volgens de huidige cardiologische richtlijn kan in patiënten met VWD veilig plaatsvinden met adequate substitutietherapie (Rathore, 2013; Fogarty, 2016; Cohen, 2021) |
Samenvatting literatuur
Resultaten
Er is weinig literatuur beschikbaar over percutane coronaire interventies met stent plaatsing (PCI) voor het acuut coronair syndroom (ACS) bij patiënten met VWD. Dit beperkt zich tot enkele case-series van patiënten, die succesvol een interventie hebben ondergaan (Rathore, 2013; Cohen, 2021). Fogarty et al. onderzochten de wijze en uitkomst van de behandeling van ACS in patiënten met VWD. Dit Amerikaanse onderzoek maakte gebruik van ziekenhuis data bij ontslag over een periode van 2004-2010 (Fogarty, 2016). In totaal werden 264 VWD patiënten met ACS geïncludeerd en uitkomsten vergeleken met een controlegroep ACS patiënten. Belangrijkste uitkomsten van deze studie waren dat in de ACS met VWD patiëntengroep meer vrouwen waren dan in de controle ACS groep (60 vs 39%) en dat de meeste patiënten succesvol behandeld zijn zonder bloedingscomplicaties. Opvallend was dat meer ACS patiënten met VWD alleen medicamenteus werden behandeld (57 vs 48%) en minder vaak een PCI ondergingen (31 vs 41%) dan patiënten zonder VWD. Er werd meer gebruik gemaakt van een bare metal stent (BMS) bij ACS patiënten met VWD dan bij de controles (46 vs 22%), waarschijnlijk omdat de duur van dubbele trombocytenaggregatie remming ten tijde van de studie inclusie bij een BMS 1 maand was versus 1 jaar bij een drug-eluting stent (DES) (Martin, 2016). Inmiddels zijn er ook derde generatie DES waarvoor een korte duur van dubbele plaatjes therapie kan worden gegeven (Cohen, 2021). Ook in de ASH/ISTH/WFH/NHF VWD richtlijn uit 2021 wordt geadviseerd om bij de keuze van interventies (revascularisatie) de behandeling te prefereren, waarbij de duur van gebruik van trombocytenaggregatieremmers of antistolling zo kort mogelijk is (bijv non-drug-eluting stents)(Connell, 2021). Om bloedingen tijdens en na PCI te voorkomen is het advies om stollingsfactorconcentraat toe te dienen. Afhankelijk van het VWF en factor VIII gehalte kan worden gekozen voor VWF/factor VIII concentraat of VWF concentraat. Hierbij wordt gestreefd naar een factor VIII spiegel van >80 IE/dL en een dalspiegel >30 IE/dL en een VWF activiteit >50 IE/dL (dalspiegel) gedurende 48 uur na de procedure (Martin, 2016). Ook in de ASH/ISTH/WFH/NHF VWD richtlijn is opgenomen dat bij VWD patiënten met een ernstig bloedingsfenotype profylaxe met stollingsfactorconcentraat of tranexaminezuur nodig kan zijn (Connell, 2021). Post-operatief, tijdens de periode van dubbele plaatjesaggregatieremmers, wordt bij patiënten met hemofilie en een factor VIII <20 IE/dL aanbevolen om stollingsfactorprofylaxe toe te dienen (Schutgens, 2023). Dit beleid is ook, hetzij in een enkele patiënt, bij VWD toegepast en beschreven (Cohen, 2021). In navolging van de hemofilierichtlijn is het advies om ook bij VWD patiënten VWF en factor VIII >20 IE/dL te houden met stollingsfactorconcentraat gedurende de periode van dubbele trombocytenaggregatieremming (Martin, 2016).
In de Nederlandse Richtlijn Hemofilie is een uitgangvraag opgenomen over antistollingsbehandeling bij hemofilie (Richtlijn Hemofilie, 2021). Tevens is er een “clinical practice guidance” opgesteld over antitrombotische behandeling in patiënten met hemofilie onder auspiciën van de EHA-ISTH-EAHAD-ESO (Schutgens, 2023). De bevindingen uit de hemofilierichtlijnen hebben als leidraad gediend voor de richtlijn voor patiënten met VWD.
Referenties
Bewijskracht literatuur
Level 3
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (Connell, 2021) en van de systematische reviews waarop bovengenoemde richtlijn is gebaseerd (supplement 5).
Tevens werd gebruik gemaakt van de Nederlandse Richtlijn Hemofilie 2021 (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/) en de recente clinical practice guidance on antithrombotic treatment in patients with Hemophilia of EHA-ISTH-EAHAD-ESO. (Schutgens, 2023)
De richtlijn Antitrombotisch Beleid van de NIV werd geraadpleegd (https://richtlijnendatabase.nl/richtlijn/antitrombotisch_beleid/antitrombotisch_beleid_-_korte_beschrijving.html).
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (Connell, 2021).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7805326/bin/advancesADV2020003264C-suppl4.pdf
Evidence tabellen
Voor de huidige richtlijn is gebruik gemaakt van de evidence tabellen in supplement 5 van de gebruikte richtlijn (Connell, 2021). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7805326/bin/advancesADV2020003264C-suppl5.pdf
Overwegingen
Ad aanbeveling 1:
Bij een acuut coronair syndroom dient een VWD patiënt volgens de huidige cardiologische richtlijnen te worden behandeld. Dit betreft zowel de interventie zelf, keuze van stent en het geven van antithrombotica (LMWH, trombocytenaggregatieremmers). De interventie is bewezen effectief in het verminderen van morbiditeit en mortaliteit en kan veilig worden verricht als tijdens de interventie de stollingsfactor waarden zijn genormaliseerd door toediening van stollingsfactor concentraat (VWF(/factor VIII) concentraat). Indien mogelijk wordt een radiale toegang voor angiografie gebruikt om het risico op bloedingen te verminderen t.o.v. een femorale toegang.
Ad aanbeveling 2:
Het is van groot belang dat de hemofilie behandelaar bij de behandeling van cardiovasculaire ziekten bij patiënten met VWD betrokken is. Dit dient te gebeuren in een multidisciplinair overleg. Er is bij artsen veel onbekendheid over VWD, de verschillende types van VWD, en het bloedingsrisico van de individuele patiënt. Uitleg over de ziekte en behandeling kan inzicht geven welke antitrombotische behandeling of interventie voor de patiënt het beste is. Bijvoorbeeld de keuze van de soort coronaire stent. Ook is tijdens een interventie profylactische behandeling met stollingsfactorconcentraat nodig, waarvoor begeleiding door arts met expertise in VWD noodzakelijk is.
Ad aanbeveling 3:
Na plaatsing van een coronaire stent is dubbele trombocytenaggregatieremming noodzakelijk om acute in-stent trombose te voorkomen. De duur van deze dubbel therapie is afhankelijk van de soort stent. Voor een VWD patiënt met een a priori verhoogde kans op bloedingen heeft een korte duur van deze behandeling de voorkeur. Daarom wordt geadviseerd om gebruik te maken van een stent waarbij de duur van de dubbele trombocytenaggregatieremming zo kort mogelijk is. Uiteraard kan er ook vanuit cardiologisch oogpunt een stent voorkeur zijn. Recent zijn ook drug-eluting stents ontwikkeld, waar geen langdurige dubbele trombocytenaggregatieremming nodig is. Daarom is multidisciplinair overleg over patiënten met ACS en VWD nodig voordat een procedure wordt gestart.
Onder welke omstandigheden kunnen trombocytenaggregatieremmers veilig worden gegeven in het kader van secundaire preventie van coronaire events bij patiënten met VWD?
Aanbevelingen
Onderbouwing
Inleiding
In de ASH/ISTH/WFH/NHF VWD richtlijn uit 2021 is een van de uitgangsvragen gericht op de behandeling van VWD patiënten met antistolling: Dient bij patiënten met VWD en cardiovasculaire ziekte die trombocytenaggregatieremmers of antistolling nodig hebben deze behandeling te worden gegeven?
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Behandeling van cardiovasculaire aandoeningen bij VWD patiënten met trombocytenaggregatieremmers en/of antistolling geeft een aanvaardbaar risico op bloedingen (Sanders, 2013, Alesci 2012) |
Samenvatting literatuur
Resultaten
Voor de ASH/ISTH/WFH/NHF VWD richtlijn is een uitgebreide literatuursearch verricht, waarbij geen vergelijkende studies zijn gevonden met de vraagstelling of VWD patiënten met (iedere vorm van) cardiovasculaire ziekte, die normaliter worden behandeld met trombocytenaggregatieremmers of antistolling, deze behandeling wel of niet moeten krijgen. Er werden 4698 citaties gevonden, waarvan 18 studies volledig werden beoordeeld, waarbij slechts één studie werd gevonden die deze vraag beantwoord (Alesci, 2012). Omdat in het artikel slechts data werden gegeven over de VWD patiënten die wel behandeling ondergingen, werd dit meegenomen in de evaluatie als een case-serie. Er werden in totaal twee studies meegenomen als case-series (Alesci, 2012; Piel-Julian, 2019). Daarnaast werd in het richtlijnpanel nog één aanvullende studie besproken (Sanders, 2013). In de studie van Alesci werden 22 VWD patiënten behandeld met trombocytenaggregatieremmers (14 aspirine, 4 aspirine en clopidogrel en 4 clopidogrel). Hierbij trad bij een patiënt een ernstige bloeding op. In de studie van Pier-Julian werden 2 VWD patiënten behandeld met antistolling, waarvan 1 patiënt met type 2B VWD een ernstige gastro-intestinale bloeding kreeg. In de case-serie van Sanders, die gebruikt maakte van de data uit de Willebrand in Nederland (WiN) studie, werden in totaal 21 VWD patiënten bestudeerd met een arteriële trombose, waarvan er 19 werden behandeld met antitrombotica. Dertien alleen met een trombocytenaggregatieremmer, vier met een combinatie van een trombocytenaggregatieremmer en orale antistolling, en twee met orale antistolling. Twee patiënten, die werden behandeld met trombocytenaggregatieremmers, kregen een bloeding (Sanders, 2013). Omdat de literatuur slechts uit case-series bestaat is de kans op bias zeer hoog. De bewijslast voor het beantwoorden van de uitgangsvraag is daarom ook zeer laag (Connell, 2021).
Conform de recente EHA-ISTH-EAHAD-ESO hemofilie richtlijn, waarin bij hemofiliepatiënten met een factor VIII of factor IX <20 IE/dL die antistolling of dubbele trombocytenaggregatieremming gebruiken profylaxe met stollingsfactor concentraat wordt geadviseerd, wordt dit ook geadviseerd aan patiënten met VWD en factor VIII <20 IE/dL (Schutgens, 2023). In de ASH/ISTH/WFH/NHF VWD richtlijn worden geen aanbevelingen gedaan over de afkapwaarde van factor VIII of VWF waarbij stollingsfactorsuppletie geïndiceerd is. Het is in lijn met de hemofilieconsensus om de factor VIII afkapwaarde van 20 IE/dL ook voor patiënten met VWD over te nemen om bloedingsproblemen tijdens antistollingsbehandeling te voorkomen. In de praktijk zal dit slechts bij een beperkt aantal VWD patiënten (type 3, homozygoot type 2N, en Vicenza) nodig zijn. Ook VWD patiënten met een ernstig bloedingsfenotype, onafhankelijk van het factor VIII gehalte, kunnen hiervoor in aanmerking komen.
Voor patiënten met drievoudige trombocytenaggregatieremming of dubbele trombocytenaggregatie remming in combinatie met antistolling, is het advies in de hemofilierichtlijn om een dalspiegel aan te houden van factor VIII van 80 IE/dL (Schutgens, 2023). Dit is meestal kortdurend, bijv. na cardiale ingrepen of stentplaatsing. Dit beleid wordt daarom ook geadviseerd bij patiënten met VWD met een verlaagd factor VIII. De streefwaarde voor VWF activiteit is 50 IE/dL (dalspiegel) (Martin, 2016).
Referenties
Bewijskracht literatuur
Level 3
Zoeken en selecteren
Er werd voor deze uitgangsvraag gebruik gemaakt van de recent door de American Society of Hematology (ASH), International Society on Thrombosis and Haemostasis (ISTH), National Hemophilia Foundation (NHF), and World Federation of Hemophilia (WFH) opgestelde en gepubliceerde evidence-based richtlijn (Connell, 2021) en van de systematische reviews waarop bovengenoemde richtlijn is gebaseerd (supplement 5).
Tevens werd gebruik gemaakt van de Nederlandse Richtlijn Hemofilie 2021 (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/) en de recente clinical practice guidance on antithrombotic treatment in patients with Hemophilia of EHA-ISTH-EAHAD-ESO (Schutgens, 2023).
Zoekverantwoording
De zoekverantwoording is opgenomen in supplement 4 van de gebruikte richtlijn (Connell, 2021).https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7805326/bin/advancesADV2020003264C-suppl4.pdf
Evidence tabellen
Voor de huidige richtlijn is gebruik gemaakt van de evidence tabellen in supplement 5 van de gebruikte richtlijn (Connell, 2021). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7805326/bin/advancesADV2020003264C-suppl5.pdf
Overwegingen
Ad aanbeveling 1 en 2:
Ondanks de lage bewijslast op basis van de beperkte literatuur, adviseren wij om patiënten met VWD en cardiovasculaire aandoeningen behandeling met trombocytenaggregatieremmers of anticoagulantia te geven, zoals die normaliter ook aan patiënten zonder stollingsstoornis worden gegeven. Hierbij is het van belang dat het voordeel van het geven van trombocytenaggregatieremmers en/of anticoagulantia groot is en de kans op bijwerkingen (bloeding) klein. Het is daarbij uiteraard wel van belang om voor iedere behandeling het risico op bloedingen of (recidief) trombose voor iedere individuele patiënt af te wegen. Het bloedingsrisico bij patiënten met VWD is onder meer afhankelijk van type VWD, recente VWF en factor VIII waarden, leeftijd van de patiënt en het optreden van eerdere bloedingen.
Ad aanbeveling 3:
Individuen die dubbele trombocytenaggregatieremming ontvangen na stent plaatsing hebben een vergelijkbaar risico op bloedingen als patiënten die worden behandeld met een vitamine K antagonist. Het risico op bloedingen bij patiënten met VWD is nog sterker verhoogd. Om de kans op bloedingen te reduceren is het advies om tijdelijk te behandelen met stollingsfactorconcentraat, zeker bij patiënten met ernstige vormen van VWD.
Ad aanbeveling 4:
Zodra de diagnose is gesteld krijgen VWD patiënten van hun behandelend arts het advies om geen medicijnen te gebruiken die de stolling negatief beïnvloeden, waaronder aspirine. Daarom is het van groot belang om samen met de patiënt de reden om deze medicijnen nu wel te gebruiken als behandeling of preventie van cardiovasculaire ziekten of veneuze trombose te bespreken. Hierbij moet het verhoogde risico op bloedingen tijdens behandeling met antitrombotica te worden besproken en af te worden gewogen tegen het verminderen van het risico van (recidief) arteriële of veneuze trombose bij het gebruik ervan.
Ad aanbeveling 5:
Tijdens de behandeling van VWD patiënten met trombocytenaggregatieremmers en/of anticoagulantia is het van belang om periodiek het risico van bloedingen en recidief trombose te evalueren. In geval van ernstige bloedingen kan worden overwogen om de antithrombotica te stoppen, de dosis te reduceren of om (tijdelijk) profylactisch te behandelen met stollingsfactorconcentraat.
Ad aanbeveling 6:
Bij het gebruik van aspirine is de kans op gastro-intestinale bloedingen verhoogd. Bij patiënten met VWD is het risico op bloedingen hoger dan in de algemene populatie. Het wordt daarom aanbevolen om bij aspirine gebruik ook te starten met een protonpompremmer.
Ad aanbeveling 7:
DDAVP is gecontra-indiceerd bij patiënten met cardiovasculaire aandoeningen. Dit betekent dat een patiënt die in het verleden goed kon worden behandeld bij bloedingen of chirurgische ingrepen met DDAVP, nu zal moeten worden behandeld met VWF(/factor VIII) concentraat. Het behandelplan van de patiënt dit te worden aangepast. Ook zal dit met de patiënt moeten worden besproken en worden uitgelegd.
Wanneer is medicamenteuze preventie van veneuze trombose aangewezen?
Aanbevelingen
Onderbouwing
Inleiding
Individuen met hoge factor VIII en/of VWF spiegels hebben een verhoogd risico op het ontstaan van veneuze trombose(Tsai, 2002; Rietveld, 2019). Dit is aangetoond in grote prospectieve populatiestudies en case-control onderzoek. Hoewel spontane veneuze trombose zelden is gerapporteerd in VWD patiënten, zijn er geen aanwijzingen in de literatuur dat de incidentie van veneuze trombose lager is bij VWD patiënten in vergelijking met de normale populatie (Martin, 2016; Qureshi, 2012). Het is niet onderzocht of VWD patiënten lagere kans hebben op veneuze trombose rondom operatieve ingrepen. De adviezen over wel of geen tromboseprofylaxe rondom ingrepen bij VWD patiënten zijn wisselend.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Trombose bij VWD patiënten komt meestal voor als er additionele risicofactoren voor trombose zijn (Girolami, 2015) |
|
C |
Verhoogde waarden van factor VIII en VWF zijn geassocieerd met toegenomen kans op veneuze trombose (Tsai, 2002; Rietveld, 2019) |
|
C |
Stollingsfactor suppletie met VWF/factor VIII concentraat kan leiden tot hoge factor VIII in de post-operatieve fase (Mannucci, 2002; Hazendonk, 2018) |
|
C |
De incidentie van veneuze trombose in de post-operatieve fase in VWD patiënten met verhoogd factor VIII en VWF activiteit (>150 IE/dL) na stollingsfactorsuppletie bedraagt ongeveer 4% (Gill, 2014) |
Samenvatting literatuur
Resultaten
VWD patiënten die een operatie of andere ingreep moeten ondergaan krijgen vaak VWF(/factor VIII) concentraat of DDAVP toegediend, met als doel VWF en factor VIII waarden te normaliseren. Theoretisch wordt daarmee de kans op trombose gelijk aan die van een gezond individu zonder VWD. Daarom lijkt het logisch om een VWD patiënt tromboseprofylaxe te geven, als dat voor de betreffende ingreep is geïndiceerd conform de richtlijn antitrombotisch beleid. In geval van een ernstig bloedingsfenotype en VWF en factor VIII spiegels <30 IE/dL, is te overwegen alleen tromboseprofylaxe te geven aan patiënten die een ingreep ondergaan met een hoog trombose risico, zoals heup- en knievervangende operatie, patiënten met een maligniteit of obesitas (Franchini, 2009). Mechanische tromboseprofylaxe, zoals elastische kousen, of compressietherapie kan ook worden overwogen in VWD patiënten.
Om trombose te voorkomen is het van belang om tijdens suppletie van stollingsfactoren factor VIII spiegels te meten. Door behandeling met VWF(/factor VIII) concentraat en de endogene productie van factor VIII kunnen factor VIII spiegels stijgen tot sterk verhoogde waarden, met daarbij een toegenomen kans op trombotische complicaties (Mannucci, 2017; Mannucci 2002; Hazendonk, 2018; Peyvandi, 2019). In een analyse van 2 klinische studies naar peri-operatieve suppletie met VWF(/factor VIII) concentraat in VWD patiënten met gemeten VWF en FVIII >150 IE/dL, werd een incidentie van veneuze trombose van bijna 4% gevonden (Gill, 2014). De ASH/ISTH/WFH/NHF VWD richtlijn adviseert om bij VWD patiënten met een hoger risico op trombose de combinatie van hoge FVIII/VWF spiegels (>150 IE/dL) en langdurig gebruik van tranexaminezuur te vermijden (Connell, 2021). In een systematic review van 11 studies met 364 patiënten met VWD die verschillende types VWF concentraat kregen toegediend werden er 7 trombotische complicaties beschreven (Coppola, 2012). Het is niet gerapporteerd of dit was geassocieerd met VWF of factor VIII spiegels. Het gebruik van puur VWF (plasma of recombinant) concentraat zal minder hoge factor VIII spiegels geven in de postoperatieve periode dan behandeling met VWF/factor VIII concentraat. Dit zou kunnen worden overwogen in patiënten met een hoog risico op trombose, al zijn ook trombotische complicaties tijdens peri-operatieve toediening van puur VWF concentraat beschreven (Ahmed, 2018; Peyvandi, 2019).
Referenties
Bewijskracht literatuur
Level 3
Zoeken en selecteren
Zoekverantwoording
Er werd gebruik gemaakt van de Nederlandse Richtlijn Hemofilie 2021 (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/) en de recente clinical practice guidance on antithrombotic treatment in patients with Hemophilia of EHA-ISTH-EAHAD-ESO (Schutgens, 2023).
Evidence tabellen
Niet van toepassing
Overwegingen
Mogelijk hebben patiënten met VWD een lagere kans op veneuze trombose, zeker als zij naast een verlaagd VWF ook verlaagde factor VIII waarden hebben. Hier is echter in de literatuur geen bewijs voor. Tijdens operatieve ingrepen worden patiënten behandeld met stollingsfactorconcentraat of DDAVP om bloedingen te voorkomen. Dit leidt tot normalisatie van spiegels en daarmee verminderen van het risico op bloedingen perioperatief. Hiermee stijgt echter het trombose risico bij deze patiëntengroep en lijkt het dan ook gerechtvaardigd om deze patiënten tromboseprofylaxe te geven conform de richtlijn antitrombotisch beleid. Helaas zijn geen studies beschikbaar om dit advies te onderbouwen. Ten tijde van stollingsfactor suppletie met VWF/factor VIII concentraat stijgen factor VIII spiegels vaak tot suprafysiologische waarden omdat, naast exogeen factor VIII, ook het endogene geproduceerde factor VIII stijgt (Gill, 2014). Immers dit wordt gebonden aan het circulerend VWF en daarmee minder snel afgebroken. Daarom dienen factor VIII en VWF met regelmaat te worden gecontroleerd in de post-operatieve periode om te hoge spiegels >150 IE/dL te voorkomen. De duur van de tromboseprofylaxe is ook vaak onderwerp van discussie, maar het lijkt gerechtvaardigd om na staken van de factorsuppletie en het dalen van de VWF en factor VIII tot pre-existente lage waarden, de tromboseprofylaxe te staken. Dit is echter ook afhankelijk van de aanwezige riscofactoren voor trombose, zoals obesitas, maligniteit en mate van immobilisatie.
Onder welke omstandigheden kunnen anticoagulantia veilig worden gegeven bij de therapeutische behandeling van een trombose in patiënten met VWD?
Aanbevelingen
Onderbouwing
Inleiding
Voor veneuze trombose is onomstotelijk bewezen dat behandeling met antistolling leidt tot voorkomen van uitbreiding, reductie van recidief trombose en een lagere mortaliteit.
Indien veneuze trombose optreedt bij een VWD patiënt wordt geadviseerd om de behandeling te verrichten conform de behandeling in de algemene populatie volgens de richtlijn antitrombotisch beleid (https://richtlijnendatabase.nl/richtlijn/antitrombotisch_beleid/antitrombotisch_beleid_-_korte_beschrijving.html). Uiteraard dient dit te worden afgewogen tegen de toegenomen kans op bloedingen tijdens antistollingsbehandeling.
Conclusies
|
SORT Grade |
Conclusie |
|
A |
Behandeling van veneuze trombose met anticoagulantia verlaagt de kans op recidief en mortaliteit (richtlijn antitrombotisch beleid) |
|
A |
Het korter dan drie maanden behandelen van een veneuze trombose leidt tot een verhoogd risico op recidief trombose in de algemene populatie (Schulman, 1995) |
|
A |
Gebruik van DOACs in de algemene populatie (zonder VWD) leidt tot minder bloedingen dan behandeling met vitamine K antagonisten (van Es, 2014) |
Samenvatting literatuur
Resultaten
Er is weinig onderzoek verricht naar het vóórkomen van veneuze trombose bij patiënten met VWD. Of de incidentie van veneuze trombose lager is bij VWD patiënten dan in de algemene populatie is slechts beperkt onderzocht (Qureshi, 2012). In de meeste gerapporteerde patiënten cases trad trombose op in aanwezigheid van andere risicofactoren, zoals ondergaan van een chirurgische ingreep of obesitas. Er zijn enkele case-series beschreven van patiënten bij wie trombose optrad na het toedienen van stollingsfactorconcentraat (Qureshi, 2012; Girolami 2015; Mannucci, 2002; Makris, 2002). In een systematic review naar trombose bij hemofilie en VWD patiënten werd een incidentie van trombose na infusie van concentraat van ongeveer 0,05% bij hemofiliepatiënten gevonden, met een iets hoger percentage bij VWD patiënten (Mannucci, 2002; Coppola, 2012).
Indien een veneuze trombose optreedt is behandeling met anticoagulantia geïndiceerd. De duur van de behandeling van veneuze trombose is in ieder geval 3 maanden, conform de richtlijn antitrombotisch beleid (Schulman, 1995). Bij individuen uit de algemene populatie die trombose ontwikkelen zonder onderliggende oorzaak is levenslange antistolling geïndiceerd. Voor patiënten met VWD dient een afweging gemaakt te worden tussen het risico op recidief trombose na staken van de antistolling en op bloedingen indien de antistolling wordt gecontinueerd. De voorkeur gaat uit naar een DOAC gezien de lagere kans op bloedingen in vergelijking met Vitamine K antagonisten in eerdere studies (van Es, 2014).
Bij hemofilie patiënten met factor VIII activiteit >20 IE/dL lijkt antistolling met DOAC of VKA gerechtvaardigd en veilig en hoeft geen additionele stollingsfactor concentraat te worden gegeven (Schutgens, 2023). Naar analogie hiervan lijkt het gerechtvaardigd om deze factor VIII grenswaarde ook aan te houden voor patiënten met VWD. In de EHA richtlijn voor patiënten met hemofilie wordt geadviseerd om bij patiënten met factor VIII activiteit <20 IE/dL die anticoagulantia gebruiken profylaxe te starten met stollingsfactor concentraat. Hetzelfde kan worden geadviseerd voor VWD patiënten met factor VIII <20 IE/dL (Schutgens 2023). Er zijn patiënten met VWD die een ernstig bloedingsfenotype hebben met een (sterk) verlaagd VWF, maar een factor VIII >20 IE/dL, waarbij het ook nodig kan zijn om stollingsfactorprofylaxe te geven gedurende het gebruik van anticoagulantia ter voorkoming van bloedingen (Martin, 2006).
Bij de behandeling van trombose is gebleken dat de kans op bloedingen bij DOAC lager is dan bij gebruik van VKA met een therapeutische INR (2,0-3,0). Daarom wordt ook bij patiënten met VWD hier de voorkeur aan gegeven, zeker omdat voor DOACs nu ook antidota beschikbaar zijn voor het couperen van zowel IIa als Xa remmers. Bij VWD patiënten die langdurig antistolling gebruiken, die conform de richtlijn normaliter voor dosis reductie van de DOAC in aanmerking zouden komen, wordt geadviseerd ook dosis reductie toe te passen.
Referenties
Bewijskracht literatuur
Level 3
Zoeken en selecteren
De richtlijn Antitrombotisch Beleid van de NIV werd geraadpleegd. (https://richtlijnendatabase.nl/richtlijn/antitrombotisch_beleid/antitrombotisch_beleid_-_korte_beschrijving.html). Tevens werd de Nederlandse Richtlijn Hemofilie 2021 gebruikt (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/).
Zoekverantwoording
Niet van toepassing
Evidence tabellen
Niet van toepassing
Overwegingen
Bij de behandeling van veneuze trombose bij patiënten met VWD zal meestal kunnen worden gestart zonder dat stollingfactorprofylaxe nodig is. Het risico op uitbreiding van trombose en embolisatie zonder antistolling is groter dan het risico op bloedingen met antistolling. Uiteraard dient dit risico per patiënt gewogen te worden. Helaas is er zeer beperkte literatuur beschikbaar over trombose behandeling bij VWD patiënten. Een deel van de aanbevelingen is gebaseerd op de literatuur beschikbaar over hemofilie patiënten met trombose.
De duur van de antistolling bij een veneuze trombose is ten minste 3 maanden. Indien de VWD patiënt ernstige bloedingscomplicaties ontwikkelt tijdens de eerste drie maanden kan worden overwogen om de antistolling eerder te staken, omdat de kans op recidief afneemt na 1 maand (Martin, 2016). Bij een persisterende trombose risicofactor of maligniteit is de duur van antistolling langer tot zelfs levenslang. Het risico op recidief trombose zal opnieuw moeten worden afgewogen tegen het risico op bloedingen bij VWD patiënten. Langdurige profylaxe met stollingsfactoren is voor deze patiënten niet haalbaar.
Wanneer zijn anticoagulantia aangewezen ter voorkoming van herseninfarct bij boezemfibrilleren bij patiënten met VWD?
Aanbevelingen
Onderbouwing
Inleiding
VWD patiënten kunnen atriumfibrilleren ontwikkelen met een toegenomen risico op een cerebro-vasculair trombotisch event, waarbij de vraag is of zij ter voorkoming hiervan langdurig antistollingsmedicatie veilig kunnen gebruiken. Hierbij moet in overweging genomen worden dat er mogelijk sprake is van een verminderd risico op trombo-embolische events bij patiënten met VWD door het verlaagde factor VIII en VWF. De prognostische waarde van de CHA2DS2-VASc score voor het berekenen van het risico van een trombotisch event bij atriumfibrilleren in een VWD patiënt, is niet onderzocht. Door de hypocoagulabiliteit in VWD patiënten, met name door een verlaagd FVIII kan trombine generatie verlaagd zijn en daarmee ook de kans op trombotische complicaties verlaagd. Daarnaast is ook de waarde van een score om het bloedingsrisico te kunnen afwegen niet onderzocht in patiënten met VWD. De meest gebruikte score is de HAS-BLED score, maar deze is niet gevalideerd voor patiënten met een erfelijke stollingsstoornis zoals VWD. De behandeling van atriumfibrilleren is vastgesteld in de richtlijn van de Nederlandse Vereniging Voor Cardiologie (NVVC) (https://richtlijnendatabase.nl/richtlijn/atriumfibrilleren/startpagina_-atriumfibrilleren.html). De aanbevelingen voor patiënten met VWD zijn hierop gebaseerd.
Conclusies
|
SORT Grade |
Conclusie |
|
C |
Patiënten met hemofilie en factor VIII act <10 IE/dL zijn van nature antistold vergelijkbaar met individuen op orale antistolling met VKA en een therapeutische INR (Schutgens, 2023) |
|
C |
Patiënten met hemofilie en factor VIII 10-20 IE/dL zijn van nature antistold vergelijkbaar met individuen op orale antistolling met VKA en een INR van 1,5-1,9 (Schutgens, 2023) |
|
C |
Patiënten met VWD hebben in vergelijking met gezonde controles een verminderde trombinegeneratie, wat met name afhankelijk is van FVIII activiteit (Rugeri, 2007) |
|
NVT |
Het risico op een herseninfarct bij een patiënt met VWD en atriumfibrilleren is niet bekend. |
Samenvatting literatuur
Resultaten
Er zijn weinig studies verricht over atriumfibrilleren bij VWD patiënten. De meeste artikelen betreffen case-series. Atriumfibrilleren lijkt even vaak voor te komen bij patiënten met hemofilie en VWD als in de algemene populatie. Omdat de kans op bloedingen bij patiënten met bloedingsziekten is toegenomen worden veel patiënten met atriumfibrilleren niet behandeld. In een cross-sectionele studie in Europa bleek slechts 33% van patiënten met hemofilie en atriumfibrilleren antistolling te gebruiken (Schutgens, 2014). In de recente EHA richtlijn is de literatuur samengevat over trombine generatie (Endogenous Thrombin Potential, ETP) in patiënten met hemofilie. Daarbij werd aangetoond dat hemofiliepatiënten met factor VIII <10 IE/dL een verlaagde ETP hebben, die vergelijkbaar is met het gebruik van een VKA met een INR in de therapeutische range. Daarom wordt in de hemofilie richtlijn geadviseerd om bij die patiënten geen antistolling te geven ter primaire preventie van een herseninfarct. Deze patiënten zijn immers al van nature antistold. Tussen de 10-20 IE/dL is de ETP vergelijkbaar met een INR van 1,5-1,9 (Schutgens, 2023). Bij patiënten met VWD is beperkt onderzoek verricht naar trombinegeneratie. Er werd een verminderde trombine generatie gezien in patiënten met VWD type 1 (Keularts, 2000). In een studie in 53 VWD patiënten werd een verminderde trombinegeneratie gezien, maar regressie analyse toonde dat dit met name afhankelijk was van de factor VIII activiteit in plasma (Rugeri, 2007). Dit betekent dat bij VWD patiënten met een sterk verlaagd factor VIII (<20 IE/dL) de trombinegeneratie ook sterk verlaagd zal zijn en deze patiënten ook “natuurlijk antistold” zijn. Daarom kan bij deze patiënten worden afgezien van gebruik van anticoagulantia in geval van atriumfibrilleren ter preventie van herseninfarct (Schutgens, 2023). Van de 951 patiënten in de Willebrand in Nederland studies (WiN en WiN-Pro) heeft 12% een factor VIII <20 IE/dL (data niet gepubliceerd). Martin en Key adviseren in een “How I Treat” artikel dat zij bij VWD patiënten plaatjesaggregatieremming geven in plaats van VKA of DOAC (Martin, 2016). Dit wordt echter in de recente hemofilierichtlijn afgeraden gezien het feit dat op basis van diverse studies is aangetoond, dat dit het risico op trombotische complicaties niet verlaagt, maar de kans op bloedingen wel verhoogt (Schutgens, 2023). Bij VWD patiënten die een herseninfarct krijgen ten gevolge van atriumfibrilleren is behandeling en secundaire preventie met antistollingsbehandeling uiteraard noodzakelijk. De voorkeur gaat uit naar een DOAC gezien de lagere kans op bloedingen in vergelijking met Vitamine K antagonisten in eerdere studies (van Es, 2014).
Naast antistollingstherapie zijn er ook andere interventies mogelijk om het risico op herseninfarct bij patiënten met atriumfibrilleren te verlagen. Omdat de meeste stolsels afkomstig zijn uit het linker hartoor, zijn strategieën ontwikkeld waarbij het linker hartoor wordt afgesloten (“left atrial appendage occlusion”). In gerandomiseerde studies is aangetoond dat deze procedure even effectief is als VKA in de preventie van herseninfarct en daarnaast werd er ook een trend gezien naar minder bloedingsepisodes (Holmes, 2009). Bij de meeste patiënten kan de antistolling een aantal maanden na de interventie worden gestaakt of omgezet naar trombocytenaggregatieremmers. Deze behandeling is ook succesvol toegepast bij patiënten met een hoog bloedingsrisico, waaronder patiënten met hemofilie en VWD (Schutgens, 2023). Rondom de invasieve procedure is behandeling met VWF(/factor VIII) concentraat nodig. Ritme controle wordt toegepast voor de verbetering van klachten en kwaliteit van leven bij patiënten met atriumfibrilleren. De Nederlandse cardiologische richtlijn adviseert dit bij patiënten met aanhoudende AF-gerelateerde klachten in aanvulling op preventie van een herseninfarct. Er kan zowel gekozen worden voor medicamenteuze cardioversie als elektrische cardioversie. Post-cardioversie kan worden overwogen om de antistolling te continueren of te staken, waarbij geadviseerd wordt om bij een lage CHAD2DS2-VASc (0 of 1) antistolling te staken en in andere gevallen te continueren. Katheterablatie als behandeling van atriumfibrilleren wordt gekozen op basis van een aantal redenen, zoals onvoldoende effectiviteit van medicatie, bij hartfalen of bradycardie. In het algemeen wordt de orale antistollingstherapie gedurende 2 maanden gecontinueerd na de ablatie bij alle patiënten. Daarna is de keuze om langer te behandelen voor namelijk bepaald door de CHA2DS2-VASc risicofactoren. Deze opties zouden dus ook kunnen worden ingezet voor de behandeling van AF bij patiënten met VWD omdat dit soms een kortere periode van antistolling mogelijk maakt en daarmee het bloedingsrisico lager wordt (Van der Valk, 2019; Potpara, 2015).
Referenties
Bewijskracht literatuur
Level 3
Zoeken en selecteren
Zoekverantwoording
Er werd gebruik gemaakt van de Nederlandse Richtlijn Hemofilie 2021 (https://publicatie.hematologienederland.nl/richtlijnen/hemofilie/) de recente clinical practice guidance on antithrombotic treatment in patients with Hemophilia of EHA-ISTH-EAHAD-ESO (Schutgens, 2023).
Tevens is gebruik gemaakt van de Nederlandse Cardiologie Atriumfibrilleren richtlijn (https://richtlijnendatabase.nl/richtlijn/atriumfibrilleren/startpagina_-atriumfibrilleren.html). Deze richtlijn is gebaseerd op de richtlijn van de European Association for Cardiology (Hindricks, 2021).
Evidence tabellen
Niet van toepassing.
Overwegingen
Bij patiënten met VWD komt atriumfibrilleren voor, met name op oudere leeftijd. Er is geen reden om aan te nemen dat AF minder vaak voorkomt als in de algemene populatie. Het risico op een herseninfarct als gevolg van AF is mogelijk iets lager, gezien de verminderde trombinegeneratie, echter hier is geen bewijs voor gevonden. In de hemofilie richtlijnen is de literatuur samengevat over trombine generatie in plasma van patiënten met hemofilie, waaruit blijkt dat de trombine generatie is verlaagd tov de gezonde populatie. Ook is gevonden dat dit sterk afhankelijk is van de ernst van de hemofilie en de factor VIII activiteit. Een deel van de VWD patiënten heeft ook een verlaagde factor VIII activiteit in plasma < 20 IE/dL en daarmee ook een verminderde trombine generatie. Dit zou kunnen leiden tot een lager risico op stolselvorming en daardoor een kleinere kans op herseninfarct. Daarom wordt geadviseerd om bij VWD patiënten met een sterk verlaagd factor VIII geen antistolling te geven indien atriumfibrilleren optreedt. In de praktijk zullen veel patiënten wel worden behandeld gezien het normale of slechts licht verlaagde FVIII activiteit. Indien antistolling wordt gestart is het advies om dan stollingsfactor suppletie toe te dienen om bloedingen te voorkomen.
Gezien het ontbreken van studies en case-series is er weinig bewijsvoering voor het juiste beleid bij een VWD patiënt met AF. Mede daarom is het van groot belang om de behandeling van de individuele VWD patiënt met AF multidisciplinair af te stemmen met cardioloog en VWD behandelaar. Zowel de medicamenteuze en interventie behandeling dient te worden besproken, als het risico van bloedingen en herseninfarct van de verschillende behandelstrategieën. Dit dient ook samen met de patiënt te worden besproken.
Tabel 10.1 Behandeling van VWD patiënten met antitrombotica
|
Indicatie |
Basaal factor VIII <20 IE/dL |
Basaal factor VIII >20 IE/dL |
|
Enkele trombocyten aggregatie remming
|
Start (geen factorsuppletie) |
Start (geen factorsuppletie) |
|
Dubbele trombocyten aggregatie remming |
Profylaxe met VWF(/factor VIII) concentraat dalspiegel factor VIII >20 IE/dL
|
Start (geen factorsuppletie) |
|
Orale antistolling VKA of DOAC |
Geen orale antistolling voor preventie herseninfarct AF Behandeling veneuze trombose of secundaire preventie bij AF: – profylaxe met VWF(/factor VIII) concentraat dalspiegel >20 IE/dL – voorkeur DOAC boven VKA
|
Start – voorkeur DOAC boven VKA
|
|
Drievoudige trombocyten aggregatie remming of dubbele plaatjes aggregatie remming met VKA or DOAC
|
Profylaxe met VWF(/factor VIII) concentraat Factor VIII dalspiegel >80 IE/dL Streefwaarde VWF act >50 IE/dL (alleen korte termijn) |
Profylaxe met VWF(/factor VIII) concentraat Factor VIII dalspiegel >80IE/dL Streefwaarde VWF act >50 IE/dL (alleen korte termijn) |
© 2022. Alle rechten voorbehouden
Elke 3 jaar bepaalt het bestuur van de Nederlandse Vereniging van Hemofiliebehandelaars of deze richtlijn of module nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herzieningstraject te starten. De Nederlandse Vereniging van Hemofiliebehandelaars is als houder van deze richtlijn de eerst verantwoordelijke wat betreft de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Initiatief: Nederlandse Vereniging van Hemofiliebehandelaars
Geautoriseerd door:
Nederlandse Vereniging voor Hematologie (NVvH)
Nederlandse Vereniging voor Kindergeneeskunde (NVK)
Nederlandse Vereniging van Internisten Vasculaire Geneeskunde (NVIVG)
Nederlandse Vereniging Hemofilie Verpleegkundigen (NVHV)
Module zwangerschap geautoriseerd door:
Nederlandse Vereniging voor Hematologie (NVvH)
Nederlandse Vereniging voor Kindergeneeskunde (NVK)
Nederlandse Vereniging van Internisten Vasculaire Geneeskunde (NVIVG)
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG)
Vereniging Klinische Genetica Nederland (VKGN)
Nederlandse Vereniging voor Anesthesiologie (NVA)