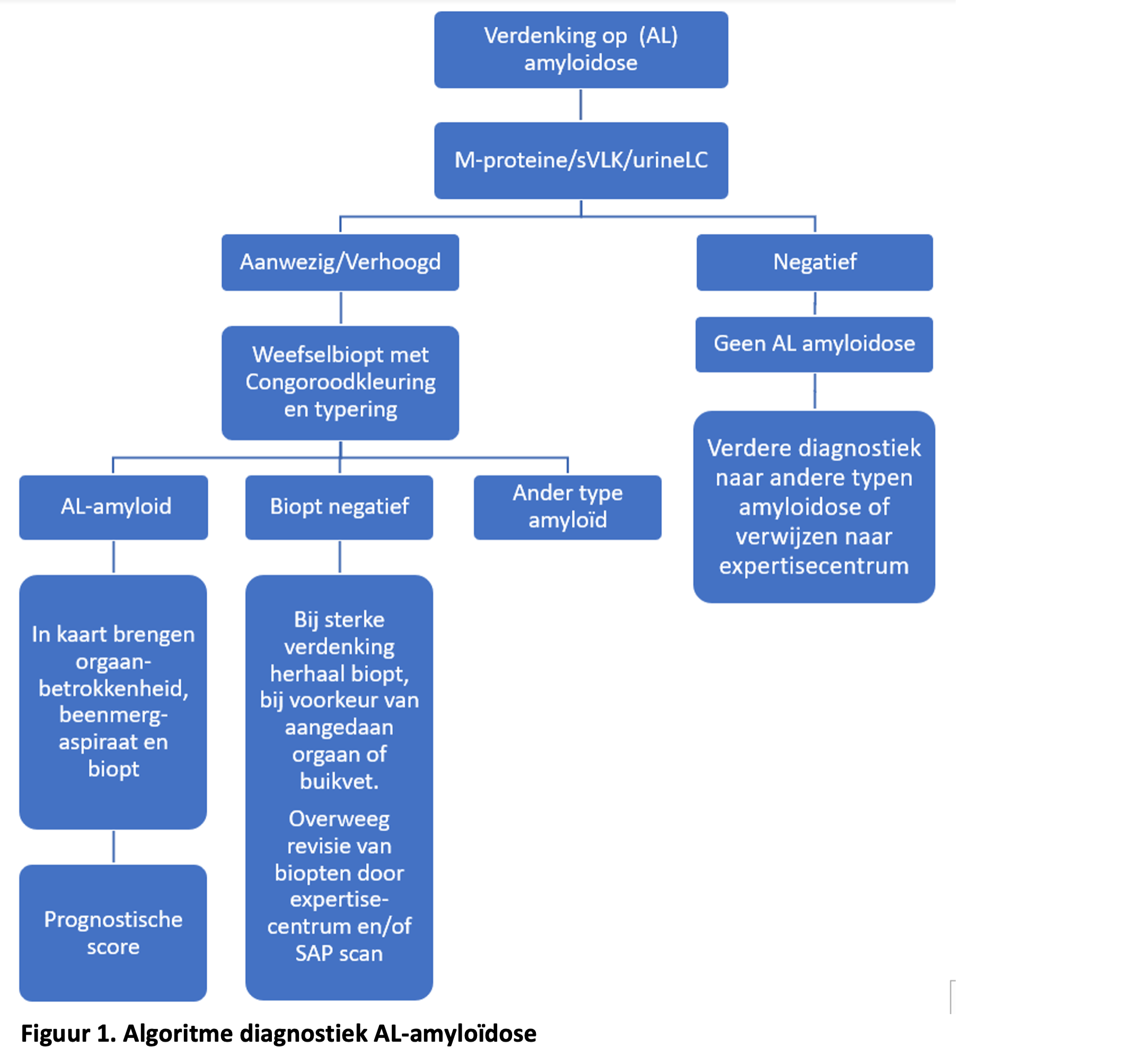
Terug naar het richtlijnenoverzicht
Amyloïd Light chain (AL)-amyloïdose is een verworven vorm van amyloïdose waarbij er amyloïd deposities in de organen ontstaan door productie van abnormale vrije lichte immunoglobulineketens door een klonale plasmacel of andere B-cel kloon. De onderliggende plasmacelkloon in het beenmerg is vaak klein met minder dan 10% plasmacellen. Ook de vrije lichte keten (VLK) waarde in het bloed is daarbij niet sterk verhoogd. De VLK is meestal van het lambda type (ongeveer 80%).
AL amyloïdose behoort tot de groep van kwaadaardige plasmacelziekten zoals Multipel Myeloom en plasmacel leukemie en moet behandeld worden met anti plasmacel gerichte therapie zoals beschreven in deze richtlijn.
De klonale VLK in het bloed ondergaan conformatieveranderingen vanuit een oligomere tussenfase en slaan daarna extracellulair neer, samen met glycosaminoglycanen en serum amyloïd P-component (SAP) in typische fibrillaire amyloïd aggregaten. Amyloïd fibrillen binden de kleurstof Congorood waarmee amyloïd depositie kan worden aangetoond in een biopt. Alleen wanneer het amyloïd dat aanwezig is in de organen functiestoornissen geeft, kan worden gesproken over de ziekte amyloïdose.1
Behalve AL-amyloïdose zijn er nog 42 andere vormen van amyloïdose bekend waarvan de meeste erfelijk bepaald zijn en dus niet verworven.2 Overige, meer voorkomende, vormen van amyloïdose zijn wild type Amyloïd Transthyretine (ATTR)-amyloïdose, erfelijke ATTR-amyloïdose en serum amyloïd A (AA)-amyloïdose. In Nederland is, net als in andere westerse landen, het subtype AL de meest voorkomende vorm van amyloïdose maar door de aandacht voor ATTR cardiale amyloidose stijgt het aandeel van deze diagnose snel.
AL-amyloïdose bestaat als lokale vorm, maar vooral als systemische vorm met betrokkenheid van meerdere organen, zoals hart, nier, lever, long, maagdarm- en zenuwstelsel. De incidentie wordt geschat op 8 per miljoen persoonsjaren. Er is in 2017 een registratie gestart via de Nederlandse Kanker Registratie (NKR) die momenteel rond de 140 nieuwe patiënten per jaar met systemische AL-amyloïdose registreert. Omdat de ziekte langzaam ontstaat, met aspecifieke klachten in het begin, duurt het vaak lang voordat de diagnose wordt gesteld. In een analyse van Nederlandse data uit 2 grote centra tussen de jaren 2008 en 2016 was de mediane tijd van klachtengemeld bij arts tot aan diagnose 15 maanden.3 In een vragenlijst uitgezet door het Amyloïdose Research Consortium gericht op alle vormen van amyloïdose bleek dat ongeveer de helft van de patiënten 4 of meer specialisten bezocht, voordat de diagnose gesteld kon worden.4
De prognose is sterk afhankelijk van de fitheid van de patiënt en de mate van betrokkenheid van het hart. In de eerder genoemde Nederlandse data-analyse was de gemiddelde overleving 4.4 jaar, maar kan variëren van enkele maanden tot >10 jaar.
De behandeling van AL-amyloïdose is gericht op reductie van het precursoreiwit: de VLK. Dit gebeurt door middel van (immuno)chemotherapie gericht op de onderliggende plasmacelkloon. Door de orgaanfunctiestoornissen bij patiënten met AL-amyloïdose worden behandelingen zoals toegepast bij het Multipel Myeloom (MM) vaak slecht verdragen en moeten ze worden aangepast. Ook autologe stamceltransplantatie (ASCT) kan slechts bij een kleine minderheid van de patiënten worden ingezet.
In verband met de orgaanbetrokkenheid van hart (80% van de patiënten) en nier (70%), waarvoor expertise buiten de hematologie nodig is, maar ook voor voeding en leefstijl-adviezen, is aanvullende ondersteunende zorg zeer belangrijk. Door de zeldzaamheid en complexiteit van de ziekte en de ingewikkelde diagnostiek en behandeling is het belangrijk om de zorg voor amyloïdose patiënten te concentreren in centra waar voldoende ervaring en expertise is met de ziekte en de behandeling. De 2 erkende expertise centra voor amyloidose in Nederland, beide aangesloten bij een ERN, zijn het UMC Utrecht en het UMCG.
Deze richtlijn is een document met aanbevelingen en instructies ter ondersteuning van de dagelijkse praktijk van de diagnostiek, behandeling en follow-up van AL-amyloïdose bij volwassenen. Voorafgaand aan de ontwikkeling van de richtlijn zijn uitgangsvragen geformuleerd. De uitgangsvragen vormen de basis voor de verschillende modules van deze richtlijn.
De richtlijn beoogt derhalve niet een volledig leerboek te zijn. De richtlijn is bedoeld om aanbevelingen te geven en tracht een betere uniformiteit van behandeling te bewerkstelligen. Uiteindelijk zou dit tot een betere kwaliteit van zorg en betere overleving van amyloïdose patiënten in Nederland kunnen leiden. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek of consensus. Het niveau van bewijsvoering staat vermeld in de tekst.
Als er in de richtlijn wordt gesproken over de patiënt, wordt ook de patiënte bedoeld. De richtlijn kan worden gebruikt bij het geven van voorlichting aan patiënten en ondersteuning bieden bij het proces van ‘shared decision making’. De richtlijn kan ook worden gebruikt voor het maken van patiënten informatiemateriaal.
Deze richtlijn is bestemd voor alle professionals die betrokken zijn bij de diagnostiek, behandeling en begeleiding van patiënten met AL-amyloïdose, zoals internist-hematologen, en internisten-nefrologen, maar ook algemeen internisten, pathologen, nucleair radiologen, cardiologen, neurologen, maag-darm-leverartsen, longartsen, revalidatieartsen, verpleegkundigen, diëtisten en fysiotherapeuten.
Voor het ontwikkelen van de richtlijn is een werkgroep ingesteld, bestaande uit leden van de HOVON Multipel Myeloom werkgroep. Elk lid van de werkgroep is door de Nederlandse Vereniging voor Hematologie gemandateerdvoor deelname. Cardioloog Dr M Oerlemans, UMC Utrecht is gemandateerd door de Nederlandse Vereniging voor Cardiologie. Dr. H Nienhuis, internist-immunoloog UMCG, is gemandateerd door de Nederlandse Internisten Vereniging. De werkgroep werkte gedurende anderhalf jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Bij de revisie is vooral het onderdeel behandeling aangepast en deze aanpassingen zijn vooraf besproken met leden van de HOVON Multipel Myeloom werkgroep en schriftelijk aangepast door de voorzitter Prof Dr MC Minnema met daarna commentaar door 2 MM werkgroepleden Dr Roeloffzen en Drs Groen en de patiënten vertegenwoordiger.
Samenstelling werkgroep AL-amyloïdose 2020
Revisie juli 2024
Alle werkgroepleden hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn en hebben belangenverklaringen ingevuld waarbij is aangegeven welke betrekkingen zij onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. De belangenverklaringen kunt u inzien bij de Nederlandse Vereniging voor Hematologie.
In onderstaande tabel wordt een overzicht gegeven met de belangen van bij de ontwikkeling van deze richtlijn betrokken personen.
|
Naam |
Belangen |
|
Prof Dr MC Minnema Internist hematoloog UMC Utrecht, voorzitter |
Hospitality: Janssen Cilag, Speakers bureau: Janssen Cilag, Pfizer, Siemens, Springer Healthcare. Consultancy: Janssen Cilag, CDR Life, GSK, BMS. Research Funding; Beigene All paid to institution |
|
Dr W Roeloffzen Internist hematoloog,UMCG |
Speaker (not personal): Janssen Cilag, Sanofi. Congres and travel expenses: Janssen Cilag, Sanofi, AbbVie. |
|
Drs K. Groen, Amsterdam UMC |
Payment or honoraria for lectures, presentations, or educational events: Bristol Myers Squibb, Beigene (no personal funding) |
|
Drs B. Woltering, patientenvertegenwoordiger SAN |
geen |
Strenght-of-Recommendation Taxonomy (SORT) gradering
Zoals beschreven in het artikel van Meijer E., et al 6 is voor de richtlijn gekozen voor SORT gradering.
|
Code |
Definitie |
|
A |
Consistent, goede kwaliteit patiënt georiënteerd bewijs |
|
B |
Inconsistent of beperkte kwaliteit patiënt georiënteerd bewijs |
|
C |
Consensus, ziekte georiënteerd bewijs, gewoon in praktijk, expert mening, case studies |
Patiënt georiënteerd bewijs meet uitkomsten belangrijk voor de patiënt; morbiditeit, mortaliteit, verbetering klachten, kostenreductie en kwaliteit van leven. Ziekte georiënteerd bewijs meet surrogaat eindpunten die al dan niet verbeteringen in patiënten uitkomsten reflecteren.
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn is/wordt digitaal verspreid onder allerelevante beroepsgroepen. Ook is de richtlijn te downloaden vanaf de website MEDonline publisher – Richtlijnen publicatie (hematologienederland.nl)
In deze richtlijn en de revisie 2024 worden de patiënten vertegenwoordigd door een afgevaardigde van de patiëntenvereniging Stichting Amyloidose Nederland (SAN), Drs B. Woltering.
De behandeling van AL-amyloïdose is complex en door de komst van nieuwe geneesmiddelen en publicaties aan verandering onderhevig. Naar aanleiding van de eerder gepubliceerde behandelingsrichtlijn uit 2013 is daarom vanuit de HOVON werkgroep Multipel Myeloom een nieuwe werkgroep gevormd met als doel de huidige stand van kennis over de behandeling van AL-amyloïdose in een evidence based richtlijn te verwerken. Deze richtlijn is in 2020 geautoriseerd en gepubliceerd. De huidige versie uit 2024 bevat een update van vooral het behandelingsdeel in verband met nieuwe gepubliceerde data en enkele tekstuele correcties en aanvullingen.
Deze richtlijn geeft een beknopt overzicht van de diagnostiek van alleen systemische AL-amyloïdose, voor andere vormen van amyloïdose is deze richtlijn niet bedoeld. De meest voorkomende betrokken organen bij de ziekte zijn hart, nieren, zenuwstelsel, maagdarmstelsel, lever (en milt), soft tissue (tong, vaten, spieren etc.) en zeldzaam longen. Zie tabel 2 voor de verschillende orgaanaspecten van de ziekte. De basis voor dit specifieke orgaantropisme is niet goed bekend.
De volgende (combinaties van) symptomen worden frequent gezien bij (AL)-amyloïdose en moeten bij aanwezigheid van een afwijkende VLK-ratio of M-proteïne aanleiding geven tot verder onderzoek op korte termijn:
De diagnose AL-amyloïdose wordt gesteld op basis van de aanwezigheid van een plasmaceldyscrasie en in een histologisch biopt aangetoond amyloïd, dat getypeerd is als AL-amyloïd. Het percentage plasmacellen is daarbij niet van belang, dit in tegenstelling tot het verschil in monoklonale gammopathie van onbekende betekenis (MGUS) en MM waarbij een grens van 10% plasmacelinfiltratie in het beenmerg wordt aangehouden.
De diagnostische criteria voor systemische AL-amyloïdose zijn beschreven door de Internationale Myeloom Werkgroep (IMWG), zie tabel 1, op basis van 4 punten, waar allen aan moet worden voldaan.5 De aanwezigheid van door amyloïd veroorzaakte orgaanschade (zoals aan hart, nier, lever, zenuwstelsel en gastro-intestinaal) is het startpunt van de verdenking op amyloidose.
|
SORT grade |
||
|
1 |
Bij elke patiënt met een eerste analyse M-proteïne en/of afwijkende VLK-ratio bij verdenking MGUS of smoldering MM is het aanbevolen bij anamnese, lichamelijk onderzoek en aanvullend onderzoek aandacht te hebben voor amyloïdose- specifieke punten en de analyse uit te breiden met elektrocardiogram (ECG), urinesediment voor eiwit, en in bloedonderzoek N-terminaal-pro brain natriuretic peptide (NT-proBNP) of BNP |
C |
|
2 |
Een buikvetbiopsie is een goede eerste screeningsmethode op deaanwezigheid van amyloïd |
A |
|
3 |
De Congoroodkleuring is de gouden standaard voor het aantonen vanamyloïd |
A |
|
4 |
Wanneer amyloïd is gevonden, zal het moeten worden getypeerdvoor de belangrijkste subtypes AL, AA en ATTR |
A |
|
5 |
De aanwezigheid van een M-proteïne of een verhoogde VLK bijaangetoond amyloïd zonder typering hiervan is niet voldoende om te concluderen dat er sprake is van AL-amyloïdose |
A |
|
6 |
In het geval van een amyloïd cardiomyopathie kan een skeletscintigrafie met 99mTc-HMDP, -DPD of -PYP behulpzaam zijn bij het nader classificeren van het amyloïd. Deze is positief bij de ATTR vorm en meestal negatief bij AL vorm |
A |
|
7 |
Evaluatie van de onderliggende plasmaceldyscrasie bestaat uit een beenmergbiopt en -aspiraat met immunohistochemische kleuringen,flowcytometrische analyse en cytogenetisch onderzoek waarbij de FISH t(11:14) voorrang moet krijgen |
C |
|
8 |
Het in kaart brengen van alle orgaanmanifestaties is van belang voor hetinschatten van de prognose, het maken van keuzes in de behandeling en als uitgangssituatie voor het beoordelen van de orgaanrespons op de ingezette behandeling. De cardiale biomarkers moeten gebruikt worden voor een cardiale risico score |
A |
Het doel van vroegdiagnostiek is om patiënten met AL-amyloïdose te diagnosticeren in een fase waarbij behandeling nog mogelijk is. De kwaliteit van leven en prognose van patiënten wordt sterk beïnvloed door tijdige diagnose. Het risico van vroegdiagnostiek is over diagnostiek bij patiënten die uiteindelijk geen amyloïdose blijken te hebben, met risico op complicaties zoals bijvoorbeeld biopsieën met pijn en een bloedingsrisico voor de patiënt.
1. Aantonen en typering van amyloïd
Aantonen van amyloïd
Op een weefselbiopt dient een Congoroodkleuring te worden verricht en het biopt moet systematisch worden nagekeken met een microscoop met een krachtige lichtbron en polarisatiefilter. Het amyloïd kleurt rood aan en toont bij gebruik van gepolariseerd licht een karakteristiek appelgroen tot geel dubbelbrekingseffect. Een andere manier om amyloïd fibrillen zichtbaar te maken is met elektronenmicroscopie. Het aantonen van amyloïd in een biopt dient altijd te worden opgevolgd met een klinische analyse voor mogelijke aanwezige amyloïdose in een patiënt.
Voor de detectie van amyloïd bij het subtype AL is een buikvetbiopsie het meest eenvoudige en veilige onderzoek met een sensitiviteit van 70-80% en, indien zorgvuldig uitgevoerd, verwerkt en beoordeeld door ervaren personeel een sensitiviteit >90%. Een instructievideo voor het verrichten van een buikvetbiopsie is beschikbaar op de website www.amyloidose-expertise.net. In het algemeen wordt de hoogste sensitiviteit en specificiteit met een biopsie van het aangedane orgaan bereikt en dit kan worden ingezet bij een negatief of onvoldoende beoordeelbaar buikvetbiopt.6Eventueel kan een speekselklierbiopt, lipbiopt of rectumbiopt worden overwogen. Bij alle patiënten met een beenmergbiopt moet Congoroodkleuring worden toegepast, maar de sensitiviteit van het beenmergbiopt voor hetdetecteren van amyloïd is laag, ongeveer 60%. Als met deze onderzoeken geen amyloïd wordt aangetoond ener een blijvende verdenking is op amyloïdose, dan is de volgende stap om de biopten die zijn gedaan te laten reviseren door een ervaren en ter zake deskundig patholoog van een van de expertise centra (figuur 1).
Als er bij een patiënt amyloïd is gevonden op een voorkeurslocatie voor lokale AL-amyloïdose (bijv. urogenitaal, ooglid, conjunctiva, larynx of huid), dan moet mogelijke aanwezigheid van systemische AL- amyloïdose worden onderzocht. Er is sprake van systemische amyloïdose als er amyloïd is aangetoond op twee verschillende plaatsen in het lichaam of als het amyloïd is aangetoond op één plaats in het lichaam in combinatie met een klassiek klinisch beeld van amyloïd depositie op een andere plaats in het lichaam (zie criteria voor orgaanbetrokkenheid, tabel 2).7
Typering van amyloïd
Wanneer amyloïd is gevonden, zal het moeten worden getypeerd. Het verkeerd typeren van het amyloïd kan ernstige klinische consequenties hebben. Zo kan bijvoorbeeld de fout worden gemaakt om aan een oudere patiënt met wild type ATTR-amyloïdose chemotherapie te geven, omdat deze persoon toevallig ook een MGUS heeft. De aanwezigheid van een monoklonale gammopathie alleen is onvoldoende om te concluderen dat er sprake is van AL-amyloïdose. In 10% van de patiënten met een MGUS en amyloïdose bleek er een andere oorzaak voor de amyloïdose gevonden te worden.8 De differentiaal diagnose van systemische amyloïdose omvat o.a. AL-, wild type ATTR-, AA-, erfelijke ATTR- en andere erfelijke typen amyloïdose en deze hebben een verschillende prognose en behandeling.
De meest gangbare manier om amyloïd te typeren is middels immunohistochemische kleuringen. Immunohistochemie is betrouwbaar voor AA-amyloïd, mits voldoende specifieke en sensitieve monoklonale antilichamen worden gebruikt. Immunohistochemie is minder betrouwbaar voor ATTR- amyloïd en vaak niet conclusief voor AL-amyloïd. Om deze reden is in het UMC Utrecht immuno- elektronenmicroscopie opgezet door de afdeling pathologie, zoals ook wordt toegepast in het Amyloid Research and Treatment Center in Pavia.9 Met deze techniek wordt in de literatuur een specificiteit >99% gehaald en hij kan worden toegepast voor alle meest voorkomende vormen van amyloïdose zoals AL, AA, ATTR, Aβ2M, en AApoAI. In het UMC Groningen wordt gebruikt gemaakt van een enzyme-linked immunosorbent assay (ELISA)- panel op buikvetmateriaal om de 3 meest relevante typen amyloïd (AA, AL en ATTR) te typeren. Bij voldoende amyloïd in het materiaal hebben deze testen eenspecificiteit van 99% en een sensitiviteit van 84%.
Als er sprake is van een amyloïd cardiomyopathie kan skeletscintigrafie met 99mTc-HDP, -DPD of -PYP behulpzaam zijn.10 In een multicenter onderzoek bleek cardiale opname >99% sensitief en 86% specifiek te zijn voor cardiale ATTR-amyloïdose. De vals-positieve uitslagen werden veroorzaakt door patiënten met een cardiale AL-amyloïdose en een positieve skeletscintigrafie kan systemische AL-amyloïdose dus niet uitsluiten. Voor ATTR-amyloïdose kan een positief voorspellende waarde van 98-100% bereikt worden met de gecombineerde bevinding van: 1) een graad 2 of 3 cardiale opname (positieve skeletscintigrafie volgens classificatie Perugini); 2) afwezigheid van een M-proteïne in serum of urine; en 3) afwezigheid van verhoogde VLK in bloed. Dit is de enige situatie (positieve skeletscintigrafie, afwezigheid verhoogde VLK en afwezigheid M-proteïne in serum of urine) waarbij de diagnose ATTR- amyloïdose gesteld kan worden zonder dat een biopt noodzakelijk is.
2. In kaart brengen van het hematologische ziekteproces
Beenmergonderzoek
CT-skelet
3. In kaart brengen van de ernst en uitgebreidheid van orgaanmanifestaties
Bij AL-amyloïdose wordt behalve de onderliggende plasmaceldyscrasie ook de ernst en uitgebreidheid van deorgaanmanifestaties in kaart gebracht. Dit is van belang voor het inschatten van de prognose, het maken van keuzes in de behandeling en als uitgangssituatie voor het beoordelen van de orgaanrespons op de ingezette behandeling. Met name het hart, de nieren, lever en het zenuwstelsel (perifeer en autonoom) zijn in dit kader relevant, maar ook betrokkenheid van andere orgaansystemen dient te worden vastgelegd en vervolgd. Orgaanbetrokkenheid wordt vastgesteld aan de hand van de internationale consensus criteria (tabel 2). Biochemische en aanvullende bepalingen die van belang zijn, staan ook weergegeven in tabel 2.
De SAP-scan kan behulpzaam zijn in gevallen waarbij er een klinische verdenking bestaat op amyloïdose, maar waarbij een biopt negatief of twijfelachtig is. De SAP-scan presteert beter dan de conventionele criteria voor het opsporen van amyloïd in de lever en milt en biedt de mogelijkheid de “amyloïdload” te kwantificeren ten behoeve van follow-up. De SAP-scan is niet geschikt voor evaluatie van cardiale betrokkenheid.
Hart
Cardiale betrokkenheid komt voor bij ongeveer 80% van de patiënten. Het kenmerk van cardiale amyloïdose is wandverdikking van zowel septum en linker en rechter ventrikel, met diastolisch hartfalen en behouden ejectiefractie (HFpEF). Volgens internationale criteria is er cardiale betrokkenheid bij een NT-proBNP >332 ng/L (= 332 pg/ml of 39 pmol/L) en/of een gemeten gemiddelde wanddikte >12 mm zonder andere verklaring bij echocardiografie.12
De klachten van cardiale amyloïdose zijn aspecifiek en kunnen bestaan uit moeheid, kortademigheid bij inspanning, en perifere oedemen. Syncope bij inspanning kan worden veroorzaakt door een gefixeerd verlaagd slagvolume, maar ook door geleidingsstoornissen. Syncope bij het starten van ACE inhibitie is typisch voor amyloïdose.13Amyloïd deposities in de kleinere vaten kunnen klachten geven van angina pectoris, kaak- en beenclaudicatio. Meest voorkomende hartritmestoornis bij cardiale amyloïdose is boezemfibrilleren. Bij lichamelijk onderzoek is de bloeddruk vaak laag. De NYHA klasse van de patiënt moet bepaald worden bij diagnose en start van de behandeling, zodat deze ook vergeleken kan worden indien er orgaanrespons optreedt (zie tabel 3).
Zie onderdeel prognose voor het bepalen van de cardiale biomarkers troponine en (NT-pro)BNP.
Het typische ECG heeft lage QRS voltages door de amyloïd infiltratie in het myocard, hetgeen in ongeveer 50- 60% van de patiënten wordt gezien. Daarnaast is er vaak sprake van een mismatch tussen het te verwachten(toegenomen) QRS voltage ten opzichte van de mate van hypertrofie bij echocardiografie. In meer dan 50% van de patiënten wordt daarbij ook pseudo-infarct patroon (QS patroon) gezien. Ook kan er sprake zijn van geleidingstoornissen, zoals een eerstegraads-AV-blok. De P top is vaak afwijkend als gevolg van vertraagde atriale geleiding en dilatatie. Indien de gecorrigeerde QT tijd (QTc) verlengd is, dient QTc verlengende medicatie te worden vermeden. Alle bekende anti emetica zijn QTc verlengend.
Cardiale amyloïdose heeft bij echocardiogram een typisch beeld van een klassieke infiltratieve cardiomyopathie.Differentiatie met andere aandoeningen, zoals een hypertrofische cardiomyopathie of stapelingsziekte kan lastigzijn. Belangrijkste kenmerken zijn verdikking van de linkerventrikelwand >12 mm (linkerventrikelhypertrofie; LVH) in combinatie met rechterventrikelhypertrofie en septale hypertrofie. Indien dit wordt gezien in afwezigheid van een langer bestaande hypertensie of afwezigheid van een ernstige aortaklepstenose en gepaard gaat met een discrepant laag voltage op het ECG, is dit sterk verdacht voor cardiale amyloïdose. De consensuscriteria beschrijven een gemiddelde wanddikte van 12 mm van de linkerventrikel als echografisch criterium, dit is de wanddikte gemeten bij het septum en de posterieur zijde van linkerventrikelwand gedeeld door twee.
De ejectiefractie is meestal behouden (>50%), wel zijn er kenmerken van een gestoorde diastolische functie in combinatie met een verhoogde linkeratrium druk. Een granulair aspect van het myocard kan worden gezien, alhoewel dit kenmerk met de huidige generatie echocardiografie machines minder bruikbaar is geworden. Globale longitudinale strain meting is vaak verminderd en icm met typische ‘apical’ sparing zeer suspect voor cardiale amyloidose.
Bij de MRI kunnen met behulp van “late gadolinium enhancement (LGE)” beeldvorming typische patronen worden gezien, zoals transmurale of subendocardiale aankleuring niet passend bij een coronair stroomgebied. Klassiek is het niet optimaal kunnen “nullen” van het hart myocard door verandering in gadolinium kinetiek. Verder zijn er vaakaanwijzingen voor diffuse myocardiale aantasting t.g.v. amyloïd infiltratie (T1 waarde) en een verhoogd extracellulair volume.
In het geval van aanhoudende klinische verdenking op cardiale amyloïdose zonder dat de diagnose op een andere manier kan worden gesteld dan wel getypeerd, moet een endomyocardbiopt (EMB) worden overwogen. Het EMB moet worden uitgevoerd door ervaren cardiologen en ook de biopt beoordeling vraagt specifieke expertise van de patholoog. De verdenking amyloïdose moet vermeld worden in de aanvraag en indien aanwezig moet daarna het type amyloïd worden bepaald.
Nieren
Het criterium voor betrokkenheid van de nieren is proteïnurie >0.5g/24u (non Bence-Jones eiwit). Belangrijke symptomen zijn perifeer oedeem, gewichtstoename en schuimende urine. Wanneer de orgaanmanifestaties in kaart worden gebracht bij een patiënt met AL-amyloïdose, is het voor de nieren van belang om de volgendelaboratoriumbepalingen te doen: albumine, creatinine, 24-uurs urine op totaal eiwit en creatinine klaring. Als de kliniek en/of het screenend labonderzoek afwijkingen laat zien, kan een nierbiopt verricht worden.
Lever
De consensus criteria voor betrokkenheid van de lever zijn een levergrootte >15 cm in afwezigheid van hartfalen of alkalisch fosfatase (AF) >1.5 keer upper limit of normal (ULN). In de kliniek zijn de volgende symptomen aanwezig:vergrote lever bij palpatie, snel vol gevoel, ascites en icterus. De screening van de lever bestaat naast anamnese enlichamelijk onderzoek uit een aantal laboratoriumbepalingen: AF, GGT, bilirubine, ALAT, ASAT en LDH. Bij afwijkingen in anamnese, LO en/of lab kunnen een echo van de lever, SAP-scan en/of leverbiopt overwogen worden.
Zenuwstelsel
Het criterium voor betrokkenheid van het perifeer zenuwstelsel is de aanwezigheid van een klinisch symmetrische sensomotorische polyneuropathie (PNP) van de onderste extremiteiten. Screenende diagnostiek bestaat uit anamnese, LO en neurologisch onderzoek (NO), waarbij gelet moet worden op de volgende symptomen: paresthesieën, neuropathische pijn en krachtsverlies. Typisch is een symmetrische perifere sensorische>motorische PNP. Wanneer er bij anamnese, LO en NO aanwijzingen worden gevonden voor bovenstaande PNP, kan een elektromyogram (EMG) worden overwogen. Typisch bij amyloïdose is axonale schade op het EMG (itt demyeliniserend zoals bij anti MAG neuropathie).
De criteria voor de betrokkenheid van het autonoom zenuwstelsel omvatten, maagontledigingsstoornissen, pseudo-obstructie, orthostatische hypotensie, erectiele disfunctie, en blaasdisfunctie niet veroorzaakt door directe infiltratie van amyloïd. Naast de klachten die passen bij deze criteria, kunnen ook slikproblemen voorkomen (“eten zakt niet”). Screening bestaat uit anamnese, LO en NO, waarbij gelet moet worden op bovenstaande symptomen. Daarnaast wordt de bloeddruk gemeten; liggend en na 3 minuten staan. Bij afwijkingen van het autonoom zenuwstelsel kan autonoom functieonderzoek (Ewing batterij) overwogen worden.
Maagdarmstelsel
Het consensus criterium voor gastro-intestinale betrokkenheid is biopt-bewezen gastro-intestinale amyloïd depositie. Symptomen die kunnen wijzen op verstoringen in het maagdarmstelsel zijn diarree, obstipatie, of afwisselend diarree en obstipatie, en gewichtsverlies. Als screening kan bij anamnese en LO extra goed gelet worden op deze klachten. Wanneer er afwijkingen worden gevonden tijdens de screening, is het van belang om andere oorzaken voor chronische diarree/obstipatie uit te sluiten. Eventueel kan een gastro- en/of colonoscopie met biopten worden verricht.
Wekedelen
Criteria voor wekedelen betrokkenheid zijn: macroglossie, arthropathie, huidveranderingen (verdikking/verstrakking, nodulair, papuleus, bloedingen), myopathie met biopt bewezen amyloïd depositie of pseudohypertrofie van spieren, lymfadenopathie, en carpaal tunnelsyndroom. Naast klachten passend bij bovenstaande criteria, kunnen additionele symptomen voorkomen, namelijk heesheid, xerostomie, kaakclaudicatio, en periorbitale hematomen (uiting van vasculopathie).
Milt
Het consensus criterium voor betrokkenheid van de milt is aankleuring van de milt met SAP-scan. Symptomen in de kliniek kunnen zijn pijn/ vol gevoel linker bovenbuik, bloedingsproblematiek en infecties met gekapselde bacteriën. Screening bestaat uit handdifferentiatie (Howell Jolly bodies) en vaststellen van de protrombinetijd (PT) en activated partial thromboplastin time (APTT). Bij afwijkingen kunnen een echo van de milt en SAP-scan overwogen worden.
Longen
Criterium voor de betrokkenheid van de longen is biopt-bewezen amyloïd depositie of een radiologisch beeld passend bij interstitiële infiltratie. Symptomen die kunnen passen bij longbetrokkenheid zijn dyspnoe en droge hoest. Een screeningsmethode is de X-thorax, ook belangrijk is voor de uitgangssituatie voor start van behandeling. Bij afwijkingen op de X-thorax kunnen een high resolution CT (HRCT)-scan (beeld van interstitiële infiltratie) en/of een biopt overwogen worden.
|
Tabel 1. IMWG diagnostische criteria systemische AL-amyloïdose8 |
|
Alle 4 criteria moeten aanwezig zijn: |
|
1. Aanwezigheid van door amyloïdose veroorzaakte orgaanschade (zoals aan hart, lever, zenuwstelsel en gastro-intestinaal). |
|
2. Aangetoond amyloïd, middels Congoroodkleuring in een weefselbiopt (bijv. buikvetbiopt, beenmergbiopt of orgaanbiopt). |
|
3. Het amyloïd moet zijn getypeerd als AL-amyloïd middels immunohistochemie, massaspectometrie of immuno-elektronenmicroscopie |
|
4. Er moet bewijs zijn van de aanwezigheid van een plasmaceldyscrasie (serum of urine M-proteïne, abnormale VLK-ratio, of een plasmacelkloon in het beenmerg) |
|
Tabel 2. Orgaanbetrokkenheid in het kader van AL-amyloïdose |
||||
|
Orgaan |
Kliniek |
Screening bij het in kaart brengen AL-amyloïdose |
Diagnostiek bij afwijkende kliniek of afwijkend screenend onderzoek |
Consensus criteria voor orgaan betrokkenheid* |
|
Nieren |
Perifeer oedeem, gewichtstoename, schuimende urine |
Albumine, creatinine, 24-uurs urine op totaal eiwit, creatinine klaring |
Nierbiopt |
Proteïnurie >0.5g/24u (non Bence-Jones eiwit) |
|
Hart |
Dyspnoe d’effort, perifeer oedeem, verhoogde CVD, ascites, syncope, moeheid, palpitaties |
(hs)TnT of TnI en (NT-pro)BNP, ECG |
Echo cor. MRI hart (met gadolinium). Botscintigrafie (bij dd ATTR-amyloïdose), endomyocardbiopt |
Gemiddelde LV wanddikte >12 mm in afwezigheid andere cardiale oorzaak of NT-proBNP >332 ng/l of 39 pmol/l in afwezigheid van nierfalen en BF |
|
Lever |
Vergrote lever bij palpatie, snel vol gevoel, ascites, icterus |
AF, GGT, bilirubine, ALAT, ASAT, LDH |
Echo lever. SAP-scan. Leverbiopt |
Levergrootte >15 cm in afwezigheid van hartfalen of AF >1.5 keer ULN |
|
Perifere zenuwstelsel |
Paresthesieën, neuropathische pijn, krachtsverlies. Typisch: symmetrische perifere sensorische>motorische pnp a |
Anamnese gericht op a |
EMG (axonale sensomotorische polyneuropathie) |
Klinisch symmetrisch sensomotore pnp van de onderste extremiteiten |
|
Autonome zenuwstelsel |
Klachten van orthostase, collaps, mictieproblemen, slikproblemen, maagontledigingsst., intestinale pseudo-obstructie, erectiele disfunctie b |
Anamnese gericht op b. Bloeddruk liggend en na 3 minuten staan |
Evt. autonoom functieonderzoek |
Maagontledigingsst., pseudo-obstructie, orthostatische hypotensie, erectiele disfunctie, blaasdisfunctie niet veroorzaakt door directe infiltratie van amyloïd |
|
Gastro-intestinaal |
Diarree, obstipatie of afwisselend diarree en obstipatie, gewichtsverlies c |
Anamnese gericht op c |
Uitsluiten andere oorzaken chronische diarree/obstipatie. Gastro- en/of colonoscopie met biopten |
Biopt bewezen amyloïd depositie gastro-intestinaal |
|
Wekedelen
|
Macroglossie met problemen tongmotoriek, gewrichtsklachten, pseudohypertrofie, CTS-klachten, heesheid, huidafwijkingen, lymfadenopathie, xerostomie, kaakclaudicatio, periorbitale hematomen (uiting van vasculopathie) d
|
Anamnese en lichamelijk onderzoek gericht op d |
Evt. MRI-scan gewrichten of SAP-scan ter beoordeling op arthropathie. PA verkrijgen van verdachte weefsel. |
Macroglossie, arthropathie, huidveranderingen, myopathie met biopt bewezen amyloïd depositie of pseudohypertrofie van spieren, lymfadenopathie, carpaal tunnelsyndroom |
|
Milt |
Pijn/ vol gevoel linker bovenbuik, bloedingsproblematiek, infecties met gekapselde bacteriën. |
PT, APTT, Handdifferentiatie: Howell-Jolly bodies |
Echo milt. SAP-scan. |
Aankleuring milt met SAP-scan |
|
Longen |
Dyspnoe, droge hoest |
X-thorax (ook als uitgangssituatie voor start behandeling) |
Evt. HRCT-scan: beeld van interstitiële infiltratie. Eventueel biopt. |
Biopt bewezen amyloïd depositie of radiologisch beeld passend bij interstitiële infiltratie |
|
Niet-invasieve diagnostische criteria voor orgaanbetrokkenheid worden alleen gebruikt in patiënten, waarbij middels een biopt de diagnose AL-amyloïdose is gesteld. |
||||
|
Tabel 3. New York Heart Association (NYHA) klasse |
|
|
NYHA klasse I |
geen symptomen of beperkingen: geen vermoeidheid, kortademigheid of pijn op de borst bij normale fysieke inspanning. |
|
NYHA klasse II |
enige beperking van de fysieke activiteiten: bij rust geen symptomen, maar normale activiteiten veroorzaken kortademigheid, vermoeidheid of pijn op de borst. |
|
NYHA klasse III |
belangrijke beperking van de inspanningscapaciteit: geen symptomen bij rust, maar een minieme inspanning kan reeds symptomen uitlokken. |
|
NYHA klasse IV |
de patiënt kan geen enkele inspanning uitvoeren zonder symptomen. De symptomen zijn reeds aanwezig bij rust en bij de minste inspanning nemen deze toe in ernst. |
De prognose van AL-amyloïdose wordt bepaald door zowel de onderliggende plasmacelkloon, als de mate van cardiale betrokkenheid.
|
|
SORT grade |
|
|
1 |
Het absolute verschil tussen de betrokken VLK en de niet-betrokken keten (dVLK) heeft prognostische waarde voor amyloïdose patiënten (Freelite assay): dVLK van ≥180 mg/dL bij diagnose is geassocieerd met verminderde overleving |
A |
|
2 |
Een cardiale risicoscore dient voor elke amyloïdose patiënt bij diagnose te worden bepaald, omdat deze prognostische waarde heeft |
A |
|
3 |
Advies is om de Europese cardiale prognostische score te gebruiken (tabel 3) |
C |
|
4 |
Cytogenetica onderzoek, inclusief de t(11;14) translocatie is wenselijk, omdat deze informatie blijkt te geven over kans op respons bij specifieke behandelingen |
C |
|
5 |
De hematologische respons op therapie is essentieel voor de prognose en moet daarom tijdens behandeling na elke cyclus worden vastgesteld door middel van VLK metingen in perifeer bloed |
A |
1. Plasmacelkloon
In een retrospectieve monocenter analyse van 415 patiënten die een autologe stamceltransplantatie hebben ondergaan, had 28% van de patiënten >10% plasmacellen in het beenmerg vastgesteld met morfologie op aspiraat of biopt. In zowel univariate als multivariate analyse bleek dat deze groep een slechtere overleving had dan de groep met ≤10% plasmacellen, met relatief risico (RR) van 1.93 (95% CI 1.19-3.10).14
Daarnaast heeft ook het absolute verschil tussen de betrokken VLK keten en de niet-betrokken keten (dVLK) een prognostische waarde. Een dVLK van ≥180 mg/L (Freelite assay) bij diagnose blijkt een negatief effect te hebben op overleving, met een statistisch significante hazard ratio (HR) van 1.4 in multivariate analyse.15 Patiënten met een dVLK <50 mg/L blijken juist een betere prognose te hebben, HR = 0.50, P = .003 of mediaan 117 vs 21 maanden, P < .001, vastgesteld in 2 verschillende studies.16,17
2. Cardiale betrokkenheid
Er zijn verschillende cardiale biomarkers en daarmee prognostische modellen gepubliceerd die standaardisatie gecompliceerd maken. De cardiale troponinen I (cTnI) en T (cTnT) zijn sensitief en specifiek voor cardiale schade enbeiden zijn in gebruik in verschillende assay vormen. Daarnaast is meer recent de high sensitivity troponine T (hs-TnT) in veel ziekenhuizen geïntroduceerd, maar deze heeft vooral in de lagere concentraties slechte correlatie met de cTnT test.
Natriuretische peptides afkomstig uit myocard cellen zijn verhoogd bij volume expansie en verhoogde wanddruk. Het prohormoon proBNP wordt omgezet in actief BNP en het biologische inactieve NT- proBNP fragment.
Bij AL-amyloïdose is meeste onderzoek gedaan naar de biomarkers cTnT en NT-proBNP. Belangrijk is dat er vele testen zijn en dat sommige BNP of NT-proBNP weergeven als pg of ng, maar andere als nmol of pmol en dus omgerekend moeten worden (zie tabel 5).
De dVLK waarde ≥180 mg/L is meegenomen in een revised prognostische MAYO score.15 De orginele MAYO score was al eerder vastgesteld in 2004 en is gebaseerd op metingen van de serum waarden van de cardiale enzymen NT-proBNP en troponine bij diagnose. Er kunnen in het oude classificatiesysteem 3 risicogroepen worden gedefinieerd met een verschillende overleving (zie tabel 1) van respectievelijk 26.4, 10.5 en 3.5 maanden.18
In het nieuwere MAYO score systeem kunnen 4 risico groepen worden vastgesteld met verdeling van stadium I, II, IIIen IV van respectievelijk patiënten aantallen 189 (25%), 206 (27%), 186 (25%) en 177 (23%). De overeenkomstige mediane overall survival (OS) vanaf diagnose was 94.1, 40.3, 14, en 5.8 maanden, respectievelijk, zie tabel 3. De 5 jaars overleving was 59%, 42%, 20%, en 14% respectievelijk. Behalve NT-proBNP kan ook de BNP waarde worden gebruikt met daarbij een afkapwaarde van 400 ng/ml. De 5 jaars overleving van 68%, 60%, 27%, en 14%, respectievelijk, is ongeveer gelijk aan de waardes bij gebruik van de NT-proBNP test. In een recente analyse demonstreerde de MAYO groep afkapwaardes voor het gebruik van de high sensitivity TnT test, zie de respectievelijke tabellen.19
Omdat de stadium III patiënten in het 2004 MAYO classificatiesysteem in de praktijk een zeer diverse groep bleek te zijn, is er in 2013 een aanpassing gepubliceerd d.m.v. retrospectieve data van 4 grote Europese amyloïdose centra. In totaal werden 346 stadium III patiënten geïncludeerd. In multivariate analyse bleek dat een NT-proBNP >8500 ng/L en systolische bloeddruk (SBP) van <100 mmHg significante negatieve parameters waren voor overleving.20 De mediane overleving voor de totale stadium III patiënten was iets beter dan eerder gepubliceerd, maar nog steeds slecht en mediaan 7 maanden. 27% van de patiënten overlijden binnen 3 maanden en de geschatte 2 jaars overleving was 29%. Indien deze stadium III patiënten een of beide van de 2 risicofactoren hadden, was hun mediane OS respectievelijk 6 en 3 mnd. Echter, de stadium III patiënten zonder deze 2 risicofactoren, dus met een NT-proBNP ≤8500 ng/L of SBP ≥100 mmHg, hadden een veel betere overleving van mediaan 25 maanden (tabel 2). I.v.m. met de standaardisatie problemen met bloeddrukmetingen wordt in de praktijk stadium III patiënten onderverdeeld in IIIa en IIIb patiënten o.b.v. hun NT-proBNP waarde van lager of hoger dan 8500 ng/L.
Indien alleen serum BNP meting beschikbaar is kan eventueel het Boston schema worden gebruikt. 21 De afkapwaarde van BNP >81 pg/mL en TnI >0.1 ng/mL correleren sterk met het MAYO NT-proBNP systeem (κ = 0.854) en binnen de stadium III patiënten bleek de IIIb subgroep te definiëren met een BNP waarde
>700 pg/ml (tabel 4). De mediane overleving was 1.0 jaar voor stadium IIIb, 4.3 jaar voor stadium IIIa,
9.4 jaar voor stadium II en niet bereikt voor stadium I patiënten. Van de patiënten met stadium IIIb overleed 43.6% binnen 6 mnd.
Voor patiënten met nier-betrokkenheid is een prognostische score ontwikkeld om het risico op het ontwikkelen van terminaal nierfalen te bepalen.22 Deze is gebaseerd op de proteïnurie per 24 uur en de estimated glomerular filtration rate (eGFR). Het test cohort bevatte 461 patiënten en het validatie cohort 271 patiënten met renale amyloïdose zonder dialyse bij diagnose. Met name de patiënten met een eGFR <50 ml/min en meer dan 5 gram proteïnurie hebben een sterk verhoogde kans om na 3 jaar terminaal nierfalen te ontwikkelen, zie tabel 6.
3. Cytogenetica
In tegenstelling tot MM zijn er bij AL-amyloïdose geen cytogenetische afwijkingen bekend die kunnen voorspellen voor overleving. In een retrospectieve monocenter studie met 401 patiënten en cytoplasmatisch aankleuren van immunoglobulin FISH (cIg-FISH) bleek 81% van de patiënten een abnormale FISH uitslag te hebben. Veel voorkomende afwijkingen waren translocaties van chromosoom 14q32 (52%); vooral t(11;14) (43%), maar ook t(14;16) (3%) en t(4;14) (2%) waren in mindere mate aanwezig. Andere afwijkingen waren monosomie 13/deletie 13q (30%), trisomie 9 (20%), 15 (14%), 11 (10%) en 3 (10%). Er blijkt dus opvallend meer t(11;14) voor te komen dan bij MM.
Er zijn retrospectieve data die aangeven dat patiënten met een t(11:14) minder goede respons op bortezomib hebben, dit is verder beschreven in het eerstelijnsbehandeling hoofdstuk.23,24 Er zijn meerdere retrospectieve studies gepubliceerd met venetoclax (combinatie) therapie in recidief AL amyloidose met ORR tussen 67-88% (≈ 60-70% CR/VGPR) maar prospectieve data ontbreken en is er geen registratie van een BCL-2 remmer voor AL amyloidose of Multipel Myeloom. Het advies is om cytogenetica te laten bepalen op het beenmergaspiraat volgens het standaard MM panel met voorrang voor de t(11;14).25 Want alhoewel het nog niet uitgekristalliseerd is hoe deze uitslagen in te passen zijn in de keuze van behandeling, heeft het de voorkeur dit nu wel te verrichten. Door het verzamelen van data in bijvoorbeeld de NKR, komen we steeds verder om de rol van cytogenetica in de behandeling en prognose van patiënten vast te stellen.
4. Hematologische respons tijdens behandeling
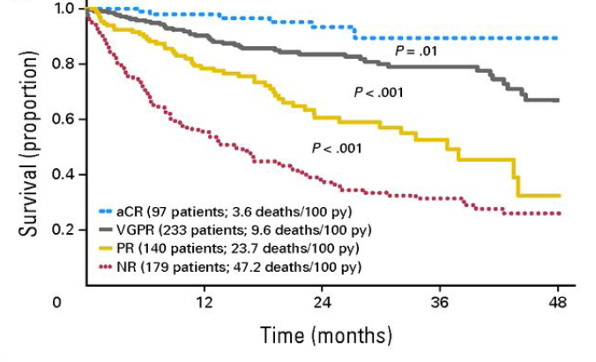
Al langer is bekend dat de mate van hematologische respons zeer belangrijk is voor de overleving van AL-amyloïdose patiënten. Ook meer recent met de huidige behandelmethoden is dit wederom aangetoond waarbij het halen van een tijdige (<3 cycli) en zeer goede partiele respons (VGPR, anders gedefinieerd dan bij MM, zie hoofdstuk ‘Definitie van hematologische en orgaanrespons’) of complete respons (CR) de beste overleving geeft. In een landmark analyse vanaf 6 maanden na diagnose met een testcohort van 816 patiënten en een separaatvalidatie cohort van 374 patiënten met diagnose tussen 2002 en 2010, werden nieuwe responscriteriagedefinieerd die voorspellend waren voor overleving.26 Patiënten die een CR bereikten, hadden een uitstekende 5 jaars prognose en de overleving voor patiënten met een VGPR was slechter met een HR van 2.67 [1.26-5.66, p= 0.01], maar nog steeds met een verwachte overleving van 80-90% bij 3 jaar. Voor patiënten die een partiele respons (PR, dVLK vermindering > 50%) bereikten, was de HR 6.24 [2.96- 16.15, p < .001] en voor patiënten zonder respons het slechtste met een HR 12.34 [6.03- 25.35, p < .001] (Figuur 1). Het belang van het bereiken van een CR/VGPR geldt ook voor cardiale stadium IIIb patiënten.27 Patiënten met een CR/VGPR dag 30 na starten therapie hadden een mediane overleving van 26 maanden en de groep zonder CR/VGPR een overleving van 5 maanden. Het minimaal behalen van een VGPR en nog beter een CR, wordt daarom beschouwd als het doel van behandelingbij systemische AL-amyloïdose en tussentijds beoordelen van hematologische respons tijdens behandeling is belangrijk om de behandeling te kunnen aanpassen indien de daling van de dVLK onvoldoende is.
|
Tabel 1. MAYO risico score 2004 |
||||
|
Stadium |
NT-proBNP (ng/l of pg/ml) |
Troponine T of (µgr/l) |
Troponine I (µgr/l) |
Mediane OS (mnd) |
|
I |
< 332 |
< 0.035* |
< 0.1 |
26.4 / 27.2 |
|
II |
Niet passend bij I of III |
|
|
10.5 / 11.1 |
|
III |
≥ 332 |
≥ 0.035 |
≥ 0.1 |
3.5 / 4.1 |
|
*hsTnT 50 ng/L |
||||
|
Tabel 2. Europese score aanvullend op MAYO 2004 stadium III patiënten |
|||
|
Stadium |
NT-proBNP (pg/ml) |
SBP (mmHg) |
Mediane OS (mnd) |
|
IIIa |
≥ 332 en ≤ 8500 |
≥ 100 |
25 |
|
IIIb |
> 8500 |
< 100 |
6 mnd (indien beide 3 mnd) |
|
Tabel 3. Revised MAYO 2012* |
||
|
Stadium |
Mediane OS (mnd) (NT-proBNP) |
Mediane OS (mnd) (BNP) |
|
I |
94.1 |
Niet bereikt |
|
II |
40.3 |
68.8 |
|
III |
14 |
16.7 |
|
IV |
5.8 |
6.7 |
|
*Elk item hieronder benoemd, is 1 punt. Geen punten is stadium I, 1 punt is stadium II, 2 punten stadium III en 3 punten stadium IV:
|
||
|
Tabel 4. Boston score 2019 |
|||
|
Stadium |
BNP (pg/ml) |
Troponine I (µgr/l) |
Mediane OS (jaren) |
|
I |
< 81 |
< 0.1 |
Niet bereikt |
|
II |
Niet passend bij I of III |
|
9.4 |
|
III IIIb |
≥ 81 ≥700 |
≥ 0.1 |
4.3 1.0 |
|
Tabel 5. Omrekenfactoren voor SI- en massa-eenheden van BNP en NT-proBNP |
||||
|
|
SI-eenheid |
Conversie van SI-eenheid naar massa-eenheid |
Conversie van massa-eenheid naar SI-eenheid |
Massa-eenheid |
|
BNP |
pmol/L |
x 3,460 |
x 0,289 |
pg/ml |
|
NT-proBNP |
pmol/L |
x 8,474 |
x 0.118 |
pg/ml |
|
Tabel 6. Renale prognostische score voor terminaal nierfalen |
|||
|
Stadium |
eGFR ml/min per 1.73 m2 |
Proteïnurie/24 uur |
Risico op dialyse 3 jaar na diagnose |
|
I |
≥ 50 |
≤ 5 gram |
0-3% |
|
II |
Eén van beiden verhoogd |
|
11-25% |
|
III |
< 50 |
>5 gram |
60-75% |
Aanbevelingen
|
|
SORT grade |
|
|
1 |
De respons-definities van de internationale consensus werkgroep worden gevolgd, waarbij zowel de betrokken als niet-betrokken VLK wordt gemeten en voor het vaststellen van CR ook immuunfixatie testen worden uitgevoerd op bloed en urine |
A |
|
2 |
Het is aan te bevelen om per kuurcyclus hematologische respons te meten, indien na 3 kuren geen VGPR of beter is bereikt, moet sterk een andere anti-plasmacel behandeling worden overwogen |
C |
Om respons op behandeling te kunnen vaststellen is het belangrijk vooraf vast te stellen wat de respons- parameters zijn. Voor de meeste patiënten zal dit voor de hematologische respons de VLK bepaling in het serum zijn, maar ook de serum en urine immuunfixatie testen van het M-proteïne zijn belangrijk en moeten herhaald worden voor het vaststellen van een CR.12 Omdat het verschil tussen de dVLK voor het bepalen van PR noodzakelijk is, moet deze voor start van de behandeling berekend worden.37 De VGPR definitie is een dVLK <40 mg/L (Freelite). Het advies is om na elke cyclus een hematologische respons meting te doen om zowel tijdig in te grijpen indien de respons onvoldoende is, maar ook om te stoppen met behandeling indien een stabiele CR is bereikt.28 Ook bij immunomodulerende imide drugs (IMiD) en anti-CD38 therapie wordt de therapie vaker gestopt bij stabiele CR of bij een totale behandelingsduur van maximaal 2 jaar. Een beenmergonderzoek is niet nodig voor het vaststellen van een CR, alhoewel er net als bij MM zeker ook data zijn die aangeven dat het bereiken van negatieve minimale residuale ziekte (MRD) voorspellend is voor betere overleving en betere orgaanrespons.29-32 In tabel 1 zijn de hematologische responscriteria vermeld.
Onderbouwing
Om respons op behandeling te kunnen vaststellen is het belangrijk vooraf vast te stellen wat de respons-parameters zijn. Voor de meeste patiënten zal dit voor de hematologische respons de VLK bepaling in het serum zijn, maar ook de serum en urine immuunfixatie testen van het M-proteïne zijn belangrijk en moeten herhaald worden voor het vaststellen van een CR.18 Omdat het verschil tussen de dVLK voor het bepalen van VGPR en PR noodzakelijk is, moet deze voor start van de behandeling berekend worden.37 Het advies is om na elke cyclus een hematologische respons meting te doen om zowel tijdig in te grijpen indien de respons onvoldoende is, maar ook om te stoppen indien een stabiele CR is bereikt.39 Ook bij immunomodulerende imide drugs (IMiD) en anti-CD38 therapie wordt de therapie vaker gestopt bij stabiele CR of bij een totale behandelingsduur van maximaal 2 jaar.40 41 Een beenmergonderzoek is niet nodig voor het vaststellen van een CR, alhoewel er net als bij MM zeker ook data zijn die aangeven dat het bereiken van negatieve minimale residuale ziekte (MRD) voorspellend is voor betere overleving.42 43 In tabel 1 zijn de hematologische responscriteria vermeld.18
|
|
SORT grade |
|
|
1 |
Breng voor start therapie alle betrokken organen in kaart zodat verbetering in orgaanfunctie vastgesteld kan worden |
A |
|
2 |
Voor hart, nieren en lever zijn officiële orgaanresponscriteria vastgesteld die vervolgd moeten worden, zowel tijdens, maar vooral na afsluiten van therapie |
A |
Onderbouwing
Orgaanresponsen kunnen zowel met behulp van anamnese, bloed- en urineonderzoek en beeldvorming vastgesteld worden. Ook hier is het voor start behandeling belangrijk vast te stellen wat de betrokken organen zijn en hoe deze in het vervolg meegenomen kunnen worden om mogelijke orgaanverbetering of -verslechtering te kunnen vaststellen. Orgaanresponsen komen later en trager tot stand dan hematologische responsen. Ook de invloed van bijvoorbeeld renale klaring, hypertensie en decompensatio cordis op respectievelijk de NT-proBNP waarde en de levergrootte moeten in de beoordeling van de orgaanresponsen worden meegenomen. Bij het behalen van een hematologische respons heeft >50% van de patiënten ook een nier, hart of lever verbetering. Het advies is om orgaanresponsen elke 3 maanden te bepalen tijdens de actieve behandeling. Beeldvorming van het hart (MRI of echocardiografie), lever en eventuele SAP-scan zouden 1-2 jaarlijks moeten worden vervolgd tot aan stabilisatie indien afwijkend bij start. Alleenvoor het hart, lever en nieren zijn officiële orgaanresponscriteria vastgesteld en deze staan beschreven in tabel 2. In tegenstelling tot de eerdere richtlijn is de wanddikte van de linkerventrikel van het hart nu geen responscriterium meer omdat deze zelden bleek te verminderen. Omdat er meestal geen verbeteringen worden vastgesteld in zenuwgeleidingsonderzoek zijn deze ook niet meegenomen in de huidige richtlijn. In 2018 en 2022 zijn nieuwe criteria vastgesteld in multicenter retrospectief onderzoek voor de diepte van (cardiale) orgaan respons meting maar deze zijn nog niet meegenomen in de officiële richtlijnen. Een betere orgaan respons was geassocieerd met een betere prognose.33,34
|
Tabel 1. Hematologische respons18 |
|
|
Complete response |
negatieve serum en urine Immuunfixatie en normale VLK ratio of negatieve serum en urine Immuunfixatie
en
hogere niet betrokken VLK waarde dan betrokken VLK waarde met afwijkende of normale VLK ratio
|
|
Modified complete response |
Patiënten met M-proteïne-negatief serum en urine via immuunfixatie, die geen genormaliseerde VLK-ratio bereikten vanwege suppressie van niet betrokken serum VLK beneden de ondergrens van normaal (VLK-ratio abnormaal of normaal) en die genormaliseerde of onder beneden grens van normaal betrokken VLK bereikten |
|
Very good partial response |
Vermindering in de dVLK waarde <40 mg/L |
|
Partial response |
Vermindering van ≥50% dVLK waarde |
|
No response |
Minder dan PR, geen progressie |
|
Progression |
Vanaf CR; abnormale VLK-ratio en verdubbeling absolute waarde van betrokken VLK (vanaf laagste waarde) of weer meetbaar M-proteïne Vanaf start therapie, PR of geen respons: betrokken VLK waarde stijging van minimaal ≥50% en ook minimaal >100 mg/L of 50% toename M-proteïne en waarde >5 g/L of 50% toename M-proteïne urine >200 mg/dag |
|
Tabel 2. Orgaanrespons en progressie criteria |
||
|
Nier |
Respons |
≥50% vermindering totaal eiwit in 24 uurs urine en absoluut minimaal daling van 0.5 gram/24 uur. Daarbij geen verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR) |
|
Progressie |
≥50% toename (minimaal 1 g/24 uur) van totaal eiwit urine gerekend vanaf laagste waarde of ≥25% toename serum creatinine of 25% vermindering eGFR gerekend vanaf laagste waarde |
|
|
Nier, nieuw30 |
Respons |
≥30% vermindering totaal eiwit in 24 uurs urine of Vermindering totaal eiwit naar <0.5 gr/dag zonder verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR) |
|
Progressie |
25% vermindering eGFR |
|
|
Hart |
Respons |
Vermindering van NT-proBNP van ≥30% en minimaal >300 ng/L (35 pmol/L) berekend vanaf startwaarde in patiënten met een NT-proBNP >650 ng/L (77 pmol/L) of NYHA stadium verbetering van minimaal 2 stadia in patiënten met NYHA 3 of 4 bij start |
|
Progressie |
Toename NT-proBNP ≥30% en minimaal >300 pg/ml (35 pmol/L) vanaf laagste waarde. Alleen indien geen verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR) te bepalen of Toename Troponine ≥33% of Daling ejectiefractie van ≥10% (absoluut) |
|
|
Lever |
Respons |
Vermindering van ≥50% van afwijkende waarde alkaline phosphatase serum of Vermindering van de levergrootte met meer dan 2 cm |
|
Progressie |
Toename ≥50% van alkaline phosphatase serum berekend vanaf laagste waarde |
|
|
|
SORT grade |
|
|
1 |
Patiënten worden gescreend voor mogelijkheid behandeling met intensieve therapie gezien langdurige PFS en OS die hierbij gehaald worden |
B |
|
2 |
Bij toepassen intensieve therapie gebruik stamcelmobilisatie zonder cyclofosfamide en high dose melfalan dosering 200 mg/m2 |
C |
Het is zeer belangrijk de behandeling bij patiënten met AL-amyloïdose aan te passen aan hun klinische conditie. De cardiale risico inschatting is daarbij een belangrijk hulpmiddel, maar ook andere parameters moeten daarbij in overweging worden genomen, zie daarvoor tabel 1.
In tegenstelling tot de behandeling van MM is slechts een minderheid van de patiënten onder de 70 jaar fit genoeg voor het ondergaan van een ASCT.35 Indien de selectie criteria niet goed worden toegepast, maar ook als het transplantatie centrum onvoldoende ervaring heeft, is het risico op overlijden door de stamceltransplantatie verhoogd. Het voordeel van de hoge dosis melfalan (HDM) en de ASCT is de zeer lange progressievrije overleving (PFS) en goede OS die gezien wordt en beter is dan bij MM (tabel 3, figuur 1).36,37
In Nederland is het gebruikelijk om, gelijk aan de behandeling van MM, inductie (immuno) chemo- -therapie vooraf aan de HDM + ASCT te geven. Door therapie vooraf worden diepere responsen behaald en vindt een vorm van preselectie plaats van patiënten die chemotherapie beter verdragen, voordat de HDM wordt gegeven.38. Voorkeur heeft het om een inductie schema te geven dat bortezomib bevat en daarom wordt het cyclofosfamide-bortezomib-dexamethason (CyBorD) schema geadviseerd dat goed verdragen wordt en ook goede responsen geeft. Meestal worden 3 tot 4 inductiekuren gegeven, zie tabel 2 en chemotherapie hoofdstuk niet-intensieve therapie.
In 2021 zijn de positieve resultaten van de gerandomiseerde fase III Andromeda studie gepubliceerd waarbij in de experimentele arm, de hematologische response rate en de diepte ervan vergelijkbaar zijn met de behaalde resultaten van bijv de HOVON 104 studie en andere studies met ASCT.38,39 De daratumumab-CyBorD therapie is EMA goedgekeurd in 2021. Zodra deze combinatie in NL verrgoed wordt, dan is het advies om bij patiënten in de eerstelijnsbehandeling te starten met daratumumab-CyBorD behandeling en alleen bij onvoldoende hematologische respons en bij fitte patiënten wordt consolidatie met ASCT aanbevolen. HDM en ASCT kan ook in latere lijnen van therapie worden toegepast.40
1. Selectiecriteria voor HDM en ASCT
De selectie criteria kunnen wisselen per land en centrum. Tabel 1 is een opsomming van de criteria zoals ook toegepast in de HOVON 104 AL-amyloïdose studie aangevuld met nieuwe inzichten.48
2. Stamcelmobilisatie
Stamcelmobilisatie en aferese kunnen ongebruikelijke bijwerkingen hebben. Bij het gebruik van granulocyt-koloniestimulerende factor (G-CSF) is een syndroom van hypoxie en hypotensie beschreven, waarschijnlijk door deinductie van een “capillary leak syndrome”. De geadviseerde dosis van G-CSF is 10 mg/kg per dag voor 4 tot 5 dagen. De cyclofosfamide mobilisatie chemotherapie vooraf is meestal niet nodig, maar kan worden overwogen bij patiënten met hogere plasmacelinfiltratie in het beenmerg bij start (>10%) of bij patiënten met een lenalidomide voorbehandeling.
3. Autologe stamceltransplantatie
Het conditioneringsschema is HDM 200 mg/m2. Lagere dosis melfalan is geassocieerd met verminderde hematologische respons en PFS, maar kan toegepast worden om de toxiciteit bij patiënten te verminderen. De dosis wordt aangepast aan de nierfunctie van de patiënt. De aanbevolen minimale eGFR grens voor het ondergaan van een ASCT (tabel 1) is ≥30 ml/min. Toch kan een zeer selecte groep patiënten met een stabiele slechte nierfunctie of dialyse en geen tot minimale betrokkenheid van andere organen, soms wel een ASCT ondergaan in centra met veel ervaring en zorgvuldig multidisciplinair overleg vooraf. Lenalidomide onderhoudstherapie wordt niet standaard aangeraden na ASCT i.v.m. ontbreken van bewijs voor langere overleving, de bijwerkingen, en al goede en langdurige responsduur na ASCT.
|
Tabel 1. Selectiecriteria voor high dose melfalan en autologe stamceltransplantatie |
|
|
Leeftijd |
≤70 jaar |
|
ECOG-PS* |
0, 1 of 2 |
|
NYHA |
1 of 2 |
|
NT-proBNP BNP |
<5000 pg/ml of ng/L = <590 pmol/L <500 pg/ml = <145 pmol/l |
|
Troponine T of Troponine I |
≤0.06 ug/L of ≤0.1 ng/mL |
|
Ejectie fractie cor |
≥45% |
|
Bloeddruk |
Systole ≥90 mm Hg |
|
eGFR |
≥30 ml/min/ 1.73m2 or on dialysis |
|
Bilirubine |
≤2 x ULN |
|
Symptomatic effusions |
Niet aanwezig |
|
* Eastern Cooperative Oncology Group Performance Status |
|
|
Tabel 2. Schema inductie chemotherapie met HDM en ASCT |
||
|
Therapie |
Tijdslijnen |
Aanvulling |
|
CyBorD inductie, 3-4 maal
|
Cyclus a 28 dg |
|
|
Stamcelmobilisatie, zonder Cyclofosfamide priming. G CSF 10 µg/kg |
Start 4-6 wk na start laatste inductie kuur |
|
|
Aferese |
Vanaf dag +4 na start G-CSF |
Target CD34+ cellen voor 1 (tot 2 bij jongere patiënt) stamceltransplantatie |
|
HDM 200 mg/m2, aanpassing nierfunctie conform MM richtlijn |
Vanaf 3 wk na ferese |
Geen cyclofosfamide gebruikt en daarom snellere opname HDM mogelijk |
|
Tabel 3. Recente publicaties HDM met ASCT. |
|||||
|
Publicatie |
Type |
Nr. patients |
ORR (CR) % |
TRM (%) |
OS (%) |
|
Landau et al41 |
Retrospectief |
143 |
CR 43% bij 12 mnd (83 pts) |
5% |
Mediaan 10.4 jaar |
|
Sanchorawalaet al42 |
Prospectief Bortezomib- |
35 |
ORR 100% CR 63% |
8.5% |
5 jaar 83% |
|
|
dex inductie |
|
|
|
|
|
Hazenberg et al43 |
Prospectief VAD inductie |
69 |
ORR 46% CR 13% |
4% |
Mediaan 10 jaar |
|
Parmar et al44 |
Retrospectief |
80 |
ORR 75% CR 18.6% |
7.5% |
10 jaar 56% |
|
Huang et al45 |
Prospectief |
56 |
ORR |
3.6% |
2 jaars 95% |
|
|
fase III +/- |
|
85.7% and53.5% |
|
en 69.4% |
|
|
Bortezomib- |
|
CR |
|
|
|
|
dex inductie |
|
67.9% and35.7% |
|
|
|
|
(28 pt) |
|
|
|
|
|
D’Souza et al46 |
Retrospectief |
1536 |
ORR 71% CR 37% (2007-2012 cohort) |
5% (2007-2012 cohort) |
5 jaars 77% (2007-2012 cohort) |
|
Cibeira et al47 |
Retrospective |
421 |
CR 34% |
5.6% (2004- 2008 cohort) |
Mediaan 6.3 jaar |
|
Minnema et al38 |
Prospectief |
50, 35 ASCT |
ORR 86% |
0% |
5 jaars OS |
|
|
VD inductie (H104) |
|
CR 46%, ITT32% |
|
73% (ITT), 91% (ASCT) |
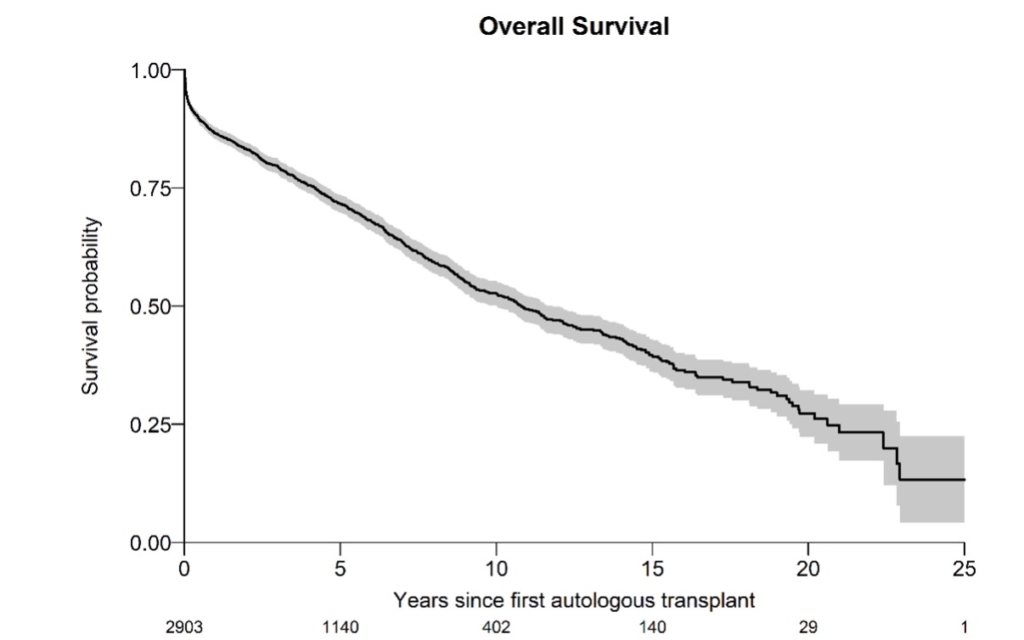
Figuur 1: Overall Survival van patiënten behandeld met ASCT uit de EBMT database (1993- 2021), met een mediane follow up van 46 maanden voor patiënten in leven.
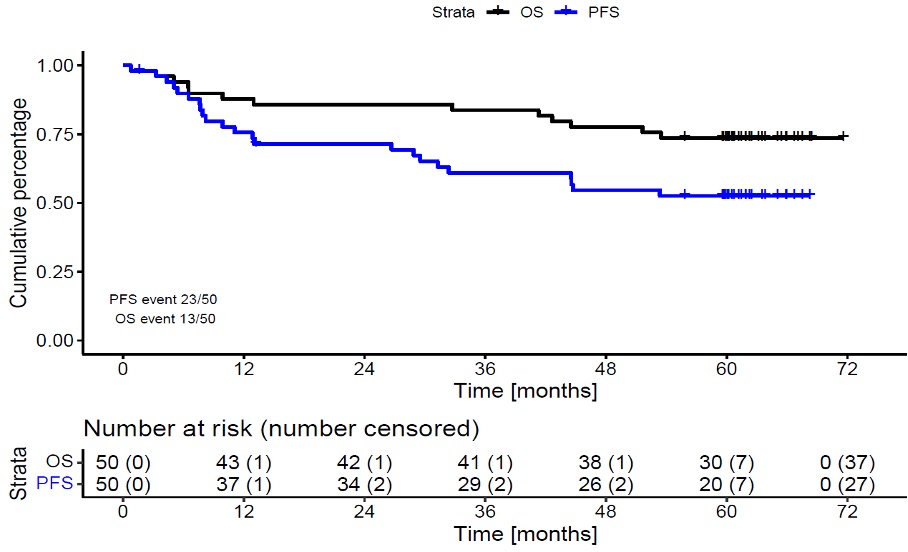
Figuur 2: OS en PFS van 50 patiënten behandeld in de HOVON 104 studie waarvan 35 ook behandeld met HDM en ASCT38
|
SORT grade |
||
|
1 |
Immuno-chemotherapie met bortezomib 1/week in combinatie met oraal cyclofosfamide, dexamethason en daratumumab wordt aanbevolen als eerstelijnstherapie (daratumumab indien vergoeding ZN) |
A |
|
2 |
Alternatieve keuze, indien bortezomib niet mogelijk is, zijn daratumumab +/- cyclofosfamide-dex, dara- lenalidomide- dexamethason en dara-melfalan-dexamethason. |
B |
|
3 |
De hematologische respons (VLK +/- M-proteïne) moet tijdens behandeling na elke cyclus gemeten worden en na behandeling elke 2-4maanden. Het doel van deze frequente metingen tijdens therapie is om te kunnen wisselen van behandeling als deze niet adequaat blijkt te zijn. Dit is meestal na 3 cycli of na 2 cycli bij cardiaal belaste patiënten |
C |
De chemotherapeutische behandeling van AL-amyloïdose is gebaseerd op schema’s zoals gebruikt worden in de behandeling van patiënten met MM. Hierbij worden aanpassingen gedaan in schema en dosering, anticiperend op de hogere behandelingstoxiciteit in relatie tot de gecompromitteerde vitale orgaanfuncties op basis van amyloïddepositie. Het doel en de uitdaging is om de maximaal tolereerbare effectieve therapie te starten bij deze kwetsbare populatie. Alhoewel in de afgelopen jaren het therapeutisch arsenaal aanzienlijk is toegenomen, zijn er slechts beperkt gecontroleerde (prospectieve) studies verricht met nieuwe middelen. De Andromeda studie is de grootse gerandomiseerde fase III studie in 388 nieuw gediagnosticeerde AL amyloidose patiënten die of het standaard schema CyBorD kregen of dit schema gecombineerd met daratumumab vanaf start en na cyclus 6 doorgaan met daratumumab onderhoudstherapie voor totaal 2 jaar. 39 Het primaire eindpunt hematologische complete response was significant verschillend en dit regime is nu eerste keus bij de eerstelijns behandeling. In de patiënten behandeld met de combinatie daratumumab en CyBorD waren de VGPR en CR rate respectievelijk 25.2% en 53.%, dit was 31.1% en 18.1% in de CyBorD arm. Orgaan responsen werden ook gezien in meer dan 50% van de patiënten bij een mediane follow up van 18 maanden. Dit effect werd onafhankelijke van het cardiaal stadium behaald, patiënten met cardiaal stadium IIIb konden niet meedoen met de studie.48 De toevoeging van daratumumab aan CyBorD gaf geen vermindering van de gemeten kwaliteit van leven. 49 De follow up duur van deze studie is nog kort en momenteel is er geen vergoeding in Nederland. In tabel 1 worden enkele recente publicaties met resultaten weergegeven. Participatie in klinische trials verdient blijvende aanbeveling.
1. Proteasoom inhibitor gebaseerde regimes
Proteasoomremming is een aantrekkelijk concept in de behandeling van amyloïdogene plasmacellen aangezien “mis gevouwen” lichte ketens het ubiquitine proteasoom systeem overladen en extra gevoelig zijn voor remming van ditsysteem, wat apoptose kan induceren. Introductie van bortezomib en dexamethason was een belangrijke vooruitgang in de behandeling van AL-amyloïdose, later in combinatie met cyclofosfamide. Er is een prospectieve fase III studie gedaan met bortezomib in combinatie met melfalan en dexamethason (BMDex) versus MDex in 109 pt. 50 Deze studie toonde aan dat de toevoeging van bortezomib aan het Mdex schema verbetering gaf in VGPR/CR rates (64% vs 39%) en verbetering in overleving (HR 0.5). Dit ging wel gepaard met meer toxiciteit (cytopenien, neuropathie en hartfalen) en het BMdex schema wordt internationaal niet veel toegepast..
Bij de meerderheid van de patiënten bestaat een snelle respons bij eens per week dosering van bortezomib. Daarbij bleek in de HOVON 104 studie de 2 keer per week dosering te toxisch. De meest gemelde bijwerkingen zijn gastro-intestinale toxiciteit, neuropathie, orthostase en cytopenie. Echter, er zijn ook aanwijzingen dat patiënten met een t(11;14) een minder diepe respons behalen met bortezomib en dat voor deze groep patiënten juist de alkyleerders een betere keuze kunnen zijn.23 Dit verschil werd niet meer gezien in de Andromeda studie bij de toevoeging van daratumumab.
Een Europese retrospectieve analyse van 230 patiënten in eerste lijn behandeld met CyBorD toonde een hematologische respons aan van 62%, waarvan tenminste 43% VGPR. Hierbij waren de orgaanrespons percentages beperkt tot 17% cardiale respons en 25% renale respons. Na een mediane follow-up van 25 maanden was de geschatte 3 jaars overleving 55% voor de totale populatie.51 Een groot monocenter cohort rapporteerde in 913 nieuw gediagnosticeerde AL-amyloïdose patiënten behandeld met een bortezomib regime, een overall response rate (ORR) van 65%, met 49% CR/VGPR en een mediane overleving van 72 maanden.52
Indien pijnlijke en > graad 1 perifere neuropathie aanwezig is, is er een relatieve contra-indicatie voor bortezomib. Er is weinig ervaring met de proteasoomremmers ixazomib en carfilzomib in de eerstelijns behandeling. Gezien de bekende cardiale toxiciteit van carfilzomib heeft dit middel geen voorkeur, alhoewel er wel een kleine studie met 5 patiënten is gepubliceerd met goede resultaten. De gebruikte dosering was 20 mg/m2 waarbij 3 patenten na cyclus 1 eendosisverhoging naar respectievelijk 36 mg/m2 en 56 g/m2 verdroegen en alle patiënten behaalden een VGPR of beter.53
2. Alkylerende middelen, in combinatie met steroïden
Lange tijd is de behandeling met MDex een effectieve orale eerstelijnsbehandeling gebleken bij intermediair risico AL-amyloïdose patiënten die niet in aanmerking komen voor ASCT en die ongeschikt zijn voor behandeling met bortezomib. De tolerantie is goed met cytopenie als belangrijkste dosisbeperkende toxiciteit. MDex geeft een hematologische respons van 76% waarvan 31% CR en een mediane overleving van 7.4 jaar.54 De cardiale respons was 37%. In een studie met patiënten met ernstige cardiale betrokkenheid bleek MDex echter ook forse common toxicity criteria (CTC) graad 3-4 non-hematologische toxiciteit te geven met een ORR van 44% en CR in 11% van de patiënten, waardoor deze behandeling voor deze patiëntengroep minder geschikt is.55
3. IMiD gebaseerde regimes
Behandeling met de IMiDs thalidomide, lenalidomide en pomalidomide in combinatie met cyclofosfamide en/of dexamethason bij patiënten met AL-amyloïdose is effectief gebleken in fase II studies, veelal in de recidief setting uitgevoerd. Thalidomide in combinatie met dexamethason is weliswaar actief, maar heeft een matige tolerantie bij patiënten met AL-amyloïdose i.v.m. neurotoxiciteit en obstipatie. Thalidomide is niet meer verkrijgbaar in Nederland en wordt niet meer geadviseerd te gebruiken.
Lenalidomide met dexamethason al dan niet met de toevoeging van een alkyleerder melfalan of cyclofosfamide, iseen effectieve therapie voor eerste lijn of recidief behandeling van AL-amyloïdose.65-68 In de studie van Cibeira et al. waarin alleen de novo patiënten werden geïncludeerd, werd een CR/VGPR respons behaald in 43% van de patiënten. In een recente prospectieve single center fase II studie werden 50 patiënten in eerste lijn behandeld met 6 cycli lenalidomide, melfalan en dexamethason. Na 6 maanden was er sprake van CR in 9 (18%), VGPR in 16 (32%) en PR in 9 (18%) patiënten.69
Er zijn een aantal bijzondere aspecten aan het gebruik van lenalidomide bij AL-amyloïdose patiënten. Ten eerste kanhet soms >2 cycli duren voordat een PR wordt bereikt, hetgeen niet ideaal is bij amyloidose patienten, en moet er dusmogelijk iets langer gewacht worden voordat van therapie wordt gewisseld. De dosering van 25 mg is te toxisch gebleken en de maximale dosering is 15 mg, eventueel nog verder te verlagen bij nierfunctiestoornissen. Als laatste blijkt dat bij 85% van de patiënten na starten van lenalidomide, een stijging van de biomarkers BNP of NT-proBNPwordt gezien zonder daarbij toename van klinisch hartfalen en onafhankelijk van gebruik van dexamethason,nierfalen etc. Dit nog onbegrepen fenomeen lijkt dus niet te duiden op orgaanprogressie en moet dus ook niet leiden tot staken van de therapie, maar deze patiënten moeten uiteraard wel zorgvuldig vervolgd worden voor klinische kernmerken van hartfalen.70
4. Anti-CD38 gebaseerde regimes
Sinds 2017 zijn er publicaties verschenen waarbij daratumumab werd gegeven aan recidief AL amyloidose patiënten waaronder 2 prospectieve fase 2 studies met daratumumab monotherapie. Deze studies toonden een hoge effectiviteit met snelle respons en VGPR/CR rate van 50% of beter.56,57 De duur van de behandeling was maximaal 24 mnd. Dit is de basis voor de Andromeda studie geweest, waarbij daratumumab werd toegevoegd aan CyBorD in een gerandomiseerde fase 3 studie, in niet eerder behandelde AL amyloidose patiënten.58 Ook Nederlandse centra hebben aan deze studie meegedaan. Primaire eindpunt van de studie was hematologische response rate en secundair eindpunten een combinatie van progressie vrije overleving en geen ernstige orgaan verslechtering hebben (MOD-PFS) en OS. Beide eindpunten werden gehaald in de studie, voor OS was langere FU nodig. De ORR was 76.7 vs 91.8% en de CR rate 18.1 vs 53.3% respectievelijk in de controle en de experimentele arm. Daarbij was de toevoeging ook veilig zonder nieuwe bijwerkingen geobserveerd, met wel meer infecties, vooral luchtweginfecties (25.9% in de experimentele arm en 11.2% in de controle arm). Op moment van publicatie had 42% van de patiënten in de controle groep en 9.8% van de daratumumab behandelde patiënten vervolgtherapie ontvangen. Bij de controle groep bestond deze behandeling in 61% van de patiënten uit een daratumumab bevattende (combinatie) therapie. ASCT werd gegeven aan respectievelijk 10.6% en 6.7% van de patiënten in de studie in de controle vs de experimentele arm. De uitkomsten van deze studie hebben geleid tot goedkeuring van EMA en zodra vergoed, zal daratumumab-CyBorD, gegeven volgens de Andromeda studie, de voorkeurs behandeling in 1e lijn zijn..
Er zijn geen vooralsnog geen studies gepubliceerd met isatuximab bij AL amyloidose patiënten.
5. Hematologische respons tijdens en na behandeling
In het grootste deel van de AL-amyloïdose patiënten is de VLK bepaling in het serum de meest effectieve methode voor het monitoren van klonale ziekte. Serum VLK moet tijdens de behandeling na elke cyclus van chemotherapie bepaald worden en na behandeling elke 1-3 maanden. Het gebruik van de dVLK wordt ook geadviseerd voor monitoring van de ziekte en is toepasbaar bij nierinsufficiëntie. Een dVLK van tenminste 50 mg/l bij diagnose is gedefinieerd als noodzakelijk voor gebruik van veranderingen in dVLK als biomarker, dit omvat ongeveer 85% van de nieuw gediagnosticeerde AL-amyloïdose patiënten. 10-15% van de AL-amyloïdose patiënten hebben slechts een minimaal abnormale VLK (dVLK <50 mg/l) en voor deze patiënten is het gebruik van de VLK bepaling niet accuraat voor monitoring van therapierespons. Daarom kan een meetbaar M-proteïne, gedefinieerd als >5 g/l, nuttig zijn voor monitoring van respons in deze groep patiënten. 1-2% van AL-amyloïdose patiënten mist een meetbare serum- of urinemarker om de respons te monitoren. Follow-up beenmergonderzoek is meestal niet nuttig of zelfs misleidend, vanwege de subtiele aard van de plasmaceldyscrasiëen bij de meeste patiënten en de inherente sampling error. De waarde van het bepalen van de MRD met behulp van hooggevoelige flowcytometrie na chemotherapie is onderwerp van lopende studies en kan een rol spelen bij monitoring van respons in de groep patiënten bij wie geen meetbare serum- or urinemarker aanwezig is of waar deze metingen lastig uit te voeren zijn door nierfunctie stoornissen of dialyse.
|
Tabel 1. Recente publicaties eerstelijnstherapie stadium II & III AL-amyloïdose, zonder ASCT |
|||||
|
Referentie |
Regime |
Aantal patiënten |
Hematologische respons ORR (CR, VGPR) % |
PFS (mediaan in maanden) |
OS (mediaan in jaren) |
|
Palladini60 |
MDex |
119 |
76 (31,29) |
30 |
7.4 |
|
Venner71 |
VCD CTD |
69 69 |
71 (40.5, 41) 80 (24.6,-) |
28 14 |
96% na 1 jr. 92% na 1 jr. |
|
Palladini56 |
CyBorD |
128 |
66 (20, 27) |
13 |
5 |
|
Hegenbart69 |
LenMelDex |
50 |
50 (18, 32) |
25.1 |
67.5 |
|
|
SORT grade |
|
|
1 |
Recidief behandeling wordt gestart bij bevestigde hematologische progressie, vooral bij patiënten met ernstige (cardiale) orgaan betrokkenheid om verder orgaanfalen te voorkomen |
B |
|
2 |
Recidief behandeling volgt de standaard overwegingen zoals ook voor MM gelden in therapiekeuze en vergoedingsstatus |
B |
| 3
|
Advies is om daratumumab, ook indien eerder gegeven, te gebruiken in de recidief behandeling indien patiënt hier niet refractair op was. |
C |
Tweedelijnstherapie wordt gestart bij zowel onvoldoende hematologische respons op eerstelijnsbehandeling als bij een bevestigd hematologisch recidief. Onvoldoende hematologische respons op eerstelijnstherapie is gedefinieerd als minder dan bereiken VGPR na 2-3 kuren. Bij hematologische progressie na een initieel goede respons, al dan niet gecombineerd met toename van de orgaandisfunctie wordt over het algemeen niet verdere orgaanprogressieafgewacht en geswitcht naar een nieuwe behandeling. Zeker indien er sprake is van cardiale betrokkenheid, dient tweedelijnstherapie gestart te worden zodra de amyloidogene VLK oploopt.60. Er is een interessante discussie gepubliceerd waarin de voor en nadelen van vroeg starten van recidief behandeling besproken worden.61 Uit retrospectieve data analyses blijkt dat starten van recidief behandeling voordat er orgaanprogressie is, een betere overleving geeft, mediaan volgt orgaanverslechtering 6 maanden na een stijging van 50% van de dVLK in 85% van de patiënten. Echter, bij patiënten met meer subtiele stijging na een diepe en langdurige response na ASCT, duurde het mediaan 14 maanden voordat er orgaanprogressie was. Het risico dat een patiënt heeft bij hematologische progressie op orgaanprogressie verschilt dus per patiënt en moet individueel goed ingeschat worden.
Er is een gerandomiseerde fase III studie uitgevoerd in recidief AL amyloidose patienten62. In deze Tourmaline studie werd ixazomib-dexamethason vergeleken met enkele andere opties/ “physicians’s choice”. De studie kon geen verschil in ORR aantonen en wordt hieronder verder beschreven. Patiënten met een recidief AL-amyloïdosereageren over het algemeen goed op therapie en hebben minder hoge kans op therapie-gerelateerde sterfte dan bij diagnose. Indien langdurige en diepe respons is opgetreden, kan herhalen van eerstelijnstherapie een goede optie zijn. Als nog geen daratumumab gegeven is, wordt sterk geadviseerd deze wel als monotherapie, of in combinatie te starten, bij de recidief behandeling. Dit is obv van de 2 prospectieve studies met daratumumab monotherapie die zeer goede verdraagzaamheid combineren met hoge effectiviteit.56,57 Omdat daratumumab niet tot aan progressie gegeven wordt in de meeste patiënten, is ook herhaling van een daratumumab gebaseerde therapie zeer waarschijnlijk een goede mogelijk alhoewel hier geen formele studies naar zijn gedaan. Andere tweedelijnstherapie opties, voortkomend uit fase I en II studies, staan samengevat in tabel 1.
1. IMiDs
IMiDs worden vaak gebruikt in de recidief setting. Lenalidomide en pomalidomide geven in de recidief setting een hematologische respons van 40-60%. IMiDs gecombineerd met een alkyleerder geven een nog hogere responskans,maar gaan gepaard met meer toxiciteit en meer myelosuppressie, en omdat gerandomiseerde studies ontbreken isonduidelijk of dit nodig is. Lenalidomide dosering dient te worden aangepast aan de nierfunctie en maximale dosering is 15 mg bij AL-amyloïdose patienten. Pomalidomide kan wel in standaard doseringen worden gegeven.63
Twee prospectieve fase II studies met lenalidomide laten zien dat de combinatie met dexamethason effectief is met hematologische respons kansen variërend tussen 45-65%.64,65 De studies geven geen PFS of OS data. Lenalidomide monotherapie is onvoldoende werkzaam. De toxiciteit is vergelijkbaar met het beeld dat gezien wordt bij MM patiënten: beenmerg remming, moeheid, veneuze trombo-embolie (VTE), huiduitslag en oedeem, maar ook onbegrepen stijging cardiale markers (zie verder eerstelijnstherapie). Pomalidomide met dexamethason is effectief in recidief patiënten met ORR van ongeveer 50%, VGPR rate 35-44% (CR 0-3%), tijd tot respons van bijna 2 maandenen mediane OS en PFS van respectievelijk 28 en 15 maanden in diverse studies en real world data.63,66,67Pomalidomide blijkt beter verdragen te worden dan lenalidomide, meest voorkomende bijwerkingen zijn oedemen en infecties.
2. Proteasoomremmers
Ixazomib toonde effectiviteit in een fase I/II studie voor recidief patiënten, vooral in bortezomib-naïeve patiënten. 68Een gerandomiseerde fase 3 studie van ixazomib-dexamethasone vs ‘physician’s best choice’ bestaande uit melfalan, of cyclofosfamide, of thalidomide of lenalidomide , allen in combinatie met dexamethason is gepubliceerd in 2022.62 Primaire eindpunt was hematologische respons. in totaal 168 patiënten zijn geïncludeerd, waarbij er geen verschil bleek te zijn in de ORR (53% vvs 51%). Er was ook geen verschil in CR/VGPR rate. Er is dus wel effectiviteit van de combinatie therapie ixazomib-dexamethason, alleen niet beter dan alkyleerders of IMIDs. De studie heeft niet geleid tot registratie voor recidief AL amyloidose patiënten maar de combinatie ixazomib-lenalidomide-dexamethason is wel beschikbaar voor recidief MM patiënten.
In 2023 werd een kleine fase Ib studie gepubliceerd met 11 recidief patiënten behandeld met de combinatie Carfilzomib-Thalidomide-Dexamethason. De VGPR/CR rate was 60% en bij de wekelijkse 45 mg/m2 Carfilzomib dosering werd 1 Dose Limiting Toxicity (acuut nierfalen) gezien. Exclusie criteria waren oa hypotensie, hartfalen of MAYO stadium III. Carfilzomib in een lagere en wekelijkse dosering zou dus overwogen kunnen worden na overleg met een expertise centrum. 69
In een prospectieve fase I/II studie met bortezomib monotherapie bij 70 recidief patiënten was e de hematologische respons 68%.70 De meest frequent voorkomende bijwerkingen waren, behalve de al eerder genoemde bijwerkingen, ook anemie en trombocytopenie, hoesten, duizeligheid en huidafwijkingen. Het advies is om net als bij eerstelijnsbehandeling van AL-amyloïdose de bortezomib 1 keer per week te gebruiken met dosering 1.3 mg/m2.
3. Daratumumab
De plasmacellen bij AL-amyloïdose hebben hoge CD38-expressie. Daratumumab monotherapie (met dexamethason als premedicatie) wordt goed verdragen en is effectief in een retrospectieve analyse met recidief patiënten met een hematologische responskans van 76%, en bereiken van een CR in 36% van de patiënten. De 2 kleinere prospectieve studies zijn al eerder benoemd en ook besproken in een editorial met titel “AL patients don’t dare go without dara”.71 Uit de studies blijkt dat daratumumab toediening veilig is en indien een respons optreedt deze snel komt na al 4 toedieningen, i.e. 1 maand behandeling. Het responspercentage CR+VGPR in de 3 studies met alleen daratumumab en een corticosteroïd was tussen de 56 en 86%. Verschillend was de duur van de daratumumab behandeling, in de 2 prospectieve studies was dit respectievelijk 6 en 24 maanden. Alhoewel het lijkt dat daratumumab niet tot aan progressie hoeft te worden gegeven aan patiënten die een goede en diepe respons halen, is het momenteel niet duidelijk hoelang de daratumumab behandeling moet worden doorgezet; waarbij een maximum van twee jaar kan worden aangehouden. Echter bij patiënten met een snel recidief of al vele recidieven in de voorgeschiedenis kan langer doorgeven ook een optie zijn.
|
Tabel 1. Recente publicaties tweedelijnstherapie AL-amyloïdose |
|||||
|
Referentie |
Regime |
Aantal patiënten |
Hematologische respons ORR (CR, VGPR)% |
PFS (mediaan in mnd) |
OS (mediaan in jr) |
|
Reece70 |
bortezomib |
70 |
60 (24/…) |
77% na 1 jaar |
90% na 1 jaar |
|
Mahmood72 |
lena-dex |
84 |
61 (20/8) |
73% na 2 jaar |
84% na 2 jaar |
|
Palladini63 |
pom-dex |
28 |
68 (4/25) |
16 |
2.5 |
|
Sanchorawala68 |
ixazomib |
27 |
52 (10/33) |
15 |
85% na 1 jaar |
|
Kaufman73 |
daratumumab |
25 |
76 (36/24) |
NR |
NR |
|
Roussel56 |
Daratumumab (6 mnd) |
40 |
55 (47.5) |
24.8 |
74,2 % na 2 jaar |
|
Sanchorawala57 |
Daratumumab (24 mnd) |
22 |
91 (86) |
28 |
86% na 2 jaar |
|
Dispenzieri62 |
Ixazomib-dex vs SOC |
168 |
53 vs 51 (CR 26 vs 18) |
11,2 vs 7.4 |
NE vs 40.8 mnd |
|
Ravichandran69 |
Carfilzomib-Thal-dex |
11 |
60 (60) |
NR |
NR |
|
|
SORT grade |
|
|
1 |
Overvulling bij hartfalen en nefrotisch syndroom wordt voornamelijk bestreden met lisdiuretica en aanvullend een mineralocorticoid receptorantagonist |
B |
|
2 |
Standaard behandelingen voor hartfalen en nefrotisch syndroom worden vaak slecht verdragen, zijn niet bewezen effectief en mogelijk wel schadelijk, en dienen met specifieke amyloïdose kennis te worden ingezet. Uitzondering zijn de SGLT2 remmers waarvoor weinig data beschikbaar is maar wel veilig lijken te zijn. |
B |
|
3 |
Elke amyloïdose patiënt krijgt specifieke voedingsondersteuning gericht op de specifieke kenmerken bij die patiënt en bij chemotherapie |
B |
|
4 |
Het gebruik van trombose profylaxe bij IMiD-bevattende therapie wordt geadviseerd, conform bij multipel myeloom |
B |
|
5 |
Wat betreft infectiepreventie wordt herpesprofylaxe middels valaciclovir geadviseerd bij proteasoomremmers, enantibioticaprofylaxe bij dexamethason >20 mg/week. Vaccinatie voor/tijdens/na therapie wordt aanbevolen |
B |
Kenmerkend voor AL-amyloïdose is de verminderde werking van meerdere organen, waardoor patiënten gemakkelijk orgaanfalen manifesteren tijdens therapie, zelfs in patiënten met vooraf ogenschijnlijk normale orgaanfunctie. Door de multisysteemziekte is het belangrijk om in het behandelcentrum multidisciplinaire zorg georganiseerd te hebben met toegang tot zorg en ondersteuning bij afdelingen hematologie, cardiologie, nefrologie, neurologie en maag-darm- leverziekten. Dit wordt het beste bereikt bij concentratie van zorg, zodat zorgverleners meer expertise bij deze complexe en fragiele patiënten kunnen opbouwen.
Er zijn vele onderzoeken gestart naar anti-amyloïd therapieën, meeste antistof gebaseerd, die door directe binding aan amyloïd, macrofagen stimuleren voor amyloïd fagocytose. Echter deze medicijnen bleken ineffectief in gerandomiseerde fase III studies of te toxisch en momenteel is er geen anti-amyloïd medicijn geregistreerd.74-76 Er zijn recent 3 gerandomiseerde studies afgerond met anti-amyloid antistoffen waarvan de resultaten nog niet bekend zijn. De geteste medicijnen zijn Birtamimab (NEOD001) dat eerder gefaald heeft en CAEL-101/Anselamimab.77
1. Nefrotisch syndroom en nierfalen
Behandeling bestaat vooral uit lisdiuretica, eventueel gecombineerd met kalium sparende mineralocorticoid receptorantagonisten, zoals spironolacton. Zout- en vochtrestrictie is meestal ook gewenst om de vullingsstatus tehandhaven. Soms kunnen albumine infusies behulpzaam zijn om betere werking van de lisdiuretica te verkrijgen. Hypertensie komt zeer weinig voor, maar indien aanwezig moet dit behandeld worden met ACE remmers of A-II-antagonisten vanwege het mogelijk anti-proteïnurisch effect van deze middelen. Echter bij cardiale betrokkenheid en hypotensie en ook bij starten van bortezomib therapie wordt niet geadviseerd deze medicijnen specifiek voor het mogelijke anti-proteïnurisch effect voor te schrijven i.v.m. de bijwerkingen.28 Hypercholesterolemie bij nefrotisch syndroom kan behandeld worden met cholesterolverlagers, maar soms, bij herstel nefrotisch syndroom, kunnen deze ook weer gestopt worden. Antistolling wordt niet standaard geadviseerd gezien het bloedingsrisico, en omdat niervenetrombose in de praktijk zelden wordt gezien.
Dialyse is zeker mogelijk bij eindstadium nierfalen zonder ernstig hartfalen en verbetert de overleving.78 Er is geen bewijs of hemodialyse of peritoneaal dialyse beter is, maar hemodialyse wordt bij hypotensie soms slecht verdragen. In een goed geselecteerde groep patiënten (performance status, goede remissie status) is niertransplantatie mogelijk. In twee artikelen is de overleving beschreven van AL- amyloïdose patiënten die een niertransplantatie ondergingen tussen 1987-2017 en 2005-2020.79,80 In het eerste artikel was de mediane follow-up 7.2 jaar met een mediane patiënt overleving vanaf niertransplantatie van 10.5 jaar. In het tweede artikel was de mediane follow-up 8.9 jaar met een mediane patiënt overleving van 9 jaar. Vooral patiënten met een goede hematologische respons (CR of VGPR) hadden een betere overleving en, ondanks dat dit een oudere groep is dan de niet-amyloïdose niertransplantatie patiënten, zijn de uitkomsten vergelijkbaar met deze groep.
2. Hartfalen en hartritmestoornissen
Ook bij klinisch hartfalen zijn lisdiuretica, aangevuld met spironolacton/ mineralocorticoid receptorantagonisten, de belangrijkste medicatie om overvulling tegen te gaan. Zout- en vochtrestrictie is meestal ook nodig om devullingsstatus te handhaven. Typisch voor het hartfalen (HF) is de behouden linkerventrikel ejectiefractie (EF) met rechtszijdige overvulling (HFpEF). Patiënten waar ook de EF verminderd is, hebben een slechte prognose. Door het restrictieve karakter is het belangrijk om voldoende vullingsstatus te behouden, omdat bij ondervulling de output wegvalt. ACE-remmers worden vaak slecht verdragen en kunnen hypotensie geven en het is onduidelijk of deze middelen, indien verdragen, nuttig zijn. Ca-antagonisten worden zeer sterk afgeraden vanwege het slecht voorspelbare effect op geleiding, prikkelbaarheid en contractiekracht. Digitalis zou wel gegeven kunnen worden met lagere startdoseringen en onder zeer strikte controle.81 De meest voorkomende ritmestoornissen zijn atriumfibrilleren en atriumflutter, maar ook ventriculaire ritmestoornissen komen voor. B-blokkade is mogelijk, maar moet zeer voorzichtig worden getitreerd gegeven, omdat ze hartfalen kunnen verergeren door remming van reflectoire maar tevens functionele tachycardie. Bij een gefixeerd en verminderd slagvolume is namelijk de hartfrequentie de enige manier om cardiac output te vergroten. Amiodarone lijkt redelijk te worden getolereerd bij patiënten metritmestoornissen. Bij persisterend atriumfibrilleren is er een indicatie voor antistolling. Van de SGLT-2 remmers zijn dapaglifozine en empafligozine ook voor te schrijven voor patiënten met hartfalen (en nierfalen). Er zijn geen klinische studies uitgevoerd bij cardiale AL amyloidose, maar wel retrospectieve analyses bij patiënten met zowel een AL of ATTR amyloidose en hartfalen.82-84 De SGLT-2 remmers lijken daarbij veilig en verbetering op een aantal cardiale parameters te geven.
Het ECG vertoont typische afwijkingen bij cardiale amyloïdose patiënten en dus behulpzaam bij de verdenking op amyloïdose, maar ook belangrijk om QTc tijd te bepalen. Er moet speciale aandacht zijn voor QTc- verlengende therapie, zoals anti-emetica en profylactische antibiotica en azolen die worden gebruikt bij chemotherapie, gezien de kans op levensbedreigende ritmestoornissen. Indien deze toch worden gegeven moet het onder monitoring van de QTc tijd gebeuren. Ventriculaire ritmestoornissen komen voor, maar het routinematig implanteren van een implanteerbare cardioverter-defibrillator (ICD) wordt afgeraden, omdat de oorzaak van plotselinge hartdood meestal bradycardie is of elektromechanische dissociatie. Een pacemaker implantatie kan worden overwogen, zoals bij iedere patiënt die voldoet aan de gebruikelijke indicatie. Harttransplantatie is in Nederland niet mogelijk voor deze groep patiënten.
Op basis van een gerandomiseerde fase III studie met doxycycline icm CyBord of CyBorD alleen bij nieuw gediagnosticeerde patiënten met AL amyloidose en cardiale betrokkenheid die geen enkel effect liet zien wordt dit antibioticum niet meer geadviseerd bij cardiale amyloidose patiënten.85
3. Neuropathie
Autonome neuropathie: hypotensie
Orthostase en hypotensie komen veelvuldig voor door autonome neuropathie en kunnen worden verergerd door de behandeling van hartfalen en het nefrotisch syndroom met diuretica en ACE-remming. Alhoewel depositie van amyloïd in de bijnieren vaak voorkomt, wordt bijnierinsufficiëntie zelden gezien. Als patiënten de lage bloeddruk verdragen, zijn voornamelijk houdings- en bewegingsadviezen belangrijk. Indien er wel klachten zijn, kunnen deze worden bestreden met steunkousen, fludrocortison of midodrine. Behandeling met midodrine (alpha-1 agonist) lijkt het meest effectief. De startdosering is 2,5 mg 3 keer per dag, op te hogen tot maximaal 15 mg 3 keer per dag. Het medicijn wordt meestal niet vergoed voor deze indicatie. Fludrocortison kan niet gegeven worden aan patiënten met hartfalen die dagelijks diuretica gebruiken.39
Sensorische neuropathie
Ook deze klacht komt veelvuldig voor bij patiënten en heeft geen specifieke therapie. Monitor bij gebruik van bortezomib de neuropathie zorgvuldig.96 Bij pijnlijke neuropathie kunnen specifieke pijnstillers, zoals gabapentine of pregabaline, worden voorgeschreven.
4. Bloedingen
Bloedingen komen frequent voor, voornamelijk door vasculopathie door gegeneraliseerde amyloïd depositie in de bloedvaten en dit geeft de typische huidbloedingen in gelaat en hals. Ook na operaties en biopsieën worden meer bloedingen gezien. Daarnaast kunnen er stollingsstoornissen optreden waarvan factor X-deficiëntie de meest voorkomende is. Hiervoor is geen effectieve therapie bekend. Een eventuele ernstige bloeding die ondersteunende therapie nodig heeft, kan worden behandeld met conventionele ondersteunende maatregelen (factor suppletie, bloedplaatjestransfusie). Bij een bekende factor X-deficiëntie kan bij ernstige bloeding factor X-concentraat overwogen worden.
5. Darmklachten en voeding
Darmklachten zijn vaak moeilijk te behandelen en kunnen optreden bij zowel autonome neuropathie en bij amyloïd depositie in de darmwand zelf. Dit onderscheid is moeilijk te maken. De klachten zijn meestal diarree, bloedingen, malabsorptie en motiliteitsstoornissen met pseudo-obstructieklachten. Ernstige diarree kan worden behandeld met imodium en octreotide. Ook kan bacteriële overgroei de oorzaak van de diarree zijn, waarvoor een behandeling met antibiotica kan worden geprobeerd.39 Incidenteel is parenterale voeding nodig, vaak wel bijvoeding. Consultatie bij een gespecialiseerd diëtiste, die zowel kennis heeft over hartfalen, nierfalen, als ook voedingsadviezen tijdens chemotherapie, is voor elke patiënt noodzakelijk.
6. Trombose profylaxe
Conform bij multipel myeloom, adviseert de werkgroep het gebruik van trombose profylaxe bij IMiD-bevattende therapie, als volgt:
Echter bestaat bij amyloïdose een verhoogde bloedingsneiging voornamelijk door vasculopathie door gegeneraliseerde amyloïd depositie in de bloedvaten, zie het bovenstaande kopje bloedingen. Dus hoewel bij het gebruik van IMiDs wel tromboseprofylaxe wordt geadviseerd, dient dit bij amyloïdose patiënten wel op individueel patiënten niveau afgewogen te worden ten opzichte van het bloedingsrisico. Een goede bloedingsanamnese is hierbij essentieel.
7. Infectiepreventie
Profylaxe
Vaccinaties
Bij AL-amyloïdose worden dezelfde vaccinaties als bij MM geadviseerd, zie verder bij deze richtlijn. Het voordeel van vaccineren is dat minder antibiotica of antivirale middelen gegeven hoeft te worden.
8. Bisfosfonaten
|
|
SORT grade |
|
|
1 |
Er dienen zowel hematologische controles als orgaanfunctie-specifieke controles verricht te worden tijdens de behandeling en in de follow-up |
B |
Therapie voor de onderliggende plasmacelziekte wordt doorgezet tot een zeer goede hematologische respons of complete respons is bereikt en respons wordt na elke cyclus bepaald. Daarna dient monitoring plaats te vinden met een interval tussen 2-4 maanden op de VLK waardes in het bloed en eventueel aanvullend met M-proteïne metingen in bloed en/of urine. Indien een CR is bereikt, is het voor de officiële criteria niet noodzakelijk om een beenmerg onderzoek te herhalen. Echter, er zijn aanwijzingen dat MRD-negatieve patiënten een betere prognose hebben en daarom kan een beenmergpunctie, al dan niet in studieverband, toch nodig zijn. Ook bij patiënten die ernstige nierfunctiestoornissen hebben en daardoor verschoven kappa-lambda ratio, als ook dialyse patiënten, is de interpretatie van de VLKs niet eenduidig en kan een beenmergpunctie belangrijk zijn voor aanvullende informatie. Informatie over de invloed van nierfunctiestoornissen op VLK uitslagen bij de verschillende VLK assays wordt uitgebreid besproken in de Diagnostiek richtlijn Multipel, zie Myeloom Diagnostiek richtlijn Multipel Myeloom – MEDonline publisher (hematologienederland.nl)
Behalve het hematologische proces moeten ook de betrokken organen goed vervolgd worden voor respons dan wel progressie kenmerken. Zie daarvoor het hoofdstuk ‘Definitie van hematologische en orgaanrespons’. In de praktijk zal voor neurologische en gastro-intestinale manifestaties vooral de anamnese belangrijk zijn en ook voor de NYHA inschatting, voor de andere organen wordt dit aangevuld met bloedonderzoek (NT-proBNP, albumine, levertesten, creatinine) en 24 uurs urine- of portie urineonderzoek (totaal eiwit, M-proteïne). Belangrijk is dat met name het NT-proBNP tijdens chemotherapie kan verslechteren door toename decompensatio cordis bij gebruik van dexamethason, door toename nierfalen of door gebruik van IMiDs zonder dat er hematologische progressie is.Daarom heeft het de voorkeur deze test eens per 3 tot 4 maanden te herhalen bij, op dat moment stabiele kliniek, om orgaanrespons of -progressie te beoordelen zowel tijdens therapie als in de follow-up.
Na het afsluiten van de chemotherapie moeten de leefregels rondom hartfalen in stand blijven, maar soms blijkt wel dat de diuretica afgebouwd kunnen worden bij verbetering van de diastolische disfunctie. Het ECG moet jaarlijks herhaald worden en voor start van een nieuwe lijn van therapie. Bij patiënten met MAYO stadium II en IIIa&b wordt geadviseerd ook het echocardiogram elke 1 tot 2 jaar te herhalen tot aan stabilisatie, en eerder op indicatie. Patiënten met MAYO stadium I ziekte hebben geen tot minimale cardiale betrokkenheid, cardiale evaluatie en echocardiografie dient alleen te worden herhaald indien er klachten zijn. Er zijn nog geen gegevens bekend over nut van follow-up MRI-scans na therapie.
Alhoewel een AL-amyloïdose zelden overgaat in een symptomatisch MM, is dit wel beschreven en dient dus ook calcium vervolgd te worden en bij botklachten een nieuwe CT-scan gemaakt te worden.
In Nederland is op dit moment geen richtlijn voor de organisatie van AL-amyloïdose zorg beschikbaar. De behandeling met immuno-chemotherapie kan in principe in elk ziekenhuis worden uitgevoerd, behalve een eventuele ASCT die alleen in ziekenhuizen met HOVON echelon A, B en C-SCT kwalificatie kan worden uitgevoerd. Echter conform nieuwe richtlijnen van andere zeldzamere hematologische ziektebeelden en de complexiteit van zorg bij AL-amyloïdose is concentratie van zorg zeer belangrijk. De 2 erkende expertise centra voor amyloidose in Nederland, beide aangesloten bij een European Reference Network, zijn het UMC Utrecht en het UMCG. Het wordt sterk aangeraden elke patient met nieuwe diagnose en recidief te bespreken in de regio consulten.
In 2018 is door de patiëntenvereniging Stichting Amyloïdose Nederland en de VSOP (Vereniging SamenwerkendeOuder- en Patiëntenorganisaties) een kwaliteitsstandaard “Concentratie en organisatie van zorg voor patiënten met AL-amyloïdose” ontwikkeld (https://zichtopzeldzaam.nl/documenten/amyloïdose-kwaliteitsstandaard/). Deze kwaliteitsstandaard schetst hoe de patiëntenvereniging de organisatie van zorg als optimaal zou beschouwen en heeft daarmee een visie voor de toekomst neergezet. De kwaliteitsstandaard is geaccordeerd door de Nederlandse verenigingen voor Cardiologie en Pathologie en is tot stand gekomen na literatuuronderzoek en interviews met patiënten, cardiologen, internisten, hematologen en pathologen.
De belangrijkste aanbevelingen van deze kwaliteitsstandaard zijn dat er meerdere ziekenhuizen in Nederland diagnostiek, behandeling en aanvullende zorg voor deze patiëntengroepen kunnen aanbieden. Idealiter zouden deze zogenaamde behandelcentra laagdrempelig toegang moeten hebben tot een van de 2 expertise centra het UMC Groningen of het UMC Utrecht, voor het opstellen van een behandelplan, zodat deze uniform en volgens de meest recente inzichten kan plaatsvinden.. In de ziekenhuizen die AL amyloidose patiënten behandelen dient gespecialiseerde en multidisciplinaire zorg plaats te vinden volgens de geldende richtlijnen waar ook specifieke amyloïdose kennis aanwezig is bij de kernspecialisten. Deze bestaan uit een hematoloog, cardioloog, nefroloog en een verpleegkundig specialist. Daarnaast is paramedische zorg belangrijk en moet patiënten toegang worden geboden tot specialistische diëtetiek, fysiotherapie, revalidatie en psychologische ondersteuning voor en/of na de behandeling.
|
AA-amyloïdose |
serum amyloid A-amyloïdose |
|
AF |
alkalisch fosfatase |
|
AL-amyloïdose |
amyloid light chain-amyloïdose |
|
ANBI |
Algemeen Nut Beogende Instelling |
|
APTT |
activated partial thromboplastin time |
|
ASCT |
autologe stamceltransplantatie |
|
ASH |
American Society of Hematology |
|
ATTR-amyloïdose |
amyloïd transthyretine-amyloïdose |
|
BF |
boezemfibrilleren |
|
BMDex |
bortezomib-melfalan-dexamethason |
|
BNP |
brain natriuretic peptide |
|
CR |
complete respons |
|
CTC |
common toxicity criteria |
|
CTD |
cyclofosfamide-thalidomide-dexamethason |
|
CVD |
centraal veneuze druk |
|
CyBorD |
cyclofosfamide-bortezomib-dexamethason |
|
DPD
|
99mTC diphophono-1,2-propanodicarboxylic acid
|
|
dVLK |
absolute verschil tussen de betrokken VLK keten en de niet-betrokken keten |
|
DVT |
diepe veneuze trombose |
|
ECG |
elektrocardiogram |
|
ECOG-PS |
Eastern Cooperative Oncology Group Performance Status |
|
eGFR |
estimated glomerular filtration rate |
|
ELISA |
enzyme-linked immunosorbent assay |
|
EMB |
endomyocardbiopt |
|
EMG |
elektromyogram |
|
EMN |
European Myeloma Network |
|
G-CSF |
granulocyt-koloniestimulerende factor(en) |
|
HDF |
hoge dosis melfalan |
|
HF |
hartfalen |
|
HFpEF |
heart failure with preserved ejection fraction |
|
HMDP |
99mTc-hydroxymethylene diphosphonate
|
|
HOVON |
Hemato-oncologie voor Volwassen Nederland |
|
HR |
hazard ratio |
|
HRCT |
high resolution computer tomografie |
|
ICD |
implanteerbare cardioverter-defibrillator |
|
IMiD |
immunomodulerende imide drugs |
|
IMWG |
Internationale Myeloom Werkgroep |
|
i.v. |
intraveneus |
|
i.v.m. |
in verband met |
|
LGE |
late gadolinium enhancement |
|
LLN |
lower limit of normal |
|
LMWH |
Low molecular weight heparin |
|
LVH |
linkerventrikelhypertrofie |
|
MGUS |
monoklonale gammopathie van onbekende betekenis |
|
MM |
multipel myeloom |
|
MPR |
melfalan-prednison-lenalidomide |
|
MRD |
minimale residuale ziekte |
|
MRI |
magnetic resonance imaging |
|
NHG |
Nederlands Huisartsen Genootschap |
|
NKR |
Nederlandse kankerregistratie |
|
NO |
neurologisch onderzoek |
|
NR |
geen respons |
|
NT-proBNP |
N-terminaal proBNP |
|
NYHA |
New York heart association |
|
ORR |
algehele respons rate |
|
OS |
algehele overleving |
|
PE |
pulmonaire embolie |
|
PFS |
progressievrije overleving |
|
PNP |
polyneuropathie |
|
p.o. |
per os |
|
PR |
partiele respons |
|
PT |
protrombine tijd |
|
PYP |
99mTc-pyrophosphate
|
|
QTc |
gecorrigeerde QT tijd |
|
RR |
relatief risico |
|
SAP |
serum amyloïd P-component |
|
SAN |
Stichting Amyloïdose Nederland |
|
s.c. |
subcutaan |
|
SECAL |
Samenwerkende Expertise Centra AL-amyloïdose |
|
SORT |
Strenght-of-Recommendation Taxonomy |
|
TnI |
troponine I |
|
TnT |
troponine T |
|
ULN |
upper limit of normal |
|
VCD |
bortezomib-cyclofosfamide-dexamethason |
|
VGPR |
zeer goede partiele respons |
|
VLK |
vrije lichte keten |
|
VSOP |
Vereniging Samenwerkende Ouder- en Patiëntenorganisaties |
|
VTE |
veneuze trombo-embolie |
|
Middel |
Dosering |
Route |
Schema |
Cyclus |
|
cyclofosfamide
bortezomib dexamethason |
300 mg/m2 met maximum 500 mg 1.3 mg/m2 10-20 mg |
p.o. s.c. p.o. |
Dag 1, 8, 15 Dag 1,8,15, 22 Dag 1,2,8,9,15,16,22,23 |
28 dagen 6-8 cycli |
|
melfalan dexamethason |
0.22 mg/kg of 10 mg/m2 20-40 mg |
p.o. p.o. p.o. |
Dag 1-4 Dag 1-4 Dag 1-4 |
28 dagen 6-8 cycli |
|
cyclofosfamide thalidomide dexamethason |
500 mg 100 mg 40 mg |
p.o. p.o. p.o. |
Dag 1,8,15 ContinueDag 1-4, 9-12 |
21 dagen 6-8 cycli |
|
lenalidomide dexamethason |
15 mg 20-40 mg |
p.o. p.o. |
Dag 1-21 Dag 18,15,22 |
28 dagen 12 cycli / tot stabieleVGPR/CR of tot progressie |
|
lenalidomide cyclofosfamide dexamethason |
15 mg 300 – 500 mg 20-40 mg |
p.o. p.o. p.o. |
Dag 1-21 Dag 1,8,15 Dag 1,8,15,22 |
28 dg 12 cycli of tot stabiele VGPR/CR |
|
bortezomib dexamethason |
1.3 mg/m2 10-20 mg |
s.c. p.o. |
Dag 1,8,15,22 Dag1,2,8,9,15,16,22,23 |
35 dagen 6-8 cycli |
|
pomalidomide dexamethason |
4 mg 20-40 mg |
p.o. p.o. |
Dag 1-21 Dag 18,15,22 |
28 dagen 12 cycli / tot stabiele VGPR/CR of tot progressie |
|
daratumumab dexamethason |
1800 mg 20 mg |
sc p.o. |
Wekelijks, na 8 weken overgaan op 2-wks gedurende 16 weken, daarna 4 wks Dag 1,8,15,22 |
28 dagen, max 2 jaar of tot stabiele VGPR/CR |
|
ixazomib lenalidomide dexamethason |
4 mg 15 mg 20-40 mg |
p.o p.o. p.o. |
Dag 1,8,15 Dag 1-21 Dag 1,8,15,22 |
28 dg, tot aan progressie of tot stabiele VGPR/CR |
|
Dara-CyBorD Bortezomib Cyclofosfamide
Dexamethason |
Dara 1.3 mg/m2 300 mg/m2, max 500 mg 10-20 mg |
s.c. s.c. p.o. p.o. |
Standaard schema Dag 1,8,15,22 Dag 1,8,15 Dag 1,8,15,22 afbouwen tot stop bij maximaal resultaat |
28 dg 6 cycli Dara totaal 2 jaar |
Een brochure en brief voor de huisarts is gemaakt door een samenwerking van de SAN, de VSOP en het Nederlands Huisartsen Genootschap (NHG). Deze brochure bevat specifieke informatie voor de huisarts over meerdere vormen van systemische amyloïdose. De brochure “Informatie voor de huisarts over Amyloïdose” is ontwikkeld in het kader van een projectsubsidie van het Innovatiefonds Zorgverzekeraars. Medisch specialisten worden verzocht in hun correspondentie na diagnosestelling deze link te vermelden: https://www.nhg.org/thema/zeldzame-ziekten/amyloïdose
Stichting Amyloïdose Nederland/SAN
Sinds 2013 is de patiëntenorganisatie, Stichting Amyloïdose Nederland, actief in Nederland. De stichting is lid van de VSOP, de overkoepelende organisatie voor genetische en zeldzame ziekten en heeft de ANBI status. De stichting heeft een groeiend aantal deelnemers en werkt nauw samen met de beide academische expertisecentra in Groningen en Utrecht. De doelstellingen van Amyloïdose Nederland zijn onder andere:
Voor meer informatie bezoek de website www.amyloïdose.nl. Een uitgebreide brochure voor geïnteresseerden, patiënten en professionals is kosteloos beschikbaar. U kunt deze downloaden op: https://www.amyloidose.nl/actueel/nieuwe-brochure-amyloidose-nederland
Gedrukte brochures, zijn per mail ook aan te vragen bij: Amyloïdose Nederland, info@amyloidose.nl
Hematon is een patiëntenorganisatie voor patiënten met een hemato-oncologische aandoening. Naast de focus op genezing en een betere kwaliteit van leven, vraagt Hematon ook aandacht voor preventie en palliatieve zorg. De organisatie maakt uitwisseling van kennis en ervaringen tussen patiënten mogelijk, onder andere door ontmoetingen tussen patiënten te faciliteren, zowel fysiek, online als via papieren uitgaven van Hematon magazine.
Er zijn folders en brochures over specifieke aandoeningen, maar ook over zaken die relevant zijn bij iedere aandoening. Deze zijn te downloaden op: https://www.hematon.nl/folders
Voor meer informatie, bezoek de website https://www.hematon.nl/
© 2022. Alle rechten voorbehouden
Nederlandse Vereniging voor Hematologie
Procedure herziening
Uiterlijk 2 jaar na verschijnen van deze richtlijn wordt door de werkgroep beoordeeld of deze richtlijn nog actueel is.De geldigheid van de richtlijn komt eerder te vervallen wanneer nieuwe ontwikkelingen het nodig maken om eerder een herzieningstraject te starten. Deze eerste herziening is gedaan in 2024.
Juridische betekenis
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat in een individueel geval deze aanbevelingen niet van toepassing zijn. Het is de verantwoordelijkheid van de behandelend arts te beoordelen of de richtlijn in depraktijk en/ of in het belang van een goede geïndividualiseerde zorg voor de patiënt toepasbaar is. Zo nodig wordt gemotiveerd afgeweken van de richtlijn.